Dióxido de carbono
 | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Dióxido de carbono | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 3DMet |
| ||
| 1900390 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.004.271 | ||
| Número CE |
| ||
| Número E | E290 (conservantes) | ||
| 989 | |||
| BARRIL | |||
| Malla | dióxido de carbono | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1013 (gas), 1845 (sólido) | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| CO2 | |||
| Masa molar | 44,009 g·mol −1 | ||
| Apariencia | Gas incoloro | ||
| Olor |
| ||
| Densidad |
| ||
| Punto crítico ( T , P ) | 304,128(15) K [2] (30,978(15) °C), 7,3773(30) MPa [2] (72,808(30) atm) | ||
| 194,6855(30) K (−78,4645(30) °C) a 1 atm (0,101325 MPa) | |||
| 1,45 g/L a 25 °C (77 °F), 100 kPa (0,99 atm) | |||
| Presión de vapor | 5,7292(30) MPa, 56,54(30) atm (20 °C (293,15 K)) | ||
| Acidez (p K a ) | Ácido carbónico : p K a1 = 3,6 p K a1 (aparente) = 6,35 p K a2 = 10,33 | ||
| −20,5·10 −6 cm3 / mol | |||
| Conductividad térmica | 0,01662 W·m −1 ·K −1 (300 K (27 °C; 80 °F)) [3] | ||
Índice de refracción ( n D ) | 1.00045 | ||
| Viscosidad |
| ||
| 0 D | |||
| Estructura | |||
| Trigonal | |||
| Lineal | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 37,135 J/(K·mol) | ||
Entropía molar estándar ( S ⦵ 298 ) | 214 J·mol −1 ·K −1 | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −393,5 kJ·mol −1 | ||
| Farmacología | |||
| V03AN02 ( OMS ) | |||
| Peligros | |||
| NFPA 704 (rombo cortafuegos) | [7] [8] | ||
| Dosis o concentración letal (LD, LC): | |||
LC Lo ( valor más bajo publicado ) | 90.000 ppm (162.000 mg/m 3 ) (humano, 5 min) [6] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 5000 ppm (9000 mg/m3 ) [ 5] | ||
REL (recomendado) | TWA 5000 ppm (9000 mg/m3 ) , ST 30 000 ppm (54 000 mg/m3 ) [ 5] | ||
IDLH (Peligro inmediato) | 40.000 ppm (72.000 mg/m3 ) [ 5] | ||
| Ficha de datos de seguridad (FDS) | Sigma-Aldrich | ||
| Compuestos relacionados | |||
Otros aniones |
| ||
Otros cationes | |||
| Ver Oxocarbono | |||
Compuestos relacionados | |||
| Página de datos complementarios | |||
| Dióxido de carbono (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El dióxido de carbono es un compuesto químico con la fórmula química CO2 . Está formado por moléculas que tienen cada una un átomo de carbono unido mediante un doble enlace covalente a dos átomos de oxígeno . Se encuentra en estado gaseoso a temperatura ambiente. Como fuente de carbono en el ciclo del carbono , el CO2 atmosférico es la principal fuente de carbono para la vida en la Tierra. En el aire, el dióxido de carbono es transparente a la luz visible, pero absorbe la radiación infrarroja , actuando como un gas de efecto invernadero . El dióxido de carbono es soluble en agua y se encuentra en aguas subterráneas , lagos , casquetes polares y agua de mar . Cuando el dióxido de carbono se disuelve en agua, forma carbonato y principalmente bicarbonato ( HCO3) .−3), lo que provoca la acidificación de los océanos a medida que aumentan los niveles de CO 2 atmosférico . [9]
Es un gas traza en la atmósfera de la Tierra a 421 partes por millón (ppm) [a] , o aproximadamente el 0,042 % (a mayo de 2022), habiendo aumentado desde los niveles preindustriales de 280 ppm o aproximadamente el 0,028 %. [11] [12] La quema de combustibles fósiles es la causa principal de estas mayores concentraciones de CO 2 y también la causa principal del cambio climático . [13]
Su concentración en la atmósfera preindustrial de la Tierra desde finales del Precámbrico estaba regulada por organismos y características geológicas. Las plantas , las algas y las cianobacterias utilizan la energía de la luz solar para sintetizar carbohidratos a partir de dióxido de carbono y agua en un proceso llamado fotosíntesis , que produce oxígeno como producto de desecho. [14] A su vez, el oxígeno es consumido y el CO 2 es liberado como desecho por todos los organismos aeróbicos cuando metabolizan compuestos orgánicos para producir energía por respiración . [15] El CO 2 se libera de los materiales orgánicos cuando se descomponen o se queman, como en los incendios forestales.
El dióxido de carbono es un 53% más denso que el aire seco, pero tiene una larga vida y se mezcla completamente en la atmósfera. Aproximadamente la mitad del exceso de emisiones de CO2 a la atmósfera son absorbidas por los sumideros de carbono terrestres y oceánicos . [16] Estos sumideros pueden saturarse y son volátiles, ya que la descomposición y los incendios forestales dan como resultado que el CO2 se libere nuevamente a la atmósfera. [17] El CO2 finalmente se secuestra (se almacena a largo plazo) en rocas y depósitos orgánicos como carbón , petróleo y gas natural . El CO2 secuestrado se libera a la atmósfera a través de la quema de combustibles fósiles o de forma natural por volcanes , fuentes termales , géiseres y cuando las rocas carbonatadas se disuelven en agua o reaccionan con ácidos.
El CO2 es un material industrial versátil, utilizado, por ejemplo, como gas inerte en soldaduras y extintores de incendios , como gas presurizador en pistolas de aire y recuperación de petróleo, y como disolvente de fluido supercrítico en descafeinización y secado supercrítico . [18] Es un subproducto de la fermentación de azúcares en la elaboración de pan , cerveza y vino , y se añade a bebidas carbonatadas como el agua carbonatada y la cerveza para generar efervescencia. Tiene un olor fuerte y ácido y produce el sabor del agua carbonatada en la boca, pero en concentraciones normales es inodoro. [1]
Propiedades químicas y físicas
El dióxido de carbono no se puede licuar a presión atmosférica. El dióxido de carbono a baja temperatura se utiliza comercialmente en su forma sólida, comúnmente conocida como " hielo seco ". La transición de fase sólida a gas ocurre a 194,7 Kelvin y se denomina sublimación .
Estructura, enlaces y vibraciones moleculares
La simetría de una molécula de dióxido de carbono es lineal y centrosimétrica en su geometría de equilibrio. La longitud del enlace carbono-oxígeno en el dióxido de carbono es de 116,3 pm , notablemente más corta que la longitud de aproximadamente 140 pm de un enlace C-O simple típico, y más corta que la de la mayoría de los otros grupos funcionales C-O con enlaces múltiples, como los carbonilos . [19] Dado que es centrosimétrica, la molécula no tiene momento dipolar eléctrico .

Como molécula triatómica lineal, el CO2 tiene cuatro modos vibracionales , como se muestra en el diagrama. En los modos de estiramiento simétrico y antisimétrico, los átomos se mueven a lo largo del eje de la molécula. Hay dos modos de flexión, que son degenerados , lo que significa que tienen la misma frecuencia y la misma energía, debido a la simetría de la molécula. Cuando una molécula toca una superficie o toca otra molécula, los dos modos de flexión pueden diferir en frecuencia porque la interacción es diferente para los dos modos. Algunos de los modos vibracionales se observan en el espectro infrarrojo (IR) : el modo de estiramiento antisimétrico en el número de onda 2349 cm −1 (longitud de onda 4,25 μm) y el par degenerado de modos de flexión en 667 cm −1 (longitud de onda 15,0 μm). El modo de estiramiento simétrico no crea un dipolo eléctrico, por lo que no se observa en la espectroscopia IR, pero se detecta en la espectroscopia Raman a 1388 cm −1 (longitud de onda 7,20 μm). [20]
En la fase gaseosa, las moléculas de dióxido de carbono experimentan movimientos vibratorios significativos y no mantienen una estructura fija. Sin embargo, en un experimento de obtención de imágenes de explosión de Coulomb , se puede deducir una imagen instantánea de la estructura molecular. Se ha realizado un experimento de este tipo [21] para el dióxido de carbono. El resultado de este experimento, y la conclusión de los cálculos teóricos [22] basados en una superficie de energía potencial ab initio de la molécula, es que ninguna de las moléculas en la fase gaseosa es exactamente lineal. Este resultado contra-intuitivo se debe trivialmente al hecho de que el elemento de volumen del movimiento nuclear se desvanece para las geometrías lineales. [22] Esto es así para todas las moléculas excepto las moléculas diatómicas .
En solución acuosa
El dióxido de carbono es soluble en agua, en la que forma reversiblemente H 2 CO 3 (ácido carbónico), que es un ácido débil , porque su ionización en agua es incompleta.
- CO2 + H2O ⇌ H2CO3
La constante de equilibrio de hidratación del ácido carbónico es, a 25 °C:
Por lo tanto, la mayor parte del dióxido de carbono no se convierte en ácido carbónico, sino que permanece como moléculas de CO2 , sin afectar el pH.
Las concentraciones relativas de CO 2 , H 2 CO 3 y las formas desprotonadas HCO−3( bicarbonato ) y CO2−3( carbonato ) depende del pH . Como se muestra en un diagrama de Bjerrum , en agua neutra o ligeramente alcalina (pH > 6,5), predomina la forma bicarbonato (>50%) convirtiéndose en la más prevalente (>95%) al pH del agua de mar. En agua muy alcalina (pH > 10,4), la forma predominante (>50%) es el carbonato. Los océanos, al ser ligeramente alcalinos con un pH típico de 8,2 a 8,5, contienen alrededor de 120 mg de bicarbonato por litro.
Al ser diprótico , el ácido carbónico tiene dos constantes de disociación ácida , la primera para la disociación en el ion bicarbonato (también llamado hidrogenocarbonato) ( HCO−3):
- H2CO3 ⇌ HCO−3+H +
- K a1 = 2,5 × 10 −4 mol/L; p K a1 = 3,6 a 25 °C. [19]
Esta es la verdadera primera constante de disociación ácida, definida como
donde el denominador incluye solo H 2 CO 3 unido covalentemente y no incluye CO 2 hidratado (ac). El valor mucho más pequeño y frecuentemente citado cerca de 4,16 × 10 −7 (o pK a1 = 6,38) es un valor aparente calculado sobre la suposición (incorrecta) de que todo el CO 2 disuelto está presente como ácido carbónico, de modo que
Dado que la mayor parte del CO 2 disuelto permanece como moléculas de CO 2 , K a1 (aparente) tiene un denominador mucho mayor y un valor mucho menor que el K a1 verdadero . [23]
El ion bicarbonato es una especie anfótera que puede actuar como ácido o como base, dependiendo del pH de la solución. A pH alto, se disocia significativamente en el ion carbonato ( CO2−3):
- OHC−3⇌ CO2−3+H +
- K a2 = 4,69 × 10 −11 mol/L; p K a2 = 10,329
En los organismos, la producción de ácido carbónico está catalizada por la enzima conocida como anhidrasa carbónica .
Además de alterar su acidez, la presencia de dióxido de carbono en el agua también afecta sus propiedades eléctricas.
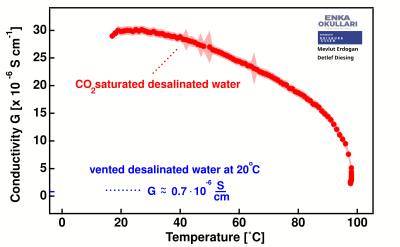
Cuando el dióxido de carbono se disuelve en agua desalinizada, la conductividad eléctrica aumenta significativamente desde menos de 1 μS/cm hasta casi 30 μS/cm. Al calentarse, el agua comienza a perder gradualmente la conductividad inducida por la presencia de , especialmente notable a temperaturas superiores a los 30 °C.
La dependencia de la temperatura de la conductividad eléctrica del agua completamente desionizada sin saturación de CO 2 es comparativamente baja en relación con estos datos.
Reacciones químicas
El CO 2 es un electrófilo potente que tiene una reactividad electrófila comparable a la del benzaldehído o a los compuestos carbonílicos α,β-insaturados fuertemente electrófilos . Sin embargo, a diferencia de los electrófilos de reactividad similar, las reacciones de los nucleófilos con el CO 2 son termodinámicamente menos favorecidas y a menudo se descubre que son altamente reversibles. [24] La reacción reversible del dióxido de carbono con aminas para formar carbamatos se utiliza en depuradores de CO 2 y se ha sugerido como un posible punto de partida para la captura y almacenamiento de carbono mediante el tratamiento de gases de amina . Solo los nucleófilos muy fuertes, como los carbaniones proporcionados por los reactivos de Grignard y los compuestos de organolitio, reaccionan con el CO 2 para dar carboxilatos :
En los complejos metálicos de dióxido de carbono , el CO2 actúa como ligando , lo que puede facilitar la conversión de CO2 en otras sustancias químicas. [25]
La reducción de CO 2 a CO es normalmente una reacción difícil y lenta:
- CO 2 + 2 mi − + 2 H + → CO + H 2 O
El potencial redox para esta reacción cerca de un pH de 7 es de aproximadamente -0,53 V en comparación con el electrodo de hidrógeno estándar . La enzima que contiene níquel, la deshidrogenasa de monóxido de carbono, cataliza este proceso. [26]
Los fotoautótrofos (es decir, plantas y cianobacterias ) utilizan la energía contenida en la luz solar para fotosintetizar azúcares simples a partir del CO2 absorbido del aire y el agua:
- norte CO 2 + norte H 2 O → (CH 2 O) norte + norte O 2
Propiedades físicas

El dióxido de carbono es incoloro. En concentraciones bajas, el gas es inodoro; sin embargo, en concentraciones suficientemente altas, tiene un olor ácido y penetrante. [1] A temperatura y presión estándar , la densidad del dióxido de carbono es de alrededor de 1,98 kg/m 3 , aproximadamente 1,53 veces la del aire . [27]
El dióxido de carbono no tiene estado líquido a presiones inferiores a 0,51795(10) MPa [2] (5,11177(99) atm ). A una presión de 1 atm (0,101325 MPa), el gas se deposita directamente en un sólido a temperaturas inferiores a 194,6855(30) K [2] (−78,4645(30) °C) y el sólido sublima directamente en un gas por encima de esta temperatura. En su estado sólido, el dióxido de carbono se denomina comúnmente hielo seco .

El dióxido de carbono líquido se forma solo a presiones superiores a 0,51795(10) MPa [2] (5,11177(99) atm); el punto triple del dióxido de carbono es 216,592(3) K [2] (−56,558(3) °C) a 0,51795(10) MPa [2] (5,11177(99) atm) (véase el diagrama de fases). El punto crítico es 304,128(15) K [2] (30,978(15) °C) a 7,3773(30) MPa [2] (72,808(30) atm). Otra forma de dióxido de carbono sólido observada a alta presión es un sólido amorfo similar al vidrio. [28] Esta forma de vidrio, llamada carbonia , se produce al sobreenfriar CO2 calentado a presiones extremas (40–48 GPa , o aproximadamente 400.000 atmósferas) en un yunque de diamante . Este descubrimiento confirmó la teoría de que el dióxido de carbono podría existir en un estado vítreo similar a otros miembros de su familia elemental, como el dióxido de silicio (vidrio de sílice) y el dióxido de germanio . Sin embargo, a diferencia de los vidrios de sílice y germania, el vidrio carbonia no es estable a presiones normales y se revierte al gas cuando se libera la presión.
A temperaturas y presiones superiores al punto crítico, el dióxido de carbono se comporta como un fluido supercrítico conocido como dióxido de carbono supercrítico .
Tabla de propiedades térmicas y físicas del dióxido de carbono líquido saturado: [29] [30]
| Temperatura (°C) | Densidad (kg/ m3 ) | Calor específico (kJ/(kg⋅K)) | Viscosidad cinemática (m2 / s) | Conductividad térmica (W/(m⋅K)) | Difusividad térmica (m2 / s) | Número de Prandtl |
|---|---|---|---|---|---|---|
| -50 | 1156.34 | 1.84 | 1,19 × 10 −7 | 0,0855 | 4,02 × 10 −8 | 2,96 |
| -40 | 1117,77 | 1,88 | 1,18 × 10 −7 | 0,1011 | 4,81 × 10 −8 | 2.46 |
| -30 | 1076,76 | 1,97 | 1,17 × 10 −7 | 0,1116 | 5,27 × 10 −8 | 2.22 |
| -20 | 1032.39 | 2.05 | 1,15 × 10 −7 | 0,1151 | 5,45 × 10 −8 | 2.12 |
| -10 | 983.38 | 2.18 | 1,13 × 10 −7 | 0,1099 | 5,13 × 10 −8 | 2.2 |
| 0 | 926,99 | 2.47 | 1,08 × 10 −7 | 0,1045 | 4,58 × 10 −8 | 2.38 |
| 10 | 860.03 | 3.14 | 1,01 × 10 −7 | 0,0971 | 3,61 × 10 −8 | 2.8 |
| 20 | 772,57 | 5 | 9,10 × 10 −8 | 0,0872 | 2,22 × 10 −8 | 4.1 |
| 30 | 597,81 | 36.4 | 8,00 × 10 −8 | 0,0703 | 0,279 × 10 −8 | 28.7 |
Tabla de propiedades térmicas y físicas del dióxido de carbono (CO 2 ) a presión atmosférica: [29] [30]
| Temperatura (K) | Densidad (kg/ m3 ) | Calor específico (kJ/(kg⋅°C)) | Viscosidad dinámica (kg/(m⋅s)) | Viscosidad cinemática (m2 / s) | Conductividad térmica (W/(m⋅°C)) | Difusividad térmica (m2 / s) | Número de Prandtl |
|---|---|---|---|---|---|---|---|
| 220 | 2.4733 | 0,783 | 1,11 × 10 −5 | 4,49 × 10 −6 | 0,010805 | 5,92 × 10 −6 | 0,818 |
| 250 | 2.1657 | 0.804 | 1,26 × 10 −5 | 5,81 × 10 −6 | 0,012884 | 7,40 × 10 −6 | 0,793 |
| 300 | 1.7973 | 0,871 | 1,50 × 10 −5 | 8,32 × 10 −6 | 0,016572 | 1,06 × 10 −5 | 0,77 |
| 350 | 1.5362 | 0.9 | 1,72 × 10 −5 | 1,12 × 10 −5 | 0,02047 | 1,48 × 10 −5 | 0,755 |
| 400 | 1.3424 | 0,942 | 1,93 × 10 −5 | 1,44 × 10 −5 | 0,02461 | 1,95 × 10 −5 | 0,738 |
| 450 | 1.1918 | 0,98 | 2,13 × 10 −5 | 1,79 × 10 −5 | 0,02897 | 2,48 × 10 −5 | 0,721 |
| 500 | 1.0732 | 1.013 | 2,33 × 10 −5 | 2,17 × 10 −5 | 0,03352 | 3,08 × 10 −5 | 0,702 |
| 550 | 0,9739 | 1.047 | 2,51 × 10 −5 | 2,57 × 10 −5 | 0,03821 | 3,75 × 10 −5 | 0,685 |
| 600 | 0,8938 | 1.076 | 2,68 × 10 −5 | 3,00 × 10 −5 | 0,04311 | 4,48 × 10 −5 | 0,668 |
| 650 | 0,8143 | 1.1 | 2,88 × 10 −5 | 3,54 × 10 −5 | 0,0445 | 4,97 × 10 −5 | 0,712 |
| 700 | 0,7564 | 1.13 | 3,05 × 10 −5 | 4,03 × 10 −5 | 0,0481 | 5,63 × 10 −5 | 0,717 |
| 750 | 0,7057 | 1.15 | 3,21 × 10 −5 | 4,55 × 10 −5 | 0,0517 | 6,37 × 10 −5 | 0,714 |
| 800 | 0,6614 | 1.17 | 3,37 × 10 −5 | 5,10 × 10 −5 | 0,0551 | 7,12 × 10 −5 | 0,716 |
Papel biológico
El dióxido de carbono es un producto final de la respiración celular en los organismos que obtienen energía descomponiendo azúcares, grasas y aminoácidos con oxígeno como parte de su metabolismo . Esto incluye a todas las plantas, algas y animales y hongos y bacterias aeróbicas . En los vertebrados , el dióxido de carbono viaja en la sangre desde los tejidos del cuerpo hasta la piel (p. ej., anfibios ) o las branquias (p. ej., peces ), desde donde se disuelve en el agua, o hasta los pulmones desde donde se exhala. Durante la fotosíntesis activa, las plantas pueden absorber más dióxido de carbono de la atmósfera del que liberan en la respiración.
Fotosíntesis y fijación de carbono

La fijación del carbono es un proceso bioquímico por el cual las plantas, algas y cianobacterias incorporan el dióxido de carbono atmosférico a moléculas orgánicas ricas en energía, como la glucosa , creando así su propio alimento mediante la fotosíntesis. La fotosíntesis utiliza el dióxido de carbono y el agua para producir azúcares a partir de los cuales se pueden construir otros compuestos orgánicos , y se produce oxígeno como subproducto.
La ribulosa-1,5-bisfosfato carboxilasa oxigenasa , comúnmente abreviada como RuBisCO, es la enzima involucrada en el primer paso principal de la fijación de carbono, la producción de dos moléculas de 3-fosfoglicerato a partir de CO2 y ribulosa bisfosfato , como se muestra en el diagrama de la izquierda.
Se cree que RuBisCO es la proteína más abundante en la Tierra. [31]
Los fotótrofos utilizan los productos de su fotosíntesis como fuentes de alimento interno y como materia prima para la biosíntesis de moléculas orgánicas más complejas, como polisacáridos , ácidos nucleicos y proteínas. Estos se utilizan para su propio crecimiento y también como base de las cadenas y redes alimentarias que alimentan a otros organismos, incluidos animales como nosotros. Algunos fotótrofos importantes, los cocolitóforos, sintetizan escamas duras de carbonato de calcio . [32] Una especie de cocolitóforo de importancia mundial es Emiliania huxleyi , cuyas escamas de calcita han formado la base de muchas rocas sedimentarias como la caliza , donde lo que anteriormente era carbono atmosférico puede permanecer fijado durante escalas de tiempo geológicas.

Las plantas pueden crecer hasta un 50% más rápido en concentraciones de 1.000 ppm de CO2 en comparación con las condiciones ambientales, aunque esto supone que no hay cambios en el clima ni limitaciones en otros nutrientes. [33] Los niveles elevados de CO2 provocan un mayor crecimiento que se refleja en el rendimiento cosechable de los cultivos, y el trigo, el arroz y la soja mostraron aumentos en el rendimiento de entre el 12 y el 14% en condiciones de CO2 elevado en experimentos FACE. [34] [35]
El aumento de las concentraciones atmosféricas de CO2 da como resultado un menor desarrollo de estomas en las plantas [36], lo que conduce a un menor uso del agua y a una mayor eficiencia en su uso . [37] Los estudios que utilizan FACE han demostrado que el enriquecimiento con CO2 conduce a una disminución de las concentraciones de micronutrientes en las plantas de cultivo. [38] Esto puede tener efectos secundarios en otras partes de los ecosistemas , ya que los herbívoros necesitarán comer más alimentos para obtener la misma cantidad de proteínas. [39]
La concentración de metabolitos secundarios como fenilpropanoides y flavonoides también puede alterarse en plantas expuestas a altas concentraciones de CO 2 . [40] [41]
Las plantas también emiten CO2 durante la respiración, por lo que la mayoría de las plantas y algas, que utilizan la fotosíntesis de C3 , solo son absorbentes netos durante el día. Aunque un bosque en crecimiento absorberá muchas toneladas de CO2 cada año, un bosque maduro producirá tanto CO2 a partir de la respiración y la descomposición de especímenes muertos (por ejemplo, ramas caídas) como el que se utiliza en la fotosíntesis en las plantas en crecimiento. [42] Contrariamente a la opinión de larga data de que son neutrales en carbono, los bosques maduros pueden seguir acumulando carbono [43] y seguir siendo valiosos sumideros de carbono , lo que ayuda a mantener el equilibrio de carbono de la atmósfera de la Tierra. Además, y de manera crucial para la vida en la Tierra, la fotosíntesis del fitoplancton consume CO2 disuelto en el océano superior y, por lo tanto, promueve la absorción de CO2 de la atmósfera. [44]
Toxicidad

El contenido de dióxido de carbono en el aire fresco (promediado entre el nivel del mar y el nivel de 10 kPa, es decir, aproximadamente 30 km (19 mi) de altitud) varía entre 0,036% (360 ppm) y 0,041% (412 ppm), dependiendo de la ubicación. [46]
En los seres humanos, la exposición al CO 2 en concentraciones superiores al 5% provoca el desarrollo de hipercapnia y acidosis respiratoria . [47] Concentraciones del 7% al 10% (70.000 a 100.000 ppm) pueden causar asfixia, incluso en presencia de suficiente oxígeno, manifestándose como mareos, dolor de cabeza, disfunción visual y auditiva y pérdida del conocimiento en unos pocos minutos a una hora. [48] Concentraciones superiores al 10% pueden causar convulsiones, coma y muerte. Niveles de CO 2 superiores al 30% actúan rápidamente provocando pérdida del conocimiento en segundos. [47]
Debido a que es más pesado que el aire, en lugares donde el gas se filtra desde el suelo (debido a la actividad volcánica o geotérmica subterránea) en concentraciones relativamente altas, sin los efectos de dispersión del viento, puede acumularse en lugares protegidos o en bolsas por debajo del nivel medio del suelo, lo que provoca la asfixia de los animales que se encuentran allí. Los carroñeros atraídos por los cadáveres también mueren. Han muerto niños de la misma forma cerca de la ciudad de Goma por las emisiones de CO 2 del cercano volcán Nyiragongo . [49] El término swahili para este fenómeno es mazuku .

La adaptación a concentraciones mayores de CO 2 ocurre en los humanos, incluyendo respiración modificada y producción de bicarbonato en los riñones, con el fin de equilibrar los efectos de la acidificación de la sangre ( acidosis ). Varios estudios sugirieron que se podrían utilizar concentraciones inspiradas del 2,0 por ciento para espacios aéreos cerrados (por ejemplo, un submarino ) ya que la adaptación es fisiológica y reversible, ya que el deterioro en el rendimiento o en la actividad física normal no ocurre en este nivel de exposición durante cinco días. [50] [51] Sin embargo, otros estudios muestran una disminución de la función cognitiva incluso a niveles mucho más bajos. [52] [53] Además, con acidosis respiratoria en curso , los mecanismos de adaptación o compensación no podrán revertir la condición.
Por debajo del 1%
Existen pocos estudios sobre los efectos en la salud de la exposición continua a largo plazo al CO2 en seres humanos y animales a niveles inferiores al 1%. En Estados Unidos, los límites de exposición ocupacional al CO2 se han establecido en 0,5% (5000 ppm) durante un período de ocho horas. [ 54] Con esta concentración de CO2 , la tripulación de la Estación Espacial Internacional experimentó dolores de cabeza, letargo, lentitud mental, irritación emocional y alteración del sueño. [55] Estudios en animales con 0,5% de CO2 han demostrado calcificación renal y pérdida ósea después de ocho semanas de exposición. [56] Un estudio de seres humanos expuestos en sesiones de 2,5 horas demostró efectos negativos significativos en las capacidades cognitivas a concentraciones tan bajas como 0,1% (1000 ppm) de CO2, probablemente debido a aumentos inducidos por el CO2 en el flujo sanguíneo cerebral. [52] Otro estudio observó una disminución en el nivel de actividad básica y el uso de la información a 1000 ppm, en comparación con 500 ppm. [53]
Sin embargo, una revisión de la literatura encontró que un subconjunto confiable de estudios sobre el fenómeno del deterioro cognitivo inducido por el dióxido de carbono solo mostró un pequeño efecto en la toma de decisiones de alto nivel (para concentraciones inferiores a 5000 ppm). La mayoría de los estudios se vieron afectados por diseños de estudio inadecuados, comodidad ambiental, incertidumbres en las dosis de exposición y diferentes evaluaciones cognitivas utilizadas. [57] De manera similar, un estudio sobre los efectos de la concentración de CO2 en los cascos de motocicleta ha sido criticado por tener una metodología dudosa al no anotar los autoinformes de los motociclistas y tomar mediciones utilizando maniquíes. Además, cuando se alcanzaron las condiciones normales de la motocicleta (como velocidades de autopista o ciudad) o se levantó la visera, la concentración de CO2 disminuyó a niveles seguros (0,2%). [58] [59]
| Concentración | Nota |
|---|---|
| 280 ppm | Niveles preindustriales |
| 421 ppm | Niveles actuales (mayo de 2022) |
| 700 ppm | Recomendación de ASHRAE [60] |
| 5.000 ppm | EE.UU. Límite de exposición de 8 h [54] |
| 10.000 ppm | Deterioro cognitivo: límite de exposición a largo plazo de Canadá [45] |
| 10.000-20.000 ppm | Somnolencia [48] |
| 20.000-50.000 ppm | Dolores de cabeza, somnolencia, falta de concentración, pérdida de atención, también pueden presentarse náuseas leves [54] |
Ventilación

La mala ventilación es una de las principales causas de concentraciones excesivas de CO2 en espacios cerrados, lo que conduce a una mala calidad del aire interior . El diferencial de dióxido de carbono por encima de las concentraciones exteriores en condiciones de estado estable (cuando la ocupación y el funcionamiento del sistema de ventilación son lo suficientemente largos como para que la concentración de CO2 se haya estabilizado) a veces se utiliza para estimar las tasas de ventilación por persona. [61] Las concentraciones más altas de CO2 se asocian con la degradación de la salud, la comodidad y el rendimiento de los ocupantes. [62] [63] Las tasas de ventilación de la Norma ASHRAE 62.1–2007 pueden dar lugar a concentraciones interiores de hasta 2100 ppm por encima de las condiciones ambientales exteriores. Por lo tanto, si la concentración exterior es de 400 ppm, las concentraciones interiores pueden alcanzar las 2500 ppm con tasas de ventilación que cumplan con esta norma de consenso de la industria. Se pueden encontrar concentraciones incluso superiores a esto en espacios mal ventilados (rango de 3000 o 4000 ppm).
Los mineros, que son especialmente vulnerables a la exposición a los gases debido a la ventilación insuficiente, se referían a las mezclas de dióxido de carbono y nitrógeno como " humedad negra ", "humedad asfixiante" o "estiba". Antes de que se desarrollaran tecnologías más efectivas, los mineros solían controlar los niveles peligrosos de humedad negra y otros gases en los pozos de las minas llevando consigo un canario enjaulado mientras trabajaban. El canario es más sensible a los gases asfixiantes que los humanos y, cuando perdía el conocimiento, dejaba de cantar y se caía de su percha. La lámpara Davy también podía detectar altos niveles de humedad negra (que se hunde y se acumula cerca del suelo) al arder con menos intensidad, mientras que el metano , otro gas asfixiante y con riesgo de explosión, hacía que la lámpara ardiese con más intensidad.
En febrero de 2020, tres personas murieron por asfixia en una fiesta en Moscú cuando se añadió hielo seco (CO2 congelado ) a una piscina para enfriarla. [64] Un accidente similar ocurrió en 2018 cuando una mujer murió a causa de los vapores de CO2 que emanaban de la gran cantidad de hielo seco que transportaba en su automóvil. [65]
Aire interior
Los seres humanos pasan cada vez más tiempo en un ambiente confinado (alrededor del 80-90% del tiempo en un edificio o un vehículo). Según la Agencia Francesa de Seguridad Alimentaria, Medioambiental y de Salud en el Trabajo (ANSES) y diversos actores en Francia, la tasa de CO2 en el aire interior de los edificios (vinculada a la ocupación humana o animal y a la presencia de instalaciones de combustión ), ponderada por la renovación del aire, se sitúa "normalmente entre 350 y 2.500 ppm" [66] .
En los hogares, escuelas, guarderías y oficinas no existen relaciones sistemáticas entre los niveles de CO2 y otros contaminantes, y el CO2 en interiores no es estadísticamente un buen predictor de los contaminantes vinculados al tráfico rodado (o aéreo, etc.) en el exterior. [67] El CO2 es el parámetro que cambia más rápidamente (junto con la higrometría y los niveles de oxígeno cuando los seres humanos o los animales están reunidos en una habitación cerrada o mal ventilada). En los países pobres, muchos hogares abiertos son fuentes de CO2 y CO emitidos directamente al entorno vital. [68]
Áreas al aire libre con concentraciones elevadas
Las concentraciones locales de dióxido de carbono pueden alcanzar valores elevados cerca de fuentes potentes, especialmente aquellas que están aisladas por el terreno circundante. En las aguas termales de Bossoleto, cerca de Rapolano Terme en Toscana , Italia, situadas en una depresión en forma de cuenco de unos 100 m (330 pies) de diámetro, las concentraciones de CO2 aumentan por encima del 75% durante la noche, lo suficiente para matar insectos y animales pequeños. Después del amanecer, el gas se dispersa por convección. [69] Se cree que las altas concentraciones de CO2 producidas por la perturbación del agua de un lago profundo saturado de CO2 causaron 37 muertes en el lago Monoun , Camerún, en 1984 y 1700 víctimas en el lago Nyos , Camerún, en 1986. [70]
Fisiología humana
Contenido
| Compartimento de sangre | ( kPa ) | ( mmHg ) |
|---|---|---|
| Dióxido de carbono en sangre venosa | 5,5–6,8 | 41–51 [71] |
| Presiones de gas pulmonar alveolar | 4.8 | 36 |
| Dióxido de carbono en sangre arterial | 4,7–6,0 | 35–45 [71] |
El cuerpo produce aproximadamente 2,3 libras (1,0 kg) de dióxido de carbono por día por persona, [72] que contiene 0,63 libras (290 g) de carbono.En los seres humanos, este dióxido de carbono se transporta a través del sistema venoso y se exhala a través de los pulmones, lo que da como resultado concentraciones más bajas en las arterias . El contenido de dióxido de carbono de la sangre a menudo se expresa como presión parcial , que es la presión que habría tenido el dióxido de carbono si solo ocupara el volumen. [73] En los seres humanos, los contenidos de dióxido de carbono en la sangre se muestran en la tabla adyacente.
Transporte en la sangre
El CO2 se transporta en la sangre de tres formas diferentes. Los porcentajes exactos varían entre la sangre arterial y la venosa.
- La mayoría (alrededor del 70% al 80%) se convierte en iones de bicarbonato HCO−3por la enzima anhidrasa carbónica en los glóbulos rojos, [74] por la reacción:
- CO 2 + H 2 O → H 2 CO 3 → H + + HCO−3
- Entre el 5 y el 10% se disuelve en el plasma sanguíneo [74]
- Entre el 5 y el 10% se une a la hemoglobina como compuestos carbamino [74]
La hemoglobina , la principal molécula transportadora de oxígeno en los glóbulos rojos , transporta tanto oxígeno como dióxido de carbono. Sin embargo, el CO 2 unido a la hemoglobina no se une al mismo sitio que el oxígeno. En cambio, se combina con los grupos N-terminales de las cuatro cadenas de globina. Sin embargo, debido a los efectos alostéricos en la molécula de hemoglobina, la unión del CO 2 disminuye la cantidad de oxígeno que se une para una presión parcial de oxígeno dada. Esto se conoce como el efecto Haldane y es importante en el transporte de dióxido de carbono desde los tejidos hasta los pulmones. Por el contrario, un aumento en la presión parcial de CO 2 o un pH más bajo provocarán la descarga de oxígeno de la hemoglobina, lo que se conoce como el efecto Bohr .
Regulación de la respiración
El dióxido de carbono es uno de los mediadores de la autorregulación local del riego sanguíneo. Si su concentración es alta, los capilares se expanden para permitir un mayor flujo sanguíneo a ese tejido. [75]
Los iones de bicarbonato son cruciales para regular el pH de la sangre. La frecuencia respiratoria de una persona influye en el nivel de CO2 en su sangre. Una respiración demasiado lenta o superficial provoca acidosis respiratoria , mientras que una respiración demasiado rápida provoca hiperventilación , que puede causar alcalosis respiratoria . [76]
Aunque el cuerpo necesita oxígeno para el metabolismo, los niveles bajos de oxígeno normalmente no estimulan la respiración, sino que la misma es estimulada por niveles más altos de dióxido de carbono. Como resultado, respirar aire a baja presión o una mezcla de gases sin oxígeno en absoluto (como nitrógeno puro) puede provocar pérdida de conciencia sin experimentar nunca la falta de aire . Esto es especialmente peligroso para los pilotos de combate de gran altitud. También es por eso que los auxiliares de vuelo instruyen a los pasajeros, en caso de pérdida de presión en la cabina, a colocarse primero la máscara de oxígeno ellos mismos antes de ayudar a los demás; de lo contrario, se corre el riesgo de perder la conciencia. [74]
Los centros respiratorios intentan mantener una presión arterial de CO2 de 40 mmHg . Con la hiperventilación intencionada, el contenido de CO2 de la sangre arterial puede reducirse a 10-20 mmHg (el contenido de oxígeno de la sangre se ve poco afectado) y el impulso respiratorio se reduce. Por eso, se puede aguantar la respiración durante más tiempo después de la hiperventilación que sin ella. Esto conlleva el riesgo de que se produzca una pérdida de conocimiento antes de que la necesidad de respirar se vuelva abrumadora, por lo que la hiperventilación es especialmente peligrosa antes del buceo en apnea. [77]
Concentraciones y papel en el medio ambiente
Atmósfera

En la atmósfera de la Tierra , el dióxido de carbono es un gas traza que juega un papel integral en el efecto invernadero , el ciclo del carbono , la fotosíntesis y el ciclo del carbono oceánico . Es uno de los tres principales gases de efecto invernadero en la atmósfera de la Tierra . El vapor de agua es el principal gas de efecto invernadero , a partir de 2010, contribuyendo con el 50% del efecto invernadero, seguido por el dióxido de carbono con el 20%. [78] La concentración promedio global actual de dióxido de carbono (CO 2 ) en la atmósfera es de 421 ppm (0,04 %) a mayo de 2022. [79] Este es un aumento del 50% desde el inicio de la Revolución Industrial , frente a las 280 ppm durante los 10.000 años anteriores a mediados del siglo XVIII. [80] [79] [81] El aumento se debe a la actividad humana . [82]
En marzo de 2024, la concentración media mensual de CO 2 alcanzó un nuevo récord de 425,22 partes por millón (ppm), lo que supone un aumento de 4,7 ppm con respecto a marzo de 2023. Según la última medición, los niveles habían aumentado aún más hasta 427,48 ppm. [83] Este aumento continuo de las concentraciones de CO 2 es un claro indicador del estrés ambiental global en curso, impulsado principalmente por la quema de combustibles fósiles , que es la principal causa de este aumento y también un importante contribuyente al cambio climático . [84] Otras actividades humanas importantes que emiten CO 2 incluyen la producción de cemento , la deforestación y la quema de biomasa .
El dióxido de carbono es un gas de efecto invernadero. Absorbe y emite radiación infrarroja en sus dos frecuencias vibratorias activas en el infrarrojo. Las dos longitudes de onda son 4,26 μm (2347 cm −1 ) ( modo vibratorio de estiramiento asimétrico ) y 14,99 μm (667 cm −1 ) (modo vibratorio de flexión). El CO 2 desempeña un papel importante en la influencia de la temperatura de la superficie de la Tierra a través del efecto invernadero. [85] La emisión de luz de la superficie de la Tierra es más intensa en la región infrarroja entre 200 y 2500 cm −1 , [86] a diferencia de la emisión de luz del Sol mucho más caliente, que es más intensa en la región visible. La absorción de luz infrarroja en las frecuencias vibratorias del CO 2 atmosférico atrapa la energía cerca de la superficie, calentando la superficie de la Tierra y su atmósfera inferior. Menos energía llega a la atmósfera superior, que por lo tanto es más fría debido a esta absorción. [87]
El aumento de las concentraciones atmosféricas de CO 2 y otros gases de efecto invernadero de larga duración, como el metano , aumenta la absorción y emisión de radiación infrarroja por parte de la atmósfera. Esto ha provocado un aumento de la temperatura media global y la acidificación de los océanos . Otro efecto directo es el efecto de fertilización del CO 2 . El aumento de las concentraciones atmosféricas de CO 2 provoca una serie de efectos adicionales del cambio climático sobre el medio ambiente y las condiciones de vida de los seres humanos.
La concentración atmosférica actual de CO2 es la más alta en 14 millones de años. [88] Las concentraciones de CO2 en la atmósfera fueron tan altas como 4.000 ppm durante el período Cámbrico hace unos 500 millones de años, y tan bajas como 180 ppm durante la glaciación cuaternaria de los últimos dos millones de años. [80] Los registros de temperatura reconstruidos para los últimos 420 millones de años indican que las concentraciones atmosféricas de CO2 alcanzaron un máximo de aproximadamente 2.000 ppm. Este pico ocurrió durante el período Devónico (hace 400 millones de años). Otro pico ocurrió en el período Triásico (hace 220-200 millones de años). [89]
Océanos
Acidificación de los océanos
El dióxido de carbono se disuelve en el océano para formar ácido carbónico ( H2CO3 ) , bicarbonato ( HCO3 ) .−3) y carbonato ( CO2−3). En los océanos hay aproximadamente cincuenta veces más dióxido de carbono disuelto que el que existe en la atmósfera. Los océanos actúan como un enorme sumidero de carbono y han absorbido aproximadamente un tercio del CO 2 emitido por la actividad humana. [91]
La acidificación de los océanos es la disminución continua del pH de los océanos de la Tierra . Entre 1950 y 2020, el pH promedio de la superficie del océano cayó de aproximadamente 8,15 a 8,05. [92] Las emisiones de dióxido de carbono de las actividades humanas son la causa principal de la acidificación de los océanos, con niveles de dióxido de carbono atmosférico (CO 2 ) que superan las 422 ppm (a partir de 2024 [actualizar]). [93] El CO 2 de la atmósfera es absorbido por los océanos. Esta reacción química produce ácido carbónico ( H 2 CO 3 ) que se disocia en un ion bicarbonato ( HCO−3) y un ion hidrógeno ( H + ). La presencia de iones hidrógeno libres ( H + ) reduce el pH del océano, aumentando la acidez (esto no significa que el agua de mar sea ácida todavía; sigue siendo alcalina , con un pH superior a 8). Los organismos marinos calcificantes , como los moluscos y los corales , son especialmente vulnerables porque dependen del carbonato de calcio para construir conchas y esqueletos. [94]
Un cambio de 0,1 en el pH representa un aumento del 26% en la concentración de iones de hidrógeno en los océanos del mundo (la escala de pH es logarítmica, por lo que un cambio de uno en las unidades de pH equivale a un cambio de diez veces en la concentración de iones de hidrógeno). El pH de la superficie del mar y los estados de saturación de carbonatos varían según la profundidad y la ubicación del océano. Las aguas más frías y de latitudes más altas son capaces de absorber más CO 2 . Esto puede hacer que la acidez aumente, reduciendo el pH y los niveles de saturación de carbonatos en estas áreas. Hay varios otros factores que influyen en el intercambio de CO 2 entre la atmósfera y el océano y, por lo tanto, en la acidificación local de los océanos. Estos incluyen las corrientes oceánicas y las zonas de surgencia , la proximidad a grandes ríos continentales, la cobertura de hielo marino y el intercambio atmosférico con nitrógeno y azufre provenientes de la quema de combustibles fósiles y la agricultura . [95] [96] [97]
Los cambios en la química del océano pueden tener amplios efectos directos e indirectos sobre los organismos y sus hábitats. Una de las repercusiones más importantes del aumento de la acidez del océano se relaciona con la producción de conchas a partir de carbonato de calcio ( CaCO 3 ). [94] Este proceso se llama calcificación y es importante para la biología y la supervivencia de una amplia gama de organismos marinos. La calcificación implica la precipitación de iones disueltos en estructuras sólidas de CaCO 3 , estructuras para muchos organismos marinos, como cocolitóforos , foraminíferos , crustáceos , moluscos , etc. Después de que se forman, estas estructuras de CaCO 3 son vulnerables a la disolución a menos que el agua de mar circundante contenga concentraciones saturantes de iones de carbonato ( CO2−3).
Muy poco del dióxido de carbono adicional que se añade al océano permanece en forma de dióxido de carbono disuelto. La mayor parte se disocia en bicarbonato adicional e iones de hidrógeno libres. El aumento de hidrógeno es mayor que el de bicarbonato, [98] lo que crea un desequilibrio en la reacción:
- OHC−3⇌ CO2−3+H +
Para mantener el equilibrio químico, algunos de los iones de carbonato que ya se encuentran en el océano se combinan con algunos de los iones de hidrógeno para formar más bicarbonato. De esta manera, se reduce la concentración de iones de carbonato en el océano, lo que elimina un componente esencial para que los organismos marinos construyan conchas o se calcifiquen:
- Ca2 + + CO2−3⇌ CaCO3
Fuentes hidrotermales
El dióxido de carbono también se introduce en los océanos a través de los respiraderos hidrotermales. El respiradero hidrotermal Champagne , que se encuentra en el volcán Eifuku del Noroeste en la Fosa de las Marianas , produce dióxido de carbono líquido casi puro, uno de los dos únicos sitios conocidos en el mundo en 2004, el otro se encuentra en la Fosa de Okinawa . [99] El hallazgo de un lago submarino de dióxido de carbono líquido en la Fosa de Okinawa se informó en 2006. [100]
Producción
Procesos biológicos
El dióxido de carbono es un subproducto de la fermentación del azúcar en la elaboración de cerveza , whisky y otras bebidas alcohólicas y en la producción de bioetanol . La levadura metaboliza el azúcar para producir CO2 y etanol , también conocido como alcohol, de la siguiente manera:
- C 6 H 12 O 6 → 2 CO 2 + 2 CH 3 CH 2 OH
Todos los organismos aeróbicos producen CO2 cuando oxidan carbohidratos , ácidos grasos y proteínas . La gran cantidad de reacciones involucradas son extremadamente complejas y no se describen fácilmente. Consulte la respiración celular , la respiración anaeróbica y la fotosíntesis . La ecuación para la respiración de la glucosa y otros monosacáridos es:
- C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O
Los organismos anaeróbicos descomponen la materia orgánica produciendo metano y dióxido de carbono junto con trazas de otros compuestos. [101] Independientemente del tipo de materia orgánica, la producción de gases sigue un patrón cinético bien definido . El dióxido de carbono constituye alrededor del 40-45% del gas que emana de la descomposición en los vertederos (denominado " gas de vertedero "). La mayor parte del 50-55% restante es metano. [102]
Procesos industriales y transporte
El dióxido de carbono se produce en muchos procesos industriales y en los motores de combustión interna de los vehículos . [103] Casi todas las emisiones de dióxido de carbono se liberan a la atmósfera. Alrededor de una milésima parte de las emisiones anuales se capturan mediante tecnología de captura y almacenamiento de carbono . [104]
Combustión
La combustión de todos los combustibles basados en carbono , como el metano ( gas natural ), los destilados de petróleo ( gasolina , diésel , queroseno , propano ), el carbón, la madera y la materia orgánica en general, produce dióxido de carbono y, excepto en el caso del carbono puro, agua. Como ejemplo, la reacción química entre el metano y el oxígeno :
- CH4 + 2O2 → CO2 + 2H2O
El hierro se reduce a partir de sus óxidos con coque en un alto horno , produciendo arrabio y dióxido de carbono: [105]
- Fe 2 O 3 + 3 CO → 3 CO 2 + 2 Fe
Subproducto de la producción de hidrógeno
El dióxido de carbono es un subproducto de la producción industrial de hidrógeno mediante reformado con vapor y la reacción de desplazamiento del gas de agua en la producción de amoníaco . Estos procesos comienzan con la reacción del agua y el gas natural (principalmente metano). [106] Esta es una fuente importante de dióxido de carbono de calidad alimentaria para su uso en la carbonatación de cerveza y refrescos , y también se utiliza para aturdir animales como las aves de corral . En el verano de 2018 surgió una escasez de dióxido de carbono para estos fines en Europa debido al cierre temporal de varias plantas de amoníaco para su mantenimiento. [107]
Descomposición térmica de la piedra caliza
Se produce por descomposición térmica de la piedra caliza, CaCO3 , mediante calentamiento ( calcinación ) a unos 850 °C (1.560 °F), en la fabricación de cal viva ( óxido de calcio , CaO), un compuesto que tiene muchos usos industriales:
- CaCO3 → CaO + CO2
Los ácidos liberan CO2 de la mayoría de los carbonatos metálicos, por lo que se puede obtener directamente de manantiales naturales de dióxido de carbono , donde se produce por la acción del agua acidificada sobre la piedra caliza o la dolomita . La reacción entre el ácido clorhídrico y el carbonato de calcio (piedra caliza o tiza) se muestra a continuación:
- CaCO3 + 2HCl → CaCl2 + H2CO3
El ácido carbónico ( H2CO3 ) luego se descompone en agua y CO2 :
- H2CO3 → CO2 + H2O
Estas reacciones van acompañadas de formación de espuma o burbujeo, o de ambos, a medida que se libera el gas. Tienen usos muy extendidos en la industria porque pueden utilizarse para neutralizar corrientes de ácidos residuales.
Usos comerciales
El dióxido de carbono se utiliza en la industria alimentaria, la industria petrolera y la industria química. [103] El compuesto tiene diversos usos comerciales, pero uno de sus mayores usos como químico es en la producción de bebidas carbonatadas; proporciona el brillo a las bebidas carbonatadas como el agua con gas, la cerveza y el vino espumoso.
Precursor de productos químicos
![[icon]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/20px-Wiki_letter_w_cropped.svg.png) | This section needs expansion. You can help by adding to it. (July 2014) |
En la industria química, el dióxido de carbono se consume principalmente como ingrediente en la producción de urea , y una fracción más pequeña se utiliza para producir metanol y una variedad de otros productos. [108] Algunos derivados del ácido carboxílico, como el salicilato de sodio, se preparan utilizando CO2 mediante la reacción de Kolbe-Schmitt . [109]
Además de los procesos convencionales que utilizan CO2 para la producción química, también se están explorando métodos electroquímicos a nivel de investigación. En particular, el uso de energía renovable para la producción de combustibles a partir de CO2 ( como el metanol) es atractivo, ya que podría dar lugar a combustibles que podrían transportarse y usarse fácilmente dentro de las tecnologías de combustión convencionales, pero que no tienen emisiones netas de CO2 . [ 110]
Agricultura
Las plantas necesitan dióxido de carbono para realizar la fotosíntesis. Las atmósferas de los invernaderos pueden (si son de gran tamaño, deben) enriquecerse con CO2 adicional para sostener y aumentar la tasa de crecimiento de las plantas. [111] [112] En concentraciones muy altas (100 veces la concentración atmosférica o más), el dióxido de carbono puede ser tóxico para la vida animal, por lo que aumentar la concentración a 10 000 ppm (1 %) o más durante varias horas eliminará plagas como moscas blancas y ácaros en un invernadero. [113] Algunas plantas responden más favorablemente al aumento de las concentraciones de dióxido de carbono que otras, lo que puede provocar cambios en el régimen de vegetación como la invasión de plantas leñosas . [114]
Alimentos

El dióxido de carbono es un aditivo alimentario que se utiliza como propulsor y regulador de la acidez en la industria alimentaria. Su uso está aprobado en la UE [115] (con el número E E290), EE. UU. [116], Australia y Nueva Zelanda [117] (con el número INS 290).
Un caramelo llamado Pop Rocks se presuriza con gas de dióxido de carbono [118] a unos 4000 kPa (40 bar ; 580 psi ). Cuando se coloca en la boca, se disuelve (al igual que otros caramelos duros) y libera las burbujas de gas con un chasquido audible.
Los agentes leudantes hacen que la masa suba al producir dióxido de carbono. [119] La levadura de panadería produce dióxido de carbono mediante la fermentación de los azúcares dentro de la masa, mientras que los leudantes químicos como el polvo de hornear y el bicarbonato de sodio liberan dióxido de carbono cuando se calientan o si se exponen a ácidos .
Bebidas
El dióxido de carbono se utiliza para producir refrescos carbonatados y agua con gas . Tradicionalmente, la carbonatación de la cerveza y el vino espumoso se producía mediante fermentación natural, pero muchos fabricantes carbonatan estas bebidas con dióxido de carbono recuperado del proceso de fermentación. En el caso de la cerveza embotellada y en barril, el método más común utilizado es la carbonatación con dióxido de carbono reciclado. Con la excepción de la cerveza real ale británica , la cerveza de barril suele transferirse desde los barriles en una cámara frigorífica o bodega a los grifos de dispensación en la barra utilizando dióxido de carbono presurizado, a veces mezclado con nitrógeno.
El sabor del agua con gas (y las sensaciones gustativas relacionadas con otras bebidas carbonatadas) es un efecto del dióxido de carbono disuelto, más que de las burbujas del gas que estallan. La anhidrasa carbónica 4 convierte el dióxido de carbono en ácido carbónico, lo que produce un sabor agrio , y el dióxido de carbono disuelto también induce una respuesta somatosensorial . [120]
Elaboración de vino

El dióxido de carbono en forma de hielo seco se utiliza a menudo durante la fase de maceración en frío en la elaboración del vino para enfriar los racimos de uvas rápidamente después de la recolección y ayudar a prevenir la fermentación espontánea por levaduras silvestres . La principal ventaja de utilizar hielo seco en lugar de hielo de agua es que enfría las uvas sin añadir agua adicional que pueda reducir la concentración de azúcar en el mosto de uva y, por tanto, la concentración de alcohol en el vino terminado. El dióxido de carbono también se utiliza para crear un entorno hipóxico para la maceración carbónica , el proceso utilizado para producir vino Beaujolais .
El dióxido de carbono se utiliza a veces para rellenar las botellas de vino u otros recipientes de almacenamiento , como los barriles, para evitar la oxidación, aunque tiene el problema de que puede disolverse en el vino, lo que hace que un vino que antes estaba quieto tenga un ligero sabor burbujeante. Por este motivo, los enólogos profesionales prefieren otros gases, como el nitrógeno o el argón , para este proceso.
Animales impresionantes
El dióxido de carbono se utiliza a menudo para "aturdir" a los animales antes del sacrificio. [121] "Aturdir" puede ser un nombre inapropiado, ya que los animales no quedan inconscientes inmediatamente y pueden sufrir angustia. [122] [123]
Gas inerte
El dióxido de carbono es uno de los gases comprimidos más utilizados para sistemas neumáticos (gas presurizado) en herramientas de presión portátiles. El dióxido de carbono también se utiliza como atmósfera para soldar , aunque en el arco de soldadura reacciona para oxidar la mayoría de los metales. Su uso en la industria automotriz es común a pesar de la evidencia significativa de que las soldaduras hechas en dióxido de carbono son más frágiles que las hechas en atmósferas más inertes. [124] Cuando se usa para soldadura MIG , el uso de CO2 a veces se conoce como soldadura MAG, para Metal Active Gas, ya que el CO2 puede reaccionar a estas altas temperaturas. Tiende a producir un charco más caliente que las atmósferas verdaderamente inertes, mejorando las características de flujo. Aunque esto puede deberse a reacciones atmosféricas que ocurren en el sitio del charco. Esto suele ser lo opuesto al efecto deseado al soldar, ya que tiende a fragilizar el sitio, pero puede no ser un problema para la soldadura de acero dulce en general, donde la ductilidad final no es una preocupación importante.
El dióxido de carbono se utiliza en muchos productos de consumo que requieren gas presurizado porque es barato y no inflamable, y porque sufre una transición de fase de gas a líquido a temperatura ambiente a una presión alcanzable de aproximadamente 60 bar (870 psi ; 59 atm ), lo que permite que quepa mucho más dióxido de carbono en un recipiente determinado de lo que cabría de otra manera. Los chalecos salvavidas a menudo contienen botes de dióxido de carbono presurizado para un inflado rápido. Las cápsulas de aluminio de CO 2 también se venden como suministros de gas comprimido para pistolas de aire , marcadores/pistolas de paintball , inflado de neumáticos de bicicleta y para hacer agua carbonatada . También se pueden utilizar altas concentraciones de dióxido de carbono para matar plagas. El dióxido de carbono líquido se utiliza en el secado supercrítico de algunos productos alimenticios y materiales tecnológicos, en la preparación de muestras para microscopía electrónica de barrido [125] y en la descafeinización de granos de café .
Extintor de incendios

El dióxido de carbono se puede utilizar para extinguir las llamas inundando el entorno alrededor de la llama con el gas. No reacciona por sí mismo para extinguir la llama, sino que la priva de oxígeno al desplazarlo. Algunos extintores , especialmente los diseñados para incendios eléctricos , contienen dióxido de carbono líquido bajo presión. Los extintores de dióxido de carbono funcionan bien en pequeños incendios de líquidos inflamables y eléctricos, pero no en incendios de combustibles ordinarios, porque no enfrían significativamente las sustancias en llamas y cuando el dióxido de carbono se dispersa, pueden incendiarse al exponerse al oxígeno atmosférico . Se utilizan principalmente en salas de servidores. [126]
El dióxido de carbono también se ha utilizado ampliamente como agente extintor en sistemas fijos de protección contra incendios para la aplicación local de peligros específicos y la inundación total de un espacio protegido. [127] Las normas de la Organización Marítima Internacional reconocen los sistemas de dióxido de carbono para la protección contra incendios de bodegas y salas de máquinas de los barcos. Los sistemas de protección contra incendios basados en dióxido de carbono se han relacionado con varias muertes, porque puede causar asfixia en concentraciones suficientemente altas. Una revisión de los sistemas de CO2 identificó 51 incidentes entre 1975 y la fecha del informe (2000), que causaron 72 muertes y 145 lesiones. [128]
CO supercrítico2como disolvente
El dióxido de carbono líquido es un buen disolvente para muchos compuestos orgánicos lipofílicos y se utiliza para descafeinar el café . [18] El dióxido de carbono ha atraído la atención en las industrias farmacéutica y de otros procesos químicos como una alternativa menos tóxica a los disolventes más tradicionales, como los organoclorados . También lo utilizan algunas tintorerías por este motivo. Se utiliza en la preparación de algunos aerogeles debido a las propiedades del dióxido de carbono supercrítico.
Usos médicos y farmacológicos
En medicina, se añade hasta un 5% de dióxido de carbono (130 veces la concentración atmosférica) al oxígeno para estimular la respiración después de la apnea y para estabilizar el equilibrio O 2 /CO 2 en la sangre.
El dióxido de carbono se puede mezclar con hasta un 50% de oxígeno, formando un gas inhalable; esto se conoce como carbógeno y tiene una variedad de usos médicos y de investigación.
Otro uso medicinal son las mofettes , balnearios secos que utilizan el dióxido de carbono procedente de descargas post-volcánicas con fines terapéuticos.
Energía
El CO2 supercrítico se utiliza como fluido de trabajo en el motor de ciclo de potencia de Allam .
Recuperación de combustibles fósiles
El dióxido de carbono se utiliza en la recuperación mejorada de petróleo , donde se inyecta en pozos de petróleo en producción o adyacentes a ellos, generalmente en condiciones supercríticas , cuando se vuelve miscible con el petróleo. Este enfoque puede aumentar la recuperación original de petróleo al reducir la saturación de petróleo residual en un 7-23% adicional a la extracción primaria . [129] Actúa como agente presurizador y, cuando se disuelve en el petróleo crudo subterráneo , reduce significativamente su viscosidad y cambia la química de la superficie permitiendo que el petróleo fluya más rápidamente a través del yacimiento hasta el pozo de extracción. [130] En los campos petrolíferos maduros, se utilizan extensas redes de tuberías para llevar el dióxido de carbono a los puntos de inyección.
En la recuperación mejorada de metano de lechos de carbón , se bombearía dióxido de carbono a la veta de carbón para desplazar el metano, a diferencia de los métodos actuales que se basan principalmente en la eliminación de agua (para reducir la presión) para hacer que la veta de carbón libere el metano atrapado. [131]
Biotransformación en combustible
Se ha propuesto que el CO2 generado por la generación de energía se inyecte en estanques para estimular el crecimiento de algas que luego podrían convertirse en combustible biodiésel . [132] Una cepa de la cianobacteria Synechococcus elongatus ha sido modificada genéticamente para producir los combustibles isobutiraldehído e isobutanol a partir de CO2 mediante la fotosíntesis. [133]
Los investigadores han desarrollado una técnica electrocatalítica que utiliza enzimas aisladas de bacterias para impulsar las reacciones químicas que convierten el CO2 en combustibles. [134] [135] [136]
Refrigerante

El dióxido de carbono líquido y sólido son refrigerantes importantes , especialmente en la industria alimentaria, donde se emplean durante el transporte y almacenamiento de helados y otros alimentos congelados. El dióxido de carbono sólido se denomina "hielo seco" y se utiliza para envíos pequeños en los que no es posible utilizar equipos de refrigeración. El dióxido de carbono sólido siempre está por debajo de los -78,5 °C (-109,3 °F) a presión atmosférica normal, independientemente de la temperatura del aire.
El dióxido de carbono líquido (nomenclatura industrial R744 o R-744) se utilizó como refrigerante antes del uso de diclorodifluorometano (R12, un compuesto de clorofluorocarbono (CFC)). [137] El CO 2 podría disfrutar de un renacimiento porque uno de los principales sustitutos de los CFC, el 1,1,1,2-tetrafluoroetano ( R134a , un compuesto de hidrofluorocarbono (HFC)) contribuye al cambio climático más que el CO 2. Las propiedades físicas del CO 2 son muy favorables para fines de refrigeración, enfriamiento y calefacción, ya que tiene una alta capacidad de enfriamiento volumétrico. Debido a la necesidad de operar a presiones de hasta 130 bares (1900 psi; 13 000 kPa), los sistemas de CO 2 requieren depósitos y componentes altamente resistentes mecánicamente que ya se han desarrollado para la producción en masa en muchos sectores. En el aire acondicionado de los automóviles, en más del 90% de las condiciones de conducción para latitudes superiores a 50°, el CO2 ( R744) funciona de manera más eficiente que los sistemas que utilizan HFC (por ejemplo, R134a). Sus ventajas medioambientales ( GWP de 1, no daña la capa de ozono, no es tóxico, no es inflamable) podrían convertirlo en el futuro fluido de trabajo que sustituya a los HFC actuales en automóviles, supermercados y calentadores de agua con bomba de calor, entre otros. Coca-Cola ha presentado enfriadores de bebidas a base de CO2 y el ejército de los EE. UU. está interesado en la tecnología de refrigeración y calefacción con CO2. [ 138] [139]
Usos menores

El dióxido de carbono es el medio láser en un láser de dióxido de carbono , que es uno de los primeros tipos de láser.
El dióxido de carbono se puede utilizar como un medio para controlar el pH de las piscinas, [140] añadiendo continuamente gas al agua, evitando así que el pH suba. Entre las ventajas de esto está la de evitar la manipulación de ácidos (más peligrosos). De manera similar, también se utiliza en el mantenimiento de acuarios de arrecife , donde se utiliza comúnmente en reactores de calcio para reducir temporalmente el pH del agua que se pasa sobre carbonato de calcio con el fin de permitir que este se disuelva en el agua más libremente, donde algunos corales lo utilizan para construir su esqueleto.
Se utiliza como refrigerante principal en el reactor británico avanzado refrigerado por gas para la generación de energía nuclear.
La inducción de dióxido de carbono se utiliza comúnmente para la eutanasia de animales de investigación de laboratorio. Los métodos para administrar CO 2 incluyen colocar a los animales directamente en una cámara cerrada y precargada que contiene CO 2 o exponerlos a una concentración de CO 2 que aumenta gradualmente. Las pautas de 2020 de la Asociación Médica Veterinaria Estadounidense para la inducción de dióxido de carbono establecen que una tasa de desplazamiento del 30 al 70 % del volumen de la cámara o jaula por minuto es óptima para la eutanasia humanitaria de pequeños roedores. [141] : 5, 31 Los porcentajes de CO 2 varían para diferentes especies, según los porcentajes óptimos identificados para minimizar la angustia. [141] : 22
El dióxido de carbono también se utiliza en varias técnicas relacionadas con la limpieza y preparación de superficies .
Historia del descubrimiento

El dióxido de carbono fue el primer gas que se describió como una sustancia discreta. Hacia 1640, [142] el químico flamenco Jan Baptist van Helmont observó que cuando quemaba carbón en un recipiente cerrado, la masa de la ceniza resultante era mucho menor que la del carbón original. Su interpretación fue que el resto del carbón se había transmutado en una sustancia invisible a la que denominó "gas" (del griego "caos") o "espíritu salvaje" ( spiritus sylvestris ). [143]
Las propiedades del dióxido de carbono fueron estudiadas más a fondo en la década de 1750 por el médico escocés Joseph Black . Descubrió que la piedra caliza ( carbonato de calcio ) podía calentarse o tratarse con ácidos para producir un gas al que llamó "aire fijo". Observó que el aire fijo era más denso que el aire y no soportaba ni llamas ni vida animal. Black también descubrió que cuando se burbujeaba a través de agua de cal (una solución acuosa saturada de hidróxido de calcio ), precipitaba carbonato de calcio . Utilizó este fenómeno para ilustrar que el dióxido de carbono se produce por la respiración animal y la fermentación microbiana. En 1772, el químico inglés Joseph Priestley publicó un artículo titulado Impregnating Water with Fixed Air en el que describía un proceso de goteo de ácido sulfúrico (o aceite de vitriolo como lo conocía Priestley) sobre tiza para producir dióxido de carbono y forzar al gas a disolverse agitando un recipiente con agua en contacto con el gas. [144]
El dióxido de carbono fue licuado por primera vez (a presiones elevadas) en 1823 por Humphry Davy y Michael Faraday . [145] La primera descripción del dióxido de carbono sólido ( hielo seco ) fue dada por el inventor francés Adrien-Jean-Pierre Thilorier , quien en 1835 abrió un recipiente presurizado de dióxido de carbono líquido, solo para descubrir que el enfriamiento producido por la rápida evaporación del líquido produjo una "nieve" de CO 2 sólido . [146] [147]
El dióxido de carbono en combinación con nitrógeno se conocía desde tiempos antiguos como humedad negra , humedad de estorbo o humedad de estrangulamiento. [b] Junto con otros tipos de humedad, se encontraba en operaciones mineras y en la perforación de pozos. La oxidación lenta del carbón y los procesos biológicos reemplazaron al oxígeno para crear una mezcla sofocante de nitrógeno y dióxido de carbono. [148]
Véase también
- Prueba de gases en sangre arterial : una prueba de sangre extraída de una arteria que mide las cantidades de ciertos gases disueltos.
- Reacción de Bosch : forma carbono elemental a partir de CO2 e hidrógeno utilizando un catalizador metálicoPages displaying wikidata descriptions as a fallback
- Eliminación de dióxido de carbono : eliminación del dióxido de carbono atmosférico a través de la actividad humana (de la atmósfera)
- Gilbert Plass – Físico canadiense (1920–2004) (primeros trabajos sobre el CO2 y el cambio climático)
- Satélite de observación de gases de efecto invernadero – Satélite de observación de la Tierra
- Lista de países por emisiones de dióxido de carbono
- Lista de centrales eléctricas menos eficientes en carbono
- Lago meromíctico : Lago permanentemente estratificado con capas de agua que no se mezclan.
- Observatorio Orbital de Carbono 2 de la NASA : satélite climático de la NASA
- Gas del suelo : gases en el espacio de aire entre los componentes del suelo.
Notas
- ^ donde "parte" aquí significa por molécula [10]
- ^ A veces se escribe "choak-damp" en textos del siglo XIX.
Referencias
- ^ abc «Dióxido de carbono» (PDF) . Air Products . Archivado desde el original (PDF) el 29 de julio de 2020 . Consultado el 28 de abril de 2017 .
- ^ abcdefghi Span R, Wagner W (1 de noviembre de 1996). "Una nueva ecuación de estado para el dióxido de carbono que cubre la región del fluido desde la temperatura del punto triple hasta 1100 K a presiones de hasta 800 MPa". Journal of Physical and Chemical Reference Data . 25 (6): 1519. Bibcode :1996JPCRD..25.1509S. doi :10.1063/1.555991.
- ^ Touloukian YS, Liley PE, Saxena SC (1970). "Propiedades termofísicas de la materia: la serie de datos TPRC". Conductividad térmica: líquidos y gases no metálicos . 3. Libro de datos.
- ^ Schäfer M, Richter M, Span R (2015). "Medidas de la viscosidad del dióxido de carbono a temperaturas de (253,15 a 473,15) K con presiones de hasta 1,2 MPa". The Journal of Chemical Thermodynamics . 89 : 7–15. Bibcode :2015JChTh..89....7S. doi :10.1016/j.jct.2015.04.015. ISSN 0021-9614.
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0103". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Dióxido de carbono". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Ficha de datos de seguridad – Gas de dióxido de carbono – versión 0.03 11/11" (PDF) . AirGas.com . 12 de febrero de 2018. Archivado (PDF) del original el 4 de agosto de 2018 . Consultado el 4 de agosto de 2018 .
- ^ "Dióxido de carbono, líquido refrigerado" (PDF) . Praxair . pág. 9. Archivado desde el original (PDF) el 29 de julio de 2018 . Consultado el 26 de julio de 2018 .
- ^ Acidificación de los océanos: una estrategia nacional para afrontar los desafíos de un océano cambiante. Washington, DC: National Academies Press. 22 de abril de 2010. pp. 23-24. doi :10.17226/12904. ISBN 978-0-309-15359-1Archivado desde el original el 5 de febrero de 2016 . Consultado el 29 de febrero de 2016 .
- ^ "Definición de concentración de gas CO2". Medidor de CO2 . 18 de noviembre de 2022 . Consultado el 5 de septiembre de 2023 .
- ^ Eggleton T (2013). Una breve introducción al cambio climático. Cambridge University Press. pág. 52. ISBN 9781107618763. Recuperado el 9 de noviembre de 2020 .
- ^ "El dióxido de carbono es ahora más de un 50% más alto que los niveles preindustriales | Administración Nacional Oceánica y Atmosférica". www.noaa.gov . 3 de junio de 2022 . Consultado el 14 de junio de 2022 .
- ^ IPCC (2022) Resumen para los responsables de políticas en Cambio climático 2022: Mitigación del cambio climático. Contribución del Grupo de trabajo III al Sexto informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático, Cambridge University Press, Cambridge, Reino Unido y Nueva York, NY, EE. UU.
- ^ Kaufman DG, Franz CM (1996). Biosfera 2000: protegiendo nuestro medio ambiente global. Kendall/Hunt Pub. Co. ISBN 978-0-7872-0460-0.
- ^ "Fábricas de alimentos". www.legacyproject.org . Archivado desde el original el 12 de agosto de 2017. Consultado el 10 de octubre de 2011 .
- ^ IPCC (2021). «Resumen para responsables de políticas» (PDF) . Cambio climático 2021: la base científica física . pág. 20. Archivado (PDF) del original el 10 de octubre de 2022.
- ^ Myles, Allen (septiembre de 2020). "Los principios de Oxford para la compensación de carbono alineada con el objetivo de cero emisiones netas" (PDF) . Archivado (PDF) del original el 2 de octubre de 2020. Consultado el 10 de diciembre de 2021 .
- ^ ab Tsotsas E, Mujumdar AS (2011). Tecnología de secado moderna. Vol. 3: Calidad y formulación del producto. John Wiley & Sons. ISBN 978-3-527-31558-1Archivado del original el 21 de marzo de 2020 . Consultado el 3 de diciembre de 2019 .
- ^ ab Greenwood NN , Earnshaw A (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . págs. 305–314. ISBN 978-0-08-037941-8.
- ^ Atkins P, de Paula J (2006). Química física (8.ª ed.). WH Freeman. pp. 461, 464. ISBN 978-0-7167-8759-4.
- ^ Siegmann B, Werner U, Lutz HO, Mann R (2002). "Fragmentación completa de Coulomb de CO 2 en colisiones con 5,9 MeV u −1 Xe 18+ y Xe 43+ ". J Phys B Atom Mol Opt Phys . 35 (17): 3755. Bibcode :2002JPhB...35.3755S. doi :10.1088/0953-4075/35/17/311. S2CID 250782825.
- ^ ab Jensen P, Spanner M, Bunker PR (2020). "La molécula de CO 2 nunca es lineal−". J Mol Struct . 1212 : 128087. Bibcode :2020JMoSt121228087J. doi :10.1016/j.molstruc.2020.128087. hdl : 2142/107329 .
- ^ Jolly WL (1984). Química inorgánica moderna . McGraw-Hill. pág. 196. ISBN. 978-0-07-032760-3.
- ^ Li Z, Mayer RJ, Ofial AR, Mayr H (mayo de 2020). "De carbodiimidas a dióxido de carbono: cuantificación de las reactividades electrofílicas de heteroalenos". Revista de la Sociedad Química Estadounidense . 142 (18): 8383–8402. doi :10.1021/jacs.0c01960. PMID 32338511. S2CID 216557447.
- ^ Aresta M, ed. (2010). El dióxido de carbono como materia prima química . Weinheim: Wiley-VCH. ISBN 978-3-527-32475-0.
- ^ Finn C, Schnittger S, Yellowlees LJ, Love JB (febrero de 2012). "Molecular approach to the electrochemical reduction of carbon dióxido" (PDF) . Chemical Communications . 48 (10): 1392–1399. doi :10.1039/c1cc15393e. hdl : 20.500.11820/b530915d-451c-493c-8251-da2ea2f50912 . PMID 22116300. S2CID 14356014. Archivado (PDF) del original el 19 de abril de 2021 . Consultado el 6 de diciembre de 2019 .
- ^ "Gases – Densidades". Caja de herramientas de ingeniería. Archivado desde el original el 2 de marzo de 2006. Consultado el 21 de noviembre de 2020 .
- ^ Santoro M, Gorelli FA, Bini R, Ruocco G, Scandolo S, Crichton WA (junio de 2006). "Dióxido de carbono similar a la sílice amorfa". Naturaleza . 441 (7095): 857–860. Código Bib :2006Natur.441..857S. doi : 10.1038/naturaleza04879. PMID 16778885. S2CID 4363092.
- ^ ab Holman, Jack P. (2002). Transferencia de calor (novena edición). Nueva York, NY: McGraw-Hill Companies, Inc., págs. 600–606. ISBN 9780072406559.
- ^ ab Incropera, Frank P.; Dewitt, David P.; Bergman, Theodore L.; Lavigne, Adrienne S. (2007). Fundamentos de transferencia de calor y masa (6.ª ed.). Hoboken, Nueva Jersey: John Wiley and Sons, Inc., págs. 941–950. ISBN 9780471457282.
- ^ Dhingra A, Portis AR, Daniell H (abril de 2004). "La traducción mejorada de un gen RbcS expresado en cloroplastos restaura los niveles de subunidades pequeñas y la fotosíntesis en plantas antisentido RbcS nucleares". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 101 (16): 6315–6320. Bibcode :2004PNAS..101.6315D. doi : 10.1073/pnas.0400981101 . PMC 395966 . PMID 15067115.
(Rubisco) es la enzima más prevalente en este planeta, representando el 30-50% de la proteína soluble total en el cloroplasto
- ^ Falkowski P, Knoll AH (1 de enero de 2007). Evolución de los productores primarios en el mar . Elsevier, Academic Press. ISBN 978-0-12-370518-1.OCLC 845654016 .
- ^ Blom TJ, Straver WA, Ingratta FJ, Khosla S, Brown W (diciembre de 2002). «Dióxido de carbono en invernaderos». Archivado desde el original el 29 de abril de 2019. Consultado el 12 de junio de 2007 .
- ^ Ainsworth EA (2008). "Producción de arroz en un clima cambiante: un metaanálisis de las respuestas a concentraciones elevadas de dióxido de carbono y ozono" (PDF) . Biología del cambio global . 14 (7): 1642–1650. Código bibliográfico :2008GCBio..14.1642A. doi :10.1111/j.1365-2486.2008.01594.x. S2CID 19200429. Archivado desde el original (PDF) el 19 de julio de 2011.
- ^ Long SP, Ainsworth EA, Leakey AD, Nösberger J, Ort DR (junio de 2006). "Alimentos para el pensamiento: estimulación del rendimiento de los cultivos inferior al esperado con concentraciones crecientes de CO2" (PDF) . Science . 312 (5782): 1918–1921. Bibcode :2006Sci...312.1918L. CiteSeerX 10.1.1.542.5784 . doi :10.1126/science.1114722. PMID 16809532. S2CID 2232629. Archivado (PDF) desde el original el 20 de octubre de 2016 . Consultado el 27 de octubre de 2017 .
- ^ Woodward F, Kelly C (1995). "La influencia de la concentración de CO2 en la densidad estomática". New Phytologist . 131 (3): 311–327. doi : 10.1111/j.1469-8137.1995.tb03067.x .
- ^ Drake BG, Gonzalez-Meler MA, Long SP (junio de 1997). "Plantas más eficientes: ¿una consecuencia del aumento del CO2 atmosférico ? ". Revisión anual de fisiología vegetal y biología molecular vegetal . 48 (1): 609–639. doi :10.1146/annurev.arplant.48.1.609. PMID 15012276. S2CID 33415877.
- ^ Loladze I (2002). "El aumento del CO2 atmosférico y la nutrición humana: ¿hacia una estequiometría vegetal globalmente desequilibrada?". Tendencias en ecología y evolución . 17 (10): 457–461. doi :10.1016/S0169-5347(02)02587-9. S2CID 16074723.
- ^ Coviella CE, Trumble JT (1999). "Efectos del dióxido de carbono atmosférico elevado en las interacciones entre insectos y plantas". Biología de la conservación . 13 (4): 700–712. Bibcode :1999ConBi..13..700C. doi :10.1046/j.1523-1739.1999.98267.x. JSTOR 2641685. S2CID 52262618.
- ^ Davey MP, Harmens H, Ashenden TW, Edwards R, Baxter R (2007). "Efectos específicos de las especies de los niveles elevados de CO 2 en la asignación de recursos en Plantago maritima y Armeria maritima ". Biochemical Systematics and Ecology . 35 (3): 121–129. doi :10.1016/j.bse.2006.09.004.
- ^ Davey MP, Bryant DN, Cummins I, Ashenden TW, Gates P, Baxter R, Edwards R (agosto de 2004). "Efectos del CO 2 elevado en la vasculatura y el metabolismo secundario fenólico de Plantago maritima". Fitoquímica . 65 (15): 2197–2204. Bibcode :2004PChem..65.2197D. doi :10.1016/j.phytochem.2004.06.016. PMID 15587703.
- ^ "Manual de evaluación de gases de efecto invernadero de la División de Medio Ambiente Mundial: documento práctico de orientación para la evaluación de emisiones de gases de efecto invernadero a nivel de proyecto". Banco Mundial . Archivado desde el original el 3 de junio de 2016. Consultado el 10 de noviembre de 2007 .
- ^ Luyssaert S, Schulze ED, Börner A, Knohl A, Hessenmöller D, Law BE, et al. (Septiembre de 2008). "Los bosques primarios como sumideros de carbono globales" (PDF) . Naturaleza . 455 (7210): 213–215. Código Bib :2008Natur.455..213L. doi : 10.1038/naturaleza07276. PMID 18784722. S2CID 4424430.
- ^ Falkowski P, Scholes RJ, Boyle E, Canadell J, Canfield D, Elser J, et al. (octubre de 2000). "El ciclo global del carbono: una prueba de nuestro conocimiento de la Tierra como sistema". Science . 290 (5490): 291–296. Bibcode :2000Sci...290..291F. doi :10.1126/science.290.5490.291. PMID 11030643. S2CID 1779934.
- ^ ab Friedman D. "Toxicidad de la exposición al gas de dióxido de carbono, síntomas de intoxicación por CO2, límites de exposición al dióxido de carbono y vínculos con los procedimientos de prueba de gases tóxicos". InspectAPedia . Archivado desde el original el 28 de septiembre de 2009.
- ^ "CarbonTracker CT2011_oi (Mapa gráfico de CO2)". esrl.noaa.gov . Archivado desde el original el 13 de febrero de 2021 . Consultado el 20 de abril de 2007 .
- ^ ab Permentier, Kris; Vercammen, Steven; Soetaert, Sylvia; Schellemans, Christian (4 de abril de 2017). "Intoxicación por dióxido de carbono: una revisión de la literatura sobre una causa de intoxicación a menudo olvidada en el departamento de emergencias". Revista internacional de medicina de emergencia . 10 (1): 14. doi : 10.1186/s12245-017-0142-y . ISSN 1865-1372. PMC 5380556 . PMID 28378268.
 El texto fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional
El texto fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional - ^ ab "El dióxido de carbono como agente extintor de incendios: análisis de los riesgos". Agencia de Protección Ambiental de Estados Unidos. Archivado desde el original el 2 de octubre de 2015.
- ^ "Volcán bajo la ciudad". Una producción de NOVA por Bonne Pioche y Greenspace para WGBH/Boston . Public Broadcasting System. 1 de noviembre de 2005. Archivado desde el original el 5 de abril de 2011..
- ^ Glatte Jr HA, Motsay GJ, Welch BE (1967). Estudios de tolerancia al dióxido de carbono (informe). Informe técnico de la Facultad de Medicina Aeroespacial de la Base de la Fuerza Aérea Brooks, Texas. SAM-TR-67-77. Archivado desde el original el 9 de mayo de 2008. Consultado el 2 de mayo de 2008 .
{{cite report}}: CS1 maint: unfit URL (link) - ^ Lambertsen CJ (1971). Carbon Dioxide Tolerance and Toxicity (Informe). Informe IFEM. Environmental Biomedical Stress Data Center, Instituto de Medicina Ambiental, Centro Médico de la Universidad de Pensilvania. N.º 2-71. Archivado desde el original el 24 de julio de 2011. Consultado el 2 de mayo de 2008 .
{{cite report}}: CS1 maint: unfit URL (link) - ^ ab Satish U, Mendell MJ, Shekhar K, Hotchi T, Sullivan D, Streufert S, Fisk WJ (diciembre de 2012). "¿Es el CO2 un contaminante en interiores? Efectos directos de concentraciones bajas a moderadas de CO2 en el desempeño de la toma de decisiones humanas" (PDF) . Environmental Health Perspectives . 120 (12): 1671–1677. doi :10.1289/ehp.1104789. PMC 3548274. PMID 23008272. Archivado desde el original (PDF) el 5 de marzo de 2016. Consultado el 11 de diciembre de 2014 .
- ^ ab Allen JG , MacNaughton P, Satish U, Santanam S, Vallarino J, Spengler JD (junio de 2016). "Asociaciones de las puntuaciones de la función cognitiva con la exposición al dióxido de carbono, la ventilación y los compuestos orgánicos volátiles en trabajadores de oficina: un estudio de exposición controlada en entornos de oficina ecológicos y convencionales". Environmental Health Perspectives . 124 (6): 805–812. doi :10.1289/ehp.1510037. PMC 4892924 . PMID 26502459.
- ^ abc «Límites de exposición al gas de dióxido de carbono: límites de CO2». InspectAPedia.com. Archivado desde el original el 16 de septiembre de 2018. Consultado el 19 de octubre de 2014 .
- ^ Law J, Watkins S, Alexander D (2010). In-Flight Carbon Dioxide Exposures and Related Syndrome: Associations, Susceptibility and Operational Implications (PDF) (Informe). Informe técnico de la NASA. TP–2010–216126. Archivado desde el original (PDF) el 27 de junio de 2011. Consultado el 26 de agosto de 2014 .
- ^ Schaefer KE, Douglas WH, Messier AA, Shea ML, Gohman PA (1979). "Efecto de la exposición prolongada a 0,5% de CO2 en la calcificación renal y la ultraestructura de los pulmones". Undersea Biomedical Research . 6 (Supl): S155–S161. PMID 505623. Archivado desde el original el 19 de octubre de 2014. Consultado el 19 de octubre de 2014 .
- ^ Du B, Tandoc MC, Mack ML, Siegel JA (noviembre de 2020). «Concentraciones de CO2 en interiores y función cognitiva: una revisión crítica». Indoor Air . 30 (6): 1067–1082. Bibcode :2020InAir..30.1067D. doi : 10.1111/ina.12706 . PMID 32557862. S2CID 219915861.
- ^ Kaplan L (4 de junio de 2019). "Pregúntale al médico: ¿mi casco me vuelve estúpido? - RevZilla". www.revzilla.com . Archivado desde el original el 22 de mayo de 2021 . Consultado el 22 de mayo de 2021 .
- ^ Brühwiler PA, Stämpfli R, Huber R, Camenzind M (septiembre de 2005). "Concentraciones de CO2 y O2 en cascos integrales de motocicleta". Ergonomía aplicada . 36 (5): 625–633. doi :10.1016/j.apergo.2005.01.018. PMID 15893291.
- ^ "Ventilación para una calidad aceptable del aire interior" (PDF) . 2018. ISSN 1041-2336. Archivado (PDF) del original el 26 de octubre de 2022. Consultado el 10 de agosto de 2023 .
- ^ "Guía estándar para el uso de concentraciones de dióxido de carbono en interiores para evaluar la calidad del aire y la ventilación en interiores". www.astm.org . Consultado el 12 de junio de 2024 .
- ^ Allen JG, MacNaughton P, Satish U, Santanam S, Vallarino J, Spengler JD (junio de 2016). "Asociaciones de las puntuaciones de la función cognitiva con la exposición al dióxido de carbono, la ventilación y los compuestos orgánicos volátiles en trabajadores de oficina: un estudio de exposición controlada en entornos de oficina ecológicos y convencionales". Environmental Health Perspectives . 124 (6): 805–812. doi :10.1289/ehp.1510037. PMC 4892924 . PMID 26502459.
- ^ Romm J (26 de octubre de 2015). «Exclusivo: los niveles elevados de CO2 afectan directamente la cognición humana, según demuestra un nuevo estudio de Harvard». ThinkProgress . Archivado desde el original el 9 de octubre de 2019 . Consultado el 14 de octubre de 2019 .
- ^ "Tres muertos en un incidente con hielo seco en una fiesta en la piscina de Moscú". BBC News . 29 de febrero de 2020. Archivado desde el original el 29 de febrero de 2020.
Las víctimas estaban relacionadas con la influencer de Instagram Yekaterina Didenko.
- ^ Rettner R (2 de agosto de 2018). "Una mujer murió por los vapores del hielo seco. Así es como puede suceder". Live Science . Archivado desde el original el 22 de mayo de 2021. Consultado el 22 de mayo de 2021 .
- ^ Concentrations de CO2 dans l'air intérieur et effets sur la santé (PDF) (Reporte) (en francés). ANSES. Julio de 2013. pág. 294.
- ^ Chatzidiakou, Lia; Mumovic, Dejan; Summerfield, Alex (marzo de 2015). "¿Es el CO2 un buen indicador de la calidad del aire interior en las aulas? Parte 1: Las interrelaciones entre las condiciones térmicas, los niveles de CO2, las tasas de ventilación y determinados contaminantes interiores". Investigación y tecnología en ingeniería de servicios de construcción . 36 (2): 129–161. doi :10.1177/0143624414566244. ISSN 0143-6244. S2CID 111182451.
- ^ Cetin, Mehmet; Sevik, Hakan (2016). "ANÁLISIS DE CALIDAD INTERIOR DEL CO2 PARA LA UNIVERSIDAD DE KASTAMONU" (PDF) . Conferencia de la Revista Internacional de Artes y Ciencias . 9 (3): 71.
- ^ van Gardingen PR, Grace J, Jeffree CE, Byari SH, Miglietta F, Raschi A, Bettarini I (1997). "Efectos a largo plazo de concentraciones mejoradas de CO2 en el intercambio de gases en las hojas: oportunidades de investigación utilizando manantiales de CO2 " . En Raschi A, Miglietta F, Tognetti R, van Gardingen PR (eds.). Respuestas de las plantas a niveles elevados de CO2 : evidencia de manantiales naturales . Cambridge: Cambridge University Press. págs. 69–86. ISBN 978-0-521-58203-2.
- ^ Martini M (1997). "Emisiones de CO2 en áreas volcánicas: casos históricos y peligros". En Raschi A, Miglietta F, Tognetti R, van Gardingen PR (eds.). Respuestas de las plantas a niveles elevados de CO2 : evidencia de manantiales naturales . Cambridge: Cambridge University Press. págs. 69–86. ISBN. 978-0-521-58203-2.
- ^ ab "ABG (gasometría arterial)". Brookside Associates . Archivado desde el original el 12 de agosto de 2017 . Consultado el 2 de enero de 2017 .
- ^ "¿Cuánto dióxido de carbono aportan los seres humanos a través de la respiración?". EPA.gov . Archivado desde el original el 2 de febrero de 2011. Consultado el 30 de abril de 2009 .
- ^ Henrickson C (2005). Química. Cliffs Notes. ISBN 978-0-7645-7419-1.
- ^ Battisti-Charbonney, A.; Fisher, J.; Duffin, J. (15 de junio de 2011). "La respuesta cerebrovascular al dióxido de carbono en humanos". J. Physiol . 589 (12): 3039–3048. doi :10.1113/jphysiol.2011.206052. PMC 3139085 . PMID 21521758.
- ^ Patel, S.; Miao, JH; Yetiskul, E.; Anokhin, A.; Majmunder, SH (2022). "Fisiología, retención de dióxido de carbono". Biblioteca Nacional de Medicina . Centro Nacional de Información Biotecnológica, NIH. PMID 29494063. Consultado el 20 de agosto de 2022 .
- ^ Wilmshurst, Peter (1998). "ABC del oxígeno". BMJ . 317 (7164): 996–999. doi :10.1136/bmj.317.7164.996. PMC 1114047 . PMID 9765173.
- ^ Gavin, Schmidt (2010), Cómo medir el efecto invernadero , consultado el 24 de agosto de 2024
- ^ ab «El dióxido de carbono es ahora más de un 50% más alto que los niveles preindustriales». National Oceanic and Atmospheric Administration . 3 de junio de 2022. Archivado desde el original el 5 de junio de 2022. Consultado el 14 de junio de 2022 .
- ^ ab Eggleton, Tony (2013). Una breve introducción al cambio climático. Cambridge University Press. pág. 52. ISBN 9781107618763Archivado desde el original el 14 de marzo de 2023 . Consultado el 14 de marzo de 2023 .
- ^ "Índice anual de gases de efecto invernadero (AGGI) de la NOAA: una introducción". Laboratorio de monitoreo global de la NOAA /Laboratorios de investigación del sistema terrestre. Archivado desde el original el 27 de noviembre de 2020. Consultado el 18 de diciembre de 2020 .
- ^ Etheridge, DM; LP Steele; RL Langenfelds; RJ Francey; J.-M. Barnola; VI Morgan (1996). "Cambios naturales y antropogénicos en el CO2 atmosférico durante los últimos 1000 años a partir del aire en el hielo y el firn antárticos". Revista de investigación geofísica . 101 (D2): 4115–28. Bibcode :1996JGR...101.4115E. doi :10.1029/95JD03410. ISSN 0148-0227. S2CID 19674607.
- ^ Pierre-Louis, Kendra (10 de mayo de 2024). "El dióxido de carbono acaba de dar un salto ominoso y sin precedentes". www.bloomberg.com . Consultado el 13 de mayo de 2024 .
- ^ IPCC (2022) Resumen para responsables de políticas Archivado el 12 de marzo de 2023 en Wayback Machine en Cambio climático 2022: mitigación del cambio climático. Contribución del Grupo de trabajo III al sexto informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático Archivado el 2 de agosto de 2022 en Wayback Machine , Cambridge University Press, Cambridge, Reino Unido y Nueva York, NY, EE. UU.
- ^ Petty, GW (2004). "Un primer curso sobre radiación atmosférica". Eos Transactions . 85 (36): 229–51. Bibcode :2004EOSTr..85..341P. doi : 10.1029/2004EO360007 .
- ^ Atkins, P. ; de Paula, J. (2006). Química física de Atkins (8.ª ed.). WH Freeman. pág. 462. ISBN 978-0-7167-8759-4.
- ^ "El dióxido de carbono absorbe y reemite radiación infrarroja". Centro de Educación Científica de la UCAR. 2012. Archivado desde el original el 21 de septiembre de 2017. Consultado el 9 de septiembre de 2017 .
- ^ Ahmed, Issam. "Los niveles actuales de dióxido de carbono se observaron por última vez hace 14 millones de años". phys.org . Consultado el 8 de febrero de 2024 .
- ^ "Clima y CO2 en la atmósfera". Archivado desde el original el 6 de octubre de 2018. Consultado el 10 de octubre de 2007 .
- ^ Friedlingstein P, Jones MW, O'sullivan M, Andrew RM, Hauck J, Peters GP, et al. (2019). "Presupuesto global de carbono 2019". Datos científicos del sistema terrestre . 11 (4): 1783–1838. Bibcode :2019ESSD...11.1783F. doi : 10.5194/essd-11-1783-2019 . hdl : 20.500.11850/385668 ..
- ^ Doney SC, Levine NM (29 de noviembre de 2006). "¿Cuánto tiempo puede el océano frenar el calentamiento global?". Oceanus. Archivado desde el original el 4 de enero de 2008. Consultado el 21 de noviembre de 2007 .
- ^ Terhaar, Jens; Frölicher, Thomas L.; Joos, Fortunat (2023). "Acidificación de los océanos en escenarios de estabilización de la temperatura impulsados por las emisiones: el papel de los gases de efecto invernadero no CO2 y de los gases de efecto invernadero impulsados por las emisiones". Environmental Research Letters . 18 (2): 024033. Bibcode :2023ERL....18b4033T. doi :10.1088/1748-9326/acaf91. ISSN 1748-9326. S2CID 255431338.
Figura 1f
- ^ Oxygen, Pro (21 de septiembre de 2024). «Página de inicio del CO2 de la Tierra» . Consultado el 21 de septiembre de 2024 .
- ^ ab Acidificación de los océanos debido al aumento del dióxido de carbono atmosférico (PDF) . Royal Society. 2005. ISBN 0-85403-617-2.
- ^ Jiang, Li-Qing; Carter, Brendan R.; Feely, Richard A.; Lauvset, Siv K.; Olsen, Are (2019). "Ph de la superficie del océano y capacidad de amortiguación: pasado, presente y futuro". Scientific Reports . 9 (1): 18624. Bibcode :2019NatSR...918624J. doi : 10.1038/s41598-019-55039-4 . PMC 6901524 . PMID 31819102.
 El texto fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional Archivado el 16 de octubre de 2017 en Wayback Machine.
El texto fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional Archivado el 16 de octubre de 2017 en Wayback Machine. - ^ Zhang, Y.; Yamamoto-Kawai, M.; Williams, WJ (16 de febrero de 2020). "Dos décadas de acidificación oceánica en las aguas superficiales del giro de Beaufort, océano Ártico: efectos del derretimiento y el retroceso del hielo marino entre 1997 y 2016". Geophysical Research Letters . 47 (3). doi : 10.1029/2019GL086421 . S2CID 214271838.
- ^ Beaupré-Laperrière, Alexis; Mucci, Alfonso; Thomas, Helmuth (31 de julio de 2020). "El estado reciente y la variabilidad del sistema carbonatado del archipiélago ártico canadiense y cuencas adyacentes en el contexto de la acidificación de los océanos". Biogeociencias . 17 (14): 3923–3942. Bibcode :2020BGeo...17.3923B. doi : 10.5194/bg-17-3923-2020 . S2CID 221369828.
- ^ Mitchell, Mark J.; Jensen, Oliver E.; Cliffe, K. Andrew; Maroto-Valer, M. Mercedes (8 de mayo de 2010). "Un modelo de disolución de dióxido de carbono y cinética de carbonatación mineral". Actas de la Royal Society A: Ciencias matemáticas, físicas e ingeniería . 466 (2117): 1265–1290. Bibcode :2010RSPSA.466.1265M. doi : 10.1098/rspa.2009.0349 .
- ^ Lupton J, Lilley M, Butterfield D, Evans L, Embley R, Olson E, et al. (2004). "Ventilación de dióxido de carbono líquido en el sitio hidrotermal Champagne, volcán NW Eifuku, Arco de las Marianas". American Geophysical Union . 2004 (reunión de otoño). V43F–08. Código Bibliográfico :2004AGUFM.V43F..08L.
- ^ Inagaki F, Kuypers MM, Tsunogai U, Ishibashi J, Nakamura K, Treude T, et al. (septiembre de 2006). "Comunidad microbiana en un lago de CO2 alojado en sedimentos del sistema hidrotermal de la depresión meridional de Okinawa". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (38): 14164–14169. Bibcode :2006PNAS..10314164I. doi : 10.1073/pnas.0606083103 . PMC 1599929 . PMID 16959888. Los vídeos se pueden descargar en «Información complementaria». Archivado desde el original el 19 de octubre de 2018.
- ^ "Recolección y uso de biogás de vertederos". Administración de Información Energética de Estados Unidos. 11 de enero de 2017. Archivado desde el original el 11 de julio de 2018. Consultado el 22 de noviembre de 2015 .
- ^ "Datos sobre el gas de vertedero" (PDF) . Agencia de Protección Ambiental de Estados Unidos. Enero de 2000. Archivado (PDF) desde el original el 23 de septiembre de 2015 . Consultado el 4 de septiembre de 2015 .
- ^ ab Pierantozzi R (2001). "Dióxido de carbono". Enciclopedia Kirk-Othmer de tecnología química . Wiley. doi :10.1002/0471238961.0301180216090518.a01.pub2. ISBN 978-0-471-23896-6.
- ^ Lebling, Katie; Gangotra, Ankita; Hausker, Karl; Byrum, Zachary (13 de noviembre de 2023). "7 cosas que hay que saber sobre la captura, utilización y secuestro de carbono". Instituto de Recursos Mundiales .
 El texto fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional
El texto fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional - ^ Strassburger J (1969). Teoría y práctica de los altos hornos . Nueva York: Instituto Americano de Ingenieros Mineros, Metalúrgicos y Petroleros. ISBN 978-0-677-10420-1.
- ^ Topham S (2000). "Dióxido de carbono". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a05_165. ISBN . 3527306730.
- ^ "Escasez de CO2: la industria alimentaria pide la acción del gobierno". BBC. 21 de junio de 2018. Archivado desde el original el 23 de mayo de 2021. Consultado el 24 de junio de 2018 .
- ^ "Informe especial del IPCC sobre captura y almacenamiento de dióxido de carbono" (PDF) . Grupo Intergubernamental de Expertos sobre el Cambio Climático. Archivado desde el original (PDF) el 24 de septiembre de 2015 . Consultado el 4 de septiembre de 2015 .
- ^ Morrison RT, Boyd RN (1983). Química orgánica (4.ª ed.). Allyn y Bacon. Págs. 976-977. ISBN 978-0-205-05838-9.
- ^ Badwal SP, Giddey SS, Munnings C, Bhatt AI, Hollenkamp AF (24 de septiembre de 2014). "Tecnologías emergentes de conversión y almacenamiento de energía electroquímica". Frontiers in Chemistry . 2 : 79. Bibcode :2014FrCh....2...79B. doi : 10.3389/fchem.2014.00079 . PMC 4174133 . PMID 25309898.
- ^ Whiting D, Roll M, Vickerman L (agosto de 2010). "Factores de crecimiento de las plantas: fotosíntesis, respiración y transpiración". CMG GardenNotes . Programa de Maestros Jardineros de Colorado. Archivado desde el original el 2 de septiembre de 2014. Consultado el 10 de octubre de 2011 .
- ^ Waggoner PE (febrero de 1994). "Dióxido de carbono". ¿Cuánta tierra pueden destinar diez mil millones de personas a la naturaleza? Archivado desde el original el 12 de octubre de 2011. Consultado el 10 de octubre de 2011 .
- ^ Stafford N (agosto de 2007). "Cultivos del futuro: el otro efecto invernadero". Nature . 448 (7153): 526–528. Bibcode :2007Natur.448..526S. doi : 10.1038/448526a . PMID 17671477. S2CID 9845813.
- ^ Archer, Steven R.; Andersen, Erik M.; Predick, Katharine I.; Schwinning, Susanne; Steidl, Robert J.; Woods, Steven R. (2017), Briske, David D. (ed.), "Invasión de plantas leñosas: causas y consecuencias", Rangeland Systems , Cham: Springer International Publishing, págs. 25–84, doi : 10.1007/978-3-319-46709-2_2 , ISBN 978-3-319-46707-8
- ^ Agencia de Normas Alimentarias del Reino Unido: «Aditivos aprobados actualmente por la UE y sus números E». Archivado desde el original el 7 de octubre de 2010. Consultado el 27 de octubre de 2011 .
- ^ Administración de Alimentos y Medicamentos de Estados Unidos: «Lista de estatus de aditivos alimentarios». Administración de Alimentos y Medicamentos . Archivado desde el original el 4 de noviembre de 2017. Consultado el 13 de junio de 2015 .
- ^ Código de Normas Alimentarias de Australia y Nueva Zelanda «Norma 1.2.4 – Etiquetado de ingredientes». 8 de septiembre de 2011. Archivado desde el original el 19 de enero de 2012. Consultado el 27 de octubre de 2011 .
- ^ Revista Futurific Leading Indicators. Vol. 1. CRAES LLC. ISBN 978-0-9847670-1-4Archivado del original el 15 de agosto de 2021 . Consultado el 9 de noviembre de 2020 .
- ^ Vijay GP (25 de septiembre de 2015). Panes indios: una guía completa de panes indios tradicionales e innovadores. Westland. ISBN 978-93-85724-46-6.[ enlace muerto permanente ]
- ^ "Los científicos descubren un receptor proteico para el sabor a carbonatación". ScienceDaily . 16 de octubre de 2009. Archivado desde el original el 29 de marzo de 2020 . Consultado el 29 de marzo de 2020 .
- ^ Coghlan A (3 de febrero de 2018). «Una forma más humana de sacrificar pollos podría obtener la aprobación de la UE». New Scientist . Archivado desde el original el 24 de junio de 2018. Consultado el 24 de junio de 2018 .
- ^ "¿Qué es el aturdimiento por CO2?". RSPCA. Archivado desde el original el 9 de abril de 2014.
- ^ Campbell A (10 de marzo de 2018). «Humane enforcement and the fear of the turbil». New Scientist . Archivado desde el original el 24 de junio de 2018. Consultado el 24 de junio de 2018 .
- ^ Internacional, Petrogav. Curso de producción para contratación en plataformas petroleras y de gas en alta mar. Petrogav Internacional. pág. 214.
- ^ Nordestgaard BG, Rostgaard J (febrero de 1985). "Secado en punto crítico frente a secado por congelación para microscopía electrónica de barrido: un estudio cuantitativo y cualitativo sobre hepatocitos aislados". Journal of Microscopy . 137 (Pt 2): 189–207. doi :10.1111/j.1365-2818.1985.tb02577.x. PMID 3989858. S2CID 32065173.
- ^ "Tipos de extintores". Centro de asesoramiento sobre seguridad contra incendios . Archivado desde el original el 28 de junio de 2021. Consultado el 28 de junio de 2021 .
- ^ Código 12 de la Asociación Nacional de Protección contra Incendios.
- ^ El dióxido de carbono como agente extintor de incendios: análisis de los riesgos, US EPA, 2000.
- ^ "Apéndice A: CO2 para su uso en la recuperación mejorada de petróleo (EOR)". Aceleración de la adopción de CCS: uso industrial del dióxido de carbono capturado. 20 de diciembre de 2011. Archivado desde el original el 28 de abril de 2017. Consultado el 2 de enero de 2017 .
{{cite book}}:|website=ignorado ( ayuda ) - ^ Austell JM (2005). "CO2 para necesidades de recuperación mejorada de petróleo: incentivos fiscales mejorados". Exploration & Production: The Oil & Gas Review . Archivado desde el original el 7 de febrero de 2012. Consultado el 28 de septiembre de 2007 .
- ^ "Recuperación mejorada de metano en capas de carbón". ETH Zurich. 31 de agosto de 2006. Archivado desde el original el 6 de julio de 2011.
- ^ Clayton M (11 de enero de 2006). «Algae – like a breath mint for smokestacks» (Las algas, como un caramelo de menta para las chimeneas). The Christian Science Monitor . Archivado desde el original el 14 de septiembre de 2008. Consultado el 11 de octubre de 2007 .
- ^ Atsumi S, Higashide W, Liao JC (diciembre de 2009). "Reciclaje fotosintético directo de dióxido de carbono a isobutiraldehído". Nature Biotechnology . 27 (12): 1177–1180. doi :10.1038/nbt.1586. PMID 19915552. S2CID 1492698.
- ^ Cobb S, Badiani V, Dharani A, Wagner A, Zacarias S, Oliveira AR, et al. (28 de febrero de 2022). "La cinética de hidratación rápida de CO2 perjudica la catálisis de reducción de CO2 heterogénea pero mejora la enzimática". Nature Chemistry . 14 (4): 417–424. Bibcode :2022NatCh..14..417C. doi :10.1038/s41557-021-00880-2. ISSN 1755-4349. PMC 7612589 . PMID 35228690. S2CID 247160910.
- ^ Edwardes Moore E, Cobb SJ, Coito AM, Oliveira AR, Pereira IA, Reisner E (enero de 2022). "Comprensión del entorno químico local de la bioelectrocatálisis". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 119 (4): e2114097119. Bibcode :2022PNAS..11914097E. doi : 10.1073/pnas.2114097119 . PMC 8795565 . PMID 35058361.
- ^ "Una forma limpia de convertir el CO2 en combustible inspirada en la naturaleza". Applied Sciences from Technology Networks . 1 de marzo de 2022 . Consultado el 2 de marzo de 2022 .
- ^ Pearson, S. Forbes. «Refrigerantes pasados, presentes y futuros» (PDF) . R744 . Archivado desde el original (PDF) el 13 de julio de 2018. Consultado el 30 de marzo de 2021 .
- ^ "The Coca-Cola Company anuncia la adopción de un aislamiento sin HFC en las unidades de refrigeración para combatir el calentamiento global". The Coca-Cola Company. 5 de junio de 2006. Archivado desde el original el 1 de noviembre de 2013. Consultado el 11 de octubre de 2007 .
- ^ "Modine refuerza sus esfuerzos de investigación sobre el CO2". R744.com. 28 de junio de 2007. Archivado desde el original el 10 de febrero de 2008.
- ^ TCE, The Chemical Engineer. Institution of Chemical Engineers. 1990. Archivado desde el original el 17 de agosto de 2021 . Consultado el 2 de junio de 2020 .
- ^ ab "Directrices de la AVMA para la eutanasia de animales: edición 2020" (PDF) . Asociación Médica Veterinaria Estadounidense . 2020. Archivado (PDF) del original el 1 de febrero de 2014 . Consultado el 13 de agosto de 2021 .
- ^ Harris D (septiembre de 1910). "El pionero en la higiene de la ventilación". The Lancet . 176 (4542): 906–908. doi :10.1016/S0140-6736(00)52420-9. Archivado desde el original el 17 de marzo de 2020 . Consultado el 6 de diciembre de 2019 .
- ^ Almqvist E (2003). Historia de los gases industriales . Springer. pág. 93. ISBN 978-0-306-47277-0.
- ^ Priestley J , Hey W (1772). "Observaciones sobre diferentes tipos de aire". Philosophical Transactions . 62 : 147–264. doi :10.1098/rstl.1772.0021. S2CID 186210131. Archivado desde el original el 7 de junio de 2010. Consultado el 11 de octubre de 2007 .
- ^ Davy H (1823). "Sobre la aplicación de líquidos formados por la condensación de gases como agentes mecánicos". Philosophical Transactions . 113 : 199–205. doi : 10.1098/rstl.1823.0020 . JSTOR 107649.
- ^ Thilorier AJ (1835). "Solidificación del ácido carbónico". Cuentas Rendus . 1 : 194–196. Archivado desde el original el 2 de septiembre de 2017 . Consultado el 1 de septiembre de 2017 .
- ^ Thilorier AJ (1836). «Solidificación del ácido carbónico». The London and Edinburgh Philosophical Magazine . 8 (48): 446–447. doi :10.1080/14786443608648911. Archivado desde el original el 2 de mayo de 2016. Consultado el 15 de noviembre de 2015 .
- ^ Haldane, John (1894). "Notas de una investigación sobre la naturaleza y la acción fisiológica de la humedad negra, como se encontró en la mina de carbón de Podmore, Staffordshire, y en la mina de carbón de Lilleshall, Shropshire". Actas de la Royal Society de Londres . 57 : 249–257. Bibcode :1894RSPS...57..249H. JSTOR 115391.
Enlaces externos
- Mapa mundial actual de la concentración de dióxido de carbono
- CDC – Guía de bolsillo de NIOSH sobre peligros químicos: dióxido de carbono
- Tendencias del dióxido de carbono atmosférico (NOAA)
- El redescubrimiento del CO2: Historia, ¿Qué es Shecco? - como refrigerante






![{\displaystyle K_{\mathrm {h} }={\frac {{\ce {[H2CO3]}}}{{\ce {[CO2_{(aq)}]}}}}=1,70\times 10^{ -3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b01be634ec0c3d83cbf3aa2c71bbd51b9ce0e26)
![{\displaystyle K_{\mathrm {a1} }={\frac {{\ce {[HCO3- ][H+]}}}{{\ce {[H2CO3]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6013fac05dba06751345e4d824c525ed2c43b12)
![{\displaystyle K_{\mathrm {a1} }{\rm {(aparente)}}={\frac {{\ce {[HCO3- ][H+]}}}{{\ce {[H2CO3] + [CO2_{(aq)}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3ae2fa07440c037d6054ce4e7ef95c15c59264e7)

