Benzaldehído
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Benzenecarbaldehído | |||
| Nombre IUPAC preferido Benzaldehído [1] | |||
| Otros nombres Benzenecarboxaldehído Fenilmetanal Aldehído benzoico | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.002.601 | ||
| Número CE |
| ||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1990 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C7H6O | |||
| Masa molar | 106,124 g·mol −1 | ||
| Apariencia | Líquido incoloro fuertemente refractario. | ||
| Olor | parecido a una almendra | ||
| Densidad | 1,044 g/mL, líquido | ||
| Punto de fusión | −57,12 [2] °C (−70,82 °F; 216,03 K) | ||
| Punto de ebullición | 178,1 °C (352,6 °F; 451,2 K) | ||
| 6,95 g/L (25 °C) [3] | |||
| registro P | 1.64 [4] | ||
| -60,78·10 −6 cm3 / mol | |||
Índice de refracción ( n D ) | 1.5456 | ||
| Viscosidad | 1,321 cP (25 °C) | ||
| Termoquímica | |||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | -36,8 kJ/mol | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | −3525,1 kJ/mol | ||
| Peligros | |||
| Etiquetado SGA : | |||
 | |||
| Advertencia | |||
| H302 | |||
| P264 , P270 , P301+P312 , P330 , P501 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | 64 °C (147 °F; 337 K) | ||
| 192 °C (378 °F; 465 K) | |||
| Límites de explosividad | 1,4–8,5% | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 1300 mg/kg (rata, oral) | ||
| Ficha de datos de seguridad (FDS) | J. T. Baker | ||
| Compuestos relacionados | |||
Compuestos relacionados | Alcohol bencílico Ácido benzoico Oxima de benzaldehído | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El benzaldehído (C 6 H 5 CHO) es un compuesto orgánico que consiste en un anillo de benceno con un sustituyente formilo . Es uno de los aldehídos aromáticos más simples y uno de los más útiles a nivel industrial.
Es un líquido incoloro con un olor característico parecido al de las almendras , y se utiliza comúnmente en refrescos con sabor a cereza . [5] El benzaldehído, un componente del aceite de almendras amargas , se puede extraer de varias otras fuentes naturales. [6] El benzaldehído sintético es el agente aromatizante del extracto de almendras de imitación, que se utiliza para dar sabor a pasteles y otros productos horneados. [7]
Historia
El benzaldehído fue extraído por primera vez en 1803 por el farmacéutico francés Martrès. Sus experimentos se centraron en dilucidar la naturaleza de la amigdalina , el compuesto venenoso que se encuentra en las almendras amargas , el fruto de Prunus dulcis . [8] Trabajos posteriores sobre el aceite por Pierre Robiquet y Antoine Boutron Charlard, dos químicos franceses, produjeron benzaldehído. [9] En 1832, Friedrich Wöhler y Justus von Liebig sintetizaron por primera vez el benzaldehído. [10]
Producción
En 1999 se producían anualmente 7000 toneladas de benzaldehído sintético y 100 toneladas de benzaldehído natural. [11] La cloración en fase líquida y la oxidación del tolueno son las principales vías de producción. Se han desarrollado otros numerosos métodos, como la oxidación parcial del alcohol bencílico , la hidrólisis alcalina del cloruro de benzal y la carbonilación del benceno ( reacción de Gatterman-Koch ). [6]
Una cantidad significativa de benzaldehído natural se produce a partir del cinamaldehído obtenido del aceite de casia mediante la reacción retroaldólica : [11] el cinamaldehído se calienta en una solución acuosa / alcohólica entre 90 °C y 150 °C con una base (más comúnmente carbonato o bicarbonato de sodio ) durante 5 a 80 horas, [12] seguido de la destilación del benzaldehído formado. Esta reacción también produce acetaldehído . El estado natural del benzaldehído obtenido de esta manera es controvertido. [11]
Aparición
El benzaldehído y otras sustancias químicas similares se encuentran de forma natural en muchos alimentos. La mayor parte del benzaldehído que consumimos proviene de alimentos vegetales naturales, como las almendras . [13]
Las almendras, los albaricoques , las manzanas y las semillas de cereza contienen cantidades significativas de amigdalina . Este glucósido se descompone mediante catálisis enzimática en benzaldehído, cianuro de hidrógeno y dos equivalentes de glucosa .
El benzaldehído contribuye al aroma de los hongos ostra ( Pleurotus ostreatus ). [14]
Reacciones
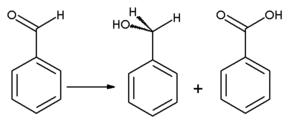
El benzaldehído se oxida fácilmente a ácido benzoico en el aire a temperatura ambiente, [15] causando una impureza común en muestras de laboratorio. Dado que el punto de ebullición del ácido benzoico es mucho más alto que el del benzaldehído, se puede purificar por destilación . El alcohol bencílico se puede formar a partir del benzaldehído por medio de hidrogenación . La reacción del benzaldehído con acetato de sodio anhidro y anhídrido acético produce ácido cinámico , mientras que el cianuro de potasio alcohólico se puede utilizar para catalizar la condensación del benzaldehído a benzoína . El benzaldehído sufre una desproporción tras el tratamiento con álcali concentrado ( reacción de Cannizzaro ): una molécula del aldehído se reduce al alcohol bencílico y otra molécula se oxida simultáneamente a ácido benzoico .
Con dioles, incluidos muchos azúcares, el benzaldehído se condensa para formar acetales de bencilideno .
Usos
El benzaldehído se emplea habitualmente para dar sabor a almendras a los alimentos y productos perfumados, incluidos los líquidos de los cigarrillos electrónicos. A veces se utiliza en productos cosméticos. [16]
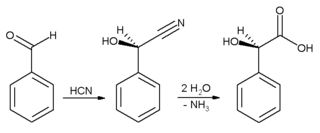
En el ámbito industrial, el benzaldehído se utiliza principalmente como precursor de otros compuestos orgánicos, desde productos farmacéuticos hasta aditivos plásticos. El tinte de anilina verde malaquita se prepara a partir de benzaldehído y dimetilanilina . El benzaldehído también es un precursor de ciertos tintes de acridina . A través de condensaciones aldólicas , el benzaldehído se convierte en derivados del cinamaldehído y el estireno . La síntesis del ácido mandélico comienza con la adición de ácido cianhídrico al benzaldehído:
La cianhidrina resultante se hidroliza a ácido mandélico . (El esquema anterior representa solo uno de los dos enantiómeros formados ).
Usos de nicho
El benzaldehído se utiliza como repelente de abejas . [17] Se coloca una pequeña cantidad de solución de benzaldehído en una placa de humos cerca de los panales. Las abejas se alejan de los panales para evitar los humos. [18] El apicultor puede entonces retirar los cuadros de miel de la colmena con menos riesgo tanto para las abejas como para el apicultor.
El benzaldehído reacciona con el nitroetano en presencia de un catalizador para producir fenil-2-nitropropeno , un precursor de la anfetamina y otras sustancias químicas. [19]
Seguridad
Tal como se utiliza en alimentos, cosméticos, productos farmacéuticos y jabones, el benzaldehído está "generalmente considerado seguro" ( GRAS ) por la FDA de los EE. UU. [20] y la FEMA . [13] Este estado se reafirmó después de una revisión en 2005. [13] Está aceptado en la Unión Europea como agente aromatizante. [16] Los estudios toxicológicos indican que es seguro y no cancerígeno en las concentraciones utilizadas para alimentos y cosméticos, [16] e incluso puede tener propiedades anticancerígenas (anticáncer). [16]
Para un humano de 70 kg, la dosis letal se estima en 50 ml. [6] La Agencia de Protección Ambiental de los Estados Unidos ha identificado una ingesta diaria aceptable de 15 mg/día para el benzaldehído . [21] El benzaldehído no se acumula en los tejidos humanos. [16] Se metaboliza y luego se excreta en la orina. [16]
Referencias
- ^ Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. pág. 908. doi :10.1039/9781849733069-FP001. ISBN. 978-0-85404-182-4.
- ^ Haynes, William M. (2014), Manual CRC de química y física (95.ª edición), CRC press, págs. 3-34, ISBN 9781482208689
- ^ "Base de datos de sustancias GESTIS". Instituto de Seguridad y Salud Laboral del Seguro Social Alemán de Accidentes. Archivado desde el original el 3 de marzo de 2016 . Consultado el 21 de agosto de 2012 .
- ^ "Benzaldehído_msds".
- ^ Lago, Christine; Reusch, Helmut; Ruge, Ingrid; Gödelmann, Rolf; Pflaum, Tabea; Kuballa, Thomas; Schumacher, Sandra; Lachenmeier, Dirk W. (2016). "Benzaldehído en sabor a cereza como precursor de la formación de benceno en bebidas". Química de los Alimentos . 206 : 74–77. doi :10.1016/j.foodchem.2016.03.034. PMID 27041300.
- ^ abc Brühne, Friedrich y Wright, Elaine (2002) "Benzaldehído" en la Enciclopedia de química industrial de Ullmann . Wiley-VCH, Weinheim. doi :10.1002/14356007.a03_463
- ^ El libro ilustrado de repostería del cocinero. America's Test Kitchen. 2013. ISBN 9781936493784.
- ↑ En 1803 C. Martrès publicó un manuscrito sobre el aceite de almendras amargas: "Recherches sur la nature et le siège de l'amertume et de l'odeur des amandes amères" (Investigación sobre la naturaleza y localización del amargor y del olor de almendras amargas). Sin embargo, las memorias fueron ignoradas en gran medida hasta que se publicó un extracto en 1819: Martrès fils (1819) "Sur les amandes amères", Journal de Pharmacie , vol. 5, páginas 289–296.
- ^ Nouvelles expériences sur les amandes amères et sur l'huile volatile qu'elles fournissent Robiquet, Boutron-Charlard, Annales de chimie et de physique, 44 (1830), 352–382,
- ^ Wöhler, Friedrich y Liebig, Justus von (1832). "Untersuchungen über das Radikal der Benzoesäure" [Investigaciones del radical del ácido benzoico]. Annalen der Pharmacie . 3 (3): 249–282. doi :10.1002/jlac.18320030302. hdl : 2027/hvd.hxdg3f .
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ abc Innovación en ingeniería de alimentos: nuevas técnicas y productos. Passos, Maria Laura., Ribeiro, Claudio P. Boca Raton, Florida: CRC Press. 2010. p. 87. ISBN 9781420086072.OCLC 500683261 .
{{cite book}}: Mantenimiento de CS1: otros ( enlace ) - ^ Wienes, Charles y Pittet, Alan O. (1985) Patente de EE. UU. 4.617.419 Proceso para preparar benzaldehído y acetaldehído naturales, composiciones de benzaldehído y acetaldehído naturales, productos producidos mediante los mismos y utilidades organolépticas para los mismos.
- ^ abc Adams, TB; Cohen, SM; Doull, J.; Feron, VJ; Goodman, JI; Marnett, LJ; Munro, IC; Portoghese, PS; Smith, RL (1 de agosto de 2005). "La evaluación FEMA GRAS de los derivados de bencilo utilizados como ingredientes de sabor". Toxicología alimentaria y química . 43 (8): 1207–1240. doi :10.1016/j.fct.2004.11.014. PMID 15950815.
- ^ Beltrán-García, Miguel J.; Estarrón-Espinosa, Mirna; Ogura, Tetsuya (1997). "Compuestos volátiles secretados por el hongo ostra ( Pleurotus ostreatus ) y sus actividades antibacterianas". Revista de química agrícola y alimentaria . 45 (10): 4049. doi :10.1021/jf960876i.
- ^ Sankar, Meenakshisundaram (2014). "La paradoja de la oxidación del benzaldehído explicada por la intercepción del radical peroxi por el alcohol bencílico" (PDF) . Nature Communications . 5 : 3332. Bibcode :2014NatCo...5.3332S. doi : 10.1038/ncomms4332 . PMID 24567108.
- ^ abcdef Andersen, Alan (1 de enero de 2006). "Informe final sobre la evaluación de seguridad del benzaldehído". Revista Internacional de Toxicología . 25 (Supl. 1): 11–27. doi : 10.1080/10915810600716612 . PMID 16835129. S2CID 32177208.
- ^ Evans, Elizabeth; Butler, Carol (9 de febrero de 2010). ¿Por qué zumban las abejas?: ¿Por qué zumban las abejas? Respuestas fascinantes a preguntas sobre las abejas. Rutgers University Press. pp. 177–178. ISBN 9780813549200.
- ^ Sanford, Malcolm T.; Bonney, Richard E. (1 de enero de 2010). Storey's Guide to Keeping Honey Bees: Honey Production, Polynization, Bee Health [Guía de Storey para la cría de abejas: producción de miel, polinización y salud de las abejas]. Storey Publishing. pág. 167. ISBN 9781603425506.
- ^ "Síntesis de fenil-2-nitropropeno". Erowid . Consultado el 7 de octubre de 2023 .
- ^ Friedrich Brühne; Elaine Wright (2007), "Benzaldehído", Ullmann's Encyclopedia of Industrial Chemistry (7.ª ed.), Wiley, pág. 11
- ^ Evaluación, Centro Nacional de Medio Ambiente de la EPA de EE. UU. "Perfil de efectos ambientales y sobre la salud del benzaldehído". cfpub.epa.gov . Consultado el 16 de septiembre de 2017 .
Enlaces externos
- Ficha internacional de seguridad química 0102
- Informe de evaluación inicial de los SIDS sobre el benzaldehído de la Organización para la Cooperación y el Desarrollo Económicos (OCDE) Archivado
- Descripción del benzaldehído en ChemicalLand21.com
- ChemSub Online: Benzaldehído.
- Proyecto de potencial carcinógeno