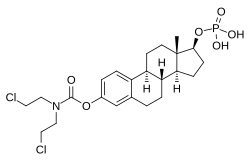
Fosfato de estramustina
 | |
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Emcyt, Estracyt |
| Otros nombres | EMP; Leo 299; NSC-89199; Ro 21-8837/001; Fosfato de normustina de estradiol; Fosfato de 3-normustina de estradiol 17β; Fosfato de 3-(bis(2-cloroetil)carbamato) de estradiol 17β-(dihidrógeno) |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a608046 |
| Datos de licencia |
|
Categoría de embarazo |
|
| Vías de administración | Por vía oral , IV |
| Clase de droga | Agente quimioterapéutico ; Estrógeno ; Éster de estrógeno |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | 44–75% (como estramustina y estromustina) [1] |
| Unión de proteínas | • Estradiol: 98% [2] • Estrona: 96% [2] |
| Metabolismo | Hígado , intestinos [3] [1] [6] |
| Metabolitos | • Estramustina [3] [1] • Estromustina [3] [1] • Estradiol [3] [1] • Estrona [3] [1] • Ácido fosfórico [3] [1] • Normustina [4] |
| Vida media de eliminación | • EMP: 1,27 horas [5] • Estromustina: 10–14 horas [1] • Estrona: 15–17 horas [1] |
| Excreción | Bilis , heces (2,9–4,8%) [1] [6] |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos |
|
| Araña química |
|
| UNIVERSIDAD |
|
| BARRIL |
|
| EBICh |
|
| Química biológica |
|
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.023.193 |
| Datos químicos y físicos | |
| Fórmula | C23H32Cl2NO6P |
| Masa molar | 520,38 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| |
El fosfato de estramustina ( EMP ), también conocido como fosfato de normustina de estradiol y vendido bajo las marcas Emcyt y Estracyt , es un medicamento dual de estrógeno y quimioterapia que se usa en el tratamiento del cáncer de próstata en hombres. [7] [4] [8] [9] [10] [3] [1] [11] [5] [12] Se toma varias veces al día por vía oral o por inyección en una vena . [7] [8] [3] [1] [5] [12]
Los efectos secundarios del EMP incluyen náuseas , vómitos , ginecomastia , feminización , desmasculinización , disfunción sexual , coágulos sanguíneos y complicaciones cardiovasculares . [3] [9] [13] El EMP es un agente citostático dual y, por lo tanto, quimioterapéutico y un agente anticanceroso hormonal del tipo estrógeno . [1] [3] [14] [5] Es un profármaco de estramustina y estromustina en términos de sus efectos citostáticos y un profármaco de estradiol en relación con sus efectos estrogénicos . [1] [3] El EMP tiene fuertes efectos estrogénicos en dosis clínicas típicas y, en consecuencia, tiene marcados efectos antigonadotrópicos y antiandrogénicos funcionales . [4] [1] [3] [14]
El EMP se introdujo para uso médico a principios de la década de 1970. [3] Está disponible en Estados Unidos , Canadá , el Reino Unido , otros países europeos y otras partes del mundo. [15] [16]
Usos médicos
En Estados Unidos , la EMP está indicada para el tratamiento paliativo del cáncer de próstata metastásico y/o progresivo, [6] mientras que en el Reino Unido está indicada para el tratamiento del cáncer de próstata que no responde o que recae . [17] [5] [1] [10] El medicamento suele reservarse para su uso en casos de cáncer de próstata refractarios a las hormonas, aunque también se ha utilizado como monoterapia de primera línea. [3] Se dice que las tasas de respuesta con EMP en el cáncer de próstata son equivalentes a la terapia convencional con estrógenos en dosis altas . [18]
Debido a sus efectos secundarios y toxicidad relativamente graves, la EMP rara vez se ha utilizado en el tratamiento del cáncer de próstata. [4] Esto es especialmente cierto en los países occidentales en la actualidad. [4] Como resultado, y también debido a los escasos efectos secundarios de los moduladores de la hormona liberadora de gonadotropina (moduladores de GnRH) como la leuprorelina , la EMP casi se abandonó. [3] Sin embargo, los alentadores hallazgos de la investigación clínica dieron como resultado un renovado interés en la EMP para el tratamiento del cáncer de próstata. [3]
El EMP se ha utilizado en dosis de 140 a 1400 mg/día por vía oral en el tratamiento del cáncer de próstata. [19] Sin embargo, el EMP oral se utiliza con mayor frecuencia en una dosis de 560 a 640 mg/día (280–320 mg dos veces al día). [1] La dosis recomendada de EMP oral en la etiqueta de la Administración de Alimentos y Medicamentos (FDA) para Emcyt es de 14 mg por kg de peso corporal (es decir, una cápsula oral de 140 mg por cada 10 kg o 22 lb de peso corporal) administrada en 3 o 4 dosis divididas por día. [7] La etiqueta indica que la mayoría de los pacientes en estudios de EMP oral en los Estados Unidos han recibido de 10 a 16 mg por kg por día. [7] Esto sería alrededor de 900 a 1440 mg/día para un hombre de 90 kg o 200 lb. [7] Se ha comprobado que dosis más bajas de EMP oral, como 280 mg/día, tienen una eficacia comparable a la de dosis más altas, pero con una mejor tolerabilidad y una toxicidad reducida. [4] Se ha descrito que dosis de 140 mg/día son muy bajas. [20] Se ha utilizado EMP en dosis de 240 a 450 mg/día por vía intravenosa. [1]
El EMP y otros estrógenos como el fosfato de poliestradiol y el etinilestradiol son mucho menos costosos que las terapias más nuevas, como los moduladores de GnRH, el acetato de abiraterona y la enzalutamida . [4] [21] [22] Además, los estrógenos pueden ofrecer beneficios significativos sobre otros medios de terapia de privación de andrógenos , por ejemplo en términos de pérdida ósea y fracturas , sofocos , cognición y estado metabólico . [4] [22]
El EMP se ha utilizado para prevenir el aumento de testosterona al inicio de la terapia con agonistas de GnRH en hombres con cáncer de próstata. [23]
| Ruta/forma | Estrógeno | Dosificación | |
|---|---|---|---|
| Oral | Estradiol | 1–2 mg 3 veces al día | |
| Estrógenos conjugados | 1,25–2,5 mg 3 veces al día | ||
| Etinilestradiol | 0,15–3 mg/día | ||
| Sulfonato de etinilestradiol | 1–2 mg 1 vez por semana | ||
| Dietilestilbestrol | 1–3 mg/día | ||
| Dienestrol | 5 mg/día | ||
| Hexestrol | 5 mg/día | ||
| Fosfestrol | 100–480 mg 1–3 veces al día | ||
| Clorotrianiseno | 12–48 mg/día | ||
| Cuadrosilano | 900 mg/día | ||
| Fosfato de estramustina | 140–1400 mg/día | ||
| Parche transdérmico | Estradiol | 2–6x 100 μg/día Escrotal: 1x 100 μg/día | |
| SOYInformación sobre herramientas intramuscularo inyección subcutánea | Benzoato de estradiol | 1,66 mg 3 veces por semana | |
| Dipropionato de estradiol | 5 mg 1 vez por semana | ||
| Valerato de estradiol | 10–40 mg 1 vez/1–2 semanas | ||
| Undecilato de estradiol | 100 mg 1 vez/4 semanas | ||
| Fosfato de poliestradiol | Solo: 160–320 mg 1x/4 semanas Con EE oral : 40–80 mg 1x/4 semanas | ||
| Estrona | 2–4 mg 2–3 veces por semana | ||
| Inyección intravenosa | Fosfestrol | 300–1200 mg 1–7 veces por semana | |
| Fosfato de estramustina | 240–450 mg/día | ||
| Nota: Las dosis no son necesariamente equivalentes. Fuentes: Ver plantilla. | |||
Formularios disponibles
El EMP está o ha estado disponible en forma de cápsulas (140 mg, 280 mg) para administración oral y soluciones acuosas (300 mg) para inyección intravenosa . [19] [24] [25] [7]
Contraindicaciones
El EMP está contraindicado cuando se utiliza en niños, pacientes hipersensibles a los estrógenos o mostazas nitrogenadas , aquellos con úlcera péptica (una úlcera en el tracto digestivo ), aquellos con función hepática severamente comprometida , aquellos con músculo cardíaco débil (también conocido como insuficiencia miocárdica ) y aquellos con trastornos tromboembólicos o complicaciones relacionadas con la retención de líquidos . [17]
Efectos secundarios
Los efectos secundarios de EMP en general se han descrito como relativamente graves. [3] Se ha informado que los efectos secundarios más comunes de EMP son efectos secundarios gastrointestinales como náuseas , vómitos y diarrea , con náuseas y vómitos que ocurren en el 40% de los hombres. [9] [1] Por lo general, son de gravedad leve o moderada, y las náuseas y los vómitos se pueden controlar con medicamentos antieméticos profilácticos . [9] No obstante, los casos graves de efectos secundarios gastrointestinales con EMP pueden requerir una reducción de la dosis o la interrupción del tratamiento. [1] Aunque se ha informado que las náuseas y los vómitos son los efectos secundarios más comunes de EMP, se ha descubierto que la ginecomastia (desarrollo de los senos masculinos) ocurre en hasta el 83% de los hombres tratados con EMP, y la incidencia de disfunción eréctil es posiblemente similar o ligeramente menor que el riesgo de ginecomastia. [3] Como regla general, se dice que la feminización , una distribución de grasa ginoide , la desmasculinización y la impotencia ocurren en prácticamente o casi el 100% de los hombres tratados con terapia de estrógenos en dosis altas . [13] [26] También se ha informado de una disminución de la actividad sexual en hombres tratados con EMP. [1] Estos efectos secundarios se deben a los altos niveles de estrógeno y los bajos niveles de testosterona . [1] [3] La irradiación profiláctica de las mamas se puede utilizar para disminuir la incidencia y la gravedad de la ginecomastia con estrógenos. [13]
Los efectos adversos graves de EMP son complicaciones tromboembólicas y cardiovasculares , incluyendo embolia pulmonar , trombosis venosa profunda , accidente cerebrovascular , tromboflebitis , enfermedad de la arteria coronaria (enfermedad cardíaca isquémica; p. ej., infarto de miocardio ), tromboflebitis e insuficiencia cardíaca congestiva con retención de líquidos . [9] [1] EMP produce toxicidad cardiovascular de manera similar al dietilestilbestrol , pero en menor medida en comparación con dosis bajas (p. ej., 280 mg/día de EMP oral frente a 1 mg/día de dietilestilbestrol oral). [3] [27] El estado de enfermedad de cáncer de próstata también aumenta el riesgo de tromboembolia, y la combinación con docetaxel también puede exacerbar el riesgo de tromboembolia. [9] Los metanálisis de ensayos clínicos han encontrado que el riesgo general de tromboembolia con EMP es del 4 al 7%, en relación con el 0,4% para los regímenes de quimioterapia sin EMP. [9] [28] La tromboembolia es la principal causa relacionada con la toxicidad de la interrupción del EMP. [29] La terapia anticoagulante con medicamentos como aspirina , warfarina , heparina no fraccionada y de bajo peso molecular y antagonistas de la vitamina K puede ser útil para disminuir el riesgo de tromboembolia con EMP y otros estrógenos como dietilestilbestrol y etinilestradiol . [9] [30] [4]
Con frecuencia se observan pruebas de función hepática adversas con EMP, pero la disfunción hepática grave es rara con la medicación. [1] Los efectos secundarios del sistema nervioso central rara vez se observan con EMP, aunque se han informado ventrículos agrandados y pigmentación neuronal en monos tratados con dosis muy altas de EMP (20-140 mg/kg/día) durante 3 a 6 meses. [1] EMP no parece tener efectos citostáticos en el tejido cerebral normal . [1] En mujeres tratadas con EMP en estudios clínicos, se han observado algunos casos de hemorragias ginecológicas menores. [1] EMP se describe como relativamente bien tolerado entre los agentes antineoplásicos citostáticos y mostaza nitrogenada, rara vez o nunca se asocia con toxicidad hematológica significativa como mielosupresión (supresión de la médula ósea), toxicidad gastrointestinal u otra toxicidad más marcada asociada con tales agentes. [5] [1] [31] A diferencia de la mayoría de los demás agentes citostáticos, que a menudo causan mielosupresión, leucopenia (disminución del recuento de glóbulos blancos ) y neutropenia (disminución del recuento de neutrófilos ), el EMP en realidad produce leucocitosis (aumento del recuento de glóbulos blancos) como efecto secundario. [32] [33]
En un pequeño estudio de dosis baja en el que se utilizaron 280 mg/día de EMP oral durante 150 días, la tolerabilidad mejoró significativamente, y la irritación gastrointestinal se produjo en solo el 15 % de los hombres, y no hubo incidencia de toxicidad cardiovascular grave ni trombosis venosa profunda. [3] [4] Además, no se observaron otros efectos secundarios además de una ligera elevación transitoria de las enzimas hepáticas . [3] Estos hallazgos sugieren que dosis más bajas de EMP oral pueden ser una opción más segura que dosis más altas para el tratamiento del cáncer de próstata. [4] Sin embargo, un metaanálisis posterior de 2004 de 23 estudios de eventos tromboembólicos con EMP encontró una incidencia sustancial de eventos tromboembólicos independientemente de la dosis y ninguna asociación de la dosis de EMP con el riesgo de estas complicaciones. [28]
Sobredosis
No ha habido experiencia clínica con sobredosis de EMP. [7] La sobredosis de EMP puede resultar en manifestaciones pronunciadas de los efectos adversos conocidos de la medicación. [7] No existe un antídoto específico para la sobredosis de EMP. [17] En caso de sobredosis, se debe utilizar un lavado gástrico para evacuar el contenido gástrico según sea necesario y el tratamiento debe basarse en los síntomas y ser de apoyo. [7] [17] En el caso de recuentos peligrosamente bajos de glóbulos rojos , glóbulos blancos o plaquetas , se puede administrar sangre completa según sea necesario. [17] La función hepática debe controlarse con la sobredosis de EMP. [17] Después de una sobredosis de EMP, los parámetros hematológicos y hepáticos deben continuar siendo monitoreados durante al menos 6 semanas. [7]
El EMP se ha utilizado en dosis altas de hasta 1.260 mg/día por vía oral y de 240 a 450 mg/día por inyección intravenosa . [3] [1]
Interacciones
Se ha informado que el EMP aumenta la eficacia y toxicidad de los antidepresivos tricíclicos como la amitriptilina y la imipramina . [17] Cuando se consumen concomitantemente con EMP productos que contienen calcio , aluminio y/o magnesio , como productos lácteos como la leche , diversos alimentos, suplementos dietéticos y antiácidos , se puede formar un complejo de quelato insoluble / sal de fosfato entre el EMP y estos metales , y esto puede perjudicar notablemente la absorción y, por lo tanto, la biodisponibilidad oral del EMP. [3] [1] [17] Puede haber un mayor riesgo de angioedema en aquellos que toman simultáneamente inhibidores de la ECA . [17]
Farmacología
Farmacodinamia

EMP, también conocido como fosfato de normustina de estradiol, es un éster de estrógeno combinado y un éster de mostaza nitrogenada . [1] [3] [14] Consiste en estradiol , un estrógeno , unido a un éster de fosfato , así como a un éster de normustina , una mostaza nitrogenada. [1] [3] [14] En términos de sus efectos farmacodinámicos , EMP es un profármaco de estramustina , estromustina y estradiol . [1] [3] Como profármaco de estradiol, EMP es un estrógeno y, por tanto, un agonista de los receptores de estrógeno . [1] [2] El propio EMP tiene una afinidad muy débil por los receptores de estrógeno. [1] El medicamento tiene un peso molecular aproximadamente un 91% superior al del estradiol debido a la presencia de sus ésteres de normustina C3 y fosfato C17β. [35] [15] Debido a que el EMP es un profármaco del estradiol, puede considerarse una forma natural y bioidéntica del estrógeno, [14] aunque tiene actividad citostática adicional a través de la estramustina y la estromustina. [1] [3]
El EMP actúa mediante un mecanismo de acción dual : 1) actividad citostática directa a través de una serie de acciones; y 2) como una forma de terapia de estrógeno en dosis altas a través de efectos antigonadotrópicos y antiandrogénicos funcionales mediados por el receptor de estrógeno . [1] [3] [14] Los efectos antigonadotrópicos y antiandrogénicos funcionales del EMP consisten en una fuerte supresión de la producción de andrógenos gonadales y, por lo tanto, de los niveles circulantes de andrógenos como la testosterona ; niveles muy aumentados de globulina transportadora de hormonas sexuales y, por lo tanto, una fracción disminuida de andrógenos libres en la circulación ; y acciones antiandrogénicas directas en las células de la próstata. [31] [1] [3] [4] [36] [37] [38] Se ha descubierto que el índice de andrógenos libres con EMP oral es en promedio 4,6 veces menor que con la orquiectomía . [37] Como tal, la terapia con EMP da como resultado una privación de andrógenos considerablemente más fuerte que la orquiectomía. [38] Se ha descubierto que los metabolitos de EMP, incluidos estramustina, estromustina, estradiol y estrona , actúan como antagonistas débiles del receptor de andrógenos ( EC 50 Concentración efectiva máxima a la mitad de la descripción emergente= 0,5–3,1 μM), aunque se desconoce la importancia clínica de esto. [39] [36] [3] [1]
Durante la terapia con EMP se producen niveles extremadamente altos de estradiol y estrona. [3] [4] Los metabolitos estrogénicos de EMP son responsables de sus efectos adversos más comunes y su toxicidad cardiovascular . [1] Se ha descrito que EMP tiene efectos estrogénicos relativamente débiles en algunas publicaciones. [5] [31] Sin embargo, ha mostrado esencialmente las mismas tasas y grados de efectos estrogénicos, como dolor en los senos , ginecomastia , toxicidad cardiovascular, cambios en la síntesis de proteínas hepáticas y supresión de testosterona, que el dietilestilbestrol y el etinilestradiol en dosis altas en estudios clínicos. [7] [4] [31] [38] [40] La noción de que EMP tiene una actividad estrogénica relativamente débil puede haberse basado en investigaciones con animales , que encontraron que EMP tenía efectos uterotróficos 100 veces menores que el estradiol en ratas, y también puede no haber tenido en cuenta las dosis muy altas de EMP utilizadas clínicamente en humanos. [40] [41]
El mecanismo de acción de los efectos citostáticos del EMP es complejo y solo se comprende parcialmente. [1] Se considera que el EMP es principalmente un inhibidor mitótico , que inhibe los mecanismos implicados en la fase de mitosis del ciclo celular . [1] [4] Específicamente, se une a las proteínas asociadas a los microtúbulos y/o a la tubulina y produce la despolimerización de los microtúbulos (K d = 10-20 μM para la estramustina), lo que resulta en la detención de la división celular en la fase G 2 /M (específicamente la metafase ). [1] [4] [42] Originalmente se pensó que el EMP mediaba sus efectos citostáticos como un profármaco de la normustina , una mostaza nitrogenada , y por lo tanto se pensó que era un agente antineoplásico alquilante . [3] [10] [5] [14] Sin embargo, investigaciones posteriores han descubierto que el EMP carece de acciones alquilantes y que la influencia del EMP en los microtúbulos está mediada por la estramustina y la estromustina intactas, y que la normustina o el estradiol solos tienen efectos menores o insignificantes. [1] [3] [43] Como tal, las propiedades únicas de las estructuras de estramustina y estromustina , que contienen un enlace carbamato - éster , parecen ser responsables de los efectos citostáticos del EMP. [1] Además de sus acciones antimitóticas, también se ha descubierto que el EMP produce otros efectos citostáticos, incluida la inducción de apoptosis , la interferencia con la síntesis de ADN , la interacción de la matriz nuclear , las alteraciones de la membrana celular , la inducción de especies reactivas de oxígeno (radicales libres de oxígeno) y posiblemente mecanismos adicionales. [1] [4] Se ha descubierto que el EMP tiene un efecto radiosensibilizante en el cáncer de próstata y las células de glioma , mejorando también la sensibilidad a la radioterapia . [1]
Los metabolitos citostáticos de EMP se acumulan en los tejidos de manera selectiva , por ejemplo, en las células de cáncer de próstata . [5] [1] [4] Esto puede deberse a la presencia de una proteína de unión a estramustina específica (EMBP) (K d = 10–35 nM para estramustina), también conocida como prostatina o proteína de secreción prostática (PSP), que se ha detectado en células de cáncer de próstata, glioma , melanoma y cáncer de mama . [1] [4] [44] Debido a su selectividad tisular, se dice que EMP produce efectos citostáticos mínimos en tejidos sanos, y su selectividad tisular puede ser responsable de su eficacia citostática terapéutica contra las células de cáncer de próstata. [5] [4] [1]
El EMP se desarrolló originalmente como un profármaco de éster dual de un estrógeno y normustina como un agente antineoplásico alquilante de mostaza nitrogenada que, debido a la afinidad de la fracción de estrógeno por los receptores de estrógeno, se acumularía selectivamente en los tejidos diana del estrógeno y, por lo tanto, en las células tumorales positivas para el receptor de estrógeno . [4] [14] [2] En consecuencia, se pensó que el EMP entregaría preferentemente la fracción alquilante de normustina a estos tejidos, lo que permitiría efectos citostáticos reducidos en tejidos sanos y, por lo tanto, una eficacia y tolerabilidad mejoradas . [4] Sin embargo, investigaciones posteriores encontraron que hay una escisión muy limitada y lenta del éster de normustina y que el EMP carece de actividad alquilante. [4] [1] [3] [31] Además, parece que la estramustina y la estromustina pueden acumularse preferentemente en los tejidos diana del estrógeno no debido a la afinidad por los receptores de estrógeno, sino debido a la afinidad por el EMBP distinto. [1] [3]
Los niveles extremadamente altos de estradiol, similares a los del embarazo , pueden ser responsables de la leucocitosis (aumento del recuento de glóbulos blancos ) que se observa en personas tratadas con EMP. [32] [33] Este efecto secundario contrasta con la mayoría de los demás agentes citotóxicos, que en cambio causan mielosupresión ( supresión de la médula ósea ), leucopenia (disminución del recuento de glóbulos blancos) y neutropenia (disminución del recuento de neutrófilos ). [ cita requerida ]
Efectos antigonadotrópicos
Se ha descubierto que el EMP en dosis de 280 mg/día suprime los niveles de testosterona en hombres hasta el rango de castración (hasta 30 ng/dL) en 20 días y hasta el rango de castración baja (hasta 10 ng/dL) en 30 días. [3] De manera similar, una dosis de 70 mg/día de EMP suprimió los niveles de testosterona hasta el rango de castración en 4 semanas. [3]
Farmacocinética
| Parámetro | Intravenosa 300 mg | Oral 420 mg |
|---|---|---|
| Cmáx . | 506 ± 61 ng/ml | 362 ± 38 ng/ml |
| Tmáx | 2,6 ± 0,4 horas | 2,2 ± 0,2 horas |
| media | 10,3 ± 0,95 horas | 13,6 ± 3,09 horas |
| Área bajo la curva (AUC) 0–32 | 4,82 ± 0,62 | 2,88 ± 0,34 |
| Biodisponibilidad | 100.0% | 43,7% ± 4,6% |
| Fuentes: [31] | ||
| Metabolito | Plasma | Relación |
|---|---|---|
| Estramustina | 20.000–23.000 pg/ml | 1:9.6–9.8 |
| Estromustina | 191.000–267.000 pg/ml | |
| Estradiol | 4.900–9.000 pg/ml | 1:9.4–11.8 |
| Estrona | 71.000–85.000 pg/ml | |
| Fuentes: [31] | ||
Tras la ingestión oral , la EMP se desfosforila rápidamente y por completo por las fosfatasas en estramustina durante el primer paso en el tracto gastrointestinal . [1] [4] [5] [45] La estramustina también se oxida parcialmente pero considerablemente en estromustina por las 17β-hidroxiesteroide deshidrogenasas durante el primer paso. [5] [1] [12] [46] Como tal, la EMP llega a la circulación como estramustina y estromustina, y el principal metabolito de la EMP es la estromustina. [1] [12] Una cantidad limitada de aproximadamente el 10 al 15% de estramustina y estromustina se metaboliza aún más lentamente a través de la hidrólisis del éster de normustina en estradiol y estrona , respectivamente. [1] [4] [31] Se cree que esta reacción es catalizada por carbamidasas , aunque no se han caracterizado los genes que codifican las enzimas responsables. [1] [47] [48] Los niveles circulantes de normustina formada a partir de EMP son insignificantes. [43] [49] No se ha demostrado la liberación de gas mostaza nitrogenado de la normustina a través de la escisión del grupo de ácido carboxílico y no parece ocurrir. [42] [31]
La biodisponibilidad oral de EMP es baja, lo que se debe a un profundo metabolismo de primer paso; específicamente, la desfosforilación de EMP. [1] La biodisponibilidad oral de EMP específicamente como estramustina y estromustina es del 44 al 75%, lo que sugiere que la absorción puede ser incompleta. [1] En cualquier caso, existe una relación lineal entre la dosis oral de EMP y los niveles circulantes de estramustina y estromustina. [1] El consumo de calcio , aluminio o magnesio con EMP oral puede perjudicar notablemente su biodisponibilidad debido a la disminución de la absorción en los intestinos, y esto puede interferir con su eficacia terapéutica a dosis bajas. [3] [17]
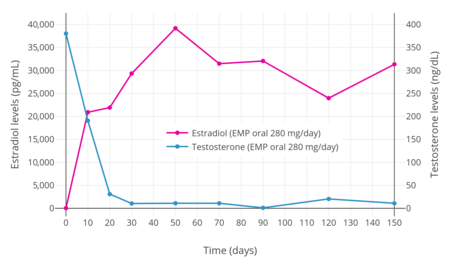
Después de una dosis oral única de 420 mg de EMP en hombres con cáncer de próstata, los niveles máximos de estromustina fueron de 310 a 475 ng/ml (475 000 pg/ml) y se produjeron después de 2 a 3 horas. [1] Se ha descubierto que los niveles de estradiol con 280 mg/día de EMP oral aumentan a concentraciones muy altas dentro de una semana de terapia. [3] En un estudio, los niveles de estradiol fueron superiores a 20 000 pg/ml después de 10 días, fueron de aproximadamente 30 000 pg/ml después de 30 días y alcanzaron un máximo de aproximadamente 40 000 pg/ml a los 50 días. [3] Otro estudio encontró niveles de estradiol más bajos de 4900 a 9000 pg/ml durante la terapia crónica con 560 mg/día de EMP oral. [31] Un estudio adicional encontró niveles de estradiol de aproximadamente 17 000 pg/ml con 140 mg/día de EMP oral y 38 000 pg/ml con 280 mg/día de EMP oral. [ cita requerida ] Se ha informado que los niveles circulantes de estradiol y estrona durante la terapia con EMP exceden los niveles normales en hombres en más de 100 y 1000 veces, respectivamente. [4] [31] Los niveles de estramustina y estradiol en la circulación son notablemente más bajos que los de estromustina y estrona, respectivamente, con una proporción de aproximadamente 1:10 en ambos casos. [1] [31] No obstante, los niveles de estradiol durante la terapia con EMP parecen ser similares a los que ocurren a mediados y finales del embarazo , que varían de 5000 a 40 000 pg/ml. [50] No se observa EMP sin cambios en la circulación con la administración oral. [1]
La farmacocinética de EMP es diferente con la inyección intravenosa . [1] Después de una única inyección intravenosa de 300 mg de EMP, los niveles de EMP fueron más altos que los de sus metabolitos durante las primeras 8 horas. [1] Esto probablemente se debe a la omisión del metabolismo de primer paso. [1] Sin embargo, a las 24 horas después de la dosis, ya no se podía detectar EMP sin cambios en la circulación. [1] El aclaramiento de EMP del plasma sanguíneo es de 4,85 ± 0,684 L/h. [1] Los volúmenes de distribución de EMP con inyección intravenosa fueron pequeños; bajo un modelo de dos compartimentos, el volumen de distribución para el compartimento central fue de 0,043 L/kg y para el compartimento periférico fue de 0,11 L/kg. [1] La unión a proteínas plasmáticas de EMP es alta. [1] La estramustina se acumula en el tejido tumoral , por ejemplo, el cáncer de próstata y el tejido glioma , con niveles de estramustina mucho más altos en estos tejidos que en el plasma (por ejemplo, 6,3 y 15,9 veces, respectivamente). [1] Por el contrario, los niveles de estramustina en el tumor frente al plasma son similares (1,0 y 0,5 veces, respectivamente). [1] La estramustina y la estromustina parecen acumularse en el tejido adiposo . [1]
La vida media de eliminación de la estromustina con EMP oral fue de 13,6 horas en promedio, con un rango de 8,8 a 22,7 horas. [1] Por el contrario, la vida media de eliminación de la estromustina con inyección intravenosa fue de 10,3 horas, con un rango de 7,36 a 12,3 horas. [1] A modo de comparación, las vidas medias de eliminación correspondientes de la estrona fueron de 16,5 y 14,7 horas para la administración oral e intravenosa, respectivamente. [1] La estramustina y la estromustina se excretan principalmente en la bilis y, por lo tanto, en las heces . [1] [31] No se cree que se excreten en la orina . [1]

Química
EMP, también conocido como estradiol 3-normustina 17β-fosfato o como estradiol 3-(bis(2-cloroetil)carbamato) 17β-(dihidrogenofosfato), es un esteroide estrano sintético y un derivado del estradiol . [35] [15] Es un éster de estrógeno ; específicamente, EMP es un diéster de estradiol con un éster de normustina C3 ( mostaza nitrogenada - fracción carbamato ) y un éster de fosfato C17β . [35] [15] EMP se proporciona como sal de sodio o meglumina . [35] [15] [24] EMP es similar como compuesto a otros ésteres de estradiol como el sulfato de estradiol y el valerato de estradiol , pero difiere en la presencia de su fracción de éster de mostaza nitrogenada. [35] [15] Los agentes antineoplásicos relacionados con EMP, aunque ninguno de ellos fue comercializado, incluyen alestramustina , atrimustina , acetato de citestrol , mostaza de estradiol , ICI-85966 y fenestrol . [35] [15]
Debido a su fracción de éster de fosfato hidrofílico , el EMP es un compuesto fácilmente soluble en agua . [51] [52] [53] Esto contrasta con la mayoría de los otros ésteres de estradiol, que son ésteres de ácidos grasos y compuestos lipofílicos que no son particularmente solubles en agua . [2] A diferencia del EMP, la estramustina es altamente lipofílica, prácticamente insoluble en agua y no ionizable . [19] El éster de fosfato del EMP se incorporó a la molécula para aumentar su solubilidad en agua y permitir la administración intravenosa . [7]
El peso molecular del EMP sódico es 564,3 g/mol, el de la meglumina del EMP es 715,6 g/mol, el de la EMP es 520,4 g/mol, el de la estramustina es 440,4 g/mol y el del estradiol es 272,4 g/mol. [54] Como resultado de estas diferencias en los pesos moleculares, el EMP contiene aproximadamente el 52%, el EMP sódico aproximadamente el 48% y el EMP meglumina aproximadamente el 38% de la cantidad de estradiol dentro de sus estructuras, al igual que una cantidad de estradiol de igual masa. [54]
| Estrógeno | Estructura | Ester(es) | Peso molecular relativo | Contenido relativo de E2 b | registro P c | ||||
|---|---|---|---|---|---|---|---|---|---|
| Puesto(s) | La mitad(es) | Tipo | Longitud a | ||||||
| Estradiol | 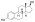 | – | – | – | – | 1.00 | 1.00 | 4.0 | |
| Acetato de estradiol | 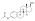 | C3 | Ácido etanoico | Ácido graso de cadena lineal | 2 | 1.15 | 0,87 | 4.2 | |
| Benzoato de estradiol |  | C3 | Ácido benzoico | Ácido graso aromático | – (~4–5) | 1.38 | 0,72 | 4.7 | |
| Dipropionato de estradiol | 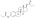 | C3, C17β | Ácido propanoico (×2) | Ácido graso de cadena lineal | 3 (×2) | 1.41 | 0,71 | 4.9 | |
| Valerato de estradiol |  | C17β | Ácido pentanoico | Ácido graso de cadena lineal | 5 | 1.31 | 0,76 | 5.6–6.3 | |
| Benzoato butirato de estradiol |  | C3, C17β | Ácido benzoico , ácido butírico | Ácido graso mixto | – (~6, 2) | 1.64 | 0,61 | 6.3 | |
| Cipionato de estradiol | 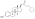 | C17β | Ácido ciclopentilpropanoico | Ácido graso cíclico | – (~6) | 1.46 | 0,69 | 6.9 | |
| Enantato de estradiol |  | C17β | Ácido heptanoico | Ácido graso de cadena lineal | 7 | 1.41 | 0,71 | 6.7–7.3 | |
| Dienantato de estradiol |  | C3, C17β | Ácido heptanoico (×2) | Ácido graso de cadena lineal | 7 (×2) | 1.82 | 0,55 | 8.1–10.4 | |
| Undecilato de estradiol |  | C17β | Ácido undecanoico | Ácido graso de cadena lineal | 11 | 1.62 | 0,62 | 9.2–9.8 | |
| Estearato de estradiol |  | C17β | Ácido octadecanoico | Ácido graso de cadena lineal | 18 | 1,98 | 0,51 | 12.2–12.4 | |
| Diestearato de estradiol |  | C3, C17β | Ácido octadecanoico (×2) | Ácido graso de cadena lineal | 18 (×2) | 2,96 | 0,34 | 20.2 | |
| Sulfato de estradiol |  | C3 | Ácido sulfúrico | Conjugado soluble en agua | – | 1.29 | 0,77 | 0,3–3,8 | |
| Glucurónido de estradiol |  | C17β | Ácido glucurónico | Conjugado soluble en agua | – | 1,65 | 0,61 | 2.1–2.7 | |
| Fosfato de estramustina d |  | C3, C17β | Normustina , ácido fosfórico | Conjugado soluble en agua | – | 1.91 | 0,52 | 2,9–5,0 | |
| Fosfato de poliestradiol e |  | C3–C17β | Ácido fosfórico | Conjugado soluble en agua | – | 1,23 f | 0,81 f | 2,9 gramos | |
| Notas al pie: a = Longitud del éster en átomos de carbono para ácidos grasos de cadena lineal o longitud aproximada del éster en átomos de carbono para ácidos grasos aromáticos o cíclicos . b = Contenido relativo de estradiol en peso (es decir, exposición estrogénica relativa). c = Coeficiente de reparto octanol/agua experimental o previsto (es decir, lipofilia / hidrofobicidad ). Obtenido de PubChem , ChemSpider y DrugBank . d = También conocido como fosfato de normustina de estradiol . e = Polímero de fosfato de estradiol (~13 unidades repetidas ). f = Peso molecular relativo o contenido de estradiol por unidad repetida. g = log P de la unidad repetida (es decir, fosfato de estradiol). Fuentes: Ver artículos individuales. | |||||||||
Historia
El EMP se sintetizó por primera vez a mediados de la década de 1960 y se patentó en 1967. [42] Inicialmente se desarrolló para el tratamiento del cáncer de mama . [1] La idea del EMP se inspiró en la captación y acumulación de estrógenos radiomarcados en el tejido del cáncer de mama. [1] Sin embargo, los hallazgos clínicos iniciales del EMP en mujeres con cáncer de mama fueron decepcionantes. [1] Posteriormente, se descubrió que el EMP radiomarcado se absorbía y acumulaba en la glándula prostática de la rata , y este hallazgo culminó en la reutilización del medicamento para el tratamiento del cáncer de próstata . [1] [3] El EMP se introdujo para uso médico en el tratamiento de esta afección a principios de la década de 1970 y se aprobó en los Estados Unidos para esta indicación en 1981. [1] [3] [55] El EMP se introdujo originalmente para su uso mediante inyección intravenosa. [31] Posteriormente, se introdujo una formulación oral y la preparación intravenosa casi se abandonó en favor de la versión oral. [31]
Sociedad y cultura
Nombres genéricos
El EMP se proporciona como sal sódica para administración oral , que tiene los nombres genéricos de fosfato sódico de estramustina ( USAN Descripción emergente Nombre adoptado por Estados Unidos) y fosfato sódico de estramustina ( BANM)Descripción emergente Nombre aprobado en Gran Bretaña, ENEDescripción emergente Nombre aceptado en japonés), y como sal de meglumina para administración intravenosa , que tiene el nombre genérico de fosfato de estramustina meglumina . [24] [35] [15] [56] [16] El INNMTooltip Nombre común internacionales fosfato de estramustina . [35] El nombre fosfato de estramustina es una contracción de fosfato de normustina de estradiol . [35] [16] EMP también se conoce por sus antiguos nombres de código de desarrollo Leo 299 , Ro 21-8837 y Ro 21-8837/001 . [35] [15] [16]
Nombres de marca
El EMP se comercializa más comúnmente bajo las marcas Estracyt y Emcyt, pero también se ha vendido bajo otras marcas, entre ellas Amsupros, Biasetyl, Cellmustin, Estramustin HEXAL, Estramustina Filaxis, Estranovag, Multosin, Multosin Injekt, Proesta, Prostamustin y Suloprost. [15] [16] [24]
Disponibilidad
EMP se comercializa en los Estados Unidos , [57] Canadá y México bajo la marca Emcyt, mientras que el medicamento se comercializa bajo la marca Estracyt en el Reino Unido y en otros lugares de Europa , así como en Argentina , Chile y Hong Kong . [15] Se ha descontinuado en varios países, incluidos Australia , Brasil , Irlanda y Noruega . [58]
Investigación
Se ha estudiado el EMP en el tratamiento de otros tipos de cáncer, como el glioma y el cáncer de mama . [1] Se ha descubierto que mejora ligeramente la calidad de vida de las personas con glioma durante los primeros 3 meses de terapia. [1]
Referencias
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo bp bq br bs bt bu bv bw bx by bz ca cb cc cd ce cf cg ch Bergenheim AT, Henriksson R (febrero de 1998). "Farmacocinética y farmacodinámica del fosfato de estramustina". Farmacocinética clínica . 34 (2): 163–172. doi :10.2165/00003088-199834020-00004. Número de modelo: PMID 9515186. Número de modelo: S2CID 1943973.
- ^ abcde Kuhl H (agosto de 2005). "Farmacología de los estrógenos y progestágenos: influencia de diferentes vías de administración". Climaterio . 8 (Supl. 1): 3–63. doi :10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar Kitamura T (febrero de 2001). "Necesidad de reevaluación del fosfato sódico de estramustina (EMP) como opción de tratamiento para la monoterapia de primera línea en el cáncer de próstata avanzado". Revista internacional de urología . 8 (2): 33–36. doi :10.1046/j.1442-2042.2001.00254.x. PMID 11240822. S2CID 43384150.
- ^ abcdefghijklmnopqrstu vwxyz Inoue T (2018). "El papel del fosfato de estramustina y otros estrógenos en el cáncer de próstata resistente a la castración". Terapia hormonal y resistencia a la castración del cáncer de próstata . Springer. págs. 249–256. doi :10.1007/978-981-10-7013-6_26. ISBN 978-981-10-7012-9.
- ^ abcdefghijklm Perry CM, McTavish D (julio de 1995). "Fosfato sódico de estramustina. Una revisión de sus propiedades farmacodinámicas y farmacocinéticas, y eficacia terapéutica en el cáncer de próstata". Drugs & Aging . 7 (1): 49–74. doi :10.2165/00002512-199507010-00006. PMID 7579781. S2CID 36725810.
- ^ abc "Dosis, indicaciones, interacciones, efectos adversos y más de Emcyt (estramustina)". Referencia de Medscape . WebMD . Consultado el 8 de febrero de 2014 .
- ^ abcdefghijkl "Cápsulas de fosfato sódico de estramustina Emcyt" (PDF) . FDA . Consultado el 14 de marzo de 2022 .
- ^ ab Qin Z, Li X, Zhang J, Tang J, Han P, Xu Z, et al. (septiembre de 2016). "Quimioterapia con o sin estramustina para el tratamiento del cáncer de próstata resistente a la castración: una revisión sistemática y un metanálisis". Medicina . 95 (39): e4801. doi :10.1097/MD.0000000000004801. PMC 5265899 . PMID 27684806.
- ^ abcdefgh Ravery V, Fizazi K, Oudard S, Drouet L, Eymard JC, Culine S, et al. (diciembre de 2011). "El uso de fosfato de estramustina en el tratamiento moderno del cáncer de próstata avanzado". BJU International . 108 (11): 1782–1786. doi :10.1111/j.1464-410X.2011.10201.x. PMID 21756277. S2CID 33456591.
- ^ abc Simpson D, Wagstaff AJ (2003). "Fosfato sódico de estramustina". Revista estadounidense del cáncer . 2 (5): 373–390. doi :10.2165/00024669-200302050-00013. S2CID 70507026.
- ^ Hudes G (febrero de 1997). "Quimioterapia basada en estramustina". Seminarios en oncología urológica . 15 (1): 13–19. PMID 9050135.
- ^ abcd Kreis W (1995). "Estramustine revisited". Conceptos, mecanismos y nuevos objetivos para la quimioterapia . Tratamiento e investigación del cáncer. Vol. 78. Springer. págs. 163–184. doi :10.1007/978-1-4615-2007-8_8. ISBN 978-1-4613-5829-9. Número PMID 8595142.
- ^ abc Galbraith SM, Duchesne GM (abril de 1997). "Andrógenos y cáncer de próstata: biología, patología y terapia hormonal". Revista Europea del Cáncer . 33 (4): 545–554. doi :10.1016/S0959-8049(96)00444-3. PMID 9274433.
- ^ abcdefgh Oettel M, Schillinger E (6 de diciembre de 2012). Estrógenos y antiestrógenos II: farmacología y aplicación clínica de estrógenos y antiestrógenos. Springer Science & Business Media. pp. 540–. ISBN 978-3-642-60107-1.
- ^ abcdefghijk Index Nominum 2000: Directorio internacional de medicamentos. Taylor y Francisco. Enero de 2000. págs. 406–407. ISBN 978-3-88763-075-1.
- ^ abcde "Usos, efectos secundarios y advertencias de la estramustina".
- ^ abcdefghij "Estracyt Capsules - Summary of Product Characteristics (RCP)" (Cápsulas de Estracyt: resumen de las características del producto [RCP]). Compendio electrónico de medicamentos . Pfizer Limited. 12 de agosto de 2013. Archivado desde el original el 22 de febrero de 2014. Consultado el 8 de febrero de 2014 .
- ^ Lupulescu A (24 de octubre de 1990). Hormonas y vitaminas en el tratamiento del cáncer. CRC Press. pp. 40–. ISBN 978-0-8493-5973-6.
- ^ abc Stella V, Borchardt R, Hageman M, Oliyai R, Maag H, Tilley J, eds. (12 de marzo de 2007). Profármacos: desafíos y recompensas. Medios de ciencia y negocios de Springer. págs. 174–. ISBN 978-0-387-49782-2.
- ^ Kitamura T, Suzuki M, Nishimatsu H, Kurosaki T, Enomoto Y, Fukuhara H, et al. (enero de 2010). "Informe final sobre monoterapia con fosfato de estramustina (EMP) en dosis bajas y terapia con EMP en dosis muy bajas combinada con agonista LH-RH para cáncer de próstata avanzado no tratado previamente". Aktuelle Urologie . 41 (Supl 1): S34–S40. doi :10.1055/s-0029-1224657. PMID 20094950. S2CID 7710924.
- ^ Sayed Y, Taxel P (diciembre de 2003). "El uso de la terapia con estrógenos en hombres". Current Opinion in Pharmacology . 3 (6): 650–654. doi :10.1016/j.coph.2003.07.004. PMID 14644018.
- ^ ab Hedlund PO, Henriksson P (marzo de 2000). "Ablación parenteral de estrógenos versus ablación total de andrógenos en el tratamiento del carcinoma de próstata avanzado: efectos sobre la supervivencia general y la mortalidad cardiovascular. Estudio de ensayo del Scandinavian Prostatic Cancer Group (SPCG)-5". Urología . 55 (3): 328–333. doi :10.1016/s0090-4295(99)00580-4. PMID 10699602.
- ^ Shimizu TS, Shibata Y, Jinbo H, Satoh J, Yamanaka H (1995). "Fosfato de estramustina para prevenir los brotes en la terapia de depósito con análogos de la hormona liberadora de hormona luteinizante". Urología europea . 27 (3): 192–195. doi :10.1159/000475159. PMID 7541359.
- ^ abcd Muller NF, Dessing RP, eds. (19 de junio de 1998). Índice europeo de medicamentos: Registros europeos de medicamentos (cuarta edición). CRC Press. págs. 245, 454. ISBN 978-3-7692-2114-5.
- ^ Becker KL (2001). Principios y práctica de endocrinología y metabolismo. Lippincott Williams & Wilkins. págs. 2153–. ISBN 978-0-7817-1750-2.
- ^ Tammela T (noviembre de 2004). "Tratamiento endocrino del cáncer de próstata". Revista de bioquímica de esteroides y biología molecular . 92 (4): 287–295. doi :10.1016/j.jsbmb.2004.10.005. PMID 15663992. S2CID 25425351.
- ^ Cox RL, Crawford ED (diciembre de 1995). "Estrógenos en el tratamiento del cáncer de próstata". The Journal of Urology . 154 (6): 1991–1998. doi :10.1016/S0022-5347(01)66670-9. PMID 7500443.
- ^ ab Lubiniecki GM, Berlin JA, Weinstein RB, Vaughn DJ (diciembre de 2004). "Eventos tromboembólicos con quimioterapia basada en fosfato de estramustina en pacientes con carcinoma de próstata refractario a hormonas: resultados de un metanálisis". Cancer . 101 (12): 2755–2759. doi :10.1002/cncr.20673. PMID 15536625. S2CID 21465413.
- ^ Fizazi K, Le Maitre A, Hudes G, Berry WR, Kelly WK, Eymard JC, et al. (noviembre de 2007). "Adición de estramustina a la quimioterapia y supervivencia de pacientes con cáncer de próstata resistente a la castración: un metaanálisis de datos de pacientes individuales". The Lancet. Oncología . 8 (11): 994–1000. doi :10.1016/S1470-2045(07)70284-X. PMID 17942366.
- ^ Petrioli R, Roviello G, Fiaschi AI, Laera L, Bianco V, Ponchietti R, et al. (octubre de 2015). "Fosfato de estramustina en dosis bajas y ácido acetilsalicílico en dosis bajas concomitante en pacientes con cáncer de próstata avanzado resistente a la castración que recibieron un tratamiento intensivo". Clinical Genitourinary Cancer . 13 (5): 441–446. doi :10.1016/j.clgc.2015.03.004. PMID 25920994.
- ^ abcdefghijklmnop Gunnarsson PO, Forshell GP (junio de 1984). "Farmacocinética clínica del fosfato de estramustina". Urología . 23 (6 Suppl): 22–27. doi :10.1016/S0090-4295(84)80093-X. PMID 6375076.
- ^ ab Alexander NC, Hancock AK, Masood MB, Peet BG, Price JJ, Turner RL, et al. (marzo de 1979). "Estracyt en carcinoma avanzado de mama: un estudio de fase II". Radiología clínica . 30 (2): 139–147. doi :10.1016/S0009-9260(79)80133-6. PMID 86404.
- ^ ab Daponte D, Sylvester R, De Pauw M, Fryszman A, Smith RM, Smith PH (agosto de 1983). "Cambio en el recuento de glóbulos blancos durante el tratamiento del cáncer avanzado de próstata con fosfato de estramustina y con estilbestrol". British Journal of Urology . 55 (4): 408–412. doi :10.1111/j.1464-410X.1983.tb03333.x. PMID 6349745.
- ^ "Cápsulas de fosfato sódico de estramustina Emcyt" (PDF) . FDA . Consultado el 14 de marzo de 2022 .
- ^ abcdefghij Elks J (14 de noviembre de 2014). Diccionario de fármacos: datos químicos: datos químicos, estructuras y bibliografías. Springer. págs. 502–503. ISBN 978-1-4757-2085-3.
- ^ ab Wang LG, Liu XM, Kreis W, Budman DR (mayo de 1998). "Efecto antagonista de los andrógenos de los metabolitos del fosfato de estramustina (EMP) en el receptor de andrógenos de tipo salvaje y mutado". Farmacología bioquímica . 55 (9): 1427–1433. doi : 10.1016/S0006-2952(97)00657-6 . PMID 10076535.
- ^ ab Van Poppel H, Werbrouck PW, Baert L (1990). "Efecto del fosfato de estramustina sobre los andrógenos libres. Un estudio comparativo del efecto de la orquiectomía y el fosfato de estramustina sobre los andrógenos libres en pacientes con cáncer de próstata". Acta Urologica Belgica . 58 (4): 89–95. PMID 2093302.
- ^ abc Karr JP, Wajsman Z, Kirdani RY, Murphy GP, Sandberg AA (agosto de 1980). "Efectos del dietilestilbestrol y el fosfato de estramustina en los niveles séricos de globulina transportadora de hormonas sexuales y testosterona en pacientes con cáncer de próstata". The Journal of Urology . 124 (2): 232–236. doi :10.1016/S0022-5347(17)55383-5. PMID 7190620.
- ^ Olson KB, Pienta KJ (mayo de 2000). "Avances recientes en quimioterapia para el cáncer de próstata avanzado". Current Urology Reports . 1 (1): 48–56. doi :10.1007/s11934-000-0035-z. PMID 12084341. S2CID 31084737.
- ^ ab Daehlin L, Damber JE, von Schoultz B, Bergman B (agosto de 1986). "Los efectos estrogénicos del fosfato de etinilestradiol/poliestradiol y del fosfato de estramustina en pacientes con carcinoma prostático. Un estudio comparativo de proteínas hepáticas sensibles al estrógeno, gonadotropinas y prolactina". British Journal of Urology . 58 (4): 412–416. doi :10.1111/j.1464-410X.1986.tb09095.x. PMID 3092893.
- ^ Fredholm, B., Jensen, G., Lindskog, M. y Muntzing, J. (1974, enero). Efectos del fosfato de estramustina (Estracyt) en el crecimiento de tumores mamarios inducidos por DMBA en ratas. En Acta Pharmacologica et Toxicologica (Vol. 35, págs. 28-28). 35 Norre Sogade, PO Box 2148, DK-1016 Copenhague, Dinamarca: Munksgaard Int Publ Ltd.
- ^ abc Punzi JS, Duax WL, Strong P, Griffin JF, Flocco MM, Zacharias DE, et al. (marzo de 1992). "Conformación molecular de la estramustina y dos análogos". Farmacología molecular . 41 (3): 569–576. PMID 1545778.
- ^ ab Hauser AR, Merryman R (mayo de 1984). "Fosfato sódico de estramustina". Drug Intelligence & Clinical Pharmacy . 18 (5): 368–374. doi :10.1177/106002808401800502. PMID 6373212. S2CID 25303747.
- ^ Tew KD, Stearns ME (1989). "Estramustina: una mostaza nitrogenada/esteroide con actividad antimicrotúbulos". Farmacología y terapéutica . 43 (3): 299–319. doi :10.1016/0163-7258(89)90012-0. PMID 2682681.
- ^ Cavalli F, Kaye SB, Hansen HH, Armitage JO, Piccart-Gebhart M, eds. (12 de septiembre de 2009). Libro de texto de Oncología Médica (Cuarta ed.). Prensa CRC. págs. 442–. ISBN 978-0-203-09289-7.
- ^ Gunnarsson O, Andersson SB, Johansson SA (1983). "La hidrólisis del fosfato de estramustina; estudios in vitro". Revista Europea de Metabolismo y Farmacocinética de Fármacos . 8 (4): 395–402. doi :10.1007/BF03188772. PMID 6673977. S2CID 22105700.
- ^ ab Ozeki T, Takeuchi M, Suzuki M, Kitamura T, Takayanagi R, Yokoyama H, Yamada Y (octubre de 2009). "Polimorfismos de un solo nucleótido del gen de la 17beta-hidroxiesteroide deshidrogenasa tipo 7: mecanismo de las reacciones adversas relacionadas con la estramustina". Revista Internacional de Urología . 16 (10): 836–841. doi :10.1111/j.1442-2042.2009.02374.x. PMID 19735314. S2CID 38350076.
- ^ ab Suzuki M, Muto S, Hara K, Ozeki T, Yamada Y, Kadowaki T, et al. (febrero de 2005). "Los polimorfismos de un solo nucleótido en los genes de la 17beta-hidroxiesteroide deshidrogenasa podrían predecir el riesgo de efectos secundarios del fosfato sódico de estramustina en pacientes con cáncer de próstata". Revista Internacional de Urología . 12 (2): 166–172. doi :10.1111/j.1442-2042.2005.01004.x. PMID 15733111. S2CID 71166897.
- ^ Gate L, Tew KD (2011). "Agentes alquilantes". Tratamiento del cáncer en el hombre: quimioterapia, terapia biológica, hipertermia y medidas de apoyo . Crecimiento y progresión del cáncer. Springer. págs. 61–85. doi :10.1007/978-90-481-9704-0_4. ISBN 978-90-481-9703-3.
- ^ "Estradiol" (PDF) . Abbott Laboratories . Noviembre de 2009. Archivado desde el original (PDF) el 2021-11-27 . Consultado el 20 de septiembre de 2018 .
- ^ Loftsson T (25 de enero de 2014). Estabilidad de fármacos para científicos farmacéuticos. Academic Press. pp. 77–. ISBN 978-0-12-411562-0.
- ^ Bernal S (21 de agosto de 1997). Resistencia a los fármacos en oncología. CRC Press. pp. 287–. ISBN 978-1-4200-0209-6.
- ^ Murff SJ (20 de febrero de 2012). Manual de seguridad y salud para fármacos citotóxicos. Institutos gubernamentales. pp. 89–. ISBN 978-1-60590-705-5.
- ^ ab "Fosfato de estramustina". PubChem . Biblioteca Nacional de Medicina de EE. UU.
- ^ Figg WD, Chau CH, Small EJ (14 de septiembre de 2010). Tratamiento farmacológico del cáncer de próstata. Springer Science & Business Media. pp. 402–. ISBN 978-1-60327-829-4.
- ^ Morton IK, Hall JM (6 de diciembre de 2012). Diccionario conciso de agentes farmacológicos: propiedades y sinónimos. Springer Science & Business Media. pp. 114–. ISBN 978-94-011-4439-1.
- ^ "Drugs@FDA: Productos farmacéuticos aprobados por la FDA". Administración de Alimentos y Medicamentos de los Estados Unidos . Consultado el 29 de enero de 2017 .
- ^ Sweetman, S, ed. (12 de febrero de 2013). "Fosfato sódico de estramustina". Martindale: The Complete Drug Reference. Londres, Reino Unido: Pharmaceutical Press . Consultado el 8 de febrero de 2014 .
Lectura adicional
- Tew KD (septiembre de 1983). "El mecanismo de acción de la estramustina". Seminarios de oncología . 10 (3 Suppl 3): 21–26. PMID 6364362.
- Hoisaeter PA, Bakke A (septiembre de 1983). "Fosfato de estramustina (Estracyt): estudios experimentales y clínicos en Europa". Seminarios en oncología . 10 (3 Suppl 3): 27–33. PMID 6364363.
- Sandberg AA (septiembre de 1983). "Aspectos metabólicos y acciones exclusivas de Estracyt". Seminars in Oncology . 10 (3 Suppl 3): 3–15. PMID 6364364.
- Haukaas SA (1984). "Efectos inmunológicos del dietilestilbestrol y el fosfato de estramustina". Revista escandinava de urología y nefrología. Suplemento . 83 : 1–32. PMID 6387896.
- Hauser AR, Merryman R (mayo de 1984). "Fosfato sódico de estramustina". Drug Intelligence & Clinical Pharmacy . 18 (5): 368–374. doi :10.1177/106002808401800502. PMID 6373212. S2CID 25303747.
- Sandberg AA (junio de 1984). "Parámetros metabólicos de Estracyt relacionados con sus efectos en el cáncer de próstata". Urología . 23 (6 Suppl): 11–21. doi :10.1016/S0090-4295(84)80092-8. PMID 6375075.
- Gunnarsson PO, Forshell GP (junio de 1984). "Farmacocinética clínica del fosfato de estramustina". Urología . 23 (6 Suppl): 22–27. doi :10.1016/S0090-4295(84)80093-X. PMID 6375076.
- Forsgren B, Björk P (junio de 1984). "Unión específica de la estramustina a las proteínas prostáticas". Urología . 23 (6 Suppl): 34–38. doi :10.1016/S0090-4295(84)80095-3. PMID 6375077.
- Kalland T, Haukaas SA (junio de 1984). "Efectos inmunológicos del fosfato de estramustina". Urología . 23 (6 Suppl): 39–45. doi :10.1016/S0090-4295(84)80096-5. PMID 6375078.
- Høisaeter PA (junio de 1984). "Modo de acción de Emcyt". Urología . 23 (6 Suppl): 46–48. doi :10.1016/S0090-4295(84)80097-7. PMID 6375079.
- Müntzing J, Gunnarsson K (junio de 1984). "Farmacología preclínica y toxicología del fosfato de estramustina". Urología . 23 (6 Suppl): 6–10. doi :10.1016/S0090-4295(84)80091-6. PMID 6375082.
- Slack NH, Murphy GP (junio de 1984). "Toxicidad clínica y resultados a largo plazo de la terapia con Emcyt para el cáncer de próstata". Urología . 23 (6 Suppl): 73–77. doi :10.1016/S0090-4295(84)80103-X. PMID 6375085.
- Hedlund PO (1985). "Modo de acción del fosfato de estramustina en el cáncer de próstata hormonodependiente y hormonodependiente". Progreso en la investigación clínica y biológica . 185A : 197–202. PMID 3898129.
- Hedlund PO (1987). "Estracyt: modo de acción y experiencia clínica". Progreso en la investigación clínica y biológica . 243B : 215–219. PMID 3309981.
- Murphy GP (1987). "Una revisión actual de la experiencia clínica con Estracyt". Progreso en la investigación clínica y biológica . 243B : 221–225. PMID 3309982.
- Forsgren B (1988). "Proteína de unión a estramustina en próstata humana y de rata". Revista escandinava de urología y nefrología. Suplemento . 107 : 56–58. PMID 3287598.
- Tew KD, Stearns ME (1989). "Efectos intracelulares de la estramustina (Estracyt/Emcyt)". Progreso en la investigación clínica y biológica . 303 : 169–175. PMID 2674983.
- Tew KD, Stearns ME (1989). "Estramustina: una mostaza nitrogenada/esteroide con actividad antimicrotúbulos". Farmacología y terapéutica . 43 (3): 299–319. doi :10.1016/0163-7258(89)90012-0. PMID 2682681.
- Könyves I (1989). "Fosfato de estramustina (Estracyt) en el tratamiento del carcinoma prostático". Urología y Nefrología Internacional . 21 (4): 393–397. doi :10.1007/BF02559635. PMID 2693392. S2CID 9727646.
- Benson R, Hartley-Asp B (1990). "Mecanismos de acción y usos clínicos de la estramustina". Cancer Investigation . 8 (3–4): 375–380. doi :10.3109/07357909009012056. PMID 2207764.
- Van Poppel H, Baert L (1991). "El papel actual del fosfato de estramustina en el cáncer de próstata avanzado". Progreso en la investigación clínica y biológica . 370 : 323–341. PMID 1924466.
- Janknegt RA (1992). "Fosfato de estramustina y otros fármacos citotóxicos en el tratamiento del cáncer de próstata avanzado de mal pronóstico". The Prostate. Supplement . 4 : 105–110. doi :10.1002/pros.2990210516. PMID 1574449. S2CID 40562112.
- Tew KD, Glusker JP, Hartley-Asp B, Hudes G, Speicher LA (diciembre de 1992). "Perspectivas preclínicas y clínicas sobre el uso de estramustina como fármaco antimitótico". Farmacología y terapéutica . 56 (3): 323–339. doi :10.1016/0163-7258(92)90023-S. PMID 1301594.
- Kreis W (1995). "Estramustine revisited". Conceptos, mecanismos y nuevos objetivos para la quimioterapia . Tratamiento e investigación del cáncer. Vol. 78. Springer. págs. 163–184. doi :10.1007/978-1-4615-2007-8_8. ISBN 978-1-4613-5829-9. Número PMID 8595142.
- Perry CM, McTavish D (julio de 1995). "Fosfato sódico de estramustina. Una revisión de sus propiedades farmacodinámicas y farmacocinéticas, y eficacia terapéutica en el cáncer de próstata". Drugs & Aging . 7 (1): 49–74. doi :10.2165/00002512-199507010-00006. PMID 7579781. S2CID 36725810.
- Hudes G (febrero de 1997). "Quimioterapia basada en estramustina". Seminarios en oncología urológica . 15 (1): 13–19. PMID 9050135.
- Bergenheim AT, Henriksson R (febrero de 1998). "Farmacocinética y farmacodinámica del fosfato de estramustina". Farmacocinética clínica . 34 (2): 163–172. doi :10.2165/00003088-199834020-00004. PMID 9515186. S2CID 1943973.
- Kitamura T (febrero de 2001). "Necesidad de reevaluar el fosfato sódico de estramustina (EMP) como opción de tratamiento para la monoterapia de primera línea en el cáncer de próstata avanzado". Revista Internacional de Urología . 8 (2): 33–36. doi :10.1046/j.1442-2042.2001.00254.x. PMID 11240822. S2CID 43384150.
- Ravery V, Fizazi K, Oudard S, Drouet L, Eymard JC, Culine S, et al. (diciembre de 2011). "El uso de fosfato de estramustina en el tratamiento moderno del cáncer de próstata avanzado". BJU International . 108 (11): 1782–1786. doi :10.1111/j.1464-410X.2011.10201.x. PMID 21756277. S2CID 33456591.
- Qin Z, Li X, Zhang J, Tang J, Han P, Xu Z, et al. (septiembre de 2016). "Quimioterapia con o sin estramustina para el tratamiento del cáncer de próstata resistente a la castración: una revisión sistemática y un metanálisis". Medicina . 95 (39): e4801. doi :10.1097/MD.0000000000004801. PMC 5265899 . PMID 27684806.