Carbamato
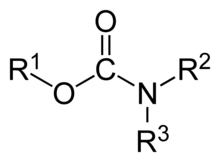
En química orgánica , un carbamato es una categoría de compuestos orgánicos con la fórmula general R 2 NC(O)OR y estructura >N−C(=O)−O− , que se derivan formalmente del ácido carbámico ( NH 2 COOH ). El término incluye compuestos orgánicos (por ejemplo, el éster carbamato de etilo ), obtenidos formalmente al reemplazar uno o más de los átomos de hidrógeno por otros grupos funcionales orgánicos ; así como sales con el anión carbamato H 2 NCOO − (por ejemplo, carbamato de amonio ). [1]
Los polímeros cuyas unidades repetidas están unidas por grupos tipo carbamato −NH−C(=O)−O− son una familia importante de plásticos , los poliuretanos . Véase § Etimología para mayor claridad.
Propiedades
Si bien los ácidos carbámicos son inestables, muchos ésteres y sales de carbamato son estables y bien conocidos. [2]
Equilibrio con carbonato y bicarbonato
En soluciones acuosas, el anión carbamato se equilibra lentamente con el amonio NH+
4catión y el carbonato CO2−
3o bicarbonato HCO−
3aniones: [3] [4] [5]
- Suboficial H2−2 + 2 H2O ⇌ NH+4 + HCO−3+ OH-
- Suboficial H2−2 + H2O⇌NH+4 + CO2−3
El carbamato de calcio es soluble en agua, mientras que el carbonato de calcio no lo es. Si se añade una sal de calcio a una solución de carbamato/carbonato de amonio, precipitará inmediatamente una parte del carbonato de calcio y luego precipitará lentamente más a medida que el carbamato se hidroliza. [3]
Síntesis
Sales de carbamato
La sal de carbamato de amonio se genera mediante el tratamiento del amoníaco con dióxido de carbono : [6]
- 2 NH 3 + CO 2 → NH 4 [H 2 NCO 2 ]
Ésteres de carbamato
Los ésteres de carbamato también surgen a través de la alcoholisis de cloruros de carbamoilo : [1]
- R2NC (O)Cl + R'OH → R2NCO2R ' + HCl
Alternativamente, los carbamatos pueden formarse a partir de cloroformiatos y aminas : [7]
- R'OC(O)Cl + R2NH → R2NCO2R ' + HCl
Los carbamatos pueden formarse a partir del reordenamiento de Curtius , donde los isocianatos formados reaccionan con un alcohol. [7]
- RCON 3 → RNCO + N 2
- RNCO + R′OH → RNHCO 2 R′
Ocurrencia natural
En la naturaleza, el dióxido de carbono puede unirse a grupos amino neutros para formar un carbamato; esta modificación postraduccional se conoce como carbamilación. Se sabe que esta modificación ocurre en varias proteínas importantes; véanse los ejemplos a continuación. [8]
Hemoglobina
Los grupos amino del extremo N de los residuos de valina en las cadenas α y β de la desoxihemoglobina existen como carbamatos. Ayudan a estabilizar la proteína cuando se convierte en desoxihemoglobina y aumentan la probabilidad de liberación de las moléculas de oxígeno restantes unidas a la proteína. Este efecto estabilizador no debe confundirse con el efecto Bohr (un efecto indirecto causado por el dióxido de carbono). [9]
Ureasa y fosfotriesterasa
Los grupos ε-amino de los residuos de lisina en la ureasa y la fosfotriesterasa también contienen carbamato. El carbamato derivado del aminoimidazol es un intermediario en la biosíntesis de la inosina . El fosfato de carbamoilo se genera a partir de carboxifosfato en lugar de CO 2 . [10]
CO2captura por ribulosa 1,5-bisfosfato carboxilasa
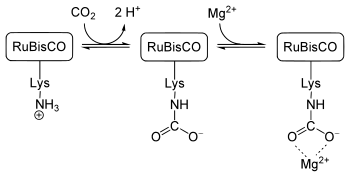
Quizás el carbamato más frecuente es el que participa en la captura de CO2 por las plantas. Este proceso es necesario para su crecimiento. La enzima ribulosa 1,5-bisfosfato carboxilasa/oxigenasa (RuBisCO) fija una molécula de dióxido de carbono como fosfoglicerato en el ciclo de Calvin . En el sitio activo de la enzima, un ion Mg2 + está unido a residuos de glutamato y aspartato, así como a un carbamato de lisina. El carbamato se forma cuando una cadena lateral de lisina sin carga cerca del ion reacciona con una molécula de dióxido de carbono del aire ( no la molécula de dióxido de carbono del sustrato), que luego la carga y, por lo tanto, es capaz de unirse al ion Mg2 + . [11]
Aplicaciones
Síntesis de urea
Aunque no suele aislarse como tal, la sal carbamato de amonio se produce a gran escala como intermediario en la producción del producto químico urea a partir de amoníaco y dióxido de carbono . [1]
Plásticos de poliuretano
Los poliuretanos contienen múltiples grupos carbamato como parte de su estructura. El "uretano" en el nombre "poliuretano" se refiere a estos grupos carbamato; el término "enlaces de uretano" describe cómo se polimerizan los carbamatos . [Requiere cita] Por el contrario, la sustancia comúnmente llamada "uretano", carbamato de etilo , no es un componente de los poliuretanos, ni se utiliza en su fabricación. [Requiere cita] Los uretanos se forman generalmente por reacción de un alcohol con un isocianato . [Requiere cita] Comúnmente, los uretanos fabricados por una ruta sin isocianato se denominan carbamatos . [Requiere cita]
Los polímeros de poliuretano tienen una amplia gama de propiedades y están disponibles comercialmente como espumas, elastómeros y sólidos. Normalmente, los polímeros de poliuretano se fabrican combinando diisocianatos, por ejemplo, diisocianato de tolueno , y dioles , donde los grupos carbamato se forman por reacción de los alcoholes con los isocianatos : [12]
- RN=C=O + R′OH → RNHC(O)OR′
Insecticidas carbamatos
Los insecticidas denominados carbamatos contienen el grupo funcional éster carbamato. En este grupo se incluyen aldicarb ( Temik ), carbofurano (Furadan), carbaril (Sevin), etienocarb , fenobucarb , oxamil y metomilo . Estos insecticidas matan a los insectos inactivando reversiblemente la enzima acetilcolinesterasa (inhibición de la AChE) [13] ( modo de acción IRAC 1a). [14] Los pesticidas organofosforados también inhiben esta enzima, aunque de forma irreversible, y causan una forma más grave de intoxicación colinérgica [15] (el similar MoA IRAC 1b). [14]
El fenoxicarb tiene un grupo carbamato pero actúa como un imitador de la hormona juvenil , en lugar de inactivar la acetilcolinesterasa. [16]
El repelente de insectos icaridina es un carbamato sustituido. [17]
Además de su uso común como artropodocidas/insecticidas, también son nematicidas . [18] Uno de ellos es el Oxamyl . [18]
Las ventas han disminuido drásticamente en las últimas décadas. [18]
Resistencia
Entre las mutaciones en las esterasas , la resistencia al carbamato implica más comúnmente la desensibilización a la acetilcolinesterasa (AChE), mientras que la resistencia a los organofosforados es más comúnmente la metabolización de la carboxilesterasa . [19]
Agentes nerviosos de tipo carbamato
Aunque los inhibidores de la acetilcolinesterasa de carbamato se conocen comúnmente como "insecticidas de carbamato" debido a su selectividad generalmente alta para las enzimas de acetilcolinesterasa de insectos sobre las versiones de mamíferos, los compuestos más potentes como el aldicarb y el carbofurano aún son capaces de inhibir las enzimas de acetilcolinesterasa de mamíferos en concentraciones lo suficientemente bajas como para representar un riesgo significativo de envenenamiento para los humanos, especialmente cuando se usan en grandes cantidades para aplicaciones agrícolas. Se sabe que otros inhibidores de la acetilcolinesterasa basados en carbamato tienen una toxicidad aún mayor para los humanos, y algunos como el T-1123 y el EA-3990 se investigaron para su posible uso militar como agentes nerviosos . Sin embargo, dado que todos los compuestos de este tipo tienen un grupo de amonio cuaternario con una carga positiva permanente, tienen una pobre penetración de la barrera hematoencefálica y también son estables solo como sales cristalinas o soluciones acuosas, por lo que no se consideró que tuvieran propiedades adecuadas para su uso como arma. [20] [21]
Conservantes y cosméticos
El butilcarbamato de yodopropinilo es un conservante de madera y pintura y se utiliza en cosméticos. [22]
Investigación química
Algunos de los grupos protectores de amina más comunes, como BOC , [23] FMOC , [24] cloroformiato de bencilo [25] y cloroformiato de tricloroetilo [26] son carbamatos.
Medicamento
Carbamato de etilo
El uretano ( carbamato de etilo ) se producía comercialmente en Estados Unidos como agente quimioterapéutico y para otros fines medicinales, pero se descubrió que era tóxico y en gran medida ineficaz. [27] Ocasionalmente se utiliza en medicina veterinaria en combinación con otros fármacos para producir anestesia . [28]
Medicamentos carbamatos
Además, algunos carbamatos se utilizan en la farmacoterapia humana , por ejemplo, los inhibidores de la acetilcolinesterasa neostigmina y rivastigmina , cuya estructura química se basa en el alcaloide natural fisostigmina . Otros ejemplos son el meprobamato y sus derivados como el carisoprodol , el felbamato , el mebutamato , el fenprobamato y el tibamato , una clase de fármacos ansiolíticos y relajantes musculares ampliamente utilizados en la década de 1960 antes del surgimiento de las benzodiazepinas, y que todavía se utilizan hoy en día en algunos casos. El carbacol se utiliza principalmente para diversos fines oftálmicos. [29]
El inhibidor de proteasa darunavir para el tratamiento del VIH también contiene un grupo funcional carbamato. [30]
El efedroxano , un análogo del aminorex utilizado como estimulante , también entra en la categoría de los carbamatos. [31]
Toxicidad
Además de inhibir la acetilcolinesterasa humana [32] (aunque en menor grado que la enzima de los insectos), los insecticidas a base de carbamatos también se dirigen a los receptores de melatonina humanos. [33] Los efectos de los carbamatos sobre la salud humana están bien documentados en la lista de compuestos disruptores endocrinos conocidos. [34] Los efectos clínicos de la exposición a los carbamatos pueden variar de ligeramente tóxicos a altamente tóxicos dependiendo de una variedad de factores, incluyendo la dosis y la vía de exposición, siendo la ingestión y la inhalación las que producen los efectos clínicos más rápidos. [34] Estas manifestaciones clínicas de la intoxicación por carbamatos son signos muscarínicos, signos nicotínicos y, en casos raros, signos del sistema nervioso central. [34]
Análogos del azufre
Hay dos átomos de oxígeno en un carbamato ( 1 ), ROC(=O)NR 2 , y uno o ambos de ellos pueden ser reemplazados conceptualmente por azufre . Los análogos de carbamatos con solo uno de los oxígenos reemplazado por azufre se denominan tiocarbamatos ( 2 y 3 ). Los carbamatos con ambos oxígenos reemplazados por azufre se denominan ditiocarbamatos ( 4 ), RSC(=S)NR 2 . [35]
Existen dos tipos diferentes de tiocarbamato estructuralmente isoméricos :
- O -tiocarbamatos ( 2 ), ROC(=S)NR 2 , donde el grupo carbonilo (C=O) se reemplaza por un grupo tiocarbonilo (C=S) [36]
- S -tiocarbamatos ( 3 ), RSC(=O)NR 2 , donde el grupo R–O– se reemplaza por un grupo R–S– [36]
Los O -tiocarbamatos pueden isomerizarse a S -tiocarbamatos, por ejemplo en el reordenamiento de Newman-Kwart . [37]
Etimología
La etimología de las palabras "uretano" y "carbamato" son muy similares, pero no son iguales. La palabra "uretano" fue acuñada por primera vez en 1833 por el químico francés Jean-Baptiste Dumas. [38] [39] Dumas afirma: "Uretano. El nuevo éter, puesto en contacto con amoníaco líquido y concentrado, ejerce sobre esta sustancia una reacción tan fuerte que la mezcla hierve, y a veces incluso produce una especie de explosión. Si el amoníaco está en exceso, todo el éter desaparece. Forma clorhidrato de amonio y una nueva sustancia dotada de propiedades interesantes". [39] Dumas parece estar nombrando este compuesto uretano. Sin embargo, más tarde Dumas afirma: "Mientras espero que se decida la naturaleza de este cuerpo, propongo designar con los nombres de uretano y oxametano los dos materiales que acabo de estudiar, y que considero como tipos de una nueva familia, entre las sustancias nitrogenadas . Estos nombres que, a mis ojos, no prejuzgan nada en la cuestión del alcohol y los éteres, tendrán al menos la ventaja de satisfacer a los químicos que todavía se niegan a aceptar nuestra teoría". [39] La palabra uretano se deriva de las palabras "urea" y "éter" con el sufijo "-ano" como sufijo químico genérico, lo que lo hace específico para la estructura de enlace R2NC(=O)OR' (R' not = H). [40]
El uso de la palabra "carbamato" parece ser posterior, ya que sólo se remonta al menos a 1849, en una descripción de la obra de Dumas por parte de Henry Medlock. [41] Medlock afirma: "Es bien sabido que la acción del amoníaco sobre el clorocarbonato (fosgeno) de etilo da lugar a la formación de la sustancia que Dumas, el descubridor, llamó uretano, y que ahora tenemos la costumbre de considerar como el éter del ácido carbámico". [41] Esto sugiere que en lugar de continuar con la convención de nomenclatura de la familia del uretano acuñada por Dumas, modificaron la convención de nomenclatura a éter etílico del ácido carbámico. El carbamato se deriva de las palabras "carbamida", también conocida como urea, y "-ato", un sufijo que indica la sal o el éster de un ácido. [42] [43]
Ambas palabras tienen raíces derivadas de urea. Carbamato es menos específico porque el sufijo -ato es ambiguo tanto para la sal como para el éster de un ácido carbámico. Sin embargo, el sufijo -ato también es más específico porque sugiere que los carbamatos deben derivarse del ácido del carbamato, o ácidos carbámicos . Aunque un uretano tiene la misma estructura química que una fracción de éster de carbamato, un uretano que no deriva de un ácido carbámico no es un éster de carbamato. En otras palabras, cualquier síntesis de la fracción R2NC(=O)OR' (R' no = H) que no derive de ácidos carbámicos no es un éster de carbamato sino un uretano. Además, los ésteres de carbamato son uretanos, pero no todos los uretanos son ésteres de carbamato. Esto sugiere además que los poliuretanos no son simplemente ésteres de policarbamato porque los poliuretanos no se sintetizan típicamente utilizando ácidos carbámicos.
La IUPAC afirma: "Los ésteres a menudo se denominan uretanos, un uso que es estrictamente correcto solo para los ésteres etílicos". [44] Pero también afirma: "Un término alternativo para los compuestos R2NC(=O)OR' (R' no = H), ésteres de ácidos carbámicos, R,NC(=O)OH, en uso estricto limitado a los ésteres etílicos, pero ampliamente utilizado en el sentido general". [45] La IUPAC proporciona estas declaraciones sin citarlas.
Véase también
Referencias
- ^ abc Jäger, Peter; Rentzea, Costin N.; Kieczka, Heinz (2000). "Carbamatos y cloruros de carbamoilo". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a05_051. ISBN. 3-527-30673-0.
- ^ Ghosh, Arun K.; Brindisi, Margherita (9 de abril de 2015). "Carbamatos orgánicos en el diseño de fármacos y la química medicinal". Revista de química medicinal . 58 (7): 2895–2940. doi :10.1021/jm501371s. ISSN 0022-2623. PMC 4393377 . PMID 25565044.
- ^ ab Burrows, George H.; Lewis, Gilbert N. (1912). "El equilibrio entre carbonato de amonio y carbamato de amonio en solución acuosa a 25°". Revista de la Sociedad Química Americana . 34 (8): 993–995. doi :10.1021/ja02209a003.
- ^ Clark, KG; Gaddy, VL; Rist, CE (1933). "Equilibrios en el sistema de carbamato de amonio-urea-agua". Ind. Eng. Chem. 25 (10): 1092–1096. doi :10.1021/ie50286a008.
- ^ Mani, Fabricio; Peruzzini, Mauricio; Stoppioni, Piero (2006). "Absorción de CO2 por NH acuoso
3Soluciones: especiación de carbamato, bicarbonato y carbonato de amonio mediante un13
Estudio de RMN de 13 C ". Química verde . 8 (11). Royal Society of Chemistry : 995. doi :10.1039/b602051h. ISSN 1463-9262. - ^ Brooks, LA; Audrieta, LF; Bluestone, H.; Jofinsox, WC (1946). "Carbamato de amonio". Síntesis inorgánica . Vol. 2. págs. 85-86. doi :10.1002/9780470132333.ch23. ISBN . 978-0-470-13233-3.
- ^ ab Chaturvedi, Devdutt (1 de mayo de 2011). "Desarrollos recientes en la carbamación de aminas". Química orgánica actual . 15 (10). Bentham Science Publishers Ltd. : 1593–1624. doi :10.2174/138527211795378173. ISSN 1385-2728.
- ^ Linthwaite, Victoria L.; Janus, Joanna M.; Brown, Adrian P.; Wong-Pascua, David; O'Donoghue, AnnMarie C.; Porter, Andrew; Treumann, Achim; Hodgson, David RW; Cann, Martin J. (6 de agosto de 2018). "La identificación de modificaciones postraduccionales de proteínas mediadas por dióxido de carbono". Nature Communications . 9 (1): 3092. Bibcode :2018NatCo...9.3092L. doi :10.1038/s41467-018-05475-z. ISSN 2041-1723. PMC 6078960 . PMID 30082797.
- ^ Ferguson, JKW; Roughton, FJW (14 de diciembre de 1934). "La estimación química directa de compuestos carbamino de CO2 con hemoglobina". Revista de fisiología . 83 (1): 68–86. doi :10.1113/jphysiol.1934.sp003212. ISSN 0022-3751. PMC 1394306 . PMID 16994615.
- ^ Bartoschek, S.; Vorholt, JA; Thauer, RK; Geierstanger, BH; Griesinger, C. (2001). "Formación de N-carboximetanofurano (carbamato) a partir de metanofurano y CO2 en arqueas metanogénicas: termodinámica y cinética de la reacción espontánea". Eur. J. Biochem. 267 (11): 3130–3138. doi : 10.1046/j.1432-1327.2000.01331.x . PMID 10824097.
- ^ T, Lundqvist; G, Schneider (29 de enero de 1991). "Estructura cristalina del complejo ternario de ribulosa-1,5-bisfosfato carboxilasa, Mg(II) y activador CO2 a una resolución de 2,3 A". Bioquímica . 30 (4): 904–8. doi :10.1021/bi00218a004. PMID 1899197.
- ^ Adán, Norberto; Ávar, Geza; Blankenheim, Herbert; Friedrichs, Wolfgang; Giersig, Manfred; Weigand, Eckehard; Halfmann, Michael; Wittbecker, Friedrich-Wilhelm; Larimer, Donald-Richard; Maier, Udo; Meyer-Ahrens, Sven; Noble, Karl-Ludwig; Wussow, Hans-Georg (2005). "Poliuretanos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a21_665.pub3. ISBN 978-3-527-30673-2.
- ^ Fukuto, TR (1990). "Mecanismo de acción de los insecticidas organofosforados y carbamatos". Environmental Health Perspectives . 87 : 245–254. doi :10.1289/ehp.9087245. PMC 1567830 . PMID 2176588.
- ^ ab "Esquema de clasificación del modo de acción del IRAC, versión 9.4" (pdf). Comité de Acción de Resistencia a los Insecticidas . Marzo de 2020.
- ^ Metcalf, Robert L. "Control de insectos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a14_263. ISBN 978-3527306732.
- ^ "Proyecto de información sobre pesticidas: fenoxicarb". Universidad de Cornell . Consultado el 15 de junio de 2019 .
- ^ Centro Nacional de Información Biotecnológica. "Resumen de compuestos de PubChem para CID 125098, icaridina". Pubchem . Consultado el 8 de enero de 2024 .
- ^ abc Sparks, Thomas; Crossthwaite, Andrew; Nauen, Ralf; Banba, Shinichi; Cordova, Daniel; Earley, Fergus; Ebbinghaus-Kintscher, Ulrich; Fujioka, Shinsuke; Hirao, Ayako; Karmon, Danny; Kennedy, Robert; Nakao, Toshifumi; Popham, Holly; Salgado, Vincent; Watson, Gerald; Wedel, Barbara; Wessels, Frank (2020). "Insecticidas, productos biológicos y nematicidas: actualizaciones de la clasificación del modo de acción del IRAC: una herramienta para el manejo de la resistencia". Bioquímica y fisiología de pesticidas . 167 . Elsevier : 104587. Bibcode :2020PBioP.16704587S. doi : 10.1016/j.pestbp.2020.104587 . Revista de Biología Molecular y Genética .
- ^ Oakeshott, John; Devonshire, Alan; Claudianos, Charles; Sutherland, Tara; Horne, Irene; Campbell, Peter; Ollis, David; Russell, Robyn (2005). "Comparación de las mutaciones de resistencia a insecticidas organofosforados y carbamatos en colina y carboxil esterasas". Interacciones químico-biológicas . 157–158. Elsevier BV : 269–275. Bibcode :2005CBI...157..269O. doi :10.1016/j.cbi.2005.10.041. ISSN 0009-2797. PMID 16289012. S2CID 32597626.
- ^ Gupta, Ramesh C, ed. (2015). Manual de toxicología de agentes de guerra química. Cambridge, Massachusetts, Estados Unidos: Academic Press. pp. 338–339. ISBN 978-0-12-800494-4.
- ^ Ellison, D (2008). Manual de agentes de guerra química y biológica . Boca Raton: CRC Press. ISBN 978-0-8493-1434-6.OCLC 82473582 .
- ^ Badreshia, S. (2002). "Butilcarbamato de yodopropinilo". Soy. J. Póngase en contacto con Dermat. 13 (2): 77–79. doi :10.1053/ajcd.2002.30728. ISSN 1046-199X. PMID 12022126.
- ^ Vommina V. Sureshbabu; Narasimhamurthy Narendra (2011). "Reacciones de protección". En Andrew B. Hughes (ed.). Reacciones de protección, química medicinal, síntesis combinatoria . Aminoácidos, péptidos y proteínas en química orgánica. Vol. 4. Wiley-VCH . págs. XVIII–LXXXIV. doi :10.1002/9783527631827.ch1. ISBN . 9783527641574.
- ^ Wellings, Donald A.; Atherton, Eric (1997). "[4] Protocolos estándar de Fmoc". Síntesis de péptidos en fase sólida . Métodos en enzimología. Vol. 289. págs. 44–67. doi :10.1016/s0076-6879(97)89043-x. ISBN 9780121821906. Número de identificación personal 9353717.
- ^ Katsoyannis, PG, ed. (1973). La química de los polipéptidos. Nueva York: Plenum Press. doi :10.1007/978-1-4613-4571-8. ISBN 978-1-4613-4571-8. S2CID 35144893. Archivado desde el original el 13 de octubre de 2022. Consultado el 1 de abril de 2021 .
- ^ Marullo, NP; Wagener, EH (1 de enero de 1969). "Química orgánica estructural por RMN. III. Isomerización de compuestos que contienen el doble enlace carbono-nitrógeno". Tetrahedron Letters . 10 (30): 2555–2558. doi :10.1016/S0040-4039(01)88566-X.
- ^ Holland, JR; Hosley, H.; Scharlau, C.; Carbone, PP; Frei, E. III; Brindley, CO; Hall, TC; Shnider, BI; Gold, GL; Lasagna, L.; Owens, AH Jr; Miller, SP (1 de marzo de 1966). "Un ensayo controlado de tratamiento con uretano en el mieloma múltiple". Sangre . 27 (3): 328–42. doi : 10.1182/blood.V27.3.328.328 . ISSN 0006-4971. PMID 5933438.
- ^ Sección de Seguridad Química y Biológica (CBSS) de la Oficina de Salud y Seguridad Ambiental. "Trabajar con uretano" (PDF) . Virginia Commonwealth University. Archivado desde el original (PDF) el 11 de mayo de 2013.
- ^ Información para el consumidor de Carbachol Multum . Consultado el 27 de abril de 2021.
- ^ DrugBank DB01264 . Consultado el 27 de abril de 2021.
- ^ Hikino H, Ogata K, Kasahara Y, Konno C (mayo de 1985). "Farmacología de los efedroxanos". Revista de Etnofarmacología . 13 (2): 175-191. doi :10.1016/0378-8741(85)90005-4. PMID 4021515.
- ^ Colovic, MB; Krstic, DZ; Lazarević-Pašti, TD; Bondžić, AM; Vasić, VM (2013). "Inhibidores de la acetilcolinesterasa: farmacología y toxicología". Curr Neurofarmacol . 11 (3): 315–35. doi :10.2174/1570159X11311030006. PMC 3648782 . PMID 24179466.
- ^ Popovska-Gorevski, M; Dubocovich, ML; Rajnarayanan, RV (2017). "Insecticidas de carbamatos dirigidos a los receptores humanos de melatonina". Chem Res Toxicol . 30 (2): 574–582. doi :10.1021/acs.chemrestox.6b00301. PMC 5318275 . PMID 28027439.
- ^ abc Marais, Simone; Diase, Elsa; Pereira, Maria de Lourdes (2012). "Carbamatos: exposición humana y efectos sobre la salud". El impacto de los pesticidas . 21 : 38 – vía Research Gate.
- ^ Rüdiger Schubart (2000). "Ácido ditiocarbámico y derivados". Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi :10.1002/14356007.a09_001. ISBN 3-527-30673-0.
- ^ ab Walter, W.; Bode, K.-D. (Abril de 1967). "Síntesis de tiocarbamatos". Angewandte Chemie Edición Internacional en inglés . 6 (4): 281–293. doi :10.1002/anie.196702811.
- ^ Newman, Melvin S.; Hetzel, Frederick W. (1971). "Tiofenoles a partir de fenoles: 2-naftalenotiol ". Org. Synth . 51 : 139. doi :10.15227/orgsyn.051.0139.
- ^ Diccionario de química . John Daintith (6.ª ed.). Nueva York: Oxford University Press. 2008. ISBN 978-1-61583-965-0.OCLC 713875281 .
{{cite book}}: Mantenimiento de CS1: otros ( enlace ) - ^ abc Dumas, Jean (1833). "Búsquedas de chimenea orgánica". Annales de Chimie et de Physique . 2da serie. 56 : 496–556.
- ^ "uretano | Etimología, origen y significado de uretano por etymonline". www.etymonline.com . Consultado el 29 de marzo de 2023 .
- ^ ab Medlock, Henry (1849). "XXIX.—Investigaciones sobre la serie amilo". QJ Chem. Soc. 1 (4): 368–379. doi :10.1039/qj8490100368. ISSN 1743-6893.
- ^ "Definición de CARBAMATO". www.merriam-webster.com . Consultado el 29 de marzo de 2023 .
- ^ Divers, Edward (1870-01-01). "XXVII.—Sobre la precipitación de soluciones de carbonato de amonio, carbonato de sodio y carbamato de amonio mediante cloruro de calcio". Journal of the Chemical Society . 23 : 359–364. doi :10.1039/JS8702300359. ISSN 0368-1769.
- ^ "Carbamatos (C00803)". Goldbook. IUPAC. doi :10.1351/goldbook.C00803 . Consultado el 29 de marzo de 2023 .
- ^ Moss, GP; Smith, P. a. S.; Tavernier, D. (1 de enero de 1995). "Glosario de nombres de clases de compuestos orgánicos e intermediarios de reactividad basados en la estructura (Recomendaciones de la IUPAC 1995)". Química Pura y Aplicada (en alemán). 67 (8–9): 1307–1375. doi : 10.1351/pac199567081307 . ISSN 1365-3075. S2CID 95004254.