1,4-dioxano
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido 1,4-dioxano | |||
| Nombre sistemático de la IUPAC 1,4-dioxaciclohexano | |||
| Otros nombres [1,4]Dioxano p -Dioxano [6]-corona-2 Dióxido de dietilenglicol Éter dietílico Disolvente de dioxano | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 102551 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.004.239 | ||
| Número CE |
| ||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1165 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C4H8O2 | |||
| Masa molar | 88,106 g·mol −1 | ||
| Apariencia | Líquido incoloro [1] | ||
| Olor | Suave, similar al éter dietílico [1] | ||
| Densidad | 1,033 g/ml | ||
| Punto de fusión | 11,8 °C (53,2 °F; 284,9 K) | ||
| Punto de ebullición | 101,1 °C (214,0 °F; 374,2 K) | ||
| Miscible | |||
| Presión de vapor | 29 mmHg (20 °C) [1] | ||
| −52,16·10 −6 cm3 / mol | |||
| Termoquímica | |||
Entropía molar estándar ( S ⦵ 298 ) | 196,6 J/K·mol | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | -354 kJ/mol | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | -2363 kJ/mol | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Sospechoso de ser carcinógeno humano [1] | ||
| Etiquetado SGA : | |||
   | |||
| Peligro | |||
| H225 , H302 , H305 , H315 , H319 , H332 , H336 , H351 , H370 , H372 , H373 | |||
| P201 , P202 , P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P280 , P281 , P302+P352 , P303+P361+P353 , P304+P312 , P304+P340 , P305+P351+P338 , P307+P311 , P308+P313 , P312 , P314 , P321 , P332+P313 , P337+P313 , P362 , P370+P378 , P403+P233 , P403+P235 , P405 , P501 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | 12 °C (54 °F; 285 K) | ||
| 180 °C (356 °F; 453 K) | |||
| Límites de explosividad | 2,0–22 % [1] | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) |
| ||
LC 50 ( concentración media ) |
| ||
LC Lo ( valor más bajo publicado ) | 1000–3000 ppm (conejillo de indias, 3 horas) 12.022 ppm (gato, 7 h) | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 100 ppm (360 mg/m 3 ) [piel] [1] | ||
REL (recomendado) | Ca C 1 ppm (3,6 mg/m 3 ) [30 minutos] [1] | ||
IDLH (Peligro inmediato) | Ca [500 ppm] [1] | ||
| Compuestos relacionados | |||
Compuestos relacionados | Oxano Trioxano Tetroxano Pentoxano | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El 1,4-dioxano ( / d aɪ ˈ ɒ k s eɪ n / ) es un compuesto orgánico heterocíclico , clasificado como un éter . Es un líquido incoloro con un ligero olor dulce similar al del éter dietílico . El compuesto a menudo se llama simplemente dioxano porque los otros isómeros del dioxano ( 1,2- y 1,3- ) rara vez se encuentran.
El dioxano se utiliza como disolvente para una variedad de aplicaciones prácticas, así como en el laboratorio, y también como estabilizador para el transporte de hidrocarburos clorados en contenedores de aluminio. [3]
Síntesis
El dioxano se produce por la deshidratación catalizada por ácido del dietilenglicol , que a su vez se obtiene de la hidrólisis del óxido de etileno .
En 1985, la capacidad de producción mundial de dioxano oscilaba entre 11.000 y 14.000 toneladas. [4] En 1990, el volumen total de producción estadounidense de dioxano oscilaba entre 5.250 y 9.150 toneladas. [5]
Estructura
La molécula de dioxano es centrosimétrica, lo que significa que adopta una conformación de silla , típica de los parientes del ciclohexano . Sin embargo, la molécula es conformacionalmente flexible y la conformación de barco se adopta fácilmente, por ejemplo, en la quelación de cationes metálicos. El dioxano se parece a un éter corona más pequeño con solo dos unidades de etilenoxilo.
Usos
Transporte de tricloroetano
En la década de 1980, la mayor parte del dioxano producido se utilizó como estabilizador del 1,1,1-tricloroetano para su almacenamiento y transporte en contenedores de aluminio . Normalmente, el aluminio está protegido por una capa de óxido pasivante, pero cuando estas capas se alteran, el aluminio metálico reacciona con el tricloroetano para dar tricloruro de aluminio , que a su vez cataliza la deshidrohalogenación del tricloroetano restante a cloruro de vinilideno y cloruro de hidrógeno . El dioxano "envenena" esta reacción de catálisis formando un aducto con el tricloruro de aluminio. [4]
Como disolvente
El dioxano se utiliza en diversas aplicaciones como disolvente aprótico versátil , por ejemplo, para tintas, adhesivos y ésteres de celulosa. Se sustituye al tetrahidrofurano (THF) en algunos procesos, debido a su menor toxicidad y su punto de ebullición más alto (101 °C, frente a los 66 °C del THF). [6]
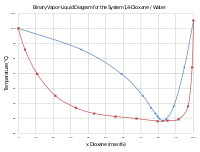
Mientras que el éter dietílico es bastante insoluble en agua, el dioxano es miscible y, de hecho, es higroscópico . A presión estándar, la mezcla de agua y dioxano en la proporción 17,9:82,1 en masa es un azeótropo positivo que hierve a 87,6 °C. [7]
Los átomos de oxígeno son débilmente básicos según el modelo Lewis. Forma aductos con una variedad de ácidos Lewis. Se clasifica como una base dura y sus parámetros básicos en el modelo ECW son E B = 1,86 y C B = 1,29.
El dioxano produce polímeros de coordinación mediante la unión de centros metálicos. [8] De esta manera, se utiliza para impulsar el equilibrio de Schlenk , lo que permite la síntesis de compuestos de dialquilmagnesio. [4] El dimetilmagnesio se prepara de esta manera: [9] [10]
- 2CH3MgBr + ( C2H4O ) 2 → MgBr2 ( C2H4O ) 2 + ( CH3 ) 2Mg
Espectroscopia
El dioxano se utiliza como estándar interno para la espectroscopia de resonancia magnética nuclear en óxido de deuterio . [11]
Toxicología
Seguridad
El dioxano tiene una DL50 de 5170 mg/kg en ratas. [4] Es irritante para los ojos y el tracto respiratorio. La exposición puede causar daños al sistema nervioso central, al hígado y a los riñones. [12] En un estudio de mortalidad de 1978 realizado en trabajadores expuestos al 1,4-dioxano, el número observado de muertes por cáncer no fue significativamente diferente del número esperado. [13] El Programa Nacional de Toxicología clasifica al dioxano como "razonablemente anticipado como carcinógeno humano". [14] También está clasificado por el IARC como carcinógeno del Grupo 2B : posiblemente carcinógeno para los humanos porque es un carcinógeno conocido en otros animales. [15] La Agencia de Protección Ambiental de los Estados Unidos clasifica al dioxano como un probable carcinógeno humano (habiendo observado una mayor incidencia de cáncer en estudios controlados con animales, pero no en estudios epidemiológicos de trabajadores que utilizan el compuesto), y un irritante conocido (con un nivel sin efectos adversos observados de 400 miligramos por metro cúbico) en concentraciones significativamente superiores a las encontradas en productos comerciales. [16] Los estudios en animales con ratas sugieren que el mayor riesgo para la salud está asociado con la inhalación de vapores en forma pura. [17] [18] [19] El estado de Nueva York ha adoptado un estándar de agua potable pionero en el país para el 1,4-dioxano y ha establecido el nivel máximo de contaminante en 1 parte por mil millones. [20]
Peligro de explosión
Al igual que otros éteres, el dioxano se combina con el oxígeno atmosférico tras una exposición prolongada al aire para formar peróxidos potencialmente explosivos . La destilación de estas mezclas es peligrosa. El almacenamiento sobre sodio metálico podría limitar el riesgo de acumulación de peróxido.
Ambiente
El dioxano tiende a concentrarse en el agua y tiene poca afinidad con el suelo. Es resistente a la degradación abiótica en el medio ambiente y antes se creía que también resistía la biodegradación . Sin embargo, estudios más recientes desde la década de 2000 han descubierto que puede biodegradarse a través de varias vías, lo que sugiere que la biorremediación se puede utilizar para tratar el agua contaminada con 1,4-dioxano. [21] [22]
El dioxano ha afectado a los suministros de agua subterránea en varias áreas. Se ha detectado dioxano en el nivel de 1 μg/L (~1 ppb) en muchos lugares de los EE. UU. [5] En el estado estadounidense de New Hampshire, se había encontrado en 67 sitios en 2010, con una concentración que oscilaba entre 2 ppb y más de 11 000 ppb. Treinta de estos sitios son vertederos de residuos sólidos, la mayoría de los cuales han estado cerrados durante años. En 2019, el Southern Environmental Law Center demandó con éxito al tratamiento de aguas residuales de Greensboro, Carolina del Norte, después de que se encontrara 1,4-dioxano en niveles 20 veces superiores a los seguros de la EPA en el río Haw. [23]
Productos cosméticos
Como subproducto del proceso de etoxilación , una ruta hacia algunos ingredientes que se encuentran en productos de limpieza e hidratación, el dioxano puede contaminar cosméticos y productos de cuidado personal como desodorantes, perfumes, champús, pastas de dientes y enjuagues bucales. [24] [25] El proceso de etoxilación hace que los agentes limpiadores, como el lauril éter sulfato de sodio y el lauril éter sulfato de amonio, sean menos abrasivos y ofrezcan características de formación de espuma mejoradas. El 1,4-dioxano se encuentra en pequeñas cantidades en algunos cosméticos, una sustancia aún no regulada que se usa en cosméticos tanto en China como en los EE. UU. [26] La investigación ha encontrado la sustancia química en ingredientes crudos etoxilados y en productos cosméticos listos para usar. El Environmental Working Group (EWG) descubrió que el 97% de los alisadores de cabello, el 57% de los jabones para bebés y el 22 por ciento de todos los productos en Skin Deep, su base de datos de productos cosméticos, están contaminados con 1,4-dioxano. [27]
Desde 1979, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha realizado pruebas en materias primas cosméticas y productos terminados para determinar los niveles de 1,4-dioxano. [28] El 1,4-dioxano estaba presente en ingredientes crudos etoxilados en niveles de hasta 1410 ppm (~0,14 % en peso), y en niveles de hasta 279 ppm (~0,03 % en peso) en productos cosméticos listos para usar. [28] Los niveles de 1,4-dioxano que superan las 85 ppm (~0,01 % en peso) en champús para niños indican que se justifica un control estricto de las materias primas y los productos terminados. [28] Si bien la FDA alienta a los fabricantes a eliminar el 1,4-dioxano, la ley federal no lo exige. [29]
El 9 de diciembre de 2019, Nueva York aprobó un proyecto de ley para prohibir la venta de cosméticos con más de 10 ppm de 1,4-dioxano a partir de fines de 2022. La ley también impedirá la venta de productos de limpieza del hogar y de cuidado personal que contengan más de 2 ppm de 1,4-dioxano a fines de 2022. [30]
Véase también

Referencias
- ^ abcdefgh Guía de bolsillo del NIOSH sobre peligros químicos. "#0237". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab "Dioxano". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Departamento de Servicios de Salud de Wisconsin (2013) Hoja informativa sobre el 1,4-dioxano Archivado el 16 de octubre de 2020 en Wayback Machine . Publicación 00514. Consultado el 12 de noviembre de 2016.
- ^ abcd Surprenant, Kenneth S. (2000). "Dioxano". Dioxano en la Enciclopedia de Química Industrial de Ullmann . doi :10.1002/14356007.a08_545. ISBN 978-3527306732.
- ^ ab "Hoja informativa sobre el 1, 4-dioxano: documento de apoyo" (PDF) . OPPT Chemical Fact Sheets . United States Environmental Protection Agency . Febrero de 1995 . Consultado el 14 de mayo de 2010 .
- ^ Klaus Weissermel, Hans-Jürgen Arpe (2003) "Química orgánica industrial". John Wiley & Sons, página 158. ISBN 3527305785 , 9783527305780.
- ^ Schneider, Charles H.; Lynch, Cecil C. (1943). "El sistema ternario: dioxano—etanol—agua". Revista de la Sociedad Química Americana . 65 (6): 1063–1066. doi :10.1021/ja01246a015.
- ^ Fischer, Reinald; Görls, Helmar; Meisinger, Philippe R.; Suxdorf, Regina; Westerhausen, Matthias (2019). "Relación estructura-solubilidad de complejos de 1,4-dioxano de di(hidrocarbil)magnesio". Química: una revista europea . 25 (55): 12830–12841. doi :10.1002/chem.201903120. PMC 7027550 . PMID 31328293.
- ^ Cope, Arthur C. (1935). "La preparación de compuestos de dialquilmagnesio a partir de reactivos de Grignard". Revista de la Sociedad Química Americana . 57 (11): 2238. doi :10.1021/ja01314a059.
- ^ Anteunis, M. (1962). "Estudios de la reacción de Grignard. II. Cinética de la reacción de dimetilmagnesio con benzofenona y de bromuro de metilmagnesio-bromuro de magnesio con pinacolona". The Journal of Organic Chemistry . 27 (2): 596. doi :10.1021/jo01049a060.
- ^ Shimizu, A.; Ikeguchi, M.; Sugai, S. (1994). "Idoneidad de DSS y TSP como referencias internas para estudios de RMN 1H de proteínas de glóbulos fundidos en medios acuosos". Journal of Biomolecular NMR . 4 (6): 859–62. doi :10.1007/BF00398414. PMID 22911388. S2CID 34800494.
- ^ "Tarjeta internacional de seguridad química". Instituto Nacional de Seguridad y Salud en el Trabajo. Archivado desde el original el 29 de abril de 2005. Consultado el 6 de febrero de 2006 .
- ^ Buffler, Patricia A.; Wood, Susan M.; Suarez, Lucina; Kilian, Duane J. (abril de 1978). "Seguimiento de la mortalidad de los trabajadores expuestos al 1,4-dioxano". Revista de medicina ocupacional y medioambiental . 20 (4): 255–259. PMID 641607 . Consultado el 26 de marzo de 2016 .
- ^ "12.º Informe sobre carcinógenos". Programa Nacional de Toxicología del Departamento de Salud y Servicios Humanos de los Estados Unidos. Archivado desde el original el 14 de julio de 2014. Consultado el 11 de julio de 2014 .
- ^ IARC Monographs Volume 71 (PDF) . Agencia Internacional para la Investigación sobre el Cáncer . Consultado el 11 de julio de 2014 .
- ^ 1,4-Dioxano (óxido de 1,4-dietilenglicol). Resumen de riesgos. Agencia de Protección Ambiental de los Estados Unidos . Creado en abril de 1992; revisado en enero de 2000. Hoja informativa.
- ^ Kano, Hirokazu; Umeda, Yumi; Saito, Misae; Senoh, Hideki; Ohbayashi, Hisao; Aiso, Shigetoshi; Yamazaki, Kazunori; Nagano, Kasuke; Fukushima, Shoji (2008). "Toxicidad oral durante trece semanas del 1,4-dioxano en ratas y ratones". La Revista de Ciencias Toxicológicas . 33 (2): 141–53. doi : 10.2131/jts.33.141 . PMID 18544906.
- ^ Kasai, T; Saito, M; Senoh, H; Umeda, Y; Aiso, S; Ohbayashi, H; Nishizawa, T; Nagano, K; Fukushima, S (2008). "Toxicidad por inhalación de trece semanas de 1,4-dioxano en ratas". Toxicología por inhalación . 20 (10): 961–71. Bibcode :2008InhTx..20..961K. doi :10.1080/08958370802105397. PMID 18668411. S2CID 86811931.
- ^ Kasai, T.; Kano, H.; Umeda, Y.; Sasaki, T.; Ikawa, N.; Nishizawa, T.; Nagano, K.; Arito, H.; Nagashima, H.; Fukushima, S. (2009). "Estudio de dos años de inhalación sobre carcinogenicidad y toxicidad crónica del 1,4-dioxano en ratas macho". Toxicología por inhalación . 21 (11): 889–97. Bibcode :2009InhTx..21..889K. doi :10.1080/08958370802629610. PMID 19681729. S2CID 45963495.
- ^ "El gobernador Cuomo anuncia el primer estándar de agua potable del país para el contaminante emergente 1,4-dioxano | Gobernador Andrew M. Cuomo". Archivado desde el original el 29 de octubre de 2020 . Consultado el 30 de octubre de 2020 .
- ^ Zenker, Matthew J.; Borden, Robert C.; Barlaz, Morton A. (septiembre de 2003). "Presencia y tratamiento de 1,4-dioxano en entornos acuosos". Environmental Engineering Science . 20 (5): 423–432. doi :10.1089/109287503768335913.
- ^ Zhang, Shu; Gedalanga, Phillip B.; Mahendra, Shaily (diciembre de 2017). "Avances en la biorremediación de aguas contaminadas con 1,4-dioxano". Journal of Environmental Management . 204 (Pt 2): 765–774. doi : 10.1016/j.jenvman.2017.05.033 . PMID 28625566.
- ^ "1,4-dioxano en Greensboro | Asamblea del río Haw". 18 de noviembre de 2020. Consultado el 13 de mayo de 2022 .
- ^ Décimo informe sobre carcinógenos Archivado el 1 de noviembre de 2004 en Wayback Machine . Departamento de Salud y Servicios Humanos de los Estados Unidos, Servicio de Salud Pública, Programa Nacional de Toxicología, diciembre de 2002.
- ^ "Enciclopedia química: 1,4-dioxano". Niño sano, mundo sano. Archivado desde el original el 29 de noviembre de 2009. Consultado el 14 de diciembre de 2009 .
- ^ "El organismo de control publica los resultados de la inspección de Johnson & Johnson". China Daily . Xinhua. 21 de marzo de 2009 . Consultado el 14 de mayo de 2010 .
- ^ "Los peligros del 1,4-dioxano y cómo evitarlo". Aspen Clean . Aspen Clean. 11 de febrero de 2020 . Consultado el 17 de diciembre de 2020 .
- ^ abc Black, RE; Hurley, FJ; Havery, DC (2001). "Presencia de 1,4-dioxano en materias primas cosméticas y productos cosméticos terminados". Journal of AOAC International . 84 (3): 666–70. doi : 10.1093/jaoac/84.3.666 . PMID 11417628.
- ^ FDA/CFSAN--Manual de cosméticos, parte 3: Requisitos reglamentarios relacionados con productos cosméticos y cuestiones de riesgo para la salud. Ingredientes prohibidos y otras sustancias peligrosas: 9. Dioxano Web.archive.org
- ^ "Nueva York restringe el 1,4-dioxano en productos de limpieza y cuidado personal". Cen.acs.org . Consultado el 13 de noviembre de 2021 .





