Naftalina
| |||
 | |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Naftaleno [2] | |||
| Otros nombres alquitrán blanco, alquitrán de alcanfor, alquitrán de alcanfor, naftalina, naftalina, antiácaros, albocarbono, hexaleno, bolas de naftalina, escamas de naftalina [1] | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 1421310 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.001.863 | ||
| Número CE |
| ||
| 3347 | |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C10H8 | |||
| Masa molar | 128,174 g·mol −1 | ||
| Apariencia | Cristales/escamas sólidos de color blanco | ||
| Olor | Fuerte olor a alquitrán de hulla o naftalina. | ||
| Densidad | 1,145 g/cm3 ( 15,5 °C) [3] 1,0253 g/cm3 ( 20 °C) [4] 0,9625 g/cm3 ( 100 °C) [3] | ||
| Punto de fusión | 78,2 °C (172,8 °F; 351,3 K) 80,26 °C (176,47 °F; 353,41 K) a 760 mmHg [4] | ||
| Punto de ebullición | 217,97 °C (424,35 °F; 491,12 K) a 760 mmHg [3] [4] | ||
| 19 mg/L (10 °C) 31,6 mg/L (25 °C) 43,9 mg/L (34,5 °C) 80,9 mg/L (50 °C) [4] 238,1 mg/L (73,4 °C) [5] | |||
| Solubilidad | Soluble en alcoholes , amoniaco líquido , ácidos carboxílicos , C 6 H 6 , SO 2 , [5] CCl 4 , CS 2 , tolueno , anilina [6] | ||
| Solubilidad en etanol | 5 g/100 g (0 °C) 11,3 g/100 g (25 °C) 19,5 g/100 g (40 °C) 179 g/100 g (70 °C) [6] | ||
| Solubilidad en ácido acético | 6,8 g/100 g (6,75 °C) 13,1 g/100 g (21,5 °C) 31,1 g/100 g (42,5 °C) 111 g/100 g (60 °C) [6] | ||
| Solubilidad en cloroformo | 19,5 g/100 g (0 °C) 35,5 g/100 g (25 °C) 49,5 g/100 g (40 °C) 87,2 g/100 g (70 °C) [6] | ||
| Solubilidad en hexano | 5,5 g/100 g (0 °C) 17,5 g/100 g (25 °C) 30,8 g/100 g (40 °C) 78,8 g/100 g (70 °C) [6] | ||
| Solubilidad en ácido butírico | 13,6 g/100 g (6,75 °C) 22,1 g/100 g (21,5 °C) 131,6 g/100 g (60 °C) [6] | ||
| registro P | 3.34 [4] | ||
| Presión de vapor | 8,64 Pa (20 °C) 23,6 Pa (30 °C) 0,93 kPa (80 °C) [5] 2,5 kPa (100 °C) [7] | ||
Constante de la ley de Henry ( k H ) | 0,42438 L·atm/mol [4] | ||
| -91,9·10 −6 cm3 / mol | |||
| Conductividad térmica | 98 kPa: 0,1219 W/m·K (372,22 K) 0,1174 W/m·K (400,22 K) 0,1152 W/m·K (418,37 K) 0,1052 W/m·K (479,72 K) [8] | ||
Índice de refracción ( n D ) | 1.5898 [4] | ||
| Viscosidad | 0,964 cP (80 °C) 0,761 cP (100 °C) 0,217 cP (150 °C) [9] | ||
| Estructura | |||
| Monoclínico [10] | |||
| P2 1 /b [10] | |||
| do5 2 horas[10] | |||
a = 8,235 Å, b = 6,003 Å, c = 8,658 Å [10] α = 90°, β = 122,92°, γ = 90° | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 165,72 J/mol·K [4] | ||
Entropía molar estándar ( S ⦵ 298 ) | 167,39 J/mol·K [4] [7] | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | 78,53 kJ/mol [4] | ||
Energía libre de Gibbs (Δ f G ⦵ ) | 201,585 kJ/mol [4] | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | -5156,3 kJ/mol [4] | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Inflamable , sensibilizante, posible carcinógeno . [12] El polvo puede formar mezclas explosivas con el aire. | ||
| Etiquetado SGA : | |||
    [11] [11] | |||
| Peligro | |||
| H228 , H302 , H351 , H410 [11] | |||
| P210 , P273 , P281 , P501 [11] | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | 80 °C (176 °F; 353 K) [11] | ||
| 525 °C (977 °F; 798 K) [11] | |||
| Límites de explosividad | 5,9% [11] | ||
Valor límite umbral (TLV) | 10 ppm [4] (promedio ponderado en el tiempo), 15 ppm [4] (límite de exposición profesional) | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 1800 mg/kg (rata, oral) 490 mg/kg (rata, intravenosa) 1200 mg/kg (conejillo de indias, oral) 533 mg/kg (ratón, oral) [14] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 10 ppm (50 mg/m3 ) [ 13] | ||
REL (recomendado) | TWA 10 ppm (50 mg/m3 ) ST 15 ppm (75 mg/m3 ) [ 13] | ||
IDLH (Peligro inmediato) | 250 ppm [13] | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El naftaleno es un compuesto orgánico con fórmula C
10yo
8Es el hidrocarburo aromático policíclico más simple y es un sólido cristalino blanco con un olor característico que se detecta en concentraciones tan bajas como 0,08 ppm en masa . [15] Como hidrocarburo aromático , la estructura del naftaleno consiste en un par de anillos de benceno fusionados . Es el ingrediente principal de las bolas de naftalina tradicionales .
Historia
A principios de la década de 1820, dos informes separados describieron un sólido blanco con un olor penetrante derivado de la destilación de alquitrán de hulla . En 1821, John Kidd citó estas dos revelaciones y luego describió muchas de las propiedades de esta sustancia y los medios de su producción. Propuso el nombre de naftalina , ya que se había derivado de un tipo de nafta (un término amplio que abarca cualquier mezcla de hidrocarburos líquidos volátiles e inflamables, incluido el alquitrán de hulla). [16] La fórmula química del naftaleno fue determinada por Michael Faraday en 1826. La estructura de dos anillos de benceno fusionados fue propuesta por Emil Erlenmeyer en 1866, [17] y confirmada por Carl Gräbe tres años después. [18]
Propiedades físicas
Una molécula de naftaleno puede considerarse como la fusión de un par de anillos de benceno . (En química orgánica , los anillos se fusionan si comparten dos o más átomos). Como tal, el naftaleno se clasifica como un hidrocarburo aromático policíclico bencenoide (HAP). [19]
Los ocho átomos de carbono que no comparten los dos anillos llevan un átomo de hidrógeno cada uno. Para los fines de la nomenclatura estándar de la IUPAC de compuestos derivados, esos ocho átomos se numeran del 1 al 8 en secuencia alrededor del perímetro de la molécula, comenzando con un átomo de carbono adyacente a uno compartido. Los átomos de carbono compartidos se etiquetan como 4a (entre 4 y 5) y 8a (entre 8 y 1). [20]
Geometría molecular
La molécula es plana, como el benceno. A diferencia del benceno, los enlaces carbono-carbono en el naftaleno no tienen la misma longitud. Los enlaces C1-C2, C3-C4, C5-C6 y C7-C8 tienen una longitud de aproximadamente 1,37 Å (137 pm), mientras que los otros enlaces carbono-carbono tienen una longitud de aproximadamente 1,42 Å (142 pm). Esta diferencia, establecida por difracción de rayos X , [21] es consistente con el modelo de enlace de valencia en el naftaleno y, en particular, con el teorema de conjugación cruzada . Este teorema describiría al naftaleno como una unidad de benceno aromático unida a un dieno pero no extensivamente conjugada a él (al menos en el estado fundamental ), lo que es consistente con dos de sus tres estructuras de resonancia .
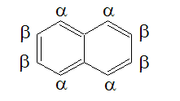
Debido a esta resonancia, la molécula tiene simetría bilateral en el plano del par de carbonos compartido, así como en el plano que biseca los enlaces C2-C3 y C6-C7, y en el plano de los átomos de carbono. Por lo tanto, hay dos conjuntos de átomos de hidrógeno equivalentes: las posiciones alfa , numeradas 1, 4, 5 y 8, y las posiciones beta , 2, 3, 6 y 7. Por lo tanto, son posibles dos isómeros para los naftalenos monosustituidos, que corresponden a la sustitución en una posición alfa o beta.

Los isómeros estructurales del naftaleno que tienen dos anillos aromáticos fusionados incluyen el azuleno , que tiene un sistema de anillos fusionados de 5 a 7, y el biciclo[6.2.0]decapentaeno , que tiene un sistema de anillos fusionados de 4 a 8. [22]
La simetría del grupo puntual del naftaleno es D 2h .
Conductividad eléctrica
El naftaleno cristalino puro es un aislante moderado a temperatura ambiente, con una resistividad de aproximadamente 10 12 Ω m . La resistividad cae más de mil veces al fundirse, a aproximadamente 4 × 10 8 Ω m. Tanto en el líquido como en el sólido, la resistividad depende de la temperatura como ρ = ρ 0 exp( E /( kT )), donde ρ 0 (Ω⋅m) y E (eV) son parámetros constantes, k es la constante de Boltzmann (8,617 × 10 −5 eV/ K ), y T es la temperatura absoluta (K). El parámetro E es 0,73 en el sólido. Sin embargo, el sólido muestra un carácter semiconductor por debajo de los 100 K. [23] [24]
Propiedades químicas
Reacciones con electrófilos
En las reacciones de sustitución aromática electrofílica , el naftaleno reacciona más fácilmente que el benceno. Por ejemplo, la cloración y bromación del naftaleno se lleva a cabo sin un catalizador para dar 1-cloronaftaleno y 1-bromonaftaleno , respectivamente. Asimismo, mientras que tanto el benceno como el naftaleno pueden alquilarse utilizando las condiciones de reacción de Friedel-Crafts , el naftaleno también puede alquilarse fácilmente mediante la reacción con alquenos o alcoholes , utilizando catalizadores de ácido sulfúrico o fosfórico . [25]
En términos de regioquímica , los electrófilos atacan en la posición alfa. La selectividad para la sustitución alfa sobre la beta se puede racionalizar en términos de las estructuras de resonancia del intermediario: para el intermediario de sustitución alfa, se pueden dibujar siete estructuras de resonancia, de las cuales cuatro conservan un anillo aromático. Para la sustitución beta, el intermediario tiene solo seis estructuras de resonancia, y solo dos de ellas son aromáticas. La sulfonación da como producto "alfa" el ácido naftaleno-1-sulfónico como producto cinético, pero el ácido naftaleno-2-sulfónico como producto termodinámico. El isómero 1 se forma predominantemente a 25 °C y el isómero 2 a 160 °C. La sulfonación para dar el ácido 1- y 2-sulfónico ocurre fácilmente:
- H2SO4 + C10H8 → C10H7SO3H + H2O
La sulfonación posterior produce ácidos di-, tri- y tetrasulfónicos.
Litiación
Análoga a la síntesis de fenil-litio es la conversión de 1-bromonaftaleno en 1-litionaftaleno, mediante intercambio litio-halógeno :
- C10H7Br + BuLi → C10H7Li + BuBr
El litionaftaleno resultante sufre una segunda litiación, a diferencia del comportamiento del fenillitio. Estos derivados de 1,8-dilitio son precursores de una serie de derivados del perinaftaleno . [26]
Reducción y oxidación
Con metales alcalinos, el naftaleno forma sales aniónicas radicales de color verde azulado oscuro, como el naftaleno de sodio , Na + C 10 H−
8Los aniones naftaleno son agentes reductores fuertes.
El naftaleno se puede hidrogenar a alta presión en presencia de catalizadores metálicos para dar 1,2,3,4-tetrahidronaftaleno ( C
10yo
12), también conocida como tetralina . Una posterior hidrogenación produce decahidronaftaleno o decalina ( C
10yo
18).
Oxidación con O
2En presencia de pentóxido de vanadio como catalizador se obtiene anhídrido ftálico :
- C 10 H 8 + 4,5 O 2 → C 6 H 4 (CO) 2 O + 2 CO 2 + 2 H 2 O
Esta reacción es la base del uso principal del naftaleno. La oxidación también se puede llevar a cabo utilizando reactivos estequiométricos convencionales de cromato o permanganato .
Producción

La mayor parte del naftaleno se obtiene a partir del alquitrán de hulla . Desde la década de 1960 hasta la de 1990, también se produjeron cantidades significativas de naftaleno a partir de fracciones pesadas de petróleo durante el refinado del petróleo , pero la producción actual se basa principalmente en el alquitrán de hulla. Se producen aproximadamente 1,3 millones de toneladas al año.
El naftaleno es el componente más abundante del alquitrán de hulla. La composición del alquitrán de hulla varía según el tipo de carbón y el procesamiento, pero el alquitrán de hulla típico contiene alrededor de un 10% de naftaleno en peso. En la práctica industrial, la destilación del alquitrán de hulla produce un aceite que contiene alrededor de un 50% de naftaleno, junto con otros doce compuestos aromáticos . Este aceite, después de lavarse con hidróxido de sodio acuoso para eliminar los componentes ácidos (principalmente varios fenoles ) y con ácido sulfúrico para eliminar los componentes básicos , se somete a una destilación fraccionada para aislar el naftaleno. El naftaleno crudo resultante de este proceso contiene alrededor de un 95% de naftaleno en peso. Las principales impurezas son el compuesto aromático que contiene azufre benzotiofeno (< 2%), indano (0,2%), indeno (< 2%) y metilnaftaleno (< 2%). El naftaleno derivado del petróleo suele ser más puro que el derivado del alquitrán de hulla. Cuando sea necesario, el naftaleno crudo se puede purificar aún más mediante recristalización a partir de una variedad de solventes, lo que da como resultado un 99 % de naftaleno en peso, denominado 80 °C (punto de fusión). [25]
En América del Norte , los productores de alquitrán de hulla son Koppers Inc., Ruetgers Canada Inc. y Recochem Inc., y el principal productor de petróleo es Monument Chemical Inc. En Europa occidental, los productores conocidos son Koppers, Ruetgers y Deza. En Europa del Este , el naftaleno se produce en una variedad de complejos metalúrgicos integrados (Severstal, Evraz, Mechel, MMK) en Rusia , los fabricantes especializados en naftaleno y fenol INKOR, la planta metalúrgica Yenakievsky en Ucrania y ArcelorMittal Temirtau en Kazajstán .
Otras fuentes y ocurrencias
El naftaleno y sus homólogos alquílicos son los principales componentes de la creosota .
Las magnolias y algunas especies de ciervos , así como las termitas subterráneas de Formosa , producen trazas de naftaleno , posiblemente producido por la termita como repelente contra "hormigas, hongos venenosos y gusanos nematodos ". [27] Algunas cepas del hongo endófito Muscodor albus producen naftaleno entre una variedad de compuestos orgánicos volátiles, mientras que Muscodor vitigenus produce naftaleno casi exclusivamente. [28]
Usos
El naftaleno se utiliza principalmente como precursor de productos químicos derivados. El uso más importante del naftaleno es la producción industrial de anhídrido ftálico , aunque se produce más anhídrido ftálico a partir de o -xileno .
Fumigante
El naftaleno se ha utilizado como fumigante . En el pasado, era el ingrediente principal de las bolas de naftalina , aunque su uso se ha sustituido en gran medida a favor de alternativas como el 1,4-diclorobenceno . En un recipiente sellado que contiene bolitas de naftaleno, los vapores de naftaleno se acumulan hasta alcanzar niveles tóxicos tanto para las formas adultas como larvarias de muchas polillas que atacan los textiles. Otros usos del naftaleno como fumigante incluyen su uso en el suelo como pesticida fumigante , en los áticos para repeler insectos y animales como las zarigüeyas [ 29] y en los cajones y armarios de almacenamiento de los museos para proteger el contenido del ataque de plagas de insectos.
Solvente
El naftaleno fundido proporciona un excelente medio de solubilización para compuestos aromáticos poco solubles. En muchos casos es más eficiente que otros disolventes de alto punto de ebullición, como el diclorobenceno , el benzonitrilo , el nitrobenceno y el dureno . La reacción de C 60 con antraceno se lleva a cabo convenientemente en naftaleno a reflujo para dar el aducto de Diels-Alder 1:1. [30] La aromatización de hidroporfirinas se ha logrado utilizando una solución de DDQ en naftaleno. [31]
Usos derivados
El mayor uso del naftaleno es la producción de anhídrido ftálico , que es un intermedio utilizado para fabricar plastificantes para cloruro de polivinilo y para fabricar polímeros de resina alquídica utilizados en pinturas y barnices.
Ácidos sulfónicos y sulfonatos
Son útiles muchos ácidos naftalenosulfónicos y sulfonatos. Los ácidos naftalenosulfónicos se utilizan en la síntesis de 1-naftol y 2-naftol , precursores de diversos colorantes, pigmentos, productos químicos para el procesamiento del caucho y otros productos químicos y farmacéuticos. [25] También se utilizan como dispersantes en cauchos sintéticos y naturales, en pesticidas agrícolas , en tintes y en placas de baterías de plomo-ácido . Los ácidos naftalenosulfónicos, como el ácido de Armstrong, se utilizan como precursores y para formar sales farmacéuticas como el CFT .
Los ácidos aminonaftalenosulfónicos son precursores para la síntesis de muchos colorantes sintéticos .
Los alquil naftaleno sulfonatos (ANS) se utilizan en muchas aplicaciones industriales como surfactantes no detergentes (agentes humectantes) que dispersan eficazmente los sistemas coloidales en medios acuosos. Las principales aplicaciones comerciales se encuentran en la industria química agrícola, que utiliza ANS para formulaciones en polvo humectable y granular humectable (fluible en seco), y en la industria textil y de tejidos, que utiliza las propiedades humectantes y antiespumantes de los ANS para operaciones de blanqueo y teñido.
Algunos polímeros de naftalensulfonato son superplastificantes que se utilizan para la producción de hormigón de alta resistencia . Se producen mediante el tratamiento del ácido naftalensulfónico con formaldehído , seguido de una neutralización con hidróxido de sodio o hidróxido de calcio .
Otros usos derivados

Muchos colorantes azoicos se producen a partir del naftaleno. Entre los agroquímicos útiles se encuentran los ácidos naftoxiacéticos. [25]
La hidrogenación del naftaleno produce tetrahidronaftaleno ( tetralina ) y decahidronaftaleno ( decalina ), que se utilizan como disolventes de baja volatilidad . La tetralina se utiliza como disolvente donante de hidrógeno. [25]
La alquilación de naftaleno con propileno produce una mezcla de diisopropilnaftalenos , que son útiles como líquidos no volátiles para tintas. [25]
Los naftalenos sustituidos sirven como productos farmacéuticos como el propranolol (un betabloqueante ) y la nabumetona (un fármaco antiinflamatorio no esteroide ).
Otros usos
La alta volatilidad del naftaleno tiene varios usos: se utiliza para crear poros artificiales en la fabricación de muelas de rectificado de alta porosidad ; se utiliza en estudios de ingeniería de transferencia de calor mediante sublimación de masa ; y se ha explorado como un propulsor sublimable para propulsores satelitales de gas frío. [32] [33]
Efectos sobre la salud
La exposición a grandes cantidades de naftaleno puede dañar o destruir los glóbulos rojos , más comúnmente en personas con la condición hereditaria conocida como deficiencia de glucosa-6-fosfato deshidrogenasa (G6PD) , [34] de la que padecen más de 400 millones de personas. [ cita requerida ] Los humanos, en particular los niños, han desarrollado la condición conocida como anemia hemolítica , después de ingerir bolas de naftalina o bloques desodorantes que contienen naftaleno. Los síntomas incluyen fatiga , falta de apetito, inquietud y piel pálida. La exposición a grandes cantidades de naftaleno puede causar confusión , náuseas , vómitos , diarrea , sangre en la orina e ictericia (coloración amarilla de la piel debido a la disfunción del hígado ). [35]
El Programa Nacional de Toxicología de los Estados Unidos (NTP) realizó un experimento en el que ratas y ratones machos y hembras fueron expuestos a vapores de naftaleno durante los días de semana durante dos años. [36] Tanto las ratas macho como las hembras mostraron evidencia de carcinogénesis con mayores incidencias de adenoma y neuroblastoma de la nariz. Los ratones hembra mostraron cierta evidencia de carcinogénesis basada en mayores incidencias de adenomas alveolares y bronquiolares del pulmón , mientras que los ratones machos no mostraron evidencia de carcinogénesis.
La Agencia Internacional para la Investigación sobre el Cáncer (IARC) [37] clasifica al naftaleno como posiblemente cancerígeno para los seres humanos y los animales ( Grupo 2B ). El IARC también señala que la exposición aguda causa cataratas en seres humanos, ratas , conejos y ratones ; y que la anemia hemolítica (descrita anteriormente) puede ocurrir en niños y bebés después de la exposición oral o por inhalación o después de la exposición materna durante el embarazo. Según la Proposición 65 de California , el naftaleno está catalogado como "conocido por el Estado como causante de cáncer". [38] Se ha identificado un mecanismo probable para los efectos cancerígenos de las bolas de naftalina y algunos tipos de ambientadores que contienen naftaleno. [39] [40]
Regulación
Las agencias gubernamentales de los EE. UU. han establecido límites de exposición ocupacional a la naftalina. La Administración de Seguridad y Salud Ocupacional ha establecido un límite de exposición permisible de 10 ppm (50 mg/m 3 ) durante un promedio ponderado en el tiempo de ocho horas. El Instituto Nacional de Seguridad y Salud Ocupacional ha establecido un límite de exposición recomendado de 10 ppm (50 mg/m 3 ) durante un promedio ponderado en el tiempo de ocho horas, así como un límite de exposición a corto plazo de 15 ppm (75 mg/m 3 ). [41] El umbral mínimo de olor de la naftalina es de 0,084 ppm para los humanos. [42]
Las bolas de naftalina y otros productos que contienen naftaleno están prohibidos en la UE desde 2008. [43] [44]
En China , el uso de naftaleno en bolas de naftalina está prohibido. [45] El peligro para la salud humana y el uso común de alcanfor natural se citan como razones para la prohibición.
Derivados del naftaleno
La lista parcial de derivados del naftaleno incluye los siguientes compuestos:
| Nombre | Fórmula química | Masa molar [g/mol] | Punto de fusión [°C] | Punto de ebullición [°C] | Densidad [g/ cm3 ] | Índice de refracción |
|---|---|---|---|---|---|---|
| Ácido 1-naftoico | C11H8O2 | 172,18 | 157 | 300 | — | |
| Ácido 2-naftoico | C11H8O2 | 172,18 | 185,5 | — | ||
| Cloruro de 1-naftoilo | C11H7ClO | 190,63 | 16–19 | 190 (35 torr ) | 1.265 | 1.6552 |
| 1-naftol | C10H8O | 144,17 | 94–96 | 278 | 1.224 | — |
| 1-naftaldehído | C11H8O | 156,18 | 1–2 | 160 (15 torr) | ||
| 1-Nitronaftaleno | C10H7NO2 | 173,17 | 53–57 | 340 | 1.22 | — |
| 1-Fluoronaftaleno | C10H7F | 146,16 | -19 | 215 | 1.323 | 1.593 |
| 1-cloronaftaleno | C10H7Cl | 162,62 | -6 | 259 | 1.194 | 1.632 |
| 2-cloronaftaleno | C10H7Cl | 162,62 | 59,5 | 256 | 1.138 | 1.643 |
| 1-Bromonaftaleno | C10H7Br | 207.07 | -2 | 279 | 1.489 | 1.670 |
| 1,2,7-Trimetilnaftaleno (Sapotalin) | C 13 H 14 | 170,25 | 143 | 128 | 0,987 | |
| Ácido naftaleno-2-sulfónico |
Véase también
- Alcanfor
- Dialina , Tetralina , Decalina
- Lista de moléculas interestelares y circunestelares
- Bolas de naftalina
- 1-naftol , 2-naftol
- Reacción de Wagner-Jauregg (síntesis clásica de naftaleno)
Referencias
- ^ Naftaleno: nombres comerciales
- ^ Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. págs. 13, 35, 204, 207, 221–222, 302, 457, 461, 469, 601, 650. doi :10.1039/9781849733069-FP001 (inactivo el 22 de junio de 2024). ISBN . 978-0-85404-182-4.
{{cite book}}: CS1 maint: DOI inactivo a partir de junio de 2024 ( enlace ) - ^ abc "Criterios de calidad del agua ambiental para el naftaleno" (PDF) . Agencia de Protección Ambiental de los Estados Unidos. 23 de abril de 2014 . Consultado el 21 de junio de 2014 .
- ^ abcdefghijklmn Lide, David R., ed. (2009). Manual de química y física del CRC (90.ª edición). Boca Ratón, Florida : CRC Press . ISBN 978-1-4200-9084-0.
- ^ abc Anatolievich, Kiper Ruslan. "naftaleno". chemister.ru . Consultado el 21 de junio de 2014 .
- ^ abcdef Seidell, Atherton; Linke, William F. (1919). Solubilidad de compuestos inorgánicos y orgánicos (2.ª ed.). Nueva York: D. Van Nostrand Company. págs. 443–446.
- ^ ab Naphthalene en Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , Instituto Nacional de Estándares y Tecnología, Gaithersburg (MD) (consultado el 24 de mayo de 2014)
- ^ "Conductividad térmica del naftaleno". DDBST GmbH . Archivado desde el original el 4 de marzo de 2016. Consultado el 21 de junio de 2014 .
- ^ "Viscosidad dinámica del naftaleno". DDBST GmbH . Archivado desde el original el 4 de marzo de 2016. Consultado el 21 de junio de 2014 .
- ^ abcd Douglas, Bodie E.; Ho, Shih-Ming (2007). Estructura y química de sólidos cristalinos. Nueva York: Springer Science+Business Media, Inc. p. 288. ISBN 978-0-387-26147-8.
- ^ abcdef Sigma-Aldrich Co. , Naftaleno.
- ^ Carcinogenicidad del naftaleno
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0439". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Naftaleno". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Amoore JE, Hautala E (1983). "El olor como ayuda a la seguridad química: Umbrales de olor comparados con valores límite de umbral y volátiles para 214 productos químicos industriales en dilución en aire y agua". J Appl Toxicol . 3 (6): 272–290. doi :10.1002/jat.2550030603. PMID 6376602. S2CID 36525625.
- ^ John Kidd (1821). "Observaciones sobre el naftaleno, una sustancia peculiar que se asemeja a un aceite esencial concreto, que se produce durante la descomposición del alquitrán de hulla, por exposición al calor rojo". Philosophical Transactions . 111 : 209–221. doi :10.1098/rstl.1821.0017. S2CID 97798085.
- ^ Emil Erlenmeyer (1866). "Studien über die sg aromatischen Säuren". Annalen der Chemie und Pharmacie . 137 (3): 327–359. doi :10.1002/jlac.18661370309.
- ^ C. Graebe (1869) "Ueber die Constitution des Naphthalins" (Sobre la estructura de la naftaleno), Annalen der Chemie und Pharmacie , 149 : 20-28.
- ^ "Hidrocarburos aromáticos policíclicos (HAP)" (PDF) . Archivado (PDF) del original el 30 de noviembre de 2014.
El naftaleno es un HAP que se produce comercialmente en los EE. UU .
- ^ Libro Azul , P-14.4 NUMERACIÓN
- ^ Cruickshank, DWJ; Sparks, RA (18 de octubre de 1960). "Determinaciones experimentales y teóricas de longitudes de enlace en naftaleno, antraceno y otros hidrocarburos". Actas de la Royal Society A: Ciencias matemáticas, físicas y de ingeniería . 258 (1293): 270–285. Bibcode :1960RSPSA.258..270C. doi :10.1098/rspa.1960.0187. S2CID 96765335.
- ^ Dieter Cremer; Thomas Schmidt; Charles W. Bock (1985). "Determinación teórica de la estructura y conformación molecular. 14. ¿El biciclo[6.2.0]decapentaeno es aromático o antiaromático?". J. Org. Chem . 50 (15): 2684–2688. doi :10.1021/jo00215a018.
- ^ Bornmann, John A. (1962). "Semiconductividad del naftaleno". The Journal of Chemical Physics . 36 (6): 1691–1692. Código Bibliográfico :1962JChPh..36.1691B. doi :10.1063/1.1732805. ISSN 0021-9606.
- ^ Schein, LB; Duke, CB; McGhie, AR (1978). "Observación de la transición de salto de banda para electrones en naftaleno". Physical Review Letters . 40 (3): 197–200. Bibcode :1978PhRvL..40..197S. doi :10.1103/PhysRevLett.40.197. ISSN 0031-9007.
- ^ abcdef Gerd Collin; Hartmut Hoke; Helmut Greim (2003). "Naftaleno e hidronaftalenos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. ISBN 978-3527306732..
- ^ van Soolingen J, de Lang RJ, den Besten R, et al. (1995). "Un procedimiento simple para la preparación de 1,8-bis(difenilfosfino)naftaleno". Synthetic Communications . 25 (11): 1741–1744. doi :10.1080/00397919508015858.
- ^ "Las 'bolas de naftalina' para termitas mantienen a raya a los insectos". Ciencia y tecnología . BBC News. 8 de abril de 1998.
- ^ Daisy BH, Strobel GA, Castillo U, et al. (noviembre de 2002). "El naftaleno, un repelente de insectos, es producido por Muscodor vitigenus, un nuevo hongo endofítico". Microbiología . 148 (Pt 11): 3737–41. doi : 10.1099/00221287-148-11-3737 . PMID 12427963.
- ^ "Resumen del estudio sobre repelentes de zarigüeyas". Archivado desde el original el 28 de septiembre de 2013.
- ^ K. Komatsua; Y. Murataa; N. Sugitaa; et al. (1993). "Uso de naftaleno como disolvente para la formación selectiva del aducto Diels-Alder 1: 1 de C 60 con antraceno". Letras de tetraedro . 34 (52): 8473–8476. doi :10.1016/S0040-4039(00)61362-X.
- ^ MA Filatov; AV Cheprakov (2011). "La síntesis de nuevas tetrabenzo- y tetranaftoporfirinas mediante reacciones de adición de 4,7-dihidroisoindol". Tetrahedron . 67 (19): 3559–3566. doi :10.1016/j.tet.2011.01.052.
- ^ Tsifakis, Dimitrios; Charles, Christine; Boswell, Rod (23 de septiembre de 2020). "El naftaleno como propulsor de gas frío para un Cubesat". Frontiers in Physics . 8 : 389. Bibcode :2020FrP.....8..389T. doi : 10.3389/fphy.2020.00389 . hdl : 1885/229663 .
- ^ "Un nuevo sistema de propulsión que utiliza el ingrediente clave de las bolas de naftalina podría impulsar satélites a través del espacio". Australian Broadcasting Corporation . 8 de diciembre de 2021 . Consultado el 11 de diciembre de 2021 .
- ^ Santucci K, Shah B (enero de 2000). "Asociación de naftaleno con anemia hemolítica aguda". Acad Emerg Med . 7 (1): 42–7. doi : 10.1111/j.1553-2712.2000.tb01889.x . PMID 10894241.
- ^ Enciclopedia MedlinePlus : Intoxicación por naftaleno
- ^ "Informes técnicos 410 y 500 del NTP". Informes técnicos 410 y 500 del NTP, disponibles en NTP: Resúmenes e informes a largo plazo . Archivado desde el original el 24 de octubre de 2004. Consultado el 6 de marzo de 2005 .
- ^ Monografías del IARC sobre la evaluación de los riesgos cancerígenos para los seres humanos. ISBN 978-92-832-1282-9. Recuperado el 25 de diciembre de 2008 .
{{cite book}}:|work=ignorado ( ayuda ) - ^ Proposición 65 Archivado el 29 de julio de 2019 en Wayback Machine , Oficina de Evaluación de Riesgos para la Salud Ambiental
- ^ "Los científicos pueden haber resuelto el misterio de las bolas de naftalina cancerígenas", Physorg.com , 20 de junio de 2006.
- ^ "Bolas de naftalina, ambientadores y cáncer". Asociación de Salud Ambiental de Nueva Escocia . Consultado el 24 de mayo de 2013 .
- ^ "Guía de bolsillo de los CDC y NIOSH sobre los peligros químicos: naftaleno". Cdc.gov . Consultado el 6 de marzo de 2022 .
- ^ "Naftaleno" (PDF) . Epa.gov . Archivado (PDF) del original el 14 de octubre de 2016 . Consultado el 6 de marzo de 2022 .
- ^ Alderson, Andrew (15 de noviembre de 2008). "Santo cielo, ahora los eurócratas están prohibiendo las bolas de naftalina" . The Telegraph . Archivado desde el original el 12 de enero de 2022. Consultado el 23 de noviembre de 2013 .
- ^ Gray, Kerrina (17 de noviembre de 2013). "El Ayuntamiento advierte contra el uso de bolas de naftalina venenosas". Your Local Guardian . Newsquest (Londres) Ltd . Consultado el 23 de noviembre de 2012 .
- ^ 国务院经贸办、卫生部关于停止生产和销售萘丸提倡使用樟脑制品的通知(国经贸调(1993)64号)
Enlaces externos
- Naftaleno—Centro Nacional de Información sobre Pesticidas
- Naftaleno: sitio web de la EPA sobre sustancias tóxicas en el aire
- Naftaleno (PIM 363): principalmente sobre la toxicidad del naftaleno
- Naftaleno: Guía de bolsillo de los CDC y NIOSH sobre peligros químicos
- Naftaleno en la base de datos de propiedades de pesticidas (PPDB)
- . Encyclopædia Britannica . Vol. 19 (11.ª ed.). 1911. págs. 167–168.