Ribosa
| |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC D -ribosa | |||
| Nombre sistemático de la IUPAC (2R , 3R , 4S , 5R ) -5-(hidroximetil)oxolano-2,3,4-triol | |||
| Otros nombres d -ribosa | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Número CE |
| ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
| |||
| |||
| Propiedades [1] [2] | |||
| C5H10O5 | |||
| Masa molar | 150,13 | ||
| Apariencia | Sólido blanco | ||
| Punto de fusión | 95 °C (203 °F; 368 K) | ||
| 100 g/L (25 °C, 77 °F) | |||
Rotación quiral ([α] D ) | −21,5° ( H2O ) | ||
| Compuestos relacionados | |||
Aldopentosas relacionadas | Arabinosa Xilosa Lixosa | ||
Compuestos relacionados | Desoxirribosa | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||

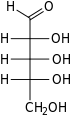
La ribosa es un azúcar simple y carbohidrato con fórmula molecular C 5 H 10 O 5 y la composición de forma lineal H−(C=O)−(CHOH) 4 −H. La forma natural, d -ribosa , es un componente de los ribonucleótidos a partir de los cuales se construye el ARN , por lo que este compuesto es necesario para la codificación , decodificación , regulación y expresión de genes . Tiene un análogo estructural , la desoxirribosa , que es un componente esencial similar del ADN . La l -ribosa es un azúcar artificial que fue preparado por primera vez por Emil Fischer y Oscar Piloty en 1891. [3] No fue hasta 1909 que Phoebus Levene y Walter Jacobs reconocieron que la d -ribosa era un producto natural , el enantiómero del producto de Fischer y Piloty, y un componente esencial de los ácidos nucleicos . [4] [5] [6] Fischer eligió el nombre "ribosa" porque es un reordenamiento parcial del nombre de otro azúcar, la arabinosa , de la cual la ribosa es un epímero en el carbono 2'; ambos nombres también se relacionan con la goma arábiga , de la cual se aisló por primera vez la arabinosa y de la cual prepararon la l -ribosa . [6] [7]
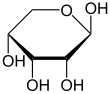
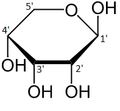
Como la mayoría de los azúcares, la ribosa existe como una mezcla de formas cíclicas en equilibrio con su forma lineal, y estas se interconvierten fácilmente, especialmente en solución acuosa . [8] El nombre "ribosa" se utiliza en bioquímica y biología para referirse a todas estas formas, aunque se utilizan nombres más específicos para cada una cuando es necesario. En su forma lineal, la ribosa puede reconocerse como el azúcar pentosa con todos sus grupos funcionales hidroxilo en el mismo lado en su proyección de Fischer . La d -ribosa tiene estos grupos hidroxilo en el lado derecho y está asociada con el nombre sistemático (2R , 3R , 4R ) -2,3,4,5-tetrahidroxipentanal, [9] mientras que la l -ribosa tiene sus grupos hidroxilo que aparecen en el lado izquierdo en una proyección de Fischer. La ciclización de la ribosa ocurre a través de la formación de hemiacetal debido al ataque al aldehído por el grupo hidroxilo C4' para producir una forma furanosa o por el grupo hidroxilo C5' para producir una forma piranosa . En cada caso, hay dos posibles resultados geométricos, denominados α- y β- y conocidos como anómeros , dependiendo de la estereoquímica en el átomo de carbono hemiacetal (el "carbono anomérico"). A temperatura ambiente, aproximadamente el 76% de la d -ribosa está presente en las formas de piranosa [8] : 228 (α:β = 1:2) [10] y el 24% en las formas de furanosa [8] : 228 (α:β = 1:3), [10] con solo alrededor del 0,1% de la forma lineal presente. [11] [12]
Los ribonucleósidos adenosina , citidina , guanosina y uridina son todos derivados de la β- d -ribofuranosa. Las especies metabólicamente importantes que incluyen ribosa fosforilada incluyen ADP , ATP , coenzima A , [8] : 228–229 y NADH . El AMPc y el GMPc sirven como mensajeros secundarios en algunas vías de señalización y también son derivados de la ribosa. La fracción ribosa aparece en algunos agentes farmacéuticos, incluidos los antibióticos neomicina y paromomicina . [10]
Síntesis y fuentes
La ribosa, en forma de éster 5-fosfato, se produce normalmente a partir de la glucosa mediante la vía de las pentosas fosfato . En al menos algunas arqueas se han identificado vías alternativas. [13]
La ribosa se puede sintetizar químicamente, pero su producción comercial depende de la fermentación de la glucosa. Utilizando cepas de B. subtilis modificadas genéticamente , se pueden producir 90 g/litro de ribosa a partir de 200 g de glucosa. La conversión implica la intermediación del gluconato y la ribulosa. [14]
Se ha detectado ribosa en meteoritos . [15] [16]
Estructura
La ribosa es una aldopentosa (un monosacárido que contiene cinco átomos de carbono y que, en su forma de cadena abierta , tiene un grupo funcional aldehído en un extremo). En el esquema de numeración convencional para los monosacáridos, los átomos de carbono se numeran desde C1' (en el grupo aldehído) hasta C5'. El derivado desoxirribosa que se encuentra en el ADN se diferencia de la ribosa por tener un átomo de hidrógeno en lugar del grupo hidroxilo en C2'. Este grupo hidroxilo realiza una función en el empalme del ARN .
La " d -" en el nombre d -ribosa se refiere a la estereoquímica del átomo de carbono quiral más alejado del grupo aldehído (C4'). En la d -ribosa, como en todos los d -azúcares, este átomo de carbono tiene la misma configuración que en el d -gliceraldehído .
- α- d -Ribopiranosa
- β- d -Ribopiranosa
- α- d -Ribofuranosa
- β- d -Ribofuranosa
Abundancia relativa de formas de ribosa en solución: β- d -ribopiranosa (59%), α- d -ribopiranosa (20%), β- d -ribofuranosa (13%), α- d -ribofuranosa (7%) y cadena abierta (0,1%). [11]
En el caso de los residuos de ribosa en nucleósidos y nucleótidos , los ángulos de torsión para la rotación que abarca los enlaces influyen en la configuración del respectivo nucleósido y nucleótido. La estructura secundaria de un ácido nucleico está determinada por la rotación de sus 7 ángulos de torsión . [17] Tener una gran cantidad de ángulos de torsión permite una mayor flexibilidad.
En las ribosas de anillo cerrado, la flexibilidad observada mencionada anteriormente no se observa porque el ciclo del anillo impone un límite en el número de ángulos de torsión posibles en la estructura. [17] Los conformadores de las ribosas de forma cerrada difieren con respecto a cómo se posiciona el oxígeno solitario en la molécula con respecto a la base nitrogenada (también conocida como nucleobase o simplemente una base) unida a la ribosa. Si un carbono está orientado hacia la base, entonces la ribosa se etiqueta como endo. Si un carbono está orientado en dirección opuesta a la base, entonces la ribosa se etiqueta como exo. Si hay una molécula de oxígeno unida al carbono 2' de una ribosa de ciclo cerrado, entonces la confirmación exo es más estable porque disminuye las interacciones del oxígeno con la base. [17] La diferencia en sí es bastante pequeña, pero cuando se observa una cadena completa de ARN, la ligera diferencia equivale a un impacto considerable.
- Algunas configuraciones fruncidas de ribosa
- 2' endo
- 2' endo 3' exo
- 3' endo 2' exo
- 3' endo
Una molécula de ribosa se representa típicamente como una molécula plana en el papel. A pesar de esto, típicamente no es plana por naturaleza. Incluso entre átomos de hidrógeno, los muchos constituyentes de una molécula de ribosa causan impedimento estérico y tensión entre ellos. Para aliviar este apiñamiento y tensión del anillo , el anillo se frunce, es decir, se vuelve no plano. [18] Este fruncimiento se logra desplazando un átomo del plano, aliviando la tensión y produciendo una conformación más estable. [17] El fruncimiento, también conocido como conformación del anillo de azúcar (específicamente el azúcar ribosa), se puede describir por la amplitud del fruncimiento, así como por el ángulo de pseudorotación . El ángulo de pseudorotación se puede describir como rango "norte (N)" o "sur (S)". Si bien ambos rangos se encuentran en dobles hélices, el rango norte se asocia comúnmente con el ARN y la forma A del ADN . Por el contrario, el rango sur se asocia con la forma B del ADN . El ADN-Z contiene azúcares en los rangos norte y sur. [19] Cuando se desplaza un solo átomo, se habla de un fruncido de "envoltura". Cuando se desplazan dos átomos, se habla de un fruncido de "torsión", en referencia a la orientación en zigzag. [20] En un fruncido "endo", el desplazamiento principal de los átomos se produce en la cara β, el mismo lado que el enlace C4'-C5' y la base. En un fruncido "exo", el desplazamiento principal de los átomos se produce en la cara α, en el lado opuesto del anillo. Las formas principales de la ribosa son el fruncidor 3'-endo (comúnmente adoptado por el ARN y el ADN de forma A) y el fruncidor 2'-endo (comúnmente adoptado por el ADN de forma B). [21] Estos fruncidos de anillo se desarrollan a partir de cambios en los ángulos de torsión del anillo; hay infinitas combinaciones de ángulos, por lo que hay un número infinito de conformaciones de fruncidor transponibles, cada una separada por energías de activación dispares.
Funciones
El ATP se deriva de la ribosa; contiene una ribosa, tres grupos fosfato y una base adenina . El ATP se crea durante la respiración celular a partir del difosfato de adenosina (ATP con un grupo fosfato menos).
Vías de señalización
La ribosa es un componente básico de las moléculas de señalización secundaria, como el monofosfato de adenosina cíclico (AMPc), que se deriva del ATP. Un caso específico en el que se utiliza el AMPc es en las vías de señalización dependientes del AMPc . En las vías de señalización del AMPc, una molécula señal activa un receptor hormonal estimulante o inhibidor. Estos receptores están vinculados a una proteína G reguladora estimulante o inhibidora . Cuando se activa una proteína G estimulante, la adenilil ciclasa cataliza el ATP en AMPc utilizando Mg 2+ o Mn 2+ . El AMPc, un mensajero secundario, activa entonces la proteína quinasa A , que es una enzima que regula el metabolismo celular . La proteína quinasa A regula las enzimas metabólicas mediante fosforilación , lo que provoca un cambio en la célula dependiendo de la molécula señal original. Lo contrario ocurre cuando se activa una proteína G inhibidora; la proteína G inhibe la adenilil ciclasa y el ATP no se convierte en AMPc.

Metabolismo
La ribosa se conoce como la "moneda molecular" debido a su participación en las transferencias de energía intracelular. [ cita requerida ] Por ejemplo, el dinucleótido de nicotinamida y adenina (NAD), el dinucleótido de flavina y adenina (FAD) y el fosfato de dinucleótido de nicotinamida y adenina (NADP) contienen la fracción d -ribofuranosa . Cada uno de ellos puede derivarse de la d -ribosa después de que la enzima riboquinasa la convierta en d -ribosa 5-fosfato . [22] [23] El NAD, el FAD y el NADP actúan como aceptores de electrones en reacciones redox bioquímicas en las principales vías metabólicas, incluida la glucólisis , el ciclo del ácido cítrico , la fermentación y la cadena de transporte de electrones .

Biosíntesis de nucleótidos
Los nucleótidos se sintetizan mediante la síntesis de rescate o de novo . [24] La síntesis de rescate de nucleótidos utiliza fragmentos de nucleótidos previamente elaborados y los resintetiza para su uso futuro. En la síntesis de novo, se utilizan aminoácidos, dióxido de carbono, derivados de folato y pirofosfato de fosforribosil (PRPP) para sintetizar nucleótidos. [24] Tanto la síntesis de novo como la de rescate requieren PRPP, que se sintetiza a partir de ATP y ribosa 5-fosfato mediante una enzima llamada PRPP sintetasa . [24]
Modificaciones
Modificaciones en la naturaleza
La riboquinasa cataliza la conversión de d -ribosa en d -ribosa 5-fosfato . Una vez convertida, la d -ribosa-5-fosfato está disponible para la fabricación de los aminoácidos triptófano e histidina , o para su uso en la vía de las pentosas fosfato . La absorción de d -ribosa es del 88-100% en el intestino delgado (hasta 200 mg/kg·h). [25]
Una modificación importante ocurre en la posición C2' de la molécula de ribosa. Al añadir un grupo O-alquilo , la resistencia nuclear del ARN aumenta debido a fuerzas estabilizadoras adicionales. Estas fuerzas son estabilizadoras debido al aumento de los enlaces de hidrógeno intramoleculares y a un aumento de la estabilidad del enlace glucosídico . [26] El aumento resultante de la resistencia conduce a aumentos en la vida media del ARNi y al potencial terapéutico en células y animales. [27] La metilación de la ribosa en sitios particulares se correlaciona con una disminución de la estimulación inmunológica. [28]
Modificaciones sintéticas
Junto con la fosforilación, las moléculas de ribofuranosa pueden intercambiar su oxígeno con selenio y azufre para producir azúcares similares que solo varían en la posición 4'. Estos derivados son más lipofílicos que la molécula original. La mayor lipofilicidad hace que estas especies sean más adecuadas para su uso en técnicas como PCR , posmodificación de aptámeros de ARN , tecnología antisentido y para la faseación de datos cristalográficos de rayos X. [27]
De manera similar a las modificaciones 2' en la naturaleza, una modificación sintética de la ribosa incluye la adición de flúor en la posición 2'. Esta ribosa fluorada actúa de manera similar a la ribosa metilada porque es capaz de suprimir la estimulación inmunitaria dependiendo de la ubicación de la ribosa en la cadena de ADN. [26] La gran diferencia entre la metilación y la fluoración es que esta última solo ocurre a través de modificaciones sintéticas. La adición de flúor conduce a un aumento en la estabilización del enlace glucosídico y un aumento de los enlaces de hidrógeno intramoleculares. [26]
Usos médicos
Se ha sugerido el uso de d -ribosa en el tratamiento de la insuficiencia cardíaca congestiva [29] (así como otras formas de enfermedad cardíaca) y para el síndrome de fatiga crónica (SFC), también llamado encefalomielitis miálgica (EM) en un estudio subjetivo abierto, no ciego, no aleatorizado y no cruzado. [30]
La d -ribosa suplementaria puede eludir parte de la vía de la pentosa fosfato , una vía de producción de energía, para producir d -ribosa-5-fosfato. La enzima glucosa-6-fosfato-deshidrogenasa (G-6-PDH) a menudo escasea en las células, pero más en el tejido enfermo, como en las células miocárdicas en pacientes con enfermedad cardíaca. El suministro de d -ribosa en las mitocondrias está directamente correlacionado con la producción de ATP; la disminución del suministro de d -ribosa reduce la cantidad de ATP que se produce. Los estudios sugieren que la suplementación de d -ribosa después de la isquemia tisular (p. ej., isquemia miocárdica) aumenta la producción de ATP miocárdico y, por lo tanto, la función mitocondrial. Esencialmente, la administración de d -ribosa suplementaria evita un paso enzimático en la vía de la pentosa fosfato al proporcionar una fuente alternativa de 5-fosfo- d -ribosa 1- pirofosfato para la producción de ATP. La d -ribosa suplementaria mejora la recuperación de los niveles de ATP al mismo tiempo que reduce la lesión celular en humanos y otros animales. Un estudio sugirió que el uso de suplementos de d -ribosa reduce la incidencia de angina en hombres con enfermedad coronaria diagnosticada . [31] La d -ribosa se ha utilizado para tratar muchas afecciones patológicas , como el síndrome de fatiga crónica, la fibromialgia y la disfunción miocárdica. También se utiliza para reducir los síntomas de calambres, dolor, rigidez, etc. después del ejercicio y para mejorar el rendimiento atlético [ cita requerida ] .
Referencias
- ^ El índice Merck: una enciclopedia de productos químicos, fármacos y productos biológicos (11.ª ed.), Merck, 1989, ISBN 091191028X, 8205
- ^ Weast, Robert C., ed. (1981). Manual de química y física del CRC (62.ª edición). Boca Raton, FL: CRC Press. pág. C-506. ISBN 0-8493-0462-8.
- ^ Fischer, Emil ; Piloty, Oscar (1891). "Ueber eine neue Pentonsäure und die zweite inactive Trioxyglutarsäure" [Acerca de un nuevo ácido pentónico y el segundo ácido trioxiglutárico inactivo]. Berichte der deutschen chemischen Gesellschaft (en alemán). 24 (2): 4214–4225. doi :10.1002/cber.189102402322. Archivado desde el original el 4 de junio de 2020 . Consultado el 12 de marzo de 2020 .
- ^ Levene, Pensilvania ; Jacobs, Washington (1909). "Über Inosinsäure" [Acerca del ácido inósico]. Berichte der deutschen chemischen Gesellschaft (en alemán). 42 (1): 1198-1203. doi :10.1002/cber.190904201196.
- ^ Levene, Pensilvania ; Jacobs, Washington (1909). "Über die Pentose in den Nucleinsäuren" [Acerca de las pentosas en los ácidos nucleicos]. Berichte der deutschen chemischen Gesellschaft (en alemán). 42 (3): 3247–3251. doi :10.1002/cber.19090420351.
- ^ ab Jeanloz, Roger W. ; Fletcher, Hewitt G. (1951). "La química de la ribosa". En Hudson, Claude S. ; Cantor, Sidney M. (eds.). Avances en la química de los carbohidratos . Vol. 6. Academic Press . págs. 135–174. doi :10.1016/S0096-5332(08)60066-1. ISBN 9780080562650. PMID 14894350. Archivado desde el original el 26 de octubre de 2023 . Consultado el 15 de diciembre de 2019 .
- ^ Nechamkin, Howard (1958). "Algunas derivaciones etimológicas interesantes de la terminología química". Educación científica . 42 (5): 463–474. Bibcode :1958SciEd..42..463N. doi :10.1002/sce.3730420523.
- ^ abcd Dewick, Paul M. (2013). "El oxígeno como nucleófilo: hemicetales, hemicetales, acetales y cetales". Fundamentos de química orgánica: para estudiantes de farmacia, química medicinal y química biológica . John Wiley & Sons . págs. 224–234. ISBN 9781118681961Archivado desde el original el 26 de octubre de 2023 . Consultado el 15 de diciembre de 2019 .
- ^ Leigh, Jeffery (julio-agosto de 2012). «Sistemas de nomenclatura no pertenecientes a la IUPAC». Chemistry International . 34 (4). Unión Internacional de Química Pura y Aplicada . Archivado desde el original el 5 de diciembre de 2019 . Consultado el 15 de diciembre de 2019 .
- ^ abc Bhutani, SP (2019). "Aldopentosas: los azúcares de los ácidos nucleicos". Química de biomoléculas (2.ª ed.). CRC Press . pp. 63–65. ISBN 9781000650907Archivado desde el original el 26 de octubre de 2023 . Consultado el 15 de diciembre de 2019 .
- ^ ab Drew, Kenneth N.; Zajicek, Jaroslav; Bondo, Gail; Bose, Bidisha; Serianni, Anthony S. (febrero de 1998). "Aldopentosas marcadas con 13C: detección y cuantificación de formas cíclicas y acíclicas mediante espectroscopia de RMN heteronuclear 1D y 2D". Investigación de carbohidratos . 307 (3–4): 199–209. doi : 10.1016/S0008-6215(98)00040-8 .
- ^ de Wulf, P.; Vandamme, EJ (1997). "Síntesis microbiana de ᴅ-ribosa: desregulación metabólica y proceso de fermentación". Avances en microbiología aplicada . 44 : 167–214. doi :10.1016/S0065-2164(08)70462-3. ISBN . 9780120026449.
- ^ Tumbula, DL; Teng, Q.; Bartlett, MG; Whitman, WB (1997). "Biosíntesis de ribosa y evidencia de un primer paso alternativo en la vía de aminoácidos aromáticos comunes en Methanococcus maripaludis". Journal of Bacteriology . 179 (19): 6010–6013. doi :10.1128/jb.179.19.6010-6013.1997. PMC 179501 . PMID 9324245.
- ^ Wulf, P. De; Vandamme, EJ (1997). "Producción de d-ribosa por fermentación". Applied Microbiology and Biotechnology . 48 (2): 141–148. doi :10.1007/s002530051029. hdl : 11572/262019 . PMID 9299771. S2CID 34340369.
- ^ Steigerwald, Bill; Jones, Nancy; Furukawa, Yoshihiro (18 de noviembre de 2019). «La primera detección de azúcares en meteoritos da pistas sobre el origen de la vida». NASA . Archivado desde el original el 15 de enero de 2021. Consultado el 18 de noviembre de 2019 .
- ^ Furukawa, Yoshihiro; Chikaraishi, Yoshito; Ohkouchi, Naohiko; Ogawa, Nanako O.; Glavin, Daniel P.; Dworkin, Jason P.; Abe, Chiaki; Nakamura, Tomoki (2019). "Ribosa extraterrestre y otros azúcares en meteoritos primitivos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 116 (49): 24440–24445. Bibcode :2019PNAS..11624440F. doi : 10.1073/pnas.1907169116 . PMC 6900709 . PMID 31740594.
- ^ abcd Bloomfield, Victor; Crothers, Donald; Tinoco, Ignacio (2000). Ácidos nucleicos: estructuras, propiedades y funciones . University Science Books. págs. 19–25. ISBN 9780935702491.
- ^ Voet, Donald; Voet, Judith (2011). Bioquímica . John Wiley & Sons, Inc. págs. 1152, 1153. ISBN 978-0470570951.
- ^ Foloppe, Nicolas; MacKerell, Alexander D. (agosto de 1998). "Propiedades conformacionales de las fracciones desoxirribosa y ribosa de los ácidos nucleicos: un estudio de mecánica cuántica". The Journal of Physical Chemistry B . 102 (34): 6669–6678. doi :10.1021/jp9818683. ISSN 1520-6106.
- ^ "Arquitectura de ácidos nucleicos". fbio.uh.cu . Archivado desde el original el 17 de mayo de 2018 . Consultado el 8 de octubre de 2019 .
- ^ Neidle, Stephen (2008). "Los bloques de construcción del ADN y el ARN". En Neidle, Stephen (ed.). Principles of Nucleic Acid Structure . Academic Press . págs. 20–37. doi :10.1016/B978-012369507-9.50003-0. ISBN 9780123695079.
- ^ Bork, Peer ; Sander, Chris ; Valencia, Alfonso (1993). "Evolución convergente de funciones enzimáticas similares en diferentes pliegues proteicos: las familias de quinasas de azúcar hexoquinasa, riboquinasa y galactoquinasa". Protein Science . 2 (1): 31–40. doi : 10.1002/pro.5560020104 . PMC 2142297 . PMID 8382990.
- ^ Park, Jae; Gupta, Radhey S. (2008). "Adenosina quinasa y riboquinasa: la familia de proteínas RK". Ciencias de la vida celular y molecular . 65 (18): 2875–2896. doi :10.1007/s00018-008-8123-1. PMC 11131688 . PMID 18560757. S2CID 11439854.
- ↑ abc Puigserver, Pere (2018). "Transducción de señales y metabolómica". En Hoffman, Ronald; Benz, Edward J.; Silberstein, Leslie E.; Heslop, Helen E. (eds.). Hematología (7ª ed.). Elsevier. págs. 68–78. doi :10.1016/B978-0-323-35762-3.00007-X. ISBN 9780323357623.
- ^ "Índice de suplementos y remedios a base de hierbas de la A a la Z". PDRHealth.com . PDR, LLC. Archivado desde el original el 11 de octubre de 2008.
- ^ abc Hamlow, Lucas; He, Chenchen; Fan, Lin; Wu, Ranran; Yang, Bo; Rodgers, MT; Berden, Giel; Oomens, J. (junio de 2015). Efectos estructurales de las modificaciones de la 2'-ribosa de citidina determinadas mediante espectroscopia de acción Irmpd . 70.º Simposio Internacional sobre Espectroscopia Molecular. Universidad de Illinois en Urbana-Champaign . Bibcode :2015isms.confEMI13H. doi : 10.15278/isms.2015.MI13 .
- ^ ab Evich, Marina; Spring-Connell, Alexander M.; Germann, Markus W. (27 de enero de 2017). "Impacto de los azúcares ribosa modificados en la conformación y función de los ácidos nucleicos". Comunicaciones heterocíclicas . 23 (3): 155–165. doi : 10.1515/hc-2017-0056 . ISSN 2191-0197. S2CID 91052034.
- ^ Peacock, Hayden; Fucini, Raymond V.; Jayalath, Prasanna; Ibarra-Soza, José M.; Haringsma, Henry J.; Flanagan, W. Michael; Willingham, Aarron; Beal, Peter A. (2011). "Las modificaciones de nucleobases y ribosas controlan la inmunoestimulación por un ARN mimético de microARN-122". Revista de la Sociedad Química Americana . 133 (24): 9200–9203. doi :10.1021/ja202492e. PMC 3116021 . PMID 21612237.
- ^ Omran, Heyder; McCarter, Dean; St Cyr, John; Lüderitz, Berndt (2004). "La ᴅ-ribosa ayuda a los pacientes con insuficiencia cardíaca congestiva". Cardiología experimental y clínica . Verano (9(2)): 117–118. PMC 2716264 . PMID 19641697.
- ^ Teitelbaum, Jacob E.; Johnson, Clarence; St Cyr, John (26 de noviembre de 2006). "El uso de ᴅ-ribosa en el síndrome de fatiga crónica y fibromialgia: un estudio piloto". The Journal of Alternative and Complementary Medicine . 12 (9): 857–862. CiteSeerX 10.1.1.582.4800 . doi :10.1089/acm.2006.12.857. PMID 17109576.
- ^ "Ribosa". wa.kaiserpermanente.org . Archivado desde el original el 3 de marzo de 2021 . Consultado el 7 de octubre de 2019 .