Estructura secundaria de la proteína


La estructura secundaria de la proteína es la conformación espacial local de la cadena principal del polipéptido excluyendo las cadenas laterales. [1] Los dos elementos estructurales secundarios más comunes son las hélices alfa y las láminas beta , aunque también se encuentran los giros beta y los bucles omega . Los elementos de estructura secundaria generalmente se forman espontáneamente como un intermediario antes de que la proteína se pliegue en su estructura terciaria tridimensional .
La estructura secundaria se define formalmente por el patrón de enlaces de hidrógeno entre los átomos de hidrógeno del amino y de oxígeno del carboxilo en la cadena principal del péptido . La estructura secundaria se puede definir alternativamente en función del patrón regular de ángulos diedros de la cadena principal en una región particular del diagrama de Ramachandran, independientemente de si tiene los enlaces de hidrógeno correctos.
El concepto de estructura secundaria fue introducido por primera vez por Kaj Ulrik Linderstrøm-Lang en Stanford en 1952. [2] [3] Otros tipos de biopolímeros como los ácidos nucleicos también poseen estructuras secundarias características .
Tipos
| Atributo de geometría | hélice α | 3 10 hélice | hélice π |
|---|---|---|---|
| Residuos por vuelta | 3.6 | 3.0 | 4.4 |
| Traducción por residuo | 1,5 Å (0,15 nm) | 2,0 Å (0,20 nm) | 1,1 Å (0,11 nm) |
| Radio de hélice | 2,3 Å (0,23 nm) | 1,9 Å (0,19 nm) | 2,8 Å (0,28 nm) |
| Paso | 5,4 Å (0,54 nm) | 6,0 Å (0,60 nm) | 4,8 Å (0,48 nm) |
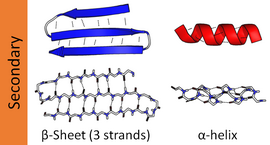

Las estructuras secundarias más comunes son las hélices alfa y las láminas beta . Se calcula que otras hélices, como la hélice 3 10 y la hélice π , tienen patrones de enlaces de hidrógeno energéticamente favorables, pero rara vez se observan en proteínas naturales, excepto en los extremos de las hélices α debido al empaquetamiento desfavorable de la cadena principal en el centro de la hélice. Otras estructuras extendidas, como la hélice de poliprolina y la lámina alfa, son raras en las proteínas en estado nativo , pero a menudo se plantean como intermediarios importantes del plegamiento de proteínas . Los giros cerrados y los bucles sueltos y flexibles unen los elementos de la estructura secundaria más "regulares". La espiral aleatoria no es una verdadera estructura secundaria, pero es la clase de conformaciones que indican una ausencia de estructura secundaria regular.
Los aminoácidos varían en su capacidad para formar los diversos elementos de estructura secundaria. La prolina y la glicina a veces se conocen como "rompedores de hélice" porque alteran la regularidad de la conformación de la cadena principal helicoidal α; sin embargo, ambos tienen capacidades conformacionales inusuales y se encuentran comúnmente en turnos . Los aminoácidos que prefieren adoptar conformaciones helicoidales en proteínas incluyen metionina , alanina , leucina , glutamato y lisina ("MALEK" en códigos de aminoácidos de 1 letra); por el contrario, los grandes residuos aromáticos ( triptófano , tirosina y fenilalanina ) y los aminoácidos C β -ramificados ( isoleucina , valina y treonina ) prefieren adoptar conformaciones de cadena β . Sin embargo, estas preferencias no son lo suficientemente fuertes como para producir un método confiable para predecir la estructura secundaria a partir de la secuencia sola.
Se cree que las vibraciones colectivas de baja frecuencia son sensibles a la rigidez local dentro de las proteínas, lo que revela que las estructuras beta son genéricamente más rígidas que las proteínas alfa o desordenadas. [6] [7] Las mediciones de dispersión de neutrones han conectado directamente la característica espectral a ~1 THz con los movimientos colectivos de la estructura secundaria de la proteína de barril beta GFP. [8]
Los patrones de enlaces de hidrógeno en las estructuras secundarias pueden estar significativamente distorsionados, lo que dificulta la determinación automática de la estructura secundaria. Existen varios métodos para definir formalmente la estructura secundaria de las proteínas (por ejemplo, DSSP , [9] DEFINE, [10] STRIDE , [11] ScrewFit, [12] SST [13] ).
Clasificación DSSP

El Diccionario de Estructura Secundaria de Proteínas, abreviado DSSP, se utiliza comúnmente para describir la estructura secundaria de las proteínas con códigos de una sola letra. La estructura secundaria se asigna en función de los patrones de enlaces de hidrógeno, como los propuestos inicialmente por Pauling et al. en 1951 (antes de que se hubiera determinado experimentalmente ninguna estructura de proteínas ). Hay ocho tipos de estructura secundaria que define DSSP:
- G = hélice de 3 vueltas ( hélice de 3 x 10 ). Longitud mínima de 3 residuos.
- H = hélice de 4 vueltas ( hélice α ). Longitud mínima 4 residuos.
- I = hélice de 5 vueltas ( hélice π ). Longitud mínima 5 residuos.
- T = vuelta unida por hidrógeno (3, 4 o 5 vueltas)
- E = cadena extendida en conformación de lámina β paralela y/o antiparalela . Longitud mínima 2 residuos.
- B = residuo en puente β aislado (formación de enlace de hidrógeno de hoja β de un solo par)
- S = curva (la única asignación no basada en enlaces de hidrógeno).
- C = bobina (residuos que no están en ninguna de las conformaciones anteriores).
El término "bobina" se suele codificar como " " (espacio), C (bobina) o "–" (guión). Se requiere que las conformaciones de hélices (G, H e I) y de lámina tengan una longitud razonable. Esto significa que 2 residuos adyacentes en la estructura primaria deben formar el mismo patrón de enlaces de hidrógeno. Si el patrón de enlaces de hidrógeno de la hélice o de la lámina es demasiado corto, se designan como T o B, respectivamente. Existen otras categorías de asignación de estructura secundaria de proteínas (giros bruscos, bucles Omega , etc.), pero se utilizan con menos frecuencia.
La estructura secundaria se define por el enlace de hidrógeno , por lo que la definición exacta de un enlace de hidrógeno es fundamental. La definición estándar de enlace de hidrógeno para la estructura secundaria es la de DSSP , que es un modelo puramente electrostático. Asigna cargas de ± q 1 ≈ 0,42 e al carbono carbonílico y al oxígeno, respectivamente, y cargas de ± q 2 ≈ 0,20 e al hidrógeno y al nitrógeno de la amida, respectivamente. La energía electrostática es
Según la DSSP, existe un enlace de hidrógeno si y solo si E es menor que −0,5 kcal/mol (−2,1 kJ/mol). Aunque la fórmula de la DSSP es una aproximación relativamente rudimentaria de la energía física del enlace de hidrógeno, se acepta generalmente como una herramienta para definir la estructura secundaria.
temperatura media del mar[13]clasificación
La SST es un método bayesiano para asignar una estructura secundaria a los datos de coordenadas de proteínas utilizando el criterio de información de Shannon de inferencia de longitud mínima de mensaje ( MML ). La SST trata cualquier asignación de estructura secundaria como una hipótesis potencial que intenta explicar ( comprimir ) los datos de coordenadas de proteínas dados. La idea central es que la mejor asignación de estructura secundaria es la que puede explicar ( comprimir ) las coordenadas de una proteína dada de la manera más económica, vinculando así la inferencia de la estructura secundaria a la compresión de datos sin pérdida . La SST delinea con precisión cualquier cadena de proteínas en regiones asociadas con los siguientes tipos de asignación: [14]
- E = Hebra (extendida) de una lámina β-plegada
- G = hélice dextrógira 3 x 10
- H = hélice α dextrógira
- I = π - hélice dextrógira
- g = hélice zurda 3 10
- h = hélice α zurda
- i = π - hélice zurda
- 3 = 3 10 -como Turn
- 4 = Giro tipo α
- 5 = π- como Giro
- T = Giro no especificado
- C = Bobina
- - = Residuo no asignado
SST detecta las tapas helicoidales π y 3 10 en hélices α estándar y ensambla automáticamente las distintas cadenas extendidas en láminas β plegadas uniformes. Proporciona una salida legible de elementos estructurales secundarios diseccionados y un script correspondiente cargable en PyMol para visualizar los elementos estructurales secundarios asignados individualmente.
Determinación experimental
El contenido aproximado de estructura secundaria de un biopolímero (por ejemplo, "esta proteína es 40% α-hélice y 20% β-lámina ") se puede estimar espectroscópicamente . [15] Para las proteínas, un método común es el dicroísmo circular ultravioleta lejano (UV lejano, 170-250 nm) . Un mínimo doble pronunciado a 208 y 222 nm indica una estructura α-helicoidal, mientras que un mínimo único a 204 nm o 217 nm refleja una estructura de bobina aleatoria o de lámina β, respectivamente. Un método menos común es la espectroscopia infrarroja , que detecta diferencias en las oscilaciones de enlace de los grupos amida debido a la unión de hidrógeno. Finalmente, los contenidos de estructura secundaria se pueden estimar con precisión utilizando los desplazamientos químicos de un espectro de RMN inicialmente no asignado . [16]
Predicción
Predecir la estructura terciaria de una proteína únicamente a partir de su secuencia de aminoácidos es un problema muy desafiante (ver predicción de la estructura de una proteína ), pero usar definiciones de estructura secundaria más simples es más manejable.
Los primeros métodos de predicción de la estructura secundaria se limitaban a predecir los tres estados predominantes: hélice, lámina o espiral aleatoria. Estos métodos se basaban en las propensiones de formación de hélices o láminas de aminoácidos individuales, a veces acopladas con reglas para estimar la energía libre de los elementos de formación de la estructura secundaria. Las primeras técnicas ampliamente utilizadas para predecir la estructura secundaria de las proteínas a partir de la secuencia de aminoácidos fueron el método de Chou-Fasman [17] [18] [19] y el método GOR [20] . Aunque dichos métodos afirmaban alcanzar una precisión de aproximadamente el 60 % en la predicción de cuál de los tres estados (hélice/lámina/espiral) adopta un residuo, las evaluaciones de computación a ciegas mostraron posteriormente que la precisión real era mucho menor. [21]
Se logró un aumento significativo en la precisión (hasta casi ~80%) al explotar la alineación de secuencias múltiples ; conocer la distribución completa de los aminoácidos que se encuentran en una posición (y en sus proximidades, típicamente ~7 residuos a cada lado) a lo largo de la evolución proporciona una imagen mucho mejor de las tendencias estructurales cerca de esa posición. [22] [23] A modo de ilustración, una proteína dada podría tener una glicina en una posición dada, lo que por sí solo podría sugerir una espiral aleatoria allí. Sin embargo, la alineación de secuencias múltiples podría revelar que los aminoácidos que favorecen la hélice se encuentran en esa posición (y posiciones cercanas) en el 95% de las proteínas homólogas que abarcan casi mil millones de años de evolución. Además, al examinar la hidrofobicidad promedio en esa posición y posiciones cercanas, la misma alineación también podría sugerir un patrón de accesibilidad al solvente de residuos consistente con una hélice α. Tomados en conjunto, estos factores sugerirían que la glicina de la proteína original adopta una estructura de hélice α, en lugar de una espiral aleatoria. Se utilizan varios tipos de métodos para combinar todos los datos disponibles y formar una predicción de tres estados, incluidas las redes neuronales , los modelos ocultos de Markov y las máquinas de vectores de soporte . Los métodos de predicción modernos también proporcionan una puntuación de confianza para sus predicciones en cada posición.
Los métodos de predicción de estructura secundaria se evaluaron mediante experimentos de Evaluación crítica de la predicción de la estructura de proteínas (CASP) y se compararon continuamente, por ejemplo, con EVA (referencia) . Con base en estas pruebas, los métodos más precisos fueron Psipred , SAM, [24] PORTER, [25] PROF, [26] y SABLE. [27] El área principal de mejora parece ser la predicción de cadenas β; es probable que los residuos predichos con confianza como cadenas β lo sean, pero los métodos tienden a pasar por alto algunos segmentos de cadenas β (falsos negativos). Es probable que haya un límite superior de ~90% de precisión de predicción en general, debido a las idiosincrasias del método estándar ( DSSP ) para asignar clases de estructura secundaria (hélice/cadena/bobina) a las estructuras PDB, contra las cuales se comparan las predicciones. [28]
La predicción precisa de la estructura secundaria es un elemento clave en la predicción de la estructura terciaria , en todos los casos excepto en los más simples ( modelado por homología ). Por ejemplo, un patrón predicho con seguridad de seis elementos de estructura secundaria βαββαβ es la firma de un pliegue de ferredoxina . [29]
Aplicaciones
Tanto las estructuras secundarias de proteínas como las de ácidos nucleicos pueden utilizarse para facilitar el alineamiento de múltiples secuencias . Estos alineamientos pueden hacerse más precisos mediante la inclusión de información de estructura secundaria además de información de secuencia simple. Esto a veces es menos útil en el ARN porque el apareamiento de bases está mucho más conservado que la secuencia. Las relaciones distantes entre proteínas cuyas estructuras primarias no se pueden alinear a veces se pueden encontrar mediante la estructura secundaria. [22]
Se ha demostrado que las hélices α son más estables, resistentes a las mutaciones y más fáciles de diseñar que las cadenas β en las proteínas naturales, [30] por lo que diseñar proteínas α funcionales es probablemente más fácil que diseñar proteínas con hélices y cadenas; esto se ha confirmado experimentalmente recientemente. [31]
Véase también
Referencias
- ^ Sun PD, Foster CE, Boyington JC (mayo de 2004). "Descripción general de los pliegues estructurales y funcionales de las proteínas". Protocolos actuales en ciencia de las proteínas . 17 (1): Unidad 17.1. doi :10.1002/0471140864.ps1701s35. PMC 7162418. PMID 18429251 .
- ^ Linderstrøm-Lang KU (1952). Conferencias médicas de Lane: proteínas y enzimas . Stanford University Press. pág. 115. ASIN B0007J31SC.
- ^ Schellman JA, Schellman CG (1997). "Kaj Ulrik Linderstrøm-Lang (1896–1959)". Protein Sci . 6 (5): 1092–100. doi :10.1002/pro.5560060516. PMC 2143695 . PMID 9144781.
Ya había introducido los conceptos de la estructura primaria, secundaria y terciaria de las proteínas en la tercera conferencia Lane (Linderstram-Lang, 1952).
- ^ Bottomley S (2004). «Tutorial interactivo sobre la estructura de las proteínas». Archivado desde el original el 1 de marzo de 2011. Consultado el 9 de enero de 2011 .
- ^ Schulz GE, Schirmer RH (1979). Principios de la estructura de las proteínas. Nueva York: Springer-Verlag. ISBN 0-387-90386-0.OCLC 4498269 .
- ^ Perticaroli S, Nickels JD, Ehlers G, O'Neill H, Zhang Q, Sokolov AP (octubre de 2013). "Estructura secundaria y rigidez en proteínas modelo". Soft Matter . 9 (40): 9548–56. Bibcode :2013SMat....9.9548P. doi :10.1039/C3SM50807B. PMID 26029761.
- ^ Perticaroli S, Nickels JD, Ehlers G, Sokolov AP (junio de 2014). "Rigidez, estructura secundaria y la universalidad del pico del bosón en proteínas". Biophysical Journal . 106 (12): 2667–74. Bibcode :2014BpJ...106.2667P. doi :10.1016/j.bpj.2014.05.009. PMC 4070067 . PMID 24940784.
- ^ Nickels JD, Perticaroli S, O'Neill H, Zhang Q, Ehlers G, Sokolov AP (2013). "Dispersión coherente de neutrones y dinámica colectiva en la proteína GFP". Biophys. J . 105 (9): 2182–87. Bibcode :2013BpJ...105.2182N. doi :10.1016/j.bpj.2013.09.029. PMC 3824694 . PMID 24209864.
- ^ Kabsch W, Sander C (diciembre de 1983). "Diccionario de la estructura secundaria de proteínas: reconocimiento de patrones de enlaces de hidrógeno y características geométricas". Biopolímeros . 22 (12): 2577–637. doi :10.1002/bip.360221211. PMID 6667333. S2CID 29185760.
- ^ Richards FM, Kundrot CE (1988). "Identificación de motivos estructurales a partir de datos de coordenadas de proteínas: estructura secundaria y estructura supersecundaria de primer nivel". Proteínas . 3 (2): 71–84. doi :10.1002/prot.340030202. PMID 3399495. S2CID 29126855.
- ^ Frishman D, Argos P (diciembre de 1995). "Asignación de estructura secundaria de proteínas basada en conocimiento" (PDF) . Proteínas . 23 (4): 566–79. CiteSeerX 10.1.1.132.9420 . doi :10.1002/prot.340230412. PMID 8749853. S2CID 17487756. Archivado desde el original (PDF) el 2010-06-13.
- ^ Calligari PA, Kneller GR (diciembre de 2012). "ScrewFit: combinación de localización y descripción de la estructura secundaria de proteínas". Acta Crystallographica Sección D. 68 ( Pt 12): 1690–3. doi :10.1107/s0907444912039029. PMID 23151634.
- ^ ab Konagurthu AS, Lesk AM, Allison L (junio de 2012). "Inferencia de la longitud mínima del mensaje de la estructura secundaria a partir de datos de coordenadas de proteínas". Bioinformática . 28 (12): i97–i105. doi :10.1093/bioinformatics/bts223. PMC 3371855 . PMID 22689785.
- ^ "Servidor web SST" . Consultado el 17 de abril de 2018 .
- ^ Pelton JT, McLean LR (2000). "Métodos espectroscópicos para el análisis de la estructura secundaria de proteínas". Anal. Biochem . 277 (2): 167–76. doi :10.1006/abio.1999.4320. PMID 10625503.
- ^ Meiler J, Baker D (2003). "Determinación rápida del plegamiento de proteínas utilizando datos de RMN no asignados". Proc. Natl. Sci. USA . 100 (26): 15404–09. Bibcode :2003PNAS..10015404M. doi : 10.1073/pnas.2434121100 . PMC 307580 . PMID 14668443.
- ^ Chou PY, Fasman GD (enero de 1974). "Predicción de la conformación de proteínas". Bioquímica . 13 (2): 222–45. doi :10.1021/bi00699a002. PMID 4358940.
- ^ Chou PY, Fasman GD (1978). "Predicciones empíricas de la conformación de proteínas". Revista Anual de Bioquímica . 47 : 251–76. doi :10.1146/annurev.bi.47.070178.001343. PMID 354496.
- ^ Chou PY, Fasman GD (1978). "Predicción de la estructura secundaria de las proteínas a partir de su secuencia de aminoácidos". Avances en enzimología y áreas relacionadas de la biología molecular . Avances en enzimología y áreas relacionadas de la biología molecular. Vol. 47. págs. 45–148. doi :10.1002/9780470122921.ch2. ISBN 9780470122921. PMID 364941.
- ^ Garnier J, Osguthorpe DJ, Robson B (marzo de 1978). "Análisis de la precisión y las implicaciones de métodos simples para predecir la estructura secundaria de proteínas globulares". Journal of Molecular Biology . 120 (1): 97–120. doi :10.1016/0022-2836(78)90297-8. PMID 642007.
- ^ Kabsch W, Sander C (mayo de 1983). "¿Qué tan buenas son las predicciones de la estructura secundaria de las proteínas?". FEBS Letters . 155 (2): 179–82. doi :10.1016/0014-5793(82)80597-8. PMID 6852232. S2CID 41477827.
- ^ ab Simossis VA, Heringa J (agosto de 2004). "Integración de la predicción de la estructura secundaria de proteínas y alineamiento de secuencias múltiples". Current Protein & Peptide Science . 5 (4): 249–66. doi :10.2174/1389203043379675. PMID 15320732.
- ^ Pirovano W, Heringa J (2010). "Predicción de la estructura secundaria de proteínas". Técnicas de minería de datos para las ciencias de la vida . Métodos en biología molecular. Vol. 609. págs. 327–48. doi :10.1007/978-1-60327-241-4_19. ISBN 978-1-60327-240-7. PMID20221928 .
- ^ Karplus K (2009). "SAM-T08, predicción de la estructura de proteínas basada en HMM". Nucleic Acids Res . 37 (edición del servidor web): W492–97. doi :10.1093/nar/gkp403. PMC 2703928 . PMID 19483096.
- ^ Pollastri G, McLysaght A (2005). "Porter: un servidor nuevo y preciso para la predicción de la estructura secundaria de proteínas". Bioinformática . 21 (8): 1719–20. doi : 10.1093/bioinformatics/bti203 . hdl : 2262/39594 . PMID 15585524.
- ^ Yachdav G, Kloppmann E, Kajan L, Hecht M, Goldberg T, Hamp T, Hönigschmid P, Schafferhans A, Roos M, Bernhofer M, Richter L, Ashkenazy H, Punta M, Schlessinger A, Bromberg Y, Schneider R, Vriend G, Sander C, Ben-Tal N, Rost B (2014). "PredictProtein: un recurso abierto para la predicción en línea de las características estructurales y funcionales de las proteínas". Nucleic Acids Res . 42 (edición del servidor web): W337–43. doi :10.1093/nar/gku366. PMC 4086098 . PMID 24799431.
- ^ Adamczak R, Porollo A, Meller J (2005). "Combinación de predicción de estructura secundaria y accesibilidad a solventes en proteínas". Proteins . 59 (3): 467–75. doi :10.1002/prot.20441. PMID 15768403. S2CID 13267624.
- ^ Kihara D (agosto de 2005). "El efecto de las interacciones de largo alcance en la formación de la estructura secundaria de las proteínas". Protein Science . 14 (8): 1955–963. doi :10.1110/ps.051479505. PMC 2279307 . PMID 15987894.
- ^ Qi Y, Grishin NV (2005). "Clasificación estructural de proteínas plegadas similares a tiorredoxina" (PDF) . Proteínas . 58 (2): 376–88. CiteSeerX 10.1.1.644.8150 . doi :10.1002/prot.20329. PMID 15558583. S2CID 823339.
Dado que la definición de pliegue debe incluir solo los elementos estructurales secundarios centrales que están presentes en la mayoría de los homólogos, definimos el pliegue similar a la tiorredoxina como un sándwich α/β de dos capas con el patrón de estructura secundaria βαβββα.
- ^ Abrusán G, Marsh JA (diciembre de 2016). "Las hélices alfa son más resistentes a las mutaciones que las cadenas beta". PLOS Computational Biology . 12 (12): e1005242. Bibcode :2016PLSCB..12E5242A. doi : 10.1371/journal.pcbi.1005242 . PMC 5147804 . PMID 27935949.
- ^ Rocklin GJ, Chidyausiku TM, Goreshnik I, Ford A, Houliston S, Lemak A, et al. (julio de 2017). "Análisis global del plegamiento de proteínas mediante diseño, síntesis y pruebas masivamente paralelas". Science . 357 (6347): 168–175. Bibcode :2017Sci...357..168R. doi :10.1126/science.aan0693. PMC 5568797 . PMID 28706065.
Lectura adicional
- Branden C, Tooze J (1999). Introducción a la estructura de las proteínas (2.ª ed.). Nueva York: Garland Science. ISBN 978-0815323051.
- Pauling L , Corey RB (1951). "Configuraciones de cadenas polipeptídicas con orientaciones favorecidas alrededor de enlaces simples: dos nuevas láminas plegadas". Proc. Natl. Sci. USA . 37 (11): 729–40. Bibcode :1951PNAS...37..729P. doi : 10.1073/pnas.37.11.729 . PMC 1063460 . PMID 16578412.(El artículo original sobre la conformación de la hoja beta).
- Pauling L , Corey RB , Branson HR (1951). "La estructura de las proteínas; dos configuraciones helicoidales unidas por enlaces de hidrógeno de la cadena polipeptídica". Proc. Natl. Sci. EE. UU . . 37 (4): 205–11. Bibcode :1951PNAS...37..205P. doi : 10.1073/pnas.37.4.205 . PMC 1063337 . PMID 14816373.(conformaciones de hélice alfa y pi, ya que predijeron que las hélices no serían posibles).
Enlaces externos
- NetSurfP – Predictor de accesibilidad de superficies y estructuras secundarias
- PROFE
- Ajuste por tornillo
- PSSpred Un programa de entrenamiento de redes neuronales múltiples para la predicción de la estructura secundaria de proteínas
- Metaservidor Genesilico Metaservidor que permite ejecutar más de 20 predictores de estructura secundaria diferentes con un solo clic
- Servidor web SST: una asignación estructural secundaria basada en la teoría de la información (basada en la compresión).


