Cobalto
El cobalto es un elemento químico de símbolo Co y número atómico 27. Al igual que el níquel , el cobalto se encuentra en la corteza terrestre solo en forma químicamente combinada, salvo en pequeños depósitos que se encuentran en aleaciones de hierro meteórico natural . El elemento libre , producido por fundición reductora, es un metal gris, duro, brillante y algo quebradizo .
Los pigmentos azules a base de cobalto ( azul cobalto ) se han utilizado desde la antigüedad para joyería y pinturas, y para impartir un tinte azul distintivo al vidrio. Durante mucho tiempo se creyó que el color se debía al metal bismuto . Los mineros habían utilizado durante mucho tiempo el nombre de mineral de kobold ( en alemán , mineral de duende ) para algunos de los minerales productores de pigmentos azules . Se los llamó así porque eran pobres en metales conocidos y emitían humos venenosos que contenían arsénico cuando se fundían. [8] En 1735, se descubrió que dichos minerales eran reducibles a un nuevo metal (el primero descubierto desde la antigüedad), que finalmente recibió el nombre del kobold .
En la actualidad, parte del cobalto se produce específicamente a partir de varios minerales con brillo metálico, como la cobaltita (CoAsS). El elemento se produce más habitualmente como subproducto de la minería de cobre y níquel. El Cinturón de Cobre en la República Democrática del Congo (RDC) y Zambia produce la mayor parte de la producción mundial de cobalto. La producción mundial en 2016 fue de 116.000 toneladas (114.000 toneladas largas; 128.000 toneladas cortas) (según Recursos Naturales de Canadá ), y la RDC por sí sola representó más del 50%. [9]
El cobalto se utiliza principalmente en baterías de iones de litio y en la fabricación de aleaciones magnéticas , resistentes al desgaste y de alta resistencia . Los compuestos silicato de cobalto y aluminato de cobalto (II) ( CoAl2O4 , azul cobalto) dan un color azul intenso distintivo al vidrio , la cerámica , las tintas , las pinturas y los barnices . El cobalto se presenta de forma natural como un solo isótopo estable , el cobalto-59. El cobalto-60 es un radioisótopo de importancia comercial, utilizado como trazador radiactivo y para la producción de rayos gamma de alta energía . El cobalto también se utiliza en la industria petrolera como catalizador al refinar el petróleo crudo. Esto es para purgarlo de azufre, que es muy contaminante cuando se quema y causa lluvia ácida. [10]
El cobalto es el centro activo de un grupo de coenzimas llamadas cobalaminas . La vitamina B 12 , el ejemplo más conocido de este tipo, es una vitamina esencial para todos los animales. El cobalto en forma inorgánica también es un micronutriente para bacterias , algas y hongos .
El nombre cobalto deriva de un tipo de mineral considerado una molestia por los mineros de plata alemanes del siglo XVI, que a su vez puede haber recibido el nombre de un espíritu o duende considerado supersticiosamente responsable de él; este espíritu es considerado equitativo al kobold (un espíritu doméstico ) por algunos, o categorizado como un gnomo (espíritu de la mina) por otros.
Características

El cobalto es un metal ferromagnético con una gravedad específica de 8,9. La temperatura de Curie es de 1115 °C (2039 °F) [11] y el momento magnético es de 1,6–1,7 magnetones de Bohr por átomo . [12] El cobalto tiene una permeabilidad relativa dos tercios de la del hierro . [13] El cobalto metálico se presenta en dos estructuras cristalográficas : hcp y fcc . La temperatura de transición ideal entre las estructuras hcp y fcc es de 450 °C (842 °F), pero en la práctica la diferencia de energía entre ellas es tan pequeña que el crecimiento aleatorio de las dos es común. [14] [15] [16]
El cobalto es un metal débilmente reductor que está protegido de la oxidación por una película de óxido pasivante . Es atacado por halógenos y azufre . El calentamiento en oxígeno produce Co3O4 que pierde oxígeno a 900 °C (1650 °F) para dar el monóxido CoO. [17] El metal reacciona con flúor (F2 ) a 520 K para dar CoF3 ; con cloro ( Cl2), bromo (Br2) y yodo (I2), produciendo haluros binarios equivalentes. No reacciona con gas hidrógeno ( H2 ) o gas nitrógeno ( N2 ) incluso cuando se calienta , pero sí reacciona con boro , carbono , fósforo , arsénico y azufre . [ 18 ] A temperaturas ordinarias, reacciona lentamente con ácidos minerales y muy lentamente con aire húmedo , pero no seco. [ cita requerida ]
Compuestos
Los estados de oxidación comunes del cobalto incluyen +2 y +3, aunque también se conocen compuestos con estados de oxidación que van desde -3 a +5 . Un estado de oxidación común para compuestos simples es +2 (cobalto(II)). Estas sales forman el complejo acuoso metálico de color rosa [Co(H
2O)
6]2+
en agua. La adición de cloruro da como resultado el azul intenso [CoCl
4]2−
. [6] En una prueba de llama con perlas de bórax , el cobalto muestra un color azul profundo tanto en llamas oxidantes como reductoras. [19]
Compuestos de oxígeno y calcógeno
Se conocen varios óxidos de cobalto. El óxido de cobalto (II) verde (CoO) tiene estructura de sal de roca . Se oxida fácilmente con agua y oxígeno a hidróxido de cobalto (III) marrón (Co(OH) 3 ). A temperaturas de 600-700 °C, el CoO se oxida al óxido de cobalto (II,III) azul (Co 3 O 4 ), que tiene una estructura de espinela . [6] También se conoce el óxido de cobalto (III) negro (Co 2 O 3 ). [20] Los óxidos de cobalto son antiferromagnéticos a baja temperatura : CoO ( temperatura de Néel 291 K) y Co 3 O 4 (temperatura de Néel: 40 K), que es análogo a la magnetita (Fe 3 O 4 ), con una mezcla de estados de oxidación +2 y +3. [21]
Los principales calcogenuros de cobalto son los sulfuros de cobalto (II) negro , CoS 2 ( estructura de pirita ), Co 2 S 3 ( estructura de espinela ) y CoS ( estructura de arseniuro de níquel ). [6] : 1118
Haluros
-chloride-hexahydrate-sample.jpg/440px-Cobalt(II)-chloride-hexahydrate-sample.jpg)
Se conocen cuatro dihaluros de cobalto(II): fluoruro de cobalto(II) (CoF 2 , rosa), cloruro de cobalto(II) (CoCl 2 , azul), bromuro de cobalto(II) (CoBr 2 , verde) y yoduro de cobalto(II) (CoI 2 , azul-negro). Estos haluros existen en forma anhidra e hidratada. Mientras que el dicloruro anhidro es azul, el hidrato es rojo. [22]
El potencial de reducción para la reacción Co3+
+ e − → Co2+
es +1,92 V, más allá de eso para el cloro a cloruro, +1,36 V. En consecuencia, el cloruro de cobalto (III) se reduciría espontáneamente a cloruro de cobalto (II) y cloro. Debido a que el potencial de reducción para el flúor a fluoruro es tan alto, +2,87 V, el fluoruro de cobalto (III) es uno de los pocos compuestos estables simples de cobalto (III). El fluoruro de cobalto (III), que se utiliza en algunas reacciones de fluoración, reacciona vigorosamente con el agua. [17]
Compuestos de coordinación
El inventario de complejos es muy grande. A partir de los estados de oxidación más altos, los complejos de Co(IV) y Co(V) son raros. Se encuentran ejemplos en el hexafluorocobaltato(IV) de cesio (Cs2CoF6 ) y el percobaltato de potasio ( K3CoO4 ) . [ 17 ]
El cobalto (III) forma una amplia variedad de complejos de coordinación con amoníaco y aminas, que se denominan complejos de amina . Los ejemplos incluyen [Co(NH 3 ) 6 ] 3+ , [Co(NH 3 ) 5 Cl] 2+ ( cloropentamminocobalto (III) ), y cis - y trans - [Co(NH 3 ) 4 Cl 2 ] + . Los complejos de etilendiamina correspondientes también son bien conocidos. Se conocen análogos en los que los haluros se reemplazan por nitrito , hidróxido , carbonato , etc. Alfred Werner trabajó extensamente en estos complejos en su trabajo ganador del premio Nobel. [23] La robustez de estos complejos se demuestra por la resolución óptica de tris(etilendiamina)cobalto (III) ( [Co(en)
3]3+
). [24]
El cobalto (II) forma una amplia variedad de complejos, pero principalmente con ligandos débilmente básicos. El catión de color rosa hexaaquocobalto (II) [Co(H 2 O) 6 ] 2+ se encuentra en varias sales de cobalto habituales, como el nitrato y el sulfato. Tras la adición de exceso de cloruro, las soluciones del complejo hexaaquo se convierten en el azul intenso CoCl2−4, que es tetraédrico.
Los ligandos más suaves como la trifenilfosfina forman complejos con Co(II) y Co(I), siendo algunos ejemplos el cloruro de bis- y tris(trifenilfosfina)cobalto(I), CoCl 2 (PPh 3 ) 2 y CoCl(PPh 3 ) 3 . Estos complejos de Co(I) y Co(II) representan un enlace con los complejos organometálicos descritos a continuación.
Compuestos organometálicos
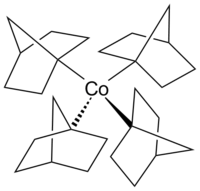
El cobaltoceno es un análogo estructural del ferroceno , con cobalto en lugar de hierro. El cobaltoceno es mucho más sensible a la oxidación que el ferroceno. [25] El carbonilo de cobalto ( Co 2 (CO) 8 ) es un catalizador en reacciones de carbonilación e hidrosililación . [26] La vitamina B 12 (ver más abajo ) es un compuesto organometálico que se encuentra en la naturaleza y es la única vitamina que contiene un átomo de metal. [27] Un ejemplo de un complejo de alquilcobalto en el estado de oxidación +4, por lo demás poco común, del cobalto es el complejo homoléptico tetrakis(1-norbornil)cobalto(IV) (Co(1-norb) 4 ), un complejo de metal de transición-alquilo que es notable por su resistencia a la eliminación de β-hidrógeno , [28] de acuerdo con la regla de Bredt . Los complejos de cobalto(III) y cobalto(V) [Li(THF)
4]+
[Co(1-norb)
4]−
y [Co(1-norb)
4]+
[Novio]
4]−
También se conocen. [29]
Isótopos
El 59 Co es el único isótopo estable del cobalto y el único que existe de forma natural en la Tierra. Se han caracterizado veintidós radioisótopos : el más estable, el 60 Co , tiene una vida media de 5,2714 años; el 57 Co tiene una vida media de 271,8 días; el 56 Co tiene una vida media de 77,27 días; y el 58 Co tiene una vida media de 70,86 días. Todos los demás isótopos radiactivos del cobalto tienen vidas medias inferiores a 18 horas y, en la mayoría de los casos, inferiores a 1 segundo. Este elemento también tiene 4 estados meta , todos ellos con vidas medias inferiores a 15 minutos. [30]
Los isótopos del cobalto tienen un peso atómico que va desde 50 u ( 50 Co) hasta 73 u ( 73 Co). El modo de desintegración principal de los isótopos con valores unitarios de masa atómica menores que el del único isótopo estable, 59 Co, es la captura de electrones y el modo de desintegración principal de los isótopos con masa atómica mayor que 59 unidades de masa atómica es la desintegración beta . Los principales productos de desintegración por debajo de 59 Co son los isótopos del elemento 26 ( hierro ); por encima de este valor, los productos de desintegración son los isótopos del elemento 28 (níquel). [30]
Etimología
Se han propuesto muchas versiones diferentes sobre el origen de la palabra "cobalto". En una versión, el elemento cobalto recibió su nombre de " kobelt ", el nombre que los mineros de plata alemanes del siglo XVI habían dado a un tipo de mineral molesto que se encontraba en el lugar y que era corrosivo y emitía gases venenosos. [31] [32] Aunque estos minerales se habían utilizado para la pigmentación azul desde la antigüedad, los alemanes en ese momento no tenían la tecnología para fundir el mineral en metal (cf. § Historia a continuación). [33]
La autoridad sobre dicho mineral kobelt (latinizado como cobalto o cadmia [34] [35] ) en ese momento era Georgius Agricola . [31] [33] También fue la autoridad citada a menudo sobre los espíritus de minas llamados " kobel " (latinizado como cobalus o pl. cobali ) en una obra separada. [36] [37] [38]
Agricola no hizo una conexión entre el mineral de nombre similar y el espíritu. Sin embargo, una conexión causal (el mineral se atribuyó a "kobel") fue hecha por un contemporáneo [40] y una conexión de origen de la palabra (la palabra "formada" a partir de cobalus ) hecha por un escritor de finales del siglo XVIII. [41] Más tarde, el diccionario de Grimms (1868) señaló que el mineral de kobalto/kobelt fue atribuido al espíritu de la montaña ( Bergmännchen[b] ), que también fue considerado responsable de "robar la plata y producir un mineral que causó una atmósfera minera pobre ( Wetter [42] ) y otros riesgos para la salud". [32]
Las entradas del diccionario de los hermanos Grimm equiparaban la palabra "kobel" con "kobold", y la enumeraban como una mera variante diminutiva , [44] pero el último se define en él como un espíritu doméstico . [43] Mientras que algunos de los comentaristas más recientes prefieren caracterizar al homónimo del mineral, kobelt (recté kobel ), como un gnomo . [45] [48]
El Oxford English Dictionary de principios del siglo XX (primera edición, 1908) había confirmado la etimología de Grimm. [c] [49] Pero casi al mismo tiempo en Alemania, se estaba proponiendo como más convincente la etimología alternativa no respaldada por Grimm ( kob/kof "casa, cámara" + walt "poder, gobernante"). [50] [51]
Un poco más tarde, Paul Kretschmer (1928) explicó que si bien esta etimología de "gobernante de la casa" era la adecuada que respaldaba el significado original de kobold como espíritu del hogar, más tarde se produjo una corrupción que introdujo la idea de "demonio de la mina". [52] La edición actual del Etymologisches Wörterbuch (25.ª ed., 2012) en "kobold" enumera esta última, no la etimología de Grimm, pero aún persiste, en su entrada para "kobalto", que si bien el mineral de cobalto puede haber obtenido su nombre de "un tipo de espíritu/demonio de la mina" ( daemon metallicus ) al tiempo que afirma que este es "aparentemente" el kobold. [53]
Joseph William Mellor (1935) también afirmó que el cobalto puede derivar del kobalos ( κόβαλος ), aunque se habían sugerido otras teorías. [54]
Teorías alternativas
Se han sugerido varias etimologías alternativas que pueden no implicar en absoluto un espíritu (kobel o kobold). Karl Müller-Fraureuth conjeturó que kobelt derivaba de Kübel , un cubo utilizado en minería, mencionado con frecuencia por Agricola, [50] es decir, kobel/köbel (latinizado como modulus ). [55]
Otra teoría dada por el Etymologisches Wörterbuch deriva el término de kōbathium [53] o más bien cobathia ( κωβάθια , "sulfuro de arsénico" [56] ) que se presenta en forma de humos nocivos. [33]
Emanuel Merck (1902) sugirió una etimología del eslavo kowalti . [57] [54]
WW Skeat y J. Berendes interpretaron al κόβαλος como un "parásito", es decir, como un mineral parásito del níquel , [54] pero esta explicación es criticada por su anacronismo ya que el níquel no fue descubierto hasta 1751. [58] [59]
Historia

Los compuestos de cobalto se han utilizado durante siglos para impartir un color azul intenso al vidrio , los esmaltes y la cerámica . Se ha detectado cobalto en esculturas egipcias, joyas persas del tercer milenio a. C., en las ruinas de Pompeya , destruida en el año 79 d. C., y en China, que datan de la dinastía Tang (618-907 d. C.) y la dinastía Ming (1368-1644 d. C.). [60]
El cobalto se ha utilizado para dar color al vidrio desde la Edad del Bronce . La excavación del naufragio de Uluburun permitió descubrir un lingote de vidrio azul, fundido durante el siglo XIV a. C. [61] [62] El vidrio azul de Egipto se coloreaba con cobre, hierro o cobalto. El vidrio de color cobalto más antiguo es de la dinastía XVIII de Egipto (1550-1292 a. C.). Se desconoce la fuente del cobalto que utilizaban los egipcios. [63]
La palabra cobalto se deriva del término alemán del siglo XVI " kobelt ", un tipo de mineral, como se mencionó anteriormente. Los primeros intentos de fundir esos minerales para obtener cobre o plata fracasaron, y en su lugar se obtuvo simplemente polvo (óxido de cobalto (II)). Debido a que los minerales primarios de cobalto siempre contienen arsénico, la fundición del mineral oxidó el arsénico en óxido de arsénico altamente tóxico y volátil , lo que aumentó la notoriedad del mineral. [64] Paracelso , Georgius Agricola y Basil Valentine se refirieron a estos silicatos como "cobalto". [65]
Al químico sueco Georg Brandt (1694-1768) se le atribuye el descubrimiento del cobalto en 1735 , demostrando que era un elemento previamente desconocido, distinto del bismuto y otros metales tradicionales. Brandt lo llamó un nuevo "semimetal", [66] [67] nombrándolo por el mineral del que lo había extraído. [68] : 153 Demostró que los compuestos de cobalto metálico eran la fuente del color azul del vidrio, que anteriormente se había atribuido al bismuto encontrado con cobalto. El cobalto se convirtió en el primer metal en ser descubierto desde el período prehistórico. Todos los metales conocidos anteriormente (hierro, cobre, plata, oro, zinc, mercurio, estaño, plomo y bismuto) no tenían descubridores registrados. [69]
Durante el siglo XIX, una parte significativa de la producción mundial de azul de cobalto (un pigmento hecho con compuestos de cobalto y alúmina) y esmalte ( vidrio de cobalto en polvo para su uso con fines pigmentarios en cerámica y pintura) se llevó a cabo en el Blaafarveværket noruego . [70] [71] Las primeras minas para la producción de esmalte en el siglo XVI se ubicaron en Noruega, Suecia, Sajonia y Hungría. Con el descubrimiento de mineral de cobalto en Nueva Caledonia en 1864, la minería de cobalto en Europa disminuyó. Con el descubrimiento de depósitos de mineral en Ontario , Canadá, en 1904 y el descubrimiento de depósitos aún más grandes en la provincia de Katanga en el Congo en 1914, las operaciones mineras cambiaron nuevamente. [64] Cuando comenzó el conflicto de Shaba en 1978, las minas de cobre de la provincia de Katanga casi detuvieron la producción. [72] [73] El impacto de este conflicto sobre la economía mundial del cobalto fue menor de lo esperado: el cobalto es un metal raro, el pigmento es altamente tóxico y la industria ya había establecido formas efectivas de reciclar materiales de cobalto. En algunos casos, la industria pudo cambiar a alternativas sin cobalto. [72] [73]
En 1938, John Livingood y Glenn T. Seaborg descubrieron el radioisótopo cobalto-60 . [74] Este isótopo se utilizó en la Universidad de Columbia en la década de 1950 para establecer la violación de la paridad en la desintegración beta radiactiva . [75] [76]
Después de la Segunda Guerra Mundial, Estados Unidos quiso garantizar el suministro de mineral de cobalto para usos militares (como lo habían estado haciendo los alemanes) y realizó prospecciones de cobalto dentro de Estados Unidos. El cobalto de alta pureza era muy buscado para su uso en motores a reacción y turbinas de gas. [77] Se encontró un suministro adecuado de mineral en Idaho cerca del cañón Blackbird . Calera Mining Company comenzó la producción en el sitio. [78]
La demanda de cobalto se ha acelerado aún más en el siglo XXI como componente esencial de los materiales utilizados en baterías recargables, superaleaciones y catalizadores. [77] Se ha argumentado que el cobalto será uno de los principales objetos de competencia geopolítica en un mundo que funciona con energía renovable y depende de baterías, pero esta perspectiva también ha sido criticada por subestimar el poder de los incentivos económicos para una producción expandida. [79]
Aparición
La forma estable del cobalto se produce en las supernovas a través del proceso r . [80] Comprende el 0,0029% de la corteza terrestre . Excepto como se entregó recientemente en el hierro meteórico, el cobalto libre (el metal nativo ) no se encuentra en la superficie de la Tierra debido a su tendencia a reaccionar con el oxígeno en la atmósfera. Se encuentran pequeñas cantidades de compuestos de cobalto en la mayoría de las rocas, suelos, plantas y animales. [81] En el océano, el cobalto generalmente reacciona con el cloro.
En la naturaleza, el cobalto se asocia frecuentemente con el níquel . Ambos son componentes característicos del hierro meteórico , aunque el cobalto es mucho menos abundante en los meteoritos de hierro que el níquel. Al igual que con el níquel, el cobalto en las aleaciones de hierro meteórico puede haber estado lo suficientemente protegido del oxígeno y la humedad como para permanecer como metal libre (pero aleado). [82]
El cobalto en forma compuesta se encuentra en minerales de cobre y níquel. Es el principal componente metálico que se combina con azufre y arsénico en los minerales sulfídicos de cobaltita (CoAsS), safflorita (CoAs 2 ), glaucodota ( (Co,Fe)AsS ) y skutterudita (CoAs 3 ). [17] El mineral cattierita es similar a la pirita y se encuentra junto con la vaesita en los depósitos de cobre de la provincia de Katanga . [83] Cuando alcanza la atmósfera, se produce la meteorización ; los minerales de sulfuro se oxidan y forman eritrita rosa ("vislumbre de cobalto": Co 3 (AsO 4 ) 2 ·8H 2 O ) y esferocobaltita (CoCO 3 ). [84] [85]
El cobalto también es un componente del humo del tabaco . [86] La planta del tabaco absorbe y acumula fácilmente metales pesados como el cobalto del suelo circundante en sus hojas, que luego se inhalan al fumar tabaco . [87]
Producción

| País | Producción | Reservas |
|---|---|---|
 República Democrática del Congo República Democrática del Congo | 130.000 | 4.000.000 |
 Indonesia Indonesia | 10.000 | 600.000 |
 Rusia Rusia | 8.900 | 250.000 |
 Australia Australia | 5.900 | 1.500.000 |
 Canadá Canadá | 3.900 | 220.000 |
 Cuba Cuba | 3.800 | 500.000 |
 Filipinas Filipinas | 3.800 | 260.000 |
 Madagascar Madagascar | 3.000 | 100.000 |
 Papúa Nueva Guinea Papúa Nueva Guinea | 3.000 | 47.000 |
 Pavo Pavo | 2.700 | 36.000 |
 Marruecos Marruecos | 2.300 | 13.000 |
 Porcelana Porcelana | 2.200 | 140.000 |
 Estados Unidos Estados Unidos | 800 | 69.000 |
| Otros países | 5.200 | 610.000 |
| Total mundial | 190.000 | 8.300.000 |
Los principales minerales de cobalto son la cobaltita , la eritrita , la glaucodota y la skutterudita (véase más arriba), pero la mayor parte del cobalto se obtiene reduciendo los subproductos de cobalto de la minería y fundición de níquel y cobre . [89] [90]
Dado que el cobalto se produce generalmente como subproducto, su suministro depende en gran medida de la viabilidad económica de la minería de cobre y níquel en un mercado determinado. Se prevé que la demanda de cobalto crezca un 6% en 2017. [91]
Los depósitos primarios de cobalto son raros, como los que se encuentran en depósitos hidrotermales asociados con rocas ultramáficas , como el distrito de Bou-Azzer en Marruecos . En esos lugares, se extraen exclusivamente minerales de cobalto, aunque en menor concentración, y por lo tanto requieren un mayor procesamiento posterior para la extracción de cobalto. [92] [93]
Existen varios métodos para separar el cobalto del cobre y el níquel, dependiendo de la concentración de cobalto y la composición exacta del mineral utilizado. Un método es la flotación por espuma , en la que los surfactantes se unen a los componentes del mineral, lo que lleva a un enriquecimiento de los minerales de cobalto. La tostación posterior convierte los minerales en sulfato de cobalto , y el cobre y el hierro se oxidan al óxido. La lixiviación con agua extrae el sulfato junto con los arseniatos . Los residuos se lixivian aún más con ácido sulfúrico , produciendo una solución de sulfato de cobre. El cobalto también se puede lixiviar de la escoria de la fundición de cobre. [94]
Los productos de los procesos antes mencionados se transforman en óxido de cobalto (Co 3 O 4 ). Este óxido se reduce a metal mediante la reacción aluminotérmica o reducción con carbono en un alto horno . [17]

Extracción

El Servicio Geológico de los Estados Unidos estima que las reservas mundiales de cobalto ascienden a 7.100.000 toneladas métricas. [95] La República Democrática del Congo (RDC) produce actualmente el 63% del cobalto mundial. Esta cuota de mercado puede alcanzar el 73% en 2025 si las expansiones previstas por productores mineros como Glencore Plc se llevan a cabo como se espera. Bloomberg New Energy Finance ha estimado que para 2030, la demanda mundial de cobalto podría ser 47 veces mayor que en 2017. [96]
Los cambios que el Congo introdujo en las leyes mineras en 2002 atrajeron nuevas inversiones en proyectos de cobre y cobalto congoleños. La mina Mutanda de Glencore envió 24.500 toneladas de cobalto en 2016, el 40% de la producción de la República Democrática del Congo y casi una cuarta parte de la producción mundial. Después de un exceso de oferta, Glencore cerró Mutanda durante dos años a fines de 2019. [97] [98] El proyecto minero Katanga de Glencore también se está reanudando y debería producir 300.000 toneladas de cobre y 20.000 toneladas de cobalto para 2019, según Glencore. [91]
República Democrática del Congo

En 2005, el principal productor de cobalto fueron los yacimientos de cobre de la provincia de Katanga, en la República Democrática del Congo . La zona, antiguamente provincia de Shaba, poseía casi el 40% de las reservas mundiales, según informó el British Geological Survey en 2009. [99]
La minería artesanal aporta entre el 17% y el 40% de la producción de la República Democrática del Congo. [100] Unos 100.000 mineros de cobalto en la República Democrática del Congo utilizan herramientas manuales para excavar cientos de metros, con poca planificación y menos medidas de seguridad, según afirman los trabajadores y funcionarios del gobierno y de las ONG, así como las observaciones de los periodistas del Washington Post en sus visitas a minas aisladas. La falta de precauciones de seguridad causa con frecuencia lesiones o muertes. [101] La minería contamina los alrededores y expone a la fauna local y a las comunidades indígenas a metales tóxicos que se cree que causan defectos de nacimiento y dificultades respiratorias, según los funcionarios de salud. [102]
El trabajo infantil se utiliza en la extracción de cobalto de las minas artesanales africanas . [100] [103] Los activistas de derechos humanos han destacado esto y los informes de periodismo de investigación lo han confirmado. [104] [105] Esta revelación impulsó al fabricante de teléfonos celulares Apple Inc. , el 3 de marzo de 2017, a dejar de comprar mineral de proveedores como Zhejiang Huayou Cobalt que se abastecen de minas artesanales en la República Democrática del Congo, y comenzar a utilizar solo proveedores que estén verificados para cumplir con sus estándares laborales. [106] [107]
Existe una presión global por parte de la UE y los principales fabricantes de automóviles (OEM) para que la producción mundial de cobalto se obtenga y produzca de manera sostenible, responsable y con trazabilidad en la cadena de suministro. Las empresas mineras están adoptando y practicando iniciativas ESG en línea con la Guía de la OCDE y poniendo en marcha evidencia de actividades con huella de carbono cero o baja en la producción de la cadena de suministro de baterías de iones de litio . Estas iniciativas ya se están llevando a cabo con las principales empresas mineras, las empresas mineras artesanales y de pequeña escala (ASM). Fabricantes de automóviles y cadenas de suministro de fabricantes de baterías: Tesla, VW, BMW, BASF y Glencore están participando en varias iniciativas, como la Iniciativa de Cobalto Responsable y el estudio Cobalto para el Desarrollo. En 2018, BMW Group, en asociación con BASF, Samsung SDI y Samsung Electronics, lanzó un proyecto piloto en la República Democrática del Congo en una mina piloto, para mejorar las condiciones y abordar los desafíos de los mineros artesanales y las comunidades circundantes.
La dinámica política y étnica de la región ha provocado en el pasado brotes de violencia y años de conflicto armado y poblaciones desplazadas. Esta inestabilidad afectó al precio del cobalto y también creó incentivos perversos para que los combatientes de la Primera y Segunda Guerra del Congo prolongaran los combates, ya que el acceso a las minas de diamantes y otros recursos valiosos contribuía a financiar sus objetivos militares (que con frecuencia equivalían a genocidio) y también enriquecía a los propios combatientes. Si bien en la década de 2010 la República Democrática del Congo no ha sido invadida recientemente por fuerzas militares vecinas, algunos de los depósitos minerales más ricos lindan con zonas en las que los tutsis y los hutus siguen enfrentándose con frecuencia, los disturbios continúan aunque en menor escala y los refugiados siguen huyendo de los brotes de violencia. [108]
El cobalto extraído de pequeñas explotaciones mineras artesanales congoleñas en 2007 abasteció a una sola empresa china, Congo DongFang International Mining. Una filial de Zhejiang Huayou Cobalt, uno de los mayores productores de cobalto del mundo, Congo DongFang suministró cobalto a algunos de los mayores fabricantes de baterías del mundo, que produjeron baterías para productos omnipresentes como los iPhones de Apple . Debido a las supuestas violaciones laborales y las preocupaciones ambientales, LG Chem posteriormente auditó a Congo DongFang de acuerdo con las directrices de la OCDE. LG Chem, que también produce materiales para baterías para empresas automovilísticas, impuso un código de conducta a todos los proveedores que inspecciona. [109]
El proyecto de la montaña Mukondo , operado por la Central African Mining and Exploration Company (CAMEC) en la provincia de Katanga, puede ser la reserva de cobalto más rica del mundo. Se estima que produjo un tercio de la producción mundial total de cobalto en 2008. [110] En julio de 2009, CAMEC anunció un acuerdo a largo plazo para entregar toda su producción anual de concentrado de cobalto de la montaña Mukondo a Zhejiang Galico Cobalt & Nickel Materials de China. [111]
En 2016, se estimó que la propiedad china de la producción de cobalto en el Congo superaba el 10% del suministro mundial de cobalto, lo que constituye un insumo clave para la industria de refinación de cobalto china y otorga a China una influencia sustancial sobre la cadena de suministro mundial de cobalto. [112] El control chino del cobalto congoleño ha generado preocupación en las naciones occidentales que han tratado de reducir la dependencia de la cadena de suministro de China y han expresado su preocupación por las violaciones de los derechos humanos y laborales en las minas de cobalto en la República Democrática del Congo. [113] [114]
En febrero de 2018, la firma de gestión de activos globales AllianceBernstein definió a la RDC como económicamente "la Arabia Saudita de la era de los vehículos eléctricos", debido a sus recursos de cobalto, esenciales para las baterías de iones de litio que impulsan los vehículos eléctricos . [115]
El 9 de marzo de 2018, el presidente Joseph Kabila actualizó el código minero de 2002, aumentando los cobros de regalías y declarando al cobalto y al coltán como "metales estratégicos". [116] [117] El código minero de 2002 se actualizó efectivamente el 4 de diciembre de 2018. [118]
En diciembre de 2019, International Rights Advocates, una ONG de derechos humanos, presentó una demanda histórica contra Apple, Tesla , Dell , Microsoft y la empresa Alphabet de Google por "beneficiarse deliberadamente y ayudar e instigar el uso cruel y brutal de niños pequeños" en la minería de cobalto. [119] Las empresas en cuestión negaron su participación en el trabajo infantil . [120] En 2024, el tribunal dictaminó que los proveedores facilitan el trabajo forzoso, pero las empresas tecnológicas estadounidenses no son responsables porque no operan como una empresa compartida con los proveedores y que las "supuestas lesiones no son razonablemente rastreables" a ninguna de las conductas de los acusados. [121]
Canadá
En 2017, algunas empresas de exploración estaban planeando inspeccionar antiguas minas de plata y cobalto en el área de Cobalt, Ontario , donde se cree que hay importantes depósitos. [122]
Cuba
La canadiense Sherritt International procesa minerales de cobalto en depósitos de níquel de las minas de Moa en Cuba , y la isla tiene varias otras minas en Mayarí , Camagüey y Pinar del Río . Las inversiones continuas de Sherritt International en la producción cubana de níquel y cobalto mientras adquiría derechos mineros por 17 a 20 años hicieron que el país comunista ocupara el tercer lugar en reservas de cobalto en 2019, por delante del propio Canadá. [123]
Indonesia
En 2021, Indonesia comenzó a producir cobalto como subproducto de la producción de níquel , a partir de cantidades más pequeñas . Para 2022, el país se había convertido en el segundo mayor productor de cobalto del mundo, y Benchmark Mineral Intelligence pronostica que la producción indonesia representará el 20 por ciento de la producción mundial para 2030. [124]
Aplicaciones
En 2016, se utilizaron 116.000 toneladas (128.000 toneladas cortas) de cobalto. [9] El cobalto se ha utilizado en la producción de aleaciones de alto rendimiento. [89] [90] También se utiliza en algunas baterías recargables.
Aleaciones
Las superaleaciones a base de cobalto han consumido históricamente la mayor parte del cobalto producido. [89] [90] La estabilidad de la temperatura de estas aleaciones las hace adecuadas para álabes de turbinas para turbinas de gas y motores a reacción de aviones, aunque las aleaciones monocristalinas a base de níquel las superan en rendimiento. [125] Las aleaciones a base de cobalto también son resistentes a la corrosión y al desgaste, lo que las hace, como el titanio , útiles para fabricar implantes ortopédicos que no se desgastan con el tiempo. El desarrollo de aleaciones de cobalto resistentes al desgaste comenzó en la primera década del siglo XX con las aleaciones de estelita , que contienen cromo con cantidades variables de tungsteno y carbono. Las aleaciones con cromo y carburos de tungsteno son muy duras y resistentes al desgaste. [126] Las aleaciones especiales de cobalto-cromo- molibdeno como Vitallium se utilizan para piezas protésicas (reemplazos de cadera y rodilla). [127] Las aleaciones de cobalto también se utilizan para prótesis dentales como un sustituto útil del níquel, que puede ser alergénico. [128] Algunos aceros de alta velocidad también contienen cobalto para aumentar la resistencia al calor y al desgaste. Las aleaciones especiales de aluminio, níquel, cobalto y hierro, conocidas como Alnico , y de samario y cobalto ( imán de samario-cobalto ) se utilizan en imanes permanentes . [129] También se alea con platino al 95% para joyería, lo que produce una aleación adecuada para fundición fina, que también es ligeramente magnética. [130]
Baterías
El óxido de cobalto y litio (LiCoO2 ) se utiliza ampliamente en los cátodos de baterías de iones de litio . El material está compuesto de capas de óxido de cobalto con litio intercalado . Durante la descarga ( es decir , cuando no se está cargando activamente), el litio se libera como iones de litio. [131] Las baterías de níquel-cadmio [132] (NiCd) y de hidruro metálico de níquel [133] (NiMH) también incluyen cobalto para mejorar la oxidación del níquel en la batería. [132] Transparency Market Research estimó el mercado mundial de baterías de iones de litio en 30 mil millones de dólares en 2015 y predijo un aumento a más de 75 mil millones de dólares para 2024. [134]
Aunque en 2018 la mayor parte del cobalto en baterías se utilizó en un dispositivo móvil, [135] una aplicación más reciente del cobalto son las baterías recargables para automóviles eléctricos. Esta industria ha quintuplicado su demanda de cobalto, lo que hace urgente encontrar nuevas materias primas en áreas más estables del mundo. [136] Se espera que la demanda continúe o aumente a medida que aumenta la prevalencia de los vehículos eléctricos. [137] La exploración en 2016-2017 incluyó el área alrededor de Cobalt, Ontario, un área donde muchas minas de plata dejaron de operar hace décadas. [136] El cobalto para vehículos eléctricos aumentó un 81% desde el primer semestre de 2018 a 7200 toneladas en el primer semestre de 2019, para una capacidad de batería de 46,3 GWh. [138] [139]
Español Dado que se ha informado repetidamente sobre trabajo infantil y esclavo en la minería de cobalto, principalmente en las minas artesanales de la República Democrática del Congo, las empresas de tecnología que buscan una cadena de suministro ética se han enfrentado a la escasez de esta materia prima y [140] el precio del metal de cobalto alcanzó un máximo de nueve años en octubre de 2017, más de 30 dólares estadounidenses la libra, frente a los 10 dólares estadounidenses a finales de 2015. [141] Después de un exceso de oferta, el precio bajó a unos más normales 15 dólares en 2019. [142] [143] Como reacción a los problemas con la minería artesanal de cobalto en la República Democrática del Congo, varios proveedores de cobalto y sus clientes han formado la Fair Cobalt Alliance (FCA), que tiene como objetivo poner fin al uso de mano de obra infantil y mejorar las condiciones de trabajo de la minería y el procesamiento de cobalto en la República Democrática del Congo. Los miembros de FCA incluyen a Zhejiang Huayou Cobalt , Sono Motors , la Iniciativa de Cobalto Responsable, Fairphone , Glencore y Tesla, Inc. [144] [145]
La Unión Europea está realizando investigaciones sobre la posibilidad de eliminar los requisitos de cobalto en la producción de baterías de iones de litio. [146] [147] A partir de agosto de 2020, los fabricantes de baterías han reducido gradualmente el contenido de cobalto del cátodo de 1/3 ( NMC 111) a 1/5 (NMC 442) a actualmente 1/10 (NMC 811) y también han introducido el cátodo de fosfato de hierro y litio sin cobalto en los paquetes de baterías de automóviles eléctricos como el Tesla Model 3. [ 148] [149] En septiembre de 2020, Tesla describió sus planes para fabricar sus propias celdas de batería sin cobalto. [150]
Las baterías de fosfato de hierro y litio superaron oficialmente a las baterías ternarias de cobalto en 2021 con el 52% de la capacidad instalada. Los analistas estiman que su participación de mercado superará el 60% en 2024. [151]
Catalizadores
Varios compuestos de cobalto son catalizadores de oxidación . El acetato de cobalto se utiliza para convertir xileno en ácido tereftálico , el precursor del polímero a granel tereftalato de polietileno . Los catalizadores típicos son los carboxilatos de cobalto (conocidos como jabones de cobalto). También se utilizan en pinturas, barnices y tintas como "agentes secantes" a través de la oxidación de aceites secantes . [152] [131] Sin embargo, su uso se está eliminando gradualmente debido a problemas de toxicidad. [153] Los mismos carboxilatos se utilizan para mejorar la adhesión entre el acero y el caucho en neumáticos radiales con cinturón de acero. Además, se utilizan como aceleradores en sistemas de resina de poliéster . [154] [155] [156]
Los catalizadores a base de cobalto se utilizan en reacciones que involucran monóxido de carbono . El cobalto también es un catalizador en el proceso Fischer-Tropsch para la hidrogenación de monóxido de carbono en combustibles líquidos. [157] La hidroformilación de alquenos a menudo utiliza octacarbonilo de cobalto como catalizador. [158] La hidrodesulfuración del petróleo utiliza un catalizador derivado del cobalto y el molibdeno. Este proceso ayuda a limpiar el petróleo de impurezas de azufre que interfieren con el refinado de combustibles líquidos. [131]
Pigmentos y colorantes


Antes del siglo XIX, el cobalto se utilizaba predominantemente como pigmento. Se ha utilizado desde la Edad Media para hacer esmalte , un vidrio de color azul. El esmalte se produce fundiendo una mezcla de esmaltita mineral tostada , cuarzo y carbonato de potasio , lo que produce un vidrio de silicato azul oscuro, que se muele finamente después de la producción. [159] El esmalte se usaba ampliamente para colorear el vidrio y como pigmento para pinturas. [160] En 1780, Sven Rinman descubrió el verde cobalto y en 1802 Louis Jacques Thénard descubrió el azul cobalto . [161] Los pigmentos de cobalto como el azul cobalto (aluminato de cobalto), el azul cerúleo (estannato de cobalto (II)), varios tonos de verde cobalto (una mezcla de óxido de cobalto (II) y óxido de zinc ) y el violeta de cobalto ( fosfato de cobalto ) se utilizan como pigmentos para artistas debido a su estabilidad cromática superior. [162] [163]
Radioisótopos
El cobalto-60 (Co-60 o 60 Co) es útil como fuente de rayos gamma porque se puede producir en cantidades predecibles con alta actividad bombardeando cobalto con neutrones . Produce rayos gamma con energías de 1,17 y 1,33 MeV . [30] [164]
El cobalto se utiliza en radioterapia de haz externo , esterilización de suministros médicos y desechos médicos, tratamiento de radiación de alimentos para esterilización ( pasteurización en frío ), [165] radiografía industrial (por ejemplo, radiografías de integridad de soldadura), mediciones de densidad (por ejemplo, mediciones de densidad del hormigón) e interruptores de altura de llenado de tanques. El metal tiene la desafortunada propiedad de producir un polvo fino, lo que causa problemas con la protección radiológica . El cobalto de las máquinas de radioterapia ha sido un peligro grave cuando no se desecha correctamente, y uno de los peores accidentes de contaminación por radiación en América del Norte ocurrió en 1984, cuando una unidad de radioterapia desechada que contenía cobalto-60 fue desmontada por error en un depósito de chatarra en Juárez, México. [166] [167]
El cobalto-60 tiene una vida media radiactiva de 5,27 años. La pérdida de potencia requiere el reemplazo periódico de la fuente en radioterapia y es una de las razones por las que las máquinas de cobalto han sido reemplazadas en gran medida por aceleradores lineales en la radioterapia moderna. [168] El cobalto-57 (Co-57 o 57 Co) es un radioisótopo de cobalto que se usa con mayor frecuencia en pruebas médicas, como radiomarcador para la captación de vitamina B 12 y para la prueba de Schilling . El cobalto-57 se usa como fuente en la espectroscopia Mössbauer y es una de las varias fuentes posibles en los dispositivos de fluorescencia de rayos X. [169] [170]
Los diseños de armas nucleares podrían incorporar intencionalmente 59Co , parte del cual se activaría en una explosión nuclear para producir 60Co . El 60Co , dispersado como lluvia radiactiva , a veces se denomina bomba de cobalto . [171] [172]
Materiales magnéticos
Debido a las propiedades ferromagnéticas del cobalto, se utiliza en la producción de varios materiales magnéticos. [173] Se utiliza para crear imanes permanentes como los imanes Alnico , conocidos por sus fuertes propiedades magnéticas utilizadas en motores eléctricos , sensores y máquinas de resonancia magnética . [174] [175] También se utiliza en la producción de aleaciones magnéticas como el acero al cobalto , ampliamente utilizado en medios de grabación magnética como discos duros y cintas . [176]
La capacidad del cobalto para mantener propiedades magnéticas a altas temperaturas lo hace valioso en aplicaciones de grabación magnética, lo que garantiza dispositivos de almacenamiento de datos confiables . [177] El cobalto también contribuye a imanes especializados como los imanes de samario-cobalto y neodimio-hierro-boro , que son vitales en la electrónica para componentes como sensores y actuadores . [178]
Otros usos
- El cobalto se utiliza en galvanoplastia por su apariencia atractiva, dureza y resistencia a la oxidación. [179]
- También se utiliza como capa base de imprimación para esmaltes de porcelana . [180]
Papel biológico
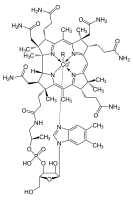
El cobalto es esencial para el metabolismo de todos los animales. Es un componente clave de la cobalamina , también conocida como vitamina B 12 , el principal reservorio biológico de cobalto como un ultraelemento traza . [181] [182] Las bacterias en los estómagos de los animales rumiantes convierten las sales de cobalto en vitamina B 12 , un compuesto que solo puede ser producido por bacterias o arqueas . Por lo tanto, una presencia mínima de cobalto en los suelos mejora notablemente la salud de los animales de pastoreo , y se recomienda una ingesta de 0,20 mg/kg al día, porque no tienen otra fuente de vitamina B 12 . [183]
Las proteínas basadas en cobalamina utilizan corrina para retener el cobalto. La coenzima B 12 presenta un enlace reactivo C-Co que participa en las reacciones. [184] En los humanos, B 12 tiene dos tipos de ligando alquilo : metilo y adenosilo. MeB 12 promueve transferencias de grupos metilo (−CH 3 ). La versión adenosilo de B 12 cataliza reordenamientos en los que un átomo de hidrógeno se transfiere directamente entre dos átomos adyacentes con intercambio concomitante del segundo sustituyente, X, que puede ser un átomo de carbono con sustituyentes, un átomo de oxígeno de un alcohol o una amina. La metilmalonil coenzima A mutasa (MUT) convierte MMl-CoA en Su-CoA , un paso importante en la extracción de energía de proteínas y grasas. [185]
Aunque son mucho menos comunes que otras metaloproteínas (por ejemplo, las de zinc y hierro), se conocen otras cobaltoproteínas además de la B 12 . Estas proteínas incluyen la metionina aminopeptidasa 2 , una enzima que se produce en humanos y otros mamíferos que no utiliza el anillo de corrina de la B 12 , sino que se une al cobalto directamente. Otra enzima de cobalto no corrina es la nitrilo hidratasa , una enzima en bacterias que metaboliza los nitrilos . [186]
Deficiencia de cobalto
En los seres humanos, el consumo de vitamina B 12 que contiene cobalto cubre todas las necesidades de cobalto. Para el ganado vacuno y ovino, que cubren las necesidades de vitamina B 12 a través de la síntesis por las bacterias residentes en el rumen, existe una función para el cobalto inorgánico. A principios del siglo XX, durante el desarrollo de la agricultura en la meseta volcánica de la Isla Norte de Nueva Zelanda, el ganado vacuno sufrió lo que se denominó "enfermedad de los matorrales". Se descubrió que los suelos volcánicos carecían de las sales de cobalto esenciales para la cadena alimentaria del ganado. [187] [188] Se descubrió que la "enfermedad de la costa" de las ovejas en el desierto de Ninety Mile del sudeste de Australia del Sur en la década de 1930 se originó en deficiencias nutricionales de oligoelementos como cobalto y cobre. La deficiencia de cobalto se superó mediante el desarrollo de "balas de cobalto", bolitas densas de óxido de cobalto mezcladas con arcilla que se administran por vía oral para alojarse en el rumen del animal . [ aclaración necesaria ] [189] [188] [190]
- Ovejas con deficiencia de cobalto
Problemas de salud
| Peligros | |
|---|---|
| Etiquetado SGA : [191] | |
  | |
| Peligro | |
| H302 , H317 , H319 , H334 , H341 , H350 , H360F , H412 | |
| P273 , P280 , P301+P312 , P302+P352 , P305+P351+P338 , P308+P313 | |
| NFPA 704 (rombo cortafuegos) | |
Se ha estimado que el valor LD 50 de las sales solubles de cobalto está entre 150 y 500 mg/kg. [192] En los EE. UU., la Administración de Seguridad y Salud Ocupacional (OSHA) ha designado un límite de exposición permisible (PEL) en el lugar de trabajo como un promedio ponderado en el tiempo (TWA) de 0,1 mg/m 3 . El Instituto Nacional para la Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 0,05 mg/m 3 , promedio ponderado en el tiempo. El valor IDLH (inmediatamente peligroso para la vida y la salud) es de 20 mg/m 3 . [193]
Sin embargo, la ingestión crónica de cobalto ha provocado graves problemas de salud en dosis mucho menores que la dosis letal. En 1966, la adición de compuestos de cobalto para estabilizar la espuma de la cerveza en Canadá provocó una forma peculiar de miocardiopatía inducida por toxinas , que llegó a conocerse como miocardiopatía del bebedor de cerveza . [194] [195]
Además, se sospecha que el metal cobalto causa cáncer (es decir, posiblemente cancerígeno , Grupo 2B del IARC ) según las monografías de la Agencia Internacional para la Investigación sobre el Cáncer (IARC). [196]
Provoca problemas respiratorios si se inhala. [197] También provoca problemas en la piel si se toca; después del níquel y el cromo, el cobalto es una de las principales causas de dermatitis de contacto . [198]
Notas
- ^ La expansión térmica del cobalto es anisotrópica : los coeficientes para cada eje del cristal son (a 20 °C): α a = 10,9 × 10 −6 /K, α c = 17,9 × 10 −6 /K, y α promedio = α V /3 = 12,9 × 10 −6 /K.
- ^ El diccionario de Grimm lo llama más específicamente "maniquí de montaña espectral" ( gespenstisches Bergmännchen) , en otro lugar ("Kobold" II) se señala que kobold también se refiere a Berggeist en bergmännisch (jerga de los mineros).
- ^ Grimm derivó y kobold del griego kobalos , como se mencionó anteriormente; el OED coincidió en que kobold , kobelt (mineral) y kobel (espíritu de la mina) eran la misma palabra.
Referencias
- ^ "cobalto". Diccionario Oxford de inglés (2.ª ed.). Oxford University Press . 1989.
- ^ "Pesos atómicos estándar: cobalto". CIAAW . 2017.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ de Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ abc Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 28. ISBN 978-0-08-037941-8.
- ^ abcd Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . págs. 1117–1119. ISBN 978-0-08-037941-8.
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ "cobalto". Diccionario Oxford de inglés (2.ª ed.). Oxford University Press . 1989.
- ^ de Danielle Bochove (1 de noviembre de 2017). "El futuro de los coches eléctricos impulsa la fiebre del cobalto: la creciente demanda del producto insufla nueva vida a una pequeña ciudad de Ontario". Vancouver Sun . Bloomberg. Archivado desde el original el 28 de julio de 2019.
- ^ "Catalizadores". Instituto del Cobalto . Archivado desde el original el 16 de agosto de 2023. Consultado el 15 de agosto de 2023 .
- ^ Enghag, Per (2004). "Cobalto". Enciclopedia de los elementos: datos técnicos, historia, procesamiento, aplicaciones . Wiley. pág. 667. ISBN 978-3-527-30666-4.
- ^ Murthy, VS R (2003). "Propiedades magnéticas de los materiales". Estructura y propiedades de los materiales de ingeniería . McGraw-Hill Education (India) Pvt Limited. pág. 381. ISBN 978-0-07-048287-6.
- ^ Celozzi, Salvatore; Araneo, Rodolfo; Lovat, Giampiero (1 de mayo de 2008). Blindaje electromagnético. Wiley. pag. 27.ISBN 978-0-470-05536-6.
- ^ Lee, B.; Alsenz, R.; Ignatiev, A.; Van Hove, M.; Van Hove, MA (1978). "Estructuras superficiales de las dos fases alotrópicas del cobalto". Physical Review B . 17 (4): 1510–1520. Código Bibliográfico :1978PhRvB..17.1510L. doi :10.1103/PhysRevB.17.1510.
- ^ "Propiedades y hechos del cobalto". American Elements . Archivado desde el original el 2 de octubre de 2008 . Consultado el 19 de septiembre de 2008 .
- ^ Cobalto. Bruselas: Centre d'Information du Cobalt. 1966. pág. 45.
- ^ abcde Holleman, AF; Wiberg, E.; Wiberg, N. (2007). "Cobalto". Lehrbuch der Anorganischen Chemie (en alemán) (102ª ed.). de Gruyter. págs. 1146-1152. ISBN 978-3-11-017770-1.
- ^ Housecroft, CE; Sharpe, AG (2008). Química inorgánica (3.ª ed.). Prentice Hall. pág. 722. ISBN 978-0-13-175553-6.
- ^ Rutley, Frank (6 de diciembre de 2012). Elementos de mineralogía de Rutley. Springer Science & Business Media. pág. 40. ISBN 978-94-011-9769-4.
- ^ Krebs, Robert E. (2006). Historia y uso de los elementos químicos de la Tierra: una guía de referencia (2.ª ed.). Greenwood Publishing Group. pág. 107. ISBN 0-313-33438-2.
- ^ Petitto, Sarah C.; Marsh, Erin M.; Carson, Gregory A.; Langell, Marjorie A. (2008). "Química de la superficie del óxido de cobalto: la interacción de CoO(100), Co3O4(110) y Co3O4(111) con oxígeno y agua". Journal of Molecular Catalysis A: Chemical . 281 (1–2): 49–58. doi :10.1016/j.molcata.2007.08.023. S2CID 28393408.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . págs. 1119–1120. ISBN 978-0-08-037941-8.
- ^ Werner, A. (1912). "Zur Kenntnis des asymmetrischen Kobaltatoms. V". Chemische Berichte . 45 : 121-130. doi :10.1002/cber.19120450116.
- ^ Gispert, Joan Ribas (2008). "Teorías tempranas de la química de coordinación". Química de coordinación . Wiley. pp. 31–33. ISBN 978-3-527-31802-5. Archivado desde el original el 5 de mayo de 2016 . Consultado el 27 de junio de 2015 .
- ^ House, James E. (2008). Química inorgánica. Academic Press. pp. 767–. ISBN 978-0-12-356786-4. Recuperado el 16 de mayo de 2011 .
- ^ Starks, Charles M.; Liotta, Charles Leonard; Halpern, Marc (1994). Catálisis por transferencia de fase: fundamentos, aplicaciones y perspectivas industriales. Springer. pp. 600–. ISBN 978-0-412-04071-9. Recuperado el 16 de mayo de 2011 .
- ^ Sigel, Astrid; Sigel, Helmut; Sigel, Roland, eds. (2010). Organometálicos en el medio ambiente y la toxicología (Iones metálicos en las ciencias de la vida) . Cambridge , Reino Unido : Royal Society of Chemistry Publishing . pág. 75. ISBN. 978-1-84755-177-1.
- ^ Byrne, Erin K.; Richeson, Darrin S.; Theopold, Klaus H. (1 de enero de 1986). "Tetrakis(1-norbornil)cobalto, un complejo tetraédrico de bajo espín de un metal de transición de primera fila". Journal of the Chemical Society, Chemical Communications (19): 1491. doi :10.1039/C39860001491. ISSN 0022-4936.
- ^ Byrne, Erin K.; Theopold, Klaus H. (1 de febrero de 1987). "Química redox del tetrakis(1-norbornil)cobalto. Síntesis y caracterización de un alquilo de cobalto(V) y tasa de autointercambio de una pareja Co(III)/Co(IV)". Journal of the American Chemical Society . 109 (4): 1282–1283. doi :10.1021/ja00238a066. ISSN 0002-7863.
- ^ abc Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "La evaluación NUBASE de las propiedades nucleares y de desintegración", Nuclear Physics A , 729 : 3–128, Bibcode :2003NuPhA.729....3A, doi :10.1016/j.nuclphysa.2003.11. 001
- ^ abc Ball, Philip (2003). Bright Earth: Art and the Invention of Color [Tierra brillante: el arte y la invención del color]. University of Chicago Press. pp. 118–119. ISBN 9780226036281.
- ^ abc Grimms ; Hildebrand, Rudolf (1868). Deutsches Wörterbuch , Banda 5, sv " Kobalt "
- ^ abcdef Wothers, Peter (2019). Antimonio, oro y el lobo de Júpiter: cómo se nombraban los elementos. Oxford University Press. págs. 47–49. ISBN 9780192569905.
- ^ Agrícola, Georgius (1546) [1530]. "Bermannus, sive de re Metallica dialogus". Georgii Agricolae De ortu & causis subterraneorum lib. 5. De natura eorum quae effluunt ex terra lib. 4. De natura fosilium lib. 10. De ueteribus & nouis metallis lib. 2. Bermannus, siue De re Metallica dialogus lib.1. Interpretatio Germanica uocum rei Metallicæ, addito Indice fœcundissimo . Basilea: Froben. págs. 441–442.
cobaltum nostri uocant, Græci cadmio
; Cf. índice bajo " cobalto ". - ^ Agricola, Georgius (1912). Georgius Agricola De Re Metallica: Tr. de la 1.ª edición latina de 1556 (libros I–VIII). Traducido por Hoover, Herbert Clark y Lou Henry Hoover . Londres: The Mining Magazine. págs. 112–113.Describe (y tabula) la forma alemana kobelt ; en dos volúmenes: Segunda Parte , Libros IX–XII, paginación contigua.
- ^ Agrícola, Georgius (1614) [1549]. "37". En Johannes Sigfridus (ed.). Georgii Agricolae De Animantibus subterraneis . Witebergæ: Typis Meisnerianis. págs. 78–79.
- ^ ab Agricola, Georgius (1657) [1530]. "Animantium nomina latina, graega, q'ue germanice reddita, autor del quórum en Libro de subterraneis animantibus meminit". Georgii Agricolae Kempnicensis Medici Ac Philosophi Clariss. De Re Metallica Libri XII.: Quibus Officia, Instrumenta, Machinae, Ac Omnia Denique Ad Metallicam Spectantia, Non Modo Luculentissime describuntur; sed & per efigies, suis locis insertas... ita ob oculos ponuntur, ut clarius tradi non possint . Basilea: Sumptibus & Typis Emanuelis König. pag. [762].
Dæmonum
:
Dæmon subterraneus trunculentus
: bergterufel;
mitis
bergmenlein/kobel/guttel
- ^ Este pasaje de la obra separada, de animantibus, está traducido en nota al pie por la traducción de Agricola & Hoovers (1912), pág. 217, n26 : "tanto los alemanes como los griegos llaman cobalos ".
- ^ Traducción de Agricola y Hoovers (1912), pág. 214, n21.
- ^ Sermón del teólogo reformista luterano Johannes Mathesius (1652) sobre la molestia que se creía que era causada por un demonio conocido por las masas como Kobel . Citado en inglés por los Hoover, [39] extractado por Wothers. [33]
- ^ Johann Beckmann (trad. inglesa, 1797), quien comentó explícitamente sobre la derivación de la palabra para el mineral de "cobalto" formado a partir de kobel ( cobalus de Agricola ), ha sido citado por el químico Peter Wothers sobre este tema. [33]
- ^ "Nuevo y completo diccionario de la lengua alemana para ingleses" sv " Das Wetter ": "4. Aire y vapores, humedades, vapores... entre los mineros", Küttner, Carl Gottlob; Nicholson, William, edd. (1813), vol. 3.
- ^ ab Grimms ; Hildebrand, Rudolf (1868). Deutsches Wörterbuch , Band 5, sv " Kobold " en "III. 3) nebenformen"
- ^ El diccionario Grimm establece que kobalt y kobold son "la misma palabra en su fuente original ( ursprünglich )". [32] Además, la entrada de Grimm en "kobold", III. ursprung, nebenformen, 3) a) enumera kobel como un diminutivo Nebenname . [43]
- ^ En realidad, entre "gnomos y duendes". [31] [33]
- ^ Lecouteux, Claude (2016). "BERGMÄNNCHEN (Bergmännlein, Bergmönch, Knappenmanndl, Kobel, Gütel; gruvrå en Suecia)". Enciclopedia de folclore, mitología y magia nórdica y germánica . Simón y Schuster. ISBN 9781620554814., cf. (en francés) Lecouteux (2014), " BERGMÄNNCHEN ", Dictionnaire de Mythologie Germanique , págs. 1995-1996.
- ^ Verardi, Donato (2023). Aristotelismo y magia en la Europa moderna temprana: filósofos, experimentadores y hacedores de milagros. Bloomsbury Publishing. pág. 85. ISBN 9781350357174.
- ^ El kobel era también conocido como "bergmenlin" (ortografía estándar modificada Bergmännlein, Bergmännchen ) según la glosa de Agricola. [37] El diccionario de Grimm también dice que los minerales son causados por duendes Bergmännchen , pero cree que los mineros llaman a esto "kobold", no distinguible de "kobel". Mientras que el diccionario de Lecouteux define "Bergmännchen" como "espíritu de mina" y admite "kobel" pero no "kobld" como sinónimo. [46] Más recientemente, se ha encontrado literatura que no duda en llamar al Bergmännchen un "gnomo". [47]
- ^ "cobalto" . Diccionario Oxford de inglés (edición en línea). Oxford University Press . (Se requiere suscripción o membresía de una institución participante.) ; Murray, James AH ed. (1908) A New Eng. Dict. II , sv"cobalt"
- ^ ab Müller-Fraureuth, Karl (1906). "Cap. 14". Sächsische Volkswörter: Beiträge zur mundartlichen Volkskunde . Dresde: Wilhelm Baensch. págs. 25-26. ISBN 978-3-95770-329-3.
- ^ Glasenapp, Carl Friedrich [en alemán] (1911). "III. El Kobold". Siegfried Wagner und seine Kunst: gesammelte Aufsätze über das dramatische Schaffen Siegfried Wagners vom "Bärenhäuter" bis zum "Banadietrich" . Ilustrado por Franz Stassen . Leipzig: Breitkopf & Härtel. pag. 134.
- ^ Kretschmer, Paul (1928). "Weiteres zur Urgeschichte der Inder". Zeitschrift für vergleichende Sprachforschung auf dem Gebiete der indogermanischen Sprachen . 55 . pag. 89 y pág. 87, n2.
- ^ ab Kluge, Friedrich ; Seebold, Elmar , eds. (2012) [1899]. "Cobalto". Etymologisches Wörterbuch der deutschen Sprache (25 ed.). Walter de Gruyter GmbH & Co KG. pag. 510.ISBN 9783110223651.
- ^ abc Mellor, JW (1935) Cobalto Un tratado completo sobre química inorgánica y teórica vol. XIV, pág. 420.
- ^ Agrícola (1546) p. 481 : latín : módulo = alemán : Kobel
- ^ Liddell y Scott (1940). A Greek–English Lexicon (Léxico griego -inglés ). sv " kwba/qia ". Revisado y ampliado por Sir Henry Stuart Jones con la ayuda de Roderick McKenzie. Oxford: Clarendon Press. ISBN 0-19-864226-1 . Versión en línea recuperada el 29 de agosto de 2024.
- ^ Merck, Emanuel (1902). "Metal de cobalto". Nada etéreo: imaginando el otro mundo de las hadas desde la Edad Media hasta la Era de la Razón: Ensayos en honor a Alasdair A. MacDonald (2.ª ed.). Darmstadt: E. Merck. pág. 75.
- ^ Taylor, JR (1977). "El origen y uso de los compuestos de cobalto como azul". Ciencia y arqueología . 19 : 6.
- ^ "J. Berenedes" recté Berendes, J. (8 de febrero de 1899). "Los nombres de los elementos". Chemiker-Zeitung . 23 (11): 103.
- ^ Cobalto, Encyclopædia Britannica Online.
- ^ Pulak, Cemal (1998). "El naufragio de Uluburun: una visión general". Revista Internacional de Arqueología Náutica . 27 (3): 188–224. doi :10.1111/j.1095-9270.1998.tb00803.x.
- ^ Henderson, Julian (2000). "Vidrio". La ciencia y la arqueología de los materiales: una investigación de materiales inorgánicos. Routledge. pág. 60. ISBN 978-0-415-19933-9.
- ^ Rehren, Thilo (2003). "Aspectos de la producción de vidrio azul cobalto en Egipto". Arqueometría . 43 (4): 483–489. doi :10.1111/1475-4754.00031.
- ^ ab Dennis, W. H (2010). "Cobalto". Metalurgia: 1863-1963 . AldineTransaction. págs. 254-256. ISBN 978-0-202-36361-5.
- ^ "Encuestas de información arancelaria sobre los artículos del párrafo 1- de la Ley Arancelaria de 1913... y artículos relacionados en otros párrafos". 17 de agosto de 2023.
- ^ Georg Brandt demostró por primera vez que el cobalto es un nuevo metal en: G. Brandt (1735) "Dissertatio de semimetallis" (Disertación sobre semimetales), Acta Literaria et Scientiarum Sveciae (Revista de literatura y ciencias suecas), vol. 4, páginas 1 a 10.
Véase también: (1) G. Brandt (1746) "Rön och anmärkningar angäende en synnerlig färg—cobolt" (Observaciones y comentarios sobre un pigmento extraordinario: el cobalto), Kongliga Svenska vetenskapsakademiens handlear (Transacciones de la Real Academia Sueca de Ciencias), vol. 7, págs. 119-130; (2) G. Brandt (1748) "Cobalti nova species examinata et descripta" (Cobalto, un nuevo elemento examinado y descrito), Acta Regiae Societatis Scientiarum Upsaliensis (Revista de la Real Sociedad Científica de Uppsala), primera serie, vol. 3, págs. 33–41; (3) James L. Marshall y Virginia R. Marshall (primavera de 2003) "Redescubrimiento de los elementos: Riddarhyttan, Suecia". The Hexagon (revista oficial de la fraternidad de químicos Alpha Chi Sigma ), vol. 94, núm. 1, páginas 3–8. - ^ Wang, Shijie (2006). "Cobalto: su recuperación, reciclaje y aplicación". Revista de la Sociedad de Minerales, Metales y Materiales . 58 (10): 47–50. Bibcode :2006JOM....58j..47W. doi :10.1007/s11837-006-0201-y. S2CID 137613322.
- ^ Weeks, ME (1968). Descubrimiento de los elementos. (HM Leicester, Ed.; 7.ª ed.). Revista de educación química.
- ^ Weeks, Mary Elvira (1932). "El descubrimiento de los elementos. III. Algunos metales del siglo XVIII". Revista de Educación Química . 9 (1): 22. Bibcode :1932JChEd...9...22W. doi :10.1021/ed009p22.
- ^ Ramberg, Ivar B. (2008). La formación de una tierra: geología de Noruega. Sociedad Geológica. pp. 98–. ISBN 978-82-92394-42-7. Recuperado el 30 de abril de 2011 .
- ^ C. Tomlinson, ed. (1852). "Cobalto". Enciclopedia de artes y manufacturas útiles , págs. 400–403.
- ^ ab Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. "Recursos minerales no combustibles globales y sostenibilidad". Servicio Geológico de los Estados Unidos.
- ^ ab Westing, Arthur H; Instituto Internacional de Investigación para la Paz de Estocolmo (1986). "cobalto". Recursos globales y conflicto internacional: factores ambientales en la política y la acción estratégicas . Oxford University Press. págs. 75–78. ISBN 978-0-19-829104-6.
- ^ Livingood, J.; Seaborg, Glenn T. (1938). "Isótopos de radiocobalto de larga duración". Physical Review . 53 (10): 847–848. Código Bibliográfico :1938PhRv...53..847L. doi :10.1103/PhysRev.53.847.
- ^ Wu, CS (1957). "Prueba experimental de conservación de paridad en desintegración beta". Physical Review . 105 (4): 1413–1415. Bibcode :1957PhRv..105.1413W. doi : 10.1103/PhysRev.105.1413 .
- ^ Wróblewski, AK (2008). "La caída de la paridad: la revolución que ocurrió hace cincuenta años". Acta Physica Polonica B . 39 (2): 251. Bibcode :2008AcPPB..39..251W. S2CID 34854662.
- ^ ab Roberts, Stephen; Gunn, Gus (6 de enero de 2014), Gunn, Gus (ed.), "Cobalt", Critical Metals Handbook (1.ª ed.), Wiley, págs. 122-149, doi :10.1002/9781118755341.ch6, ISBN 978-0-470-67171-9, consultado el 1 de diciembre de 2023
- ^ "El hoyo más rico de la montaña". Popular Mechanics : 65–69. 1952.
- ^ Overland, Indra (1 de marzo de 2019). "La geopolítica de las energías renovables: desmitificando cuatro mitos emergentes". Investigación energética y ciencias sociales . 49 : 36–40. Bibcode :2019ERSS...49...36O. doi : 10.1016/j.erss.2018.10.018 . hdl : 11250/2579292 . ISSN 2214-6296.
- ^ Ptitsyn, DA; Chechetkin, VM (1980). "Creación de elementos del grupo del hierro en una explosión de supernova". Soviet Astronomy Letters . 6 : 61–64. Código Bibliográfico :1980SvAL....6...61P.
- ^ Domingo, Jose L. (1989), "El cobalto en el medio ambiente y sus implicaciones toxicológicas", en Ware, George W. (ed.), Reviews of Environmental Contamination and Toxicology , vol. 108, Nueva York: Springer, pp. 105–132, doi :10.1007/978-1-4613-8850-0_3, ISBN 978-1-4613-8850-0, PMID 2646660 , consultado el 30 de noviembre de 2023
- ^ Nuccio, Pasquale Mario; Valenza, Mariano (1979). «Determinación de hierro metálico, níquel y cobalto en meteoritos» (PDF) . Rediconti Societa Italiana di Mineralogía y Petrografía . 35 (1): 355–360.
- ^ Kerr, Paul F. (1945). "Cattierita y vaesita: nuevos minerales de níquel y cobre del Congo belga" (PDF) . American Mineralogist . 30 : 83–492.
- ^ Buckley, AN (1987). "La oxidación superficial de la cobaltita". Revista australiana de química . 40 (2): 231. doi :10.1071/CH9870231.
- ^ Young, R. (1957). "La geoquímica del cobalto". Geochimica et Cosmochimica Acta . 13 (1): 28–41. Código Bibliográfico :1957GeCoA..13...28Y. doi :10.1016/0016-7037(57)90056-X.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, enero; Wester, Piet; Opperhuizen, Antoon (2011). "Compuestos peligrosos del humo del tabaco". Revista Internacional de Investigación Ambiental y Salud Pública . 8 (12): 613–628. doi : 10.3390/ijerph8020613 . ISSN 1660-4601. PMC 3084482 . PMID 21556207.
- ^ Pourkhabbaz, A; Pourkhabbaz, H (2012). "Investigación de metales tóxicos en el tabaco de diferentes marcas de cigarrillos iraníes y problemas de salud relacionados". Revista iraní de ciencias médicas básicas . 15 (1): 636–644. PMC 3586865 . PMID 23493960.
- ^ Estadísticas e información sobre el cobalto (PDF) , Servicio Geológico de Estados Unidos, 2023
- ^ abc Shedd, Kim B. "Mineral Yearbook 2006: Cobalt" (PDF) . Servicio Geológico de los Estados Unidos . Consultado el 26 de octubre de 2008 .
- ^ abc Shedd, Kim B. "Informe sobre productos básicos 2008: cobalto" (PDF) . Servicio Geológico de los Estados Unidos . Consultado el 26 de octubre de 2008 .
- ^ ab Henry Sanderson (14 de marzo de 2017). "El meteórico ascenso del cobalto en peligro por la Katanga del Congo" . Financial Times.
- ^ Murray W. Hitzman, Arthur A. Bookstrom, John F. Slack y Michael L. Zientek (2017). "Cobalto: estilos de depósitos y búsqueda de depósitos primarios". USGS . Consultado el 17 de abril de 2021.
- ^ "Precio del cobalto: BMW evita el enigma del Congo, por ahora". Mining.com . Consultado el 17 de abril de 2021.
- ^ Davis, Joseph R. (2000). Manual de especialidades de ASM: níquel, cobalto y sus aleaciones. ASM International. pág. 347. ISBN 0-87170-685-7.
- ^ "Cobalto" (PDF) . Servicio Geológico de los Estados Unidos, Resúmenes de productos minerales. Enero de 2016. Págs. 52-53.
- ^ Wilson, Thomas (26 de octubre de 2017). "Todos dependeremos del Congo para impulsar nuestros coches eléctricos" . Bloomberg . Consultado el 25 de marzo de 2023 .
- ^ "El excedente de existencias de cobalto de Glencore contiene los precios a pesar de la suspensión de la mina". Reuters . 8 de agosto de 2019.
- ^ "Glencore cierra la mina Mutanda, el 20% del suministro mundial de cobalto se desconecta". Benchmark Mineral Intelligence . 28 de noviembre de 2019.
La mina se pondría en cuidado y mantenimiento por un período no inferior a dos años
- ^ "Producción de minerales en África" (PDF) . British Geological Survey . Consultado el 6 de junio de 2009 .
- ^ ab Frankel, Todd C. (30 de septiembre de 2016). «La extracción de cobalto para baterías de iones de litio tiene un alto coste humano». The Washington Post . Consultado el 18 de octubre de 2016 .
- ^ Mucha, Lena; Sadof, Karly Domb; Frankel, Todd C. (28 de febrero de 2018). "Perspectiva: los costos ocultos de la minería de cobalto". The Washington Post . ISSN 0190-8286 . Consultado el 7 de marzo de 2018 .
- ^ Frankel, Todd C. (30 de septiembre de 2016). "EL OLEODUCTO DE COBALTO: Rastreando la ruta desde las minas mortíferas excavadas a mano en el Congo hasta los teléfonos y computadoras portátiles de los consumidores". The Washington Post .
- ^ El trabajo infantil detrás de las baterías de los teléfonos inteligentes y los coches eléctricos. Amnistía Internacional (19 de enero de 2016). Consultado el 7 de enero de 2018.
- ^ Crawford, Alex. Conoce a Dorsen, de 8 años, que extrae cobalto para que tu teléfono inteligente funcione. Sky News UK . Consultado el 7 de enero de 2018.
- ^ ¿ Tienes en tus manos un producto del trabajo infantil en este momento? (Video). Sky News UK (2017-02-28). Consultado el 2018-01-07.
- ^ Reisinger, Don. (3 de marzo de 2017) La revelación sobre el trabajo infantil impulsa a Apple a realizar un cambio en la política de proveedores. Fortune . Recuperado el 7 de enero de 2018.
- ^ Frankel, Todd C. (3 de marzo de 2017) Apple toma medidas más duras contra el proveedor de cobalto en el Congo mientras persiste el trabajo infantil. The Washington Post . Consultado el 7 de enero de 2018.
- ^ Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. "Recursos minerales no combustibles globales y sostenibilidad" . Consultado el 16 de mayo de 2009 .
- ^ Informe de auditoría sobre Congo Dongfang International Mining sarl. DNV-GL Consultado el 18 de abril de 2021.
- ^ "CAMEC – El campeón del cobalto" (PDF) . Minería internacional. Julio de 2008 . Consultado el 18 de noviembre de 2011 .
- ^ Amy Witherden (6 de julio de 2009). «Daily podcast – July 6, 2009». Mining weekly . Consultado el 15 de noviembre de 2011 .
- ^ Gulley, Andrew; McCullough, Erin; Shedd, Kim (agosto de 2019). "La influencia interna y externa de China en la cadena de suministro global de cobalto". Política de recursos . 62 : 317–323. Bibcode :2019RePol..62..317G. doi : 10.1016/j.resourpol.2019.03.015 .
- ^ "Del cobalto a los automóviles: cómo China explota el trabajo infantil y forzoso en el Congo | Comisión Ejecutiva del Congreso sobre China". www.cecc.gov . 14 de noviembre de 2023.
- ^ Home, Andy (19 de febrero de 2024). "Occidente pone en entredicho el control chino de minerales críticos sobre África". Reuters .
- ^ Mining Journal "El retroceso [de Ivanhoe] que los inversores han estado esperando", Aspermont Ltd., Londres, Reino Unido, 22 de febrero de 2018. Consultado el 21 de noviembre de 2018.
- ^ Shabalala, Zandi "El cobalto será declarado mineral estratégico en el Congo", Reuters, 14 de marzo de 2018. Consultado el 3 de octubre de 2018.]
- ^ Reuters , "Kabila del Congo firma un nuevo código minero", 14 de marzo de 2018. Consultado el 3 de octubre de 2018.
- ^ "RDC declara que el cobalto es 'estratégico'", Mining Journal , 4 de diciembre de 2018. Consultado el 7 de octubre de 2020.
- ^ "La demanda estadounidense por el cobalto pone el foco en la tecnología 'sostenible'". Sustainability Times . 17 de diciembre de 2019 . Consultado el 16 de septiembre de 2020 .
- ^ "Apple y Google luchan contra la culpa por el trabajo infantil en las minas de cobalto - Law360" www.law360.com . Consultado el 16 de septiembre de 2020 .
- ^ "La compra de cobalto no responsabiliza a las empresas estadounidenses de los abusos cometidos en la República Democrática del Congo". 6 de marzo de 2024.
- ^ El pueblo fantasma canadiense que Tesla está devolviendo a la vida. Bloomberg (31 de octubre de 2017). Consultado el 7 de enero de 2018.
- ^ "La producción cubana de níquel supera las 50.000 toneladas métricas". Cuba Business Report. Consultado el 18 de abril de 2021.
- ^ "La mayor fuente de cobalto fuera de África es ahora Indonesia". Bloomberg News . 8 de febrero de 2023 . Consultado el 10 de mayo de 2023 .
- ^ Donachie, Matthew J. (2002). Superaleaciones: una guía técnica. ASM International. ISBN 978-0-87170-749-9.
- ^ Campbell, Flake C (30 de junio de 2008). "Cobalto y aleaciones de cobalto". Elementos de metalurgia y aleaciones de ingeniería . ASM International. págs. 557–558. ISBN 978-0-87170-867-0.
- ^ Michel, R.; Nolte, M.; Reich M.; Löer, F. (1991). "Efectos sistémicos de prótesis implantadas hechas de aleaciones de cobalto-cromo". Archivos de Cirugía Ortopédica y Traumatológica . 110 (2): 61–74. doi :10.1007/BF00393876. PMID 2015136. S2CID 28903564.
- ^ Disegi, John A. (1999). Aleaciones a base de cobalto para aplicaciones biomédicas. ASTM International. pág. 34. ISBN 0-8031-2608-5.
- ^ Luborsky, FE; Mendelsohn, LI; Paine, TO (1957). "Reproducción de las propiedades de aleaciones de imán permanente de Alnico con partículas de hierro y cobalto de dominio único alargadas". Journal of Applied Physics . 28 (344): 344. Bibcode :1957JAP....28..344L. doi :10.1063/1.1722744.
- ^ Biggs, T.; Taylor, SS; Van Der Lingen, E. (2005). "El endurecimiento de aleaciones de platino para aplicaciones potenciales en joyería". Platinum Metals Review . 49 : 2–15. doi : 10.1595/147106705X24409 .
- ^ abc Hawkins, M. (2001). "Por qué necesitamos cobalto". Applied Earth Science . 110 (2): 66–71. Bibcode :2001ApEaS.110...66H. doi :10.1179/aes.2001.110.2.66. S2CID 137529349.
- ^ ab Armstrong, RD; Briggs, GWD; Charles, EA (1988). "Algunos efectos de la adición de cobalto al electrodo de hidróxido de níquel". Journal of Applied Electrochemistry . 18 (2): 215–219. doi :10.1007/BF01009266. S2CID 97073898.
- ^ Zhang, P.; Yokoyama, Toshiro; Itabashi, Osamu; Wakui, Yoshito; Suzuki, Toshishige M.; Inoue, Katsutoshi (1999). "Recuperación de valores metálicos de baterías recargables de níquel-hidruro metálico gastadas". Journal of Power Sources . 77 (2): 116–122. Bibcode :1999JPS....77..116Z. doi :10.1016/S0378-7753(98)00182-7.
- ^ West , Karl ( 29 de julio de 2017) . «Los sueños eléctricos de los fabricantes de automóviles dependen del suministro de minerales raros». The Guardian . Archivado desde el original el 6 de junio de 2022. Consultado el 29 de junio de 2022 .
- ^ Castellano, Robert (13 de octubre de 2017). «Cómo minimizar el riesgo de la cadena de suministro de cobalto de Tesla». Seeking Alpha . Archivado desde el original el 4 de abril de 2022 . Consultado el 29 de junio de 2022 .
- ^ ab "A medida que se reduce el suministro de cobalto, LiCo Energy Metals anuncia dos nuevas minas de cobalto". cleantechnica.com . 28 de noviembre de 2017 . Consultado el 7 de enero de 2018 .
- ^ Shilling, Erik (31 de octubre de 2017). «Es posible que no tengamos suficientes minerales ni siquiera para satisfacer la demanda de coches eléctricos». Jalopnik . Archivado desde el original el 1 de abril de 2022 . Consultado el 29 de junio de 2022 .
- ^ "Estado de carga: vehículos eléctricos, baterías y materiales de baterías (informe gratuito de @AdamasIntel)". Adamas Intelligence . 20 de septiembre de 2019. Archivado desde el original el 20 de octubre de 2019 . Consultado el 20 de octubre de 2019 .
- ^ "Los Muskmobiles sacan a sus rivales de la carretera". MINING.COM . 26 de septiembre de 2019. Archivado desde el original el 30 de septiembre de 2019.
- ^ Hermes, Jennifer. (31 de mayo de 2017) Tesla y GE enfrentan una importante escasez de cobalto de origen ético. Environmentalleader.com. Consultado el 7 de enero de 2018.
- ^ Los coches eléctricos aún no han convertido el mercado del cobalto en una mina de oro – Nornickel. MINING.com (30 de octubre de 2017). Consultado el 7 de enero de 2018.
- ^ "¿Por qué se han desplomado los precios del cobalto?". International Banker . 31 de julio de 2019. Archivado desde el original el 30 de noviembre de 2019.
- ^ "Precios del cobalto y gráficos de precios del cobalto - InvestmentMine". www.infomine.com .
- ^ "Tesla se une a la "Fair Cobalt Alliance" para mejorar la minería artesanal en la República Democrática del Congo". mining-technology.com . 8 de septiembre de 2020 . Consultado el 26 de septiembre de 2020 .
- ^ Klender, Joey (8 de septiembre de 2020). "Tesla se une a la Fair Cobalt Alliance en apoyo de los esfuerzos de minería moral". teslarati.com . Consultado el 26 de septiembre de 2020 .
- ^ Sitio web de baterías sin CO2 para futuras aplicaciones automotrices
- ^ Proyecto COBRA en la Unión Europea
- ^ Yoo-chul, Kim (14 de agosto de 2020). "La estrategia de baterías de Tesla, implicaciones para LG y Samsung". The Korea Times . Consultado el 26 de septiembre de 2020 .
- ^ Shahan, Zachary (31 de agosto de 2020). "Litio, níquel y Tesla, ¡Dios mío!". cleantechnica.com . Consultado el 26 de septiembre de 2020 .
- ^ Calma, Justine (22 de septiembre de 2020). "Tesla fabricará cátodos para baterías de vehículos eléctricos sin cobalto". theverge.com . Consultado el 26 de septiembre de 2020 .
- ^ "La batería de litio y fosfato de hierro para vehículos eléctricos contraataca". energytrend.com . 25 de mayo de 2022.
- ^ "Secante de cobalto para pinturas | Cobalt Cem-All®". Borchers . Archivado desde el original el 9 de julio de 2023 . Consultado el 15 de mayo de 2021 .
- ^ Halstead, Joshua (abril de 2023). "Aplicaciones ampliadas y mayor durabilidad de los recubrimientos alquídicos mediante catalizadores de alto rendimiento". CoatingsTech . 20 (3): 45–55 – vía American Coatings Association.
- ^ Weatherhead, RG (1980), Weatherhead, RG (ed.), "Catalizadores, aceleradores e inhibidores para resinas de poliéster insaturado", Tecnología FRP: sistemas de resina reforzada con fibra , Dordrecht: Springer Países Bajos, págs. 204-239, doi :10.1007/978-94-009-8721-0_10, ISBN 978-94-009-8721-0
- ^ "El selector de productos | AOC". aocresins.com . Consultado el 15 de mayo de 2021 .
- ^ "Comar Chemicals - Aceleración del poliéster". www.comarchemicals.com . Archivado desde el original el 15 de mayo de 2021. Consultado el 15 de mayo de 2021 .
- ^ Khodakov, Andrei Y. Khodakov; Chu, Wei y Fongarland, Pascal (2007). "Avances en el desarrollo de nuevos catalizadores Fischer-Tropsch de cobalto para la síntesis de hidrocarburos de cadena larga y combustibles limpios". Chemical Reviews . 107 (5): 1692–1744. doi :10.1021/cr050972v. PMID 17488058.
- ^ Hebrard, Frédéric y Kalck, Philippe (2009). "Hidroformilación de alquenos catalizada por cobalto: generación y reciclaje de especies carbonílicas y ciclo catalítico". Chemical Reviews . 109 (9): 4272–4282. doi :10.1021/cr8002533. PMID 19572688.
- ^ Overman, Frederick (1852). Tratado sobre metalurgia. D. Appleton & Company. págs. 631–637.
- ^ Muhlethaler, Bruno; Tissen, Jean (1969). "Pequeño". Estudios en Conservación . 14 (2): 47–61. doi :10.2307/1505347. JSTOR 1505347.
- ^ Gehlen, AF (1803). "Ueber die Bereitung einer blauen Farbe aus Kobalt, die eben so schön ist wie Ultramarin. Vom Bürger Thenard". Neues Allgemeines Journal der Chemie, Banda 2 . H. Frölich.(Traducción alemana de LJ Thénard ; Journal des Mines; Brumario 12, 1802; p. 128-136)
- ^ Witteveen, HJ; Farnau, EF (1921). "Colores desarrollados por óxidos de cobalto". Química industrial e ingeniería . 13 (11): 1061–1066. doi :10.1021/ie50143a048.
- ^ Venetskii, S. (1970). "La carga de los cañones de la paz". Metalúrgico . 14 (5): 334–336. doi :10.1007/BF00739447. S2CID 137225608.
- ^ Mandeville, C.; Fulbright, H. (1943). "Las energías de los rayos γ de Sb 122 , Cd 115 , Ir 192 , Mn 54 , Zn 65 y Co 60 ". Physical Review . 64 (9–10): 265–267. Bibcode :1943PhRv...64..265M. doi :10.1103/PhysRev.64.265.
- ^ Wilkinson, VM; Gould, G. (1998). Irradiación de alimentos: una guía de referencia. Woodhead. pág. 53. ISBN 978-1-85573-359-6.
- ^ Blakeslee, Sandra (1 de mayo de 1984). "El accidente de Juárez". The New York Times . Consultado el 6 de junio de 2009 .
- ^ "Dispersión de fuentes huérfanas en Ciudad Juárez, 1983". Wm. Robert Johnston. 23 de noviembre de 2005. Consultado el 24 de octubre de 2009 .
- ^ Consejo Nacional de Investigación (EE. UU.). Comité sobre el uso y reemplazo de fuentes de radiación; Consejo Nacional de Investigación (EE. UU.). Junta de Estudios Nucleares y Radiológicos (enero de 2008). Uso y reemplazo de fuentes de radiación: versión abreviada. National Academies Press. pp. 35–. ISBN 978-0-309-11014-3. Recuperado el 29 de abril de 2011 .
- ^ Meyer, Theresa (30 de noviembre de 2001). Physical Therapist Examination Review. SLACK Incorporated. pág. 368. ISBN 978-1-55642-588-2.
- ^ Kalnicky, D.; Singhvi, R. (2001). "Análisis XRF portátil de campo de muestras ambientales". Journal of Hazardous Materials . 83 (1–2): 93–122. Bibcode :2001JHzM...83...93K. doi :10.1016/S0304-3894(00)00330-7. PMID 11267748.
- ^ Payne, LR (1977). "Los peligros del cobalto". Medicina del trabajo . 27 (1): 20–25. doi :10.1093/occmed/27.1.20. PMID 834025.
- ^ Puri-Mirza, Amna (2020). "Producción de cobalto en Marruecos". Estadística .
- ^ Trento, Chin (14 de abril de 2024). «¿Para qué se utiliza el cobalto en la vida cotidiana?». Stanford Advanced Materials . Consultado el 24 de junio de 2024 .
- ^ Croat, John; Ormerod, John, eds. (2022). "Capítulo 11: Recubrimientos de imanes permanentes y procedimientos de prueba". Imanes permanentes modernos . Serie de publicaciones Woodhead en materiales electrónicos y ópticos. Publicaciones Woodhead. págs. 371–402. doi :10.1016/B978-0-323-88658-1.00011-X. ISBN 9780323886581. Recuperado el 24 de junio de 2024 .
- ^ "Imanes de Alnico: una mirada más cercana a su historia, propiedades y aplicaciones". Radial Magnet . 15 de febrero de 2024 . Consultado el 24 de junio de 2024 .
- ^ Mohapatra, Jeotikanta; Xing, Meiying (2020). "Materiales magnéticos duros y semiduros basados en cobalto y aleaciones de cobalto". Revista de aleaciones y compuestos . 824 . doi :10.1016/j.jallcom.2020.153874.
- ^ Yousuf, Rehab; Mahmoud, Naglaa (2021). "Propiedades eléctricas y magnéticas de complejos organometálicos de cobalto, cobre y níquel para cables moleculares". Revista de ingeniería Ain Shams . 12 (2): 2135–2144. doi : 10.1016/j.asej.2020.12.002 .
- ^ "Imanes de neodimio y cobalto y samario". Soluciones magnéticas ideales . 15 de mayo de 2019. Consultado el 24 de junio de 2024 .
- ^ Davis, Joseph R; Comité del Manual, ASM International (1 de mayo de 2000). "Cobalto". Níquel, cobalto y sus aleaciones . ASM International. pág. 354. ISBN 978-0-87170-685-0.
- ^ Comité de Alternativas Tecnológicas para la Conservación del Cobalto, Consejo Nacional de Investigación (EE.UU.); Consejo Nacional de Asesoramiento de Materiales, Consejo Nacional de Investigación (EE.UU.) (1983). "Ground–Coat Frit". Conservación del cobalto mediante alternativas tecnológicas . pág. 129.
- ^ Yamada, Kazuhiro (2013). "Capítulo 9. Cobalto: su papel en la salud y la enfermedad". En Sigel, Astrid; Sigel, Helmut; Sigel, Roland KO (eds.). Interrelaciones entre iones metálicos esenciales y enfermedades humanas . Iones metálicos en las ciencias de la vida. Vol. 13. Springer. págs. 295–320. doi :10.1007/978-94-007-7500-8_9. ISBN 978-94-007-7499-5. Número de identificación personal 24470095.
- ^ Cracan, Valentin; Banerjee, Ruma (2013). "Capítulo 10 Transporte y bioquímica de cobalto y corrinoides". En Banci, Lucia (ed.). Metalómica y la célula . Iones metálicos en las ciencias de la vida. Vol. 12. Springer. págs. 333–374. doi :10.1007/978-94-007-5561-1_10. ISBN 978-94-007-5560-4. Número de identificación personal 23595677.libro electrónico ISBN 978-94-007-5561-1 ISSN 1559-0836 electrónico- ISSN 1868-0402.
- ^ Schwarz, FJ; Kirchgessner, M.; Stangl, GI (2000). "Requerimiento de cobalto del ganado vacuno de carne: consumo de alimento y crecimiento a diferentes niveles de suministro de cobalto". Journal of Animal Physiology and Animal Nutrition . 83 (3): 121–131. doi :10.1046/j.1439-0396.2000.00258.x.
- ^ Voet, Judith G.; Voet, Donald (1995). Bioquímica . Nueva York: J. Wiley & Sons. pag. 675.ISBN 0-471-58651-X.OCLC 31819701 .
- ^ Smith, David M.; Golding, Bernard T.; Radom, Leo (1999). "Comprensión del mecanismo de la metilmalonil-CoA mutasa dependiente de B12: transferencia parcial de protones en acción". Revista de la Sociedad Química Estadounidense . 121 (40): 9388–9399. doi :10.1021/ja991649a.
- ^ Kobayashi, Michihiko; Shimizu, Sakayu (1999). "Proteínas de cobalto". Revista Europea de Bioquímica . 261 (1): 1–9. doi :10.1046/j.1432-1327.1999.00186.x. PMID 10103026.
- ^ "Suelos". Universidad de Waikato. Archivado desde el original el 25 de enero de 2012. Consultado el 16 de enero de 2012 .
- ^ ab McDowell, Lee Russell (2008). Vitaminas en la nutrición animal y humana (2.ª ed.). Hoboken: John Wiley & Sons. pág. 525. ISBN 978-0-470-37668-3.
- ^ Academia Australiana de Ciencias > Miembros fallecidos > Hedley Ralph Marston 1900–1965 Consultado el 12 de mayo de 2013.
- ^ Snook, Laurence C. (1962). "Cobalto: su uso para controlar la enfermedad del desgaste". Revista del Departamento de Agricultura, Australia Occidental . 4. 3 (11): 844–852.
- ^ "Cobalto 356891". Sigma-Aldrich . 14 de octubre de 2021 . Consultado el 22 de diciembre de 2021 .
- ^ Donaldson, John D. y Beyersmann, Detmar (2005) "Cobalto y compuestos de cobalto" en Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, Weinheim. doi :10.1002/14356007.a07_281.pub2
- ^ Guía de bolsillo del NIOSH sobre peligros químicos. "#0146". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Morin Y; Tětu A; Mercier G (1969). "Miocardiopatía en bebedores de cerveza de Quebec: aspectos clínicos y hemodinámicos". Anales de la Academia de Ciencias de Nueva York . 156 (1): 566–576. Bibcode :1969NYASA.156..566M. doi :10.1111/j.1749-6632.1969.tb16751.x. PMID 5291148. S2CID 7422045.
- ^ Barceloux, Donald G. y Barceloux, Donald (1999). "Cobalto". Toxicología clínica . 37 (2): 201–216. doi :10.1081/CLT-100102420. PMID 10382556.
- ^ [PDF]
- ^ Elbagir, Nima; van Heerden, Dominique; Mackintosh, Eliza (mayo de 2018). "Energía sucia". CNN . Consultado el 30 de mayo de 2018 .
- ^ Basketter, David A.; Angelini, Gianni; Ingber, Arieh; Kern, Petra S.; Menné, Torkil (2003). "Níquel, cromo y cobalto en productos de consumo: revisando los niveles seguros en el nuevo milenio". Dermatitis de contacto . 49 (1): 1–7. doi : 10.1111/j.0105-1873.2003.00149.x . PMID 14641113. S2CID 24562378.
Lectura adicional
- Harper, EM; Kavlak, G.; Graedel, TE (2012). "Rastreando el metal de los duendes: el ciclo de uso del cobalto". Environmental Science & Technology . 46 (2): 1079–86. Bibcode :2012EnST...46.1079H. doi :10.1021/es201874e. PMID 22142288. S2CID 206948482.
- Narendrula, R.; Nkongolo, KK; Beckett, P. (2012). "Análisis comparativos de metales en el suelo en Sudbury (Ontario, Canadá) y Lubumbashi (Katanga, RD-Congo)". Boletín de contaminación ambiental y toxicología . 88 (2): 187–92. Bibcode :2012BuECT..88..187N. doi :10.1007/s00128-011-0485-7. PMID 22139330. S2CID 34070357.
- Pauwels, H.; Pettenati, M.; Greffié, C. (2010). "El efecto combinado de las minas abandonadas y la agricultura en la química del agua subterránea". Journal of Contaminant Hydrology . 115 (1–4): 64–78. Bibcode :2010JCHyd.115...64P. doi :10.1016/j.jconhyd.2010.04.003. PMID 20466452.
- Bulut, G. (2006). "Recuperación de cobre y cobalto de escorias antiguas". Waste Management & Research . 24 (2): 118–24. Bibcode :2006WMR....24..118B. doi :10.1177/0734242X06063350. PMID 16634226. S2CID 24931095.
- Jefferson, JA; Escudero, E.; Hurtado, ME; Pando, J.; Tapia, R.; Swenson, ER; Prchal, J.; Schreiner, GF; Schoene, RB; Hurtado, A.; Johnson, RJ (2002). "Eritrocitosis excesiva, mal de montaña crónico y niveles séricos de cobalto". Lancet . 359 (9304): 407–8. doi :10.1016/s0140-6736(02)07594-3. PMID 11844517. S2CID 12319751.
- Løvold, TV; Haugsbø, L. (1999). "Fábrica de minería de cobalto: diagnósticos 1822-32". Tidsskrift for den Norske Laegeforening . 119 (30): 4544–6. PMID 10827501.
- Bird, GA; Hesslein, RH; Mills, KH; Schwartz, WJ; Turner, MA (1998). "Bioacumulación de radionucleidos en cuencas lacustres fertilizadas del Escudo Canadiense". La ciencia del medio ambiente total . 218 (1): 67–83. Bibcode :1998ScTEn.218...67B. doi :10.1016/s0048-9697(98)00179-x. PMID 9718743.
- Nemery, B. (1990). "Toxicidad de metales y vías respiratorias". The European Respiratory Journal . 3 (2): 202–19. doi : 10.1183/09031936.93.03020202 . PMID 2178966.
- Kazantzis, G. (1981). "El papel del cobalto, el hierro, el plomo, el manganeso, el mercurio, el platino, el selenio y el titanio en la carcinogénesis". Environmental Health Perspectives . 40 : 143–61. doi :10.1289/ehp.8140143. PMC 1568837 . PMID 7023929.
- Kerfoot, EJ; Fredrick, WG; Domeier, E. (1975). "Estudios de inhalación de metal cobalto en cerdos miniatura". Revista de la Asociación Estadounidense de Higiene Industrial . 36 (1): 17–25. doi :10.1080/0002889758507202. PMID 1111264.
Enlaces externos
- . Enciclopedia Británica . vol. VI (9ª ed.). 1878, págs. 81–83.
- El cobalto en la tabla periódica de vídeos (Universidad de Nottingham)
- Centros para la Prevención y la Prevención de Enfermedades – Cobalto