Hexano
 | |
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Hexano [2] | |
| Otros nombres Sextano, [1] hexacarbano | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 1730733 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos | |
| Tarjeta informativa de la ECHA | 100.003.435 |
| Número CE |
|
| 1985 | |
| BARRIL | |
| Malla | n-hexano |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 1208 |
Panel de control CompTox ( EPA ) |
|
| |
| Propiedades | |
| C6H14 | |
| Masa molar | 86,178 g·mol −1 |
| Apariencia | Líquido incoloro |
| Olor | Petrolífero |
| Densidad | 0,6606 g mL −1 [3] |
| Punto de fusión | −96 a −94 °C; −141 a −137 °F; 177 a 179 K |
| Punto de ebullición | 68,5 a 69,1 °C; 155,2 a 156,3 °F; 341,6 a 342,2 K |
| 9,5 mg L -1 | |
| registro P | 3.764 |
| Presión de vapor | 17,60 kPa (a 20,0 °C) |
Constante de la ley de Henry ( k H ) | 7,6 nmol Pa −1 kg −1 |
| UV-vis (λmáx . ) | 200 nm |
| −74,6·10 −6 cm3 / mol | |
Índice de refracción ( n D ) | 1.375 |
| Viscosidad | 0,3 mPa·s |
| 0,08 D | |
| Termoquímica | |
Capacidad calorífica ( C ) | 265,2 JK −1 mol −1 |
Entropía molar estándar ( S ⦵ 298 ) | 296,06 JK −1 mol −1 |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −199,4–−198,0 kJ mol −1 |
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | −4180–−4140 kJ mol −1 |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Toxicidad reproductiva : después de aspiración , edema pulmonar , neumonitis [4] |
| Etiquetado SGA : | |
    | |
| Peligro | |
| H225 , H302 , H305 , H315 , H336 , H361fd , H373 , H411 | |
| P201 , P202 , P210 , P233 , P235 , P240 , P241 , P242 , P243 , P260 , P264 , P271 , P273 , P280 , P281 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+P340 , P308+P313 , P310 , P312 , P314 , P332+P313 , P363 , P370+P378 , P391 , P403+P233 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | -26,0 °C (-14,8 °F; 247,2 K) |
| 234,0 °C (453,2 °F; 507,1 K) | |
| Límites de explosividad | 1,2–7,7% |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 25 g kg −1 (oral, rata) 28710 mg/kg (rata, oral) [6] |
LD Lo ( valor más bajo publicado ) | 56137 mg/kg (rata, oral) [6] |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | TWA 500 ppm (1800 mg/m3 ) [ 5] |
REL (recomendado) | TWA 50 ppm (180 mg/m3 ) [ 5] |
IDLH (Peligro inmediato) | 1100 ppm [5] |
| Compuestos relacionados | |
Alcanos relacionados | |
| Página de datos complementarios | |
| Hexano (página de datos) | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El hexano ( / ˈ h ɛ k s eɪ n / ) o n -hexano es un compuesto orgánico , un alcano de cadena lineal con seis átomos de carbono y la fórmula molecular C 6 H 14 . [7]
El hexano es un líquido incoloro, inodoro cuando está puro y con un punto de ebullición de aproximadamente 69 °C (156 °F). Se utiliza ampliamente como un disolvente no polar barato, relativamente seguro, poco reactivo y de fácil evaporación, y las mezclas de gasolina modernas contienen aproximadamente un 3 % de hexano. [8]
El término hexanos se refiere a una mezcla , compuesta principalmente (>60%) de n -hexano, con cantidades variables de los compuestos isoméricos 2-metilpentano y 3-metilpentano , y posiblemente, cantidades más pequeñas de (ciclo)alcanos no isoméricos C5 , C6 y C7 . Estas mezclas de "hexanos" son más económicas que el hexano puro y se utilizan a menudo en operaciones a gran escala que no requieren un solo isómero (por ejemplo, como disolvente de limpieza o para cromatografía ).
Isómeros
| Nombre común | Nombre IUPAC | Fórmula de texto | Fórmula esquelética |
|---|---|---|---|
| Hexano normal , n -hexano | Hexano | CH3 ( CH2 ) 4 CH3 | 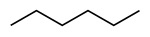 |
| Isohexano | 2-Metilpentano | ( CH3 ) 2CH ( CH2 ) 2CH3 | 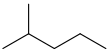 |
| 3-Metilpentano | CH3CH2CH ( CH3 ) CH2CH3 | 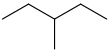 | |
| 2,3-Dimetilbutano | ( CH3 ) 2CHCH ( CH3 ) 2 | 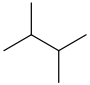 | |
| Neohexano | 2,2-Dimetilbutano | ( CH3 ) 3CCH2CH3 | 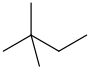 |
Usos
En la industria, los hexanos se utilizan en la formulación de pegamentos para zapatos, productos de cuero y techos. También se utilizan para extraer aceites de cocina (como el aceite de canola o el aceite de soja ) de las semillas, para limpiar y desengrasar una variedad de artículos y en la fabricación de textiles.
Un uso típico de los hexanos en el laboratorio es la extracción de contaminantes de aceite y grasa del agua y el suelo para su análisis. [9] Dado que el hexano no se puede desprotonar fácilmente , se utiliza en el laboratorio para reacciones que involucran bases muy fuertes, como la preparación de organolitios . Por ejemplo, los butil-litios se suministran típicamente como una solución de hexano. [10]
Los hexanos se utilizan habitualmente en cromatografía como disolvente no polar. Los alcanos superiores presentes como impurezas en los hexanos tienen tiempos de retención similares a los del disolvente, lo que significa que las fracciones que contienen hexano también contendrán estas impurezas. En la cromatografía preparativa, la concentración de un gran volumen de hexanos puede dar como resultado una muestra considerablemente contaminada por alcanos. Esto puede dar como resultado la obtención de un compuesto sólido en forma de aceite y los alcanos pueden interferir en el análisis.
Producción
El hexano se obtiene principalmente refinando el petróleo crudo . La composición exacta de la fracción depende en gran medida de la fuente del petróleo (crudo o reformado) y de las limitaciones de la refinación. [11] El producto industrial (normalmente alrededor del 50% en peso del isómero de cadena lineal) es la fracción que hierve a 65–70 °C (149–158 °F).
Propiedades físicas
Todos los alcanos son incoloros. [12] [13] Los puntos de ebullición de los diversos hexanos son bastante similares y, al igual que en el caso de otros alcanos, son generalmente más bajos en las formas más ramificadas. Los puntos de fusión son bastante diferentes y la tendencia no es evidente. [14]
| Isómero | MP (°C) | MP (°F) | Presión arterial (°C) | Presión arterial (°F) |
|---|---|---|---|---|
| n- hexano | -95,3 | −139,5 | 68,7 | 155,7 |
| 3-metilpentano | −118,0 | −180,4 | 63.3 | 145,9 |
| 2-metilpentano (isohexano) | −153,7 | −244,7 | 60.3 | 140,5 |
| 2,3-dimetilbutano | −128,6 | -199,5 | 58.0 | 136.4 |
| 2,2-dimetilbutano (neohexano) | −99,8 | −147,6 | 49,7 | 121,5 |
El hexano tiene una presión de vapor considerable a temperatura ambiente:
| Temperatura (°C) | Temperatura (°F) | Presión de vapor ( mmHg ) | Presión de vapor ( kPa ) |
|---|---|---|---|
| -40 | -40 | 3.36 | 0,448 |
| -30 | -22 | 7.12 | 0,949 |
| -20 | -4 | 14.01 | 1.868 |
| -10 | 14 | 25,91 | 3.454 |
| 0 | 32 | 45.37 | 6.049 |
| 10 | 50 | 75,74 | 10.098 |
| 20 | 68 | 121.26 | 16.167 |
| 25 | 77 | 151.28 | 20.169 |
| 30 | 86 | 187.11 | 24.946 |
| 40 | 104 | 279,42 | 37.253 |
| 50 | 122 | 405.31 | 54.037 |
| 60 | 140 | 572,76 | 76.362 |
Reactividad
Como la mayoría de los alcanos, los hexanos se caracterizan por mostrar una baja reactividad y son disolventes adecuados para compuestos reactivos. Sin embargo, las muestras comerciales de n -hexano a menudo contienen metilciclopentano , que presenta enlaces CH terciarios, que son incompatibles con algunas reacciones radicalarias. [15]
Seguridad
La inhalación de n -hexano a 5000 ppm durante 10 minutos produce vértigo marcado; 2500-1000 ppm durante 12 horas produce somnolencia , fatiga , pérdida de apetito y parestesia en las extremidades distales; 2500–5000 ppm produce debilidad muscular, pulsaciones frías en las extremidades, visión borrosa, dolor de cabeza y anorexia . [16] Se ha demostrado que la exposición ocupacional crónica a niveles elevados de n -hexano está asociada con neuropatía periférica en mecánicos de automóviles en los EE. UU. y neurotoxicidad en trabajadores de imprentas y fábricas de zapatos y muebles en Asia, Europa y América del Norte. [17]
El Instituto Nacional de Seguridad y Salud Ocupacional de los Estados Unidos (NIOSH) ha establecido un límite de exposición recomendado (REL) para los isómeros de hexano (no n -hexano) de 100 ppm (350 mg/m3 ( 0,15 gr/pie cúbico)) durante una jornada laboral de 8 horas. [18] Sin embargo, para el n -hexano, el REL actual de NIOSH es de 50 ppm (180 mg/m3 ( 0,079 gr/pie cúbico)) durante una jornada laboral de 8 horas. [19] Este límite fue propuesto como límite de exposición permisible (PEL) por la Administración de Seguridad y Salud Ocupacional en 1989; sin embargo, este PEL fue anulado en los tribunales de los Estados Unidos en 1992. [20] El PEL actual de n-hexano en los Estados Unidos es de 500 ppm (1.800 mg/m3 ( 0,79 gr/pie cúbico)). [19]
El hexano y otros hidrocarburos volátiles ( éter de petróleo ) presentan un riesgo de aspiración . [21] El n -hexano se utiliza a veces como desnaturalizante del alcohol y como agente de limpieza en las industrias textil , del mueble y del cuero. Poco a poco se va sustituyendo por otros disolventes. [22]
Al igual que la gasolina, el hexano es altamente volátil y presenta riesgo de explosión. Las explosiones de las alcantarillas de Louisville en 1981 , que destruyeron más de 21 km de líneas de alcantarillado y calles en Kentucky, fueron causadas por la ignición de vapores de hexano que habían sido descargados ilegalmente de una planta procesadora de soja propiedad de Ralston-Purina . El hexano fue atribuido como la causa de una explosión que ocurrió en la Universidad Nacional de Río Cuarto , Argentina, el 5 de diciembre de 2007, debido a un derrame de hexano cerca de una máquina productora de calor que explotó, produciendo un incendio que mató a un estudiante e hirió a 24 más.
Incidentes
Se han producido casos de intoxicación ocupacional por hexano en trabajadores japoneses que fabrican sandalias, trabajadores italianos del calzado, [23] trabajadores de pruebas de imprenta de Taiwán y otros. [24] El análisis de los trabajadores taiwaneses ha demostrado exposición ocupacional a sustancias que incluyen n -hexano. [25] En 2010-2011, se informó de que trabajadores chinos que fabricaban iPhones habían sufrido intoxicación por hexano. [26] [27]
Biotransformación
El n -hexano se biotransforma en 2-hexanol y luego en 2,5-hexanodiol en el cuerpo. La conversión es catalizada por la enzima citocromo P450 que utiliza oxígeno del aire. El 2,5-hexanodiol puede oxidarse aún más a 2,5-hexanodiona , que es neurotóxica y produce una polineuropatía . [22] En vista de este comportamiento, se ha discutido la sustitución del n -hexano como disolvente. El n -heptano es una posible alternativa. [28]
Véase también
Referencias
- ^ Hofmann, August Wilhelm Von (1 de enero de 1867). "I. Sobre la acción del tricloruro de fósforo sobre las sales de las monaminas aromáticas". Actas de la Royal Society de Londres . 15 : 54–62. doi :10.1098/rspl.1866.0018. S2CID 98496840.
- ^ "n-hexano – Resumen del compuesto". PubChem Compound . EE. UU.: Centro Nacional de Información Biotecnológica. 16 de septiembre de 2004. Identificación y registros relacionados. Archivado desde el original el 8 de marzo de 2012 . Consultado el 31 de diciembre de 2011 .
- ^ William M. Haynes (2016). Manual de química y física del CRC (97.ª edición). Boca Raton: CRC Press. págs. 3–298. ISBN 978-1-4987-5429-3.
- ^ Clasificación GHS en [PubChem]
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0322". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab "n-Hexano". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ PubChem. "n-HEXANO". pubchem.ncbi.nlm.nih.gov . Consultado el 3 de noviembre de 2023 .
- ^ "n-Hexano - Agentes peligrosos". Haz-Map . Consultado el 7 de julio de 2022 .
- ^ Uso de sustancias que agotan la capa de ozono en laboratorios. Kbh: Nordisk Ministerråd. 2003.ISBN 92-893-0884-2. OCLC 474188215. Archivado desde el original el 16 de julio de 2012.
- ^ Schwindeman, James A.; Woltermann, Chris J.; Letchford, Robert J. (1 de mayo de 2002). "Manipulación segura de compuestos de organolitio en el laboratorio". Chemical Health & Safety . 9 (3): 6–11. doi :10.1016/s1074-9098(02)00295-2. ISSN 1074-9098.
- ^ Le Van Mao, R.; Melancon, S.; Gauthier-Campbell, C.; Kletnieks, P. (1 de mayo de 2001). "Proceso de craqueo catalítico profundo selectivo (SDCC) de materias primas de petróleo para la producción de olefinas ligeras. I. El efecto Catlever obtenido con un sistema de dos zonas de reacción en la conversión de n-hexano". Catalysis Letters . 73 (2): 181–186. doi :10.1023/A:1016685523095. ISSN 1572-879X. S2CID 98167823.
- ^ "Química orgánica-I" (PDF) . Nsdl.niscair.res.in. Archivado desde el original (PDF) el 29 de octubre de 2013 . Consultado el 17 de febrero de 2014 .
- ^ "13. Hidrocarburos | Libros de texto". Textbook.s-anand.net. Archivado desde el original el 6 de octubre de 2014. Consultado el 17 de febrero de 2014 .
- ^ William D. McCain (1990). Propiedades de los fluidos derivados del petróleo. PennWell. ISBN 978-0-87814-335-1.
- ^ Koch, H.; Haaf, W. (1973). "Ácido 1-adamantanocarboxílico". Síntesis orgánicas; Volúmenes recopilados , vol. 5, pág. 20.
- ^ "N-HEXANO". Red de datos toxicológicos Banco de datos de sustancias peligrosas . Biblioteca Nacional de Medicina . Archivado desde el original el 4 de septiembre de 2015.
- ^ Centros para el Control y la Prevención de Enfermedades (CDC) (16 de noviembre de 2001). "Neuropatía periférica relacionada con el n-hexano entre técnicos automotrices: California, 1999-2000". MMWR. Informe semanal de morbilidad y mortalidad . 50 (45): 1011–1013. ISSN 0149-2195. PMID 11724159.
- ^ "CDC – NIOSH Pocket Guide to Chemical Hazards – Hexane isomers (without n-Hexane)" (Guía de bolsillo de los CDC sobre peligros químicos del NIOSH: isómeros de hexano (excluyendo n-hexano)). cdc.gov . Archivado desde el original el 31 de octubre de 2015. Consultado el 3 de noviembre de 2015 .
- ^ ab CDC (28 de marzo de 2018). "n-Hexano". Centros para el Control y la Prevención de Enfermedades . Consultado el 3 de mayo de 2020 .
- ^ "Apéndice G: Proyecto de actualización de contaminantes del aire de 1989 - Límites de exposición que NO están en vigor". www.cdc.gov . 20 de febrero de 2020 . Consultado el 3 de mayo de 2020 .
- ^ Gad, Shayne C (2005), "Hidrocarburos de petróleo", Enciclopedia de toxicología , vol. 3 (2.ª ed.), Elsevier, págs. 377-379
- ^ ab Clough, Stephen R; Mulholland, Leyna (2005). "Hexano". Enciclopedia de toxicología . Vol. 2 (2.ª ed.). Elsevier. págs. 522–525.
- ^ Rizzuto, N; De Grandis, D; Di Trapani, G; Pasinato, E (1980). "Polineuropatía por N-hexano. Una enfermedad ocupacional de los zapateros". Neurología europea . 19 (5): 308–15. doi :10.1159/000115166. PMID 6249607.
- ^ n-Hexano, Criterios de salud ambiental , Organización Mundial de la Salud, 1991, archivado desde el original el 19 de marzo de 2014
- ^ Liu, CH; Huang, CY; Huang, CC (2012). "Enfermedades neurotóxicas ocupacionales en Taiwán". Seguridad y salud en el trabajo . 3 (4): 257–67. doi :10.5491/SHAW.2012.3.4.257. PMC 3521924 . PMID 23251841.
- ^ "Trabajadores envenenados mientras fabricaban iPhones – ABC News (Australian Broadcasting Corporation)". Australian Broadcasting Corporation. 26 de octubre de 2010. Archivado desde el original el 8 de abril de 2011. Consultado el 17 de marzo de 2015 .
- ^ David Barboza (22 de febrero de 2011). «Trabajadores de un proveedor de Apple en China se enferman». The New York Times . Archivado desde el original el 7 de abril de 2015. Consultado el 17 de marzo de 2015 .
- ^ Filser JG, Csanády GA, Dietz W, Kessler W, Kreuzer PE, Richter M, Störmer A (1996). "Estimación comparativa de los riesgos neurotóxicos del N-hexano y el N-heptano en ratas y seres humanos en función de la formación de los metabolitos 2,5-hexanodiona y 2,5-heptanodiona". Intermedios reactivos biológicos V. Avances en medicina y biología experimental. Vol. 387. págs. 411–427. doi :10.1007/978-1-4757-9480-9_50. ISBN 978-1-4757-9482-3. Número de identificación personal 8794236.
Enlaces externos
- Ficha internacional de seguridad química 1262 (2-metilpentano)
- Hoja de datos de seguridad del material para hexano
- Inventario Nacional de Contaminantes: hoja informativa sobre el n-hexano
- Entrada de la base de datos de fitoquímica
- Centro para el Control y la Prevención de Enfermedades
- Advertencia del Consejo Nacional de Seguridad: “SUSTANCIAS QUÍMICAS COMUNES AFECTAN A LA MECÁNICA AUTOMOTRIZ”
- Página del Inventario Nacional de Contaminantes (NPI) de Australia
- "La EPA no considera que el n-hexano sea un carcinógeno humano". Registro Federal / Vol. 66, No. 71 / Jueves, 12 de abril de 2001 / Normas y reglamentos



