Ácido butírico
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Ácido butanóico [1] | |||
| Otros nombres | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.003.212 | ||
| Número CE |
| ||
| |||
| BARRIL | |||
| Malla | Ácido butírico+ | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 2820 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| do 3yo 7COOH | |||
| Masa molar | 88,106 g·mol −1 | ||
| Apariencia | Líquido incoloro | ||
| Olor | Desagradable, similar al vómito o al olor corporal. | ||
| Densidad | 1,135 g/cm3 ( −43 °C) [2] 0,9528 g/cm3 ( 25 °C) [3] | ||
| Punto de fusión | -5,1 °C (22,8 °F; 268,0 K) [3] | ||
| Punto de ebullición | 163,75 °C (326,75 °F; 436,90 K) [3] | ||
| Sublimes a −35 °C Δ subl H | |||
| Miscible | |||
| Solubilidad | Miscible con etanol y éter . Ligeramente soluble en CCl4 . | ||
| registro P | 0,79 | ||
| Presión de vapor | 0,112 kPa (20 °C) 0,74 kPa (50 °C) 9,62 kPa (100 °C) [4] | ||
Constante de la ley de Henry ( k H ) | 5,35·10 −4 L·atm/mol | ||
| Acidez (p K a ) | 4.82 | ||
| −55,10·10 −6 cm3 / mol | |||
| Conductividad térmica | 1,46·10 5 W/m·K | ||
Índice de refracción ( n D ) | 1.398 (20 °C) [3] | ||
| Viscosidad | 1,814 cP (15 °C) [5] 1,426 cP (25 °C) | ||
| Estructura | |||
| Monoclínico (−43 °C) [2] | |||
| C2/m [2] | |||
a = 8,01 Å, b = 6,82 Å, c = 10,14 Å [2] α = 90°, β = 111,45°, γ = 90° | |||
| 0,93 D (20 °C) [5] | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 178,6 J/mol·K [4] | ||
Entropía molar estándar ( S ⦵ 298 ) | 222,2 J/mol·K [5] | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −533,9 kJ/mol [4] | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | 2183,5 kJ/mol [4] | ||
| Peligros | |||
| Etiquetado SGA : | |||
 [6] [6] | |||
| Peligro | |||
| H314 [6] | |||
| P280 , P305+P351+P338 , P310 [6] | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | 71 a 72 °C (160 a 162 °F; 344 a 345 K) [6] | ||
| 440 °C (824 °F; 713 K) [6] | |||
| Límites de explosividad | 2,2–13,4% | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 2000 mg/kg (oral, rata) | ||
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa | ||
| Compuestos relacionados | |||
Ácidos carboxílicos relacionados | Ácido propiónico , ácido pentanoico | ||
Compuestos relacionados | 1-Butanol Butiraldehído Butirato de metilo | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El ácido butírico ( / ˈbj uːt ɪr ɪk / ; del griego antiguo : βούτῡρον , que significa "mantequilla"), también conocido bajo el nombre sistemático de ácido butanoico , es un ácido alquilcarboxílico de cadena lineal con la fórmula química CH 3 CH 2 CH 2 CO 2 H . Es un líquido aceitoso, incoloro y con un olor desagradable . El ácido isobutírico (ácido 2-metilpropanoico) es un isómero . Las sales y ésteres del ácido butírico se conocen como butiratos o butanoatos . El ácido no se encuentra ampliamente en la naturaleza, pero sus ésteres están muy extendidos. Es una sustancia química industrial común [7] y un componente importante en el intestino de los mamíferos.
Historia
El ácido butírico fue observado por primera vez en una forma impura en 1814 por el químico francés Michel Eugène Chevreul . En 1818, lo había purificado lo suficiente como para caracterizarlo. Sin embargo, Chevreul no publicó sus primeras investigaciones sobre el ácido butírico; en cambio, depositó sus hallazgos en forma de manuscrito con el secretario de la Academia de Ciencias en París, Francia. Henri Braconnot , un químico francés, también estaba investigando la composición de la mantequilla y estaba publicando sus hallazgos y esto dio lugar a disputas sobre la prioridad. Ya en 1815, Chevreul afirmó que había encontrado la sustancia responsable del olor de la mantequilla. [8] En 1817, publicó algunos de sus hallazgos sobre las propiedades del ácido butírico y lo nombró. [9] Sin embargo, no fue hasta 1823 que presentó las propiedades del ácido butírico en detalle. [10] El nombre ácido butírico proviene de βούτῡρον , que significa "mantequilla", la sustancia en la que se encontró por primera vez. El nombre latino butyrum (o buturum ) es similar.
Aparición
Los triglicéridos del ácido butírico componen el 3-4% de la mantequilla . Cuando la mantequilla se vuelve rancia, el ácido butírico se libera del glicérido por hidrólisis . [11] Es uno del subgrupo de ácidos grasos llamados ácidos grasos de cadena corta . El ácido butírico es un ácido carboxílico típico que reacciona con bases y afecta a muchos metales. [12] Se encuentra en la grasa animal y los aceites vegetales , la leche bovina , la leche materna , la mantequilla , el queso parmesano , el olor corporal , el vómito y como producto de la fermentación anaeróbica (incluso en el colon ). [13] [14] Tiene un sabor parecido a la mantequilla y un olor desagradable . Los mamíferos con buenas habilidades de detección de olores, como los perros , pueden detectarlo en 10 partes por mil millones , mientras que los humanos pueden detectarlo solo en concentraciones superiores a 10 partes por millón . En la fabricación de alimentos , se utiliza como agente aromatizante . [15]
En los seres humanos, el ácido butírico es uno de los dos agonistas endógenos primarios del receptor 2 del ácido hidroxicarboxílico humano ( HCA 2 ), un receptor acoplado a la proteína G acoplado a G i/o . [16] [17]
El ácido butírico está presente en forma de éster octílico en la chirivía ( Pastinaca sativa ) [18] y en la semilla del árbol de ginkgo . [19]
Producción
Industrial
En la industria, el ácido butírico se produce por hidroformilación a partir de propeno y gas de síntesis , formando butiraldehído , que se oxida hasta el producto final. [7]
- H 2 + CO + CH 3 CH=CH 2 → CH 3 CH 2 CH 2 CHOoxidación→ácido butírico
Se puede separar de soluciones acuosas por saturación con sales como el cloruro de calcio . La sal de calcio, Ca(C 4 H 7 O 2 ) 2 · H 2 O , es menos soluble en agua caliente que en fría.
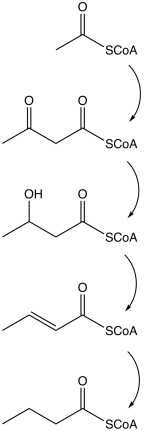
Biosíntesis microbiana
El butirato se produce mediante varios procesos de fermentación realizados por bacterias anaeróbicas obligadas . [20] Esta vía de fermentación fue descubierta por Louis Pasteur en 1861. Ejemplos de especies de bacterias productoras de butirato :
- Clostridium butyricum
- Clostridium kluyveri
- Clostridium pasteurianum
- Bacteria fecal prausnitzii
- Fusobacterium nucleatum
- Fibrisolvens de Butyrivibrio
- Eubacteria limosum
La vía comienza con la escisión glucolítica de la glucosa en dos moléculas de piruvato , como sucede en la mayoría de los organismos. El piruvato se oxida a acetil coenzima A catalizada por la piruvato:ferredoxina oxidorreductasa . Se forman dos moléculas de dióxido de carbono ( CO2 ) y dos moléculas de hidrógeno ( H2 ) como productos de desecho. Posteriormente, se produce ATP en el último paso de la fermentación. Se producen tres moléculas de ATP por cada molécula de glucosa, un rendimiento relativamente alto. La ecuación balanceada para esta fermentación es
- C 6 H 12 O 6 → C 4 H 8 O 2 + 2CO 2 + 2H 2
Otras vías para el butirato incluyen la reducción de succinato y la desproporción de crotonato.
| Acción | Enzima responsable |
|---|---|
| La acetil coenzima A se convierte en acetoacetil coenzima A | acetil-CoA-acetiltransferasa |
| La acetoacetil coenzima A se convierte en β-hidroxibutiril CoA | β-hidroxibutiril-CoA deshidrogenasa |
| El β-hidroxibutiril CoA se convierte en crotonil CoA | crotonasa |
| El crotonil CoA se convierte en butiril CoA ( CH 3 CH 2 CH 2 C=O−CoA ) | Butiril CoA deshidrogenasa |
| Un grupo fosfato reemplaza a CoA para formar fosfato de butirilo. | fosfobutirilasa |
| El grupo fosfato se une al ADP para formar ATP y butirato. | butirato quinasa |
Varias especies forman acetona y n -butanol en una vía alternativa, que comienza como fermentación del butirato. Algunas de estas especies son:
- Clostridium acetobutylicum , el mayor productor de acetona y butanol, utilizado también en la industria.
- Clostridium beijerinckii
- Clostridium tetanomorphum
- Clostridium aurantibutyricum
Estas bacterias comienzan con la fermentación del butirato, como se ha descrito anteriormente, pero, cuando el pH desciende por debajo de 5, pasan a producir butanol y acetona para evitar que el pH siga bajando. Se forman dos moléculas de butanol por cada molécula de acetona.
El cambio de vía ocurre después de la formación de acetoacetil CoA. Este intermediario toma entonces dos posibles vías:
- acetoacetil CoA → acetoacetato → acetona
- acetoacetil CoA → butiril CoA → butiraldehído → butanol
Para fines comerciales, las especies de Clostridium se utilizan preferentemente para la producción de ácido butírico o butanol. La especie más común utilizada para probióticos es Clostridium butyricum . [21]
Fuentes de fibra fermentable
Los residuos de fibra altamente fermentables, como los del almidón resistente , el salvado de avena , la pectina y el guar, son transformados por las bacterias colónicas en ácidos grasos de cadena corta (AGCC), incluido el butirato, lo que produce más AGCC que las fibras menos fermentables, como las celulosas . [14] [22] Un estudio encontró que el almidón resistente produce consistentemente más butirato que otros tipos de fibra dietética . [23] La producción de AGCC a partir de fibras en animales rumiantes , como el ganado, es responsable del contenido de butirato de la leche y la mantequilla. [13] [24]
Los fructanos son otra fuente de fibras dietéticas solubles prebióticas que se pueden digerir para producir butirato. [25] A menudo se encuentran en las fibras solubles de alimentos con alto contenido de azufre , como el allium y las verduras crucíferas . Las fuentes de fructanos incluyen trigo (aunque algunas cepas de trigo como la espelta contienen cantidades menores), [26] centeno , cebada , cebolla , ajo , alcachofa de Jerusalén y alcachofa , espárragos , remolacha , achicoria , hojas de diente de león , puerro , radicchio , la parte blanca de la cebolla de verdeo , brócoli , coles de Bruselas , repollo , hinojo y prebióticos , como fructooligosacáridos ( FOS ), oligofructosa e inulina . [27] [28]
Reacciones
El ácido butírico reacciona como un ácido carboxílico típico: puede formar derivados de amida , éster , anhídrido y cloruro . [29] Este último, el cloruro de butirilo , se utiliza comúnmente como intermedio para obtener los demás.
Usos
El ácido butírico se utiliza en la preparación de diversos ésteres de butirato. Se utiliza para producir acetato butirato de celulosa (CAB), que se utiliza en una amplia variedad de herramientas, pinturas y revestimientos, y es más resistente a la degradación que el acetato de celulosa . [30] El CAB puede degradarse con la exposición al calor y la humedad, liberando ácido butírico. [31]
Los ésteres de ácido butírico de bajo peso molecular, como el butirato de metilo , tienen en su mayoría aromas o sabores agradables. [7] Por ello, se utilizan como aditivos alimentarios y de perfumes. Es un aromatizante alimentario aprobado en la base de datos FLAVIS de la UE (número 08.005).
Debido a su potente olor, también se ha utilizado como aditivo para cebos de pesca. [32] Muchos de los sabores disponibles comercialmente que se utilizan en cebos para carpas ( Cyprinus carpio ) utilizan ácido butírico como base de éster. No está claro si los peces se sienten atraídos por el ácido butírico en sí o por las sustancias que se le añaden. El ácido butírico fue uno de los pocos ácidos orgánicos que demostró ser agradable tanto para la tenca como para el bitterling . [33] La sustancia ha sido utilizada como bomba fétida por la Sea Shepherd Conservation Society para perturbar a las tripulaciones balleneras japonesas . [34]
Farmacología
| Enzima inhibida | CI50 ( nM ) | Nota de entrada |
|---|---|---|
| HDAC1 | 16.000 | |
| HDAC2 | 12.000 | |
| HDAC3 | 9.000 | |
| HDAC4 | 2.000.000 | Límite inferior |
| HDAC5 | 2.000.000 | Límite inferior |
| HDAC6 | 2.000.000 | Límite inferior |
| HDAC7 | 2.000.000 | Límite inferior |
| HDAC8 | 15.000 | |
| HDAC9 | 2.000.000 | Límite inferior |
| CA1 | 511.000 | |
| CA2 | 1.032.000 | |
| Objetivo GPCR | CEp 50 | Nota de entrada |
| FFAR2 | 2.9–4.6 | Agonista completo |
| FFAR3 | 3.8–4.9 | Agonista completo |
| AHC 2 | 2.8 | Agonista |
Farmacodinamia
El ácido butírico (pKa 4,82 ) está completamente ionizado a pH fisiológico , por lo que su anión es el material que tiene mayor relevancia en los sistemas biológicos. Es uno de los dos agonistas endógenos primarios del receptor 2 del ácido hidroxicarboxílico humano ( HCA 2 , también conocido como GPR109A), un receptor acoplado a proteína G (GPCR) acoplado a G i/o , [16] [17]
Al igual que otros ácidos grasos de cadena corta (SCFA), el butirato es un agonista de los receptores de ácidos grasos libres FFAR2 y FFAR3 , que funcionan como sensores de nutrientes que facilitan el control homeostático del equilibrio energético ; sin embargo, entre el grupo de SCFA, solo el butirato es un agonista de HCA 2. [37] [38] [39] También es un inhibidor de HDAC (específicamente, HDAC1, HDAC2, HDAC3 y HDAC8), [35] [ 36] un fármaco que inhibe la función de las enzimas histonas desacetilasas , favoreciendo así un estado acetilado de las histonas en las células. [39] La acetilación de histonas afloja la estructura de la cromatina al reducir la atracción electrostática entre las histonas y el ADN . [39] En general, se cree que los factores de transcripción no podrán acceder a las regiones donde las histonas están estrechamente asociadas con el ADN (es decir, no acetiladas, por ejemplo, heterocromatina). [ cita médica necesaria ] Por lo tanto, se cree que el ácido butírico mejora la actividad transcripcional en los promotores, [39] que normalmente están silenciados o regulados negativamente debido a la actividad de la histona desacetilasa.
Farmacocinética
El butirato que se produce en el colon a través de la fermentación microbiana de la fibra dietética es absorbido y metabolizado principalmente por los colonocitos y el hígado [nota 1] para la generación de ATP durante el metabolismo energético; sin embargo, algo de butirato se absorbe en el colon distal, que no está conectado a la vena porta, lo que permite la distribución sistémica del butirato a múltiples sistemas orgánicos a través del sistema circulatorio. [39] [40] El butirato que ha alcanzado la circulación sistémica puede cruzar fácilmente la barrera hematoencefálica a través de transportadores monocarboxilato (es decir, ciertos miembros del grupo de transportadores SLC16A ). [41] [42] Otros transportadores que median el paso del butirato a través de las membranas lipídicas incluyen SLC5A8 (SMCT1), SLC27A1 (FATP1) y SLC27A4 (FATP4). [35] [42]
Metabolismo
El ácido butírico es metabolizado por varias ligasas XM humanas (ACSM1, ACSM2B, ASCM3, ACSM4, ACSM5 y ACSM6), también conocidas como ligasa butirato-CoA. [43] [44] El metabolito producido por esta reacción es butiril-CoA y se produce de la siguiente manera: [43]
- Trifosfato de adenosina + ácido butírico + coenzima A → monofosfato de adenosina + pirofosfato + butiril-CoA
Como ácido graso de cadena corta , el butirato es metabolizado por las mitocondrias como fuente de energía (es decir, trifosfato de adenosina o ATP) a través del metabolismo de los ácidos grasos . [39] En particular, es una fuente de energía importante para las células que recubren el colon de los mamíferos (colonocitos). [25] Sin butiratos, las células del colon experimentan autofagia (es decir, autodigestión) y mueren. [45]
En los seres humanos, el precursor del butirato tributirina , que está presente de forma natural en la mantequilla, es metabolizado por la lipasa de triacilglicerol en dibutirina y butirato a través de la reacción: [46]
- Tributirina + H 2 O → dibutirina + ácido butírico
Bioquímica
El butirato tiene numerosos efectos sobre la homeostasis energética y enfermedades relacionadas ( diabetes y obesidad ), la inflamación y la función inmune (por ejemplo, tiene efectos antimicrobianos y anticancerígenos pronunciados ) en humanos. Estos efectos ocurren a través de su metabolismo por las mitocondrias para generar ATP durante el metabolismo de los ácidos grasos o a través de uno o más de sus objetivos enzimáticos modificadores de histonas (es decir, las histonas desacetilasas de clase I ) y objetivos de receptores acoplados a proteína G (es decir, FFAR2 , FFAR3 y HCA 2 ). [37] [47]
En el intestino de los mamíferos
El butirato es esencial para la homeostasis inmunitaria del huésped. [37] Aunque el papel y la importancia del butirato en el intestino no se entienden completamente, muchos investigadores sostienen que un agotamiento de las bacterias productoras de butirato en pacientes con varias afecciones vasculíticas es esencial para la patogénesis de estos trastornos. Un agotamiento de butirato en el intestino generalmente es causado por una ausencia o agotamiento de bacterias productoras de butirato (BPB). Este agotamiento en BPB conduce a una disbiosis microbiana . Esto se caracteriza por una baja biodiversidad general y un agotamiento de los miembros clave productores de butirato. El butirato es un metabolito microbiano esencial con un papel vital como modulador de la función inmune adecuada en el huésped. Se ha demostrado que los niños que carecen de BPB son más susceptibles a la enfermedad alérgica [48] y la diabetes tipo 1. [49] El butirato también se reduce en una dieta baja en fibra dietética , que puede inducir inflamación y tener otros efectos adversos en la medida en que estos ácidos grasos de cadena corta activan PPAR-γ . [50]
El butirato desempeña un papel clave para el mantenimiento de la homeostasis inmunológica tanto a nivel local (en el intestino) como sistémico (a través del butirato circulante). Se ha demostrado que promueve la diferenciación de las células T reguladoras . En particular, el butirato circulante estimula la generación de células T reguladoras extratímicas. Los bajos niveles de butirato en sujetos humanos podrían favorecer un control reducido mediado por células T reguladoras, promoviendo así una potente respuesta inmunopatológica de las células T. [51] Por otro lado, se ha informado que el butirato intestinal inhibe las citocinas proinflamatorias locales. Por lo tanto, la ausencia o el agotamiento de estas BPB en el intestino podría ser una posible ayuda en la respuesta inflamatoria hiperactiva. El butirato en el intestino también protege la integridad de la barrera epitelial intestinal. Por lo tanto, la disminución de los niveles de butirato conduce a una barrera epitelial intestinal dañada o disfuncional. [52] La reducción de butirato también se ha asociado con la proliferación de Clostridioides difficile . Por el contrario, una dieta rica en fibra produce una mayor concentración de ácido butírico y una inhibición del crecimiento de C. difficile . [53]
En un estudio de investigación de 2013 realizado por Furusawa et al., se descubrió que el butirato derivado de microbios era esencial para inducir la diferenciación de células T reguladoras colónicas en ratones. Esto es de gran importancia y posiblemente relevante para la patogénesis y la vasculitis asociadas con muchas enfermedades inflamatorias porque las células T reguladoras tienen un papel central en la supresión de las respuestas inflamatorias y alérgicas. [54] En varios estudios de investigación, se ha demostrado que el butirato indujo la diferenciación de células T reguladoras in vitro e in vivo. [55] La capacidad antiinflamatoria del butirato ha sido ampliamente analizada y respaldada por muchos estudios. Se ha descubierto que el butirato producido por microorganismos acelera la producción de células T reguladoras, aunque el mecanismo específico por el cual lo hace no está claro. [56] Más recientemente, se ha demostrado que el butirato juega un papel esencial y directo en la modulación de la expresión génica de las células T citotóxicas. [57] El butirato también tiene un efecto antiinflamatorio sobre los neutrófilos, reduciendo su migración a las heridas. Este efecto está mediado por el receptor HCA 1. [58 ]
En los microbiomas intestinales que se encuentran en la clase Mammalia, los omnívoros y herbívoros tienen comunidades bacterianas productoras de butirato dominadas por la vía butiril-CoA:acetato CoA-transferasa, mientras que los carnívoros tienen comunidades bacterianas productoras de butirato dominadas por la vía butirato quinasa. [59]
El olor del ácido butírico, que emana de los folículos sebáceos de todos los mamíferos, actúa sobre la garrapata como una señal.
Inmunomodulación e inflamación
Los efectos del butirato sobre el sistema inmunológico están mediados por la inhibición de las histonas desacetilasas de clase I y la activación de sus receptores acoplados a proteína G : HCA 2 (GPR109A), FFAR2 (GPR43) y FFAR3 (GPR41). [38] [60] Entre los ácidos grasos de cadena corta , el butirato es el promotor más potente de las células T reguladoras intestinales in vitro y el único entre el grupo que es un ligando HCA 2. [38] Se ha demostrado que es un mediador crítico de la respuesta inflamatoria colónica. Posee potencial tanto preventivo como terapéutico para contrarrestar la colitis ulcerosa y el cáncer colorrectal mediados por inflamación .
El butirato ha establecido propiedades antimicrobianas en humanos que están mediadas a través del péptido antimicrobiano LL-37 , que induce a través de la inhibición de HDAC en la histona H3. [60] [61] [62] In vitro, el butirato aumenta la expresión génica de FOXP3 (el regulador de la transcripción de Tregs ) y promueve las células T reguladoras colónicas (Tregs) a través de la inhibición de las histonas desacetilasas de clase I ; [38] [60] a través de estas acciones, aumenta la expresión de interleucina 10 , una citocina antiinflamatoria . [60] [38] El butirato también suprime la inflamación colónica al inhibir las vías de señalización de IFN-γ - STAT1 , que está mediada parcialmente a través de la inhibición de la histona desacetilasa . Mientras que la señalización transitoria de IFN-γ generalmente se asocia con la respuesta inmune normal del huésped , la señalización crónica de IFN-γ a menudo se asocia con la inflamación crónica. Se ha demostrado que el butirato inhibe la actividad de HDAC1 que está unido al promotor del gen Fas en las células T, lo que da como resultado la hiperacetilación del promotor Fas y la regulación positiva del receptor Fas en la superficie de las células T. [63]
Al igual que otros agonistas de HCA 2 estudiados, el butirato también produce marcados efectos antiinflamatorios en una variedad de tejidos, incluidos el cerebro, el tracto gastrointestinal, la piel y el tejido vascular . [64] [65] [66] La unión del butirato en FFAR3 induce la liberación del neuropéptido Y y promueve la homeostasis funcional de la mucosa colónica y el sistema inmunológico entérico. [67]
Cáncer
Se ha demostrado que el butirato es un mediador crítico de la respuesta inflamatoria colónica. Es responsable de aproximadamente el 70% de la energía de los colonocitos, siendo un SCFA crítico en la homeostasis del colon . [68] El butirato posee potencial tanto preventivo como terapéutico para contrarrestar la colitis ulcerosa (CU) mediada por inflamación y el cáncer colorrectal . [69] Produce diferentes efectos en células sanas y cancerosas: esto se conoce como la "paradoja del butirato". En particular, el butirato inhibe las células tumorales colónicas y estimula la proliferación de células epiteliales colónicas sanas. [70] [71] La explicación de por qué el butirato es una fuente de energía para los colonocitos normales e induce apoptosis en células de cáncer de colon , es el efecto Warburg en las células cancerosas, que lleva a que el butirato no se metabolice adecuadamente. Este fenómeno lleva a la acumulación de butirato en el núcleo, actuando como un inhibidor de la histona desacetilasa (HDAC). [72] Un mecanismo subyacente a la función del butirato en la supresión de la inflamación colónica es la inhibición de las vías de señalización IFN-γ / STAT1 . Se ha demostrado que el butirato inhibe la actividad de HDAC1 que está unida al promotor del gen Fas en las células T , lo que resulta en la hiperacetilación del promotor Fas y la regulación positiva del receptor Fas en la superficie de las células T. Por lo tanto, se sugiere que el butirato mejora la apoptosis de las células T en el tejido colónico y, por lo tanto, elimina la fuente de inflamación (producción de IFN-γ). [73] El butirato inhibe la angiogénesis al inactivar la actividad del factor de transcripción Sp1 y regular negativamente la expresión del gen del factor de crecimiento endotelial vascular . [74]
En resumen, la producción de ácidos grasos volátiles como el butirato a partir de fibras fermentables puede contribuir al papel de la fibra dietética en el cáncer de colon. Los ácidos grasos de cadena corta , que incluyen el ácido butírico, son producidos por bacterias colónicas beneficiosas ( probióticos ) que se alimentan de, o fermentan, prebióticos, que son productos vegetales que contienen fibra dietética. Estos ácidos grasos de cadena corta benefician a los colonocitos al aumentar la producción de energía y pueden proteger contra el cáncer de colon al inhibir la proliferación celular. [22]
Por el contrario, algunos investigadores han intentado eliminar el butirato y lo consideran un posible factor desencadenante de cáncer. [75] Estudios en ratones indican que impulsa la transformación de células epiteliales del colon deficientes en MSH2 . [76]
Posibles tratamientos a partir de la restauración con butirato
Debido a la importancia del butirato como regulador inflamatorio y contribuyente al sistema inmunológico, la disminución de butirato podría ser un factor clave que influye en la patogénesis de muchas enfermedades vasculíticas . Por lo tanto, es esencial mantener niveles saludables de butirato en el intestino. Los trasplantes de microbiota fecal (para restablecer la BPB y la simbiosis en el intestino) podrían ser efectivos al reponer los niveles de butirato. En este tratamiento, un individuo sano dona sus heces para que sean trasplantadas a un individuo con disbiosis. Una opción de tratamiento menos invasiva es la administración de butirato (como suplementos orales o enemas), que ha demostrado ser muy eficaz para terminar con los síntomas de inflamación con efectos secundarios mínimos o nulos. En un estudio en el que se trató a pacientes con colitis ulcerosa con enemas de butirato, la inflamación disminuyó significativamente y el sangrado cesó por completo después de la administración de butirato. [77]
Adicción
El ácido butírico es un HDACDescripción de herramienta de la histona desacetilasainhibidor que es selectivo para las HDAC de clase I en humanos. [35] Las HDAC son enzimas modificadoras de histonas que pueden causar la desacetilación de histonas y la represión de la expresión génica. Las HDAC son reguladores importantes de la formación sináptica, la plasticidad sináptica y la formación de la memoria a largo plazo . Se sabe que las HDAC de clase I están involucradas en la mediación del desarrollo de una adicción . [78] [79] [80] El ácido butírico y otros inhibidores de HDAC se han utilizado en la investigación preclínica para evaluar los efectos transcripcionales, neuronales y conductuales de la inhibición de HDAC en animales adictos a las drogas. [80] [81] [82]
Sales y ésteres de butirato
El ion butirato o butanoato , C 3 H 7 C O O − , es la base conjugada del ácido butírico. Es la forma que se encuentra en los sistemas biológicos a pH fisiológico . Un compuesto butírico (o butanoico) es una sal o éster carboxilato del ácido butírico.
Ejemplos
Sales
Ésteres
- Butirato de butilo
- Butiril-CoA
- Butirato de acetato de celulosa (agente aeronáutico)
- Benzoato butirato de estradiol
- Butirato de etilo
- Butirato de metilo
- Butirato de pentilo
- Tributirina
Véase también
- Lista de ácidos grasos saturados
- Chocolate con leche de Hershey
- Histona
- Ácidos hidroxibutíricos
- Ácidos oxobutíricos
- Ácido 2-oxobutírico (ácido α-cetobutírico)
- Ácido 3-oxobutírico (ácido acetoacético)
- Ácido 4-oxobutírico (semialdehído succínico)
- Ácido β-metilbutírico
Notas
- ^ La mayor parte del butirato que se absorbe en el plasma sanguíneo desde el colon ingresa al sistema circulatorio a través de la vena porta ; la mayor parte del butirato que ingresa al sistema circulatorio por esta vía es absorbido por el hígado. [39]
Referencias
Este artículo incorpora texto de una publicación que ahora es de dominio público : Chisholm, Hugh , ed. (1911). "Ácido butírico". Encyclopædia Britannica (11.ª ed.). Cambridge University Press.
- ^ "Aplicaciones a clases específicas de compuestos". Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. p. 746. doi :10.1039/9781849733069-00648. ISBN . 978-0-85404-182-4.
- ^ abcd Strieter FJ, Templeton DH (1962). "Estructura cristalina del ácido butírico" (PDF) . Acta Crystallographica . 15 (12): 1240–1244. Código Bibliográfico :1962AcCry..15.1240S. doi :10.1107/S0365110X6200328X.
- ^ abcd Lide, David R., ed. (2009). Manual de química y física del CRC (90.ª edición). Boca Ratón, Florida : CRC Press . ISBN 978-1-4200-9084-0.
- ^ abcde Ácido butanóico en Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , Instituto Nacional de Estándares y Tecnología, Gaithersburg (MD) (consultado el 27 de octubre de 2020)
- ^ abc "Ácido butanóico". Chemister.ru. 19 de marzo de 2007. Consultado el 27 de octubre de 2020 .
- ^ abcde Sigma-Aldrich Co. , Ácido butírico. Recuperado el 27 de octubre de 2020.
- ^ abc Riemenschneider, Wilhelm (2002). "Ácidos carboxílicos alifáticos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a05_235. ISBN 978-3527306732.
- ^ Chevreul (1815) "Lettre de M. Chevreul à MM. les rédacteurs des Annales de chimie" (Carta del Sr. Chevreul a los editores de Annals of Chemistry), Annales de chimie , 94 : 73–79; en una nota a pie de página que abarca las páginas 75 y 76, menciona que había encontrado una sustancia responsable del olor a mantequilla.
- ^ Chevreul (1817) "Extrait d'une lettre de M. Chevreul à MM. les Rédacteurs du Journal de Pharmacie" (Extracto de una carta del Sr. Chevreul a los editores del Journal of Pharmacy), Journal de Pharmacie et des sciences accesorios , 3 : 79–81. En la pág. 81, nombró ácido butírico: "Ce principe, que j'ai appelé depuis acid butérique,..." (Este principio [es decir, constituyente], que desde entonces he denominado "ácido butírico",...)
- ^ E. Chevreul, Recherches chimiques sur les corps gras d'origine animale [Investigaciones químicas sobre sustancias grasas de origen animal] (París, Francia: FG Levrault, 1823), páginas 115-133.
- ^ Woo, AH; Lindsay, RC (1983). "Análisis discriminante por pasos de perfiles de ácidos grasos libres para identificar fuentes de enzimas lipolíticas en mantequilla rancia". Journal of Dairy Science . 66 (10): 2070–2075. doi : 10.3168/jds.S0022-0302(83)82052-9 .
- ^ ICSC 1334 – Ácido butírico. Inchem.org (23 de noviembre de 1998). Recuperado el 27 de octubre de 2020.
- ^ ab McNabney, SM; Henagan, TM (2017). "Ácidos grasos de cadena corta en el colon y los tejidos periféricos: un enfoque en el butirato, el cáncer de colon, la obesidad y la resistencia a la insulina". Nutrients . 9 (12): 1348. doi : 10.3390/nu9121348 . PMC 5748798 . PMID 29231905.
- ^ ab Morrison, DJ; Preston, T. (2016). "Formación de ácidos grasos de cadena corta por la microbiota intestinal y su impacto en el metabolismo humano". Microbios intestinales . 7 (3): 189–200. doi :10.1080/19490976.2015.1134082. PMC 4939913 . PMID 26963409.
- ^ "Ácido butírico". The Good Scents Company . Consultado el 26 de octubre de 2020 .
- ^ ab Offermanns S, Colletti SL, Lovenberg TW, Semple G, Wise A, IJzerman AP (junio de 2011). "Unión Internacional de Farmacología Básica y Clínica. LXXXII: Nomenclatura y clasificación de los receptores de ácido hidroxicarboxílico (GPR81, GPR109A y GPR109B)". Pharmacological Reviews . 63 (2): 269–90. doi : 10.1124/pr.110.003301 . PMID 21454438.
- ^ ab Offermanns S, Colletti SL, IJzerman AP, Lovenberg TW, Semple G, Wise A, Waters MG. "Receptores de ácido hidroxicarboxílico". Guía de farmacología de la IUPHAR/BPS . Unión Internacional de Farmacología Básica y Clínica . Consultado el 13 de julio de 2018 .
- ^ Carroll, Mark J.; Berenbaum, May R. (2002). "Respuestas conductuales del gusano tejedor de la chirivía a los volátiles de la planta hospedante". Journal of Chemical Ecology . 28 (11): 2191–2201. Bibcode :2002JCEco..28.2191C. doi :10.1023/A:1021093114663. PMID 12523562. S2CID 23512190.
- ^ Raven, Peter H .; Evert, Ray F.; Eichhorn, Susan E. (2005). Biología de las plantas . WH Freemanand Company. págs. 429–431. ISBN 978-0-7167-1007-3. Recuperado el 11 de octubre de 2018 .
- ^ Seedorf, H.; Fricke, WF; Veith, B.; Bruggemann, H.; Liesegang, H.; Strittmatter, A.; Miethke, M.; Buckel, W.; Hinderberger, J.; Li, F.; Hagemeier, C.; Thauer, RK; Gottschalk, G. (2008). "El genoma de Clostridium kluyveri, un anaerobio estricto con características metabólicas únicas". Actas de la Academia Nacional de Ciencias . 105 (6): 2128–2133. Bibcode :2008PNAS..105.2128S. doi : 10.1073/pnas.0711093105 . PMC 2542871 . PMID 18218779.
- ^ Zigová, Jana; Šturdı́k, Ernest; Vandák, Dušan; Schlosser, Štefan (octubre de 1999). "Producción de ácido butírico por Clostridium butyricum con extracción y extracción integradas". Bioquímica de procesos . 34 (8): 835–843. doi :10.1016/S0032-9592(99)00007-2.
- ^ ab Lupton JR (febrero de 2004). "Los productos de degradación microbiana influyen en el riesgo de cáncer de colon: la controversia sobre el butirato". The Journal of Nutrition . 134 (2): 479–82. doi : 10.1093/jn/134.2.479 . PMID 14747692.
- ^ Cummings JH, Macfarlane GT, Englyst HN (febrero de 2001). "Digestión y fermentación prebiótica". The American Journal of Clinical Nutrition . 73 (2 Suppl): 415S–420S. doi : 10.1093/ajcn/73.2.415s . PMID 11157351.
- ^ Grummer RR (septiembre de 1991). "Efecto del alimento en la composición de la grasa de la leche". Journal of Dairy Science . 74 (9): 3244–57. doi : 10.3168/jds.S0022-0302(91)78510-X . PMID 1779073.
- ^ ab Rivière, Audrey; Selak, Marija; Lantin, David; Leroy, Frédéric; De Vuyst, Luc (2016). "Bifidobacterias y bacterias del colon productoras de butirato: importancia y estrategias para su estimulación en el intestino humano". Frontiers in Microbiology . 7 : 979. doi : 10.3389/fmicb.2016.00979 . PMC 4923077 . PMID 27446020.
- ^ "Preguntas frecuentes en el área de la dieta y el síndrome del intestino irritable". Departamento de Gastroenterología, Ciencias de la Nutrición Traslacional, Universidad de Monash, Victoria, Australia . Consultado el 24 de marzo de 2016 .
- ^ Gibson, Peter R.; Shepherd, Susan J. (1 de febrero de 2010). "Manejo dietético basado en evidencia de los síntomas gastrointestinales funcionales: el enfoque FODMAP". Revista de Gastroenterología y Hepatología . 25 (2): 252–258. doi : 10.1111/j.1440-1746.2009.06149.x . ISSN 1440-1746. PMID 20136989. S2CID 20666740.
- ^ Gibson, Peter R.; Varney, Jane; Malakar, Sreepurna; Muir, Jane G. (1 de mayo de 2015). "Componentes alimentarios y síndrome del intestino irritable". Gastroenterología . 148 (6): 1158–1174.e4. doi : 10.1053/j.gastro.2015.02.005 . ISSN 1528-0012. PMID 25680668.
- ^ Jenkins, PR (1985). "Ácidos carboxílicos y derivados". Métodos generales y sintéticos . Vol. 7. págs. 96-160. doi :10.1039/9781847556196-00096. ISBN . 978-0-85186-884-4.
- ^ Lokensgard, Erik (2015). Plásticos industriales: teoría y aplicaciones (6.ª ed.). Cengage Learning.
- ^ Williams, R. Scott. "Cuidado de los plásticos: plásticos malignos". Boletín WAAC . Vol. 24, núm. 1. Conservation OnLine . Consultado el 29 de mayo de 2017 .
- ^ Cebos congeladores Archivado el 25 de enero de 2010 en Wayback Machine , nutrabaits.net
- ^ Kasumyan A, Døving K (2003). "Preferencias gustativas en los peces". Pesca y pesca . 4 (4): 289–347. Bibcode :2003AqFF....4..289K. doi :10.1046/j.1467-2979.2003.00121.x.
- ^ Balleneros japoneses heridos por activistas que lanzaron ácido Archivado el 8 de junio de 2010 en Wayback Machine , newser.com, 10 de febrero de 2010
- ^ abcd «Ácido butírico». Guía de farmacología de la IUPHAR/BPS . Unión Internacional de Farmacología Básica y Clínica . Consultado el 13 de julio de 2018 .
- ^ ab "Ácido butanóico y butirato de sodio". BindingDB . La base de datos de enlaces . Consultado el 27 de octubre de 2020 .
- ^ abc Kasubuchi M, Hasegawa S, Hiramatsu T, Ichimura A, Kimura I (2015). "Metabolitos microbianos intestinales dietéticos, ácidos grasos de cadena corta y regulación metabólica del huésped". Nutrients . 7 (4): 2839–49. doi : 10.3390/nu7042839 . PMC 4425176 . PMID 25875123.
Los ácidos grasos de cadena corta (AGCC) como el acetato, el butirato y el propionato, que se producen por fermentación microbiana intestinal de la fibra dietética, se reconocen como fuentes esenciales de energía para el huésped y actúan como moléculas de transducción de señales a través de receptores acoplados a proteína G (FFAR2, FFAR3, OLFR78, GPR109A) y como reguladores epigenéticos de la expresión génica mediante la inhibición de la histona desacetilasa (HDAC). Evidencias recientes sugieren que la fibra dietética y los AGCC derivados de los microbios intestinales ejercen múltiples efectos beneficiosos sobre el metabolismo energético del huésped, no sólo mejorando el ambiente intestinal, sino también afectando directamente a varios tejidos periféricos del huésped.
- ^ abcde Hoeppli RE, Wu D, Cook L, Levings MK (febrero de 2015). "El entorno de la biología de las células T reguladoras: citocinas, metabolitos y el microbioma". Front Immunol . 6 : 61. doi : 10.3389/fimmu.2015.00061 . PMC 4332351 . PMID 25741338.
Figura 1: Las moléculas derivadas de microbios promueven la diferenciación de Treg colónicos. - ^ abcdefg Bourassa MW, Alim I, Bultman SJ, Ratan RR (junio de 2016). "Butirato, neuroepigenética y el microbioma intestinal: ¿puede una dieta rica en fibra mejorar la salud cerebral?". Neurosci. Lett . 625 : 56–63. doi :10.1016/j.neulet.2016.02.009. PMC 4903954. PMID 26868600 .
- ^ van Hoogdalem, Edward; de Boer, Albertus G.; Breimer, Douwe D. (julio de 1991). "Farmacocinética de la administración rectal de fármacos, parte I. Consideraciones generales y aplicaciones clínicas de fármacos de acción central". Farmacocinética clínica . 21 (1): 14. doi :10.2165/00003088-199121010-00002. ISSN 0312-5963. PMID 1717195. Consultado el 18 de marzo de 2024.
Las venas rectales media e inferior drenan la parte inferior del recto y la sangre venosa se devuelve a la vena cava inferior. Por lo tanto, los fármacos absorbidos en este último sistema se entregarán preferentemente a la circulación sistémica, evitando el hígado y el metabolismo de primer paso.
- ^ Tsuji A (2005). "Small molecular drug transfer across the blood–brain barrier via carrier-mediated transport systems". NeuroRx . 2 (1): 54–62. doi :10.1602/neurorx.2.1.54. PMC 539320 . PMID 15717057.
Otros estudios in vivo en nuestros laboratorios indicaron que varios compuestos, incluidos acetato, propionato, butirato, ácido benzoico, ácido salicílico, ácido nicotínico y algunos antibióticos β-lactámicos, pueden ser transportados por el MCT en la BHE.
21
... La captación de ácido valproico se redujo en presencia de ácidos grasos de cadena media como hexanoato, octanoato y decanoato, pero no propionato o butirato, lo que indica que el ácido valproico se absorbe en el cerebro a través de un sistema de transporte para ácidos grasos de cadena media, no ácidos grasos de cadena corta.
- ^ ab Vijay N, Morris ME (2014). "El papel de los transportadores de monocarboxilato en la administración de fármacos al cerebro". Curr. Pharm. Des . 20 (10): 1487–98. doi :10.2174/13816128113199990462. PMC 4084603 . PMID 23789956.
Se sabe que los transportadores de monocarboxilato (MCT) median el transporte de monocarboxilatos de cadena corta como el lactato, el piruvato y el butirato. ... MCT1 y MCT4 también se han asociado con el transporte de ácidos grasos de cadena corta como el acetato y el formato que luego se metabolizan en los astrocitos [78]. ... SLC5A8 se expresa en el tejido de colon normal y funciona como un supresor tumoral en el colon humano; el silenciamiento de este gen ocurre en el carcinoma de colon. Este transportador está involucrado en la captación concentrativa de butirato y piruvato producidos como producto de la fermentación por las bacterias colónicas.
- ^ ab Ácido butírico. Universidad de Alberta . Consultado el 15 de agosto de 2015 .
{{cite encyclopedia}}:|website=ignorado ( ayuda ) - ^ "Metabolismo del butanoato: vía de referencia". Enciclopedia de Kyoto de genes y genomas . Laboratorios Kanehisa. 1 de noviembre de 2017. Consultado el 1 de febrero de 2018 .
- ^ Donohoe, Dallas R.; Garge, Nikhil; Zhang, Xinxin; Sun, Wei; O'Connell, Thomas M.; Bunger, Maureen K.; Bultman, Scott J. (4 de mayo de 2011). "El microbioma y el butirato regulan el metabolismo energético y la autofagia en el colon de los mamíferos". Metabolismo celular . 13 (5): 517–526. doi :10.1016/j.cmet.2011.02.018. ISSN 1550-4131. PMC 3099420 . PMID 21531334.
- ^ "triacilglicerol lipasa - Homo sapiens". BRENDA . Universidad Técnica de Braunschweig . Consultado el 25 de mayo de 2015 .
- ^ Tilg H, Moschen AR (septiembre de 2014). "Microbiota y diabetes: una relación en evolución". Gut . 63 (9): 1513–1521. doi :10.1136/gutjnl-2014-306928. PMID 24833634. S2CID 22633025.
- ^ Cait, Alissa; Cardenas, Erick (diciembre de 2019). "Potencial genético reducido para la fermentación del butirato en el microbioma intestinal de los lactantes que desarrollan sensibilización alérgica". Revista de alergia e inmunología clínica . 144 (6): 1638–1647. E3. doi : 10.1016/j.jaci.2019.06.029 . PMID 31279007.
- ^ Vatanen, T.; Franzosa, EA; Schwager, R.; et al. (2018). "El microbioma intestinal humano en la diabetes tipo 1 de aparición temprana del estudio TEDDY". Nature . 562 (7728): 589–594. Bibcode :2018Natur.562..589V. doi : 10.1038/s41586-018-0620-2 . PMC 6296767 . PMID 30356183.
- ^ Kumar J, Rani K, Datt C (2020). "Enlace molecular entre la fibra dietética, la microbiota intestinal y la salud". Molecular Biology Reports . 47 (8): 6229–6237. doi :10.1007/s11033-020-05611-3. PMID 32623619. S2CID 220337072.
- ^ Consolandi, Clarissa; Turroni, Silvia; Emmi, Giacomo; et al. (abril de 2015). "Los pacientes con síndrome de Behçet presentan una firma microbiana específica". Autoimmunity Reviews . 14 (4): 269–276. doi : 10.1016/j.autrev.2014.11.009 . hdl : 2158/962790 . PMID 25435420.
- ^ Ye, Zi; Zhang, Ni; Wu, Chunyan; et al. (4 de agosto de 2018). "Un estudio metagenómico del microbioma intestinal en la enfermedad de Behcet". Microbioma . 6 (1): 135. doi : 10.1186/s40168-018-0520-6 . PMC 6091101 . PMID 30077182.
- ^ Di Bella, Stefano; Sansón, Gianfranco; Monticelli, Jacopo; Zerbato, Verena; Príncipe, Luigi; Giuffré, Mauro; Pipitone, Giuseppe; Luzzati, Roberto (29 de febrero de 2024). Staley, Christopher (ed.). "Infección por Clostridioides difficile: historia, epidemiología, factores de riesgo, prevención, manifestaciones clínicas, tratamiento y opciones futuras". Reseñas de microbiología clínica . 37 (2). Mayuresh Abhyankar: e0013523. doi :10.1128/cmr.00135-23. ISSN 0893-8512. PMC 11324037. PMID 38421181.
- ^ Cait, Alissa; Hughes, Michael R (mayo de 2018). "La inflamación alérgica pulmonar impulsada por el microbioma se mejora con ácidos grasos de cadena corta". Inmunología de las mucosas . 11 (3): 785–796. doi : 10.1038/mi.2017.75 . PMID 29067994.
- ^ Furusawa, Yukihiro; Obata, Yuuki; Fukuda, Shinji; et al. (13 de noviembre de 2013). "El butirato derivado de microbios comensales induce la diferenciación de células T reguladoras colónicas". Nature . 504 (7480): 446–450. Bibcode :2013Natur.504..446F. doi :10.1038/nature12721. PMID 24226770. S2CID 4408815.
- ^ Arpaia, Nicholas; Campbell, Clarissa; Fan, Xiying; et al. (13 de noviembre de 2013). "Los metabolitos producidos por bacterias comensales promueven la generación periférica de células T reguladoras". Nature . 504 (7480): 451–455. Bibcode :2013Natur.504..451A. doi :10.1038/nature12726. PMC 3869884 . PMID 24226773.
- ^ Luu, Maik; Weigand, Katharina; Wedi, Fatana; et al. (26 de septiembre de 2018). "Regulación de la función efectora de las células T CD8+ por el metabolito butirato derivado de la microbiota intestinal". Scientific Reports . 8 (1): 14430. Bibcode :2018NatSR...814430L. doi :10.1038/s41598-018-32860-x. PMC 6158259 . PMID 30258117.
- ^ Cholan, Pradeep Manuneedhi; Han, Alvin; Woodie, Brad R.; Watchon, Maxinne; Kurz, Angela RM; Laird, Angela S.; Britton, Warwick J.; Ye, Lihua; Holmes, Zachary C.; McCann, Jessica R.; David, Lawrence A. (9 de noviembre de 2020). "Efectos antiinflamatorios conservados y detección de butirato en pez cebra". Microbios intestinales . 12 (1): 1–11. doi :10.1080/19490976.2020.1824563. ISSN 1949-0976. PMC 7575005 . PMID 33064972.
- ^ Vital, Mario; Gao, Jiarong; Rizzo, Mike; Harrison, Tara; Tiedje, James M. (2015). "La dieta es un factor importante que rige la estructura comunitaria productora de butirato fecal en Mammalia, Aves y Reptilia". La Revista ISME . 9 (4): 832–843. Código Bib : 2015ISMEJ...9..832V. doi :10.1038/ismej.2014.179. PMC 4817703 . PMID 25343515.
- ^ abcd Wang G (2014). "Péptidos y proteínas antimicrobianos humanos". Productos farmacéuticos . 7 (5): 545–94. doi : 10.3390/ph7050545 . PMC 4035769 . PMID 24828484.
Tabla 3: Péptidos antimicrobianos humanos seleccionados y sus objetivos propuestos
Tabla 4: Algunos factores conocidos que inducen la expresión de péptidos antimicrobianos - ^ Yonezawa H, Osaki T, Hanawa T, Kurata S, Zaman C, Woo TD, Takahashi M, Matsubara S, Kawakami H, Ochiai K, Kamiya S (2012). "Efectos destructivos del butirato en la envoltura celular de Helicobacter pylori". J. Med. Microbiol . 61 (Pt 4): 582–9. doi :10.1099/jmm.0.039040-0. PMID 22194341.
- ^ McGee DJ, George AE, Trainor EA, Horton KE, Hildebrandt E, Testerman TL (2011). "El colesterol aumenta la resistencia de Helicobacter pylori a los antibióticos y a LL-37". Antimicrob. Agentes Chemother . 55 (6): 2897–904. doi :10.1128/AAC.00016-11. PMC 3101455. PMID 21464244 .
- ^ Zimmerman MA, Singh N, Martin PM, Thangaraju M, Ganapathy V, Waller JL, Shi H, Robertson KD, Munn DH, Liu K (2012). "El butirato suprime la inflamación colónica a través de la regulación positiva de Fas dependiente de HDAC1 y la apoptosis de células T mediada por Fas". Am. J. Physiol. Gastrointest. Liver Physiol . 302 (12): G1405–15. doi : 10.1152/ajpgi.00543.2011. PMC 3378095. PMID 22517765.
- ^ Offermanns S, Schwaninger M (2015). "La activación nutricional o farmacológica de HCA(2) mejora la neuroinflamación". Trends Mol Med . 21 (4): 245–255. doi :10.1016/j.molmed.2015.02.002. PMID 25766751.
- ^ Chai JT, Digby JE, Choudhury RP (mayo de 2013). "GPR109A e inflamación vascular". Curr Atheroscler Rep . 15 (5): 325. doi :10.1007/s11883-013-0325-9. PMC 3631117. PMID 23526298 .
- ^ Graff EC, Fang H, Wanders D, Judd RL (febrero de 2016). "Efectos antiinflamatorios del receptor 2 del ácido hidroxicarboxílico". Metab. Clin. Exp . 65 (2): 102–113. doi :10.1016/j.metabol.2015.10.001. PMID 26773933.
- ^ Farzi A, Reichmann F, Holzer P (2015). "El papel homeostático del neuropéptido Y en la función inmune y su impacto en el estado de ánimo y el comportamiento". Acta Physiol (Oxf) . 213 (3): 603–27. doi :10.1111/apha.12445. PMC 4353849. PMID 25545642 .
- ^ Zeng, Huawei; Lazarova, DL; Bordonaro, M (2014). "Mecanismos que vinculan la fibra dietética, la microbiota intestinal y la prevención del cáncer de colon". Revista Mundial de Oncología Gastrointestinal . 6 (2): 41–51. doi : 10.4251/wjgo.v6.i2.41 . PMC 3926973 . PMID 24567795.
- ^ Chen, Jiezhong; Zhao, Kong-Nan; Vitetta, Luis (2019). "Efectos del butirato elaborado por microbios intestinales en las vías de señalización oncogénica" (pdf) . Nutrients . 11 (5): 1026. doi : 10.3390/nu11051026 . PMC 6566851 . PMID 31067776. S2CID 148568580.
- ^ Klampfer L, Huang J, Sasazuki T, Shirasawa S, Augenlicht L (agosto de 2004). "Ras oncogénico promueve la apoptosis inducida por butirato a través de la inhibición de la expresión de gelsolina". The Journal of Biological Chemistry . 279 (35): 36680–8. doi : 10.1074/jbc.M405197200 . PMID 15213223.
- ^ Vanhoutvin SA, Troost FJ, Hamer HM, Lindsey PJ, Koek GH, Jonkers DM, Kodde A, Venema K, Brummer RJ (2009). Bereswill S (ed.). "Cambios transcripcionales inducidos por butirato en la mucosa colónica humana". PLOS ONE . 4 (8): e6759. Bibcode :2009PLoSO...4.6759V. doi : 10.1371/journal.pone.0006759 . PMC 2727000 . PMID 19707587.
- ^ Encarnação, JC; Abrantes, AM; Pires, AS; et al. (30 de julio de 2015). "Revisión de la fibra dietética en el cáncer colorrectal: butirato y su papel en la prevención y el tratamiento". Cancer and Metastasis Reviews . 34 (3): 465–478. doi :10.1007/s10555-015-9578-9. PMID 26224132. S2CID 18573671.
- ^ Zimmerman, Mary A.; Singh, Nagendra; Martin, Pamela M.; et al. (15 de junio de 2012). "El butirato suprime la inflamación colónica a través de la regulación positiva de Fas dependiente de HDAC1 y la apoptosis de células T mediada por Fas". American Journal of Physiology. Fisiología gastrointestinal y hepática . 302 (12): G1405–G1415. doi :10.1152/ajpgi.00543.2011. PMC 3378095 . PMID 22517765.
- ^ Prasanna Kumar, S.; Thippeswamy, G.; Sheela, ML; et al. (octubre de 2008). "La fosfatasa inducida por butirato regula el factor de crecimiento endotelial vascular (VEGF) y la angiogénesis a través de Sp1". Archivos de bioquímica y biofísica . 478 (1): 85–95. doi :10.1016/j.abb.2008.07.004. PMID 18655767.
- ^ "Una dieta baja en carbohidratos reduce el riesgo de cáncer de colon, según un estudio | Sala de prensa de la Universidad de Toronto". media.utoronto.ca . Consultado el 4 de mayo de 2016 .
- ^ Belcheva, Antoaneta; Irrazabal, Thergiory; Robertson, Susan J.; Streutker, Catherine; Maughan, Heather; Rubino, Stephen; Moriyama, Eduardo H.; Copeland, Julia K.; Kumar, Sachin (17 de julio de 2014). "El metabolismo microbiano intestinal impulsa la transformación de células epiteliales del colon deficientes en MSH2". Cell . 158 (2): 288–299. doi : 10.1016/j.cell.2014.04.051 . ISSN 1097-4172. PMID 25036629.
- ^ Scheppach, W.; Sommer, H.; Kirchner, T.; et al. (1992). "Efecto de los enemas de butirato sobre la mucosa colónica en la colitis ulcerosa distal". Gastroenterología . 103 (1): 51–56. doi : 10.1016/0016-5085(92)91094-K . PMID 1612357.
- ^ Robison AJ, Nestler EJ (noviembre de 2011). "Mecanismos transcripcionales y epigenéticos de la adicción". Nat. Rev. Neurosci . 12 (11): 623–637. doi :10.1038/nrn3111. PMC 3272277 . PMID 21989194.
- ^ Nestler EJ (enero de 2014). "Mecanismos epigenéticos de la adicción a las drogas". Neurofarmacología . 76 Pt B: 259–268. doi :10.1016/j.neuropharm.2013.04.004. PMC 3766384 . PMID 23643695.
- ^ ab Walker DM, Cates HM, Heller EA, Nestler EJ (febrero de 2015). "Regulación de los estados de la cromatina por drogas de abuso". Curr. Opin. Neurobiol . 30 : 112–121. doi :10.1016/j.conb.2014.11.002. PMC 4293340. PMID 25486626 .
- ^ Ajonijebu DC, Abboussi O, Russell VA, Mabandla MV, Daniels WM (agosto de 2017). "Epigenética: un vínculo entre la adicción y el entorno social". Ciencias de la vida celular y molecular . 74 (15): 2735–2747. doi :10.1007/s00018-017-2493-1. PMC 11107568 . PMID 28255755. S2CID 40791780.
- ^ Legastelois R, Jeanblanc J, Vilpoux C, Bourguet E, Naassila M (2017). "Mécanismos epigénéticos y problemas de uso del alcohol: ¿un tratamiento terapéutico interesante?" [Mecanismos epigenéticos y trastornos por consumo de alcohol: una posible diana terapéutica]. Biologie Aujourd'hui (en francés). 211 (1): 83–91. doi : 10.1051/jbio/2017014 . PMID 28682229.
Enlaces externos
- Datos de referencia estándar del NIST para el ácido butanóico





