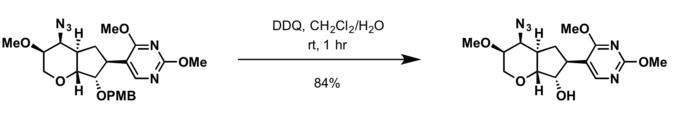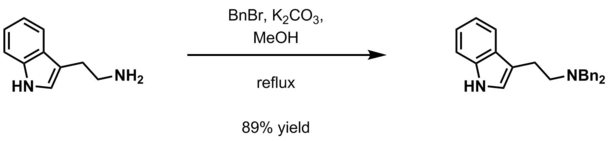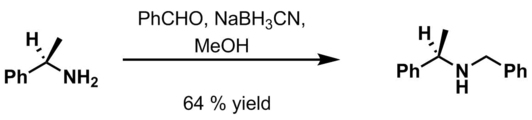Grupo bencilo

En química orgánica , el bencilo es el sustituyente o fragmento molecular que posee la estructura R−CH 2 −C 6 H 5 . El bencilo presenta un anillo de benceno ( C 6 H 6 ) unido a un grupo metileno ( −CH 2 − ). [1]
Nomenclatura
En la nomenclatura IUPAC , el prefijo bencilo se refiere a un sustituyente C6H5CH2 , por ejemplo cloruro de bencilo o benzoato de bencilo . El bencilo no debe confundirse con el fenilo con la fórmula C6H5 . El término bencílico se utiliza para describir la posición del primer carbono unido a un benceno u otro anillo aromático. Por ejemplo, ( C6H5 ) ( CH3 ) 2C + se denomina carbocatión "bencílico". El radical libre bencilo tiene la fórmula C6H5CH2 • . El catión bencilo o ion fenilcarbenio es el carbocatión con la fórmula C6H5CH+2; el anión bencilo o ion fenilmetanuro es el carbanión con la fórmula C 6 H 5 CH−2Ninguna de estas especies puede formarse en cantidades significativas en la fase de solución en condiciones normales, pero son referentes útiles para la discusión de los mecanismos de reacción y pueden existir como intermedios reactivos.
Abreviaturas
El bencilo se abrevia comúnmente como Bn. Por ejemplo, el alcohol bencílico se puede representar como BnOH. Otras abreviaturas menos comunes son Bzl y Bz, la última de las cuales es ambigua, ya que también es la abreviatura estándar para el grupo benzoilo C 6 H 5 C(O)− . Asimismo, el bencilo no debe confundirse con el grupo fenilo C 6 H 5 − , abreviado como Ph.
Reactividad de los centros bencílicos
La reactividad mejorada de las posiciones bencílicas se atribuye a la baja energía de disociación de enlaces C−H bencílicos. Específicamente, el enlace C6H5CH2 − H es aproximadamente un 10-15 % más débil que otros tipos de enlaces C−H. El anillo aromático vecino estabiliza los radicales bencílicos. Los datos tabulados a continuación comparan la fuerza del enlace C−H bencílico con la de enlaces C−H relacionados.
| Vínculo | Vínculo | Energía de disociación de enlace [2] [3] | Comentario | |
|---|---|---|---|---|
| (kcal/mol) | (kJ/mol) | |||
| C6H5CH2 - H | enlace C−H bencílico | 90 | 377 | Similares a los enlaces C-H alílicos, estos enlaces muestran una reactividad mejorada. |
| H3C − H | enlace metilo C−H | 105 | 439 | Uno de los enlaces C−H alifáticos más fuertes. |
| C2H5 - H | enlace etílico C−H | 101 | 423 | ligeramente más débil que H 3 C−H |
| C6H5 - H | enlace C−H fenilo | 113 | 473 | comparable al radical vinílico, raro |
| CH2 = CHCH2 − H | enlace C–H alílico | 89 | 372 | similar al CH bencílico |
| ( C6H4 ) 2CH − H | enlace C–H fluorenilo | 80 | Más activado que el difenilmetilo ( pKa = 22,6) | |
| ( C6H5 ) 2CH − H | Enlace C–H difenilmetilo | 82 | "doblemente bencílico" ( pKa = 32,2) | |
| ( C6H5 ) 3C − H | enlace C–H tritilo | 81 | 339 | "triplemente bencílico" |
La debilidad del enlace C−H refleja la estabilidad del radical bencílico. Por razones relacionadas, los sustituyentes bencílicos exhiben una reactividad mejorada, como en la oxidación , la halogenación de radicales libres o la hidrogenólisis . Como ejemplo práctico, en presencia de catalizadores adecuados, el p - xileno se oxida exclusivamente en las posiciones bencílicos para dar ácido tereftálico :
Con este método se producen anualmente millones de toneladas de ácido tereftálico. [4]
Funcionalización en la posición bencílica
En algunos casos, estas transformaciones bencílicas ocurren bajo condiciones adecuadas para la síntesis de laboratorio. La reacción de Wohl-Ziegler bromará un enlace C–H bencílico: ( ArCHR 2 → ArCBrR 2 ). [5] Cualquier grupo alquilo bencílico no terciario se oxidará a un grupo carboxilo mediante permanganato de potasio acuoso ( KMnO 4 ) o ácido nítrico concentrado ( HNO 3 ): ( ArCHR 2 → ArCOOH ). [6] Finalmente, el complejo de trióxido de cromo y 3,5-dimetilpirazol ( CrO 3 −dmpyz ) oxidará selectivamente un grupo metileno bencílico a un carbonilo: ( ArCH 2 R → ArC(O)R ). [7] El ácido 2-yodoxibenzoico en DMSO funciona de manera similar. [8]
Como grupo protector
Los grupos bencilo se emplean ocasionalmente como grupos protectores en la síntesis orgánica. Su instalación y, especialmente, su eliminación requieren condiciones relativamente duras, por lo que el bencilo no suele ser el grupo preferido para la protección. [9]
Protección contra el alcohol
El bencilo se utiliza comúnmente en síntesis orgánica como un grupo protector robusto para alcoholes y ácidos carboxílicos .
- Tratamiento del alcohol con una base fuerte como hidróxido de potasio en polvo o hidruro de sodio y haluro de bencilo ( BnCl o BnBr ) [9] [10]
- La monobencilación de dioles se puede lograr utilizando Ag2O en dimetilformamida ( DMF ) a temperaturas ambiente y elevadas [11].
- Los alcoholes primarios se pueden bencilar selectivamente en presencia de grupos funcionales fenol utilizando Cu(acac) 2 [12]
Métodos de desprotección
Los éteres bencílicos se pueden eliminar en condiciones reductoras , condiciones oxidativas y mediante el uso de ácidos de Lewis . [9]
- Eliminado mediante hidrogenólisis [13]
- Proceso de un solo electrón con Na / NH3 o Li / NH3
- Los grupos protectores de bencilo se pueden eliminar utilizando una amplia gama de agentes oxidantes, incluidos:
- CrO 3 / ácido acético a temperatura ambiente
- Ozono
- N -Bromosuccinimida (NBS)
- N -yodosuccinimida (NIS)
- Yoduro de trimetilsililo (Me 3 SiI) en diclorometano a temperatura ambiente (se puede lograr selectividad en condiciones específicas)
Elpag-grupo protector metoxibencilo
El p -metoxibencilo ( PMB ) se utiliza como grupo protector de alcoholes en síntesis orgánica ( el 4-metoxibenciltiol se utiliza para proteger tioles).

- Base fuerte como hidróxido de potasio en polvo o hidruro de sodio y haluro de p -metoxibencilo (cloruro o bromuro) [14] [15]
- El 4-metoxibencil-2,2,2-tricloroacetimidato se puede utilizar para instalar el grupo PMB en presencia de:
- Triflato de escandio (III) (Sc(OTf) 3 ) en tolueno a 0 °C [16]
- Ácido trifluorometanosulfónico (TfOH) en diclorometano a 0 °C [17]
Métodos de desprotección
- 2,3-Dicloro-5,6-diciano- p -benzoquinona (DDQ) [18]
- Las condiciones para la desprotección del grupo bencilo son aplicables para la escisión del grupo protector PMB
Protección de aminas
El grupo bencilo se utiliza ocasionalmente como grupo protector de aminas en síntesis orgánica . Existen otros métodos. [9]
- Carbonato de potasio acuoso y haluro de bencilo ( BnCl , BnBr ) en metanol [19]
- Benzaldehído , HCl 6 M y NaBH 3 CN en metanol [20]
Métodos de desprotección
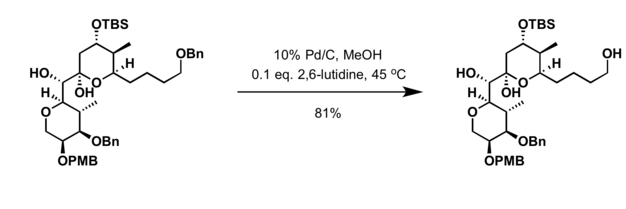
- Hidrogenación en presencia del catalizador de paladio [21]
Véase también
Referencias
- ^ Carey, FA; Sundberg, RJ (2008). Química orgánica avanzada, parte A: Estructura y mecanismos (5.ª ed.). Nueva York, NY: Springer. pp. 806–808, 312–313. ISBN 9780387448978.
- ^ Xue, Xiao-Song; Ji, Pengju; Zhou, Biying; Cheng, Jin-Pei (2017). "El papel esencial de la energía de los enlaces en la activación/funcionalización de C–H". Chemical Reviews . 117 (13): 8622–8648. doi :10.1021/acs.chemrev.6b00664. PMID 28281752.
- ^ Zhang, Xian-Man; Bordwell, Frederick G. (1992). "Energías de disociación de enlaces homolíticos de los enlaces carbono-hidrógeno bencílicos en aniones radicales y cationes radicales derivados de fluorenos, trifenilmetanos y compuestos relacionados". Journal of the American Chemical Society . 114 (25): 9787–9792. doi :10.1021/ja00051a010.
- ^ Sheehan, Richard J. "Ácido tereftálico, tereftalato de dimetilo y ácido isoftálico". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a26_193. ISBN . 978-3527306732.
- ^ C., Vollhardt, K. Peter (29 de enero de 2018). Química orgánica: estructura y función . Schore, Neil Eric, 1948- (8.ª ed.). Nueva York. ISBN 9781319079451.OCLC 1007924903 .
{{cite book}}: CS1 maint: falta la ubicación del editor ( enlace ) CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Chandler), Norman, ROC (Richard Oswald (1993). Principios de síntesis orgánica . Coxon, JM (James Morriss), 1941- (3.ª ed.). Londres: Blackie Academic & Professional. ISBN 978-0751401264.OCLC 27813843 .
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Johnston, Jeffrey N. (2001), "Óxido de cromo (VI)–3,5-dimetilpirazol", Enciclopedia de reactivos para síntesis orgánica , Sociedad Estadounidense del Cáncer, doi : 10.1002/047084289x.rc170, ISBN 9780470842898
- ^ Baran, Phil S.; Zhong, Yong-Li (1 de abril de 2001). "Oxidación selectiva en carbono adyacente a sistemas aromáticos con IBX". Revista de la Sociedad Química Americana . 123 (13): 3183–3185. doi :10.1021/ja004218x. ISSN 0002-7863. PMID 11457049.
- ^ abcd Wuts, Peter GM; Greene, Theodora W. (2006). Grupos protectores de Greene en síntesis orgánica (4.ª ed.). Wiley Online Library. doi :10.1002/0470053488. ISBN 9780470053485. Número de identificación del sujeto 83393227.
- ^ Fukuzawa, Akio; Sato, Hideaki; Masamune, Tadashi (1 de enero de 1987). "Síntesis de (±) -prepinnaterpeno, un bromoditerpeno del alga roja Yamada". Letras de tetraedro . 28 (37): 4303–4306. doi :10.1016/S0040-4039(00)96491-8.
- ^ Van Hijfte, Luc; Little, R. Daniel (1985-10-01). "Reacciones intramoleculares de atrapamiento de 1,3-diilo. Una síntesis total formal de (±)-coriolina". The Journal of Organic Chemistry . 50 (20): 3940–3942. doi :10.1021/jo00220a058. ISSN 0022-3263.
- ^ Sirkecioglu, Okan; Karliga, Bekir; Talinli, Naciye (10 de noviembre de 2003). "Bencilación de alcoholes mediante el uso de bis [acetilacetonato] cobre como catalizador". Letras de tetraedro . 44 (46): 8483–8485. doi :10.1016/j.tetlet.2003.09.106.
- ^ Smith, Amos B.; Zhu, Wenyu; Shirakami, Shohei; Sfouggatakis, Chris; Doughty, Victoria A.; Bennett, Clay S.; Sakamoto, Yasuharu (1 de marzo de 2003). "Síntesis total de (+)-espongistatina 1. Una construcción eficaz de segunda generación de una sal avanzada de Wittig EF, unión de fragmentos y elaboración final". Cartas orgánicas . 5 (5): 761–764. doi :10.1021/ol034037a. ISSN 1523-7060. PMID 12605509.
- ^ Marco, José L.; Hueso-Rodríguez, Juan A. (1 de enero de 1988). "Síntesis de derivados de 1- (3-furil) -1,2-dihidroxietano ópticamente puros". Letras de tetraedro . 29 (20): 2459–2462. doi :10.1016/S0040-4039(00)87907-1.
- ^ Takaku, Hiroshi; Kamaike, Kazuo; Tsuchiya, Hiromichi (1984-01-01). "Síntesis de oligonucleótidos. Parte 21. Síntesis de ribooligonucleótidos utilizando el grupo 4-metoxibencilo como un nuevo grupo protector para el grupo 2'-hidroxilo". The Journal of Organic Chemistry . 49 (1): 51–56. doi :10.1021/jo00175a010. ISSN 0022-3263.
- ^ Trost, Barry M.; Waser, Jerome; Meyer, Arndt (1 de noviembre de 2007). "Síntesis total de ácido (−)-pseudolárico B". Revista de la Sociedad Química Americana . 129 (47): 14556–14557. doi :10.1021/ja076165q. ISSN 0002-7863. PMC 2535803. PMID 17985906 .
- ^ Mukaiyama, Teruaki; Shiina, Isamu; Iwadare, Hayato; Saitoh, Masahiro; Nishimura, Toshihiro; Ohkawa, Naoto; Sakoh, Hiroki; Nishimura, Koji; Tani, Yu-ichirou (4 de enero de 1999). "Síntesis total asimétrica de Taxol \ R". Química: una revista europea . 5 (1): 121–161. doi : 10.1002/(SICI)1521-3765(19990104)5:1<121::AID-CHEM121>3.0.CO;2-O . ISSN 1521-3765.
- ^ Hanessian, Stephen; Marcotte, Stéphane; Machaalani, Roger; Huang, Guobin (1 de noviembre de 2003). "Síntesis total y confirmación estructural de la malayamicina A: un nuevo C -nucleósido bicíclico de Streptomyces malaysiensis". Cartas orgánicas . 5 (23): 4277–4280. doi :10.1021/ol030095k. ISSN 1523-7060. PMID 14601979.
- ^ Kuehne, Martin E.; Xu, Feng (1993-12-01). "Síntesis total de alcaloides de estricnina y aspidospermatano. 3. La síntesis total de (±)-estricnina". The Journal of Organic Chemistry . 58 (26): 7490–7497. doi :10.1021/jo00078a030. ISSN 0022-3263.
- ^ Cain, Christian M.; Cousins, Richard PC; Coumbarides, Greg; Simpkins, Nigel S. (1990-01-01). "Desprotonación asimétrica de cetonas proquirales utilizando bases quirales de amida de litio". Tetrahedron . 46 (2): 523–544. doi :10.1016/S0040-4020(01)85435-1.
- ^ Zhou, Hao; Liao, Xuebin; Cook, James M. (1 de enero de 2004). "Síntesis total regioespecífica y enantioespecífica de los alcaloides indólicos sustituidos con 12-alcoxi, (+)-12-metoxi-Na-metilvellosimina, (+)-12-metoxiafinisina y (−)-fucsiaefolina". Organic Letters . 6 (2): 249–252. doi :10.1021/ol0362212. ISSN 1523-7060. PMID 14723540.
- ^ Rong, Yi; Al-Harbi, Ahmed; Parkin, Gerard (2012). "Ángulos de enlace Zr–CH2–Ph altamente variables en tetrabencilcirconio: análisis de los modos de coordinación del ligando bencílico". Organometallics . 31 (23): 8208–8217. doi :10.1021/om300820b.
Enlaces externos
 Portal de química
Portal de química Citas relacionadas con el grupo bencilo en Wikiquote
Citas relacionadas con el grupo bencilo en Wikiquote