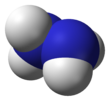
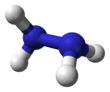
Hidracina
| |||
| |||
 Hidrazina anhidra | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Hidracina [2] | |||
| Nombre sistemático de la IUPAC Diazano [2] | |||
| Otros nombres Diamina [1] Tetrahidridodinitrogeno( N - N ) Diamidógeno | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 3DMet |
| ||
| 878137 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.005.560 | ||
| Número CE |
| ||
| 190 | |||
| BARRIL | |||
| Malla | Hidracina | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 2029 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| N2H4 | |||
| Masa molar | 32,0452 g/mol | ||
| Apariencia | Líquido aceitoso, incoloro y humeante [3] | ||
| Olor | Similar al amoniaco [3] | ||
| Densidad | 1,021 g/ cm3 | ||
| Punto de fusión | 2 °C; 35 °F; 275 K | ||
| Punto de ebullición | 114 °C; 237 °F; 387 K | ||
| Miscible [3] | |||
| registro P | 0,67 | ||
| Presión de vapor | 1 kPa (a 30,7 °C) | ||
| Acidez (p K a ) | 8.10 ( [ N2H5 ] + ) [ 4 ] | ||
| Basicidad (p K b ) | 5,90 | ||
| Ácido conjugado | Hidrazinio | ||
Índice de refracción ( n D ) | 1.46044 (a 22 °C) | ||
| Viscosidad | 0,876 cP | ||
| Estructura | |||
| Pirámide triangular en N | |||
| 1,85 D [5] | |||
| Termoquímica | |||
Entropía molar estándar ( S ⦵ 298 ) | 121,52 J/(K·mol) | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | 50,63 kJ/mol | ||
| Peligros | |||
| Etiquetado SGA : | |||
     | |||
| Peligro | |||
| H226 , H301 , H311 , H314 , H317 , H331 , H350 , H410 | |||
| P201 , P261 , P273 , P280 , P301+P310 , P305+P351+P338 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | 52 °C (126 °F; 325 K) | ||
| 24 a 270 °C (75 a 518 °F; 297 a 543 K) | |||
| Límites de explosividad | 1,8–100% | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 59–60 mg/kg (oral en ratas y ratones) [6] | ||
LC 50 ( concentración media ) | 260 ppm (rata, 4 h ) 630 ppm (rata, 1 h) 570 ppm (rata, 4 h) 252 ppm (ratón, 4 h) [7] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 1 ppm (1,3 mg/m 3 ) [piel] [3] | ||
REL (recomendado) | Ca C 0,03 ppm (0,04 mg/m 3 ) [2 horas] [3] | ||
IDLH (Peligro inmediato) | Ca [50 ppm] [3] | ||
| Ficha de datos de seguridad (FDS) | ICSC 0281 | ||
| Compuestos relacionados | |||
Otros aniones | Tetrafluorohidrazina Peróxido de hidrógeno Difosfano Tetrayoduro de difósforo | ||
Otros cationes | Hidracinas orgánicas | ||
Azanes binarios relacionados | Triazano de amoniaco | ||
Compuestos relacionados | Diazeno Triazeno Tetrazeno Difosfeno | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
La hidracina es un compuesto inorgánico con la fórmula química N 2 H 4 . Es un hidruro de nitrato simple y es un líquido inflamable incoloro con un olor similar al del amoníaco . La hidracina es muy peligrosa a menos que se manipule en solución como, por ejemplo, el hidrato de hidracina ( N 2 H 4 · x H 2 O ).
La hidracina se utiliza principalmente como agente espumante en la preparación de espumas de polímeros , pero las aplicaciones también incluyen sus usos como precursor de productos farmacéuticos y agroquímicos , así como un propulsor almacenable a largo plazo para la propulsión de naves espaciales en el espacio . Además, la hidracina se utiliza en varios combustibles para cohetes y para preparar los precursores de gas utilizados en las bolsas de aire . La hidracina se utiliza en los ciclos de vapor de las centrales eléctricas nucleares y convencionales como depurador de oxígeno para controlar las concentraciones de oxígeno disuelto en un esfuerzo por reducir la corrosión. [8] A partir de 2000 [actualizar], aproximadamente 120.000 toneladas de hidrato de hidracina (que corresponden a una solución de hidracina al 64% en agua en peso) se fabricaron en todo el mundo por año. [9]
Las hidrazinas son una clase de sustancias orgánicas derivadas de la sustitución de uno o más átomos de hidrógeno en la hidrazina por un grupo orgánico. [9]
Etimología
La nomenclatura es una forma bivalente, con el prefijo hydr- utilizado para indicar la presencia de átomos de hidrógeno y el sufijo que comienza con -az- , de azote , la palabra francesa para nitrógeno .
Aplicaciones
Productores de gas y propulsores
El uso más importante de la hidracina es como precursor de agentes espumantes . Los compuestos específicos incluyen azodicarbonamida y azobisisobutironitrilo , que producen entre 100 y 200 ml de gas por gramo de precursor. En una aplicación relacionada, la azida de sodio , el agente formador de gas en las bolsas de aire , se produce a partir de hidracina por reacción con nitrito de sodio . [9]
La hidracina también se utiliza como propulsor almacenable a largo plazo a bordo de vehículos espaciales , como la misión Dawn a Ceres y Vesta, y tanto para reducir la concentración de oxígeno disuelto como para controlar el pH del agua utilizada en grandes calderas industriales. El avión de combate F-16 , el Eurofighter Typhoon [10] , el transbordador espacial y el avión espía U-2 utilizan hidracina para alimentar su sistema de arranque de emergencia en caso de que se pare el motor. [11]
Precursor de pesticidas y productos farmacéuticos.

La hidracina es un precursor de varios productos farmacéuticos y pesticidas. A menudo, estas aplicaciones implican la conversión de hidracina en anillos heterocíclicos como pirazoles y piridazinas . Entre los ejemplos de derivados de hidracina bioactivos comercializados se incluyen cefazolina , rizatriptán , anastrozol , fluconazol , metazaclor, metamitrona, metribuzina , paclobutrazol , diclobutrazol, propiconazol , sulfato de hidracina , [12] diimida , triadimefón , [9] y dibenzoilhidrazina .
Los compuestos de hidracina pueden ser eficaces como ingredientes activos en insecticidas, acaricidas, nematicidas , fungicidas, agentes antivirales, atrayentes, herbicidas o reguladores del crecimiento de las plantas. [13]
Pequeña escala, nicho e investigación
El fabricante italiano de catalizadores Acta (empresa química) ha propuesto utilizar hidracina como alternativa al hidrógeno en las pilas de combustible . El principal beneficio de utilizar hidracina es que puede producir más de 200 mW / cm2 más que una pila de hidrógeno similar sin requerir catalizadores de platino (costosos) . [14] Debido a que el combustible es líquido a temperatura ambiente, se puede manipular y almacenar más fácilmente que el hidrógeno. Al almacenar la hidracina en un tanque lleno de un carbonilo carbono - oxígeno con doble enlace , el combustible reacciona y forma un sólido seguro llamado hidrazona . Al enjuagar el tanque con agua tibia, se libera el hidrato de hidracina líquido. La hidracina tiene una fuerza electromotriz más alta de 1,56 V en comparación con 1,23 V para el hidrógeno. La hidracina se descompone en la celda para formar nitrógeno e hidrógeno que se unen con el oxígeno, liberando agua. [14] La hidracina se utilizó en pilas de combustible fabricadas por Allis-Chalmers Corp. , incluidas algunas que proporcionaron energía eléctrica a los satélites espaciales en la década de 1960.
Una mezcla de 63% de hidracina, 32% de nitrato de hidracina y 5% de agua es un propulsor estándar para artillería experimental de propulsante líquido de carga masiva . La mezcla de propulsante anterior es una de las más predecibles y estables, con un perfil de presión plano durante el disparo. Los fallos de encendido suelen deberse a una ignición inadecuada. El movimiento del proyectil después de una ignición errónea provoca una gran burbuja con una superficie de ignición mayor, y la mayor tasa de producción de gas provoca una presión muy alta, que a veces incluye fallos catastróficos de los tubos (es decir, explosiones). [15] Entre enero y junio de 1991, el Laboratorio de Investigación del Ejército de los EE. UU. realizó una revisión de los primeros programas de cañones de propulsante líquido de carga masiva para determinar su posible relevancia para el programa de propulsión química electrotérmica. [15]
La Fuerza Aérea de los Estados Unidos (USAF) utiliza regularmente H-70, una mezcla de 70% de hidracina y 30% de agua, en operaciones que emplean el avión de combate General Dynamics F-16 "Fighting Falcon" y el avión de reconocimiento Lockheed U-2 "Dragon Lady" . El monomotor F-16 utiliza hidracina para alimentar su unidad de potencia de emergencia (EPU), que proporciona potencia eléctrica e hidráulica de emergencia en caso de que se apague el motor. La EPU se activa automáticamente, o manualmente por control del piloto, en caso de pérdida de presión hidráulica o potencia eléctrica para proporcionar controles de vuelo de emergencia. El monomotor U-2 utiliza hidracina para alimentar su sistema de arranque de emergencia (ESS), que proporciona un método altamente confiable para reiniciar el motor en vuelo en caso de pérdida de sustentación. [16]
Combustible para cohetes

La hidracina se utilizó por primera vez como componente de combustibles para cohetes durante la Segunda Guerra Mundial . Una mezcla al 30 % en peso con 57 % de metanol (denominada M-Stoff en la Luftwaffe alemana ) y 13 % de agua fue denominada C-Stoff por los alemanes. [17] La mezcla se utilizó para propulsar el avión de combate propulsado por cohetes Messerschmitt Me 163B , en el que se utilizó el peróxido de alto rendimiento alemán T-Stoff como oxidante. Los alemanes denominaron a la hidracina sin mezclar B-Stoff , una designación que también se utilizó más tarde para el combustible de etanol/agua para el misil V-2 . [18]
La hidracina se utiliza como monopropelente de baja potencia para los propulsores de maniobra (RCS/sistema de control de reacción) de las naves espaciales, y se utilizó para alimentar las unidades de potencia auxiliares (APU) del transbordador espacial . Además, los motores de cohetes monopropelentes alimentados con hidracina se utilizan a menudo en el descenso terminal de las naves espaciales. Dichos motores se utilizaron en los módulos de aterrizaje del programa Viking en la década de 1970, así como en los módulos de aterrizaje de Marte Phoenix (mayo de 2008), Curiosity (agosto de 2012) y Perseverance (febrero de 2021).
Una mezcla de hidracina y ácido nítrico fumante rojo ( HNO3 + N2H4 ) se utilizó como combustible líquido para cohetes durante el programa espacial soviético , donde llegó a ser conocido como " veneno del diablo " debido a su naturaleza altamente peligrosa. [19]
En todos los motores monopropulsados de hidracina, la hidracina pasa sobre un catalizador , como el metal iridio, soportado por alúmina de gran área superficial (óxido de aluminio), lo que hace que se descomponga en amoníaco ( NH 3 ), gas nitrógeno ( N 2 ) y gas hidrógeno ( H 2 ) de acuerdo con las tres reacciones siguientes: [20]
- Reacción 1: N 2 H 4 → N 2 + 2 H 2
- Reacción 2: 3 N 2 H 4 → 4 NH 3 + N 2
- Reacción 3: 4 NH 3 + N 2 H 4 → 3 N 2 + 8 H 2
Las dos primeras reacciones son extremadamente exotérmicas (la cámara del catalizador puede alcanzar los 800 °C en cuestión de milisegundos, [21] ) y producen grandes volúmenes de gas caliente a partir de un pequeño volumen de líquido, [22] lo que convierte a la hidracina en un propulsor de propulsión bastante eficiente con un impulso específico de vacío de unos 220 segundos. [23] La reacción 2 es la más exotérmica, pero produce un número menor de moléculas que el de la reacción 1. La reacción 3 es endotérmica y revierte el efecto de la reacción 2 al mismo efecto que la reacción 1 sola (menor temperatura, mayor número de moléculas). La estructura del catalizador afecta la proporción del NH 3 que se disocia en la reacción 3; una temperatura más alta es deseable para los propulsores de cohetes, mientras que más moléculas son deseables cuando las reacciones están destinadas a producir mayores cantidades de gas. [24]
Dado que la hidracina es un sólido por debajo de los 2 °C, no es adecuada como propulsor de cohetes de uso general para aplicaciones militares. Otras variantes de hidracina que se utilizan como combustible para cohetes son la monometilhidrazina, CH3NHNH2 , también conocida como MMH (punto de fusión -52 °C), y la dimetilhidrazina asimétrica , (CH3 ) 2NNH2 , también conocida como UDMH (punto de fusión -57 °C). Estos derivados se utilizan en combustibles para cohetes de dos componentes, a menudo junto con tetróxido de dinitrógeno , N2O4 . Se utilizó una mezcla 50:50 en peso de hidracina y UDMH en el motor del sistema de propulsión de servicio del módulo de mando y servicio del Apolo , tanto en los motores de ascenso como de descenso del módulo lunar del Apolo y de los misiles balísticos intercontinentales Titan II , y se conoce como Aerozine 50 . [17] Estas reacciones son extremadamente exotérmicas y la combustión también es hipergólica (comienza a arder sin ninguna ignición externa). [25]
En el libro de ficción The Martian (también adaptado a un largometraje ), el personaje principal utiliza un catalizador de iridio para separar el gas hidrógeno del combustible de hidracina sobrante, que luego quema para generar agua para sobrevivir.
En la industria aeroespacial se están realizando esfuerzos para encontrar un reemplazo para la hidracina, dada su posible prohibición en toda la Unión Europea. [26] [27] [28] Las alternativas prometedoras incluyen combinaciones de propulsores basados en óxido nitroso , cuyo desarrollo está liderado por las empresas comerciales Dawn Aerospace , Impulse Space , [29] y Launcher . [30] El primer sistema basado en óxido nitroso que voló en el espacio fue realizado por D-Orbit a bordo de su portador de satélites ION en 2021, utilizando seis propulsores Dawn Aerospace B20. [31] [32]
Riesgos laborales
Efectos sobre la salud
Las posibles vías de exposición a la hidrazina incluyen la vía dérmica, ocular, inhalación e ingestión. [33]
La exposición a la hidracina puede causar irritación cutánea, dermatitis de contacto y ardor, irritación de ojos, nariz y garganta, náuseas y vómitos, dificultad para respirar, edema pulmonar, dolor de cabeza, mareos, depresión del sistema nervioso central, letargo, ceguera temporal, convulsiones y coma. La exposición también puede causar daño orgánico al hígado, los riñones y el sistema nervioso central. [33] [34] La hidracina está documentada como un fuerte sensibilizador cutáneo con potencial de sensibilización cruzada a los derivados de la hidracina después de la exposición inicial. [35] Además de los usos ocupacionales analizados anteriormente, la exposición a la hidracina también es posible en pequeñas cantidades a través del humo del tabaco. [34]
Las recomendaciones oficiales de los Estados Unidos sobre la hidracina como carcinógeno son contradictorias, pero en general se reconocen sus posibles efectos cancerígenos. El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) la clasifica como "carcinógeno ocupacional potencial". El Programa Nacional de Toxicología (NTP) considera que "se prevé razonablemente que sea un carcinógeno humano". La Conferencia Americana de Higienistas Industriales Gubernamentales (ACGIH) clasifica a la hidracina como "A3: carcinógeno animal confirmado con relevancia desconocida para los humanos". La Agencia de Protección Ambiental de los Estados Unidos (EPA) la clasifica como "B2: un probable carcinógeno humano basado en evidencia de estudios en animales". [36]
La Agencia Internacional para la Investigación sobre el Cáncer (IARC) clasifica la hidracina como "2A, probablemente carcinógena para los humanos" con una asociación positiva observada entre la exposición a la hidracina y el cáncer de pulmón. [37] Basándose en estudios de cohorte y transversales de exposición ocupacional a la hidracina, un comité de las Academias Nacionales de Ciencias , Ingeniería y Medicina concluyó que hay evidencia sugestiva de una asociación entre la exposición a la hidracina y el cáncer de pulmón, con evidencia insuficiente de asociación con el cáncer en otros sitios. [38] El Comité Científico de Límites de Exposición Ocupacional (SCOEL) de la Comisión Europea coloca a la hidracina en el "grupo B" de carcinógenos, un carcinógeno genotóxico. El mecanismo genotóxico citado por el comité hace referencia a la reacción de la hidracina con formaldehído endógeno y la formación de un agente metilante del ADN. [39]
En caso de una emergencia relacionada con la exposición a la hidracina, el NIOSH recomienda quitarse la ropa contaminada inmediatamente, lavar la piel con agua y jabón y, en caso de exposición ocular, quitarse las lentillas y enjuagar los ojos con agua durante al menos 15 minutos. El NIOSH también recomienda que cualquier persona con una posible exposición a la hidracina busque atención médica lo antes posible. [33] No existen recomendaciones específicas de laboratorio o imágenes médicas posteriores a la exposición, y la evaluación médica puede depender del tipo y la gravedad de los síntomas. La Organización Mundial de la Salud (OMS) recomienda que las posibles exposiciones se traten sintomáticamente, prestando especial atención al posible daño pulmonar y hepático. En casos anteriores de exposición a la hidracina se ha documentado el éxito del tratamiento con piridoxina ( vitamina B6 ). [35]
Límites de exposición ocupacional
- Límite de exposición recomendado (REL) de NIOSH : 0,03 ppm (0,04 mg/m 3 ) límite de exposición de 2 horas [36]
- Límite de exposición permisible (PEL) de OSHA : 1 ppm (1,3 mg/m 3 ) Promedio ponderado en el tiempo de 8 horas [36]
- Valor límite de umbral (TLV) de la ACGIH : 0,01 ppm (0,013 mg/m 3 ) Promedio ponderado en el tiempo de 8 horas [36]
El umbral de olor de la hidracina es de 3,7 ppm, por lo que si un trabajador percibe un olor similar al del amoníaco, es probable que supere el límite de exposición. Sin embargo, este umbral de olor varía mucho y no debería utilizarse para determinar exposiciones potencialmente peligrosas. [40]
Para el personal aeroespacial, la Fuerza Aérea de los Estados Unidos utiliza una directriz de exposición de emergencia, desarrollada por el Comité de Toxicología de la Academia Nacional de Ciencias , que se utiliza para exposiciones no rutinarias del público en general y se denomina Directriz de exposición pública de emergencia a corto plazo (SPEGL). La SPEGL, que no se aplica a las exposiciones ocupacionales, se define como la concentración máxima aceptable para exposiciones de emergencia imprevistas, únicas y a corto plazo del público en general y representa exposiciones poco frecuentes en la vida de un trabajador. Para la hidracina, la SPEGL de 1 hora es de 2 ppm, con una SPEGL de 24 horas de 0,08 ppm. [41]
Manipulación y vigilancia médica
Un programa completo de vigilancia de la hidracina debe incluir un análisis sistemático de la vigilancia biológica, la detección médica y la información sobre morbilidad y mortalidad. Los CDC recomiendan que se proporcionen resúmenes de vigilancia y educación a los supervisores y trabajadores. Se deben realizar exámenes médicos periódicos y previos a la colocación, con especial atención a los posibles efectos de la hidracina sobre el funcionamiento de los ojos, la piel, el hígado, los riñones y los sistemas hematopoyético, nervioso y respiratorio. [33]
Los controles comunes utilizados para la hidracina incluyen el encierro del proceso, la ventilación por extracción local y el equipo de protección personal (EPP). [33] Las pautas para el EPP para hidracina incluyen guantes y ropa impermeables, gafas resistentes a salpicaduras con ventilación indirecta, pantalla facial y, en algunos casos, un respirador. [40] El uso de respiradores para la manipulación de hidracina debe ser el último recurso como método para controlar la exposición de los trabajadores. En los casos en que se necesiten respiradores, se debe implementar la selección adecuada de respiradores y un programa completo de protección respiratoria que sea coherente con las pautas de OSHA . [33]
Para el personal de la USAF , la Norma 48-8 de Seguridad y Salud Ocupacional de la Fuerza Aérea (AFOSH), Anexo 8, analiza las consideraciones para la exposición ocupacional a la hidracina en sistemas de misiles, aeronaves y naves espaciales. Las pautas específicas para la respuesta a la exposición incluyen duchas de emergencia obligatorias y estaciones lavaojos y un proceso para descontaminar la ropa protectora. Las pautas también asignan responsabilidades y requisitos para el EPP adecuado, la capacitación de los empleados, la vigilancia médica y la respuesta a emergencias. [41] Las bases de la USAF que requieren el uso de hidracina generalmente tienen regulaciones específicas de base que rigen los requisitos locales para el uso seguro de la hidracina y la respuesta a emergencias.
Estructura molecular
La hidrazina, H 2 N−NH 2 , contiene dos grupos amina NH 2 conectados por un enlace simple entre los dos átomos de nitrógeno. Cada subunidad N−NH 2 es piramidal. La estructura de las moléculas libres se determinó por difracción de electrones de gas y espectroscopia de microondas . La longitud del enlace simple N–N es 1,447(2) Å (144,7(2) pm ), la distancia NH es 1,015(2) Å , los ángulos NNH son 106(2)° y 112(2)°, el ángulo HNH es 107°. [42] La molécula adopta una conformación gauche con un ángulo de torsión de 91(2)° (ángulo diedro entre los planos que contienen el enlace NN y las bisectrices de los ángulos HNH). La barrera rotacional es el doble de la del etano . Estas propiedades estructurales se asemejan a las del peróxido de hidrógeno gaseoso, que adopta una conformación anticlinal "sesgada" y también experimenta una fuerte barrera rotacional.
La estructura de la hidracina sólida se determinó mediante difracción de rayos X. En esta fase, el enlace NN tiene una longitud de 1,46 Å y las distancias no enlazadas más cercanas son 3,19, 3,25 y 3,30 Å . [43]
Síntesis y producción
Se han desarrollado diversas vías sintéticas para la producción de hidrazina. [9] El paso clave es la creación del enlace simple N -N. Las numerosas vías se pueden dividir en aquellas que utilizan oxidantes de cloro (y generan sal) y aquellas que no lo hacen.
Oxidación del amoniaco a través de oxaziridinas a partir del peróxido.
La hidrazina se puede sintetizar a partir de amoníaco y peróxido de hidrógeno con un catalizador de cetona, en un procedimiento llamado proceso de peróxido (a veces llamado proceso de Pechiney-Ugine-Kuhlmann, ciclo de Atofina-PCUK o proceso de ketazina). [9] La reacción neta es: [44]
- 2NH3 + H2O2 → N2H4 + 2H2O
En esta ruta, la cetona y el amoníaco primero se condensan para dar la imina , que se oxida con peróxido de hidrógeno a la oxaziridina , un anillo de tres miembros que contiene carbono, oxígeno y nitrógeno. A continuación, la oxaziridina da la hidrazona mediante tratamiento con amoníaco , proceso que crea el enlace simple nitrógeno-nitrógeno. Esta hidrazona se condensa con un equivalente más de cetona.
La azina resultante se hidroliza para dar hidrazina y regenerar la cetona, metiletilcetona :
A diferencia de la mayoría de los otros procesos, este enfoque no produce sal como subproducto. [45]
Oxidaciones basadas en cloro
El proceso Olin Raschig , anunciado por primera vez en 1907, produce hidrazina a partir de hipoclorito de sodio (el ingrediente activo de muchos blanqueadores ) y amoníaco sin el uso de un catalizador de cetona. Este método se basa en la reacción de la monocloramina con amoníaco para crear el enlace simple N -N , así como un subproducto de cloruro de hidrógeno : [12]
- NH2Cl + NH3 → N2H4 + HCl
En relación con el proceso Raschig, se puede oxidar urea en lugar de amoníaco. Nuevamente, el hipoclorito de sodio actúa como oxidante. La reacción neta se muestra: [46]
- (NH 2 ) 2 CO + NaOCl + 2 NaOH → N 2 H 4 + H 2 O + NaCl + Na 2 CO 3
El proceso genera importantes subproductos y se practica principalmente en Asia. [9]
El proceso de ketazina de Bayer es el predecesor del proceso de peróxido. Utiliza hipoclorito de sodio como oxidante en lugar de peróxido de hidrógeno. Como todas las rutas basadas en hipoclorito, este método produce un equivalente de sal por cada equivalente de hidrazina. [9]
Reacciones
Comportamiento ácido-base

La hidracina forma un monohidrato N2H4 · H2O que es más denso (1,032 g/cm3 ) que la forma anhidra N2H4 ( 1,021 g / cm3 ) . La hidracina tiene propiedades químicas básicas ( alcalinas ) comparables a las del amoníaco : [ 47]
- N2H4 + H2O → [ N2H5 ] ++ OH− , Kb = 1,3 × 10−6 , pKb = 5,9
(para amoniaco K b = 1,78 × 10 −5 )
Es difícil de diprotonar: [48]
- [ N2H5 ] + + H2O → [ N2H6 ] 2+ + OH − , Kb = 8,4 × 10 −16 , pKb = 15
La exposición a bases extremadamente fuertes o metales alcalinos genera sales de hidrazida desprotonadas. La mayoría explotan al exponerse al aire o la humedad. [49]
Reacciones redox
Idealmente, la combustión de hidracina en oxígeno produce nitrógeno y agua:
- N2H4 + O2 → N2 + 2H2O
Un exceso de oxígeno produce óxidos de nitrógeno, incluidos monóxido de nitrógeno y dióxido de nitrógeno :
- N2H4 + 2O2 → 2NO + 2H2O
- N2H4 + 3O2 → 2NO2 + 2H2O
El calor de combustión de la hidracina en oxígeno (aire) es 19,41 MJ/kg (8345 BTU/lb). [50]
La hidracina es un reductor conveniente porque los subproductos son típicamente gas nitrógeno y agua. Esta propiedad la hace útil como antioxidante , eliminador de oxígeno e inhibidor de corrosión en calderas de agua y sistemas de calefacción. También reduce directamente las sales de metales menos activos (por ejemplo, bismuto, arsénico, cobre, mercurio, plata, plomo, platino y paladio) al elemento. [51] Esa propiedad tiene aplicación comercial en el niquelado electrolítico y la extracción de plutonio de los desechos de reactores nucleares . Algunos procesos fotográficos en color también utilizan una solución débil de hidracina como lavado estabilizador, ya que elimina el acoplador de tinte y los haluros de plata sin reaccionar. La hidracina es el agente reductor más común y eficaz utilizado para convertir óxido de grafeno (GO) en óxido de grafeno reducido (rGO) mediante tratamiento hidrotérmico. [52]
Sales de hidrazinio
La hidracina se puede protonar para formar varias sales sólidas del catión hidrazinio [N 2 H 5 ] + , mediante el tratamiento con ácidos minerales. Una sal común es el hidrogenosulfato de hidrazinio , [N 2 H 5 ] + [HSO 4 ] − . [53] El hidrogenosulfato de hidrazinio se investigó como tratamiento de la caquexia inducida por cáncer , pero resultó ineficaz. [54]
La doble protonación da el dicatión hidrazinio o hidrazinedio, [N 2 H 6 ] 2+ , del que se conocen varias sales. [55]
Química orgánica
Las hidrazinas forman parte de muchas síntesis orgánicas , a menudo de importancia práctica en productos farmacéuticos (véase la sección de aplicaciones), así como en tintes textiles y en fotografía. [9]
La hidracina se utiliza en la reducción de Wolff-Kishner , una reacción que transforma el grupo carbonilo de una cetona en un puente metileno (o un aldehído en un grupo metilo ) a través de un intermediario llamado hidrazona . La producción del dinitrógeno altamente estable a partir del derivado de hidracina ayuda a impulsar la reacción.
Al ser bifuncional, con dos aminas, la hidrazina es un componente fundamental para la preparación de muchos compuestos heterocíclicos mediante condensación con una variedad de electrófilos difuncionales . Con 2,4-pentanodiona , se condensa para dar el 3,5-dimetilpirazol . [56] En la reacción de Einhorn-Brunner, las hidrazinas reaccionan con imidas para dar triazoles .
Al ser un buen nucleófilo, el N 2 H 4 puede atacar a los haluros de sulfonilo y a los haluros de acilo. [57] La tosilhidrazina también forma hidrazonas tras el tratamiento con carbonilos.
La hidrazina se utiliza para escindir los derivados de ftalimida N -alquilados. Esta reacción de escisión permite que el anión ftalimida se utilice como precursor de amina en la síntesis de Gabriel . [58]
Formación de hidrazona
Un ejemplo de la condensación de la hidracina con un carbonilo simple es su reacción con acetona para dar la acetona azina . Esta última reacciona posteriormente con la hidracina para dar la acetona hidrazona : [59]
- 2 (CH 3 ) 2 CO + N 2 H 4 → 2 H 2 O + ((CH 3 ) 2 C=N) 2
- ((CH 3 ) 2 C=N) 2 + N 2 H 4 → 2 (CH 3 ) 2 C=NNH 2
La propanona azina es un intermediario en el proceso Atofina-PCUK . La alquilación directa de hidrazinas con haluros de alquilo en presencia de una base produce hidrazinas sustituidas con alquilo, pero la reacción es típicamente ineficiente debido al control deficiente del nivel de sustitución (igual que en las aminas comunes ). La reducción de hidrazonas a hidrazinas presenta una forma limpia de producir hidrazinas 1,1-dialquiladas.
En una reacción relacionada, las 2-cianopiridinas reaccionan con hidrazina para formar hidrazidas de amida, que pueden convertirse usando 1,2-dicetonas en triazinas .
Bioquímica
La hidrazina es el intermediario en el proceso de oxidación anaeróbica del amoníaco ( anammox ). [60] Es producida por algunas levaduras y por la bacteria de mar abierto anammox ( Brocadiade anammoxidans ). [61]
La falsa morilla produce el veneno giromitrina , que es un derivado orgánico de la hidracina que se convierte en monometilhidrazina mediante procesos metabólicos. Incluso el hongo comestible más popular, Agaricus bisporus , produce derivados orgánicos de la hidracina, entre ellos la agaritina , un derivado de hidracina de un aminoácido, y la giromitrina . [62] [63]
Historia
El nombre "hidrazina" fue acuñado por Emil Fischer en 1875; estaba tratando de producir compuestos orgánicos que consistieran en hidrazina mono-sustituida. [64] En 1887, Theodor Curtius había producido sulfato de hidrazina tratando diazidas orgánicas con ácido sulfúrico diluido; sin embargo, no pudo obtener hidrazina pura, a pesar de sus repetidos esfuerzos. [65] [66] [67] La hidrazina anhidra pura fue preparada por primera vez por el químico holandés Lobry de Bruyn en 1895. [68] [69] [70]
Véase también
- Mezcla de combustible de óxido nitroso : clase de propulsores líquidos para cohetes
- USA-193 – Satélite militar estadounidense (2006-2008)
Referencias
- ^ "Guía del NIOSH: hidrazina". Centros para el Control y la Prevención de Enfermedades . Consultado el 16 de agosto de 2012 .
- ^ ab "hidrazina—Base de datos de sustancias químicas públicas de PubChem". El proyecto PubChem . EE. UU.: Centro Nacional de Información Biotecnológica.
- ^ abcdef Guía de bolsillo del NIOSH sobre peligros químicos. "#0329". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Hall HK, et al. (1957). "Correlación de las fuerzas de base de las aminas1". J. Am. Chem. Soc. 79 (20): 5441. doi :10.1021/ja01577a030.
- ^ Greenwood NN , Earnshaw A (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ Martel B, Cassidy K, et al. (2004). Análisis de riesgos químicos: un manual práctico . Ámsterdam: Butterworth–Heinemann. pág. 361. ISBN 978-1-903996-65-2.OCLC 939257974 .
- ^ "Hidrazina". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Tsubakizaki S, Takada M, Gotou H, Mawatari K, Ishihara N, Kai R (2009). "Alternativas a la hidracina en el tratamiento del agua en plantas de energía térmica" (PDF) . Mitsubishi Heavy Industries Technical Review . 6 (2): 43–47.
- ^ abcdefghi Schirmann JP, Bourdauducq P (2001). "Hidracina". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a13_177. ISBN 3-527-30673-0.
- ^ "Resumen de los derrames e incendios relacionados con el combustible hipergólico de la NASA y la USAF" (PDF) . Centro Espacial Kennedy .
- ^ Suggs HJ, Luskus LJ, Kilian HJ, Mokry JW (1979). "Exhaust Gas Composition of the F-16 Emergency Power Unit" (informe técnico). USAF . SAM-TR-79-2. Archivado desde el original el 4 de marzo de 2016. Consultado el 23 de enero de 2019 .
- ^ ab Adams R, Brown BK (1922). "Sulfato de hidrazina". Org. Synth. 2 : 37. doi :10.15227/orgsyn.002.0037. S2CID 221547391.
- ^ Toki T, Koyanagi T, Yoshida K, Yamamoto K, Morita M (1994). "Compuestos de hidrazina útiles como pesticidas" (patente estadounidense). Ishihara Sangyo Kaisha Ltd (cesionario original). US5304657A.
- ^ ab "Activo líquido". El Ingeniero . Centaur Media plc. 15 de enero de 2008. Consultado el 23 de enero de 2019 .
- ^ ab Knapton JD, Stobie IC, Elmore L (marzo de 1993). "Una revisión del programa de cañones de propulsión líquida de carga masiva para su posible relevancia para el programa de propulsión química electrotérmica" (PDF) . Laboratorio de investigación del ejército. ADA263143. Archivado (PDF) del original el 7 de marzo de 2020.
- ^ "Servicio de mantenimiento en tierra de aeronaves y conexión a tierra/conexión estática" (PDF) . USAF (manual técnico). 13 de marzo de 2017. TO 00-25-172 . Consultado el 23 de noviembre de 2018 .
- ^ ab Clark JD (23 de mayo de 2018). Ignition!: An Informal History of Liquid Rocket Propellants [¡Ignición!: Una historia informal de los propulsores líquidos para cohetes]. Rutgers University Press. pág. 302. ISBN 978-0-8135-9918-2.
- ^ TW Price, DD Evans. Informe técnico 32-7227 El estado de la tecnología de hidracina como monopropelente (PDF) (Informe). Administración Nacional de Aeronáutica y del Espacio (NASA). pág. 1. Consultado el 22 de febrero de 2022 .
- ^ "La catástrofe de Nedelin, parte 1". 28 de octubre de 2014. Archivado desde el original el 15 de febrero de 2022. Consultado el 15 de febrero de 2022 .
- ^ Haws JL, Harden DG (1965). "Propiedades termodinámicas de la hidracina". Revista de naves espaciales y cohetes . 2 (6): 972–974. Código Bibliográfico :1965JSpRo...2..972H. doi :10.2514/3.28327.
- ^ Vieira R, Pham-Huu C, Kellera N, Ledouxa MJ (2002). "Nuevo compuesto de fieltro de grafito y nanofibras de carbono para su uso como soporte de catalizador para la descomposición catalítica de hidrazina". Chem. Comm. 44 (9): 954–955. doi :10.1039/b202032g. PMID 12123065.
- ^ Chen X, Zhang T, Xia L, Li T, Zheng M, Wu Z, Wang X, Wei Z, Xin Q, Li C (abril de 2002). "Descomposición catalítica de hidrazina sobre catalizadores de nitruro de molibdeno soportados en un propulsor monopropelente". Catalysis Letters . 79 : 21–25. doi :10.1023/A:1015343922044. S2CID 92094908.
- ^ "Página de cierre de sesión de BIG-IP". www.eso-io.com . Archivado desde el original el 23 de junio de 2008. Consultado el 20 de mayo de 2020 .
- ^ Valera-Medina A, Xiao H, Owen-Jones M, David WI, Bowen PJ (1 de noviembre de 2018). "Amoníaco para energía". Progreso en la ciencia de la energía y la combustión . 69 : 63–102. doi : 10.1016/j.pecs.2018.07.001 . ISSN 0360-1285. S2CID 106214840.
- ^ Mitchell MC, Rakoff RW, Jobe TO, Sanchez DL, Wilson B (2007). "Análisis termodinámico de ecuaciones de estado para el monopropelente hidracina". Revista de termofísica y transferencia de calor . 21 (1): 243–246. doi :10.2514/1.22798.
- ^ "La prohibición de la hidracina podría costar miles de millones a la industria espacial europea". SpaceNews . 2017-10-25 . Consultado el 2022-08-19 .
- ^ "Proyectos de investigación internacionales | Ministerio de Negocios, Innovación y Empleo". www.mbie.govt.nz . Consultado el 19 de agosto de 2022 .
- ^ Urban V (15 de julio de 2022). «Dawn Aerospace recibe 1,4 millones de euros de la UE para tecnología de propulsión ecológica». SpaceWatch.Global . Consultado el 19 de agosto de 2022 .
- ^ Berger E (19 de julio de 2022). «Dos empresas se unen a SpaceX en la carrera hacia Marte, con un lanzamiento posible en 2024». Ars Technica . Consultado el 19 de agosto de 2022 .
- ^ "Lanzador para desarrollar vehículo de transferencia orbital". SpaceNews . 2021-06-15 . Consultado el 2022-08-19 .
- ^ "Dawn Aerospace valida los propulsores B20 en el espacio – Bits&Chips" . Consultado el 19 de agosto de 2022 .
- ^ "Los propulsores Dawn B20 se han probado en el espacio". Dawn Aerospace . Consultado el 19 de agosto de 2022 .
- ^ abcdef "Directriz de seguridad y salud ocupacional para la hidracina: posible carcinógeno humano" (PDF) . NIOSH . 1988 . Consultado el 23 de noviembre de 2018 .
- ^ ab "Hydrazine 302-01-2" (PDF) . EPA de EE. UU . . Consultado el 23 de noviembre de 2018 .
- ^ ab "Programa Internacional de Seguridad Química—Guía de Salud y Seguridad No. 56—Hidrazina". IPCS INCHEM . Ginebra: OMS . 1991 . Consultado el 24 de noviembre de 2018 .
- ^ abcd "Base de datos de sustancias químicas ocupacionales: hidrazina". www.osha.gov . OSHA . Consultado el 24 de noviembre de 2018 .
- ^ "Hidrazina" (PDF) . IARC . Junio de 2018. Archivado desde el original (PDF) el 26 de noviembre de 2020 . Consultado el 23 de noviembre de 2018 .
- ^ Instituto de Medicina (2005). "Cap. 9: Hidracinas y ácido nítrico". La guerra del Golfo y la salud: combustibles, productos de combustión y propelentes . Vol. 3. Washington, DC: The National Academies Press. p. 347. doi :10.17226/11180. ISBN 978-0-309-09527-3. Número de identificación del sujeto 228274601.
- ^ "Recomendación del Comité científico sobre los límites de exposición profesional a la hidracina" (PDF) . Comisión Europea . Agosto de 2010 . Consultado el 23 de noviembre de 2018 .
- ^ ab "Hoja informativa sobre sustancias peligrosas: hidrazina" (PDF) . Departamento de Salud Pública de Nueva Jersey . Noviembre de 2009 . Consultado el 23 de noviembre de 2018 .
- ^ ab "Estándar 48-8 de seguridad y salud ocupacional de la Fuerza Aérea (AFOSH)" (PDF) . USAF . 1 de septiembre de 1997 . Consultado el 23 de noviembre de 2018 .
- ^ Kohata K, Fukuyama T, Kuchitsu K (marzo de 1982). "Estructura molecular de la hidracina estudiada por difracción de electrones de gas". The Journal of Physical Chemistry . 86 (5): 602–606. doi :10.1021/j100394a005. ISSN 0022-3654.
- ^ Collin RL, Lipscomb WN (1 de enero de 1951). "La estructura cristalina de la hidracina". Acta Crystallographica . 4 (1): 10–14. Código Bibliográfico :1951AcCry...4...10C. doi : 10.1107/s0365110x51000027 . ISSN 0365-110X.
- ^ Matar S, Hatch LF (2001). Química de los procesos petroquímicos (2.ª ed.). Burlington: Gulf Professional Publishing. pág. 148. ISBN 978-1-4933-0346-5. OCLC 990470096 – vía Elsevier.
- ^ Riegel ER, Kent JA (2003). "Hidrazina". Manual de química industrial de Riegel (10.ª ed.). Nueva York: Springer Science & Business Media. pág. 192. ISBN 978-0-306-47411-8.OCLC 55023601 .
- ^ "Hidrazina: información sobre productos químicos". chemindustry.ru . Archivado desde el original el 22 de enero de 2018. Consultado el 8 de enero de 2007 .
- ^ Manual de química y física (83.ª edición). CRC Press. 2002.
- ^ Holleman AF, Wiberg E, Wiberg N (2001). Química inorgánica (1ª ed. inglesa). San Diego: Prensa académica. ISBN 978-0-12-352651-9.OCLC 813400418 .
- ^ Eugene F. Rothgery (2004), "Hidrazina y sus derivados", Kirk-Othmer Encyclopedia of Chemical Technology , Nueva York: John Wiley, doi :10.1002/0471238961.0825041819030809.a01.pub2, ISBN 9780471238966
- ^ "Tabla de propiedades químicas peligrosas de la hidracina" (PDF) . NOAA.gov . 1999.
- ^ Audrieth LF, Kleinberg J (1953). Disolventes no acuosos. Nueva York: John Wiley & Sons. pág. 133. LCCN 52-12057.
- ^ Stankovich S, Dikin DA, Piner RD, Kohlhaas KA, Kleinhammes A, Jia Y, Wu Y, Nguyen ST, Ruoff RS (2007). "Síntesis de nanohojas a base de grafeno mediante reducción química de óxido de grafito exfoliado". Carbono . 45 (7): 1558-1565. Código Bib : 2007Carbo..45.1558S. doi :10.1016/j.carbon.2007.02.034. S2CID 14548921.
- ^ "SULFATO DE HIDRACINA". hazard.com . Consultado el 22 de enero de 2019 .
- ^ Gagnon B, Bruera E (mayo de 1998). "Una revisión del tratamiento farmacológico de la caquexia asociada al cáncer". Drugs . 55 (5): 675–88. doi :10.2165/00003495-199855050-00005. PMID 9585863. S2CID 22180434.
- ^ "Diazanedio". CharChem . Consultado el 22 de enero de 2019 .
- ^ Wiley RH, Hexner PE (1951). "3,5-dimetilpirazol". Org. Sintetizador. 31 : 43. doi : 10.15227/orgsyn.031.0043.
- ^ Friedman L, Litle RL, Reichle WR (1960). "P-toluenosulfonilhidrazida". Org. Synth. 40 : 93. doi :10.15227/orgsyn.040.0093.
- ^ Weinshenker NM, Shen CM, Wong JY (1977). "Carbodiimida polimérica. Preparación". Org. Sintetizador. 56 : 95. doi : 10.15227/orgsyn.056.0095.
- ^ Day AC, Whiting MC (1970). "Acetona Hidrazona". Síntesis orgánicas . 50 : 3. doi :10.15227/orgsyn.050.0003.
- ^ Strous M, Jetten MS (2004). "Oxidación anaeróbica de metano y amonio". Annu Rev Microbiol . 58 : 99–117. doi :10.1146/annurev.micro.58.030603.123605. hdl : 2066/60186 . PMID 15487931.
- ^ Handwerk B (9 de noviembre de 2005). «Las bacterias se alimentan de aguas residuales humanas y producen combustible para cohetes». National Geographic . Consultado el 12 de noviembre de 2007 , a través de Wild Singapore.
- ^ Hashida C, Hayashi K, Jie L, Haga S, Sakurai M, Shimizu H (1990). "[Cantidades de agaritina en hongos ( Agaricus bisporus ) y carcinogenicidad de extractos de metanol de hongos en el epitelio de la vejiga del ratón]". Nippon Koshu Eisei Zasshi (en japonés). 37 (6): 400–5. PMID 2132000.
- ^ Sieger AA, ed. (1 de enero de 1998). "Spore Prints #338". Boletín de la Sociedad Micológica de Puget Sound . Consultado el 13 de octubre de 2008 .
- ^ Fischer E (1875). "Über aromatische Hydrazinverbindungen" [Sobre los compuestos aromáticos de hidracina]. Ber. Alemán. Química. Ges. 8 : 589–594. doi :10.1002/cber.187500801178.
- ^ Curtius T (1887). "Über das Diamid (Hidrazina)" [Sobre diamida (hidrazina)]. Ber. Alemán. Química. Ges. 20 : 1632-1634. doi :10.1002/cber.188702001368.
- ^ Curtius T, Jay R (1889). "Diazo- und Azoverbindungen der Fettreihe. IV. Abhandlung. über das Hydrazin" [Compuestos diazo y azo de alcanos. Cuarto tratado. Sobre hidracina]. En Erdmann OL (ed.). Revista para la química práctica . vol. 147. Verlag von Johann Ambrosius Barth.En la pág. 129, Curtius admite: " Das freie Diamid NH 2 -NH 2 ist noch nicht analysiert worden ". [La hidracina libre aún no ha sido analizada .]
- ^ Curtius T, Schulz H (1890). "Über Hydrazinehydrat und die Halogenverbindungen des Diammoniums" [Sobre el hidrato de hidracina y los compuestos halógenos del diamonio]. Revista para la química práctica . vol. 150, págs. 521–549.
- ^ Lobry de Bruyn CA (1894). "Sur l'hidrazina (diamida) libre" [Sobre la hidrazina (diamida) libre]. Reccl. Trav. Chim. País-Bas . 13 (8): 433–440. doi :10.1002/recl.18940130816.
- ^ Lobry de Bruyn CA (1895). "Sur l'hydrate d'hydrazine" [Sobre el hidrato de hidrazina]. Recl. Trav. Chim. Pays-Bas . 14 (3): 85–88. doi :10.1002/recl.18950140302.
- ^ Lobry de Bruyn CA (1896). "L'hydrazine libre I" [Hidrazina libre, Parte 1]. Recl. Trav. Chim. Pays-Bas . 15 (6): 174–184. doi :10.1002/recl.18960150606.
Enlaces externos
- El programa de la noche con Rob! El invitado especial de esta noche: Hydrazine (PDF) – Robert Matunas
- Hidracina – información del producto químico: propiedades, producción, aplicaciones.
- Toxicidad de la hidracina
- CDC – Guía de bolsillo de NIOSH sobre peligros químicos