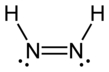Diimida
| |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Diazeno | |||
| Otros nombres Diimida Diimina Dihidridodinitrógeno Azodihidrógeno | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Araña química | |||
| BARRIL | |||
| Malla | Diazeno | ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| H2N2 | |||
| Masa molar | 30,030 g·mol −1 | ||
| Apariencia | Gas amarillo | ||
| Punto de fusión | -80 °C (-112 °F; 193 K) | ||
| Compuestos relacionados | |||
Otros aniones | difluoruro de dinitrógeno de difosfeno | ||
Otros cationes | compuestos azoicos | ||
Azanes binarios relacionados | |||
Compuestos relacionados | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
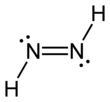
La diimida , también llamada diazeno o diimina , es un compuesto que tiene la fórmula HN=NH. Existe como dos isómeros geométricos , E ( trans ) y Z ( cis ). El término diazeno es más común para los derivados orgánicos de la diimida. Por lo tanto, el azobenceno es un ejemplo de diazeno orgánico.
Síntesis
Una ruta tradicional para obtener diimida implica la oxidación de hidrazina con peróxido de hidrógeno o aire. [1]
- norte 2 h 4 + h 2 o 2 → norte 2 h 2 + 2h 2 o
Alternativamente, la hidrólisis de azodicarboxilato de dietilo o azodicarbonamida produce diimida: [2]
- Et−O 2 C−N=N−CO 2 −Et → HN=NH + 2 CO 2 + 2 HOEt
Actualmente, la diimida se genera por descomposición térmica de 2,4,6-triisopropilbencenosulfonilhidrazida. [3]
Debido a su inestabilidad, la diimida se genera y se utiliza in situ . Se produce una mezcla de los isómeros cis ( Z- ) y trans ( E- ). Ambos isómeros son inestables y experimentan una interconversión lenta. El isómero trans es más estable, pero el isómero cis es el que reacciona con sustratos insaturados, por lo tanto, el equilibrio entre ellos se desplaza hacia el isómero cis debido al principio de Le Chatelier . Algunos procedimientos requieren la adición de ácidos carboxílicos, que catalizan la isomerización cis-trans. [4] La diimida se descompone fácilmente. Incluso a bajas temperaturas, el isómero trans más estable experimenta rápidamente varias reacciones de desproporción, formando principalmente hidrazina y gas nitrógeno : [5]
- 2 HN=NH → H 2 N−NH 2 + norte 2
Debido a esta reacción de descomposición competitiva, las reducciones con diimida normalmente requieren un gran exceso del reactivo precursor.
Aplicaciones a la síntesis orgánica
La diimida es ocasionalmente útil como reactivo en síntesis orgánica . [4] Hidrogena alquenos y alquinos con suministro selectivo de hidrógeno desde una cara del sustrato, lo que da como resultado la misma estereoselectividad que la adición de H2 catalizada por metales . El único coproducto liberado es gas nitrógeno. Aunque el método es engorroso, el uso de diimida evita la necesidad de altas presiones o gas hidrógeno y catalizadores metálicos , que pueden ser costosos. [6] El mecanismo de hidrogenación implica un estado de transición C2H2N2 de seis miembros :
Selectividad
La diimida es ventajosa porque reduce selectivamente los alquenos y alquinos y no es reactiva frente a muchos grupos funcionales que interferirían con la hidrogenación catalítica normal . Por lo tanto, la diimida tolera los peróxidos , haluros de alquilo y tioles , pero estos mismos grupos normalmente se degradarían con catalizadores metálicos. El reactivo reduce preferentemente los alquinos y los alquenos no impedidos o tensos [1] a los alquenos y alcanos correspondientes. [4]
Relacionado
Se calcula que la forma dicatiónica , H−N + ≡N + −H (diazinedio, dinitrógeno diprotonado), tiene el enlace químico más fuerte conocido. Este ion puede considerarse como una molécula de nitrógeno doblemente protonada. El orden de fuerza de enlace relativo (RBSO) es 3,38. [7] F−N+≡N+−H (ion fluorodiazinedio) y F−N + ≡N + −F (ion difluorodiazinedio) tienen enlaces de fuerza ligeramente menor. [7]
En presencia de bases fuertes, la diimida se desprotona para formar el anión pernitruro, N − =N − .
Referencias
- ^ ab Ohno, M.; Okamoto, M. (1973). "cis-Ciclododeceno". Síntesis orgánicas; Volúmenes recopilados , vol. 5, pág. 281.
- ^ Wiberg, E.; Holleman, AF (2001). "1.2.7: Diimina, N2H2". Química Inorgánica . Elsevier . pag. 628.ISBN 9780123526519.
- ^ Chamberlin, A. Richard; Sheppeck, James E.; Somoza, Alvaro (2008). "2,4,6-Triisopropilbencenosulfonilhidrazida". Enciclopedia de reactivos para síntesis orgánica . doi :10.1002/047084289X.rt259.pub2. ISBN 978-0471936237.
- ^ abc Pasto, DJ (2001). "Diimida". Enciclopedia de reactivos para síntesis orgánica . John Wiley & Sons. doi :10.1002/047084289X.rd235. ISBN 0471936235.
- ^ Wiberg, Nils; Holleman, AF; Wiberg, Egon, eds. (2001). "1.2.7 Diimina N 2 H 2 [1.13.17]". Química inorgánica . Academic Press. págs. 628–632. ISBN 978-0123526519.
- ^ Miller, CE (1965). "Hidrogenación con diimida". Revista de educación química . 42 (5): 254–259. Código Bibliográfico :1965JChEd..42..254M. doi :10.1021/ed042p254.
- ^ ab Kalescky, Robert; Kraka, Elfi; Cremer, Dieter (12 de septiembre de 2013). "Identificación de los enlaces más fuertes en química". The Journal of Physical Chemistry A . 117 (36): 8981–8995. Bibcode :2013JPCA..117.8981K. doi :10.1021/jp406200w. PMID 23927609. S2CID 11884042.