Ácido carbámico
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Ácido carbámico [1] | |||
| Otros nombres Ácido aminometanoico | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| BARRIL | |||
| Malla | Ácido carbámico+ | ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| NH3CO2 | |||
| Masa molar | 61,040 g·mol −1 | ||
| Compuestos relacionados | |||
Compuestos relacionados | Formamida Ditiocarbamato Ácido carbónico Urea Carbamato de etilo Ácido sulfámico | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
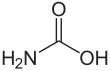
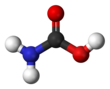
El ácido carbámico , que también puede llamarse ácido aminofórmico o ácido aminocarboxílico , [2] es un compuesto químico con la fórmula H 2 NCOOH . Se puede obtener por reacción de amoniaco NH 3 y dióxido de carbono CO 2 a temperaturas muy bajas, lo que también produce carbamato de amonio [NH 4 ] + [NH 2 CO 2 ] − . El compuesto es estable solo hasta aproximadamente 250 K (−23 °C); a temperaturas más altas se descompone en esos dos gases. [3] El sólido aparentemente consiste en dímeros , con las dos moléculas conectadas por enlaces de hidrógeno entre los dos grupos carboxilo –COOH. [4]
El ácido carbámico podría considerarse tanto una amina como un ácido carboxílico y, por lo tanto, un aminoácido ; [3] sin embargo, la unión del grupo carboxilo –COOH directamente al átomo de nitrógeno (sin ninguna cadena de carbono intermedia) hace que se comporte de manera muy diferente a los aminoácidos con cadena de carbono intermedia. ( La glicina NH 2 CH 2 COOH generalmente se considera el aminoácido más simple). El grupo hidroxilo –OH unido al carbono también lo excluye de la clase de amida .
El término "ácido carbámico" también se utiliza genéricamente para cualquier compuesto de la forma RR′NCOOH, donde R y R′ son grupos orgánicos o hidrógeno. [5]
La desprotonación de un ácido carbámico produce un anión carbamato RR′NCOO − , cuyas sales pueden ser relativamente estables. El término carbamato también se utiliza para los ésteres de ácidos carbámicos, como el carbamato de metilo H 2 N−C(=O)−OCH 3 . El grupo funcional carbamoilo RR′N–C(=O)– (a menudo denotado por Cbm ) es la molécula de ácido carbámico menos la parte OH del carboxilo.
Estructura
El ácido carbámico es una molécula plana. [3]
El grupo H 2 N− del ácido carbámico, a diferencia del de la mayoría de las aminas, no puede protonarse a un grupo amonio H 3 N + − . La forma zwitteriónica H 3 N + −COO − es muy inestable y se descompone rápidamente en amoníaco y dióxido de carbono, [6] sin embargo, hay un informe de su detección en hielos irradiados con protones de alta energía . [3]
Derivados
El ácido carbámico es formalmente el compuesto original de varias familias importantes de compuestos orgánicos:
- ácidos carbámicos
- aniones carbamato
- ésteres de carbamato
Ácidos carbámicos
Muchos ácidos carbámicos sustituidos (RHNCOOH o RR′NCOOH) se pueden sintetizar fácilmente burbujeando dióxido de carbono a través de soluciones de la amina correspondiente ( RNH 2 o RR′NH, respectivamente) en un disolvente apropiado, como DMSO o dióxido de carbono supercrítico . [5] Estos ácidos carbámicos son generalmente inestables a temperatura ambiente y vuelven a la amina original y al dióxido de carbono. [7]
Ésteres de carbamato
A diferencia de los ácidos carbámicos, los ésteres de carbamato son generalmente estables a temperatura ambiente como un estado superior. Se preparan por reacción de cloruros de carbamoilo con alcoholes, la adición de alcoholes a isocianatos y la reacción de ésteres de carbonato con amoníaco. [8] El carbamato de metilo y el carbamato de etilo se encuentran entre los ejemplos más simples y se han utilizado históricamente en la industria textil, ambos son ahora sospechosos de ser carcinógenos. También se conoce el carbamato de bencilo .
Ocurrencia en la naturaleza
La clase de enzimas carbamato quinasa , involucrada en varias vías metabólicas de los organismos vivos, cataliza la formación de fosfato de carbamoilo H 2 N−C(=O)−O−PO2−3:
Un ejemplo importante de una enzima con esta actividad es la carbamoil fosfato sintetasa , por ejemplo, la carbamoil fosfato sintetasa I, que lleva a cabo el primer paso del ciclo de la urea para eliminar el amoníaco residual.
Una molécula de hemoglobina puede transportar cuatro moléculas de dióxido de carbono a los pulmones en forma de grupos carbamato formados por la reacción del CO2 con cuatro grupos amino terminales de la forma desoxi . El compuesto resultante se denomina carbaminohemoglobina .
Usos
Industrial
El ácido carbámico es un intermediario en la producción industrial de urea , que implica la reacción de dióxido de carbono y amoníaco. [9]
- CO2 + NH3 → H2NCOOH
- H 2 NCOOH + NH 3 → CO(NH 2 ) 2 + H 2 O
Médico
Algunos ésteres de carbamato se utilizan como relajantes musculares , entre ellos el emylcamate , el fenprobamato , el estiramato y otros miembros del código ATC M03BA . Estos se unen al sitio barbitúrico del receptor GABA A. [10]
Insecticidas
Se han desarrollado varios insecticidas basados en ácido carbámico; por ejemplo, aldicarb , carbaril y carbofurano . [11]
Síntesis química
Un grupo funcional amina −NH2 puede protegerse de reacciones no deseadas al formarse como residuo de éster carbamato –NHC(=O)–OR. La hidrólisis del enlace éster produce un ácido carbámico –NHC(=O)OH, que luego pierde dióxido de carbono y produce la amina deseada.
Referencias
- ^ Unión Internacional de Química Pura y Aplicada (2014). Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013. The Royal Society of Chemistry . pág. 778. doi :10.1039/9781849733069. ISBN . 978-0-85404-182-4.
- ^ "Resumen de compuestos de PubChem para CID 277, ácido carbámico". Centro Nacional de Información Biotecnológica. 2020. Consultado el 10 de octubre de 2020 .
- ^ abcd RK Khanna y MH Moore (1999): "Ácido carbámico: estructura molecular y espectros IR". Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy , volumen 55, número 5, páginas 961-967. doi :10.1016/S1386-1425(98)00228-5 PMID 10347902 Bibcode :1999AcSpA..55..961K
- ^ JB Bossa, P. Theulé, F. Duvernay, F. Borget y T. Chiavassa (2008): "Formación de ácido carbámico y carbamato en hielos de NH 3 :CO 2 – Irradiación UV versus procesos térmicos". Astronomy and Astrophysics , volumen 492, número 3, páginas 719-724. doi :10.1051/0004-6361:200810536
- ^ ab ZJ Dijkstra, AR Doornbos, H. Weyten, JM Ernsting, CJ Elsevier y JTF Keurentjes (2007): "Formación de ácido carbámico en disolventes orgánicos y dióxido de carbono supercrítico". Journal of Supercritical Fluids , volumen 41, número 1, páginas 109-114. doi :10.1016/j.supflu.2006.08.012
- ^ Y.-J. Chen, M. Nuevo, J.-M. Hsieh, T.-S. Yih, W.-H. Sun, W.-H. Ip, H.-S. Fung, S.-Y. Chiang, Y.-Y. Lee, J.-M. Chen y C.-YR Wu (2007): "Ácido carbámico producido por la irradiación UV/EUV de análogos de hielo interestelar". Astronomy and Astrophysics , volumen 464, número 1, páginas 253-257. doi :10.1051/0004-6361:20066631
- ^ Lemke, Thomas L. (2003). Revisión de grupos funcionales orgánicos: Introducción a la química orgánica medicinal. Filadelfia, PA: Lippincott, Williams & Wilkins. p. 63. ISBN 978-0-7817-4381-5.
- ^ Jäger, Peter; Rentzea, Costin N.; Kieczka, Heinz (2000). "Carbamatos y cloruros de carbamoilo". Ullmann's Encyclopedia of Industrial Chemistry . doi :10.1002/14356007.a05_051. ISBN 3527306730.
- ^ Meessen, JH; Petersen, H. "Urea". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a27_333. ISBN 978-3527306732.
- ^ Block, John H.; Beale, John M., eds. (2004). "Depresor del sistema nervioso central". Wilson and Gisvold's Textbook of Organic Medicinal and Pharmaceutical Chemistry . Filadelfia, PA: Lippincott, Williams & Wilkins. pág. 495. ISBN 978-0-7817-3481-3.
- ^ Risher, John F.; Mink, Franklin L.; Stara, Jerry F. (1987). "Los efectos toxicológicos del insecticida carbamato aldicarb en mamíferos: una revisión". Environmental Health Perspectives . 72 : 267–281. doi :10.2307/3430304. JSTOR 3430304. PMC 1474664 . PMID 3304999.