Yoduro de hidrógeno
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Yoduro de hidrógeno | |
| Nombre sistemático de la IUPAC Yodano | |
| Otros nombres Ácido yodhídrico (solución acuosa) Hidruro de yodo | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.030.087 |
| Número CE |
|
| BARRIL |
|
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 1787 2197 |
Panel de control CompTox ( EPA ) |
|
| Propiedades | |
| HOLA | |
| Masa molar | 127,912 g·mol −1 |
| Apariencia | Gas incoloro |
| Olor | acre |
| Densidad | 2,85 g/ml (−47 °C) |
| Punto de fusión | -50,80 °C (-59,44 °F; 222,35 K) |
| Punto de ebullición | -35,36 °C (-31,65 °F; 237,79 K) |
| aproximadamente 245 g/100 ml | |
| Acidez (p K a ) | −10 (en agua, estimación); [1] −9,5 (±1,0) [2] 2.8 (en acetonitrilo) [3] |
| Ácido conjugado | Yodonio |
| Base conjugada | Yoduro |
Índice de refracción ( n D ) | 1.466 (16 °C) [4] |
| Estructura | |
| Término | |
| 0,38 D | |
| Termoquímica [4] | |
Capacidad calorífica ( C ) | 29,2 J·mol −1 ·K −1 |
Entropía molar estándar ( S ⦵ 298 ) | 206,6 J·mol −1 ·K −1 |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | 26,5 kJ·mol −1 |
Energía libre de Gibbs (Δ f G ⦵ ) | 1,7 kJ·mol −1 |
Entalpía de fusión (Δ f H ⦵ fus ) | 2,87 kJ·mol −1 |
Entalpía de vaporización (Δ f H vap ) | 17,36 kJ·mol −1 |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Tóxico, corrosivo, nocivo e irritante. |
| Etiquetado SGA : | |
  | |
| Peligro | |
| H302 , H314 | |
| P260 , P264 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P363 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | Ininflamable |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 345 mg/kg (rata, vía oral) [5] |
| Ficha de datos de seguridad (FDS) | yoduro de hidrógeno |
| Compuestos relacionados | |
Otros aniones | Fluoruro de hidrógeno Cloruro de hidrógeno Bromuro de hidrógeno Astaturo de hidrógeno |
| Página de datos complementarios | |
| Yoduro de hidrógeno (página de datos) | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El yoduro de hidrógeno (HI) es una molécula diatómica y un haluro de hidrógeno . Las soluciones acuosas de HI se conocen como ácido yodhídrico o ácido yodhídrico, un ácido fuerte . Sin embargo, el yoduro de hidrógeno y el ácido yodhídrico se diferencian en que el primero es un gas en condiciones estándar , mientras que el otro es una solución acuosa del gas . Son interconvertibles. El HI se utiliza en síntesis orgánica e inorgánica como una de las principales fuentes de yodo y como agente reductor .
Propiedades del yoduro de hidrógeno
El HI es un gas incoloro que reacciona con el oxígeno para formar agua y yodo. Con aire húmedo, el HI produce una niebla (o vapores) de ácido yodhídrico. Es excepcionalmente soluble en agua, lo que produce ácido yodhídrico. Un litro de agua disolverá 425 litros de gas HI, y la solución más concentrada tiene solo cuatro moléculas de agua por molécula de HI. [6]
Ácido yodhídrico
El ácido yodhídrico no es yoduro de hidrógeno puro, sino una mezcla que lo contiene. El ácido yodhídrico "concentrado" comercial suele contener entre un 48 y un 57 % de HI en masa. La solución forma un azeótropo que hierve a 127 °C con un 57 % de HI y un 43 % de agua. La alta acidez se debe a la dispersión de la carga iónica sobre el anión. El radio del ion yoduro es mucho mayor que el de otros haluros comunes , lo que hace que la carga negativa se disperse en un espacio grande. Por el contrario, un ion cloruro es mucho más pequeño, lo que significa que su carga negativa está más concentrada, lo que conduce a una interacción más fuerte entre el protón y el ion cloruro. Esta interacción H + ···I − más débil en HI facilita la disociación del protón del anión y es la razón por la que HI es el ácido más fuerte de los hidrohaluros.
- HI (g) + H 2 O (l) → H 3 O + (ac) + I − (ac) K a ≈ 10 10
- HBr (g) + H 2 O (l) → H 3 O + (ac) + Br − (ac) K a ≈ 10 9
- HCl (g) + H 2 O (l) → H 3 O + (ac) + Cl − (ac) K a ≈ 10 6
Síntesis
La preparación industrial de HI implica la reacción de I 2 con hidrazina , que también produce gas nitrógeno : [7]
- 2I2 + N2H4 → 4HI + N2
Cuando se realiza en agua, el HI debe ser destilado .
El HI también se puede destilar a partir de una solución de NaI u otro yoduro alcalino en ácido fosfórico concentrado (tenga en cuenta que el ácido sulfúrico concentrado no funcionará para acidificar yoduros, ya que oxidará el yoduro a yodo elemental).
Otra forma de preparar HI es burbujeando vapor de sulfuro de hidrógeno a través de una solución acuosa de yodo, formando ácido yodhídrico (que se destila) y azufre elemental (que se filtra): [8]
- H2S +I2 → 2HI +S
Además, el HI se puede preparar simplemente combinando H2 e I2 : esta es una reacción reversible (usando condiciones de 250 °C).
- H2 + I2 → 2HI
Este método se emplea generalmente para generar muestras de alta pureza.
Durante muchos años, se consideró que esta reacción implicaba una reacción bimolecular simple entre moléculas de H 2 e I 2 . Sin embargo, cuando una mezcla de gases se irradia con una longitud de onda de luz igual a la energía de disociación de I 2 , aproximadamente 578 nm, la velocidad aumenta significativamente. Esto respalda un mecanismo por el cual el I 2 primero se disocia en 2 átomos de yodo, que se unen cada uno a un lado de una molécula de H 2 y rompen el enlace H−H : [9]
- H 2 + I 2 + ( radiación de 578 nm) → H 2 + 2I → I···H···H···I → 2HI
En el laboratorio, otro método implica la hidrólisis de PI 3 , el análogo yodo del PBr 3 . En este método, el I 2 reacciona con el fósforo para crear triyoduro de fósforo , que luego reacciona con agua para formar HI y ácido fosforoso :
- 3 I 2 + 2 P + 6 H 2 O → 2 PI 3 + 6 H 2 O → 6 HI + 2 H 3 PO 3
Reacciones y aplicaciones clave
Las soluciones de yoduro de hidrógeno se oxidan fácilmente por el aire:
- 4HI+ O2 → 2H2O + 2I2
- Hola + yo 2 ⇌ Hola 3 [10]
HI 3 es de color marrón oscuro, lo que hace que las soluciones envejecidas de HI a menudo parezcan de color marrón oscuro.
Al igual que HBr y HCl, el HI se agrega a los alquenos : [11]
- HI + H2C = CH2 → H3CCH2I
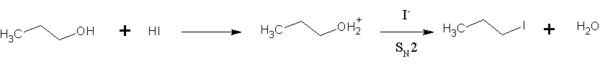
El HI también se utiliza en química orgánica para convertir alcoholes primarios en yoduros de alquilo . [12] Esta reacción es una sustitución S N 2 , en la que el ion yoduro reemplaza al grupo hidroxilo "activado" (agua):
Se prefiere el HI a otros haluros de hidrógeno porque el ion yoduro es un nucleófilo mucho mejor que el bromuro o el cloruro, por lo que la reacción puede tener lugar a una velocidad razonable sin mucho calentamiento. Esta reacción también ocurre con los alcoholes secundarios y terciarios, pero la sustitución se produce a través de la vía S N 1 .
El HI (o HBr ) también se puede utilizar para escindir éteres en yoduros de alquilo y alcoholes, en una reacción similar a la sustitución de alcoholes. Este tipo de escisión es importante porque se puede utilizar para convertir un éter químicamente estable [12] e inerte en especies más reactivas. En este ejemplo, el éter dietílico se escinde en etanol y yodoetano:
La reacción es regioselectiva , ya que el yoduro tiende a atacar al carbono del éter menos impedido estéricamente . Si se utiliza un exceso de HI, el alcohol formado en esta reacción se convertirá en un segundo equivalente de yoduro de alquilo, como en la conversión de alcoholes primarios en yoduros de alquilo.
El HI está sujeto a las mismas pautas de Markovnikov y anti-Markovnikov que el HCl y el HBr.
Aunque es duro para los estándares modernos, el HI se empleó comúnmente como agente reductor desde el principio de la historia de la química orgánica. Los químicos del siglo XIX intentaron preparar ciclohexano mediante la reducción del benceno con HI a altas temperaturas, pero en su lugar aislaron el producto reorganizado, metilciclopentano ( véase el artículo sobre ciclohexano ). Como informó por primera vez Kiliani, [13] la reducción de azúcares y otros polioles con ácido yodhídrico da como resultado la escisión reductora de varios o incluso todos los grupos hidroxi, aunque a menudo con un bajo rendimiento y/o reproducibilidad. [14] En el caso de los alcoholes bencílicos y los alcoholes con grupos α-carbonilo, la reducción con HI puede proporcionar rendimientos sintéticamente útiles del producto hidrocarbonado correspondiente ( ROH + 2HI → RH + H 2 O + I 2 ). [11] Este proceso se puede hacer catalítico en HI utilizando fósforo rojo para reducir el I 2 formado . [15]
Véase también
Referencias
- ^ Bell, RP El protón en la química . 2.ª ed., Cornell University Press, Ithaca, NY, 1973 .
- ^ Trummal, A.; Lipping, L.; Kaljurand, I.; Koppel, IA; Leito, I. "Acidez de ácidos fuertes en agua y dimetilsulfóxido" J. Phys. Chem. A. 2016 , 120 , 3663-3669. doi :10.1021/acs.jpca.6b02253
- ^ Raamat, E.; Kaupmees, K.; Ovsjannikov, G.; Trummal, A.; Kutt, A.; Samé, J.; Koppel, I.; Kaljurand, I.; Labios, L.; Rodima, T.; Pihl, V.; Koppel, IA; Leito, I. "Acidez de ácidos de Brønsted neutros fuertes en diferentes medios". J. Física. Org. química . 2013 , 26 , 162-170. doi :10.1002/poc.2946
- ^ ab Manual de química y física del CRC: un libro de referencia rápida de datos químicos y físicos. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97.ª ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint: falta la ubicación del editor ( enlace ) CS1 maint: otros ( enlace ) - ^ Yoduro de hidrógeno: toxicidad
- ^ Holleman, AF; Wiberg, E. "Química inorgánica" Academic Press: San Diego, 2001. ISBN 0-12-352651-5 .
- ^ Greenwood, NN y A. Earnshaw. La química de los elementos . 2.ª ed. Oxford: Butterworth-Heineman. págs. 809–815. 1997.
- ^ Joseph Louis Gay-Lussac (1815), "Una memoria sobre el yodo", Anales de filosofía , 5 : 101
- ^ Holleman, AF Wiberg, E. Química inorgánica . San Diego: Academic Press. pág. 371, 432–433. 2001.
- ^ Magnuson, JA; Wolfenden, JH (1 de diciembre de 1956). «Triyoduro de hidrógeno». Journal of Physical Chemistry . 60 (12): 1665–1666. doi :10.1021/j150546a021 . Consultado el 26 de mayo de 2022 .
- ^ ab Breton, GW, PJ Kropp, PJ; Harvey, RG "Yoduro de hidrógeno" en Enciclopedia de reactivos para síntesis orgánica (Ed: L. Paquette) 2004, J. Wiley & Sons, Nueva York. doi :10.1002/047084289X.
- ^ ab Bruice, Paula Yurkanis. Química orgánica, 4.ª ed. Prentice Hall: Upper Saddle River, N. J., 2003, págs. 438–439, 452.
- ^ Kiliani, Heinrich (1 de enero de 1886). "Ueber die Constitution der Dextrosecarbonsäure". Berichte der Deutschen Chemischen Gesellschaft . 19 (1): 1128-1130. doi :10.1002/cber.188601901251. ISSN 1099-0682.
- ^ Perlin, AS; Purves, CB (1 de marzo de 1953). "Reducción de Kiliani de cianohidrinas de glucosa y fructosa a los correspondientes ácidos heptanoicos y lactonas". Revista Canadiense de Química . 31 (3): 227–236. doi : 10.1139/v53-033 . ISSN 0008-4042.
- ^ Dobmeier, Michael; Herrmann, Josef M; Lenoir, Dieter; König, Burkhard (2012-03-02). "Reducción de alcoholes bencílicos y compuestos α-hidroxicarbonílicos mediante ácido yodhídrico en un medio de reacción bifásico". Beilstein Journal of Organic Chemistry . 8 (1): 330–336. doi :10.3762/bjoc.8.36. PMC 3302097 . PMID 22423302.
Enlaces externos
- Ficha internacional de seguridad química 1326 - Yoduro de hidrógeno