Plutonio
El plutonio es un elemento químico ; su símbolo es Pu y su número atómico es 94. Es un metal actínido de color gris plateado que se empaña cuando se expone al aire y forma una capa opaca cuando se oxida . El elemento normalmente presenta seis alótropos y cuatro estados de oxidación . Reacciona con carbono , halógenos , nitrógeno , silicio e hidrógeno . Cuando se expone al aire húmedo, forma óxidos e hidruros que pueden expandir la muestra hasta un 70% en volumen, que a su vez se desprende en forma de polvo pirofórico . Es radiactivo y puede acumularse en los huesos , lo que hace que la manipulación del plutonio sea peligrosa.
El plutonio se sintetizó y aisló por primera vez a finales de 1940 y principios de 1941, mediante el bombardeo con deuterones del uranio-238 en el ciclotrón de 1,5 metros (60 pulgadas) de la Universidad de California, Berkeley . Primero se sintetizó el neptunio-238 ( vida media de 2,1 días), que luego se desintegró para formar el nuevo elemento con número atómico 94 y peso atómico 238 (vida media de 88 años). Dado que el uranio había recibido el nombre del planeta Urano y el neptunio del planeta Neptuno , el elemento 94 recibió el nombre de Plutón , que en ese momento también se consideraba un planeta. El secreto de la guerra impidió que el equipo de la Universidad de California publicara su descubrimiento hasta 1948.
El plutonio es el elemento con el mayor número atómico que se conoce en la naturaleza. En los depósitos naturales de uranio se forman trazas de este elemento cuando el uranio-238 captura neutrones emitidos por la desintegración de otros átomos de uranio-238. El isótopo pesado plutonio-244 tiene una vida media lo suficientemente larga como para que en cantidades traza extremas se haya podido conservar desde el principio (desde la formación de la Tierra) hasta el presente, pero hasta ahora los experimentos no han sido lo suficientemente sensibles como para detectarlo.
Tanto el plutonio-239 como el plutonio-241 son fisionables , lo que significa que pueden sostener una reacción nuclear en cadena , lo que lleva a aplicaciones en armas nucleares y reactores nucleares . El plutonio-240 tiene una alta tasa de fisión espontánea , lo que aumenta el flujo de neutrones de cualquier muestra que lo contenga. La presencia de plutonio-240 limita la utilidad de una muestra de plutonio para armas o su calidad como combustible para reactores, y el porcentaje de plutonio-240 determina su grado ( grado para armas , grado para combustible o grado para reactores). El plutonio-238 tiene una vida media de 87,7 años y emite partículas alfa . Es una fuente de calor en generadores termoeléctricos de radioisótopos , que se utilizan para impulsar algunas naves espaciales . Los isótopos de plutonio son caros e incómodos de separar, por lo que los isótopos particulares generalmente se fabrican en reactores especializados.
La producción de plutonio en cantidades útiles por primera vez fue una parte importante del Proyecto Manhattan durante la Segunda Guerra Mundial , que desarrolló las primeras bombas atómicas. Las bombas Fat Man utilizadas en la prueba nuclear Trinity en julio de 1945 y en el bombardeo de Nagasaki en agosto de 1945 tenían núcleos de plutonio . Los experimentos de radiación humana para estudiar el plutonio se llevaron a cabo sin consentimiento informado y después de la guerra se produjeron varios accidentes de criticidad , algunos letales. La eliminación de residuos de plutonio de las centrales nucleares y de las armas nucleares desmanteladas construidas durante la Guerra Fría es una preocupación ambiental y de proliferación nuclear . Otras fuentes de plutonio en el medio ambiente son las partículas radiactivas de muchas pruebas nucleares sobre la superficie, que ahora están prohibidas .
Características
Propiedades físicas
El plutonio, como la mayoría de los metales, tiene un aspecto plateado brillante al principio, muy parecido al níquel , pero se oxida muy rápidamente a un gris opaco, aunque también se han reportado amarillo y verde oliva. [4] [5] A temperatura ambiente, el plutonio está en su forma α ( alfa ) . Este alótropo es casi tan duro y quebradizo como el hierro fundido gris . Cuando el plutonio se alea con otros metales, el alótropo δ de alta temperatura se estabiliza a temperatura ambiente, [6] [7] haciéndolo blando y dúctil. A diferencia de la mayoría de los metales, no es un buen conductor de calor o electricidad . Tiene un punto de fusión bajo (640 °C, 1184 °F) y un punto de ebullición inusualmente alto (3228 °C, 5842 °F). [4] Esto da un amplio rango de temperaturas (más de 2500 kelvin de ancho) en las que el plutonio es líquido, pero este rango no es el mayor entre todos los actínidos ni entre todos los metales, [8] y se cree que el neptunio tiene el rango más grande en ambos casos. El bajo punto de fusión, así como la reactividad del metal nativo en comparación con el óxido, hace que los óxidos de plutonio sean una forma preferida para aplicaciones como combustible para reactores de fisión nuclear ( combustible MOX ).
La desintegración alfa , la liberación de un núcleo de helio de alta energía , es la forma más común de desintegración radiactiva del plutonio. [9] Una masa de 5 kg de 239 Pu contiene aproximadamente12,5 × 10 24 átomos. Con una vida media de 24.100 años, aproximadamente11,5 × 10 12 de sus átomos se desintegran cada segundo emitiendo una partícula alfa de 5,157 MeV . Esto equivale a 9,68 vatios de potencia. El calor producido por la desaceleración de estas partículas alfa hace que esté caliente al tacto. [10] [11] 238
Debido a su vida media mucho más corta, el Pu se calienta a temperaturas mucho más altas y brilla al rojo vivo con radiación de cuerpo negro si se lo deja sin calentamiento ni enfriamiento externo. Este calor se ha utilizado en generadores termoeléctricos de radioisótopos (ver más abajo).
La resistividad del plutonio a temperatura ambiente es muy alta para un metal, y se vuelve aún más alta con temperaturas más bajas, lo cual es inusual para los metales. [12] Esta tendencia continúa hasta 100 K , por debajo del cual la resistividad disminuye rápidamente para muestras frescas. [12] La resistividad luego comienza a aumentar con el tiempo alrededor de 20 K debido al daño por radiación, con la velocidad dictada por la composición isotópica de la muestra. [12]
Debido a la autoirradiación, una muestra de plutonio se fatiga en toda su estructura cristalina, lo que significa que la disposición ordenada de sus átomos se ve alterada por la radiación con el tiempo. [13] La autoirradiación también puede provocar un recocido que contrarresta algunos de los efectos de la fatiga a medida que la temperatura aumenta por encima de los 100 K. [14]
A diferencia de la mayoría de los materiales, el plutonio aumenta su densidad cuando se funde, en un 2,5%, pero el metal líquido exhibe una disminución lineal en su densidad con la temperatura. [12] Cerca del punto de fusión, el plutonio líquido tiene una viscosidad y una tensión superficial muy altas en comparación con otros metales. [13]
Alótropos
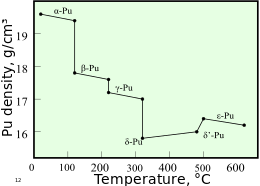
El plutonio normalmente tiene seis alótropos y forma un séptimo (zeta, ζ) a alta temperatura dentro de un rango de presión limitado. [15] Estos alótropos, que son diferentes modificaciones estructurales o formas de un elemento, tienen energías internas muy similares pero densidades y estructuras cristalinas significativamente variables . Esto hace que el plutonio sea muy sensible a los cambios de temperatura, presión o química, y permite cambios dramáticos de volumen después de las transiciones de fase de una forma alotrópica a otra. [13] Las densidades de los diferentes alótropos varían de 16,00 g/cm 3 a 19,86 g/cm 3 . [16]
La presencia de estos numerosos alótropos hace que el mecanizado del plutonio sea muy difícil, ya que cambia de estado muy fácilmente. Por ejemplo, la forma α existe a temperatura ambiente en el plutonio sin alear. Tiene características de mecanizado similares al hierro fundido , pero cambia a la forma β ( beta ) plástica y maleable a temperaturas ligeramente más altas. [17] Las razones del complicado diagrama de fases no se comprenden por completo. La forma α tiene una estructura monoclínica de baja simetría , de ahí su fragilidad, resistencia, compresibilidad y mala conductividad térmica. [15]
El plutonio en la forma δ ( delta ) normalmente existe en el rango de 310 °C a 452 °C pero es estable a temperatura ambiente cuando se alea con un pequeño porcentaje de galio , aluminio o cerio , lo que mejora la trabajabilidad y permite soldarlo . [ 17] La forma δ tiene un carácter metálico más típico y es aproximadamente tan fuerte y maleable como el aluminio. [15] En las armas de fisión, las ondas de choque explosivas utilizadas para comprimir un núcleo de plutonio también causarán una transición del plutonio de fase δ habitual a la forma α más densa, lo que ayuda significativamente a lograr la supercriticidad . [ cita requerida ] La fase ε, el alótropo sólido de temperatura más alta, exhibe una autodifusión atómica anómalamente alta en comparación con otros elementos. [13]
Fisión nuclear
El plutonio es un metal actínido radiactivo cuyo isótopo , el plutonio-239 , es uno de los tres isótopos fisionables primarios ( el uranio-233 y el uranio-235 son los otros dos); el plutonio-241 también es altamente fisionable. Para ser considerado fisionable, el núcleo atómico de un isótopo debe ser capaz de fragmentarse o fisionarse cuando es golpeado por un neutrón de movimiento lento y liberar suficientes neutrones adicionales para sostener la reacción nuclear en cadena mediante la división de más núcleos. [18]
El plutonio-239 puro puede tener un factor de multiplicación (k eff ) mayor que uno, lo que significa que si el metal está presente en cantidad suficiente y con una geometría apropiada (por ejemplo, una esfera de tamaño suficiente), puede formar una masa crítica . [19] Durante la fisión, una fracción de la energía de enlace nuclear , que mantiene unido a un núcleo, se libera como una gran cantidad de energía electromagnética y cinética (gran parte de esta última se convierte rápidamente en energía térmica). La fisión de un kilogramo de plutonio-239 puede producir una explosión equivalente a 21.000 toneladas de TNT (88.000 GJ ). Es esta energía la que hace que el plutonio-239 sea útil en armas nucleares y reactores . [10]
La presencia del isótopo plutonio-240 en una muestra limita su potencial como bomba nuclear, ya que el 240 Pu tiene una tasa de fisión espontánea relativamente alta (~440 fisiones por segundo por gramo; más de 1000 neutrones por segundo por gramo), [20] lo que aumenta los niveles de neutrones de fondo y, por lo tanto, aumenta el riesgo de predetonación . [21] El plutonio se identifica como de grado armamentístico , de grado combustible o de grado reactor según el porcentaje de 240 Pu que contiene. El plutonio de grado armamentístico contiene menos del 7 % de 240 Pu. El plutonio de grado combustible contiene entre un 7 % y un 19 %, y el de grado reactor de potencia contiene un 19 % o más de 240 Pu. El plutonio de supergrado , con menos del 4 % de 240 Pu, se utiliza en las armas de la Armada de los EE. UU. almacenadas cerca de las tripulaciones de los barcos y submarinos, debido a su menor radiactividad. [22] El plutonio-238 no es fisible, pero puede experimentar fisión nuclear fácilmente con neutrones rápidos , así como desintegración alfa. [10] Todos los isótopos del plutonio pueden "criarse" en material fisible con una o más absorciones de neutrones , ya sea seguidas de desintegración beta o no. Esto hace que los isótopos no fisibles del plutonio sean un material fértil .
Isótopos y nucleosíntesis
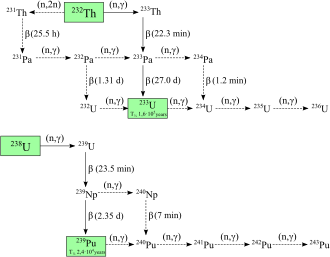
Se han caracterizado veintiún radioisótopos del plutonio, desde el 227 Pu hasta el 247 Pu. Los de vida media más larga son el 244 Pu, con una vida media de 80,8 millones de años; el 242 Pu, con una vida media de 373.300 años; y el 239 Pu, con una vida media de 24.110 años. Todos los demás isótopos tienen vidas medias inferiores a 7.000 años. Este elemento también tiene ocho estados metaestables , aunque todos tienen vidas medias inferiores a un segundo. [9] El 244 Pu se ha encontrado en el espacio interestelar [23] y tiene la vida media más larga de todos los radioisótopos no primordiales. Los principales modos de desintegración de los isótopos con números másicos inferiores al isótopo más estable, el 244 Pu, son la fisión espontánea y la emisión alfa , formando principalmente isótopos de uranio (92 protones ) y neptunio (93 protones) como productos de desintegración (sin tener en cuenta la amplia gama de núcleos hijos creados por los procesos de fisión). El principal modo de desintegración de los isótopos más pesados que el 244 Pu, junto con el 241 Pu y el 243 Pu, es la emisión beta , formando isótopos de americio (95 protones). El plutonio-241 es el isótopo progenitor de la serie del neptunio , que se desintegra en americio-241 mediante emisión beta. [9] [24]
El plutonio-238 y 239 son los isótopos más ampliamente sintetizados. [10] El 239 Pu se sintetiza a través de la siguiente reacción utilizando uranio (U) y neutrones (n) mediante desintegración beta (β − ) con neptunio (Np) como intermediario: [25]
Los neutrones de la fisión del uranio-235 son capturados por los núcleos de uranio-238 para formar uranio-239; una desintegración beta convierte un neutrón en un protón para formar neptunio-239 (vida media de 2,36 días) y otra desintegración beta forma plutonio-239. [26] Egon Bretscher, trabajando en el proyecto British Tube Alloys , predijo esta reacción teóricamente en 1940. [27]
El plutonio-238 se sintetiza bombardeando uranio-238 con deuterones (D o 2 H, los núcleos del hidrógeno pesado ) en la siguiente reacción: [28]
donde un deuterón que choca con el uranio-238 produce dos neutrones y neptunio-238, que se desintegra emitiendo partículas beta negativas para formar plutonio-238. [29] El plutonio-238 también se puede producir mediante la irradiación con neutrones del neptunio-237 . [30]
Calor de desintegración y propiedades de fisión
Los isótopos de plutonio sufren una desintegración radiactiva, que produce calor de desintegración . Los distintos isótopos producen distintas cantidades de calor por masa. El calor de desintegración suele expresarse en vatios/kilogramo o milivatios/gramo. En piezas de plutonio de mayor tamaño (por ejemplo, un foso de armas) y con una eliminación inadecuada del calor, el autocalentamiento resultante puede ser significativo.
| Isótopo | Modo de decadencia | Vida media (años) | Calor de desintegración (W/kg) | Neutrones de fisión espontánea (FS) (1/(g·s)) | Comentario |
|---|---|---|---|---|---|
| 238 Pu | alfa (α) a 234 U | 87,74 | 560 | 2600 | Calor de desintegración muy elevado. Incluso pequeñas cantidades pueden provocar un calentamiento espontáneo significativo. Se utiliza por sí solo en generadores termoeléctricos de radioisótopos . |
| 239 Pu | α a 235 U | 24100 | 1.9 | 0,022 | El principal isótopo fisible en uso. |
| 240 Pu | α a 236 U , SF | 6560 | 6.8 | 910 | La principal impureza en muestras de 239 Pu. El grado de plutonio se indica generalmente como porcentaje de 240 Pu. La alta tasa de SF dificulta su uso en armas nucleares. |
| 241 Pu | beta-menos, hasta 241 Am | 14.4 | 4.2 | 0,049 | Se desintegra en americio-241; su acumulación presenta un riesgo de radiación en muestras más antiguas. |
| 242 Pu | α a 238 U | 376000 | 0,1 | 1700 | 242 Pu α-se desintegra a 238 U; también se desintegra por SF. |
Compuestos y química

A temperatura ambiente, el plutonio puro es de color plateado, pero se oscurece cuando se oxida. [32] El elemento muestra cuatro estados de oxidación iónica comunes en solución acuosa y uno raro: [16]
- Pu(III), como Pu 3+ (lavanda azul)
- Pu(IV), como Pu 4+ (marrón amarillento)
- Pu(V), como PuO+
2(rosa claro) [nota 1] - Pu(VI), como PuO2+
2(naranja rosa) - Pu(VII), como PuO3−
5(verde)—el ion heptavalente es raro.
El color que muestran las soluciones de plutonio depende tanto del estado de oxidación como de la naturaleza del anión ácido . [34] Es el anión ácido el que influye en el grado de complejación —cómo se conectan los átomos a un átomo central— de las especies de plutonio. Además, el estado de oxidación formal +2 del plutonio se conoce en el complejo [K(2.2.2-criptando)] [Pu II Cp″ 3 ], Cp″ = C 5 H 3 (SiMe 3 ) 2 . [35]
También es posible un estado de oxidación +8 en el tetróxido volátil PuO
4. [36] Aunque se descompone fácilmente a través de un mecanismo de reducción similar al FeO
4, PuO
4Puede estabilizarse en soluciones alcalinas y cloroformo . [37] [36]
El plutonio metálico se produce al reaccionar tetrafluoruro de plutonio con bario , calcio o litio a 1200 °C. [38] El plutonio metálico es atacado por ácidos , oxígeno y vapor, pero no por álcalis , y se disuelve fácilmente en ácidos clorhídrico , yodhídrico y perclórico concentrados . [39] El metal fundido debe mantenerse al vacío o en una atmósfera inerte para evitar la reacción con el aire. [17] A 135 °C, el metal se encenderá en el aire y explotará si se coloca en tetracloruro de carbono . [40]

El plutonio es un metal reactivo. En aire húmedo o argón húmedo , el metal se oxida rápidamente, produciendo una mezcla de óxidos e hidruros . [4] Si el metal se expone durante un tiempo suficiente a una cantidad limitada de vapor de agua, se forma una capa superficial en polvo de PuO 2 . [4] También se forma hidruro de plutonio , pero un exceso de vapor de agua forma solo PuO 2 . [39]
El plutonio muestra velocidades de reacción enormes y reversibles con hidrógeno puro, formando hidruro de plutonio . [13] También reacciona fácilmente con oxígeno, formando PuO y PuO 2 , así como óxidos intermedios; el óxido de plutonio llena un 40% más de volumen que el plutonio metálico. El metal reacciona con los halógenos , dando lugar a compuestos con la fórmula general PuX 3 donde X puede ser F , Cl , Br o I y también se observa PuF 4 . Se observan los siguientes oxihaluros: PuOCl, PuOBr y PuOI. Reaccionará con carbono para formar PuC , nitrógeno para formar PuN y silicio para formar PuSi 2 . [16] [40]
La química organometálica de los complejos de plutonio es típica de las especies de organoactínidos ; un ejemplo característico de un compuesto de organoplutonio es el plutonoceno . [26] [41] Los métodos de química computacional indican un carácter covalente mejorado en el enlace plutonio-ligando. [13] [41]
Los polvos de plutonio, sus hidruros y ciertos óxidos como el Pu2O3 son pirofóricos , lo que significa que pueden encenderse espontáneamente a temperatura ambiente y, por lo tanto, se manipulan en una atmósfera inerte y seca de nitrógeno o argón. El plutonio a granel se enciende solo cuando se calienta por encima de los 400 °C. El Pu2O3 se calienta espontáneamente y se transforma en PuO2 , que es estable en aire seco, pero reacciona con vapor de agua cuando se calienta. [42]
Los crisoles que se utilizan para contener plutonio deben ser capaces de soportar sus propiedades fuertemente reductoras . Los metales refractarios como el tantalio y el tungsteno, junto con los óxidos, boruros , carburos , nitruros y siliciuros más estables , pueden tolerar esto. La fusión en un horno de arco eléctrico se puede utilizar para producir pequeños lingotes del metal sin la necesidad de un crisol. [17]
El cerio se utiliza como simulador químico del plutonio para el desarrollo de tecnologías de contención, extracción y otras. [43]
Estructura electrónica
El plutonio es un elemento en el que los electrones 5f son la frontera de transición entre deslocalizado y localizado; por lo tanto, se considera uno de los elementos más complejos. [44] El comportamiento anómalo del plutonio se debe a su estructura electrónica. La diferencia de energía entre las subcapas 6d y 5f es muy baja. El tamaño de la capa 5f es justo el suficiente para permitir que los electrones formen enlaces dentro de la red, en el límite entre el comportamiento localizado y el comportamiento de enlace. La proximidad de los niveles de energía conduce a múltiples configuraciones electrónicas de baja energía con niveles de energía casi iguales. Esto conduce a configuraciones competitivas 5f n 7s 2 y 5f n−1 6d 1 7s 2 , lo que causa la complejidad de su comportamiento químico. La naturaleza altamente direccional de los orbitales 5f es responsable de los enlaces covalentes direccionales en las moléculas y complejos de plutonio. [13]
Aleaciones
El plutonio puede formar aleaciones y compuestos intermedios con la mayoría de los demás metales. Las excepciones incluyen litio, sodio , potasio , rubidio y cesio de los metales alcalinos ; y magnesio , calcio, estroncio y bario de los metales alcalinotérreos ; y europio e iterbio de los metales de tierras raras . [39] Las excepciones parciales incluyen los metales refractarios cromo , molibdeno , niobio , tantalio y tungsteno, que son solubles en plutonio líquido, pero insolubles o solo ligeramente solubles en plutonio sólido. [39] El galio, el aluminio, el americio, el escandio y el cerio pueden estabilizar el plutonio en fase δ a temperatura ambiente. El silicio , el indio , el zinc y el circonio permiten la formación del estado δ metaestable cuando se enfrían rápidamente. Las altas cantidades de hafnio , holmio y talio también permiten cierta retención de la fase δ a temperatura ambiente. El neptunio es el único elemento que puede estabilizar la fase α a temperaturas más altas. [13]
Las aleaciones de plutonio se pueden producir añadiendo un metal al plutonio fundido. Si el metal de aleación es lo suficientemente reductor, se puede añadir plutonio en forma de óxidos o haluros. La aleación de plutonio-galio (PGA) de fase δ y la aleación de plutonio-aluminio se producen añadiendo fluoruro de Pu(III) al galio o al aluminio fundidos, lo que tiene la ventaja de evitar el contacto directo con el metal plutonio altamente reactivo. [45]
- El PGA se utiliza para estabilizar la fase δ del plutonio, evitando los problemas relacionados con la fase α y α–δ. Su principal uso es en fosos de bombas de implosión . [46]
- El plutonio-aluminio es una alternativa al PGA. Fue el elemento original considerado para la estabilización de la fase δ, pero su tendencia a reaccionar con las partículas alfa y liberar neutrones reduce su utilidad para armas nucleares. La aleación de plutonio-aluminio también se puede utilizar como componente del combustible nuclear . [47]
- La aleación de plutonio-galio-cobalto (PuCoGa 5 ) es un superconductor no convencional , que muestra una superconductividad por debajo de 18,5 K, un orden de magnitud superior a la más alta entre los sistemas de fermiones pesados , y tiene una gran corriente crítica. [44] [48]
- La aleación de plutonio y circonio se puede utilizar como combustible nuclear . [49]
- Las aleaciones de plutonio-cerio y de plutonio-cerio-cobalto se utilizan como combustibles nucleares. [50]
- El plutonio-uranio , con un porcentaje de plutonio de entre el 15 y el 30 % en moles, se puede utilizar como combustible nuclear para reactores reproductores rápidos. Su naturaleza pirofórica y su alta susceptibilidad a la corrosión hasta el punto de autoencenderse o desintegrarse tras la exposición al aire requieren una aleación con otros componentes. La adición de aluminio, carbono o cobre no mejora notablemente las tasas de desintegración; las aleaciones de circonio y hierro tienen una mejor resistencia a la corrosión, pero también se desintegran en varios meses en el aire. La adición de titanio o circonio aumenta significativamente el punto de fusión de la aleación. [51]
- Se han investigado los compuestos plutonio-uranio-titanio y plutonio-uranio-circonio para su uso como combustibles nucleares. La adición del tercer elemento aumenta la resistencia a la corrosión, reduce la inflamabilidad y mejora la ductilidad, la fabricabilidad, la resistencia y la expansión térmica. El plutonio-uranio-molibdeno tiene la mejor resistencia a la corrosión, ya que forma una película protectora de óxidos, pero se prefieren el titanio y el circonio por razones físicas. [51]
- Se investigó el torio-uranio-plutonio como combustible nuclear para reactores reproductores rápidos. [51]
Aparición
En la naturaleza se pueden encontrar trazas de plutonio-238, plutonio-239, plutonio-240 y plutonio-244. Pequeñas trazas de plutonio-239, unas pocas partes por billón , y sus productos de desintegración se encuentran de forma natural en algunos minerales concentrados de uranio, [52] como el reactor de fisión nuclear natural de Oklo , Gabón . [53] La proporción de plutonio-239 a uranio en el depósito de uranio de la mina Cigar Lake varía de2,4 × 10 −12 a44 × 10 −12 . [54] Estas trazas de 239 Pu se originan de la siguiente manera: en raras ocasiones, el 238 U sufre fisión espontánea y, en el proceso, el núcleo emite uno o dos neutrones libres con cierta energía cinética. Cuando uno de estos neutrones golpea el núcleo de otro átomo de 238 U, es absorbido por el átomo, que se convierte en 239 U. Con una vida media relativamente corta, el 239 U se desintegra en 239 Np, que se desintegra en 239 Pu. [55] [56] Finalmente, se han encontrado cantidades extremadamente pequeñas de plutonio-238, atribuidas a la extremadamente rara desintegración doble beta del uranio-238, en muestras de uranio natural. [57]
Debido a su vida media relativamente larga de unos 80 millones de años, se sugirió que el plutonio-244 se produce de forma natural como un nucleido primordial , pero no se pudieron confirmar los primeros informes de su detección. [58] Con base en su probable abundancia inicial en el Sistema Solar, es probable que los experimentos actuales a partir de 2022 estén a un orden de magnitud de detectar 244 Pu primordial vivo . [59] Sin embargo, su larga vida media aseguró su circulación a través del sistema solar antes de su extinción , [60] y, de hecho, se ha encontrado evidencia de la fisión espontánea del 244 Pu extinto en meteoritos. [61] La antigua presencia de 244 Pu en el Sistema Solar temprano ha sido confirmada, ya que hoy se manifiesta como un exceso de sus hijos, ya sea 232 Th (de la vía de desintegración alfa) o isótopos de xenón (de su fisión espontánea ). Estos últimos son generalmente más útiles, porque las químicas del torio y el plutonio son bastante similares (ambos son predominantemente tetravalentes) y, por lo tanto, un exceso de torio no sería una prueba sólida de que parte de él se formó como una hija del plutonio. [62] El 244 Pu tiene la vida media más larga de todos los nucleidos transuránicos y se produce solo en el proceso r en supernovas y estrellas de neutrones en colisión ; cuando los núcleos son expulsados de estos eventos a alta velocidad para llegar a la Tierra, el 244 Pu solo entre los nucleidos transuránicos tiene una vida media lo suficientemente larga para sobrevivir al viaje, y por lo tanto se han encontrado pequeños rastros de 244 Pu interestelar vivo en el fondo del mar profundo. Debido a que el 240 Pu también ocurre en la cadena de desintegración del 244 Pu, también debe estar presente en el equilibrio secular , aunque en cantidades aún más pequeñas. [63]
En el cuerpo humano se encuentran generalmente trazas diminutas de plutonio debido a las 550 pruebas nucleares atmosféricas y submarinas que se han llevado a cabo, y a un pequeño número de accidentes nucleares importantes . [40] La mayoría de las pruebas nucleares atmosféricas y submarinas fueron detenidas por el Tratado de Prohibición Limitada de Ensayos en 1963, que las potencias nucleares firmaron y ratificaron los Estados Unidos, el Reino Unido y la Unión Soviética . Francia continuaría las pruebas nucleares atmosféricas hasta 1974 y China continuaría las pruebas nucleares atmosféricas hasta 1980. Todas las pruebas nucleares posteriores se llevaron a cabo bajo tierra. [64]
Historia
Descubrimiento
Enrico Fermi y un equipo de científicos de la Universidad de Roma informaron que habían descubierto el elemento 94 en 1934. [65] Fermi llamó al elemento hesperio y lo mencionó en su discurso Nobel en 1938. [66] La muestra en realidad contenía productos de fisión nuclear , principalmente bario y criptón . [67] La fisión nuclear, descubierta en Alemania en 1938 por Otto Hahn y Fritz Strassmann , era desconocida en ese momento. [68]

El plutonio (específicamente, plutonio-238) fue producido, aislado y luego identificado químicamente por primera vez entre diciembre de 1940 y febrero de 1941 por Glenn T. Seaborg , Edwin McMillan , Emilio Segrè , Joseph W. Kennedy y Arthur Wahl mediante bombardeo de uranio con deuterones en el ciclotrón de 60 pulgadas (150 cm) en el Laboratorio de Radiación de Berkeley en la Universidad de California, Berkeley . [69] [70] [71] El neptunio-238 fue creado directamente por el bombardeo, pero se descompuso por emisión beta con una vida media de poco más de dos días, lo que indicó la formación del elemento 94. [40] El primer bombardeo tuvo lugar el 14 de diciembre de 1940, y el nuevo elemento se identificó por primera vez a través de la oxidación en la noche del 23 al 24 de febrero de 1941. [70]
El equipo preparó un artículo que documentaba el descubrimiento y lo envió a la revista Physical Review en marzo de 1941, [40] pero la publicación se retrasó hasta un año después del final de la Segunda Guerra Mundial debido a problemas de seguridad. [72] En el Laboratorio Cavendish en Cambridge , Egon Bretscher y Norman Feather se dieron cuenta de que un reactor de neutrones lento alimentado con uranio produciría teóricamente cantidades sustanciales de plutonio-239 como subproducto. Calcularon que el elemento 94 sería fisible y tendría la ventaja adicional de ser químicamente diferente del uranio y podría separarse fácilmente de él. [27]
McMillan había nombrado recientemente al primer elemento transuránico neptunio en honor al planeta Neptuno , y sugirió que el elemento 94, siendo el siguiente elemento en la serie, se nombrara en honor al que entonces se consideraba el siguiente planeta, Plutón . [10] [nota 2] Nicholas Kemmer del equipo de Cambridge propuso de forma independiente el mismo nombre, basándose en el mismo razonamiento que el equipo de Berkeley. [27] Seaborg consideró originalmente el nombre "plutium", pero más tarde pensó que no sonaba tan bien como "plutonium". [74] Eligió las letras "Pu" como una broma, en referencia a la interjección "P U" para indicar un olor especialmente repugnante, que pasó sin previo aviso a la tabla periódica. [nota 3] Los nombres alternativos considerados por Seaborg y otros fueron "ultimium" o "extremium" debido a la creencia errónea de que habían encontrado el último elemento posible en la tabla periódica . [76]
Hahn y Strassmann, e independientemente Kurt Starke , estaban en ese momento trabajando también en elementos transuránicos en Berlín. Es probable que Hahn y Strassmann fueran conscientes de que el plutonio-239 debería ser fisible. Sin embargo, no tenían una fuente potente de neutrones. El elemento 93 fue reportado por Hahn y Strassmann, así como por Starke, en 1942. El grupo de Hahn no persiguió el elemento 94, probablemente porque se sintieron desanimados por la falta de éxito de McMillan y Abelson en aislarlo cuando encontraron por primera vez el elemento 93. Sin embargo, dado que el grupo de Hahn tenía acceso al ciclotrón más fuerte en París en ese momento, probablemente habrían podido detectar plutonio si lo hubieran intentado, aunque en cantidades minúsculas (unos pocos becquerelios ). [77]
Investigaciones tempranas

La química del plutonio se parecía a la del uranio después de unos meses de estudio inicial. [40] Las primeras investigaciones continuaron en el Laboratorio Metalúrgico secreto de la Universidad de Chicago . El 20 de agosto de 1942, se aisló y midió por primera vez una cantidad traza de este elemento. Se produjeron unos 50 microgramos de plutonio-239 combinado con uranio y productos de fisión y solo se aisló alrededor de 1 microgramo. [52] [78] Este procedimiento permitió a los químicos determinar el peso atómico del nuevo elemento. [79] [nota 4] El 2 de diciembre de 1942, en una cancha de raqueta debajo de la tribuna oeste del Stagg Field de la Universidad de Chicago, los investigadores encabezados por Enrico Fermi lograron la primera reacción en cadena autosostenida en una pila de grafito y uranio conocida como CP-1 . Utilizando la información teórica obtenida del funcionamiento del CP-1, DuPont construyó un reactor de producción experimental refrigerado por aire, conocido como X-10 , y una instalación piloto de separación química en Oak Ridge. La instalación de separación, utilizando métodos desarrollados por Glenn T. Seaborg y un equipo de investigadores del Met Lab, eliminó el plutonio del uranio irradiado en el reactor X-10. La información del CP-1 también fue útil para los científicos del Met Lab que diseñaron los reactores de producción de plutonio refrigerados por agua para Hanford. La construcción en el sitio comenzó a mediados de 1943. [80]
En noviembre de 1943 se redujo algo de trifluoruro de plutonio para crear la primera muestra de plutonio metálico: unos pocos microgramos de perlas metálicas. [52] Se produjo suficiente plutonio para convertirlo en el primer elemento sintético visible a simple vista. [81]
También se estudiaron las propiedades nucleares del plutonio-239; los investigadores descubrieron que cuando es golpeado por un neutrón, se desintegra (se fisiona) liberando más neutrones y energía. Estos neutrones pueden golpear otros átomos de plutonio-239 y así sucesivamente en una reacción en cadena exponencialmente rápida. Esto puede dar como resultado una explosión lo suficientemente grande como para destruir una ciudad si se concentra una cantidad suficiente del isótopo para formar una masa crítica . [40]
En las primeras etapas de la investigación, se utilizaron animales para estudiar los efectos de las sustancias radiactivas sobre la salud. Estos estudios comenzaron en 1944 en el Laboratorio de Radiación de la Universidad de California en Berkeley y fueron realizados por Joseph G. Hamilton. Hamilton buscaba responder a preguntas sobre cómo el plutonio variaría en el cuerpo dependiendo del modo de exposición (ingestión oral, inhalación, absorción a través de la piel), las tasas de retención y cómo el plutonio se fijaría en los tejidos y se distribuiría entre los diversos órganos. Hamilton comenzó a administrar porciones solubles de microgramos de compuestos de plutonio-239 a ratas utilizando diferentes estados de valencia y diferentes métodos de introducción del plutonio (oral, intravenosa, etc.). Finalmente, el laboratorio de Chicago también realizó sus propios experimentos de inyección de plutonio utilizando diferentes animales, como ratones, conejos, peces e incluso perros. Los resultados de los estudios en Berkeley y Chicago mostraron que el comportamiento fisiológico del plutonio difería significativamente del del radio. El resultado más alarmante fue que hubo una deposición significativa de plutonio en el hígado y en la parte "de metabolización activa" del hueso. Además, la tasa de eliminación de plutonio en los excrementos difería entre especies animales en un factor de hasta cinco, lo que hacía sumamente difícil estimar cuál sería la tasa para los seres humanos. [82]
Producción durante el Proyecto Manhattan
Durante la Segunda Guerra Mundial, el gobierno de los Estados Unidos estableció el Proyecto Manhattan para desarrollar una bomba atómica. Los tres sitios principales de investigación y producción del proyecto fueron la instalación de producción de plutonio en lo que ahora es el Sitio Hanford ; las instalaciones de enriquecimiento de uranio en Oak Ridge, Tennessee ; y el laboratorio de investigación y diseño de armas, ahora conocido como Laboratorio Nacional de Los Álamos , LANL. [83]


El primer reactor de producción que produjo 239 Pu fue el reactor de grafito X-10 . Entró en funcionamiento en 1943 y se construyó en una instalación en Oak Ridge que luego se convirtió en el Laboratorio Nacional de Oak Ridge . [40] [nota 5]
En enero de 1944, los trabajadores pusieron los cimientos del primer edificio de separación química, la Planta T, situada en 200-West. Tanto la Planta T como su instalación hermana en 200-West, la Planta U, se completaron en octubre. (La Planta U se utilizó sólo para formación durante el Proyecto Manhattan). El edificio de separación en 200-East, la Planta B, se completó en febrero de 1945. La segunda instalación prevista para 200-East se canceló. Los trabajadores que los construyeron los apodaron Queen Marys; eran unas impresionantes estructuras tipo cañón de 240 metros de largo, 20 metros de ancho y 24 metros de alto que contenían cuarenta piscinas de proceso. El interior tenía una calidad inquietante, ya que los operadores, detrás de siete pies de blindaje de hormigón, manipulaban el equipo de control remoto mirando a través de monitores de televisión y periscopios desde una galería superior. Incluso con enormes tapas de hormigón en las piscinas de proceso, eran necesarias precauciones contra la exposición a la radiación que influyeron en todos los aspectos del diseño de la planta. [80]
El 5 de abril de 1944, Emilio Segrè recibió en Los Álamos la primera muestra de plutonio producido en reactores de Oak Ridge. [85] En diez días, descubrió que el plutonio generado en reactores tenía una concentración más alta de 240 Pu que el plutonio producido en ciclotrones. El 240 Pu tiene una alta tasa de fisión espontánea, lo que aumenta el nivel general de neutrones de fondo de la muestra de plutonio. [86] Como resultado, el arma de plutonio tipo cañón original , cuyo nombre en código era " Thin Man ", tuvo que ser abandonada: el mayor número de neutrones espontáneos significaba que era probable que se produjera una predetonación nuclear ( fizzle ). [87]
Todo el esfuerzo de diseño de armas de plutonio en Los Álamos pronto se trasladó al dispositivo de implosión más complicado, cuyo nombre en código era " Fat Man ". En una bomba de implosión, el plutonio se comprime a alta densidad con lentes explosivas , una tarea técnicamente más desalentadora que la simple bomba tipo cañón, pero necesaria para una bomba de plutonio. El uranio, por el contrario, se puede utilizar con cualquiera de los dos métodos. [87]
La construcción del reactor B de Hanford , el primer reactor nuclear de tamaño industrial destinado a la producción de materiales, se completó en marzo de 1945. El reactor B produjo el material fisible para las armas de plutonio utilizadas durante la Segunda Guerra Mundial. [nota 6] B, D y F fueron los reactores iniciales construidos en Hanford, y seis reactores adicionales productores de plutonio se construyeron más tarde en el sitio. [90]
A finales de enero de 1945, el plutonio altamente purificado se sometió a una mayor concentración en el edificio de aislamiento químico, donde se eliminaron con éxito las impurezas restantes. Los Álamos recibió su primer plutonio de Hanford el 2 de febrero. Si bien todavía no estaba claro que se pudiera producir suficiente plutonio para su uso en bombas al final de la guerra, Hanford estaba en funcionamiento a principios de 1945. Solo habían pasado dos años desde que el coronel Franklin Matthias estableció por primera vez su cuartel general temporal en las orillas del río Columbia. [80]
Según Kate Brown , las plantas de producción de plutonio de Hanford y Mayak en Rusia, durante un período de cuatro décadas, "ambas liberaron más de 200 millones de curies de isótopos radiactivos al medio ambiente circundante, el doble de la cantidad expulsada en el desastre de Chernóbil en cada caso". [91] La mayor parte de esta contaminación radiactiva a lo largo de los años fue parte de operaciones normales, pero ocurrieron accidentes imprevistos y la administración de la planta mantuvo esto en secreto, ya que la contaminación continuó sin cesar. [91]
En 2004, durante las excavaciones de una zanja de entierro en el sitio nuclear de Hanford , se descubrió una caja fuerte . Dentro de la caja fuerte había varios artículos, incluida una gran botella de vidrio que contenía una suspensión blanquecina que posteriormente se identificó como la muestra más antigua de plutonio apto para armas que se conoce que existe. El análisis de isótopos realizado por el Laboratorio Nacional del Noroeste del Pacífico indicó que el plutonio en la botella se fabricó en el reactor de grafito X-10 en Oak Ridge durante 1944. [92] [93] [94]
Bombas atómicas de Trinity y Fat Man
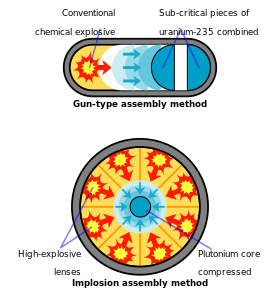
La primera prueba de bomba atómica, llamada en código " Trinity " y detonada el 16 de julio de 1945, cerca de Alamogordo, Nuevo México , utilizó plutonio como material fisible. [52] El diseño de implosión de " Gadget ", como se llamó en código al dispositivo Trinity, utilizó lentes explosivas convencionales para comprimir una esfera de plutonio en una masa supercrítica, que fue bañada simultáneamente con neutrones de "Urchin" , un iniciador hecho de polonio y berilio ( fuente de neutrones : reacción (α, n) ). [40] Juntos, estos aseguraron una reacción en cadena descontrolada y una explosión. El arma pesaba más de 4 toneladas , aunque tenía solo 6 kg de plutonio. [95] Aproximadamente el 20% del plutonio en el arma Trinity se fisionó; liberando una energía equivalente a aproximadamente 20.000 toneladas de TNT. [96] [nota 7]
Un diseño idéntico fue utilizado en "Fat Man", lanzado sobre Nagasaki , Japón , el 9 de agosto de 1945, matando a 35.000-40.000 personas y destruyendo entre el 68% y el 80% de la producción bélica en Nagasaki. [98] Solo después del anuncio de las primeras bombas atómicas se dio a conocer al público la existencia y el nombre del plutonio mediante el Informe Smyth del Proyecto Manhattan . [99]
Uso y desperdicio de la Guerra Fría
Durante la Guerra Fría , tanto la Unión Soviética como los Estados Unidos acumularon grandes reservas de plutonio apto para la fabricación de armas . Los reactores estadounidenses de Hanford y de Savannah River en Carolina del Sur produjeron 103 toneladas [100] y se calcula que en la URSS se produjeron unas 170 toneladas de plutonio apto para uso militar [101] [nota 8] Cada año se siguen produciendo unas 20 toneladas de este elemento como subproducto de la industria nuclear [16] Es posible que haya hasta 1000 toneladas de plutonio almacenadas, y más de 200 toneladas de este material pueden estar dentro de las armas nucleares o extraídas de ellas [40] . El SIPRI estimó que en 2007 las reservas mundiales de plutonio eran de unas 500 toneladas, divididas equitativamente entre las reservas de armas y las reservas civiles [103] .
La contaminación radiactiva en la planta Rocky Flats se debió principalmente a dos grandes incendios de plutonio en 1957 y 1969. Durante la vida operativa de la planta, de 1952 a 1992, se liberaron concentraciones mucho más bajas de isótopos radiactivos. Los vientos predominantes de la planta transportaron la contaminación aérea hacia el sur y el este, hacia las zonas pobladas al noroeste de Denver. La contaminación de la zona de Denver por plutonio procedente de los incendios y otras fuentes no se informó públicamente hasta la década de 1970. Según un estudio de 1972 coescrito por Edward Martell , "en las zonas más densamente pobladas de Denver, el nivel de contaminación por Pu en los suelos superficiales es varias veces superior al de la lluvia radiactiva", y la contaminación por plutonio "justo al este de la planta Rocky Flats es hasta cientos de veces superior a la de las pruebas nucleares". [104] Como señaló Carl Johnson en Ambio , "la exposición de una gran población de la zona de Denver al plutonio y otros radionucleidos en las columnas de escape de la planta se remonta a 1953". [105] La producción de armas en la planta de Rocky Flats se detuvo después de una redada conjunta del FBI y la EPA en 1989 y años de protestas. Desde entonces, la planta ha sido cerrada, sus edificios han sido demolidos y completamente retirados del sitio. [106]
En los EE. UU., parte del plutonio extraído de armas nucleares desmanteladas se funde para formar troncos de vidrio de óxido de plutonio que pesan dos toneladas. [40] El vidrio está hecho de borosilicatos mezclados con cadmio y gadolinio . [nota 9] Se planea que estos troncos se encierren en acero inoxidable y se almacenen hasta 4 km (2 mi) bajo tierra en pozos que se rellenarán con hormigón . [40] Estados Unidos planeó almacenar plutonio de esta manera en el depósito de desechos nucleares de Yucca Mountain , que se encuentra a unas 100 millas (160 km) al noreste de Las Vegas, Nevada . [107]
El 5 de marzo de 2009, el Secretario de Energía Steven Chu dijo en una audiencia del Senado que "el sitio de Yucca Mountain ya no era visto como una opción para almacenar desechos de reactores". [108] Desde 1999, los desechos nucleares generados por los militares están siendo enterrados en la Planta Piloto de Aislamiento de Residuos en Nuevo México.
En un memorando presidencial de fecha 29 de enero de 2010, el Presidente Obama creó la Comisión Cinta Azul sobre el Futuro Nuclear de Estados Unidos . [109] En su informe final, la Comisión formuló recomendaciones para desarrollar una estrategia integral a seguir, incluyendo: [110]
- "Recomendación nº 1: Estados Unidos debería emprender un programa integrado de gestión de desechos nucleares que conduzca al desarrollo oportuno de una o más instalaciones geológicas profundas permanentes para la eliminación segura del combustible gastado y de los desechos nucleares de alto nivel". [110]
Experimentación médica
Durante y después del final de la Segunda Guerra Mundial, los científicos que trabajaban en el Proyecto Manhattan y otros proyectos de investigación de armas nucleares realizaron estudios sobre los efectos del plutonio en animales de laboratorio y sujetos humanos. [111] Los estudios en animales encontraron que unos pocos miligramos de plutonio por kg de tejido es una dosis letal. [112]
En el caso de los sujetos humanos, esto implicaba inyectar soluciones que normalmente contenían 5 microgramos (μg) de plutonio a pacientes hospitalizados que se pensaba que estaban en fase terminal o que tenían una expectativa de vida de menos de diez años debido a la edad o a una enfermedad crónica. [111] Esto se redujo a 1 μg en julio de 1945 después de que estudios en animales descubrieran que la forma en que el plutonio se distribuye en los huesos es más peligrosa que el radio . [112] La mayoría de los sujetos, dice Eileen Welsome , eran pobres, impotentes y enfermos. [113]
Entre 1945 y 1947, dieciocho sujetos de prueba humanos fueron inyectados con plutonio sin su consentimiento informado . Las pruebas se utilizaron para crear herramientas de diagnóstico para determinar la absorción de plutonio en el cuerpo con el fin de desarrollar estándares de seguridad para trabajar con plutonio. [111] Ebb Cade participó involuntariamente en experimentos médicos que implicaron la inyección de 4,7 μg de plutonio el 10 de abril de 1945 en Oak Ridge, Tennessee . [114] [115] Este experimento estuvo bajo la supervisión de Harold Hodge . [116] Otros experimentos dirigidos por la Comisión de Energía Atómica de los Estados Unidos y el Proyecto Manhattan continuaron hasta la década de 1970. The Plutonium Files narra las vidas de los sujetos del programa secreto nombrando a cada persona involucrada y discutiendo la investigación ética y médica realizada en secreto por los científicos y médicos. El episodio ahora se considera una violación grave de la ética médica y del juramento hipocrático . [117]
El gobierno ocultó la mayoría de estas acciones hasta 1993, cuando el presidente Bill Clinton ordenó un cambio de política y las agencias federales hicieron públicos los registros pertinentes. La investigación resultante fue realizada por el Comité Asesor del presidente sobre Experimentos con Radiación Humana , y descubrió gran parte del material sobre la investigación con plutonio en humanos. El comité publicó un controvertido informe en 1995 que decía que "se cometieron errores", pero no condenaba a quienes los perpetraron. [113]
Aplicaciones
Explosivos

El 239 Pu es un componente fisible clave en las armas nucleares, debido a su facilidad de fisión y disponibilidad. Al encerrar el núcleo de plutonio de la bomba en un tamper (una capa de material denso), se reduce la masa crítica al reflejar los neutrones que escapan hacia el núcleo de plutonio. Esto reduce la masa crítica de 16 kg a 10 kg, que es una esfera con un diámetro de unos 10 centímetros (4 pulgadas). [118] Esta masa crítica es aproximadamente un tercio de la del uranio-235. [10]
Las bombas de plutonio de Fat Man utilizaban la compresión explosiva del plutonio para obtener una densidad significativamente mayor que la normal, combinada con una fuente central de neutrones para iniciar la reacción y aumentar la eficiencia. Por lo tanto, solo se necesitaban 6 kg de plutonio para un rendimiento explosivo equivalente a 20 kilotones de TNT. [96] [119] Hipotéticamente, se podrían utilizar tan solo 4 kg de plutonio (y tal vez incluso menos) para fabricar una sola bomba atómica utilizando diseños de ensamblaje muy sofisticados. [119]
Combustible de óxido mixto
El combustible nuclear gastado de los reactores de agua ligera normales contiene plutonio, pero es una mezcla de plutonio-242 , 240, 239 y 238. La mezcla no está lo suficientemente enriquecida para armas nucleares eficientes, pero puede usarse una vez como combustible MOX . [120] La captura accidental de neutrones hace que la cantidad de plutonio-242 y 240 crezca cada vez que el plutonio se irradia en un reactor con neutrones "térmicos" de baja velocidad, de modo que después del segundo ciclo, el plutonio solo puede ser consumido por reactores de neutrones rápidos . Si no se dispone de reactores de neutrones rápidos (el caso normal), el exceso de plutonio generalmente se descarta y forma uno de los componentes de más larga duración de los desechos nucleares. El deseo de consumir este plutonio y otros combustibles transuránicos y reducir la radiotoxicidad de los desechos es la razón habitual que dan los ingenieros nucleares para construir reactores de neutrones rápidos. [121]
El proceso químico más común, PUREX ( extracción de plutonio- uranio ) , reprocesa el combustible nuclear gastado para extraer plutonio y uranio que se pueden utilizar para formar un combustible de óxido mixto (MOX) para su reutilización en reactores nucleares. El plutonio apto para armas se puede añadir a la mezcla de combustible. El combustible MOX se utiliza en reactores de agua ligera y consta de 60 kg de plutonio por tonelada de combustible; después de cuatro años, tres cuartas partes del plutonio se queman (se convierten en otros elementos). [40] El combustible MOX se ha utilizado desde la década de 1980 y se utiliza ampliamente en Europa. [120] Los reactores reproductores están diseñados específicamente para crear más material fisionable del que consumen. [122]
El combustible MOX mejora la combustión total. Una barra de combustible se reprocesa después de tres años de uso para eliminar los productos de desecho, que para entonces representan el 3% del peso total de las barras. [40] Cualquier isótopo de uranio o plutonio producido durante esos tres años se deja y la barra vuelve a la producción. [nota 10] La presencia de hasta un 1% de galio por masa en una aleación de plutonio de grado armamentístico tiene el potencial de interferir con el funcionamiento a largo plazo de un reactor de agua ligera. [123]
El plutonio recuperado del combustible de reactores usados plantea poco riesgo de proliferación, debido a la excesiva contaminación con plutonio-240 y plutonio-242 no fisionables. La separación de los isótopos no es factible. Por lo general, se requiere un reactor dedicado que funcione con un grado de combustión muy bajo (de ahí la mínima exposición del plutonio-239 recién formado a neutrones adicionales que hacen que se transforme en isótopos más pesados de plutonio) para producir material adecuado para su uso en armas nucleares eficientes . Si bien se define el plutonio "apta para armas" como aquel que contiene al menos un 92% de plutonio-239 (del plutonio total), los Estados Unidos han logrado detonar un dispositivo de menos de 20 Kt utilizando plutonio que se cree que contiene sólo alrededor del 85% de plutonio-239, el llamado plutonio "apta para combustible". [124] El plutonio de "calidad para reactor" producido por un ciclo de combustión normal de un reactor de agua de pequeña potencia contiene normalmente menos del 60% de Pu-239, con hasta un 30% de Pu-240/Pu-242 parásito y entre un 10 y un 15% de Pu-241 fisible. [124] Se desconoce si un dispositivo que utilice plutonio obtenido a partir de residuos nucleares civiles reprocesados puede detonarse, sin embargo, un dispositivo de este tipo podría hipotéticamente estallar y esparcir materiales radiactivos sobre una gran zona urbana. El OIEA clasifica de manera conservadora el plutonio de todos los vectores isotópicos como material de "uso directo", es decir, "material nuclear que puede utilizarse para la fabricación de componentes de explosivos nucleares sin transmutación ni enriquecimiento adicional". [124]
Fuente de energía y calor


El plutonio-238 tiene una vida media de 87,74 años. [125] Emite una gran cantidad de energía térmica con bajos niveles tanto de rayos gamma / fotones como de neutrones. [126] Al ser un emisor alfa, combina radiación de alta energía con baja penetración y, por lo tanto, requiere un blindaje mínimo. Se puede utilizar una hoja de papel para protegerse contra las partículas alfa del 238 Pu. Un kilogramo del isótopo genera alrededor de 570 vatios de calor. [10] [126]
Estas características lo hacen muy adecuado para la generación de energía eléctrica para dispositivos que deben funcionar sin mantenimiento directo durante escalas de tiempo que se aproximan a la vida humana. Por lo tanto, se utiliza en generadores termoeléctricos de radioisótopos y unidades de calentamiento de radioisótopos como los de las sondas espaciales Cassini , [127] Voyager , Galileo y New Horizons [128] , y los exploradores marcianos Curiosity [129] y Perseverance ( Mars 2020 ) .
Las naves espaciales gemelas Voyager se lanzaron en 1977, cada una con una fuente de energía de plutonio de 500 vatios. Más de 30 años después, cada fuente todavía produce alrededor de 300 vatios, lo que permite un funcionamiento limitado de cada nave espacial. [130] Una versión anterior de la misma tecnología impulsó cinco paquetes experimentales de superficie lunar de Apolo , comenzando con el Apolo 12 en 1969. [40]
El 238 Pu también se ha utilizado con éxito para alimentar marcapasos cardíacos artificiales , para reducir el riesgo de cirugía repetida. [131] [132] Ha sido reemplazado en gran medida por células primarias basadas en litio , pero a partir de 2003 [actualizar]había entre 50 y 100 marcapasos alimentados con plutonio todavía implantados y funcionando en pacientes vivos en los Estados Unidos. [133] A fines de 2007, se informó que el número de marcapasos alimentados con plutonio se redujo a solo nueve. [134] El 238 Pu se estudió como una forma de proporcionar calor suplementario al buceo . [135] El 238 Pu mezclado con berilio se utiliza para generar neutrones con fines de investigación. [40]
Precauciones
Toxicidad
Los efectos nocivos del plutonio tienen dos aspectos: la radiactividad y el envenenamiento por metales pesados . Los compuestos de plutonio son radiactivos y se acumulan en la médula ósea . La contaminación por óxido de plutonio ha sido resultado de desastres nucleares e incidentes radiactivos , incluidos accidentes nucleares militares en los que se han quemado armas nucleares. [136] Los estudios de los efectos de estas liberaciones más pequeñas, así como de la enfermedad y muerte generalizadas por envenenamiento por radiación tras los bombardeos atómicos de Hiroshima y Nagasaki , han proporcionado información considerable sobre los peligros, los síntomas y el pronóstico del envenenamiento por radiación , que en el caso de los sobrevivientes japoneses no estaba relacionado en gran medida con la exposición directa al plutonio. [137]
La descomposición del plutonio libera tres tipos de radiación ionizante : alfa (α), beta (β) y gamma (γ). Tanto la exposición aguda como la prolongada conllevan el peligro de graves consecuencias para la salud, como enfermedad por radiación , daño genético , cáncer y muerte. El peligro aumenta con la cantidad de exposición. [40] La radiación α puede viajar solo una corta distancia y no puede atravesar la capa externa muerta de la piel humana. La radiación β puede penetrar la piel humana, pero no puede atravesar todo el cuerpo. La radiación γ puede atravesar todo el cuerpo. [138] Aunque la radiación α no puede penetrar la piel, el plutonio ingerido o inhalado irradia los órganos internos. [40] Se ha descubierto que las partículas α generadas por el plutonio inhalado causan cáncer de pulmón en una cohorte de trabajadores nucleares europeos. [139] El esqueleto , donde se acumula el plutonio, y el hígado , donde se acumula y se concentra, están en riesgo. [39] El plutonio no se absorbe en el cuerpo de manera eficiente cuando se ingiere; solo el 0,04% del óxido de plutonio se absorbe después de la ingestión. [40] El plutonio absorbido por el cuerpo se excreta muy lentamente, con una vida media biológica de 200 años. [140] El plutonio pasa lentamente a través de las membranas celulares y los límites intestinales, por lo que la absorción por ingestión y la incorporación a la estructura ósea se producen muy lentamente. [141] [142] Donald Mastick tragó accidentalmente una pequeña cantidad de cloruro de plutonio (III) , que fue detectable durante los siguientes treinta años de su vida, pero aparentemente no sufrió efectos nocivos. [143]
El plutonio es más peligroso si se inhala que si se ingiere. El riesgo de cáncer de pulmón aumenta cuando la dosis de radiación equivalente total del plutonio inhalado supera los 400 mSv . [144] El Departamento de Energía de los Estados Unidos estima que el riesgo de cáncer a lo largo de la vida por inhalar 5.000 partículas de plutonio, cada una de aproximadamente 3 μm de ancho, es un 1% superior al promedio de los Estados Unidos. [145] La ingestión o inhalación de grandes cantidades puede causar envenenamiento por radiación agudo y posiblemente la muerte. Sin embargo, no se sabe que ningún ser humano haya muerto a causa de la inhalación o ingestión de plutonio, y muchas personas tienen cantidades mensurables de plutonio en sus cuerpos. [124]
La teoría de la " partícula caliente ", según la cual una partícula de polvo de plutonio irradia una zona localizada del tejido pulmonar, no está respaldada por la investigación convencional: estas partículas son más móviles de lo que se pensaba originalmente y la toxicidad no aumenta de forma mensurable debido a su forma particulada. [141] Cuando se inhala, el plutonio puede pasar al torrente sanguíneo. Una vez en el torrente sanguíneo, se desplaza por todo el cuerpo y llega a los huesos, el hígado u otros órganos corporales. El plutonio que llega a los órganos corporales generalmente permanece en el cuerpo durante décadas y continúa exponiendo el tejido circundante a la radiación, por lo que puede causar cáncer. [146]
Una cita comúnmente citada de Ralph Nader afirma que una libra de polvo de plutonio esparcida en la atmósfera sería suficiente para matar a 8 mil millones de personas. [147] Esto fue cuestionado por Bernard Cohen , un oponente del modelo lineal sin umbral generalmente aceptado de toxicidad por radiación. Cohen estimó que una libra de plutonio podría matar a no más de 2 millones de personas por inhalación, por lo que la toxicidad del plutonio es aproximadamente equivalente a la del gas nervioso . [148]
Se ha realizado un seguimiento y análisis minucioso de varias poblaciones de personas que han estado expuestas al polvo de plutonio (por ejemplo, personas que viven a sotavento de los sitios de prueba de Nevada, supervivientes de Nagasaki, trabajadores de instalaciones nucleares y pacientes "en fase terminal" a los que se les inyectó Pu en 1945-46 para estudiar el metabolismo del Pu). Cohen encontró que estos estudios no eran coherentes con las altas estimaciones de toxicidad del plutonio, y citó casos como el de Albert Stevens, que sobrevivió hasta una edad avanzada tras ser inyectado con plutonio. [141] "Hubo unos 25 trabajadores del Laboratorio Nacional de Los Álamos que inhalaron una cantidad considerable de polvo de plutonio durante la década de 1940; según la teoría de las partículas calientes, cada uno de ellos tiene un 99,5% de posibilidades de estar muerto de cáncer de pulmón a estas alturas, pero no ha habido ni un solo cáncer de pulmón entre ellos". [148] [149]
Toxicidad marina
Se sabe que el plutonio entra al medio marino a través del vertido de residuos o de fugas accidentales de las plantas nucleares. Aunque las mayores concentraciones de plutonio en los ambientes marinos se encuentran en los sedimentos, el complejo ciclo biogeoquímico del plutonio implica que también se encuentra en todos los demás compartimentos. [150] Por ejemplo, varias especies de zooplancton que ayudan en el ciclo de nutrientes consumen el elemento a diario. La excreción completa del plutonio ingerido por el zooplancton hace que su defecación sea un mecanismo extremadamente importante en la recolección de plutonio de las aguas superficiales. [151] Sin embargo, el zooplancton que sucumbe a la depredación de organismos más grandes puede convertirse en un vehículo de transmisión del plutonio a los peces.
Además del consumo, los peces también pueden estar expuestos al plutonio por su distribución alrededor del mundo. Un estudio investigó los efectos de los elementos transuránicos ( plutonio-238 , plutonio-239 , plutonio-240 ) en varios peces que viven en la Zona de Exclusión de Chernóbil (ZEC). Los resultados mostraron que una proporción de percas hembras en la ZEC mostraron una falla o retraso en la maduración de las gónadas. [152] Estudios similares encontraron grandes acumulaciones de plutonio en los órganos respiratorios y digestivos del bacalao, la platija y el arenque. [150]
La toxicidad del plutonio es igualmente perjudicial para las larvas de peces en las zonas de residuos nucleares. Los huevos no desarrollados tienen un riesgo mayor que los peces adultos desarrollados expuestos al elemento en estas zonas de residuos. El Laboratorio Nacional de Oak Ridge demostró que los embriones de carpa y pececillo criados en soluciones que contenían plutonio no eclosionaron; los huevos que eclosionaron mostraron anomalías significativas en comparación con los embriones desarrollados de control. [153] Reveló que se ha descubierto que concentraciones más altas de plutonio causan problemas en la fauna marina expuesta al elemento.
Potencial de criticidad

Se debe tener cuidado para evitar la acumulación de cantidades de plutonio que se acerquen a la masa crítica, en particular porque la masa crítica del plutonio es solo un tercio de la del uranio-235. [10] Una masa crítica de plutonio emite cantidades letales de neutrones y rayos gamma . [154] El plutonio en solución tiene más probabilidades de formar una masa crítica que la forma sólida debido a la moderación del hidrógeno en el agua. [ dudoso – discutir ] [16]
Se han producido accidentes de criticidad , en ocasiones con muerte de personas. El manejo descuidado de ladrillos de carburo de tungsteno alrededor de una esfera de plutonio de 6,2 kg resultó en una dosis fatal de radiación en Los Álamos el 21 de agosto de 1945, cuando el científico Harry Daghlian recibió una dosis estimada en 5,1 sievert (510 rem ) y murió 25 días después. [155] [156] Nueve meses después, otro científico de Los Álamos, Louis Slotin , murió a causa de un accidente similar que involucró a un reflector de berilio y al mismo núcleo de plutonio (el " núcleo demoníaco ") que había matado previamente a Daghlian. [157]
En diciembre de 1958, durante un proceso de purificación de plutonio en Los Álamos, se formó una masa crítica en un recipiente de mezcla, que mató al operador químico Cecil Kelley . Otros accidentes nucleares han ocurrido en la Unión Soviética, Japón, Estados Unidos y muchos otros países. [158]
Inflamabilidad
El plutonio metálico es un peligro de incendio, especialmente si está finamente dividido. En un ambiente húmedo, el plutonio forma hidruros en su superficie, que son pirofóricos y pueden encenderse en el aire a temperatura ambiente. El plutonio se expande hasta un 70% en volumen a medida que se oxida y, por lo tanto, puede romper su recipiente. [42] La radiactividad del material en llamas es otro peligro. La arena de óxido de magnesio es probablemente el material más eficaz para extinguir un incendio de plutonio. Enfría el material en llamas, actuando como un disipador de calor , y también bloquea el oxígeno. Se necesitan precauciones especiales para almacenar o manipular el plutonio en cualquier forma; generalmente se requiere una atmósfera de gas inerte seco. [42] [nota 11]
Transporte
Tierra y mar
El transporte habitual de plutonio se realiza a través del óxido de plutonio, que es más estable, en un paquete sellado. Un transporte típico consiste en un camión que lleva un contenedor de envío protegido, que contiene varios paquetes con un peso total que varía de 80 a 200 kg de óxido de plutonio. Un envío marítimo puede constar de varios contenedores, cada uno de los cuales contiene un paquete sellado. [160] La Comisión Reguladora Nuclear de los Estados Unidos dicta que debe ser sólido en lugar de polvo si el contenido supera los 0,74 TBq (20 curios ) de radiactividad. [161] En 2016, los barcos Pacific Egret [162] y Pacific Heron de Pacific Nuclear Transport Ltd. transportaron 331 kg (730 lbs) de plutonio a una instalación del gobierno de los Estados Unidos en Savannah River , Carolina del Sur . [163] [164]
Aire
Las normas de transporte aéreo del Gobierno de los Estados Unidos permiten el transporte de plutonio por vía aérea, sujeto a restricciones sobre otros materiales peligrosos transportados en el mismo vuelo, requisitos de embalaje y estiba en la parte más trasera del avión. [165]
En 2012, los medios de comunicación revelaron que se había sacado plutonio de Noruega en aviones comerciales de pasajeros , aproximadamente cada dos años, incluida una vez en 2011. [166] Las regulaciones permiten que un avión transporte 15 gramos de material fisionable. [166] Este transporte de plutonio no presenta problemas, según un asesor senior ( seniorrådgiver ) de Statens strålevern . [166]
Notas
Notas al pie
- ^ El PuO+
2El ion es inestable en solución y se desproporcionará en Pu 4+ y PuO2+
2; el Pu 4+ luego oxidará el PuO restante+
2a PuO2+
2, reduciéndose a su vez a Pu 3+ . Por lo tanto, las soluciones acuosas de PuO+
2tienden con el tiempo hacia una mezcla de Pu 3+ y PuO2+
2. OO+
2es inestable por la misma razón. [33] - ^ No era la primera vez que alguien sugería que un elemento se llamara "plutonio". Una década después de que se descubriera el bario , un profesor de la Universidad de Cambridge sugirió que se le cambiara el nombre a "plutonio" porque el elemento no era (como sugería la raíz griega , barys , de la que se le había dado el nombre) pesado. Razonó que, dado que se producía mediante la relativamente nueva técnica de la electrólisis , su nombre debería hacer referencia al fuego . Por lo tanto, sugirió que se le pusiera el nombre en honor al dios romano del inframundo, Plutón . [73]
- ^ Como dice un artículo, haciendo referencia a la información que Seaborg dio en una charla: "La elección obvia para el símbolo habría sido Pl, pero Seaborg sugirió jocosamente Pu, como las palabras que exclamaría un niño, 'Pee-yoo!', cuando huele algo malo. Seaborg pensó que recibiría muchas críticas por esa sugerencia, pero el comité de nombres aceptó el símbolo sin decir palabra". [75]
- ^ La sala 405 del Laboratorio George Herbert Jones , donde tuvo lugar el primer aislamiento de plutonio, fue nombrada Monumento Histórico Nacional en mayo de 1967.
- ^ Durante el Proyecto Manhattan, al plutonio también se lo solía denominar simplemente "49": el número 4 era el último dígito del 94 (número atómico del plutonio), y 9 era el último dígito del plutonio-239, el isótopo fisible de grado armamentístico utilizado en las bombas nucleares. [84]
- ^ La Sociedad Estadounidense de Ingenieros Mecánicos (ASME) estableció el Reactor B como Monumento Histórico Nacional de Ingeniería Mecánica en septiembre de 1976. [88] En agosto de 2008, el Reactor B fue designado Monumento Histórico Nacional de EE. UU . [89]
- ^ El cálculo de la eficiencia se basa en el hecho de que la fisión de 1 kg de plutonio-239 (o uranio-235) produce una liberación de energía de aproximadamente 17 kt , lo que lleva a una estimación redondeada de 1,2 kg de plutonio realmente fisionado para producir el rendimiento de 20 kt. [97]
- ^ Gran parte de este plutonio se utilizó para fabricar los núcleos fisionables de un tipo de arma termonuclear que emplea el diseño Teller-Ulam . Estas llamadas "bombas de hidrógeno" son una variedad de arma nuclear que utiliza una bomba de fisión para desencadenar la fusión nuclear de isótopos pesados de hidrógeno . Su rendimiento destructivo suele ser de millones de toneladas de TNT equivalente, en comparación con los miles de toneladas de TNT equivalentes de los dispositivos de solo fisión. [102]
- ^ Óxido de gadolinio y circonio ( Gd
2Zr
2Oh
7) se ha estudiado porque podría contener plutonio durante hasta 30 millones de años. [102] - ^ Descomposición del plutonio en una barra de combustible nuclear gastada: plutonio-239 (~58%), 240 (24%), 241 (11%), 242 (5%) y 238 (2%). [102]
- ^ En 1969 se produjo un gran incendio provocado por plutonio en la planta Rocky Flats, cerca de Boulder, Colorado. [159]
Citas
- ^ abc Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ Magurno y Pearlstein 1981, págs. 835 y siguientes.
- ^ abcd «Plutonio radiactivo». Sistema de información inalámbrica para equipos de respuesta a emergencias (WISER) . Bethesda (MD): Biblioteca Nacional de Medicina de EE. UU., Institutos Nacionales de Salud. Archivado desde el original el 13 de agosto de 2011. Consultado el 23 de noviembre de 2008 .(texto de dominio público)
- ^ "Procesamiento de ácido nítrico". Actinide Research Quarterly (tercer trimestre). Los Alamos (NM): Los Alamos National Laboratory. 2008. Archivado desde el original el 18 de septiembre de 2016. Consultado el 9 de febrero de 2010.
Si bien el dióxido de plutonio normalmente es verde oliva, las muestras pueden tener varios colores. En general, se cree que el color es una función de la pureza química, la estequiometría, el tamaño de las partículas y el método de preparación, aunque el color resultante de un método de preparación determinado no siempre es reproducible.
- ^ Babak Sadigh, Per Söderlind y Wilhelm G. Wolfer (2003): Geometría y estructura electrónica de δ-Pu: un estudio teórico. Physical Review B 68, 241101(R)
- ^ KT Moore, P. Söderlind, AJ Schwartz y DE Laughlin (2006): Simetría y estabilidad del plutonio δ: la influencia de la estructura electrónica. Physical Review Letters 96, 206402.
- ^ "Liquid Range". webelements.com . Archivado desde el original el 27 de febrero de 2022 . Consultado el 28 de febrero de 2022 .
- ^ abc Sonzogni, Alejandro A. (2008). "Chart of Nuclides". Upton: National Nuclear Data Center, Brookhaven National Laboratory . Archivado desde el original el 21 de julio de 2011. Consultado el 13 de septiembre de 2008 .
- ^ abcdefgh Heiserman 1992, pág. 338
- ^ Rhodes 1986, pp. 659–660 Leona Marshall : "Cuando sostienes un trozo en tu mano, se siente cálido, como un conejo vivo".
- ^ abcd Miner 1968, pág. 544
- ^ abcdefgh Hecker, Siegfried S. (2000). "Plutonio y sus aleaciones: de los átomos a la microestructura" (PDF) . Los Alamos Science . 26 : 290–335. Archivado (PDF) desde el original el 24 de febrero de 2009. Consultado el 15 de febrero de 2009 .
- ^ Hecker, Siegfried S.; Martz, Joseph C. (2000). "Envejecimiento del plutonio y sus aleaciones" (PDF) . Los Alamos Science (26). Los Alamos, Nuevo México: Los Alamos National Laboratory: 242. Archivado (PDF) desde el original el 28 de abril de 2021. Consultado el 15 de febrero de 2009 .
- ^ abcd Baker, Richard D.; Hecker, Siegfried S.; Harbur, Delbert R. (1983). "Plutonio: una pesadilla en tiempos de guerra pero el sueño de un metalúrgico" (PDF) . Los Alamos Science . Los Alamos National Laboratory: 148, 150–151. Archivado (PDF) desde el original el 17 de octubre de 2011 . Consultado el 15 de febrero de 2009 .
- ^ abcde Lide 2006, págs. 4-27
- ^ abcd Miner 1968, pág. 542
- ^ "Glosario – Material fisible". Comisión Reguladora Nuclear de los Estados Unidos . 20 de noviembre de 2014. Archivado desde el original el 4 de febrero de 2015. Consultado el 5 de febrero de 2015 .
- ^ Asimov 1988, pág. 905
- ^ Glasstone, Samuel; Redman, Leslie M. (junio de 1972). "Introducción a las armas nucleares" (PDF) . División de Aplicaciones Militares de la Comisión de Energía Atómica. pág. 12. WASH-1038. Archivado desde el original (PDF) el 27 de agosto de 2009.
- ^ Gosling 1999, pág. 40
- ^ "Plutonio: Los primeros 50 años" (PDF) . Departamento de Energía de Estados Unidos. 1996. DOE/DP-1037. Archivado desde el original (PDF) el 18 de febrero de 2013.
- ^ Wallner, A.; Faestermann, T.; Feige, J.; Feldstein, C.; Knie, K.; Korschinek, G.; Kutschera, W.; Ofán, A.; Pablo, M.; Quinto, F.; Rugel, G.; Steier, P. (2015). "La abundancia de 244Pu vivo en reservorios de aguas profundas en la Tierra apunta a la rareza de la nucleosíntesis de actínidos". Comunicaciones de la naturaleza . 6 : 5956. arXiv : 1509.08054 . Código Bib : 2015NatCo...6.5956W. doi : 10.1038/ncomms6956. ISSN 2041-1723. PMC 4309418 . PMID 25601158.
- ^ Heiserman 1992, pág. 340
- ^ Kennedy, JW; Seaborg, GT; Segrè, E.; Wahl, AC (1946). "Propiedades del elemento 94". Physical Review . 70 (7–8): 555–556. Código Bibliográfico :1946PhRv...70..555K. doi : 10.1103/PhysRev.70.555 .
- ^ de Greenwood 1997, pág. 1259
- ^ abc Clark 1961, págs. 124-125.
- ^ Seaborg, Glenn T.; McMillan, E.; Kennedy, JW; Wahl, AC (1946). "Elemento radiactivo 94 de deuterones en uranio". Physical Review . 69 (7–8): 366. Bibcode :1946PhRv...69..366S. doi :10.1103/PhysRev.69.366.
- ^ Bernstein 2007, págs. 76–77.
- ^ Miotla, Dennis (21 de abril de 2008). "Evaluación de la producción de alternativas de plutonio-238: Informe para el Comité Asesor de Energía Nuclear" (PDF) . Energy.gov. Archivado (PDF) del original el 16 de marzo de 2022 . Consultado el 28 de febrero de 2022 .
- ^ "¿Puede el plutonio apto para reactores producir armas de fisión nuclear?". Consejo para el Ciclo del Combustible Nuclear Instituto de Economía Energética, Japón. Mayo de 2001. Archivado desde el original el 24 de febrero de 2021. Consultado el 30 de enero de 2010 .
- ^ Heiserman 1992, pág. 339
- ^ Crooks, William J. (2002). "Módulo 10 de capacitación en ingeniería de seguridad de criticidad nuclear: seguridad de criticidad en operaciones de procesamiento de materiales, parte 1" (PDF) . Archivado desde el original (PDF) el 20 de marzo de 2006. Consultado el 15 de febrero de 2006 .
- ^ Matlack, George (2002). Introducción al plutonio: una introducción a la química del plutonio y su radiactividad . Laboratorio Nacional de Los Álamos. LA-UR-02-6594.
- ^ Windorff, Cory J.; Chen, Guo P; Cross, Justin N; Evans, William J.; Furche, Filipp; Gaunt, Andrew J.; Janicke, Michael T.; Kozimor, Stosh A.; Scott, Brian L. (2017). "Identificación del estado de oxidación formal +2 del plutonio: síntesis y caracterización de {Pu II [C 5 H 3 (SiMe 3 ) 2 ] 3 } − ". J. Am. Chem. Soc . 139 (11): 3970–3973. doi :10.1021/jacs.7b00706. PMID 28235179.
- ^ ab Zaitsevskii, Andréi; Mosyagin, Nikolai S.; Titov, Anatoly V.; Kiselev, Yuri M. (21 de julio de 2013). "Modelado de la teoría funcional de la densidad relativista de moléculas de óxido superior de plutonio y americio". La Revista de Física Química . 139 (3): 034307. Código bibliográfico : 2013JChPh.139c4307Z. doi : 10.1063/1.4813284. PMID 23883027.
- ^ Kiselev, Yu. METRO.; Nikonov, MV; Dolzhenko, VD; Ermilov, A. Yu.; Tananaev, IG; Myasoedov, BF (17 de enero de 2014). "Sobre la existencia y propiedades de los derivados del plutonio (VIII)". Radiochimica Acta . 102 (3): 227–237. doi :10.1515/ract-2014-2146. S2CID 100915090.
- ^ Eagleson 1994, pág. 840
- ^ abcde Miner 1968, pág. 545
- ^ abcdefghijklmnopqrs Emsley 2001, págs. 324-329
- ^ ab Apostolidis, Christos; Walter, Olaf; Vogt, Jochen; Liebing, Phil; Maron, Laurent; Edelmann, Frank T. (2017). "Un complejo organometálico de plutonio (IV) caracterizado estructuralmente". Angewandte Chemie International Edition . 56 (18): 5066–5070. doi :10.1002/anie.201701858. ISSN 1521-3773. PMC 5485009 . PMID 28371148.
- ^ abc "Manual sobre calentamiento espontáneo y piroforicidad: metales pirofóricos: plutonio". Washington (DC): Departamento de Energía de los Estados Unidos, Oficina de Seguridad Nuclear, Garantía de Calidad y Medio Ambiente. 1994. Archivado desde el original el 28 de abril de 2007.
- ^ Crooks, WJ; et al. (2002). "Reacción a baja temperatura de ReillexTM HPQ y ácido nítrico". Extracción por disolventes e intercambio iónico . 20 (4–5): 543–559. doi :10.1081/SEI-120014371. S2CID 95081082. Archivado desde el original el 14 de junio de 2011. Consultado el 24 de enero de 2010 .
- ^ ab Dumé, Belle (20 de noviembre de 2002). «El plutonio también es un superconductor». PhysicsWeb.org. Archivado desde el original el 12 de enero de 2012. Consultado el 24 de enero de 2010 .
- ^ Moody, Hutcheon y Grant 2005, pág. 169
- ^ Kolman, DG y Colletti, LP (2009). "El comportamiento de corrosión acuosa del metal plutonio y de las aleaciones de plutonio-galio expuestas a soluciones acuosas de nitrato y cloruro". ECS Transactions . 16 (52). Electrochemical Society: 71. Bibcode :2009ECSTr..16Z..71K. doi :10.1149/1.3229956. ISBN 978-1-56677-751-3. S2CID 96567022. Archivado desde el original el 16 de marzo de 2022 . Consultado el 2 de diciembre de 2020 .
- ^ Hurst y Ward 1956
- ^ Curro, NJ (primavera de 2006). "Superconductividad no convencional en PuCoGa5" (PDF) . Laboratorio Nacional de Los Álamos. Archivado desde el original (PDF) el 22 de julio de 2011. Consultado el 24 de enero de 2010 .
- ^ McCuaig, Franklin D. "Aleación de Pu-Zr para combustible de tipo lámina de alta temperatura", patente estadounidense n.° 4.059.439 , expedida el 22 de noviembre de 1977
- ^ Jha 2004, pág. 73
- ^ abc Kay 1965, pág. 456
- ^ abcd Miner 1968, pág. 541
- ^ "Oklo: Reactores nucleares naturales". Departamento de Energía de Estados Unidos, Oficina de Gestión de Residuos Radiactivos Civiles. 2004. Archivado desde el original el 20 de octubre de 2008. Consultado el 16 de noviembre de 2008 .
- ^ Curtis, David; Fabryka-Martin, June; Paul, Dixon; Cramer, Jan (1999). «Elementos poco comunes de la naturaleza: plutonio y tecnecio». Geochimica et Cosmochimica Acta . 63 (2): 275–285. Código Bibliográfico :1999GeCoA..63..275C. doi :10.1016/S0016-7037(98)00282-8. Archivado desde el original el 27 de junio de 2021 . Consultado el 29 de junio de 2019 .
- ^ Bernstein 2007, págs. 75–77.
- ^ Hoffman, DC; Lawrence, FO; Mewherter, JL; Rourke, FM (1971). "Detección de plutonio-244 en la naturaleza". Nature . 234 (5325): 132–134. Código Bibliográfico :1971Natur.234..132H. doi :10.1038/234132a0. S2CID 4283169.
- ^ Peterson, Ivars (7 de diciembre de 1991). "El uranio muestra un tipo raro de radiactividad". Science News . 140 (23). Wiley-Blackwell : 373. doi :10.2307/3976137. JSTOR 3976137.
- ^ Hoffman, DC; Lawrence, FO; Mewherter, JL; Rourke, FM (1971). "Detección de plutonio-244 en la naturaleza". Nature . 234 (5325): 132–134. Código Bibliográfico :1971Natur.234..132H. doi :10.1038/234132a0. S2CID 4283169. Nr. 34.
- ^ Wu, Yang; Dai, Xiongxin; Xing, Shan; Luo, Maoyi; Christl, Marcus; Synal, Hans-Arno; Hou, Shaochun (2022). "Búsqueda directa de 244Pu primordial en bastnasita de Bayan Obo". Chinese Chemical Letters . 33 (7): 3522–3526. doi :10.1016/j.cclet.2022.03.036. Archivado desde el original el 29 de enero de 2024 . Consultado el 29 de enero de 2024 .
- ^ Turner, Grenville; Harrison, T. Mark; Holland, Greg; Mojzsis, Stephen J.; Gilmour, Jamie (1 de enero de 2004). "244Pu extinto en circones antiguos" (PDF) . Science . 306 (5693): 89–91. Bibcode :2004Sci...306...89T. doi :10.1126/science.1101014. JSTOR 3839259. PMID 15459384. S2CID 11625563. Archivado desde el original (PDF) el 11 de febrero de 2020.
- ^ Hutcheon, ID; Price, PB (1 de enero de 1972). "Huellas de fisión de plutonio-244: evidencia en una roca lunar de 3.950 millones de años de antigüedad". Science . 176 (4037): 909–911. Bibcode :1972Sci...176..909H. doi :10.1126/science.176.4037.909. JSTOR 1733798. PMID 17829301. S2CID 25831210.
- ^ Kunz, Joachim; Staudacher, Thomas; Allègre, Claude J. (1 de enero de 1998). "Se encontró plutonio por fisión de xenón en el manto de la Tierra". Science . 280 (5365): 877–880. Bibcode :1998Sci...280..877K. doi :10.1126/science.280.5365.877. JSTOR 2896480. PMID 9572726.
- ^ Wallner, A.; Faestermann, T.; Feige, J.; Feldstein, C.; Knie, K.; Korschinek, G.; Kutschera, W.; Ofan, A.; Paul, M.; Quinto, F.; Rugel, G.; Steiner, P. (30 de marzo de 2014). "La abundancia de 244Pu vivo en depósitos de aguas profundas en la Tierra apunta a la rareza de la nucleosíntesis de actínidos". Nature Communications . 6 : 5956. arXiv : 1509.08054 . Bibcode :2015NatCo...6.5956W. doi :10.1038/ncomms6956. PMC 4309418 . PMID 25601158. S2CID 119286045.
- ^ "Ensayos nucleares de 1945 a la actualidad". Organización del Tratado de Prohibición Completa de los Ensayos Nucleares. Archivado desde el original el 7 de febrero de 2022. Consultado el 7 de febrero de 2022 .
- ^ Holden, Norman E. (2001). "Una breve historia de los datos nucleares y su evaluación". 51.ª reunión del Grupo de trabajo de evaluación de secciones transversales del Departamento de Energía de los Estados Unidos (USDOE) . Upton (NY): Centro Nacional de Datos Nucleares, Laboratorio Nacional de Brookhaven. Archivado desde el original el 5 de agosto de 2012. Consultado el 3 de enero de 2009 .
- ^ Fermi, Enrico (12 de diciembre de 1938). «Radiactividad artificial producida por bombardeo de neutrones: conferencia Nobel» (PDF) . Real Academia Sueca de Ciencias. Archivado (PDF) desde el original el 5 de agosto de 2011. Consultado el 4 de enero de 2009 .
- ^ Darden, Lindley (1998). "La naturaleza de la investigación científica". College Park: Departamento de Filosofía, Universidad de Maryland. Archivado desde el original el 17 de agosto de 2012. Consultado el 3 de enero de 2008 .
- ^ Bernstein 2007, págs. 44–52.
- ^ Seaborg, Glenn T. "Una historia temprana del LBNL: elementos 93 y 94". Departamento de Informática Avanzada para la Ciencia, Laboratorio Nacional Lawrence Berkeley. Archivado desde el original el 5 de noviembre de 2014. Consultado el 17 de septiembre de 2008 .
- ^ ab Glenn T. Seaborg (septiembre de 1981). "La historia del plutonio". Laboratorio Lawrence Berkeley, Universidad de California. LBL-13492, DE82 004551. Archivado desde el original el 16 de mayo de 2013. Consultado el 16 de marzo de 2022 .
- ^ E. Segrè, Una mente siempre en movimiento, University of California Press, 1993, págs. 162-169
- ^ Seaborg y Seaborg 2001, págs. 71–72.
- ^ Heiserman 1992, pág. 338.
- ^ Clark, David L.; Hobart, David E. (2000). "Reflexiones sobre el legado de una leyenda: Glenn T. Seaborg, 1912-1999" (PDF) . Los Alamos Science . 26 : 56-61, pág. 57. Archivado (PDF) desde el original el 3 de junio de 2016. Consultado el 15 de febrero de 2009 .
- ^ Clark, David L.; Hobart, David E. (2000). "Reflexiones sobre el legado de una leyenda: Glenn T. Seaborg, 1912-1999" (PDF) . Los Alamos Science . 26 : 56-61, pág. 57. Archivado (PDF) desde el original el 3 de junio de 2016. Consultado el 15 de febrero de 2009 .
- ^ "Entrevista de primera línea con Seaborg". Frontline . Public Broadcasting Service. 1997. Archivado desde el original el 29 de junio de 2018 . Consultado el 7 de diciembre de 2008 .
- ^ Winterberg, Friedwardt; Herrmann, Günter; Fodor, Igor; Wolfenstein, Lincoln; Singer, Mark E. (1996). "Más sobre cómo la Alemania nazi fracasó en el desarrollo de la bomba atómica". Física hoy . 49 (1): 11–15, 83. Bibcode :1996PhT....49a..11W. doi :10.1063/1.2807455.
- ^ Glenn T. Seaborg (1977). «Historia de la Sección CI del Laboratorio MET, abril de 1942 – abril de 1943». Oficina de Información Científica y Técnica Informes Técnicos . Universidad de California, Berkeley (EE. UU.). Lawrence Berkeley Lab. doi : 10.2172/7110621 . Archivado desde el original el 15 de marzo de 2020. Consultado el 29 de junio de 2019 .
- ^ "Sala 405, Laboratorio George Herbert Jones". Servicio de Parques Nacionales. Archivado desde el original el 8 de febrero de 2008. Consultado el 14 de diciembre de 2008 .
- ^ abc «Tabla periódica de elementos». Laboratorio Nacional de Los Álamos. Archivado desde el original el 12 de febrero de 2019. Consultado el 15 de septiembre de 2015 .
- ^ Miner 1968, pág. 540
- ^ "Plutonio". Atomic Heritage Foundation. Archivado desde el original el 6 de mayo de 2019. Consultado el 15 de septiembre de 2015 .
- ^ "Selección de sitio". Historia del LANL . Los Álamos, Nuevo México: Laboratorio Nacional de Los Álamos. Archivado desde el original el 13 de septiembre de 2011. Consultado el 23 de diciembre de 2008 .
- ^ Hammel, EF (2000). «La domesticación del «49»: la gran ciencia en poco tiempo. Recuerdos de Edward F. Hammel, en: Cooper NG Ed. Desafíos en la ciencia del plutonio» (PDF) . Los Alamos Science . 26 (1): 2–9. Archivado (PDF) desde el original el 20 de enero de 2017. Consultado el 15 de febrero de 2009 .
- Hecker, SS (2000). «Plutonio: una visión histórica. En: Desafíos en la ciencia del plutonio». Los Alamos Science . 26 (1): 1–2. Archivado desde el original el 18 de enero de 2017 . Consultado el 15 de febrero de 2009 .
- ^ Sublette, Carey. «Cronología de la historia atómica 1942-1944». Washington (DC): Atomic Heritage Foundation. Archivado desde el original el 4 de enero de 2009. Consultado el 22 de diciembre de 2008 .
- ^ Hoddeson y col. 1993, págs. 235-239.
- ^ ab Hoddeson y col. 1993, págs. 240-242.
- ^ Wahlen 1989, pág. 1.
- ^ "Acciones de la lista semanal". Servicio de Parques Nacionales. 29 de agosto de 2008. Archivado desde el original el 31 de octubre de 2008. Consultado el 30 de agosto de 2008 .
- ^ Wahlen 1989, pág. iv, 1
- ^ ab Lindley, Robert (2013). «Kate Brown: Las "plutopias" nucleares, el mayor programa de bienestar social de la historia estadounidense». History News Network . Archivado desde el original el 3 de mayo de 2019. Consultado el 19 de diciembre de 2013 .
- ^ Rincon, Paul (2 de marzo de 2009). «BBC NEWS – Science & Environment – US nuclear relic found in bottle». BBC News . Archivado desde el original el 2 de marzo de 2009. Consultado el 2 de marzo de 2009 .
- ^ Gebel, Erika (2009). "Plutonio viejo, trucos nuevos". Química analítica . 81 (5): 1724. doi : 10.1021/ac900093b .
- ^ Schwantes, Jon M.; Matthew Douglas; Steven E. Bonde; James D. Briggs; et al. (2009). "Arqueología nuclear en una botella: evidencia de actividades armamentísticas estadounidenses anteriores a Trinity en un sitio de enterramiento de desechos". Química analítica . 81 (4): 1297–1306. doi :10.1021/ac802286a. PMID 19152306.
- ^ Sublette, Carey (3 de julio de 2007). "8.1.1 El diseño de Gadget, Fat Man y "Joe 1" (RDS-1)". Preguntas frecuentes sobre armas nucleares, edición 2.18 . The Nuclear Weapon Archive . Consultado el 4 de enero de 2008 .
- ^ ab Malik, John (septiembre de 1985). "Los rendimientos de las explosiones de Hiroshima y Nagasaki" (PDF) . Los Álamos. pag. Cuadro VI. LA-8819. Archivado (PDF) desde el original el 24 de febrero de 2009 . Consultado el 15 de febrero de 2009 .
- ^ Sobre la cifra de 1 kg = 17 kt, véase Garwin, Richard (4 de octubre de 2002). "Proliferación de armas y materiales nucleares a actores estatales y no estatales: qué significa para el futuro de la energía nuclear" (PDF) . Simposio de la Universidad de Michigan . Federación de Científicos Estadounidenses. Archivado (PDF) desde el original el 24 de febrero de 2009. Consultado el 4 de enero de 2009 .
- ^ Sklar 1984, págs. 22-29.
- ^ Berstein 2007, pág. 70.
- ^ "Registro histórico de ingeniería estadounidense: reactor B (edificio 105-B)". Richland: Departamento de Energía de los Estados Unidos. 2001. pág. 110. DOE/RL-2001-16. Archivado desde el original el 26 de diciembre de 2008. Consultado el 24 de diciembre de 2008 .
- ^ Cochran, Thomas B. (1997). Salvaguarda de materiales aptos para la fabricación de armas nucleares en Rusia (PDF) . Foro Internacional sobre Tráfico Nuclear Ilegal. Washington (DC): Natural Resources Defense Council, Inc. Archivado desde el original (PDF) el 5 de julio de 2013. Consultado el 21 de diciembre de 2008 .
- ^ Emsley 2001.
- ^ Instituto Internacional de Investigación para la Paz de Estocolmo 2007, pág. 567.
- ^ Poet, SE; Martell, EA (octubre de 1972). "Contaminación por plutonio-239 y americio-241 en el área de Denver". Health Physics . 23 (4): 537–48. doi :10.1097/00004032-197210000-00012. PMID 4634934. S2CID 26296070.
- ^ Johnson, CJ (octubre de 1981). "Incidencia de cáncer en un área contaminada con radionucleidos cerca de una instalación nuclear". Ambio . 10 (4): 176–182. JSTOR 4312671. PMID 7348208.Reimpreso en Johnson, C. J (octubre de 1981). "Incidencia de cáncer en un área contaminada con radionúclidos cerca de una instalación nuclear". Colo Med . 78 (10): 385–92. PMID 7348208.
- ^ "Refugio Nacional de Vida Silvestre Rocky Flats". Servicio de Pesca y Vida Silvestre de Estados Unidos. Archivado desde el original el 9 de abril de 2020. Consultado el 2 de julio de 2013 .
- ^ Secretario de Prensa (23 de julio de 2002). "President Signs Yucca Mountain Bill". Washington (DC): Oficina del Secretario de Prensa, Casa Blanca. Archivado desde el original el 6 de marzo de 2008. Consultado el 9 de febrero de 2015 .
- ^ Hebert, H. Josef (6 de marzo de 2009). "Los desechos nucleares no irán a la montaña Yucca de Nevada, dice un funcionario de Obama". Chicago Tribune . p. 4. Archivado desde el original el 24 de marzo de 2011 . Consultado el 17 de marzo de 2011 .
- ^ "Acerca de la Comisión". Archivado desde el original el 21 de junio de 2011.
- ^ Comisión Blue Ribbon sobre el futuro nuclear de Estados Unidos. "Informe del Subcomité de Eliminación de Armas Nucleares a la Comisión en pleno" (PDF) . Archivado desde el original (PDF) el 25 de enero de 2017. Consultado el 26 de febrero de 2017 .
- ^ abc Moss, William; Eckhardt, Roger (1995). "The Human Plutonium Injection Experiments" (PDF) . Los Alamos Science . 23 . Los Alamos National Laboratory: 188, 205, 208, 214. Archivado (PDF) desde el original el 14 de enero de 2009 . Consultado el 6 de junio de 2006 .
- ^ ab Voelz, George L. (2000). "Plutonio y salud: ¿Qué tan grande es el riesgo?". Los Alamos Science (26). Los Alamos (NM): Los Alamos National Laboratory: 78–79.
- ^ ab Longworth, RC (noviembre-diciembre de 1999). "Injected! Book review: The Plutonium Files: America's Secret Medical Experiments in the Cold War". El Boletín de los Científicos Atómicos . 55 (6): 58-61. doi :10.2968/055006016. Archivado desde el original el 5 de enero de 2013.
- ^ Moss, William y Roger Eckhardt (1995). "Los experimentos de inyección de plutonio en humanos". Los Alamos Science. 23: 177–233.
- ^ Openness, DOE. (Junio de 1998). Experimentos de radiación humana: Informe ACHRE. Capítulo 5: Los experimentos del distrito de Manhattan; la primera inyección. Washington, DC. Superintendente de Documentos, Oficina de Imprenta del Gobierno de los Estados Unidos.
- ^ AEC n.º UR-38, Informe técnico trimestral de 1948
- ^ Yesley, Michael S. (1995). «'Daño ético' y los experimentos de inyección de plutonio» (PDF) . Los Alamos Science . 23 : 280–283. Archivado (PDF) desde el original el 24 de febrero de 2009. Consultado el 15 de febrero de 2009 .
- ^ Martín 2000, pág. 532.
- ^ ab "Nuclear Weapon Design". Federación de Científicos Estadounidenses . 1998. Archivado desde el original el 26 de diciembre de 2008. Consultado el 7 de diciembre de 2008 .
- ^ ab "Mixed Oxide (MOX) Fuel". Londres (Reino Unido): Asociación Nuclear Mundial. 2006. Archivado desde el original el 1 de marzo de 2013. Consultado el 14 de diciembre de 2008 .
- ^ Till y Chang 2011, págs. 254-256.
- ^ Till y Chang 2011, pág. 15.
- ^ Besmann, Theodore M. (2005). "Comportamiento termoquímico del galio en combustible de reactores de agua ligera (LWR) de óxido mixto derivado de material para armas". Journal of the American Ceramic Society . 81 (12): 3071–3076. doi :10.1111/j.1151-2916.1998.tb02740.x. Archivado desde el original el 17 de marzo de 2020 . Consultado el 29 de junio de 2019 .
- ^ abcd «Plutonio». Asociación Nuclear Mundial. Marzo de 2009. Archivado desde el original el 30 de marzo de 2010. Consultado el 28 de febrero de 2010 .
- ^ "Ciencia para las masas críticas: cómo cambia el plutonio con el tiempo". Instituto de Investigación Energética y Ambiental. Archivado desde el original el 14 de febrero de 2012. Consultado el 2 de julio de 2010 .
- ^ ab "De fuentes de calor a fuentes de corazón: Los Álamos fabricó material para una bomba impulsada por plutonio". Actinide Research Quarterly (1). Los Álamos: Laboratorio Nacional de Los Álamos. 2005. Archivado desde el original el 16 de febrero de 2013. Consultado el 15 de febrero de 2009 .
- ^ "Por qué la misión Cassini no puede utilizar paneles solares" (PDF) . NASA/JPL. 6 de diciembre de 1996. Archivado desde el original (PDF) el 26 de febrero de 2015 . Consultado el 21 de marzo de 2014 .
- ^ St. Fleur, Nicholas, "El corazón radiactivo de la nave espacial New Horizons a Plutón" Archivado el 9 de enero de 2017 en Wayback Machine , New York Times , 7 de agosto de 2015. "El generador de 125 libras de la nave [se] llama Generador Termoeléctrico de Radioisótopos de Fuente de Calor de Propósito General. [Estaba] cargado con 24 libras de plutonio que producían alrededor de 240 vatios de electricidad cuando salió de la Tierra en 2006, según Ryan Bechtel, un ingeniero del Departamento de Energía que trabaja en energía nuclear espacial. Durante el sobrevuelo de Plutón, la batería produjo 202 vatios, dijo Bechtel. La energía continuará disminuyendo a medida que el metal se desintegra, pero hay suficiente para comandar la sonda durante otros 20 años, según Curt Niebur, un científico del programa de la NASA en la misión New Horizons". Consultado el 10 de agosto de 2015.
- ^ Mosher, Dave (19 de septiembre de 2013). «El problema del plutonio de la NASA podría acabar con la exploración del espacio profundo». Wired . Archivado desde el original el 8 de febrero de 2015. Consultado el 5 de febrero de 2015 .
- ^ "Vida útil de la nave espacial Voyager". Laboratorio de Propulsión a Chorro . 11 de junio de 2014. Archivado desde el original el 27 de octubre de 2007. Consultado el 5 de febrero de 2015 .
- ^ Venkateswara Sarma Mallela; V. Ilankumaran y N. Srinivasa Rao (2004). "Tendencias en baterías para marcapasos cardíacos". Indian Pacing Electrophysiol . 4 (4): 201–212. PMC 1502062. PMID 16943934 .
- ^ "Marcapasos alimentados con plutonio (1974)". Oak Ridge Associated Universities. Archivado desde el original el 29 de octubre de 2021. Consultado el 11 de octubre de 2021 .
- ^ "Marcapasos alimentados con plutonio (1974)". Oak Ridge: Orau.org. 2021. Archivado desde el original el 29 de octubre de 2021. Consultado el 11 de octubre de 2021 .
- ^ "El marcapasos nuclear sigue funcionando después de 34 años". 19 de diciembre de 2007. Archivado desde el original el 9 de enero de 2018. Consultado el 14 de marzo de 2019 .
- ^ Bayles, John J.; Taylor, Douglas (1970). SEALAB III – Sistema de calentamiento isotópico de trajes de baño para buceadores (informe). Port Hueneme: Naval Civil Engineering Lab. AD0708680. Archivado desde el original el 12 de marzo de 2020.
- ^ "Perfil toxicológico del plutonio" (PDF) . Departamento de Salud y Servicios Humanos de Estados Unidos, Agencia para Sustancias Tóxicas y Registro de Enfermedades (ATSDR). Noviembre de 2010. Archivado (PDF) desde el original el 28 de mayo de 2012. Consultado el 9 de febrero de 2015 .
- ^ Little, MP (junio de 2009). "Efectos cancerígenos y no cancerígenos en los supervivientes japoneses de la bomba atómica". J Radiol Prot . 29 (2A): A43–59. Bibcode :2009JRP....29...43L. doi :10.1088/0952-4746/29/2A/S04. PMID 19454804. S2CID 29868078.
- ^ "Plutonio, CAS ID #: 7440-07-5". Centros para el Control y la Prevención de Enfermedades (CDC) Agencia para Sustancias Tóxicas y Registro de Enfermedades . Archivado desde el original el 5 de febrero de 2015. Consultado el 5 de febrero de 2015 .
- ^ Grellier, James; Atkinson, Will; Bérard, Philippe; Bingham, Derek; Birchall, Alan; Blanchardon, Eric; Bull, Richard; Guseva Canu, Irina; Challeton-de Vathaire, Cécile; Cockerill, Rupert; Do, Minh T; Engels, Hilde; Figuerola, Jordi; Foster, Adrian; Holmstock, Luc; Hurtgen, Christian; Laurier, Dominique; Puncher, Matthew; Riddell, Tony; Samson, Eric; Thierry-Chef, Isabelle; Tirmarche, Margot; Vrijheid, Martine; Cardis, Elisabeth (2017). "Riesgo de mortalidad por cáncer de pulmón en trabajadores nucleares por exposición interna a radionucleidos emisores de partículas alfa". Epidemiología . 28 (5): 675–684. doi :10.1097/EDE.0000000000000684. PMC 5540354 . PMID 28520643.
- ^ "Capacitación técnica en control radiológico" (PDF) . Departamento de Energía de Estados Unidos. Archivado desde el original (PDF) el 30 de junio de 2007. Consultado el 14 de diciembre de 2008 .
- ^ abc Cohen, Bernard L. "El mito de la toxicidad del plutonio". Archivado desde el original el 26 de agosto de 2011.
- ^ Cohen, Bernard L. (mayo de 1977). "Peligros derivados de la toxicidad del plutonio". The Radiation Safety Journal: Health Physics . 32 (5): 359–379. doi :10.1097/00004032-197705000-00003. PMID 881333. S2CID 46325265.
- ^ Welsome, Eileen (1999). Los expedientes del plutonio: los experimentos médicos secretos de Estados Unidos durante la Guerra Fría . Nueva York: The Dial Press. pp. 15-19. ISBN 0-385-31402-7.OCLC 537755781 .
- ^ Brown, Shannon C.; Margaret F. Schonbeck; David McClure; et al. (julio de 2004). "Cáncer de pulmón y dosis pulmonares internas entre trabajadores de plutonio en la planta Rocky Flats: un estudio de casos y controles". American Journal of Epidemiology . 160 (2). Oxford Journals: 163–172. doi : 10.1093/aje/kwh192 . PMID 15234938.
- ^ "Hoja informativa sobre la salud humana del ANL: plutonio" (PDF) . Laboratorio Nacional Argonne. 2001. Archivado desde el original (PDF) el 16 de febrero de 2013 . Consultado el 16 de junio de 2007 .
- ^ "Protección radiológica, plutonio: ¿Qué hace el plutonio una vez que entra en el cuerpo?". Agencia de Protección Ambiental de Estados Unidos. Archivado desde el original el 16 de marzo de 2011. Consultado el 15 de marzo de 2011 .
- ^ "¿Dijo Ralph Nader que una libra de plutonio podría causar 8 mil millones de cánceres?". Archivado desde el original el 3 de noviembre de 2013. Consultado el 3 de enero de 2013 .
- ^ por Bernard L. Cohen. "La opción de la energía nuclear, capítulo 13, Plutonio y bombas". Archivado desde el original el 21 de julio de 2013. Consultado el 28 de marzo de 2011 .(Versión en línea del libro de Cohen The Nuclear Energy Option (Plenum Press, 1990) ISBN 0-306-43567-5 ).
- ^ Voelz, GL (1975). "Lo que hemos aprendido sobre el plutonio a partir de datos humanos". The Radiation Safety Journal Health Physics . 29 (4): 551–561. doi :10.1097/00004032-197510000-00011. PMID 1205858. S2CID 11705537. Archivado desde el original el 16 de agosto de 2017 . Consultado el 29 de diciembre de 2009 .
- ^ ab Skwarzec, B; Struminska, D; Borylo, A (2001). "Bioacumulación y distribución de plutonio en peces de la bahía de Gdansk". Journal of Environmental Radioactivity . 55 (2): 167–178. Bibcode :2001JEnvR..55..167S. doi :10.1016/s0265-931x(00)00190-9. PMID 11398376.
- ^ Baxter, M; Fowler, S; Povined, P (1995). "Observaciones sobre plutonio en los océanos". Applied Radiation and Isotopes . 46 (11): 1213–1223. Bibcode :1995AppRI..46.1213B. doi :10.1016/0969-8043(95)00163-8.
- ^ Lerebours, A; Gudkov, D; Nagorskaya, L; Kaglyan, A; Rizewski, V; Leshchenko, A (2018). "Impacto de la radiación ambiental en la salud y el estado reproductivo de los peces de Chernóbil". Environmental Science & Technology . 52 (16): 9442–9450. Bibcode :2018EnST...52.9442L. doi : 10.1021/acs.est.8b02378 . PMID 30028950.
- ^ Till, John E.; Kaye, SV; Trabalka, JR (1976). "La toxicidad del uranio y el plutonio para los embriones en desarrollo de los peces". Oak Ridge National Laboratory : 187. doi : 10.2172/7344946 . Archivado desde el original el 16 de marzo de 2022 . Consultado el 20 de noviembre de 2020 .
- ^ Miner 1968, pág. 546
- ^ Roark, Kevin N. (2000). "Se emitió un informe sobre accidentes de criticidad". Los Alamos (NM): Laboratorio Nacional de Los Alamos. Archivado desde el original el 8 de octubre de 2008. Consultado el 16 de noviembre de 2008 .
- ^ Hunner 2004, pág. 85.
- ^ "Raemer Schreiber". Biografías del personal . Los Alamos: Laboratorio Nacional de Los Alamos. Archivado desde el original el 3 de enero de 2013. Consultado el 16 de noviembre de 2008 .
- ^ McLaughlin, Monahan y Pruvost 2000, pág. 17.
- ^ Albright, David; O'Neill, Kevin (1999). "Las lecciones del secreto nuclear en Rocky Flats". ISIS Issue Brief . Instituto para la Ciencia y la Seguridad Internacional (ISIS). Archivado desde el original el 8 de julio de 2008 . Consultado el 7 de diciembre de 2008 .
- ^ "Transporte de materiales radiactivos". Asociación Nuclear Mundial. Archivado desde el original el 5 de febrero de 2015. Consultado el 6 de febrero de 2015 .
- ^ "§ 71.63 Requisito especial para envíos de plutonio". Comisión Reguladora Nuclear de los Estados Unidos . Archivado desde el original el 5 de febrero de 2015. Consultado el 6 de febrero de 2015 .
- ^ "Garceta del Pacífico". Archivado desde el original el 20 de abril de 2016 . Consultado el 22 de marzo de 2016 .
- ^ Yamaguchi, Mari. «Dos barcos británicos llegan a Japón para llevar plutonio a EE.UU.». Archivado desde el original el 23 de marzo de 2016. Consultado el 22 de marzo de 2016 .
- ^ «Dos barcos británicos llegan a Japón para transportar plutonio para su almacenamiento en EE.UU.» Archivado desde el original el 24 de marzo de 2016 . Consultado el 22 de marzo de 2016 .
- ^ "Parte 175.704 Envíos de plutonio". Código de Regulaciones Federales 49 — Transporte . Archivado desde el original el 27 de abril de 2012 . Consultado el 1 de agosto de 2012 .
- ^ abc Av Ida Søraunet Wangberg y Anne Kari Hinna. "Klassekampen: Flyr plutonio con rutefly". Klassekampen.no. Archivado desde el original el 2 de agosto de 2012 . Consultado el 13 de agosto de 2012 .
Referencias
- Asimov, Isaac (1988). "Reactores nucleares". Entendiendo la física . Nueva York: Barnes & Noble Publishing. ISBN 0-88029-251-2.
- Bernstein, Jeremy (2007). Plutonio: una historia del elemento más peligroso del mundo . Washington, DC: Joseph Henry Press. ISBN 978-0-309-10296-4.OCLC 76481517 .
- Clark, Ronald (1961). El nacimiento de la bomba: la historia no contada del papel de Gran Bretaña en el arma que cambió el mundo . Londres: Phoenix House. OCLC 824335.
- Eagleson, Mary (1994). Enciclopedia concisa de química . Berlín: Walter de Gruyter. ISBN 978-3-11-011451-5.
- Emsley, John (2001). "Plutonio". Los elementos básicos de la naturaleza: una guía de la A a la Z sobre los elementos . Oxford (Reino Unido): Oxford University Press. ISBN 0-19-850340-7.
- Gosling, FG (1999). El Proyecto Manhattan: Fabricación de la bomba atómica (PDF) . Oak Ridge: Departamento de Energía de los Estados Unidos. ISBN 0-7881-7880-6. DOE/MA-0001-01/99. Archivado desde el original (PDF) el 24 de febrero de 2009 . Consultado el 15 de febrero de 2009 .
- Greenwood, NN; Earnshaw, A. (1997). Química de los elementos (2.ª ed.). Oxford (Reino Unido): Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Heiserman, David L. (1992). "Elemento 94: plutonio" . Exploración de elementos químicos y sus compuestos . Nueva York (NY): TAB Books. págs. 337–340. ISBN 0-8306-3018-X.
- Hoddeson, Lillian ; Henriksen, Paul W.; Meade, Roger A.; Westfall, Catherine L. (1993). Critical Assembly: A Technical History of Los Alamos During the Oppenheimer Years, 1943–1945 [Ensamblaje crítico: una historia técnica de Los Álamos durante los años de Oppenheimer, 1943–1945] . Nueva York: Cambridge University Press. ISBN 0-521-44132-3.OCLC 26764320 .
- Hunner, Jon (2004). Inventando Los Álamos . Prensa de la Universidad de Oklahoma. ISBN 978-0-8061-3891-6.
- Hurst, DG; Ward, AG (1956). Reactores de investigación canadienses (PDF) . Ottawa: Atomic Energy of Canada Limited. OCLC 719819357. Archivado (PDF) desde el original el 5 de febrero de 2015 . Consultado el 6 de febrero de 2015 .
- Jha, DK (2004). Energía nuclear. Discovery Publishing House. ISBN 81-7141-884-8Archivado del original el 6 de enero de 2022 . Consultado el 6 de enero de 2022 .
- Kaku, Michio; Trainer, Jennifer (1983). Energía nuclear, ambos lados: los mejores argumentos a favor y en contra de la tecnología más controvertida. WW Norton & Company. ISBN 9780393301281Archivado desde el original el 6 de enero de 2022 . Consultado el 8 de diciembre de 2013 .
- Kay, AE (1965). Plutonio 1965. Taylor & Francis. Archivado desde el original el 6 de enero de 2022. Consultado el 6 de enero de 2022 .
- Lide, David R., ed. (2006). Manual de química y física (87.ª edición). Boca Raton: CRC Press, Taylor & Francis Group. ISBN 0-8493-0487-3.
- Magurno, BA; Pearlstein, S., eds. (1981). Actas de la conferencia sobre métodos y procedimientos de evaluación de datos nucleares. BNL-NCS 51363 (PDF) . Vol. II. Upton: Brookhaven National Laboratory . Archivado (PDF) del original el 8 de marzo de 2021. Consultado el 6 de agosto de 2014 .
- Martin, James E. (2000). Física para la protección radiológica . Wiley-Interscience. ISBN 0-471-35373-6.
- McLaughlin, Thomas P.; Monahan, Shean P.; Pruvost, Norman L. (2000). Una revisión de los accidentes de criticidad (PDF) . Los Álamos: Laboratorio Nacional de Los Álamos. LA-13638. Archivado (PDF) desde el original el 18 de enero de 2017 . Consultado el 6 de febrero de 2015 .
- Miner, William N.; Schonfeld, Fred W. (1968). "Plutonio" . En Clifford A. Hampel (ed.). La enciclopedia de los elementos químicos . Nueva York (NY): Reinhold Book Corporation. págs. 540–546. LCCN 68029938.
- Moody, Kenton James; Hutcheon, Ian D.; Grant, Patrick M. (2005). Análisis forense nuclear. CRC Press. ISBN 0-8493-1513-1Archivado del original el 6 de enero de 2022 . Consultado el 6 de enero de 2022 .
- Rhodes, Richard (1986). La fabricación de la bomba atómica . Nueva York: Simon & Schuster. ISBN. 0-671-65719-4.
- Seaborg, GT; Seaborg, E. (2001). Aventuras en la era atómica: de Watts a Washington . Farrar, Straus y Giroux. ISBN 0-374-29991-9.
- Sklar, Morty (1984). Nuke-Rebuke: Escritores y artistas contra la energía nuclear y las armas nucleares . Serie de antología contemporánea. The Spirit That Moves Us Press.
- Instituto Internacional de Investigación para la Paz de Estocolmo (2007). Anuario SIPRI 2007: Armamentos, desarme y seguridad internacional. Oxford University Press. ISBN 978-0-19-923021-1Archivado del original el 6 de enero de 2022 . Consultado el 6 de enero de 2022 .
- Till, CE; Chang, YI (2011). Energía abundante: la historia del reactor rápido integral, la compleja historia de una tecnología de reactor simple, con énfasis en su base científica para no especialistas . Charles E. Till y Yoon Il Chang. ISBN 978-1-4663-8460-6.
- Wahlen, RK (1989). Historia del área 100-B (PDF) . Richland, Washington: Westinghouse Hanford Company. WHC-EP-0273. Archivado desde el original (PDF) el 27 de marzo de 2009. Consultado el 15 de febrero de 2009 .
- Welsome, Eileen (2000). Los expedientes del plutonio: los experimentos médicos secretos de Estados Unidos durante la Guerra Fría . Nueva York: Random House. ISBN 0-385-31954-1.
Enlaces externos
- "Biblioteca digital Alsos para cuestiones nucleares: plutonio". Universidad Washington y Lee . Archivado desde el original el 3 de febrero de 2009. Consultado el 15 de febrero de 2009 .
- Sutcliffe, WG; et al. (1995). "Una perspectiva sobre los peligros del plutonio". Laboratorio Nacional Lawrence Livermore . Archivado desde el original el 29 de septiembre de 2006.
- "Propiedades físicas, nucleares y químicas del plutonio". IEER . 2005 . Consultado el 15 de febrero de 2009 .
- "Una historia del plutonio". Laboratorio Nacional de Los Álamos . Consultado el 8 de julio de 2023 .
- Bhadeshia, H. "Cristalografía de plutonio".
- Samuels, D. (2005). "El fin de la era del plutonio". Revista Discover . 26 (11).
- Pike, J.; Sherman, R. (2000). "Producción de plutonio". Federación de Científicos Estadounidenses . Archivado desde el original el 3 de febrero de 2009. Consultado el 15 de febrero de 2009 .
- "Fabricación y fabricación de plutonio".
- Ong, C. (1999). «World Plutonium Inventories». Nuclear Files.org. Archivado desde el original el 5 de agosto de 2014. Consultado el 15 de febrero de 2009 .
- "Desafíos en la ciencia del plutonio". Los Alamos Science . I & II (26). 2000 . Consultado el 15 de febrero de 2009 .
- "Plutonio". Royal Society of Chemistry . Consultado el 6 de febrero de 2015 .
- "Plutonio". La tabla periódica de vídeos . Universidad de Nottingham . Consultado el 6 de febrero de 2015 .
- Fabricación de combustible de plutonio por el Laboratorio Nacional de Argonne en YouTube




![{\displaystyle {\ce {{^{238}_{92}U}+{^{1}_{0}n}->{^{239}_{92}U}->[\beta ^{ -}][23.5\ {\ce {min}}]{^{239}_{93}Np}->[\beta ^{-}][2.3565\ {\ce {d}}]{^{239 }_{94}Pu}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9ba9e4744226a97ce8a41fd5b5e50b18cc259a9)
![{\displaystyle {\begin{aligned}{\ce {{^{238}_{92}U}+{^{2}_{1}H}->}}&{\ce {{^{238} _{93}Np}+2_{0}^{1}n}}\\&{\ce {^{238}_{93}Np->[\beta ^{-}][2.117\ {\ce {d}}]{^{238}_{94}Pu}}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/01aef6133d1d81ba9a87860f7409d5d694dc0fa9)





