microARN


Los microácidos ribonucleicos ( microARN , miARN , µARN ) son pequeñas moléculas de ARN monocatenario no codificante que contienen entre 21 y 23 nucleótidos . [1] Los miARN, que se encuentran en plantas, animales e incluso algunos virus, participan en el silenciamiento del ARN y la regulación postranscripcional de la expresión génica . [2] [3] Los miARN forman pares de bases con secuencias complementarias en moléculas de ARN mensajero (ARNm), [4] luego silencian dichas moléculas de ARNm mediante uno o más de los siguientes procesos: [1] [5]
- Escindiendo la cadena de ARNm en dos pedazos.
- Desestabilizando el ARNm acortando su cola poli(A) .
- Reducir la traducción del ARNm en proteínas.
En las células de los seres humanos y otros animales, los miRNA actúan principalmente desestabilizando el ARNm. [6] [7]
Los miRNA se parecen a los ARN interferentes pequeños (siRNA) de la vía de interferencia de ARN (RNAi) , excepto que los miRNA derivan de regiones de transcripciones de ARN que se pliegan sobre sí mismas para formar horquillas cortas, mientras que los siRNA derivan de regiones más largas de ARN bicatenario . [2] El genoma humano puede codificar más de 1900 miRNA, [8] [9] Sin embargo, solo alrededor de 500 miRNA humanos representan miRNA genuinos en la base de datos de genes de miRNA curada manualmente MirGeneDB . [10]
Los miRNA son abundantes en muchos tipos de células de mamíferos. [11] [12] Parecen afectar a alrededor del 60% de los genes de los humanos y otros mamíferos. [13] [14] Muchos miRNA están conservados evolutivamente, lo que implica que tienen funciones biológicas importantes. [15] [1] Por ejemplo, 90 familias de miRNA se han conservado desde al menos el ancestro común de los mamíferos y los peces, y la mayoría de estos miRNA conservados tienen funciones importantes, como lo demuestran estudios en los que se han eliminado genes de uno o más miembros de una familia en ratones. [1]
En 2024, los científicos estadounidenses Victor Ambros y Gary Ruvkun recibieron el Premio Nobel de Fisiología o Medicina por su trabajo en el descubrimiento de miRNA y su papel en la regulación genética postranscripcional. [16] [17] [18]
Historia
El primer miRNA se descubrió a principios de los años 1990. [19] Sin embargo, no se los reconoció como una clase distinta de reguladores biológicos hasta principios de los años 2000. [20] [21] [22] [23] [24] Las investigaciones revelaron diferentes conjuntos de miRNA expresados en diferentes tipos de células y tejidos [12] [25] y múltiples funciones para los miRNA en el desarrollo de plantas y animales y en muchos otros procesos biológicos. [26] [27] [28] [29] [30] [31] [32] La expresión aberrante de miRNA está implicada en estados patológicos. Se están investigando terapias basadas en miRNA. [33] [34] [35] [36]
El primer miRNA fue descubierto en 1993 por un grupo dirigido por Victor Ambros e incluyendo a Lee y Feinbaum. Sin embargo, para obtener más información sobre su modo de acción fue necesario que el equipo de Gary Ruvkun publicara simultáneamente un trabajo que incluía a Wightman y Ha. [19] [37] Estos grupos publicaron artículos consecutivos sobre el gen lin-4 , que se sabía que controlaba el momento del desarrollo larvario de C. elegans al reprimir el gen lin-14 . Cuando Lee et al. aislaron el miRNA lin-4 , descubrieron que en lugar de producir un ARNm que codificaba una proteína, producía ARN cortos no codificantes , uno de los cuales era un ARN de ~22 nucleótidos que contenía secuencias parcialmente complementarias a múltiples secuencias en el UTR 3' del ARNm lin-14 . [19] Se propuso que esta complementariedad inhibía la traducción del ARNm lin-14 en la proteína LIN-14. En aquella época se pensaba que el ARN pequeño lin-4 era una idiosincrasia de los nematodos .
En 2000, se caracterizó un segundo ARN pequeño: el ARN let-7 , que reprime lin-41 para promover una transición de desarrollo posterior en C. elegans . [20] Se descubrió que el ARN let-7 estaba conservado en muchas especies, lo que llevó a la sugerencia de que el ARN let-7 y otros "ARN temporales pequeños" podrían regular el momento del desarrollo en diversos animales, incluidos los humanos. [21]
Un año después, se descubrió que los ARN lin-4 y let-7 formaban parte de una gran clase de ARN pequeños presentes en C. elegans , Drosophila y células humanas. [22] [23] [24] Los numerosos ARN de esta clase se parecían a los ARN lin-4 y let-7 , excepto que sus patrones de expresión eran generalmente incompatibles con un papel en la regulación del momento del desarrollo. Esto sugirió que la mayoría podría funcionar en otros tipos de vías reguladoras. En este punto, los investigadores comenzaron a utilizar el término "microARN" para referirse a esta clase de ARN reguladores pequeños. [22] [23] [24]
La primera enfermedad humana asociada con la desregulación de los miRNA fue la leucemia linfocítica crónica . En este trastorno, los miRNA tienen una doble función: funcionan como supresores tumorales y oncogenes. [38]
Nomenclatura
En un sistema de nomenclatura estándar, los nombres se asignan a los miRNA confirmados experimentalmente antes de su publicación. [39] [40] El prefijo "miR" va seguido de un guión y un número, que a menudo indica el orden de denominación. Por ejemplo, el miR-124 recibió su nombre y probablemente se descubrió antes que el miR-456. Un "miR-" con mayúscula se refiere a la forma madura del miRNA, mientras que un "mir-" sin mayúscula se refiere al pre-miRNA y al pri-miRNA. [41] Los genes que codifican los miRNA también se nombran utilizando el mismo prefijo de tres letras de acuerdo con las convenciones de la nomenclatura de genes del organismo. Por ejemplo, los nombres oficiales de los genes de los miRNA en algunos organismos son " mir-1 en C. elegans y Drosophila, Mir1 en Rattus norvegicus y MIR25 en humanos.
Los miRNA con secuencias casi idénticas, excepto por uno o dos nucleótidos, se anotan con una letra minúscula adicional. Por ejemplo, el miR-124a está estrechamente relacionado con el miR-124b. Por ejemplo:
- hsa-miR-181a :aacauucaACgcugucggugAgu
- hsa-miR-181b :aacauucaUUgcugucggugGgu
Los pre-miRNA, pri-miRNA y los genes que dan lugar a miRNA maduros 100% idénticos pero que se encuentran en diferentes lugares del genoma se indican con un sufijo adicional de número y guión. Por ejemplo, los pre-miRNA hsa-mir-194-1 y hsa-mir-194-2 dan lugar a un miRNA maduro idéntico (hsa-miR-194) pero proceden de genes ubicados en diferentes regiones del genoma.
La especie de origen se designa con un prefijo de tres letras, p. ej., hsa-miR-124 es un miRNA humano ( Homo sapiens ) y oar-miR-124 es un miRNA de oveja ( Ovis aries ). Otros prefijos comunes incluyen "v" para viral (miRNA codificado por un genoma viral) y "d" para miRNA de Drosophila (una mosca de la fruta que se estudia comúnmente en la investigación genética).
Cuando dos microARN maduros se originan en brazos opuestos del mismo pre-miARN y se encuentran en cantidades aproximadamente similares, se denotan con un sufijo -3p o -5p. (En el pasado, esta distinción también se hacía con "s" ( sentido ) y "as" (antisentido)). Sin embargo, el microARN maduro encontrado en un brazo de la horquilla suele ser mucho más abundante que el encontrado en el otro brazo, [2] en cuyo caso, un asterisco después del nombre indica las especies maduras encontradas en niveles bajos en el brazo opuesto de una horquilla. Por ejemplo, miR-124 y miR-124* comparten una horquilla de pre-miARN, pero se encuentra mucho más miR-124 en la célula.
Objetivos
Los miRNA de plantas suelen tener un emparejamiento casi perfecto con sus ARNm diana, lo que induce la represión génica a través de la escisión de las transcripciones diana. [26] [42] Por el contrario, los miRNA animales pueden reconocer sus ARNm diana utilizando tan solo 6-8 nucleótidos (la región semilla) en el extremo 5' del miRNA, [13] [43] [44] lo que no es un emparejamiento suficiente para inducir la escisión de los ARNm diana. [4] La regulación combinatoria es una característica de la regulación de miRNA en animales. [4] [45] Un miRNA determinado puede tener cientos de ARNm dianas diferentes, y una diana determinada puede estar regulada por múltiples miRNA. [14] [46]
Las estimaciones del número promedio de ARN mensajeros únicos que son objetivos de represión por un miRNA típico varían, dependiendo del método de estimación, [47] pero múltiples enfoques muestran que los miRNA de mamíferos pueden tener muchos objetivos únicos. Por ejemplo, un análisis de los miRNA altamente conservados en vertebrados muestra que cada uno tiene, en promedio, aproximadamente 400 objetivos conservados. [14] De la misma manera, los experimentos muestran que una sola especie de miRNA puede reducir la estabilidad de cientos de ARN mensajeros únicos. [48] Otros experimentos muestran que una sola especie de miRNA puede reprimir la producción de cientos de proteínas, pero que esta represión a menudo es relativamente leve (mucho menos del doble). [49] [50]
Biogénesis

Hasta un 40% de los genes de miRNA pueden encontrarse en los intrones o incluso en los exones de otros genes. [51] Estos se encuentran generalmente, aunque no exclusivamente, en una orientación de sentido, [52] [53] y por lo tanto suelen estar regulados junto con sus genes hospedadores. [51] [54] [55]
La plantilla de ADN no es la última palabra sobre la producción de miRNA maduros: el 6% de los miRNA humanos muestran edición de ARN ( IsomiRs ), la modificación específica del sitio de las secuencias de ARN para producir productos diferentes de los codificados por su ADN. Esto aumenta la diversidad y el alcance de la acción de los miRNA más allá de lo que implica el genoma solo.
Transcripción
Los genes de miRNA son transcritos generalmente por la ARN polimerasa II (Pol II). [56] [57] La polimerasa a menudo se une a un promotor que se encuentra cerca de la secuencia de ADN, codificando lo que se convertirá en el bucle de horquilla del pre-miRNA. La transcripción resultante se tapa con un nucleótido especialmente modificado en el extremo 5', se poliadenila con múltiples adenosinas (una cola de poli(A)), [56] [52] y se empalma . Los miRNA animales se transcriben inicialmente como parte de un brazo de un bucle de tallo de ARN de ~80 nucleótidos que a su vez forma parte de un precursor de miRNA de varios cientos de nucleótidos de longitud denominado pri-miRNA. [56] [52] Cuando se encuentra un precursor de bucle de tallo en el 3' UTR, una transcripción puede servir como un pri-miRNA y un ARNm. [52] La ARN polimerasa III (Pol III) transcribe algunos miRNA, especialmente aquellos con secuencias Alu ascendentes , ARN de transferencia (ARNt) y unidades promotoras de repetición intercalada ancha de mamíferos (MWIR). [58]
Procesamiento nuclear

Un único pri-miRNA puede contener de uno a seis precursores de miRNA. Estas estructuras en forma de horquilla están compuestas por unos 70 nucleótidos cada una. Cada horquilla está flanqueada por secuencias necesarias para un procesamiento eficiente.
La estructura de ARN bicatenario (dsRNA) de las horquillas en un pri-miRNA es reconocida por una proteína nuclear conocida como Región Crítica 8 del Síndrome de DiGeorge (DGCR8 o "Pasha" en invertebrados ), llamada así por su asociación con el Síndrome de DiGeorge . DGCR8 se asocia con la enzima Drosha , una proteína que corta el ARN, para formar el complejo Microprocesador . [59] [60] En este complejo, DGCR8 orienta el dominio catalítico RNasa III de Drosha para liberar las horquillas de los pri-miRNA cortando el ARN aproximadamente once nucleótidos desde la base de la horquilla (un giro helicoidal de dsRNA en el tallo). [61] [62] El producto resultante tiene un saliente de dos nucleótidos en su extremo 3'; tiene grupos hidroxilo 3' y fosfato 5'. A menudo se lo denomina pre-miRNA (precursor-miRNA). Se han identificado motivos de secuencia aguas abajo del pre-miRNA que son importantes para un procesamiento eficiente. [63] [64] [65]
Los pre-miRNA que se empalman directamente de los intrones, sin pasar por el complejo del microprocesador, se conocen como " mirtrones ". [66] Se han encontrado mirtrones en Drosophila , C. elegans y mamíferos. [66] [67]
Hasta un 16% de los pre-miRNAs pueden ser alterados a través de la edición nuclear de ARN . [68] [69] [70] Más comúnmente, las enzimas conocidas como adenosina desaminasas que actúan sobre el ARN (ADAR) catalizan las transiciones de adenosina a inosina (A a I). La edición de ARN puede detener el procesamiento nuclear (por ejemplo, de pri-miR-142, lo que lleva a la degradación por la ribonucleasa Tudor-SN) y alterar los procesos posteriores, incluido el procesamiento citoplasmático de miRNA y la especificidad del objetivo (por ejemplo, al cambiar la región semilla de miR-376 en el sistema nervioso central). [68]
Exportación nuclear

Las horquillas pre-miRNA se exportan desde el núcleo en un proceso que involucra la transportadora nucleocitoplasmática Exportin-5 . Esta proteína, un miembro de la familia de las carioferinas , reconoce un saliente de dos nucleótidos dejado por la enzima ARNasa III Drosha en el extremo 3' de la horquilla pre-miRNA. El transporte mediado por Exportin-5 al citoplasma depende de la energía, utilizando guanosina trifosfato (GTP) unido a la proteína Ran . [71]
Procesamiento citoplasmático
En el citoplasma , la horquilla pre-miRNA es escindida por la enzima ARNasa III Dicer . [72] Esta endorribonucleasa interactúa con los extremos 5' y 3' de la horquilla [73] y corta el bucle que une los brazos 3' y 5', produciendo un dúplex miRNA:miRNA* imperfecto de aproximadamente 22 nucleótidos de longitud. [72] La longitud total de la horquilla y el tamaño del bucle influyen en la eficiencia del procesamiento de Dicer. La naturaleza imperfecta del apareamiento miRNA:miRNA* también afecta la escisión. [72] [74] Algunos de los pre-miRNA ricos en G pueden adoptar potencialmente la estructura G-quadruplex como una alternativa a la estructura de tallo-bucle canónica. Por ejemplo, el pre-miRNA humano 92b adopta una estructura G-quadruplex que es resistente a la escisión mediada por Dicer en el citoplasma . [75] Aunque cualquiera de las cadenas del dúplex puede actuar potencialmente como un miRNA funcional, normalmente solo una cadena se incorpora al complejo de silenciamiento inducido por ARN (RISC) donde el miRNA y su ARNm objetivo interactúan.
Si bien la mayoría de los miRNA se encuentran dentro de la célula, algunos miRNA, comúnmente conocidos como miRNA circulantes o miRNA extracelulares, también se han encontrado en el entorno extracelular, incluidos varios fluidos biológicos y medios de cultivo celular. [76] [77]
Biogénesis en plantas
La biogénesis de miRNA en plantas difiere de la biogénesis animal principalmente en los pasos de procesamiento nuclear y exportación. En lugar de ser escindidos por dos enzimas diferentes, una dentro y otra fuera del núcleo, ambas escisiones del miRNA vegetal son realizadas por un homólogo de Dicer, llamado Dicer-like1 (DL1). DL1 se expresa solo en el núcleo de las células vegetales, lo que indica que ambas reacciones tienen lugar dentro del núcleo. Antes de que los dúplex de miRNA:miRNA* de planta sean transportados fuera del núcleo, sus salientes 3' son metilados por una proteína ARN metiltransferasa llamada Hua-Enhancer1 (HEN1). Luego, el dúplex es transportado fuera del núcleo al citoplasma por una proteína llamada Hasty (HST), un homólogo de Exportin 5, donde se desensamblan y el miRNA maduro se incorpora al RISC. [78]
Complejo silenciador inducido por ARN
El miRNA maduro es parte de un complejo de silenciamiento inducido por ARN activo (RISC) que contiene Dicer y muchas proteínas asociadas. [79] El RISC también se conoce como complejo de ribonucleoproteína de microARN (miRNP); [80] Un RISC con miRNA incorporado a veces se denomina "miRISC".
Se cree que el procesamiento de Dicer del pre-miRNA está acoplado con el desenrollado del dúplex. Generalmente, solo una hebra se incorpora al miRISC, seleccionada sobre la base de su inestabilidad termodinámica y el apareamiento de bases más débil en el extremo 5' en relación con la otra hebra. [81] [82] [83] La posición del tallo-bucle también puede influir en la elección de la hebra. [84] La otra hebra, llamada hebra pasajera debido a sus niveles más bajos en el estado estacionario, se denota con un asterisco (*) y normalmente se degrada. En algunos casos, ambas hebras del dúplex son viables y se convierten en miRNA funcionales que se dirigen a diferentes poblaciones de ARNm. [85]
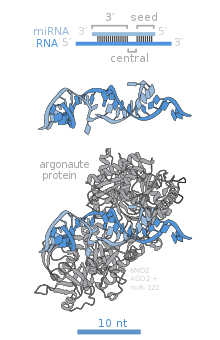
Los miembros de la familia de proteínas Argonautas (Ago) son fundamentales para la función de RISC. Los Argonautas son necesarios para el silenciamiento inducido por miRNA y contienen dos dominios de unión de ARN conservados: un dominio PAZ que puede unirse al extremo 3' monocatenario del miRNA maduro y un dominio PIWI que se asemeja estructuralmente a la ribonucleasa-H y funciona para interactuar con el extremo 5' de la cadena guía. Se unen al miRNA maduro y lo orientan para la interacción con un ARNm objetivo. Algunos argonautas, por ejemplo el Ago2 humano, escinden transcripciones objetivo directamente; los argonautas también pueden reclutar proteínas adicionales para lograr la represión de la traducción. [86] El genoma humano codifica ocho proteínas argonautas divididas por similitudes de secuencia en dos familias: AGO (con cuatro miembros presentes en todas las células de mamíferos y llamados E1F2C/hAgo en humanos), y PIWI (que se encuentra en la línea germinal y en las células madre hematopoyéticas). [80] [86]
Los componentes adicionales de RISC incluyen TRBP [proteína de unión a ARN transactivador de respuesta (TAR) del virus de inmunodeficiencia humana (VIH)], [87] PACT (activador proteico de la proteína quinasa inducida por interferón ), el complejo SMN, la proteína de retraso mental del cromosoma X frágil (FMRP), la proteína que contiene el dominio de la nucleasa estafilocócica Tudor (Tudor-SN), la supuesta helicasa de ADN MOV10 y la proteína que contiene el motivo de reconocimiento de ARN TNRC6B . [71] [88] [89]
Modo de silenciamiento y bucles regulatorios
El silenciamiento génico puede ocurrir a través de la degradación del ARNm o evitando que el ARNm se traduzca. Por ejemplo, miR16 contiene una secuencia complementaria al elemento rico en AU [90] que se encuentra en el 3'UTR de muchos ARNm inestables, como TNF alfa o GM-CSF . [91] Se ha demostrado que dada la complementariedad completa entre el miRNA y la secuencia del ARNm diana, Ago2 puede escindir el ARNm y conducir a la degradación directa del ARNm. En ausencia de complementariedad, el silenciamiento se logra evitando la traducción. [48] La relación del miRNA y su ARNm diana puede basarse en la simple regulación negativa de un ARNm diana, pero parece que un escenario común es el uso de un " bucle de retroalimentación coherente ", un "bucle de retroalimentación negativa mutua" (también denominado bucle doble negativo) y un "bucle de retroalimentación positiva/retroalimentación". Algunos miRNA funcionan como amortiguadores de cambios aleatorios en la expresión génica que surgen debido a eventos estocásticos en la transcripción, la traducción y la estabilidad de las proteínas. Esta regulación se logra típicamente en virtud de bucles de retroalimentación negativa o bucles de retroalimentación incoherentes que desacoplan la producción de proteínas de la transcripción del ARNm.
Volumen de negocios
La renovación del miRNA maduro es necesaria para que se produzcan cambios rápidos en los perfiles de expresión del miRNA. Durante la maduración del miRNA en el citoplasma, se cree que la captación por la proteína Argonaute estabiliza la cadena guía, mientras que la cadena opuesta (* o "pasajera") se destruye preferentemente. En lo que se ha denominado una estrategia de "úsalo o piérdelo", Argonaute puede retener preferentemente los miRNA con muchos objetivos en lugar de los miRNA con pocos o ningún objetivo, lo que conduce a la degradación de las moléculas que no son el objetivo. [92]
La descomposición de los miRNA maduros en Caenorhabditis elegans está mediada por la exorribonucleasa 5' a 3' XRN2 , también conocida como Rat1p. [93] En las plantas, los miembros de la familia SDN (nucleasa de degradación de ARN pequeño) degradan los miRNA en la dirección opuesta (3' a 5'). En los genomas animales se codifican enzimas similares, pero no se han descrito sus funciones. [92]
Varias modificaciones de miRNA afectan la estabilidad de miRNA. Como lo indica el trabajo en el organismo modelo Arabidopsis thaliana (berro de thale), los miRNA maduros de plantas parecen estabilizarse mediante la adición de grupos metilo en el extremo 3'. Los grupos metilo conjugados en 2'-O bloquean la adición de residuos de uracilo (U) por las enzimas uridiltransferasas , una modificación que puede estar asociada con la degradación de miRNA. Sin embargo, la uridilación también puede proteger algunos miRNA; las consecuencias de esta modificación no se comprenden completamente. Se ha informado de la uridilación de algunos miRNA animales. Tanto los miRNA vegetales como los animales pueden alterarse mediante la adición de residuos de adenina (A) al extremo 3' del miRNA. Una A adicional añadida al extremo del miR-122 de mamífero , un miRNA enriquecido en hígado importante en la hepatitis C , estabiliza la molécula y los miRNA vegetales que terminan con un residuo de adenina tienen tasas de descomposición más lentas. [92]
Funciones celulares

La función de los miRNA parece ser la regulación génica. Para ello, un miRNA es complementario a una parte de uno o más ARN mensajeros (ARNm). Los miRNA animales suelen ser complementarios a un sitio en el UTR 3', mientras que los miRNA vegetales suelen ser complementarios a las regiones codificantes de los ARNm. [95] El apareamiento de bases perfecto o casi perfecto con el ARN diana promueve la escisión del ARN. [96] Este es el modo principal de los miRNA vegetales. [97] En los animales, los emparejamientos son imperfectos.
Para que los microARN parcialmente complementarios reconozcan sus objetivos, los nucleótidos 2 a 7 del miARN (su "región semilla" [13] [43] ) deben ser perfectamente complementarios. [98] Los miARN animales inhiben la traducción de proteínas del ARNm objetivo [99] (esto está presente pero es menos común en las plantas). [97] Los microARN parcialmente complementarios también pueden acelerar la desadenilación , lo que hace que los ARNm se degraden antes. [100] Si bien la degradación del ARNm objetivo de miARN está bien documentada, se debate acaloradamente si la represión de la traducción se logra a través de la degradación del ARNm, la inhibición de la traducción o una combinación de las dos. Trabajos recientes sobre miR-430 en pez cebra, así como sobre miARN bantam y miR-9 en células cultivadas de Drosophila , muestran que la represión de la traducción es causada por la interrupción de la iniciación de la traducción , independientemente de la desadenilación del ARNm. [101] [102]
En ocasiones, los miRNA también provocan modificación de histonas y metilación del ADN de los sitios promotores , lo que afecta la expresión de genes diana. [103] [104]
Se describen y reúnen nueve mecanismos de acción de miRNA en un modelo matemático unificado: [94]
- Inhibición de la iniciación de Cap-40S;
- Inhibición de la unión de la unidad ribosomal 60S;
- Inhibición de la elongación;
- Desprendimiento de ribosomas (terminación prematura);
- Degradación de proteínas nacientes co-traduccionales;
- Secuestro en cuerpos P ;
- Desintegración del ARNm (desestabilización);
- escisión de ARNm;
- Inhibición transcripcional a través de la reorganización de la cromatina mediada por microARN seguida de silenciamiento genético.
A menudo es imposible discernir estos mecanismos utilizando datos experimentales sobre velocidades de reacción estacionarias. Sin embargo, se diferencian en dinámica y tienen diferentes firmas cinéticas . [94]
A diferencia de los microARN de plantas, los microARN de animales se dirigen a diversos genes. [43] Sin embargo, los genes involucrados en funciones comunes a todas las células, como la expresión genética, tienen relativamente menos sitios diana de microARN y parecen estar bajo selección para evitar ser atacados por microARN. [105] Existe una fuerte correlación entre las regulaciones del gen ITPR y mir-92 y mir-19. [106]
El dsRNA también puede activar la expresión génica , un mecanismo que se ha denominado "activación génica inducida por ARN pequeño" o ARNa . Los dsRNA que se dirigen a los promotores de genes pueden inducir una potente activación transcripcional de los genes asociados. Esto se demostró en células humanas utilizando dsRNA sintéticos denominados ARN activadores pequeños (saRNAs), [107] pero también se ha demostrado para microRNA endógeno. [108]
Se cree que las interacciones entre microARN y secuencias complementarias en genes e incluso pseudogenes que comparten homología de secuencia son un canal de comunicación que regula los niveles de expresión entre genes parálogos (genes que tienen una estructura similar que indica divergencia de un gen ancestral común). Estos microARN, que reciben el nombre de "ARN endógenos competitivos" ( ceRNA ), se unen a "elementos de respuesta a microARN" en genes y pseudogenes y pueden proporcionar otra explicación para la persistencia del ADN no codificante . [109]
Los miRNA también se encuentran como miRNA circulantes extracelulares . [110] Los miRNA circulantes se liberan en fluidos corporales, incluyendo sangre y líquido cefalorraquídeo y tienen el potencial de estar disponibles como biomarcadores en una serie de enfermedades. [110] [111] Algunas investigaciones muestran que la carga de ARNm de los exosomas puede tener un papel en la implantación, pueden destruir una adhesión entre el trofoblasto y el endometrio o apoyar la adhesión regulando negativamente o positivamente la expresión de genes involucrados en la adhesión/invasión. [112]
Además, los microARN como miR-183/96/182 parecen desempeñar un papel clave en el ritmo circadiano . [113]
Evolución
Los microARN están bien conservados tanto en plantas como en animales, y se cree que son un componente vital y evolutivamente antiguo de la regulación genética. [114] [115] [116] [117] [118] Si bien los componentes centrales de la vía de los microARN se conservan entre plantas y animales , los repertorios de microARN en los dos reinos parecen haber surgido de forma independiente con diferentes modos de acción primarios. [119] [120]
Los microARN son marcadores filogenéticos útiles debido a su tasa aparentemente baja de evolución. [121] El origen de los microARN como mecanismo regulador se desarrolló a partir de una maquinaria de ARNi previa que se utilizó inicialmente como defensa contra material genético exógeno como los virus. [122] Su origen puede haber permitido el desarrollo de la innovación morfológica y, al hacer que la expresión genética sea más específica y "ajustable", permitió la génesis de órganos complejos [123] y quizás, en última instancia, vida compleja. [118] Las ráfagas rápidas de innovación morfológica generalmente se asocian con una alta tasa de acumulación de microARN. [121] [123]
Los nuevos microARN se crean de múltiples maneras. Los microARN nuevos pueden originarse a partir de la formación aleatoria de horquillas en secciones "no codificantes" del ADN (es decir, intrones o regiones intergénicas ), pero también por la duplicación y modificación de microARN existentes. [124] Los microARN también pueden formarse a partir de duplicaciones invertidas de secuencias codificantes de proteínas, lo que permite la creación de una estructura de horquilla de repliegue. [125] La tasa de evolución (es decir, sustitución de nucleótidos) en microARN de origen reciente es comparable a la de otras partes del ADN no codificante, lo que implica una evolución por deriva neutral; sin embargo, los microARN más antiguos tienen una tasa de cambio mucho menor (a menudo menos de una sustitución cada cien millones de años), [118] lo que sugiere que una vez que un microARN adquiere una función, sufre una selección purificadora. [124] Las regiones individuales dentro de un gen de miARN enfrentan diferentes presiones evolutivas, donde las regiones que son vitales para el procesamiento y la función tienen niveles más altos de conservación. [126] En este punto, un microARN rara vez se pierde del genoma de un animal, [118] aunque los microARN más nuevos (por lo tanto presumiblemente no funcionales) se pierden con frecuencia. [124] En Arabidopsis thaliana , se ha predicho que el flujo neto de genes de miARN está entre 1,2 y 3,3 genes por millón de años. [127] Esto los convierte en un valioso marcador filogenético, y se los está considerando como una posible solución a problemas filogenéticos pendientes, como las relaciones de los artrópodos . [128] Por otro lado, en múltiples casos los microARN se correlacionan pobremente con la filogenia, y es posible que su concordancia filogenética refleje en gran medida un muestreo limitado de microARN. [129]
Los microARN están presentes en los genomas de la mayoría de los organismos eucariotas, desde las algas pardas [130] hasta los animales. Sin embargo, la diferencia en cómo funcionan estos microARN y en la forma en que se procesan sugiere que los microARN surgieron de forma independiente en plantas y animales. [131]
Centrándonos en los animales, el genoma de Mnemiopsis leidyi [132] parece carecer de microARN reconocibles, así como de las proteínas nucleares Drosha y Pasha , que son fundamentales para la biogénesis canónica de microARN. Es el único animal del que se ha informado hasta ahora que carece de Drosha. Los microARN desempeñan un papel vital en la regulación de la expresión génica en todos los animales no ctenóforos investigados hasta ahora, excepto en Trichoplax adhaerens , el primer miembro conocido del filo Placozoa . [133]
En todas las especies, hasta marzo de 2010 se habían identificado más de 5000 miRNA diferentes. [134] Si bien en las bacterias existen secuencias cortas de ARN (50 a cientos de pares de bases) con una función ampliamente comparable, las bacterias carecen de microRNA verdaderos. [135]
Detección y manipulación experimental
Mientras los investigadores se centraban en la expresión de microARN en procesos fisiológicos y patológicos, surgieron diversas variables técnicas relacionadas con el aislamiento de microARN. Se ha cuestionado la estabilidad de las muestras de microARN almacenadas. [77] Los microARN se degradan mucho más fácilmente que los ARNm, en parte debido a su longitud, pero también debido a la presencia ubicua de ARNasas . Esto hace necesario enfriar las muestras en hielo y utilizar equipos libres de ARNasas . [136]
La expresión de microARN se puede cuantificar en un proceso de reacción en cadena de la polimerasa de dos pasos de RT-PCR modificada seguida de PCR cuantitativa . Las variaciones de este método logran una cuantificación absoluta o relativa. [137] Los miARN también se pueden hibridar a microarrays , portaobjetos o chips con sondas para cientos o miles de dianas de miARN, de modo que se puedan determinar los niveles relativos de miARN en diferentes muestras. [138] Los microARN se pueden descubrir y perfilar mediante métodos de secuenciación de alto rendimiento ( secuenciación de microARN ). [139] La actividad de un miARN se puede inhibir experimentalmente utilizando un oligo de ácido nucleico bloqueado (LNA) , un oligo de morfolino [140] [141] o un oligo de ARN 2'-O-metilo. [142] Un miARN específico se puede silenciar mediante un antagomir complementario . La maduración de microARN se puede inhibir en varios puntos mediante oligos de bloqueo estérico. [143] [144] El sitio diana de miRNA de un transcrito de ARNm también puede bloquearse mediante un oligobloqueante estérico. [145] Para la detección "in situ" de miRNA, se pueden utilizar sondas LNA [146] o Morfolino [147] . La conformación bloqueada de LNA da como resultado propiedades de hibridación mejoradas y aumenta la sensibilidad y la selectividad, lo que lo hace ideal para la detección de miRNA cortos. [148]
La cuantificación de alto rendimiento de los miRNA es propensa a errores, debido a la mayor varianza (en comparación con los ARNm ) que conlleva problemas metodológicos. Por lo tanto, la expresión de ARNm se analiza a menudo para verificar los efectos de los miRNA en sus niveles (por ejemplo, en [149] ). Las bases de datos se pueden utilizar para emparejar datos de ARNm y miRNA que predicen objetivos de miRNA en función de su secuencia de bases. [150] [151] Si bien esto generalmente se hace después de que se han detectado los miRNA de interés (por ejemplo, debido a los altos niveles de expresión), se han propuesto ideas para herramientas de análisis que integran información de expresión de ARNm y miRNA. [152] [153]
Enfermedades humanas y animales
Así como el miRNA está involucrado en el funcionamiento normal de las células eucariotas, también se ha asociado la desregulación del miRNA con enfermedades. Una base de datos de acceso público y seleccionada manualmente, miR2Disease, documenta las relaciones conocidas entre la desregulación del miRNA y las enfermedades humanas. [154]
Enfermedades hereditarias
Una mutación en la región semilla de miR-96 causa pérdida auditiva progresiva hereditaria. [155]
Una mutación en la región semilla de miR-184 causa queratocono hereditario con catarata polar anterior. [156]
La eliminación del grupo miR-17~92 provoca defectos esqueléticos y de crecimiento. [157]
Cáncer

La primera enfermedad humana que se sabe que está asociada con la desregulación de miRNA fue la leucemia linfocítica crónica . [158] Muchos otros miRNA también tienen vínculos con el cáncer y, en consecuencia, a veces se los denomina " oncomirs ". [159] En las células B malignas, los miRNA participan en vías fundamentales para el desarrollo de las células B, como la señalización del receptor de células B (BCR), la migración/adhesión de células B, las interacciones célula-célula en nichos inmunes y la producción y el cambio de clase de inmunoglobulinas. Los miRNA influyen en la maduración de las células B, la generación de células B pre-, de la zona marginal, foliculares, B1, plasmáticas y de memoria. [160]
Otra función de los miRNA en los cánceres es utilizar su nivel de expresión para el pronóstico. En muestras de CPCNP , los niveles bajos de miR-324 a pueden servir como indicador de una supervivencia deficiente. [161] Tanto los niveles altos de miR-185 como los bajos de miR-133b pueden correlacionarse con la metástasis y una supervivencia deficiente en el cáncer colorrectal . [162]
Además, los miRNA específicos pueden estar asociados con ciertos subtipos histológicos de cáncer colorrectal. Por ejemplo, se ha demostrado que los niveles de expresión de miR-205 y miR-373 aumentan en cánceres colorrectales mucinosos y cánceres de colon asociados a colitis ulcerosa productores de mucina, pero no en adenocarcinoma colónico esporádico que carece de componentes mucinosos. [163] Estudios in vitro sugirieron que miR-205 y miR-373 pueden inducir funcionalmente diferentes características de progresión neoplásica asociada a mucina en células epiteliales intestinales. [163]
La proliferación de células de carcinoma hepatocelular puede surgir de la interacción de miR-21 con MAP2K3, un gen represor de tumores. [164] El tratamiento óptimo para el cáncer implica identificar con precisión a los pacientes para una terapia estratificada por riesgo. Aquellos con una respuesta rápida al tratamiento inicial pueden beneficiarse de regímenes de tratamiento truncados, lo que demuestra el valor de las medidas precisas de la respuesta a la enfermedad. Los miRNA circulantes libres de células (cimiRNA) son altamente estables en la sangre, se sobreexpresan en el cáncer y son cuantificables dentro del laboratorio de diagnóstico. En el linfoma de Hodgkin clásico , el miR-21 plasmático, miR-494 y miR-1973 son biomarcadores prometedores de la respuesta a la enfermedad. [165] Los miRNA circulantes tienen el potencial de ayudar a la toma de decisiones clínicas y ayudar a la interpretación de la tomografía por emisión de positrones combinada con la tomografía computarizada . Se pueden realizar en cada consulta para evaluar la respuesta a la enfermedad y detectar la recaída.
Los microARN tienen el potencial de ser utilizados como herramientas o dianas para el tratamiento de diferentes tipos de cáncer. [166] Se ha descubierto que el microARN específico, miR-506, funciona como antagonista tumoral en varios estudios. Se descubrió que una cantidad significativa de muestras de cáncer de cuello uterino tenían una expresión regulada a la baja de miR-506. Además, miR-506 actúa para promover la apoptosis de las células de cáncer de cuello uterino, a través de su factor de transcripción de la vía hedgehog, Gli3. [167] [168]
Reparación del ADN y cáncer
Muchos miRNA pueden dirigirse directamente a los genes del ciclo celular e inhibirlos para controlar la proliferación celular . Una nueva estrategia para el tratamiento de tumores es inhibir la proliferación de células tumorales reparando la vía defectuosa de miRNA en los tumores. [169] El cáncer es causado por la acumulación de mutaciones , ya sea por daño en el ADN o por errores no corregidos en la replicación del ADN . [170] Los defectos en la reparación del ADN causan la acumulación de mutaciones, lo que puede conducir al cáncer. [171] Varios genes involucrados en la reparación del ADN están regulados por microRNA. [172]
Las mutaciones de la línea germinal en los genes de reparación del ADN causan solo entre el 2 y el 5 % de los casos de cáncer de colon . [173] Sin embargo, la expresión alterada de microARN, que causa deficiencias en la reparación del ADN, se asocia con frecuencia con cánceres y puede ser un factor causal importante . Entre 68 cánceres de colon esporádicos con expresión reducida de la proteína de reparación de desajustes del ADN MLH1 , se encontró que la mayoría eran deficientes debido a la metilación epigenética de la isla CpG del gen MLH1 . [174] Sin embargo, hasta el 15 % de las deficiencias de MLH1 en cánceres de colon esporádicos parecían deberse a la sobreexpresión del microARN miR-155, que reprime la expresión de MLH1. [175]
En el 29-66% [176] [177] de los glioblastomas , la reparación del ADN es deficiente debido a la metilación epigenética del gen MGMT , que reduce la expresión proteica de MGMT. Sin embargo, para el 28% de los glioblastomas, la proteína MGMT es deficiente, pero el promotor MGMT no está metilado. [176] En los glioblastomas sin promotores MGMT metilados, el nivel de microARN miR-181d está inversamente correlacionado con la expresión proteica de MGMT y el objetivo directo de miR-181d es el ARNm 3'UTR de MGMT (la región no traducida principal del ARNm de MGMT). [176] Por lo tanto, en el 28% de los glioblastomas, el aumento de la expresión de miR-181d y la reducción de la expresión de la enzima reparadora del ADN MGMT pueden ser un factor causal.
Las proteínas HMGA (HMGA1a, HMGA1b y HMGA2) están implicadas en el cáncer, y la expresión de estas proteínas está regulada por microARN. La expresión de HMGA es casi indetectable en tejidos adultos diferenciados, pero está elevada en muchos cánceres. Las proteínas HMGA son polipéptidos de ~100 residuos de aminoácidos caracterizados por una organización de secuencia modular. Estas proteínas tienen tres regiones altamente cargadas positivamente, denominadas ganchos AT , que se unen al surco menor de tramos de ADN ricos en AT en regiones específicas de ADN. Las neoplasias humanas, incluidos los carcinomas de tiroides, próstata, cuello uterino, colorrectal, pancreático y ovárico, muestran un fuerte aumento de las proteínas HMGA1a y HMGA1b. [178] Los ratones transgénicos con HMGA1 dirigido a células linfoides desarrollan un linfoma agresivo, lo que demuestra que la alta expresión de HMGA1 está asociada con cánceres y que HMGA1 puede actuar como un oncogén. [179] La proteína HMGA2 se dirige específicamente al promotor de ERCC1 , reduciendo así la expresión de este gen de reparación del ADN. [180] La expresión de la proteína ERCC1 fue deficiente en el 100% de los 47 cánceres de colon evaluados (aunque no se conoce hasta qué punto estuvo involucrado HGMA2). [181]
Los polimorfismos de nucleótido único (SNP) pueden alterar la unión de los miRNA en 3'UTR, por ejemplo, el caso de hsa-mir181a y hsa-mir181b en el gen supresor de tumores CDON. [182]
Cardiopatía
El papel global de la función de miRNA en el corazón se ha abordado inhibiendo condicionalmente la maduración de miRNA en el corazón murino . Esto reveló que los miRNA juegan un papel esencial durante su desarrollo. [183] [184] Los estudios de perfiles de expresión de miRNA demuestran que los niveles de expresión de miRNA específicos cambian en corazones humanos enfermos, lo que apunta a su participación en miocardiopatías . [185] [186] [187] Además, los estudios animales sobre miRNA específicos identificaron roles distintos para los miRNA tanto durante el desarrollo del corazón como en condiciones patológicas, incluida la regulación de factores clave importantes para la cardiogénesis, la respuesta de crecimiento hipertrófico y la conductancia cardíaca. [184] [188] [189] [190] [191] [192] Otro papel de los miRNA en las enfermedades cardiovasculares es usar sus niveles de expresión para el diagnóstico, pronóstico o estratificación del riesgo. [193] Los miRNA en modelos animales también se han relacionado con el metabolismo y la regulación del colesterol.
miARN-712
El microARN-712 murino es un biomarcador potencial (es decir, predictor) de la aterosclerosis , una enfermedad cardiovascular de la pared arterial asociada con la retención de lípidos y la inflamación. [194] El flujo sanguíneo no laminar también se correlaciona con el desarrollo de la aterosclerosis, ya que los mecanosensores de las células endoteliales responden a la fuerza de corte del flujo alterado (flujo d). [195] Varios genes proaterogénicos, incluidas las metaloproteinasas de matriz (MMP), se regulan positivamente por el flujo d, [195] mediando señales proinflamatorias y proangiogénicas. Estos hallazgos se observaron en arterias carótidas ligadas de ratones para imitar los efectos del flujo d. En 24 horas, el miR-712 inmaduro preexistente formó miR-712 maduro, lo que sugiere que el miR-712 es sensible al flujo. [195] Coincidiendo con estos resultados, el miR-712 también se regula positivamente en las células endoteliales expuestas al flujo d que se produce naturalmente en la curvatura mayor del arco aórtico. [195]
Origen
La secuencia de pre-ARNm de miR-712 se genera a partir del gen RN45s ribosomal murino en la región espaciadora transcrita interna 2 (ITS2). [195] XRN1 es una exonucleasa que degrada la región ITS2 durante el procesamiento de RN45s. [195] Por lo tanto, la reducción de XRN1 en condiciones de flujo d conduce a la acumulación de miR-712. [195]
Mecanismo
El miR-712 se dirige al inhibidor tisular de las metaloproteinasas 3 (TIMP3). [195] Las TIMP normalmente regulan la actividad de las metaloproteinasas de matriz (MMP) que degradan la matriz extracelular (ECM). La ECM arterial está compuesta principalmente de fibras de colágeno y elastina , que proporcionan el soporte estructural y las propiedades de retroceso de las arterias. [196] Estas fibras desempeñan un papel fundamental en la regulación de la inflamación y la permeabilidad vascular, que son importantes en el desarrollo de la aterosclerosis. [197] Expresado por las células endoteliales, el TIMP3 es el único TIMP unido a la ECM. [196] Una disminución en la expresión de TIMP3 da como resultado un aumento de la degradación de la ECM en presencia de flujo d. En consonancia con estos hallazgos, la inhibición del pre-miR712 aumenta la expresión de TIMP3 en las células, incluso cuando se exponen a un flujo turbulento. [195]
TIMP3 también disminuye la expresión de TNFα (un regulador proinflamatorio) durante el flujo turbulento. [195] La actividad de TNFα en el flujo turbulento se midió mediante la expresión de la enzima convertidora de TNFα (TACE) en sangre. TNFα disminuyó si se inhibió miR-712 o se sobreexpresó TIMP3, [195] lo que sugiere que miR-712 y TIMP3 regulan la actividad de TACE en condiciones de flujo turbulento.
El anti-miR-712 suprime eficazmente la expresión de miR-712 inducida por d-flow y aumenta la expresión de TIMP3. [195] El anti-miR-712 también inhibe la hiperpermeabilidad vascular, reduciendo significativamente el desarrollo de lesiones de aterosclerosis y la infiltración de células inmunes. [195]
MicroARN-205 homólogo humano
El homólogo humano de miR-712 se encontró en el gen homólogo RN45s, que mantiene miRNAs similares a los de los ratones. [195] El miR-205 de los humanos comparte secuencias similares con el miR-712 de los ratones y se conserva en la mayoría de los vertebrados. [195] El miR-205 y el miR-712 también comparten más del 50% de los objetivos de señalización celular, incluido TIMP3. [195]
Cuando se probó, el d-flow disminuyó la expresión de XRN1 en humanos como lo hizo en las células endoteliales de ratones, lo que indica un papel potencialmente común de XRN1 en humanos. [195]
Nefropatía
La eliminación dirigida de Dicer en las células progenitoras renales derivadas de FoxD1 en un modelo murino resultó en un fenotipo renal complejo que incluye expansión de progenitores de nefrona , menos células de renina , arteriolas de músculo liso , pérdida mesangial progresiva y aneurismas glomerulares. [198] El perfil de transcriptoma completo de alto rendimiento del modelo de ratón knock out FoxD1-Dicer reveló una regulación positiva ectópica del gen proapoptótico, Bcl2L11 (Bim) y una desregulación de la vía p53 con un aumento en los genes efectores p53, incluidos Bax , Trp53inp1 , Jun, Cdkn1a , Mmp2 y Arid3a . Los niveles de proteína p53 se mantuvieron sin cambios, lo que sugiere que los miRNA estromales FoxD1 reprimen directamente los genes efectores p53. Utilizando un enfoque de rastreo de linaje seguido de clasificación de células activadas por fluorescencia , el perfil de miRNA de las células derivadas de FoxD1 no solo definió de manera integral el panorama transcripcional de miRNA que son críticos para el desarrollo vascular, sino que también identificó miRNA clave que probablemente modulen el fenotipo renal en su ausencia. Estos miRNA incluyen miRs-10a, 18a, 19b, 24, 30c, 92a, 106a, 130a, 152, 181a, 214, 222, 302a, 370 y 381 que regulan Bcl2L11 (Bim) y miRs-15b, 18a, 21, 30c, 92a, 106a, 125b-5p, 145, 214, 222, 296-5p y 302a que regulan los genes efectores p53. En consonancia con los resultados del perfil, se observó apoptosis ectópica en los derivados celulares del linaje progenitor derivado de FoxD1 y reitera la importancia de los miRNA del estroma renal en la homeostasis celular. [198]
Sistema nervioso
Los miRNA son cruciales para el desarrollo y funcionamiento saludable del sistema nervioso . [199] Estudios previos demuestran que los miRNA pueden regular la diferenciación y maduración neuronal en varias etapas. [200] Los miRNA también juegan papeles importantes en el desarrollo sináptico [201] (como la dendritogénesis o la morfogénesis espinal) y la plasticidad sináptica [202] (contribuyendo al aprendizaje y la memoria). La eliminación de la formación de miRNA en ratones mediante el silenciamiento experimental de Dicer ha llevado a resultados patológicos, como tamaño neuronal reducido, anormalidades motoras (cuando se silencia en neuronas estriatales [203] ) y neurodegeneración (cuando se silencia en neuronas del prosencéfalo [204] ). Se ha encontrado una expresión alterada de miRNA en enfermedades neurodegenerativas (como la enfermedad de Alzheimer , la enfermedad de Parkinson y la enfermedad de Huntington [205] ), así como en muchos trastornos psiquiátricos (incluida la epilepsia , [206] la esquizofrenia , la depresión mayor , el trastorno bipolar y los trastornos de ansiedad [207] [208] [209] ).
Ataque
Según el Centro para el Control y la Prevención de Enfermedades, el accidente cerebrovascular es una de las principales causas de muerte y discapacidad a largo plazo en Estados Unidos. El 87% de los casos son accidentes cerebrovasculares isquémicos , que resultan del bloqueo de la arteria del cerebro que transporta sangre rica en oxígeno. La obstrucción del flujo sanguíneo significa que el cerebro no puede recibir los nutrientes necesarios, como el oxígeno y la glucosa, y eliminar los desechos, como el dióxido de carbono. [210] [211] Los miRNA desempeñan un papel en el silenciamiento génico postraduccional al dirigirse a los genes en la patogénesis de la isquemia cerebral, como la vía inflamatoria, angiogénica y apoptótica. [212]
Alcoholismo
El papel vital de los miRNA en la expresión genética es significativo para la adicción , específicamente el alcoholismo . [213] El abuso crónico de alcohol produce cambios persistentes en la función cerebral mediados en parte por alteraciones en la expresión genética . [213] La regulación global de miRNA de muchos genes descendentes se considera significativa con respecto a la reorganización o conexiones sinápticas o adaptaciones neuronales a largo plazo que involucran el cambio de comportamiento del consumo de alcohol a la abstinencia y/o dependencia . [214] Se ha encontrado que hasta 35 miRNA diferentes están alterados en el cerebro post mortem del alcohólico, todos los cuales se dirigen a genes que incluyen la regulación del ciclo celular , la apoptosis , la adhesión celular , el desarrollo del sistema nervioso y la señalización celular . [213] Se encontraron niveles alterados de miRNA en la corteza prefrontal medial de ratones dependientes del alcohol, lo que sugiere el papel de miRNA en la orquestación de desequilibrios traduccionales y la creación de proteínas expresadas diferencialmente dentro de un área del cerebro donde probablemente se originan el comportamiento cognitivo complejo y la toma de decisiones . [215]
Los miRNA pueden ser regulados positiva o negativamente en respuesta al uso crónico de alcohol. La expresión de miR-206 aumentó en la corteza prefrontal de ratas dependientes del alcohol, apuntando al factor de transcripción factor neurotrófico derivado del cerebro ( BDNF ) y finalmente reduciendo su expresión. BDNF juega un papel crítico en la formación y maduración de nuevas neuronas y sinapsis, lo que sugiere una posible implicación en el crecimiento de la sinapsis / plasticidad sináptica en los abusadores de alcohol. [216] Se encontró que miR-155 , importante en la regulación de las respuestas de neuroinflamación inducidas por el alcohol , estaba regulado positivamente, lo que sugiere el papel de la microglia y las citocinas inflamatorias en la patofisiología del alcohol. [217] La regulación negativa de miR-382 se encontró en el núcleo accumbens , una estructura en el prosencéfalo basal significativa en la regulación de los sentimientos de recompensa que potencian los hábitos motivacionales. El miR-382 es el objetivo del receptor de dopamina D1 (DRD1), y su sobreexpresión da como resultado la regulación positiva del DRD1 y delta fosB , un factor de transcripción que activa una serie de eventos de transcripción en el núcleo accumbens que finalmente resultan en conductas adictivas. [218] Alternativamente, la sobreexpresión de miR-382 resultó en un consumo atenuado de alcohol y la inhibición de la regulación positiva del DRD1 y delta fosB en modelos de rata de alcoholismo, lo que demuestra la posibilidad de usar productos farmacéuticos dirigidos a miRNA en tratamientos. [218]
Obesidad
Los miRNAs desempeñan papeles cruciales en la regulación de los progenitores de células madre que se diferencian en adipocitos . [219] Se examinaron estudios para determinar qué papel desempeñan las células madre pluripotentes en la adipogénesis en la línea celular estromal derivada de médula ósea humana inmortalizada hMSC-Tert20. [220] Se ha encontrado una expresión disminuida de miR-155 , miR-221 y miR-222 durante la programación adipogénica de hMSC tanto inmortalizadas como primarias, lo que sugiere que actúan como reguladores negativos de la diferenciación. Por el contrario, la expresión ectópica de los miRNAs 155 , 221 y 222 inhibió significativamente la adipogénesis y reprimió la inducción de los reguladores maestros PPARγ y CCAAT/proteína de unión al potenciador alfa ( CEBPA ). [221] Esto allana el camino para posibles tratamientos genéticos de la obesidad.
Otra clase de miRNA que regula la resistencia a la insulina , la obesidad y la diabetes es la familia let-7 . Let-7 se acumula en los tejidos humanos durante el transcurso del envejecimiento . [222] Cuando let-7 se sobreexpresó ectópicamente para imitar el envejecimiento acelerado, los ratones se volvieron resistentes a la insulina y, por lo tanto, más propensos a la obesidad y la diabetes inducidas por una dieta alta en grasas . [223] En contraste, cuando let-7 se inhibió mediante inyecciones de antagomirs específicos de let-7 , los ratones se volvieron más sensibles a la insulina y notablemente resistentes a la obesidad y la diabetes inducidas por una dieta alta en grasas. La inhibición de let-7 no solo podría prevenir la obesidad y la diabetes, sino que también podría revertir y curar la afección. [224] Estos hallazgos experimentales sugieren que la inhibición de let-7 podría representar una nueva terapia para la obesidad y la diabetes tipo 2.
Hemostasia
Los miRNA también desempeñan papeles cruciales en la regulación de cascadas enzimáticas complejas, incluido el sistema de coagulación sanguínea hemostática . [225] Estudios a gran escala de la orientación funcional de miRNA han descubierto recientemente objetivos terapéuticos racionales en el sistema hemostático. [226] [227] Se han relacionado directamente con la homeostasis del calcio en el retículo endoplásmico , que es fundamental en la diferenciación celular en el desarrollo temprano. [228]
Plantas
Se considera que los miRNA son reguladores clave de muchos procesos de desarrollo, homeostáticos e inmunológicos en las plantas. [229] Sus funciones en el desarrollo de las plantas incluyen el desarrollo del meristemo apical de los brotes , el crecimiento de las hojas, la formación de flores, la producción de semillas o la expansión de las raíces. [230] [231] [232] [233] Además, desempeñan un papel complejo en las respuestas a varios tipos de estrés abiótico que incluyen estrés por calor, estrés por bajas temperaturas, estrés por sequía, estrés por luz o exposición a radiación gamma. [229]
Virus
Los microARN virales desempeñan un papel importante en la regulación de la expresión génica de los genes virales y/o del huésped para beneficiar al virus . Por lo tanto, los microARN desempeñan un papel clave en las interacciones entre el huésped y el virus y en la patogénesis de las enfermedades virales . [234] [235] Se cree que la expresión de activadores de la transcripción por el ADN del virus del herpes humano-6 está regulada por el microARN viral. [236]
Predicción de objetivos
Los miRNA pueden unirse a transcripciones de ARN mensajero (ARNm) de genes codificadores de proteínas y controlar negativamente su traducción o causar la degradación del ARNm. Es de vital importancia identificar los objetivos de miRNA con precisión. [237] Se encuentra disponible una comparación del rendimiento predictivo de dieciocho algoritmos in silico . [238] Estudios a gran escala de la selección de objetivos de miRNA funcionales sugieren que muchos miRNA funcionales pueden ser ignorados por los algoritmos de predicción de objetivos. [226]
Véase también
- Oligonucleótidos anti-miRNA
- Clúster de microARN C19MC
- Expresión genética
- Lista de herramientas de predicción de genes de miRNA
- Lista de herramientas de predicción de objetivos de miRNA
- MicroADN
- Biosensores de microARN
- MiRNEST
- MIR222
- miR-324-5p
- Familia de precursores de microARN Mir-M7
- Interferencia de ARN
- ARN interferente pequeño
- MicroARN derivado de ARN nucleolar pequeño
Referencias
- ^ abcd Bartel DP (marzo de 2018). "MicroARN de metazoos". Cell . 173 (1): 20–51. doi :10.1016/j.cell.2018.03.006. PMC 6091663 . PMID 29570994.
- ^ abc Bartel DP (enero de 2004). "MicroARN: genómica, biogénesis, mecanismo y función". Cell . 116 (2): 281–297. doi : 10.1016/S0092-8674(04)00045-5 . PMID 14744438.
- ^ Qureshi A, Thakur N, Monga I, Thakur A, Kumar M (enero de 2014). "VIRmiRNA: un recurso completo para los miRNA virales validados experimentalmente y sus objetivos". Base de datos . 2014 : bau103. doi :10.1093/database/bau103. PMC 4224276 . PMID 25380780.
- ^ abc Bartel DP (enero de 2009). "MicroRNAs: reconocimiento de objetivos y funciones reguladoras". Cell . 136 (2): 215–233. doi :10.1016/j.cell.2009.01.002. PMC 3794896 . PMID 19167326.
- ^ Jonas S, Izaurralde E (julio de 2015). "Hacia una comprensión molecular del silenciamiento génico mediado por microARN". Nature Reviews. Genetics . 16 (7): 421–433. doi :10.1038/nrg3965. PMID 26077373. S2CID 24892348.
- ^ Jonas S, Izaurralde E (julio de 2015). "Hacia una comprensión molecular del silenciamiento génico mediado por microARN". Nature Reviews. Genetics . 16 (7): 421–433. doi :10.1038/nrg3965. PMID 26077373. S2CID 24892348.
- ^ Guo H, Ingolia NT, Weissman JS, Bartel DP (agosto de 2010). "Los microARN de mamíferos actúan predominantemente para disminuir los niveles de ARNm objetivo". Nature . 466 (7308): 835–840. Bibcode :2010Natur.466..835G. doi :10.1038/nature09267. hdl : 1721.1/72447 . PMC 2990499 . PMID 20703300.
- ^ "MiRNAs del Homo sapiens". miRBase. Manchester, Reino Unido: Universidad de Manchester .
- ^ Alles J, Fehlmann T, Fischer U, Backes C, Galata V, Minet M, et al. (abril de 2019). "Una estimación del número total de miRNA humanos verdaderos". Nucleic Acids Research . 47 (7): 3353–3364. doi :10.1093/nar/gkz097. PMC 6468295 . PMID 30820533.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Fromm B, Domanska D, Høye E, Ovchinnikov V, Kang W, Aparicio-Puerta E, et al. (enero de 2020). "MirGeneDB 2.0: el complemento de microARN de metazoos". Investigación de ácidos nucleicos . 48 (D1): D132-D141. doi : 10.1093/nar/gkz885. PMC 6943042 . PMID 31598695.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Lim LP, Lau NC, Weinstein EG, Abdelhakim A, Yekta S, Rhoades MW y col. (Abril de 2003). "Los microARN de Caenorhabditis elegans". Genes y desarrollo . 17 (8): 991–1008. doi :10.1101/gad.1074403. PMC 196042 . PMID 12672692.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ ab Lagos-Quintana M, Rauhut R, Yalcin A, Meyer J, Lendeckel W, Tuschl T (abril de 2002). "Identificación de microARN específicos de tejido de ratón". Current Biology . 12 (9): 735–739. Bibcode :2002CBio...12..735L. doi : 10.1016/S0960-9822(02)00809-6 . PMID 12007417.
- ^ abc Lewis BP, Burge CB, Bartel DP (enero de 2005). "El emparejamiento de semillas conservado, a menudo flanqueado por adenosinas, indica que miles de genes humanos son objetivos de microARN". Cell . 120 (1): 15–20. doi : 10.1016/j.cell.2004.12.035 . PMID 15652477.
- ^ abc Friedman RC, Farh KK, Burge CB, Bartel DP (enero de 2009). "La mayoría de los ARNm de mamíferos son dianas conservadas de los microARN". Genome Research . 19 (1): 92–105. doi :10.1101/gr.082701.108. PMC 2612969 . PMID 18955434.
- ^ Fromm B, Billipp T, Peck LE, Johansen M, Tarver JE, King BL, et al. (2015). "Un sistema uniforme para la anotación de genes de microARN de vertebrados y la evolución del microARNoma humano". Revisión anual de genética . 49 (1): 213–242. Bibcode :2015ARGen..49..213F. doi :10.1146/annurev-genet-120213-092023. PMC 4743252 . PMID 26473382.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ "El Premio Nobel de Fisiología o Medicina 2024".
- ^ "El Premio Nobel de Fisiología o Medicina 2024". NobelPrize.org (Nota de prensa) . Consultado el 7 de octubre de 2024 .
- ^ Lewis T (7 de octubre de 2024). «Premio Nobel de Fisiología o Medicina otorgado por el descubrimiento de la regulación génica mediante microARN». Scientific American . Consultado el 7 de octubre de 2024 .
- ^ abc Lee RC, Feinbaum RL, Ambros V (diciembre de 1993). "El gen heterocrónico lin-4 de C. elegans codifica ARN pequeños con complementariedad antisentido con lin-14". Cell . 75 (5): 843–54. doi : 10.1016/0092-8674(93)90529-Y . PMID 8252621.
- ^ ab Reinhart BJ, Slack FJ, Basson M, Pasquinelli AE, Bettinger JC, Rougvie AE, et al. (febrero de 2000). "El ARN let-7 de 21 nucleótidos regula el tiempo de desarrollo en Caenorhabditis elegans". Nature . 403 (6772): 901–6. Bibcode :2000Natur.403..901R. doi :10.1038/35002607. PMID 10706289. S2CID 4384503.
- ^ ab Pasquinelli AE, Reinhart BJ, Slack F, Martindale MQ, Kuroda MI, Maller B, et al. (noviembre de 2000). "Conservación de la secuencia y expresión temporal del ARN regulador heterocrónico let-7". Nature . 408 (6808): 86–9. Bibcode :2000Natur.408...86P. doi :10.1038/35040556. PMID 11081512. S2CID 4401732.
- ^ abc Lagos-Quintana M, Rauhut R, Lendeckel W, Tuschl T (octubre de 2001). "Identificación de genes nuevos que codifican ARN pequeños expresados". Science . 294 (5543): 853–8. Bibcode :2001Sci...294..853L. doi :10.1126/science.1064921. hdl : 11858/00-001M-0000-0012-F65F-2 . PMID 11679670. S2CID 18101169.
- ^ abc Lau NC, Lim LP, Weinstein EG, Bartel DP (octubre de 2001). "Una clase abundante de ARN diminutos con probables funciones reguladoras en Caenorhabditis elegans". Science . 294 (5543): 858–62. Bibcode :2001Sci...294..858L. doi :10.1126/science.1065062. PMID 11679671. S2CID 43262684.
- ^ abc Lee RC, Ambros V (octubre de 2001). "Una clase extensa de ARN pequeños en Caenorhabditis elegans". Science . 294 (5543): 862–4. Bibcode :2001Sci...294..862L. doi :10.1126/science.1065329. PMID 11679672. S2CID 33480585.
- ^ Wienholds E, Kloosterman WP, Miska E, Álvarez-Saavedra E, Berezikov E, de Bruijn E, et al. (Julio de 2005). "Expresión de microARN en el desarrollo embrionario del pez cebra". Ciencia . 309 (5732): 310–1. Código Bib : 2005 Ciencia... 309.. 310W. doi : 10.1126/ciencia.1114519. PMID 15919954. S2CID 38939571.
- ^ ab Jones-Rhoades MW, Bartel DP, Bartel B (2006). "MicroRNAS y sus funciones reguladoras en plantas". Revisión anual de biología vegetal . 57 : 19–53. doi :10.1146/annurev.arplant.57.032905.105218. PMID 16669754.
- ^ Brennecke J, Hipfner DR, Stark A, Russell RB, Cohen SM (abril de 2003). "Bantam codifica un microARN regulado por el desarrollo que controla la proliferación celular y regula el gen proapoptótico oculto en Drosophila". Cell . 113 (1): 25–36. doi : 10.1016/S0092-8674(03)00231-9 . PMID 12679032.
- ^ Cuellar TL, McManus MT (diciembre de 2005). "MicroRNAs and endocrine biology". The Journal of Endocrinology . 187 (3): 327–32. doi : 10.1677/joe.1.06426 . PMID 16423811.
- ^ Poy MN, Eliasson L, Krutzfeldt J, Kuwajima S, Ma X, Macdonald PE, et al. (noviembre de 2004). "Un microARN específico de los islotes pancreáticos regula la secreción de insulina". Nature . 432 (7014): 226–30. Bibcode :2004Natur.432..226P. doi :10.1038/nature03076. PMID 15538371. S2CID 4415988.
- ^ Chen CZ, Li L, Lodish HF, Bartel DP (enero de 2004). "Los microARN modulan la diferenciación del linaje hematopoyético". Science . 303 (5654): 83–6. Bibcode :2004Sci...303...83C. doi :10.1126/science.1091903. hdl : 1721.1/7483 . PMID 14657504. S2CID 7044929.
- ^ Wilfred BR, Wang WX, Nelson PT (julio de 2007). "Energizing miRNA research: a review of the role of miRNAs in lipid metabolic, with a prediction that miR-103/107 regulation human metabolic pathways" (Energía para la investigación de los miRNA: una revisión del papel de los miRNA en el metabolismo lipídico, con una predicción de que el miR-103/107 regula las vías metabólicas humanas). Molecular Genetics and Metabolism (Genética molecular y metabolismo ) . 91 (3): 209–17. doi :10.1016/j.ymgme.2007.03.011. PMC 1978064. PMID 17521938 .
- ^ Harfe BD, McManus MT, Mansfield JH, Hornstein E, Tabin CJ (agosto de 2005). "La enzima Dicer de la ARNasa III es necesaria para la morfogénesis, pero no para la formación de patrones en las extremidades de los vertebrados". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 102 (31): 10898–903. Bibcode :2005PNAS..10210898H. doi : 10.1073/pnas.0504834102 . PMC 1182454 . PMID 16040801.
- ^ Trang P, Weidhaas JB, Slack FJ (diciembre de 2008). "MicroRNAs as potential cancer therapeutics" (MicroARN como posibles terapias contra el cáncer). Oncogene . 27 (Supl. 2): S52–7. doi : 10.1038/onc.2009.353 . PMC 10033140 . PMID 19956180.
- ^ Li C, Feng Y, Coukos G, Zhang L (diciembre de 2009). "Estrategias terapéuticas de microARN en el cáncer humano". The AAPS Journal . 11 (4): 747–57. doi :10.1208/s12248-009-9145-9. PMC 2782079 . PMID 19876744.
- ^ Fasanaro P, Greco S, Ivan M, Capogrossi MC, Martelli F (enero de 2010). "microARN: dianas terapéuticas emergentes en enfermedades isquémicas agudas". Farmacología y terapéutica . 125 (1): 92–104. doi :10.1016/j.pharmthera.2009.10.003. PMID 19896977.
- ^ Hydbring P, Badalian-Very G (agosto de 2013). "Aplicaciones clínicas de los microARN". F1000Research . 2 : 136. doi : 10.12688/f1000research.2-136.v2 . PMC 3917658 . PMID 24627783.
- ^ Wightman B, Ha I, Ruvkun G (diciembre de 1993). "La regulación postranscripcional del gen heterocrónico lin-14 por lin-4 media la formación de patrones temporales en C. elegans". Cell . 75 (5): 855–62. doi : 10.1016/0092-8674(93)90530-4 . PMID 8252622.
- ^ Giza DE, Calin GA (2015). "MicroRNA y leucemia linfocítica crónica". MicroRNA: cáncer . Avances en medicina y biología experimental. Vol. 889. págs. 23–40. doi :10.1007/978-3-319-23730-5_2. ISBN . 978-3-319-23729-9. Número de identificación personal 26658994.
- ^ Ambros V, Bartel B, Bartel DP, Burge CB, Carrington JC, Chen X, et al. (marzo de 2003). "Un sistema uniforme para la anotación de microARN". ARN . 9 (3): 277–9. doi :10.1261/rna.2183803. PMC 1370393 . PMID 12592000.
- ^ Griffiths-Jones S, Grocock RJ, van Dongen S, Bateman A, Enright AJ (enero de 2006). "miRBase: secuencias de microARN, objetivos y nomenclatura génica". Nucleic Acids Research . 34 (número de la base de datos): D140–4. doi :10.1093/nar/gkj112. PMC 1347474 . PMID 16381832.
- ^ Wright MW, Bruford EA (enero de 2011). "Nomenclatura de genes de ARN no codificante de proteínas (ARNnc) humanos". Human Genomics . 5 (2): 90–8. doi : 10.1186/1479-7364-5-2-90 . PMC 3051107 . PMID 21296742.
- ^ Hunt M, Banerjee S, Surana P, Liu M, Fuerst G, Mathioni S, et al. (2019). "Descubrimiento de ARN pequeño en la interacción entre la cebada y el patógeno del mildiú polvoroso". BMC Genomics . 20 (1): 19–53. doi : 10.1186/s12864-019-5947-z . PMC 6657096 . PMID 31345162.
- ^ abc Lewis BP, Shih IH, Jones-Rhoades MW, Bartel DP, Burge CB (diciembre de 2003). "Predicción de dianas de microARN en mamíferos". Cell . 115 (7): 787–98. doi : 10.1016/S0092-8674(03)01018-3 . PMID 14697198.
- ^ Ellwanger DC, Büttner FA, Mewes HW, Stümpflen V (mayo de 2011). "El conjunto mínimo suficiente de tipos de semillas de miRNA". Bioinformática . 27 (10): 1346–50. doi :10.1093/bioinformatics/btr149. PMC 3087955 . PMID 21441577.
- ^ Rajewsky N (junio de 2006). "Predicciones de dianas de microARN en animales". Nature Genetics . 38 (6s): S8–13. doi :10.1038/ng1798. PMID 16736023. S2CID 23496396.
- ^ Krek A, Grün D, Poy MN, Wolf R, Rosenberg L, Epstein EJ, et al. (mayo de 2005). "Predicciones combinatorias de dianas de microARN". Nature Genetics . 37 (5): 495–500. doi :10.1038/ng1536. PMID 15806104. S2CID 22672750.
- ^ Thomson DW, Bracken CP, Goodall GJ (septiembre de 2011). "Estrategias experimentales para la identificación de dianas de microARN". Nucleic Acids Research . 39 (16): 6845–53. doi :10.1093/nar/gkr330. PMC 3167600 . PMID 21652644.
- ^ ab Lim LP, Lau NC, Garrett-Engele P, Grimson A, Schelter JM, Castle J, et al. (febrero de 2005). "El análisis de microarrays muestra que algunos microARN regulan negativamente un gran número de ARNm objetivo". Nature . 433 (7027): 769–73. Bibcode :2005Natur.433..769L. doi :10.1038/nature03315. PMID 15685193. S2CID 4430576.
- ^ Selbach M, Schwanhäusser B, Thierfelder N, Fang Z, Khanin R, Rajewsky N (septiembre de 2008). "Cambios generalizados en la síntesis de proteínas inducida por microARN". Nature . 455 (7209): 58–63. Bibcode :2008Natur.455...58S. doi :10.1038/nature07228. PMID 18668040. S2CID 4429008.
- ^ Baek D, Villén J, Shin C, Camargo FD, Gygi SP, Bartel DP (septiembre de 2008). "El impacto de los microARN en la producción de proteínas". Nature . 455 (7209): 64–71. Bibcode :2008Natur.455...64B. doi :10.1038/nature07242. PMC 2745094 . PMID 18668037.
- ^ ab Rodriguez A, Griffiths-Jones S, Ashurst JL, Bradley A (octubre de 2004). "Identificación de genes hospedadores de microARN de mamíferos y unidades de transcripción". Genome Research . 14 (10A): 1902–10. doi :10.1101/gr.2722704. PMC 524413 . PMID 15364901.
- ^ abcd Cai X, Hagedorn CH, Cullen BR (diciembre de 2004). "Los microARN humanos se procesan a partir de transcripciones poliadeniladas con capuchón que también pueden funcionar como ARNm". ARN . 10 (12): 1957–66. doi :10.1261/rna.7135204. PMC 1370684 . PMID 15525708.
- ^ Weber MJ (enero de 2005). "Nuevos genes de microARN humanos y de ratón encontrados mediante búsqueda de homología". The FEBS Journal . 272 (1): 59–73. doi : 10.1111/j.1432-1033.2004.04389.x . PMID 15634332. S2CID 32923462.
- ^ Kim YK, Kim VN (febrero de 2007). "Procesamiento de microARN intrónicos". The EMBO Journal . 26 (3): 775–83. doi :10.1038/sj.emboj.7601512. PMC 1794378 . PMID 17255951.
- ^ Baskerville S, Bartel DP (marzo de 2005). "El perfilado de microarrays de microARN revela una coexpresión frecuente con miARN vecinos y genes del huésped". ARN . 11 (3): 241–7. doi :10.1261/rna.7240905. PMC 1370713 . PMID 15701730.
- ^ abc Lee Y, Kim M, Han J, Yeom KH, Lee S, Baek SH, et al. (octubre de 2004). "Los genes de microARN son transcritos por la ARN polimerasa II". The EMBO Journal . 23 (20): 4051–60. doi :10.1038/sj.emboj.7600385. PMC 524334 . PMID 15372072.
- ^ Zhou X, Ruan J, Wang G, Zhang W (marzo de 2007). "Caracterización e identificación de promotores centrales de microARN en cuatro especies modelo". PLOS Computational Biology . 3 (3): e37. Bibcode :2007PLSCB...3...37Z. doi : 10.1371/journal.pcbi.0030037 . PMC 1817659 . PMID 17352530.
- ^ Faller M, Guo F (noviembre de 2008). "Biogénesis de microARN: hay más de una forma de despellejar a un gato". Biochimica et Biophysica Acta (BBA) - Mecanismos de regulación genética . 1779 (11): 663–7. doi :10.1016/j.bbagrm.2008.08.005. PMC 2633599. PMID 18778799 .
- ^ Lee Y, Ahn C, Han J, Choi H, Kim J, Yim J, et al. (Septiembre de 2003). "La ARNasa III nuclear Drosha inicia el procesamiento de microARN". Naturaleza . 425 (6956): 415–9. Código Bib :2003Natur.425..415L. doi : 10.1038/naturaleza01957. PMID 14508493. S2CID 4421030.
- ^ Gregory RI, Chendrimada TP, Shiekhattar R (2006). "Biogénesis de microARN: aislamiento y caracterización del complejo microprocesador". Protocolos de microARN . Métodos en biología molecular. Vol. 342. págs. 33–47. doi :10.1385/1-59745-123-1:33. ISBN. 978-1-59745-123-9. Número de identificación personal 16957365.
- ^ Han J, Lee Y, Yeom KH, Kim YK, Jin H, Kim VN (diciembre de 2004). "El complejo Drosha-DGCR8 en el procesamiento primario de microARN". Genes & Development . 18 (24): 3016–27. doi :10.1101/gad.1262504. PMC 535913 . PMID 15574589.
- ^ Han J, Lee Y, Yeom KH, Nam JW, Heo I, Rhee JK, et al. (junio de 2006). "Base molecular para el reconocimiento de microARN primarios por el complejo Drosha-DGCR8". Cell . 125 (5): 887–901. doi : 10.1016/j.cell.2006.03.043 . PMID 16751099.
- ^ Conrad T, Marsico A, Gehre M, Orom UA (octubre de 2014). "La actividad del microprocesador controla la biogénesis diferencial de miRNA in vivo". Cell Reports . 9 (2): 542–54. doi : 10.1016/j.celrep.2014.09.007 . PMID 25310978.
- ^ Auyeung VC, Ulitsky I, McGeary SE, Bartel DP (febrero de 2013). "Más allá de la estructura secundaria: los determinantes de la secuencia primaria autorizan el procesamiento de las horquillas pri-miRNA". Cell . 152 (4): 844–58. doi :10.1016/j.cell.2013.01.031. PMC 3707628 . PMID 23415231.
- ^ Ali PS, Ghoshdastider U, Hoffmann J, Brutschy B, Filipek S (noviembre de 2012). "Reconocimiento del precursor de miRNA let-7g por Lin28B humano". FEBS Letters . 586 (22): 3986–90. Bibcode :2012FEBSL.586.3986S. doi : 10.1016/j.febslet.2012.09.034 . PMID 23063642. S2CID 28899778.
- ^ ab Ruby JG, Jan CH, Bartel DP (julio de 2007). "Precursores de microARN intrónicos que evitan el procesamiento de Drosha". Nature . 448 (7149): 83–86. Bibcode :2007Natur.448...83R. doi :10.1038/nature05983. PMC 2475599 . PMID 17589500.
- ^ Berezikov E, Chung WJ, Willis J, Cuppen E, Lai EC (octubre de 2007). "Genes mirtron de mamíferos". Célula molecular . 28 (2): 328–336. doi :10.1016/j.molcel.2007.09.028. PMC 2763384 . PMID 17964270.
- ^ ab Kawahara Y, Megraw M, Kreider E, Iizasa H, Valente L, Hatzigeorgiou AG, et al. (Septiembre de 2008). "Frecuencia y destino de la edición de microARN en el cerebro humano". Investigación de ácidos nucleicos . 36 (16): 5270–80. doi : 10.1093/nar/gkn479. PMC 2532740 . PMID 18684997.
- ^ Winter J, Jung S, Keller S, Gregory RI, Diederichs S (marzo de 2009). "Muchos caminos hacia la madurez: vías de biogénesis de microARN y su regulación". Nature Cell Biology . 11 (3): 228–34. doi :10.1038/ncb0309-228. PMID 19255566. S2CID 205286318.
- ^ Ohman M (octubre de 2007). "Edición A-a-I: un desafío o un aliado para el proceso de microARN". Biochimie . 89 (10): 1171–6. doi :10.1016/j.biochi.2007.06.002. PMID 17628290.
- ^ ab Murchison EP , Hannon GJ (junio de 2004). "Los miRNA en movimiento: biogénesis de los miRNA y la maquinaria de RNAi". Current Opinion in Cell Biology . 16 (3): 223–9. doi :10.1016/j.ceb.2004.04.003. PMID 15145345.

- ^ abc Lund E, Dahlberg JE (2006). "Selectividad de sustrato de exportina 5 y Dicer en la biogénesis de microARN". Simposios de Cold Spring Harbor sobre biología cuantitativa . 71 : 59–66. doi : 10.1101/sqb.2006.71.050 . PMID 17381281.
- ^ Park JE, Heo I, Tian Y, Simanshu DK, Chang H, Jee D, et al. (julio de 2011). "Dicer reconoce el extremo 5' del ARN para un procesamiento eficiente y preciso". Nature . 475 (7355): 201–5. doi :10.1038/nature10198. PMC 4693635 . PMID 21753850.
- ^ Ji X (2008). "El mecanismo de acción de la ARNasa III: cómo Dicer corta". Interferencia de ARN . Temas actuales en microbiología e inmunología. Vol. 320. págs. 99-116. doi :10.1007/978-3-540-75157-1_5. ISBN 978-3-540-75156-4. Número de identificación personal 18268841.
- ^ Mirihana Arachchilage G, Dassanayake AC, Basu S (febrero de 2015). "Un interruptor estructural de ARN dependiente del ion potasio regula la maduración del pre-miRNA 92b humano". Química y biología . 22 (2): 262–72. doi : 10.1016/j.chembiol.2014.12.013 . PMID 25641166.
- ^ Sohel MH (2016). "MicroARN extracelulares/circulantes: mecanismos de liberación, funciones y desafíos". Logros en las ciencias de la vida . 10 (2): 175–186. doi : 10.1016/j.als.2016.11.007 .
- ^ ab Boeckel JN, Reis SM, Leistner D, Thomé CE, Zeiher AM, Fichtlscherer S, et al. (abril de 2014). "Del corazón a los pies: contribución del corazón a los niveles de microARN periféricos". Revista internacional de cardiología . 172 (3): 616–7. doi :10.1016/j.ijcard.2014.01.082. PMID 24508494.
- ^ Lelandais-Brière C, Sorin C, Declerck M, Benslimane A, Crespi M, Hartmann C (marzo de 2010). "Diversidad de ARN pequeños en plantas y su impacto en el desarrollo". Current Genomics . 11 (1): 14–23. doi :10.2174/138920210790217918. PMC 2851111 . PMID 20808519.
- ^ Rana TM (enero de 2007). "Iluminando el silencio: comprensión de la estructura y función de los ARN pequeños". Nature Reviews Molecular Cell Biology . 8 (1): 23–36. doi :10.1038/nrm2085. PMID 17183358. S2CID 8966239.
- ^ ab Schwarz DS, Zamore PD (mayo de 2002). "¿Por qué los miRNA viven en el miRNP?". Genes & Development . 16 (9): 1025–31. doi : 10.1101/gad.992502 . PMID 12000786.
- ^ Krol J, Sobczak K, Wilczynska U, Drath M, Jasinska A, Kaczynska D, et al. (octubre de 2004). "Características estructurales de los precursores de microARN (miARN) y su relevancia para la biogénesis de miARN y el diseño de ARN interferente pequeño/ARN de horquilla corta". The Journal of Biological Chemistry . 279 (40): 42230–9. doi : 10.1074/jbc.M404931200 . PMID 15292246.
- ^ Khvorova A, Reynolds A, Jayasena SD (octubre de 2003). "Los siRNA y miRNA funcionales exhiben sesgo de cadena". Cell . 115 (2): 209–16. doi : 10.1016/S0092-8674(03)00801-8 . PMID 14567918.
- ^ Schwarz DS, Hutvágner G, Du T, Xu Z, Aronin N, Zamore PD (octubre de 2003). "Asimetría en el ensamblaje del complejo enzimático de ARNi". Cell . 115 (2): 199–208. doi : 10.1016/S0092-8674(03)00759-1 . PMID 14567917.
- ^ Lin SL, Chang D, Ying SY (agosto de 2005). "Asimetría de las estructuras intrónicas de pre-miRNA en el ensamblaje funcional de RISC". Gene . 356 : 32–8. doi :10.1016/j.gene.2005.04.036. PMC 1788082 . PMID 16005165.
- ^ Okamura K, Chung WJ, Lai EC (septiembre de 2008). "Lo largo y lo corto de los genes de repetición invertida en animales: microARN, mirtrones y ARN de horquilla". Ciclo celular . 7 (18): 2840–5. doi :10.4161/cc.7.18.6734. PMC 2697033 . PMID 18769156.
- ^ ab Pratt AJ, MacRae IJ (julio de 2009). "El complejo silenciador inducido por ARN: una máquina versátil de silenciamiento de genes". The Journal of Biological Chemistry . 284 (27): 17897–901. doi : 10.1074/jbc.R900012200 . PMC 2709356 . PMID 19342379.
- ^ MacRae IJ, Ma E, Zhou M, Robinson CV, Doudna JA (enero de 2008). "Reconstitución in vitro del complejo de carga RISC humano". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (2): 512–7. Bibcode :2008PNAS..105..512M. doi : 10.1073/pnas.0710869105 . PMC 2206567 . PMID 18178619.
- ^ Mourelatos Z, Dostie J, Paushkin S, Sharma A, Charroux B, Abel L, et al. (marzo de 2002). "miRNPs: una nueva clase de ribonucleoproteínas que contienen numerosos microARN". Genes & Development . 16 (6): 720–8. doi :10.1101/gad.974702. PMC 155365 . PMID 11914277.
- ^ Meister G, Landthaler M, Peters L, Chen PY, Urlaub H, Lührmann R, et al. (diciembre de 2005). "Identificación de nuevas proteínas asociadas a argonauta". Current Biology . 15 (23): 2149–55. Bibcode :2005CBio...15.2149M. doi : 10.1016/j.cub.2005.10.048 . hdl : 11858/00-001M-0000-0012-E763-B . PMID 16289642.
- ^ Shaw G, Kamen R (29 de agosto de 1986). "Una secuencia AU conservada de la región 3' no traducida del ARNm de GM-CSF media la degradación selectiva del ARNm". Cell . 46 (5): 659–667. doi :10.1016/0092-8674(86)90341-7. ISSN 0092-8674. PMID 3488815.
- ^ Jing Q, Huang S, Guth S, Zarubin T, Motoyama A, Chen J, et al. (marzo de 2005). "Participación de microARN en la inestabilidad del ARNm mediada por elementos ricos en AU". Cell . 120 (5): 623–34. doi : 10.1016/j.cell.2004.12.038 . PMID 15766526.
- ^ abc Kai ZS, Pasquinelli AE (enero de 2010). "Asesinos de microARN: factores que regulan la desaparición de los miARN". Nature Structural & Molecular Biology . 17 (1): 5–10. doi :10.1038/nsmb.1762. PMC 6417416 . PMID 20051982.
- ^ Chatterjee S, Grosshans H (septiembre de 2009). "El recambio activo modula la actividad de microARN maduro en Caenorhabditis elegans". Nature . 461 (7263): 546–9. Bibcode :2009Natur.461..546C. doi :10.1038/nature08349. PMID 19734881. S2CID 4414841.
- ^ abc Morozova N, Zinovyev A, Nonne N, Pritchard LL, Gorban AN, Harel-Bellan A (septiembre de 2012). "Firmas cinéticas de los modos de acción de microARN". ARN . 18 (9): 1635–55. doi :10.1261/rna.032284.112. PMC 3425779 . PMID 22850425.
- ^ Wang XJ, Reyes JL, Chua NH, Gaasterland T (2004). "Predicción e identificación de microARN de Arabidopsis thaliana y sus dianas de ARNm". Genome Biology . 5 (9): R65. doi : 10.1186/gb-2004-5-9-r65 . PMC 522872 . PMID 15345049.
- ^ Kawasaki H, Taira K (2004). "El microARN-196 inhibe la expresión de HOXB8 en la diferenciación mieloide de las células HL60". Serie de simposios sobre ácidos nucleicos . 48 (1): 211–2. doi : 10.1093/nass/48.1.211 . PMID 17150553.
- ^ ab Moxon S, Jing R, Szittya G, Schwach F, Rusholme Pilcher RL, Moulton V, et al. (octubre de 2008). "La secuenciación profunda de ARN cortos de tomates identifica microARN que se dirigen a genes implicados en la maduración de la fruta". Genome Research . 18 (10): 1602–9. doi :10.1101/gr.080127.108. PMC 2556272 . PMID 18653800.
- ^ Mazière P, Enright AJ (junio de 2007). "Predicción de dianas de microARN". Drug Discovery Today . 12 (11–12): 452–8. doi :10.1016/j.drudis.2007.04.002. PMID 17532529.
- ^ Williams AE (febrero de 2008). "Aspectos funcionales de los microARN animales". Cellular and Molecular Life Sciences . 65 (4): 545–62. doi :10.1007/s00018-007-7355-9. PMC 11131689 . PMID 17965831. S2CID 5708394.
- ^ Eulalio A, Huntzinger E, Nishihara T, Rehwinkel J, Fauser M, Izaurralde E (enero de 2009). "La deadenilación es un efecto generalizado de la regulación de los miARN". ARN . 15 (1): 21–32. doi :10.1261/rna.1399509. PMC 2612776 . PMID 19029310.
- ^ Bazzini AA, Lee MT, Giraldez AJ (abril de 2012). "El perfil de ribosomas muestra que miR-430 reduce la traducción antes de provocar la descomposición del ARNm en el pez cebra". Science . 336 (6078): 233–7. Bibcode :2012Sci...336..233B. doi :10.1126/science.1215704. PMC 3547538 . PMID 22422859.
- ^ Djuranovic S, Nahvi A, Green R (abril de 2012). "Silenciamiento génico mediado por miRNA mediante represión traduccional seguida de desadenilación y desintegración del mRNA". Science . 336 (6078): 237–40. Bibcode :2012Sci...336..237D. doi :10.1126/science.1215691. PMC 3971879 . PMID 22499947.
- ^ Tan Y, Zhang B, Wu T, Skogerbø G, Zhu X, Guo X, et al. (febrero de 2009). "Inhibición transcripcional de la expresión de Hoxd4 por miRNA-10a en células de cáncer de mama humano". BMC Molecular Biology . 10 (1): 12. doi : 10.1186/1471-2199-10-12 . PMC 2680403 . PMID 19232136.
- ^ Hawkins PG, Morris KV (marzo de 2008). "ARN y modulación transcripcional de la expresión génica". Ciclo celular . 7 (5): 602–7. doi :10.4161/cc.7.5.5522. PMC 2877389 . PMID 18256543.
- ^ Stark A, Brennecke J, Bushati N, Russell RB, Cohen SM (diciembre de 2005). "Los microARN animales confieren robustez a la expresión génica y tienen un impacto significativo en la evolución del 3'UTR". Cell . 123 (6): 1133–46. doi : 10.1016/j.cell.2005.11.023 . PMID 16337999.
- ^ He L, Hannon GJ (julio de 2004). "MicroARN: ARN pequeños con un papel importante en la regulación génica". Nature Reviews. Genetics . 5 (7): 522–531. doi :10.1038/nrg1379. PMID 15211354. S2CID 5270062.
- ^ Li LC (2008). "Activación génica mediada por ARN pequeño". En Morris KV (ed.). ARN y regulación de la expresión génica: una capa oculta de complejidad. Horizon Scientific Press. ISBN 978-1-904455-25-7.
- ^ Place RF, Li LC, Pookot D, Noonan EJ, Dahiya R (febrero de 2008). "MicroRNA-373 induce la expresión de genes con secuencias promotoras complementarias". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (5): 1608–13. Bibcode :2008PNAS..105.1608P. doi : 10.1073/pnas.0707594105 . PMC 2234192 . PMID 18227514. (Fe de erratas: doi : 10.1073/pnas.1803343115, PMID 29555737, Retraction Watch )
- ^ Salmena L, Poliseno L, Tay Y, Kats L, Pandolfi PP (agosto de 2011). "Una hipótesis de ARNce: ¿la piedra Rosetta de un lenguaje de ARN oculto?". Celúla . 146 (3): 353–8. doi : 10.1016/j.cell.2011.07.014. PMC 3235919 . PMID 21802130.
- ^ ab Kumar S, Reddy PH (septiembre de 2016). "¿Son los microARN circulantes biomarcadores periféricos de la enfermedad de Alzheimer?". Biochim Biophys Acta . 1862 (9): 1617–27. doi :10.1016/j.bbadis.2016.06.001. PMC 5343750. PMID 27264337 .
- ^ van den Berg MM, Krauskopf J, Ramaekers JG, et al. (febrero de 2020). "MicroARN circulantes como posibles biomarcadores de trastornos psiquiátricos y neurodegenerativos". Prog Neurobiol . 185 : 101732. doi : 10.1016/j.pneurobio.2019.101732 . PMID 31816349.
- ^ Cuman C, Van Sinderen M, Gantier MP, Rainczuk K, Sorby K, Rombauts L, et al. (octubre de 2015). "Los microARN secretados por blastocistos humanos regulan la adhesión de células epiteliales endometriales". eBioMedicine . 2 (10): 1528–1535. doi :10.1016/j.ebiom.2015.09.003. PMC 4634783 . PMID 26629549.
- ^ Zhou L, Miller C, Miraglia LJ, Romero A, Mure LS, Panda S, et al. (enero de 2021). "Un análisis de microARN de todo el genoma identifica el grupo de microARN-183/96/182 como modulador de los ritmos circadianos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 118 (1): e2020454118. Bibcode :2021PNAS..11820454Z. doi : 10.1073/pnas.2020454118 . PMC 7817116 . PMID 33443164. S2CID 230713808.
- "Los microARN desempeñan un papel clave en la regulación de los ritmos circadianos". Science News . 6 de enero de 2021.
- ^ Axtell MJ, Bartel DP (junio de 2005). "Antigüedad de los microARN y sus objetivos en plantas terrestres". The Plant Cell . 17 (6): 1658–73. doi :10.1105/tpc.105.032185. PMC 1143068 . PMID 15849273.
- ^ Tanzer A, Stadler PF (mayo de 2004). "Evolución molecular de un grupo de microARN". Journal of Molecular Biology . 339 (2): 327–35. CiteSeerX 10.1.1.194.1598 . doi :10.1016/j.jmb.2004.03.065. PMID 15136036.
- ^ Chen K, Rajewsky N (febrero de 2007). "La evolución de la regulación génica mediante factores de transcripción y microARN". Nature Reviews Genetics . 8 (2): 93–103. doi :10.1038/nrg1990. PMID 17230196. S2CID 174231.
- ^ Lee CT, Risom T, Strauss WM (abril de 2007). "Conservación evolutiva de los circuitos reguladores de microARN: un examen de la complejidad de los genes de microARN y las interacciones conservadas entre microARN y diana a través de la filogenia de los metazoos". ADN y biología celular . 26 (4): 209–18. doi :10.1089/dna.2006.0545. PMID 17465887.
- ^ abcd Peterson KJ, Dietrich MR, McPeek MA (julio de 2009). "MicroARN y macroevolución de los metazoos: perspectivas sobre la canalización, la complejidad y la explosión cámbrica". BioEssays . 31 (7): 736–47. doi : 10.1002/bies.200900033 . PMID 19472371. S2CID 15364875.
- ^ Shabalina SA, Koonin EV (octubre de 2008). "Orígenes y evolución de la interferencia del ARN eucariota". Tendencias en ecología y evolución . 23 (10): 578–87. Bibcode :2008TEcoE..23..578S. doi :10.1016/j.tree.2008.06.005. PMC 2695246 . PMID 18715673.
- ^ Axtell MJ, Westholm JO, Lai EC (2011). "Vive la différence: biogénesis y evolución de microRNAs en plantas y animales". Genome Biology . 12 (4): 221. doi : 10.1186/gb-2011-12-4-221 . PMC 3218855 . PMID 21554756.
- ^ ab Wheeler BM, Heimberg AM, Moy VN, Sperling EA, Holstein TW, Heber S, et al. (2009). "La evolución profunda de los microARN de los metazoos". Evolución y desarrollo . 11 (1): 50–68. doi :10.1111/j.1525-142X.2008.00302.x. PMID 19196333. S2CID 14924603.
- ^ Pashkovskiy PP, Ryazansky SS (junio de 2013). "Biogénesis, evolución y funciones de los microARN de plantas". Bioquímica. Biokhimiia . 78 (6): 627–37. doi :10.1134/S0006297913060084. PMID 23980889. S2CID 12025420.
- ^ ab Heimberg AM, Sempere LF, Moy VN, Donoghue PC, Peterson KJ (febrero de 2008). "MicroRNAs and the advenimiento de la complejidad morfológica de los vertebrados". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (8): 2946–50. Bibcode :2008PNAS..105.2946H. doi : 10.1073/pnas.0712259105 . PMC 2268565 . PMID 18287013.
- ^ abc Nozawa M, Miura S, Nei M (julio de 2010). "Orígenes y evolución de los genes de microARN en especies de Drosophila". Genome Biology and Evolution . 2 : 180–9. doi :10.1093/gbe/evq009. PMC 2942034 . PMID 20624724.
- ^ Allen E, Xie Z, Gustafson AM, Sung GH, Spatafora JW, Carrington JC (diciembre de 2004). "Evolución de genes de microARN mediante duplicación invertida de secuencias de genes diana en Arabidopsis thaliana". Nature Genetics . 36 (12): 1282–90. doi :10.1038/ng1478. PMID 15565108. S2CID 11997028.
- ^ Warthmann N, Das S, Lanz C, Weigel D (mayo de 2008). "Análisis comparativo del locus de microARN MIR319a en Arabidopsis y Brassicaceae relacionadas". Biología molecular y evolución . 25 (5): 892–902. doi : 10.1093/molbev/msn029 . PMID 18296705.
- ^ Fahlgren N, Jogdeo S, Kasschau KD, Sullivan CM, Chapman EJ, Laubinger S, et al. (Abril de 2010). "Evolución del gen microARN en Arabidopsis lyrata y Arabidopsis thaliana". La célula vegetal . 22 (4): 1074–89. doi :10.1105/tpc.110.073999. PMC 2879733 . PMID 20407027.
- ^ Caravas J, Friedrich M (junio de 2010). "De ácaros y milpiés: progreso reciente en la resolución de la base del árbol de los artrópodos". BioEssays . 32 (6): 488–95. doi :10.1002/bies.201000005. PMID 20486135. S2CID 20548122.
- ^ Kenny NJ, Namigai EK, Marlétaz F, Hui JH, Shimeld SM (diciembre de 2015). "Ensamblajes genómicos preliminares y complementos de microARN previstos de los lofotrocozoos intermareales Patella vulgata (Mollusca, Patellogastropoda) y Spirobranchus (Pomatoceros) lamarcki (Annelida, Serpulida)". Marine Genomics . 24 (2): 139–46. Bibcode :2015MarGn..24..139K. doi :10.1016/j.margen.2015.07.004. PMID 26319627.
- ^ Cock JM, Sterck L, Rouzé P, Scornet D, Allen AE, Amoutzias G, et al. (junio de 2010). "El genoma de Ectocarpus y la evolución independiente de la multicelularidad en las algas pardas". Nature . 465 (7298): 617–21. Bibcode :2010Natur.465..617C. doi : 10.1038/nature09016 . PMID 20520714.
- ^ Cuperus JT, Fahlgren N, Carrington JC (febrero de 2011). "Evolución y diversificación funcional de los genes MIRNA". The Plant Cell . 23 (2): 431–42. doi :10.1105/tpc.110.082784. PMC 3077775 . PMID 21317375.
- ^ Ryan JF, Pang K, Schnitzler CE, Nguyen AD, Moreland RT, Simmons DK, et al. (diciembre de 2013). "El genoma del ctenóforo Mnemiopsis leidyi y sus implicaciones para la evolución del tipo celular". Science . 342 (6164): 1242592. doi :10.1126/science.1242592. PMC 3920664 . PMID 24337300.
- ^ Maxwell EK, Ryan JF, Schnitzler CE, Browne WE, Baxevanis AD (diciembre de 2012). "Los microARN y los componentes esenciales de la maquinaria de procesamiento de microARN no están codificados en el genoma del ctenóforo Mnemiopsis leidyi". BMC Genomics . 13 (1): 714. doi : 10.1186/1471-2164-13-714 . PMC 3563456 . PMID 23256903.
- ^ Dimond PF (15 de marzo de 2010). «El potencial terapéutico de los miRNA». Noticias sobre ingeniería genética y biotecnología . 30 (6): 1. Archivado desde el original el 19 de julio de 2010. Consultado el 10 de julio de 2010 .
- ^ Tjaden B, Goodwin SS, Opdyke JA, Guillier M, Fu DX, Gottesman S, et al. (2006). "Predicción de objetivos para ARN pequeños no codificantes en bacterias". Nucleic Acids Research . 34 (9): 2791–802. doi :10.1093/nar/gkl356. PMC 1464411 . PMID 16717284.
- ^ Liu CG, Calin GA, Volinia S, Croce CM (2008). "Perfiles de expresión de microARN mediante microarrays". Nature Protocols . 3 (4): 563–78. doi :10.1038/nprot.2008.14. PMID 18388938. S2CID 2441105.
- ^ Chen C, Ridzon DA, Broomer AJ, Zhou Z, Lee DH, Nguyen JT, et al. (noviembre de 2005). "Cuantificación en tiempo real de microARN mediante RT-PCR de tallo-bucle". Nucleic Acids Research . 33 (20): e179. doi :10.1093/nar/gni178. PMC 1292995 . PMID 16314309.
- ^ Shingara J, Keiger K, Shelton J, Laosinchai-Wolf W, Powers P, Conrad R, et al. (septiembre de 2005). "Una plataforma optimizada de aislamiento y etiquetado para la determinación precisa de la expresión de microARN". ARN . 11 (9): 1461–70. doi :10.1261/rna.2610405. PMC 1370829 . PMID 16043497.
- ^ Buermans HP, Ariyurek Y, van Ommen G, den Dunnen JT, 't Hoen PA (diciembre de 2010). "Nuevos métodos para la secuenciación de próxima generación basada en la determinación de perfiles de expresión de microARN". BMC Genomics . 11 : 716. doi : 10.1186/1471-2164-11-716 . PMC 3022920 . PMID 21171994.
- ^ Kloosterman WP, Wienholds E, Ketting RF, Plasterk RH (2004). "Requerimientos de sustrato para la función let-7 en el embrión de pez cebra en desarrollo". Nucleic Acids Research . 32 (21): 6284–91. doi :10.1093/nar/gkh968. PMC 535676 . PMID 15585662.
- ^ Flynt AS, Li N, Thatcher EJ, Solnica-Krezel L, Patton JG (febrero de 2007). "El miR-214 del pez cebra modula la señalización de Hedgehog para especificar el destino de las células musculares". Nature Genetics . 39 (2): 259–63. doi :10.1038/ng1953. PMC 3982799 . PMID 17220889.
- ^ Meister G, Landthaler M, Dorsett Y, Tuschl T (marzo de 2004). "Inhibición específica de secuencia del silenciamiento de ARN inducido por microARN y siARN". ARN . 10 (3): 544–50. doi :10.1261/rna.5235104. PMC 1370948 . PMID 14970398.
- ^ Kloosterman WP, Lagendijk AK, Ketting RF, Moulton JD, Plasterk RH (agosto de 2007). "La inhibición dirigida de la maduración de miRNA con morfolinos revela un papel para miR-375 en el desarrollo de los islotes pancreáticos". PLOS Biology . 5 (8): e203. doi : 10.1371/journal.pbio.0050203 . PMC 1925136 . PMID 17676975. (Este artículo actualmente tiene una expresión de preocupación , consulte doi : 10.1371/journal.pbio.3001631, PMID 35486652. )
- ^ Gebert LF, Rebhan MA, Crivelli SE, Denzler R, Stoffel M, Hall J (enero de 2014). "Miravirsen (SPC3649) puede inhibir la biogénesis de miR-122". Nucleic Acids Research . 42 (1): 609–21. doi :10.1093/nar/gkt852. PMC 3874169 . PMID 24068553.
- ^ Choi WY, Giraldez AJ, Schier AF (octubre de 2007). "Los protectores de dianas revelan amortiguación y equilibrio del agonista y antagonista nodal por miR-430". Science . 318 (5848): 271–4. Bibcode :2007Sci...318..271C. doi : 10.1126/science.1147535 . PMID 17761850. S2CID 30461594.
- ^ You Y, Moreira BG, Behlke MA, Owczarzy R (mayo de 2006). "Diseño de sondas LNA que mejoran la discriminación de desajustes". Nucleic Acids Research . 34 (8): e60. doi :10.1093/nar/gkl175. PMC 1456327 . PMID 16670427.
- ^ Lagendijk AK, Moulton JD, Bakkers J (junio de 2012). "Detalles reveladores: protocolo de hibridación in situ de microARN de montaje completo para embriones de pez cebra y tejidos adultos". Biology Open . 1 (6): 566–9. doi :10.1242/bio.2012810. PMC 3509442 . PMID 23213449.
- ^ Kaur H, Arora A, Wengel J, Maiti S (junio de 2006). "Efectos termodinámicos, de contraión y de hidratación para la incorporación de nucleótidos de ácidos nucleicos bloqueados en dúplex de ADN". Bioquímica . 45 (23): 7347–55. doi :10.1021/bi060307w. PMID 16752924.
- ^ Nielsen JA, Lau P, Maric D, Barker JL, Hudson LD (agosto de 2009). "Integración de los perfiles de expresión de microARN y ARNm de los progenitores neuronales para identificar redes reguladoras subyacentes al inicio de la neurogénesis cortical". BMC Neuroscience . 10 : 98. doi : 10.1186/1471-2202-10-98 . PMC 2736963 . PMID 19689821.
- ^ Grimson A, Farh KK, Johnston WK, Garrett-Engele P, Lim LP, Bartel DP (julio de 2007). "Especificidad de la orientación de microARN en mamíferos: determinantes más allá del apareamiento de semillas". Molecular Cell . 27 (1): 91–105. doi :10.1016/j.molcel.2007.06.017. PMC 3800283 . PMID 17612493.
- ^ Griffiths-Jones S, Saini HK, van Dongen S, Enright AJ (enero de 2008). "miRBase: herramientas para la genómica de microARN". Nucleic Acids Research . 36 (número de la base de datos): D154–8. doi :10.1093/nar/gkm952. PMC 2238936 . PMID 17991681.
- ^ Nam S, Li M, Choi K, Balch C, Kim S, Nephew KP (julio de 2009). "Análisis integrado de microARN y ARNm (MMIA): una herramienta web para examinar las funciones biológicas de la expresión de microARN". Nucleic Acids Research . 37 (número de servidor web): W356–62. doi :10.1093/nar/gkp294. PMC 2703907 . PMID 19420067.
- ^ Artmann S, Jung K, Bleckmann A, Beissbarth T (2012). Provero P (ed.). "Detección de efectos de grupo simultáneos en la expresión de microARN y conjuntos de genes diana relacionados". PLOS ONE . 7 (6): e38365. Bibcode :2012PLoSO...738365A. doi : 10.1371/journal.pone.0038365 . PMC 3378551 . PMID 22723856.
- ^ Jiang Q, Wang Y, Hao Y, Juan L, Teng M, Zhang X, et al. (enero de 2009). "miR2Disease: una base de datos curada manualmente para la desregulación de microARN en enfermedades humanas". Nucleic Acids Research . 37. 37 (número de base de datos): D98–104. doi :10.1093/nar/gkn714. PMC 2686559 . PMID 18927107.
- ^ Mencía A, Modamio-Høybjør S, Redshaw N, Morín M, Mayo-Merino F, Olavarrieta L, et al. (Mayo 2009). "Las mutaciones en la región semilla del miR-96 humano son responsables de la pérdida auditiva progresiva no sindrómica". Nature Genetics . 41 (5): 609–13. doi :10.1038/ng.355. PMID 19363479. S2CID 11113852.
- ^ Hughes AE, Bradley DT, Campbell M, Lechner J, Dash DP, Simpson DA, et al. (noviembre de 2011). "La mutación que altera la región de la semilla de miR-184 causa queratocono familiar con cataratas". American Journal of Human Genetics . 89 (5): 628–33. doi :10.1016/j.ajhg.2011.09.014. PMC 3213395 . PMID 21996275.
- ^ de Pontual L, Yao E, Callier P, Faivre L, Drouin V, Cariou S, et al. (Septiembre de 2011). "La eliminación de la línea germinal del grupo miR-17 ~ 92 provoca defectos esqueléticos y de crecimiento en humanos". Genética de la Naturaleza . 43 (10): 1026–30. doi :10.1038/ng.915. PMC 3184212 . PMID 21892160.
- ^ Calin GA, Liu CG, Sevignani C, Ferracin M, Felli N, Dumitru CD, et al. (agosto de 2004). "El perfil de microARN revela firmas distintivas en las leucemias linfocíticas crónicas de células B". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 101 (32): 11755–11760. Bibcode :2004PNAS..10111755C. doi : 10.1073/pnas.0404432101 . PMC 511048 . PMID 15284443.
- ^ Velle A, Pesenti C, Grassi T, Beltrame L, Martini P, Jaconi M, et al. (mayo de 2023). "Una investigación exhaustiva de microARN específicos de histotipo y sus variantes en cánceres de ovario epiteliales en estadio I". Revista internacional del cáncer . 152 (9): 1989–2001. doi : 10.1002/ijc.34408 . hdl : 11577/3478062 . PMID 36541726. S2CID 255034585.
- ^ Kyriakidis I, Kyriakidis K, Tsezou A (agosto de 2022). "MicroARN y diagnóstico de leucemia linfoblástica aguda infantil: revisión sistemática, metanálisis y reanálisis con nuevas herramientas de secuenciación de ARN pequeño". Cánceres . 14 (16): 3976. doi : 10.3390/cancers14163976 . PMC 9406077 . PMID 36010971.
- ^ Võsa U, Vooder T, Kolde R, Fischer K, Välk K, Tõnisson N, et al. (octubre de 2011). "Identificación de miR-374a como marcador pronóstico de supervivencia en pacientes con cáncer de pulmón de células no pequeñas en etapa temprana". Genes, cromosomas y cáncer . 50 (10): 812–22. doi :10.1002/gcc.20902. PMID 21748820. S2CID 9746594.
- ^ Akçakaya P, Ekelund S, Kolosenko I, Caramuta S, Ozata DM, Xie H, et al. (agosto de 2011). "La desregulación de miR-185 y miR-133b está asociada con la supervivencia general y la metástasis en el cáncer colorrectal". Revista Internacional de Oncología . 39 (2): 311–8. doi : 10.3892/ijo.2011.1043 . PMID 21573504.
- ^ ab Eyking A, Reis H, Frank M, Gerken G, Schmid KW, Cario E (2016). "MiR-205 y MiR-373 están asociados con el cáncer colorrectal mucinoso humano agresivo". PLOS ONE . 11 (6): e0156871. Bibcode :2016PLoSO..1156871E. doi : 10.1371/journal.pone.0156871 . PMC 4894642 . PMID 27271572.
- ^ El microARN-21 promueve la proliferación de células de carcinoma hepatocelular HepG2 a través de la represión de la proteína quinasa-quinasa 3 activada por mitógeno. Guangxian Xu et al., 2013
- ^ Jones K, Nourse JP, Keane C, Bhatnagar A, Gandhi MK (enero de 2014). "Los microARN plasmáticos son biomarcadores de respuesta a la enfermedad en el linfoma de Hodgkin clásico". Clinical Cancer Research . 20 (1): 253–64. doi : 10.1158/1078-0432.CCR-13-1024 . PMID 24222179.
- ^ Hosseinahli N, Aghapour M, Duijf PH, Baradaran B (agosto de 2018). "Tratamiento del cáncer con terapia de reemplazo de microARN: una revisión de la literatura". Journal of Cellular Physiology . 233 (8): 5574–5588. doi : 10.1002/jcp.26514 . PMID 29521426. S2CID 3766576.
- ^ Liu G, Sun Y, Ji P, Li X, Cogdell D, Yang D, et al. (julio de 2014). "MiR-506 suprime la proliferación e induce la senescencia al dirigirse directamente al eje CDK4/6-FOXM1 en el cáncer de ovario". The Journal of Pathology . 233 (3): 308–18. doi :10.1002/path.4348. PMC 4144705 . PMID 24604117.
- ^ Wen SY, Lin Y, Yu YQ, Cao SJ, Zhang R, Yang XM, et al. (febrero de 2015). "miR-506 actúa como un supresor tumoral al dirigirse directamente al factor de transcripción de la vía hedgehog Gli3 en el cáncer de cuello uterino humano". Oncogene . 34 (6): 717–25. doi : 10.1038/onc.2014.9 . PMID 24608427. S2CID 20603801.
- ^ Universidad de Pekín (13 de septiembre de 2022). «Los científicos desarrollan una nueva y poderosa arma contra el cáncer». Cell . 185 (11). SciTech Daily : 1888–1904.e24. doi : 10.1016/j.cell.2022.04.030 . PMID 35623329. S2CID 249070106 . Consultado el 15 de septiembre de 2022 .
- ^ Loeb KR, Loeb LA (marzo de 2000). "Importancia de las mutaciones múltiples en el cáncer". Carcinogénesis . 21 (3): 379–385. doi : 10.1093/carcin/21.3.379 . PMID 10688858.
- ^ Lodish H, Berk A, Kaiser CA, Krieger M, Bretscher A, Ploegh H, et al. (2016). Biología celular molecular (8.ª ed.). Nueva York: WH Freeman and Company. pág. 203. ISBN 978-1-4641-8339-3.
- ^ Hu H, Gatti RA (junio de 2011). "MicroRNAs: nuevos actores en la respuesta al daño del ADN". Journal of Molecular Cell Biology . 3 (3): 151–158. doi :10.1093/jmcb/mjq042. PMC 3104011 . PMID 21183529.
- ^ Jasperson KW, Tuohy TM, Neklason DW, Burt RW (junio de 2010). "Cáncer de colon hereditario y familiar". Gastroenterología . 138 (6): 2044–58. doi :10.1053/j.gastro.2010.01.054. PMC 3057468 . PMID 20420945.
- ^ Truninger K, Menigatti M, Luz J, Russell A, Haider R, Gebbers JO, et al. (mayo de 2005). "El análisis inmunohistoquímico revela una alta frecuencia de defectos de PMS2 en el cáncer colorrectal". Gastroenterología . 128 (5): 1160–71. doi : 10.1053/j.gastro.2005.01.056 . PMID 15887099.
- ^ Valeri N, Gasparini P, Fabbri M, Braconi C, Veronese A, Lovat F, et al. (abril de 2010). "Modulación de la reparación de errores de emparejamiento y estabilidad genómica por miR-155". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (15): 6982–7. Bibcode :2010PNAS..107.6982V. doi : 10.1073/pnas.1002472107 . PMC 2872463 . PMID 20351277.
- ^ abc Zhang W, Zhang J, Hoadley K, Kushwaha D, Ramakrishnan V, Li S, et al. (junio de 2012). "miR-181d: un biomarcador predictivo del glioblastoma que regula negativamente la expresión de MGMT". Neuro-Oncology . 14 (6): 712–9. doi :10.1093/neuonc/nos089. PMC 3367855 . PMID 22570426.
- ^ Spiegl-Kreinecker S, Pirker C, Filipits M, Lötsch D, Buchroithner J, Pichler J, et al. (enero de 2010). "La expresión de la proteína O6-metilguanina ADN metiltransferasa en células tumorales predice el resultado de la terapia con temozolomida en pacientes con glioblastoma". Neuro-Oncology . 12 (1): 28–36. doi :10.1093/neuonc/nop003. PMC 2940563 . PMID 20150365.
- ^ Sgarra R, Rustighi A, Tessari MA, Di Bernardo J, Altamura S, Fusco A, et al. (Septiembre de 2004). "Fosfoproteínas nucleares HMGA y su relación con la estructura de la cromatina y el cáncer". Cartas FEBS . 574 (1–3): 1–8. Código Bib : 2004FEBSL.574....1S. doi :10.1016/j.febslet.2004.08.013. PMID 15358530. S2CID 28903539.
- ^ Xu Y, Sumter TF, Bhattacharya R, Tesfaye A, Fuchs EJ, Wood LJ, et al. (mayo de 2004). "El oncogén HMG-I causa una malignidad linfoide altamente penetrante y agresiva en ratones transgénicos y se sobreexpresa en la leucemia humana". Cancer Research . 64 (10): 3371–5. doi : 10.1158/0008-5472.CAN-04-0044 . PMID 15150086.
- ^ Borrmann L, Schwanbeck R, Heyduk T, Seebeck B, Rogalla P, Bullerdiek J, et al. (diciembre de 2003). "La proteína del grupo A2 de alta movilidad y sus derivados se unen a una región específica del promotor del gen de reparación del ADN ERCC1 y modulan su actividad". Nucleic Acids Research . 31 (23): 6841–51. doi :10.1093/nar/gkg884. PMC 290254 . PMID 14627817.
- ^ Facista A, Nguyen H, Lewis C, Prasad AR, Ramsey L, Zaitlin B, et al. (abril de 2012). "Expresión deficiente de enzimas reparadoras del ADN en la progresión temprana del cáncer de colon esporádico". Integridad del genoma . 3 (1): 3. doi : 10.1186/2041-9414-3-3 . PMC 3351028 . PMID 22494821.
- ^ Gibert B, Delloye-Bourgeois C, Gattolliat CH, Meurette O, Le Guernevel S, Fombonne J, et al. (noviembre de 2014). "Regulación por la familia miR181 de la actividad supresora tumoral del receptor de dependencia CDON en el neuroblastoma". Journal of the National Cancer Institute . 106 (11). doi : 10.1093/jnci/dju318 . PMID 25313246.
- ^ Chen JF, Murchison EP , Tang R, Callis TE, Tatsuguchi M, Deng Z, et al. (febrero de 2008). "La eliminación dirigida de Dicer en el corazón conduce a miocardiopatía dilatada e insuficiencia cardíaca". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (6): 2111–6. Bibcode :2008PNAS..105.2111C. doi : 10.1073/pnas.0710228105 . PMC 2542870 . PMID 18256189.
- ^ ab Zhao Y, Ransom JF, Li A, Vedantham V, von Drehle M, Muth AN, et al. (abril de 2007). "Desregulación de la cardiogénesis, la conducción cardíaca y el ciclo celular en ratones que carecen de miRNA-1-2". Cell . 129 (2): 303–17. doi : 10.1016/j.cell.2007.03.030 . PMID 17397913.
- ^ Thum T, Galuppo P, Wolf C, Fiedler J, Kneitz S, van Laake LW, et al. (julio de 2007). "MicroARN en el corazón humano: una pista para la reprogramación genética fetal en la insuficiencia cardíaca". Circulation . 116 (3): 258–67. doi : 10.1161/CIRCULATIONAHA.107.687947 . PMID 17606841.
- ^ van Rooij E, Sutherland LB, Liu N, Williams AH, McAnally J, Gerard RD, et al. (noviembre de 2006). "Un patrón característico de microARN sensibles al estrés que pueden provocar hipertrofia cardíaca e insuficiencia cardíaca". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (48): 18255–60. Bibcode :2006PNAS..10318255V. doi : 10.1073/pnas.0608791103 . PMC 1838739 . PMID 17108080.
- ^ Tatsuguchi M, Seok HY, Callis TE, Thomson JM, Chen JF, Newman M, et al. (junio de 2007). "La expresión de microARN se regula dinámicamente durante la hipertrofia de los cardiomiocitos". Journal of Molecular and Cellular Cardiology . 42 (6): 1137–41. doi :10.1016/j.yjmcc.2007.04.004. PMC 1934409 . PMID 17498736.
- ^ Zhao Y, Samal E, Srivastava D (julio de 2005). "El factor de respuesta sérica regula un microARN específico del músculo que se dirige a Hand2 durante la cardiogénesis". Nature . 436 (7048): 214–20. Bibcode :2005Natur.436..214Z. doi :10.1038/nature03817. PMID 15951802. S2CID 4340449.
- ^ Xiao J, Luo X, Lin H, Zhang Y, Lu Y, Wang N, et al. (abril de 2007). "El microARN miR-133 reprime la expresión del canal HERG K+, lo que contribuye a la prolongación del intervalo QT en corazones diabéticos". The Journal of Biological Chemistry . 282 (17): 12363–7. doi : 10.1074/jbc.C700015200 . PMC 3151106 . PMID 17344217. (Retractado, ver doi :10.1074/jbc.A111.700015, PMID 21961173, Retraction Watch )
- ^ Yang B, Lin H, Xiao J, Lu Y, Luo X, Li B, et al. (abril de 2007). "El microARN miR-1 específico del músculo regula el potencial arritmogénico cardíaco al dirigirse a GJA1 y KCNJ2". Nature Medicine . 13 (4): 486–91. doi :10.1038/nm1569. PMID 17401374. S2CID 1935811.
- ^ Carè A, Catalucci D, Felicetti F, Bonci D, Addario A, Gallo P, et al. (mayo de 2007). "El microARN-133 controla la hipertrofia cardíaca". Medicina de la Naturaleza . 13 (5): 613–8. doi :10.1038/nm1582. PMID 17468766. S2CID 10097893.
- ^ van Rooij E, Sutherland LB, Qi X, Richardson JA, Hill J, Olson EN (abril de 2007). "Control del crecimiento cardíaco dependiente del estrés y la expresión génica por un microARN". Science . 316 (5824): 575–9. Bibcode :2007Sci...316..575V. doi :10.1126/science.1139089. PMID 17379774. S2CID 1927839.
- ^ Keller T, Boeckel JN, Groß S, Klotsche J, Palapies L, Leistner D, et al. (julio de 2017). "Estratificación de riesgo mejorada en prevención mediante el uso de un panel de microARN circulantes seleccionados". Scientific Reports . 7 (1): 4511. Bibcode :2017NatSR...7.4511K. doi :10.1038/s41598-017-04040-w. PMC 5495799 . PMID 28674420.
- ^ Insull W (enero de 2009). "La patología de la aterosclerosis: desarrollo de la placa y respuestas de la placa al tratamiento médico". The American Journal of Medicine . 122 (1 Suppl): S3–S14. doi :10.1016/j.amjmed.2008.10.013. PMID 19110086.
- ^ abcdefghijklmnopq Son DJ, Kumar S, Takabe W, Kim CW, Ni CW, Alberts-Grill N, et al. (2013). "El microARN-712 mecanosensible atípico derivado del ARN preribosómico induce inflamación endotelial y aterosclerosis". Nature Communications . 4 : 3000. Bibcode :2013NatCo...4.3000S. doi :10.1038/ncomms4000. PMC 3923891 . PMID 24346612.
- ^ ab Basu R, Fan D, Kandalam V, Lee J, Das SK, Wang X, et al. (diciembre de 2012). "La pérdida del gen Timp3 conduce a la formación de un aneurisma aórtico abdominal en respuesta a la angiotensina II". The Journal of Biological Chemistry . 287 (53): 44083–96. doi : 10.1074/jbc.M112.425652 . PMC 3531724 . PMID 23144462.
- ^ Libby P (2002). "Inflamación en la aterosclerosis". Nature . 420 (6917): 868–74. Bibcode :2002Natur.420..868L. doi :10.1038/nature01323. PMID 12490960. S2CID 407449.
- ^ ab Phua YL, Chu JY, Marrone AK, Bodnar AJ, Sims-Lucas S, Ho J (octubre de 2015). "Los miRNA del estroma renal son necesarios para la nefrogénesis normal y la supervivencia mesangial glomerular". Physiological Reports . 3 (10): e12537. doi :10.14814/phy2.12537. PMC 4632944 . PMID 26438731.
- ^ Cao DD, Li L, Chan WY (mayo de 2016). "MicroARN: reguladores clave en el sistema nervioso central y su implicación en enfermedades neurológicas". Revista internacional de ciencias moleculares . 17 (6): 842. doi : 10.3390/ijms17060842 . PMC 4926376 . PMID 27240359.
- ^ Lang MF, Shi Y (2012). "Funciones dinámicas de los microARN en la neurogénesis". Frontiers in Neuroscience . 6 : 71. doi : 10.3389/fnins.2012.00071 . PMC 3356852 . PMID 22661924.
- ^ Schratt G (diciembre de 2009). "microARN en la sinapsis". Nature Reviews. Neuroscience . 10 (12): 842–849. doi :10.1038/nrn2763. PMID 19888283. S2CID 3507952.
- ^ Luo M, Li L, Ding M, Niu Y, Xu X, Shi X, et al. (19 de enero de 2023). "Se destacaron los microARN reguladores de la potenciación y la depresión a largo plazo en el deterioro del aprendizaje y la memoria inducidos por bisfenol A mediante la secuenciación de microARN y el análisis bioinformático". PLOS ONE . 18 (1): e0279029. Bibcode :2023PLoSO..1879029L. doi : 10.1371/journal.pone.0279029 . PMC 9851566 . PMID 36656826.
- ^ Cuellar TL, Davis TH, Nelson PT, Loeb GB, Harfe BD, Ullian E, et al. (abril de 2008). "La pérdida de Dicer en neuronas estriatales produce fenotipos conductuales y neuroanatómicos en ausencia de neurodegeneración". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (14): 5614–5619. Bibcode :2008PNAS..105.5614C. doi : 10.1073/pnas.0801689105 . PMC 2291142 . PMID 18385371.
- ^ Hébert SS, Papadopoulou AS, Smith P, Galas MC, Planel E, Silahtaroglu AN, et al. (octubre de 2010). "La ablación genética de Dicer en neuronas del prosencéfalo de adultos produce una hiperfosforilación y neurodegeneración anormales de tau". Genética Molecular Humana . 19 (20): 3959–3969. doi : 10.1093/hmg/ddq311 . PMID 20660113.
- ^ Roy B, Lee E, Li T, Rampersaud M (febrero de 2022). "El papel de los miRNA en la neurodegeneración: de la causa de la enfermedad a las herramientas de descubrimiento y terapia de biomarcadores". Genes . 13 (3): 425. doi : 10.3390/genes13030425 . PMC 8951370 . PMID 35327979.
- ^ Henshall DC, Hamer HM, Pasterkamp RJ, Goldstein DB, Kjems J, Prehn JH, et al. (diciembre de 2016). "MicroARN en la epilepsia: fisiopatología y utilidad clínica". The Lancet. Neurología . 15 (13): 1368–1376. doi : 10.1016/S1474-4422(16)30246-0 . PMID 27839653.
- ^ Hommers LG, Domschke K, Deckert J (enero de 2015). "Heterogeneidad e individualidad: microARN en trastornos mentales" (PDF) . Journal of Neural Transmission . 122 (1): 79–97. doi :10.1007/s00702-014-1338-4. PMID 25395183. S2CID 25088900 . Archivado (PDF) desde el original el 23 de mayo de 2022.
- ^ Feng J, Sun G, Yan J, Noltner K, Li W, Buzin CH, et al. (julio de 2009). Reif A (ed.). "Evidencia de esquizofrenia cromosómica X asociada con alteraciones de microARN". PLOS ONE . 4 (7): e6121. Bibcode : 2009PLoSO...4.6121F . doi : 10.1371/journal.pone.0006121 . PMC 2699475 . PMID 19568434.
- ^ Beveridge NJ, Gardiner E, Carroll AP, Tooney PA, Cairns MJ (diciembre de 2010). "La esquizofrenia se asocia con un aumento en la biogénesis de microARN cortical". Psiquiatría molecular . 15 (12): 1176–1189. doi : 10.1038/mp.2009.84 . PMC 2990188 . PMID 19721432.
- ^ "Datos sobre el accidente cerebrovascular". Centros para el Control y la Prevención de Enfermedades . 15 de marzo de 2019. Consultado el 5 de diciembre de 2019 .
- ^ Rink C, Khanna S (mayo de 2011). "MicroARN en la etiología y patología del accidente cerebrovascular isquémico". Genómica fisiológica . 43 (10): 521–528. doi :10.1152/physiolgenomics.00158.2010. PMC 3110894 . PMID 20841499.
- ^ Ouyang YB, Stary CM, Yang GY, Giffard R (enero de 2013). "microARN: objetivos innovadores para la isquemia cerebral y el accidente cerebrovascular". Current Drug Targets . 14 (1): 90–101. doi :10.2174/138945013804806424. PMC 3673881 . PMID 23170800.
- ^ abc Lewohl JM, Nunez YO, Dodd PR, Tiwari GR, Harris RA, Mayfield RD (noviembre de 2011). "Regulación positiva de microARN en el cerebro de alcohólicos humanos". Alcoholismo: investigación clínica y experimental . 35 (11): 1928–37. doi :10.1111/j.1530-0277.2011.01544.x. PMC 3170679. PMID 21651580 .
- ^ Tapocik JD, Solomon M, Flanigan M, Meinhardt M, Barbier E, Schank JR, et al. (junio de 2013). "Desregulación coordinada de ARNm y microARN en la corteza prefrontal medial de ratas tras antecedentes de dependencia del alcohol". The Pharmacogenomics Journal . 13 (3): 286–96. doi :10.1038/tpj.2012.17. PMC 3546132 . PMID 22614244.
- ^ Gorini G, Nunez YO, Mayfield RD (2013). "La integración de miRNA y el perfil de proteínas revela neuroadaptaciones coordinadas en el cerebro de ratones dependientes del alcohol". PLOS ONE . 8 (12): e82565. Bibcode :2013PLoSO...882565G. doi : 10.1371/journal.pone.0082565 . PMC 3865091 . PMID 24358208.
- ^ Tapocik JD, Barbier E, Flanigan M, Solomon M, Pincus A, Pilling A, et al. (marzo de 2014). "El microARN-206 en la corteza prefrontal medial de la rata regula la expresión del BDNF y el consumo de alcohol". The Journal of Neuroscience . 34 (13): 4581–8. doi :10.1523/JNEUROSCI.0445-14.2014. PMC 3965783 . PMID 24672003.
- ^ Lippai D, Bala S, Csak T, Kurt-Jones EA, Szabo G (2013). "El microARN-155 inducido por el alcohol crónico contribuye a la neuroinflamación de una manera dependiente de TLR4 en ratones". PLOS ONE . 8 (8): e70945. Bibcode :2013PLoSO...870945L. doi : 10.1371/journal.pone.0070945 . PMC 3739772 . PMID 23951048.
- ^ ab Li J, Li J, Liu X, Qin S, Guan Y, Liu Y, et al. (septiembre de 2013). "El perfil de expresión de microARN y el análisis funcional revelan que miR-382 es un gen nuevo y crítico de la adicción al alcohol". EMBO Molecular Medicine . 5 (9): 1402–14. doi :10.1002/emmm.201201900. PMC 3799494 . PMID 23873704.
- ^ Romao JM, Jin W, Dodson MV, Hausman GJ, Moore SS, Guan LL (septiembre de 2011). "Regulación de microARN en la adipogénesis de mamíferos". Experimental Biology and Medicine . 236 (9): 997–1004. doi :10.1258/ebm.2011.011101. PMID 21844119. S2CID 30646787.
- ^ Skårn M, Namløs HM, Noordhuis P, Wang MY, Meza-Zepeda LA, Myklebost O (abril de 2012). "La diferenciación de adipocitos de células estromales derivadas de médula ósea humana está modulada por microRNA-155, microRNA-221 y microRNA-222". Células madre y desarrollo . 21 (6): 873–83. doi :10.1089/scd.2010.0503. hdl : 10852/40423 . PMID 21756067.
- ^ Zuo Y, Qiang L, Farmer SR (marzo de 2006). "La activación de la expresión de la proteína de unión a CCAAT/enhancer (C/EBP) alfa por C/EBP beta durante la adipogénesis requiere una represión asociada al receptor gamma activado por el proliferador de peroxisomas de HDAC1 en el promotor del gen C/ebp alfa". The Journal of Biological Chemistry . 281 (12): 7960–7. doi : 10.1074/jbc.M510682200 . PMID 16431920.
- ^ Jun-Hao ET, Gupta RR, Shyh-Chang N (marzo de 2016). "Lin28 y let-7 en la fisiología metabólica del envejecimiento". Tendencias en endocrinología y metabolismo . 27 (3): 132–141. doi :10.1016/j.tem.2015.12.006. PMID 26811207. S2CID 3614126.
- ^ Zhu H, Shyh-Chang N, Segrè AV, Shinoda G, Shah SP, Einhorn WS, et al. (septiembre de 2011). "El eje Lin28/let-7 regula el metabolismo de la glucosa". Cell . 147 (1): 81–94. doi :10.1016/j.cell.2011.08.033. PMC 3353524 . PMID 21962509.
- ^ Frost RJ, Olson EN (diciembre de 2011). "Control de la homeostasis de la glucosa y la sensibilidad a la insulina por la familia Let-7 de microARN". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 108 (52): 21075–80. Bibcode :2011PNAS..10821075F. doi : 10.1073/pnas.1118922109 . PMC 3248488 . PMID 22160727.
- ^ Teruel-Montoya R, Rosendaal FR, Martínez C (febrero de 2015). "MicroARN en hemostasia". Revista de Trombosis y Hemostasia . 13 (2): 170–181. doi : 10.1111/jth.12788 . PMID 25400249.
- ^ ab Nourse J, Braun J, Lackner K, Hüttelmaier S, Danckwardt S (noviembre de 2018). "La identificación a gran escala de la orientación funcional de microARN revela una regulación cooperativa del sistema hemostático". Journal of Thrombosis and Haemostasis . 16 (11): 2233–2245. doi : 10.1111/jth.14290 . PMID 30207063.
- ^ Nourse J, Danckwardt S (febrero de 2021). "Una nueva justificación para la focalización del FXI: perspectivas del targetoma de microARN hemostático para estrategias anticoagulantes emergentes". Farmacología y terapéutica . 218 : 107676. doi : 10.1016/j.pharmthera.2020.107676 . PMID 32898547.
- ^ Berardi E, Pues M, Thorrez L, Sampaolesi M (octubre de 2012). "miRNAs en la diferenciación de ESC". Revista estadounidense de fisiología. Fisiología cardíaca y circulatoria . 303 (8): H931–H939. doi :10.1152/ajpheart.00338.2012. PMID 22886416. S2CID 6402014.
- ^ ab Borchers A, Pieler T (noviembre de 2010). "Programación de células precursoras pluripotentes derivadas de embriones de Xenopus para generar tejidos y órganos específicos". Genes . 1 (3): 413–426. doi : 10.3390/ijms232314755 . PMC 9740008 . PMID 36499082.
- ^ Curaba J, Spriggs A, Taylor J, Li Z, Helliwell C (julio de 2012). "Regulación de miRNA en el desarrollo temprano de la semilla de cebada". BMC Plant Biology . 12 (1): 120. doi : 10.1186/1471-2229-12-120 . PMC 3443071 . PMID 22838835.
- ^ Choudhary A, Kumar A, Kaur H, Kaur N (mayo de 2021). "MiRNA: el capataz del mundo vegetal". Biologia . 76 (5): 1551–1567. Bibcode :2021Biolg..76.1551C. doi :10.1007/s11756-021-00720-1. ISSN 1336-9563. S2CID 233685660.
- ^ Waheed S, Zeng L (marzo de 2020). "El papel fundamental de los microARN en la regulación del tiempo de floración y el desarrollo de las flores". Genes . 11 (3): 319. doi : 10.3390/genes11030319 . PMC 7140873 . PMID 32192095.
- ^ Wong CE, Zhao YT, Wang XJ, Croft L, Wang ZH, Haerizadeh F, et al. (mayo de 2011). "MicroARN en el meristemo apical del brote de soja". Journal of Experimental Botany . 62 (8): 2495–2506. doi :10.1093/jxb/erq437. hdl : 10536/DRO/DU:30106047 . PMID 21504877.
- ^ Qureshi A, Thakur N, Monga I, Thakur A, Kumar M (1 de enero de 2014). "VIRmiRNA: un recurso completo para los miRNA virales validados experimentalmente y sus objetivos". Base de datos . 2014 : bau103. doi :10.1093/database/bau103. PMC 4224276 . PMID 25380780.
- ^ Kumar M. "VIRmiRNA". Recurso para miRNA virales experimentales y sus objetivos . Centro de bioinformática, CSIR-IMTECH.
- ^ Tuddenham L, Jung JS, Chane-Woon-Ming B, Dölken L, Pfeffer S (febrero de 2012). "La secuenciación profunda de ARN pequeño identifica microARN y otros ARN pequeños no codificantes del virus del herpes humano 6B". Journal of Virology . 86 (3): 1638–49. doi :10.1128/JVI.05911-11. PMC 3264354 . PMID 22114334.
- ^ Zheng H, Fu R, Wang JT, Liu Q, Chen H, Jiang SW (abril de 2013). "Avances en las técnicas para la predicción de dianas de microARN". Revista internacional de ciencias moleculares . 14 (4): 8179–87. doi : 10.3390/ijms14048179 . PMC 3645737 . PMID 23591837.
- ^ Agarwal V, Bell GW, Nam JW, Bartel DP (agosto de 2015). "Predicción de sitios diana de microARN eficaces en ARNm de mamíferos". eLife . 4 : e05005. doi : 10.7554/eLife.05005 . PMC 4532895 . PMID 26267216.
Lectura adicional
- Definición y clasificación de microARN: Ambros V, Bartel B, Bartel DP, Burge CB, Carrington JC, Chen X, et al. (marzo de 2003). "Un sistema uniforme para la anotación de microARN". ARN . 9 (3): 277–9. doi :10.1261/rna.2183803. PMC 1370393 . PMID 12592000.
- Revisión científica de ARN pequeño: Baulcombe D (septiembre de 2002). "Eventos de ADN. Un microcosmos de ARN". Science . 297 (5589): 2002–3. doi :10.1126/science.1077906. PMID 12242426. S2CID 82531727.
- Descubrimiento de lin-4 , el primer miRNA descubierto: Lee RC, Feinbaum RL, Ambros V (diciembre de 1993). "El gen heterocrónico lin-4 de C. elegans codifica ARN pequeños con complementariedad antisentido con lin-14". Cell . 75 (5): 843–54. doi : 10.1016/0092-8674(93)90529-Y . PMID 8252621.
Enlaces externos
- La base de datos miRBase
- miRTarBase, la base de datos de interacciones microARN-objetivo validada experimentalmente.
- semirna, Aplicación web para buscar microRNAs en el genoma de una planta.
- ONCO.IO: Recurso integrador para el análisis de microARN y factores de transcripción en cáncer.
- MirOB Archivado el 4 de marzo de 2014 en Wayback Machine : Base de datos de objetivos de microARN y herramienta de análisis de datos y visualización de datos.
- Base de datos ChIPBase: una base de datos de acceso abierto para decodificar los factores de transcripción que estuvieron involucrados o afectaron la transcripción de microARN a partir de datos de ChIP-seq.
- Un vídeo animado del proceso de biogénesis de microARN.
- Reactivos de modulación de miRNA para permitir la regulación positiva o la supresión de la función de microRNA maduro endógeno


