Amida de litio
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Amida de litio | |
| Otros nombres Azanuro de litio Litamida | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.029.062 |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| Níquel de litio 2 | |
| Masa molar | 22,96 g·mol −1 |
| Apariencia | sólido blanco |
| Densidad | 1,178 g/ cm3 |
| Punto de fusión | 375 °C (707 °F; 648 K) |
| Punto de ebullición | 430 °C (806 °F; 703 K) se descompone |
| reacciona | |
| Solubilidad | ligeramente soluble en etanol insoluble en amoniaco |
| Termoquímica | |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | -182 kJ/mol |
| Peligros | |
| NFPA 704 (rombo cortafuegos) | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
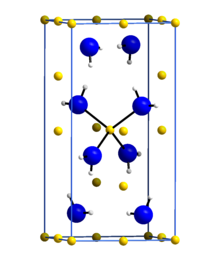
La amida de litio o azanida de litio es un compuesto inorgánico con la fórmula química LiNH 2 . Es un sólido blanco con una estructura cristalina tetragonal. [1] La amida de litio se puede obtener tratando el metal litio con amoníaco líquido : [2]
- 2 Li + 2 NH 3 → 2 LiNH 2 + H 2
La amida de litio se descompone en amoníaco e imida de litio al calentarse. [3]
Aplicaciones
La amida de litio, cuando se mezcla con hidruro de litio , muestra aplicaciones en el almacenamiento de hidrógeno . [4] [3] La reacción comienza con la descomposición de la amida de litio en amoníaco e imida de litio . Luego, el hidruro de litio desprotona el amoníaco para formar amida de litio. La reacción inversa puede ocurrir entre el hidrógeno y el producto secundario imida de litio.
Otras amidas de litio
Las bases conjugadas de las aminas se conocen como amidas. Por lo tanto, una amida de litio también puede referirse a cualquier compuesto de la clase de la sal de litio de una amina . Estos compuestos tienen la forma general LiNR 2 , con la propia amida de litio química como estructura madre . Las amidas de litio comunes incluyen diisopropilamida de litio (LDA), tetrametilpiperidina de litio (LiTMP) y hexametildisilazida de litio (LiHMDS). Se producen por la reacción del metal Li con la amina apropiada:
- 2 Li + 2 R 2 NH → 2 LiNR 2 + H 2
Las amidas de litio son compuestos muy reactivos. En concreto, son bases fuertes .
Ejemplos
El tetrametilpiperiduro de litio se ha cristalizado como un tetrámero. [5] Por otro lado, el derivado de litio de la bis(1-feniletil)amina cristaliza como un trímero: [6]
 |  |
También es posible formar oligómeros mixtos de alcóxidos metálicos y amidas. [7] Estos están relacionados con las superbases , que son mezclas de alcóxidos metálicos y alquilos. Los oligómeros cíclicos se forman cuando el nitrógeno de la amida forma un enlace sigma con un litio, mientras que el par solitario de nitrógeno se une a otro centro metálico.
En general, se considera que otros compuestos de organolitio (como BuLi ) existen y funcionan a través de especies agregadas de alto orden.
Véase también
Referencias
- ^ David, William IF; Jones, Martin O.; Gregory, Duncan H.; Jewell, Catherine M.; Johnson, Simon R.; Walton, Allan; Edwards, Peter P. (1 de febrero de 2007). "Un mecanismo para la no estequiometría en la reacción de almacenamiento de hidrógeno de amida de litio/imida de litio". Revista de la Sociedad Química Americana . 129 (6): 1594–1601. doi :10.1021/ja066016s. ISSN 0002-7863. PMID 17243680.
- ^ PW Schenk (1963). "Amiduro de litio". En G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2.ª ed . Vol. 1. Nueva York, NY: Academic Press. pág. 454.
- ^ ab Pinkerton, FE (1 de septiembre de 2005). "Cinética de descomposición de amida de litio para materiales de almacenamiento de hidrógeno". Journal of Alloys and Compounds . 400 (1): 76–82. doi :10.1016/j.jallcom.2005.01.059. ISSN 0925-8388.
- ^ Ichikawa, Takayuki; Hanada, Nobuko; Isobe, Shigehito; Leng, Haiyan; Fujii, Hironobu (1 de junio de 2004). "Mecanismo de una nueva reacción de LiNH2 y LiH a Li2NH y H2 como un prometedor sistema de almacenamiento de hidrógeno". The Journal of Physical Chemistry B . 108 (23): 7887–7892. doi :10.1021/jp049968y. ISSN 1520-6106.
- ^ MF Lappert; MJ Slade; A. Singh; JL Atwood; RD Rogers; R. Shakir (1983). "Estructura y reactividad de amidas de litio impedidas estéricamente y sus eteratos dietílicos: estructuras cristalinas y moleculares de [Li{N(SiMe3 ) 2 } (OEt2 ) ] 2 y tetrakis(2,2,6,6-tetrametilpiperidinatolitio)". Revista de la Sociedad Química Americana . 105 (2): 302–304. doi :10.1021/ja00340a031.
- ^ DR Armstrong; KW Henderson; AR Kennedy; WJ Kerr; FS Mair; JH Moir; PH Moran; R. Snaith (1999). "Estudios estructurales de las amidas de litio quirales [{PhC(H)Me} 2 NLi] y [PhCH 2 {PhC(H)Me}NLi·THF] derivadas de α-metilbencilamina". Dalton Transactions : 4063–4068. doi :10.1039/A904725E.
- ^ KW Henderson, DS Walther y PG Williard (1995). "Identificación de un complejo unimetálico de bases mediante espectroscopia de RMN de 6 Li y análisis de monocristales". Revista de la Sociedad Química Estadounidense . 117 (33): 8680–8681. doi :10.1021/ja00138a030.
- Índice Merck , 11.a edición, 5398 .



