Respuesta hemodinámica
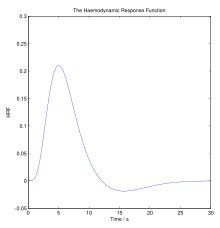
En hemodinámica , el cuerpo debe responder a las actividades físicas, la temperatura externa y otros factores ajustando homeostáticamente su flujo sanguíneo para entregar nutrientes como oxígeno y glucosa a los tejidos estresados y permitirles funcionar. La respuesta hemodinámica ( HR ) permite el rápido suministro de sangre a los tejidos neuronales activos . El cerebro consume grandes cantidades de energía pero no tiene un reservorio de sustratos energéticos almacenados. Dado que los procesos superiores en el cerebro ocurren casi constantemente, el flujo sanguíneo cerebral es esencial para el mantenimiento de las neuronas , los astrocitos y otras células del cerebro. Este acoplamiento entre la actividad neuronal y el flujo sanguíneo también se conoce como acoplamiento neurovascular . [1]
Descripción general de la anatomía vascular
Para entender cómo se lleva la sangre a los tejidos craneales, es importante entender la anatomía vascular del espacio en sí. Las grandes arterias cerebrales del cerebro se dividen en arteriolas más pequeñas , también conocidas como arterias piales. Estas están formadas por células endoteliales y células musculares lisas , y a medida que estas arterias piales se ramifican y se adentran más en el cerebro, se asocian con células gliales, es decir, astrocitos. Las arteriolas y capilares intracerebrales son diferentes a las arteriolas y capilares sistémicos en el sentido de que no permiten fácilmente que las sustancias se difundan a través de ellos; están conectados por uniones estrechas para formar la barrera hematoencefálica (BHE). Las células endoteliales, el músculo liso, las neuronas, los astrocitos y los pericitos trabajan juntos en el cerebro para mantener la BHE mientras siguen suministrando nutrientes a los tejidos y ajustando el flujo sanguíneo en el espacio intracraneal para mantener la homeostasis . Como funcionan como una unidad neurovascular funcional , las alteraciones en sus interacciones a nivel celular pueden perjudicar la frecuencia cardíaca en el cerebro y provocar desviaciones en la función nerviosa normal. [2]
Mecanismos
En la HR intervienen diversos tipos de células, entre ellas los astrocitos, las células musculares lisas, las células endoteliales de los vasos sanguíneos y los pericitos. Estas células controlan si los vasos se contraen o se dilatan, lo que determina la cantidad de oxígeno y glucosa que puede llegar al tejido neuronal.

Astrocitos
Los astrocitos son únicos porque son intermediarios que se encuentran entre los vasos sanguíneos y las neuronas. Pueden comunicarse con otros astrocitos a través de uniones comunicantes y tienen procesos terminales que interactúan con las sinapsis neuronales . Estos procesos tienen la capacidad de absorber varios neurotransmisores , como la noradrenalina (NE) y el glutamato , y realizan varias otras funciones para mantener la homeostasis química y eléctrica en el entorno neuronal.
Se ha demostrado in vitro que se produce constricción cuando la NE se coloca en la sinapsis y es captada por los receptores de los astrocitos. La captación de NE conduce a un aumento del Ca 2+ intracelular de los astrocitos . Cuando estas ondas de iones de calcio se propagan a lo largo del astrocito, se activa la fosfolipasa A (PLA 2 ), que a su vez moviliza el ácido araquidónico . Estos dos compuestos se transportan al músculo liso y allí reaccionan con el citocromo P450 para producir ácido 20-hidroxieicosatetraenoico (20-HETE), que actúa a través de mecanismos aún por determinar para inducir la vasoconstricción. También se ha demostrado que los agonistas de los receptores metabotrópicos de glutamato (mGluR) también aumentan el Ca 2+ intracelular para producir constricción. [4]
Músculo liso
La dilatación ocurre cuando el óxido nítrico (NO) se libera de las células endoteliales y se difunde hacia el músculo liso vascular cercano. Se han propuesto varias vías de vasodilatación inducida por NO a través de la investigación hemodinámica. Se ha demostrado que el NO inhibe la síntesis de 20-HETE, lo que puede interferir con las vías de constricción de los astrocitos y conducir a la vasodilatación. También se ha propuesto que el NO puede amplificar la afluencia de Ca 2+ de los astrocitos y activar los canales de potasio dependientes de Ca 2+ , liberando K + en el espacio intersticial e induciendo la hiperpolarización de las células del músculo liso. [4] Además de esto, ya se ha demostrado que el NO estimula el aumento de los niveles de GMP cíclico (cGMP) en las células del músculo liso, induciendo una cascada de señalización que da como resultado la activación de la proteína quinasa dependiente de cGMP (PKG) y una disminución final en la concentración de Ca 2+ del músculo liso . [5] Esto conduce a una disminución de la contracción muscular y una dilatación posterior del vaso sanguíneo. El hecho de que los vasos estén constreñidos o dilatados determina la cantidad de oxígeno y glucosa que puede llegar al tejido neuronal.
Pericitos
Una de las principales funciones de los pericitos es interactuar con los astrocitos, las células musculares lisas y otras células intracraneales para formar la barrera hematoencefálica y modular el tamaño de los vasos sanguíneos para garantizar la correcta llegada y distribución de oxígeno y nutrientes a los tejidos neuronales. Los pericitos tienen receptores colinérgicos (α2) y adrenérgicos (β2). La estimulación de estos últimos conduce a la relajación de los vasos, mientras que la estimulación de los receptores colinérgicos conduce a la contracción.
Se ha demostrado que la actividad paracrina y la disponibilidad de oxígeno también modulan la actividad de los pericitos. Los péptidos angiotensina II y endotelina-1 (ET-1) se unen a los pericitos y son vasoactivos. Las células endoteliales inducen la expresión de endotelina-1, que conduce a la producción de NO y vasodilatación. Los experimentos han demostrado que los niveles de oxígeno también alteran la contracción de los pericitos y la contracción posterior de los vasos sanguíneos. In vitro, las altas concentraciones de oxígeno causan constricción de los pericitos, mientras que las altas concentraciones de CO2 causan relajación. Esto sugiere que los pericitos pueden tener la capacidad de dilatar los vasos sanguíneos cuando hay demanda de oxígeno y contraerlos cuando hay exceso, modificando la tasa de flujo sanguíneo a los tejidos en función de su actividad metabólica. [6]
Complicaciones
La respuesta hemodinámica es el suministro rápido de sangre al tejido neuronal activo. Las complicaciones de esta respuesta surgen en los síndromes coronarios agudos y la hipertensión arterial pulmonar . Estas complicaciones conducen a un cambio en la regulación del flujo sanguíneo al cerebro y, a su vez, en la cantidad de glucosa y oxígeno que se suministra a las neuronas, lo que puede tener efectos graves no solo en el funcionamiento del sistema nervioso, sino en el funcionamiento de todos los sistemas corporales. [7]
Síndrome coronario agudo
Las infecciones agudas, como la neumonía adquirida en la comunidad (NAC), actúan como desencadenantes de los síndromes coronarios agudos (SCA). El SCA se trata de síntomas que resultan de la obstrucción de las arterias coronarias . Debido a esta obstrucción, hay complicaciones trombóticas en los sitios de las placas ateroscleróticas . El síntoma más común que impulsa el diagnóstico es el dolor torácico, asociado con náuseas y sudoración. El tratamiento suele incluir aspirina , clopidogrel , nitroglicerina y, si el dolor torácico persiste, morfina . Un estudio reciente sugiere que la infección aguda del tracto respiratorio puede actuar como desencadenante del SCA. Esto a su vez tiene importantes efectos protrombóticos y hemodinámicos. [7]
Estos efectos son el resultado de la coagulación , que normalmente se previene en el endotelio vascular mediante la expresión de factores antitrombóticos en su superficie. La sepsis , que causa la alteración y la apoptosis de las células endoteliales, hace que el endotelio cambie a un fenotipo procoagulante. Esto promueve la adhesión y agregación plaquetaria. Además, solo una vez que se ha producido la alteración de la superficie de la placa es probable que estos efectos protrombóticos sean significativos en la patogenia del SCA. La sepsis también se asocia en gran medida con cambios hemodinámicos. La presión de perfusión de la arteria coronaria se reduce en la vasodilatación periférica, lo que produce una reducción de la presión arterial y una reducción de la contractilidad miocárdica. La disfunción endotelial induce vasoconstricción coronaria. Esto es causado por la liberación de catecolaminas y por infecciones. Las infecciones graves conducen a un aumento de las demandas metabólicas del miocardio y a la hipoxia . Cuando el tejido neuronal se ve privado de oxígeno adecuado, la respuesta hemodinámica tiene menos efecto en el tejido neuronal activo. Todas estas alteraciones aumentan la probabilidad de sufrir un SCA, debido a la rotura de la placa coronaria y la trombosis. En general, el SCA es consecuencia del daño que la aterosclerosis provoca en las coronarias, por lo que la prevención primaria del SCA consiste en prevenir la aterosclerosis controlando los factores de riesgo, lo que incluye una alimentación saludable, hacer ejercicio regularmente y controlar los niveles de colesterol. [7]
Hipertensión arterial pulmonar
La hipertensión pulmonar (HAP) es una enfermedad de las arterias pulmonares pequeñas que suele estar causada por más de un mecanismo. Esto incluye neumonía , infecciones parasitarias, drogas callejeras, como la cocaína y las metanfetaminas que causan constricción de los vasos sanguíneos, y muchos más. Los mediadores vasoactivos, como el óxido nítrico y la prostaciclina , junto con la sobreexpresión de vasoconstrictores, no solo afectan el tono vascular sino que también promueven la remodelación vascular. La HAP se ocupa del aumento de la presión arterial en las arterias pulmonares, lo que provoca dificultad para respirar, mareos, desmayos, raramente hemoptisis y muchos otros síntomas. La HAP puede ser una enfermedad grave, que puede provocar una disminución de la tolerancia al ejercicio y, en última instancia, insuficiencia cardíaca. Implica vasoconstricciones de los vasos sanguíneos conectados a los pulmones y dentro de ellos. Como resultado, el corazón tiene dificultades para bombear sangre a través de los pulmones y los vasos sanguíneos finalmente sufren fibrosis . El aumento de la carga de trabajo del corazón provoca hipertrofia del ventrículo derecho, lo que hace que se bombee menos sangre a través de los pulmones y que se reduzca la sangre que llega al lado izquierdo del corazón. Como resultado de todo esto, el lado izquierdo del corazón tiene dificultades para bombear un suministro suficiente de oxígeno al resto del cuerpo, lo que deteriora el efecto de la respuesta hemodinámica. Las respuestas hemodinámicas deterioradas a su vez disminuyen la capacidad de ejercicio en pacientes con HAP. La gravedad de la disfunción hemodinámica durante el ejercicio progresivo en la HAP se puede registrar mediante pruebas de esfuerzo cardiopulmonar (CPET) y/o cardiografía de impedancia (ICG). Además, actualmente no existen curas para la hipertensión arterial pulmonar, pero hay opciones de tratamiento para los pacientes con la enfermedad para ayudar a prolongar su supervivencia y calidad de vida. Algunos de estos tratamientos incluyen terapia básica, bloqueadores de los canales de calcio y terapia con prostaciclina. La terapia básica puede conducir a mejoras clínicas espectaculares en pacientes con insuficiencia cardíaca derecha al instaurar una terapia diurética. Esto reduce la precarga ventricular derecha. Además, los bloqueadores de los canales de calcio en dosis altas en pacientes que responden a este tratamiento pueden prolongar la supervivencia y mejorar la hemodinámica pulmonar. Los bloqueadores de los canales de calcio provocan la regresión de la hipertrofia ventricular derecha. Por otra parte, la terapia con prostaciclina prolonga la supervivencia al inducir la relajación de los músculos lisos vasculares. Esto estimula la producción de AMP cíclico (AMPc), que inhibe el crecimiento de las células del músculo liso. [8]
En general, la hipertensión arterial pulmonar y los síndromes coronarios agudos son algunas de las muchas enfermedades que provocan hipoxia del tejido neuronal, lo que a su vez deteriora la respuesta hemodinámica y conduce a la muerte neuronal. La hipoxia prolongada induce la muerte neuronal por apoptosis. Con una respuesta hemodinámica disfuncional, el tejido neuronal activo, debido a la despolarización de la membrana, carece de la energía necesaria para propagar señales, como resultado de la obstrucción del flujo sanguíneo. Esto afecta a muchas funciones del cuerpo y puede provocar síntomas graves.
Enfermedades con respuesta hemodinámica reducida
Enfermedad de Alzheimer
En esta enfermedad, se produce una acumulación de la proteína beta amiloide en el cerebro, lo que en última instancia conduce a una reducción de la respuesta hemodinámica y a un menor flujo sanguíneo en el cerebro. Este flujo sanguíneo cerebral reducido no solo mata las células neuronales debido a la escasez de oxígeno y glucosa, sino que también reduce la capacidad del cerebro para eliminar la beta amiloide. En un cerebro sano, estos fragmentos de proteína se descomponen y se eliminan. En la enfermedad de Alzheimer, los fragmentos se acumulan para formar placas duras e insolubles que reducen el flujo sanguíneo. Dos proteínas están involucradas en esta acumulación de beta amiloide: el factor de respuesta sérica o SRF y la miocardina [9] . Juntas, estas dos proteínas determinan si el músculo liso de los vasos sanguíneos se contrae. El SRF y la miocardina son más activos en los cerebros de las personas con enfermedad de Alzheimer. Cuando estas proteínas están activas, activan SREBP2, que inhibe LRP-1. LRP-1 ayuda al cerebro a eliminar la beta amiloide. Por lo tanto, cuando el SRF y la miocardina están activos, hay una acumulación de proteína beta amiloide que en última instancia conduce a un menor flujo sanguíneo en el cerebro debido a la contracción de los vasos sanguíneos. [10]
Isquemia
Una disminución en la circulación en la vasculatura cerebral debido a un accidente cerebrovascular o una lesión puede conducir a una condición conocida como isquemia . En general, la disminución del flujo sanguíneo al cerebro puede ser el resultado de una trombosis que causa un bloqueo parcial o total de los vasos sanguíneos, hipotensión en la circulación sistémica (y en consecuencia, el cerebro) o paro cardíaco. Esta disminución en el flujo sanguíneo en el sistema vascular cerebral puede resultar en una acumulación de desechos metabólicos generados por las neuronas y las células gliales y una disminución en el suministro de oxígeno y glucosa a ellas. Como resultado, puede ocurrir una falla energética celular, despolarización de las membranas neuronales y gliales, edema y liberación excesiva de neurotransmisores e iones de calcio. [11] Esto finalmente termina con la muerte celular, ya que las células sucumben a la falta de nutrientes para impulsar su metabolismo y a un entorno cerebral tóxico, lleno de radicales libres y exceso de iones que dañan la función normal de los orgánulos celulares.
Uso clínico
Los cambios en la actividad cerebral están estrechamente relacionados con los cambios en el flujo sanguíneo en esas áreas, y conocer esto ha resultado útil para mapear las funciones cerebrales en humanos. La medición de la respuesta hemodinámica, en un entorno clínico, se puede utilizar para crear imágenes del cerebro en las que las regiones especialmente activas e inactivas se muestran como distintas unas de otras. Esto puede ser una herramienta útil para diagnosticar enfermedades neuronales o para la planificación prequirúrgica. La resonancia magnética funcional y la tomografía por emisión de positrones son las técnicas más comunes que utilizan la respuesta hemodinámica para mapear la función cerebral. Los médicos utilizan estas técnicas de diagnóstico por imágenes para examinar la anatomía del cerebro, para determinar qué partes específicas del cerebro están manejando ciertas funciones de orden superior, para evaluar los efectos de las enfermedades degenerativas e incluso para planificar tratamientos quirúrgicos del cerebro.
Resonancia magnética funcional
La resonancia magnética funcional (fMRI) es la técnica de imagen médica que se utiliza para medir la respuesta hemodinámica del cerebro en relación con las actividades neuronales. [12] Es uno de los dispositivos más utilizados para medir las funciones cerebrales y es relativamente económico de realizar en un entorno clínico. El inicio de la actividad neuronal conduce a una serie sistemática de cambios fisiológicos en la red local de vasos sanguíneos que incluyen cambios en el volumen sanguíneo cerebral por unidad de tejido cerebral (CBV), cambios en la tasa de flujo sanguíneo cerebral y cambios en la concentración de oxihemoglobina y desoxihemoglobina. Existen diferentes técnicas de fMRI que pueden captar una señal funcional correspondiente a los cambios en cada uno de los componentes mencionados anteriormente de la respuesta hemodinámica. La señal de imagen funcional más común es la señal dependiente del nivel de oxígeno en sangre (BOLD), que corresponde principalmente a la concentración de desoxihemoglobina. [13] El efecto BOLD se basa en el hecho de que cuando aumenta la actividad neuronal en una parte del cerebro, también hay un aumento en la cantidad de flujo sanguíneo cerebral a esa área que es la base de la respuesta hemodinámica. Este aumento del flujo sanguíneo produce un aumento de la proporción de hemoglobina oxigenada en relación con la hemoglobina desoxigenada en esa zona específica. La diferencia en las propiedades magnéticas de la hemoglobina oxigenada y desoxigenada es lo que permite que las imágenes fMRI produzcan un mapa eficaz de qué neuronas están activas y cuáles no. En resumen, la hemoglobina desoxigenada es paramagnética mientras que la hemoglobina oxigenada es diamagnética . La sangre diamagnética ( oxihemoglobina ) interfiere menos con la señal de resonancia magnética (RM) y esto conduce a una señal de RM mejorada en esa zona de mayor actividad neuronal. Sin embargo, la sangre paramagnética (desoxihemoglobina) hace que el campo magnético local sea no homogéneo. Esto tiene el efecto de desfasar la señal emitida en este dominio, causando una interferencia destructiva en la señal de RM observada. Por lo tanto, mayores cantidades de desoxihemoglobina conducen a una menor señal. La actividad neuronal en última instancia conduce a un aumento en la señalización local de RM correspondiente a una disminución en la concentración de desoxihemoglobina. [14]

Si la fMRI puede utilizarse para detectar el flujo sanguíneo regular en un cerebro sano, también puede utilizarse para detectar los problemas de un cerebro que ha sufrido enfermedades degenerativas. La fMRI, que utiliza la respuesta hemodinámica, puede ayudar a evaluar los efectos de un accidente cerebrovascular y otras enfermedades degenerativas como la enfermedad de Alzheimer en la función cerebral. Otra forma en que la fMRI podría utilizarse es en la planificación de la cirugía del cerebro. Los cirujanos pueden utilizar la fMRI para detectar el flujo sanguíneo de las áreas más activas del cerebro y las áreas involucradas en funciones críticas como el pensamiento, el habla, el movimiento, etc. De esta manera, los procedimientos cerebrales son menos peligrosos porque hay un mapa cerebral que muestra qué áreas son vitales para la vida de una persona. La respuesta hemodinámica es vital para la fMRI y el uso clínico porque a través del estudio del flujo sanguíneo podemos examinar la anatomía del cerebro y planificar eficazmente los procedimientos del cerebro y relacionar las causas de la enfermedad cerebral degenerativa. [15]
La fMRI en estado de reposo permite evaluar la interacción de las regiones cerebrales cuando no se realiza una tarea específica. [16] Esto también se utiliza para mostrar la red en modo predeterminado .
Tomografía por emisión de positrones (PET)
La tomografía por emisión de positrones (PET) también se utiliza junto con la fMRI para obtener imágenes cerebrales. La tomografía por emisión de positrones puede detectar áreas cerebrales activas, ya sea hemodinámicamente o metabólicamente a través de la ingesta de glucosa. Permiten observar el flujo sanguíneo o el metabolismo en cualquier parte del cerebro. Las áreas que se activan por el aumento del flujo sanguíneo y/o la ingesta de glucosa se visualizan con una señal aumentada en la imagen PET. [17]
Antes de comenzar una tomografía por emisión de positrones, se inyecta al paciente una pequeña dosis de un medicamento radiactivo asociado a un trazador , como glucosa u oxígeno. Por lo tanto, si el propósito de la tomografía por emisión de positrones es determinar la actividad cerebral, se utilizará FDG o fluorodesoxiglucosa . La FDG es un complejo de flúor radiactivo que está asociado a glucosa. Si una determinada parte del cerebro está más activa, se necesitará más glucosa o energía allí y se absorberá más FDG. Este aumento en la ingesta de glucosa será detectable con un aumento de la señal en la imagen de la tomografía por emisión de positrones. Los escáneres PET proporcionan esta característica porque miden la energía que se emite cuando los positrones del radiotrazador chocan con los electrones en el cerebro. A medida que se descompone un radiotrazador, se generan más positrones y habrá un aumento de la señal en la tomografía por emisión de positrones. [18]
Referencias
- ^ Iadecola, Costantino (2017). "La unidad neurovascular alcanza la madurez: un viaje a través del acoplamiento neurovascular en la salud y la enfermedad". Neuron . 96 (1): 17–42. doi :10.1016/j.neuron.2017.07.030. PMC 5657612 . PMID 28957666.
- ^ Iadecola Constantino (2004). "Regulación neurovascular en el cerebro normal y en la enfermedad de Alzheimer". Nature Reviews Neuroscience . 5 (5): 347–49. doi :10.1038/nrn1387. PMID 15100718. S2CID 36555564.
- ^ Sedwick C (2012). "Poda de la vasculatura cerebral para lograr eficiencia". PLOS Biol . 10 (8): e1001375. doi : 10.1371/journal.pbio.1001375 . PMC 3424260 . PMID 22927793.
- ^ ab Koehler Raymond C (2006). "El papel de los astrocitos en la regulación cerebrovascular". Revista de fisiología aplicada . 100 (1): 307–17. doi :10.1152/japplphysiol.00938.2005. PMC 1819408 . PMID 16357084.
- ^ Grange Robert W.; Isotani Eiji (2000). "El óxido nítrico contribuye a la relajación del músculo liso vascular en músculos de contracción rápida". Genómica fisiológica . 5 (1): 35–44. doi :10.1152/physiolgenomics.2001.5.1.35. PMID 11161004. S2CID 7117482.
- ^ Bergers Gabriele; Song Steven (2005). "El papel de los pericitos en la formación y el mantenimiento de los vasos sanguíneos". Neuro-Oncology . 7 (4): 452–64. doi :10.1215/S1152851705000232. PMC 1871727 . PMID 16212810.
- ^ abc " Bazaz, Rohit; Marriott, Helen M.; Francis, Sheila E.; Dockrell, David H. (2013). "Vínculos mecanicistas entre infecciones agudas del tracto respiratorio y síndromes coronarios agudos". Journal of Infection . 66 (1): 1–17. doi :10.1016/j.jinf.2012.09.009. PMID 23046969.
- ^ Humbert Marc (2004). "Tratamiento de la hipertensión arterial pulmonar". The New England Journal of Medicine . 351 (14): 1425–1436. doi :10.1056/NEJMra040291. PMID 15459304.
- ^ "Flujo sanguíneo en la enfermedad de Alzheimer". ScienceDaily. ScienceDaily, 29 de junio de 2009. Web. 4 de noviembre de 2012. https://www.sciencedaily.com/releases/2009/06/090624211135.htm
- ^ "Doc Blog". Las proteínas del sistema cardiovascular desempeñan un papel en el Alzheimer. Np, nd Web. 4 de noviembre de 2012. http://www.docblog.org/cardiovascular-system-proteins-play-a-role-in-alzheimers.html
- ^ Arcinlegas, David B., MD. "Lesión cerebral hipóxico-isquémica | Internationalbrain.org". Lesión cerebral hipóxico-isquémica | Internationalbrain.org. Asociación Internacional de Lesiones Cerebrales, marzo de 2010. Web. <http://www.internationalbrain.org/?q=node/131>
- ^ Buxton Richard; Uludag Kamil; Liu Thomas (2004). "Modelado de la respuesta hemodinámica a la activación cerebral" (PDF) . NeuroImage . 23 : S220–S233. doi :10.1016/j.neuroimage.2004.07.013. PMID 15501093. S2CID 8736954.
- ^ Barbe, Kurt y Guy Nagels. "Extracción de la respuesta hemodinámica a partir de datos de resonancia magnética funcional". IEEE Xplore. https://ieeexplore.ieee.org/stamp/stamp.jsp?arnumber=06210369, sin fecha en la Web. 3 de noviembre de 2012. <https://ieeexplore.ieee.org/stamp/stamp.jsp?arnumber=06210369>
- ^ Buckner, Randy L. "Event Related FMRI and the Haemodynamic Response" (Radiografía por resonancia magnética funcional relacionada con eventos y respuesta hemodinámica). Human Brain Mapping (Mapeo cerebral humano). Wiley-Liss Inc., 1998. Web. 10 de octubre de 2012
- ^ Attwell, David. "La base neuronal de las señales de imágenes cerebrales funcionales". University College London, nd Web. <http://dx.dio.org/10.1016/s0166-2236(02)02264-6 [ enlace muerto permanente ] >
- ^ Biswal, BB (15 de agosto de 2012). "Resonancia magnética funcional en estado de reposo: una historia personal". NeuroImage . 62 (2): 938–44. doi :10.1016/j.neuroimage.2012.01.090. PMID 22326802. S2CID 93823.
- ^ "Más información sobre las tecnologías de obtención de imágenes cerebrales". Más información sobre las tecnologías de obtención de imágenes cerebrales. Np, nd Web. 3 de noviembre de 2012. <http://learn.genetics.utah.edu/content/addiction/drugs/brainimage.html Archivado el 21 de enero de 2013 en Wayback Machine >
- ^ Shibasaki, Hiroshi. "Mapeo cerebral humano: respuesta hemodinámica y electrofisiología". Elsevier. Sin fecha, sin fecha. Web. <http://moodle.technion.ac.il/pluginfile.php/195507/mod_resource/content/0/week1/FunctionalBrainImaging.pdf>
Enlaces externos
- Una animación del acoplamiento neurovascular.