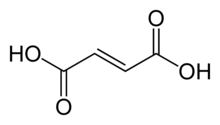
Ácido fumárico
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Ácido (2 E )-but-2-enedioico | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 605763 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos | |
| Tarjeta informativa de la ECHA | 100.003.404 |
| Número CE |
|
| Número E | E297 (conservantes) |
| 49855 | |
| BARRIL | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 9126 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C4H4O4 | |
| Masa molar | 116,072 g·mol −1 |
| Apariencia | Sólido blanco |
| Densidad | 1,635 g/ cm3 |
| Punto de fusión | 287 °C (549 °F; 560 K) (se descompone) [2] |
| 6,3 g/L a 25 °C [1] | |
| Acidez (p K a ) | p k a1 = 3,03 , p k a2 = 4,44 (15 °C, isómero cis) |
| −49,11·10 −6 cm3 / mol | |
| distinto de cero | |
| Farmacología | |
| D05AX01 ( OMS ) | |
| Peligros | |
| Etiquetado SGA : | |
 | |
| Advertencia | |
| H319 | |
| P264 , P280 , P305+P351+P338 , P313 | |
| NFPA 704 (rombo cortafuegos) | |
| 375 °C (707 °F; 648 K) | |
| Compuestos relacionados | |
Ácidos carboxílicos relacionados | |
Compuestos relacionados |
|
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El ácido fumárico o ácido trans -butenedioico es un compuesto orgánico con la fórmula HO 2 CCH=CHCO 2 H. El ácido fumárico es un sólido blanco que se encuentra ampliamente en la naturaleza. Tiene un sabor parecido al de la fruta y se ha utilizado como aditivo alimentario . Su número E es E297. [3] Las sales y ésteres se conocen como fumaratos . El fumarato también puede referirse al C
4yo
2Oh2−
4ion (en solución). El ácido fumárico es el isómero trans del ácido butenedioico, mientras que el ácido maleico es el isómero cis .
Biosíntesis y ocurrencia
Se produce en organismos eucariotas a partir del succinato en el complejo 2 de la cadena de transporte de electrones a través de la enzima succinato deshidrogenasa .
El ácido fumárico se encuentra en la fumaria ( Fumaria officinalis ), los hongos boletus (específicamente Boletus fomentarius var. pseudo-igniarius ), el liquen y el musgo de Islandia .
El fumarato es un intermediario del ciclo del ácido cítrico que utilizan las células para producir energía en forma de trifosfato de adenosina (ATP) a partir de los alimentos . Se forma por la oxidación del succinato por la enzima succinato deshidrogenasa . Luego, la enzima fumarasa convierte el fumarato en malato .
La piel humana produce naturalmente ácido fumárico cuando se expone a la luz solar . [4] [5]
El fumarato también es un producto del ciclo de la urea .
Haga clic en los genes, proteínas y metabolitos que aparecen a continuación para acceder a los artículos correspondientes. [§ 1]
- ^ El mapa interactivo de la ruta se puede editar en WikiPathways: "TCACycle_WP78".
Usos
Alimento
El ácido fumárico se ha utilizado como acidulante alimentario desde 1946. Está aprobado para su uso como aditivo alimentario en la UE, [6] EE. UU. [7] y Australia y Nueva Zelanda. [8] Como aditivo alimentario , se utiliza como regulador de la acidez y puede denotarse con el número E E297. Generalmente se utiliza en bebidas y polvos para hornear para los que se imponen requisitos de pureza. El ácido fumárico se utiliza en la elaboración de tortillas de trigo como conservante de alimentos y como ácido en la levadura. [9] Generalmente se utiliza como sustituto del ácido tartárico y ocasionalmente en lugar del ácido cítrico , a una tasa de 1 g de ácido fumárico por cada ~1,5 g de ácido cítrico, para agregar acidez , de manera similar a la forma en que se utiliza el ácido málico . Además de ser un componente de algunos sabores artificiales de vinagre, como las papas fritas con sabor a "sal y vinagre", [10] también se utiliza como coagulante en mezclas para pudines para estufa.
El Comité Científico de Nutrición Animal de la Comisión Europea, parte de la DG Salud , concluyó en 2014 que el ácido fumárico es "prácticamente no tóxico", pero que dosis altas son probablemente nefrotóxicas después de un uso prolongado. [11]
Medicamento
El ácido fumárico se desarrolló como medicamento para tratar la psoriasis, una enfermedad autoinmune, en la década de 1950 en Alemania, en forma de comprimidos que contenían tres ésteres , principalmente dimetilfumarato , y Biogen Idec lo comercializó en Europa con el nombre de Fumaderm . Posteriormente, Biogen desarrollaría el éster principal, dimetilfumarato, como tratamiento para la esclerosis múltiple .
En pacientes con esclerosis múltiple recurrente-remitente, el éster dimetilfumarato (BG-12, Biogen) redujo significativamente la recaída y la progresión de la discapacidad en un ensayo de fase 3. Activa la vía de respuesta antioxidante Nrf2 , la principal defensa celular contra los efectos citotóxicos del estrés oxidativo. [12]
Otros usos
El ácido fumárico se utiliza en la fabricación de resinas de poliéster y alcoholes polihídricos y como mordiente para tintes.
Cuando se añade ácido fumárico a su alimentación, los corderos producen hasta un 70% menos de metano durante la digestión. [13]
Síntesis
El ácido fumárico se produce a partir de la isomerización catalítica del ácido maleico en soluciones acuosas a bajo pH . Precipita de la solución de reacción. El ácido maleico está disponible en grandes volúmenes como producto de hidrólisis del anhídrido maleico, producido por oxidación catalítica del benceno o el butano . [3]
Rutas históricas y de laboratorio
El ácido fumárico se preparó por primera vez a partir del ácido succínico . [14] Una síntesis tradicional implica la oxidación del furfural (del procesamiento del maíz ) utilizando clorato en presencia de un catalizador a base de vanadio . [15]
Reacciones
Las propiedades químicas del ácido fumárico se pueden anticipar a partir de sus grupos funcionales componentes . Este ácido débil forma un diéster , sufre bromación a través del doble enlace , [16] y es un buen dienófilo .
Seguridad
La DL50 oral es de 10 g/kg. [3]
Véase también
- Ciclo del ácido cítrico (ciclo TCA)
- Fumarato reductasa
- Fotosíntesis
- Ácido maleico , el isómero cis del ácido fumárico
- Ácido succínico
Referencias
- ^ Registro en la base de datos de sustancias GESTIS del Instituto de Seguridad y Salud en el Trabajo
- ^ Pubchem. "Ácido fumárico". pubchem.ncbi.nlm.nih.gov .
- ^ abc Lohbeck, Kurt; Haferkorn, Herbert; Fuhrmann, Werner; Fedtke, Norbert (2000). "Ácidos maleico y fumárico". Ullmann's Encyclopedia of Industrial Chemistry . doi :10.1002/14356007.a16_053. ISBN 3-527-30673-0.
- ^ Principios activos utilizados en los cosméticos: Encuesta de seguridad, Consejo de Europa. Comité de expertos en productos cosméticos
- ^ "Alimentos con ácido fumárico" . Consultado el 22 de abril de 2018 .[ enlace muerto permanente ]
- ^ Agencia de Normas Alimentarias del Reino Unido: "Aditivos aprobados actualmente por la UE y sus números E" . Consultado el 27 de octubre de 2011 .
- ^ Administración de Alimentos y Medicamentos de los Estados Unidos: "Listado de la condición de aditivos alimentarios, parte II". Administración de Alimentos y Medicamentos . Consultado el 27 de octubre de 2011 .
- ^ Código de normas alimentarias de Australia y Nueva Zelanda "Norma 1.2.4 - Etiquetado de ingredientes". 8 de septiembre de 2011. Consultado el 27 de octubre de 2011 .
- ^ "Ácido fumárico - The Chemical Company". The Chemical Company . Consultado el 22 de abril de 2018 .
- ^ Come en serio. "La ciencia detrás de las papas fritas con sal y vinagre". www.seriouseats.com .
- ^ Comisión Europea: «Informe de la Comisión Europea del Comité Científico de Nutrición Animal sobre la seguridad del ácido fumárico» (PDF) . Consultado el 7 de marzo de 2014 .
- ^ Gold R.; Kappos L.; Arnold DL; et al. (20 de septiembre de 2012). "Estudio de fase 3 controlado con placebo de BG-12 oral para esclerosis múltiple recurrente". N Engl J Med . 367 (12): 1098–1107. doi : 10.1056/NEJMoa1114287 . PMID 22992073. S2CID 6614191.
- ^ "Los científicos buscan reducir la flatulencia de las vacas". phys.org. 21 de marzo de 2008.
- ^ Volhard, J. "Darstellung von Maleïnsäureanhydrid" Annalen der Chemie 1892 de Justus Liebig, volumen 268, páginas 255-6. doi :10.1002/jlac.18922680108
- ^ Nicholas A. Milas (1931). "Ácido fumárico". Síntesis orgánicas . 11 : 46. doi :10.15227/orgsyn.011.0046.
- ^ Herbert S. Rhinesmith (1938). "Ácido α,β-dibromosuccínico". Síntesis orgánicas . 18 : 17. doi :10.15227/orgsyn.018.0017.
Enlaces externos
- Ficha internacional de seguridad química 1173



