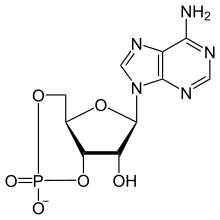
Monofosfato de adenosina cíclico
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Adenosina 3′,5′-(hidrogenofosfato) | |
| Nombre sistemático de la IUPAC (4a R ,6 R ,7 R ,7a S )-6-(6-Amino-9 H -purin-9-il)-2,7-dihidroxitetrahidro-2 H ,4 H -2λ 5 -furo[3,2- d ][1,3,2]dioxafosfinin-2-ona | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos | |
| Tarjeta informativa de la ECHA | 100.000.448 |
| |
| BARRIL | |
| Malla | Cíclico+AMP |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C10H11N5O6P | |
| Masa molar | 329,206 g/mol |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |


El monofosfato de adenosina cíclico ( AMPc , AMP cíclico o monofosfato de adenosina cíclico 3',5' ) es un segundo mensajero , o señal celular que se produce dentro de las células, que es importante en muchos procesos biológicos. El AMPc es un derivado del trifosfato de adenosina (ATP) y se utiliza para la transducción de señales intracelulares en muchos organismos diferentes, transmitiendo la vía dependiente de AMPc .
Historia
Earl Sutherland, de la Universidad de Vanderbilt, ganó el Premio Nobel de Fisiología o Medicina en 1971 "por sus descubrimientos sobre los mecanismos de acción de las hormonas", especialmente la epinefrina, a través de segundos mensajeros (como el monofosfato de adenosina cíclico, AMP cíclico).
Síntesis
El AMP cíclico se sintetiza a partir de ATP por la adenilato ciclasa ubicada en el lado interno de la membrana plasmática y anclada en varias ubicaciones en el interior de la célula. [1] La adenilato ciclasa es activada por una variedad de moléculas de señalización a través de la activación de los receptores acoplados a proteína G ( G s ) estimuladores de la adenilato ciclasa. La adenilato ciclasa es inhibida por agonistas de los receptores acoplados a proteína G ( G i ) inhibidores de la adenilato ciclasa. La adenilato ciclasa hepática responde más fuertemente al glucagón, y la adenilato ciclasa muscular responde más fuertemente a la adrenalina.
La descomposición de AMPc en AMP es catalizada por la enzima fosfodiesterasa .
Funciones
El AMPc es un segundo mensajero que se utiliza para la transducción de señales intracelulares, como la transferencia a las células de los efectos de hormonas como el glucagón y la adrenalina , que no pueden atravesar la membrana plasmática. También participa en la activación de las proteínas quinasas . Además, el AMPc se une a los canales iónicos, como los canales HCN , y a algunas otras proteínas de unión a nucleótidos cíclicos, como Epac1 y RAPGEF2 , y regula su función .
Papel en las células eucariotas
El AMPc está asociado con la función de las quinasas en varios procesos bioquímicos, incluida la regulación del metabolismo del glucógeno , el azúcar y los lípidos . [2]
En los eucariotas, el AMP cíclico funciona activando la proteína quinasa A (PKA, o proteína quinasa dependiente de AMPc ). La PKA normalmente es inactiva como una holoenzima tetramérica , que consta de dos unidades catalíticas y dos unidades reguladoras (C 2 R 2 ), y las unidades reguladoras bloquean los centros catalíticos de las unidades catalíticas.
El AMP cíclico se une a ubicaciones específicas en las unidades reguladoras de la proteína quinasa y provoca la disociación entre las subunidades reguladoras y catalíticas, lo que permite que esas unidades catalíticas fosforilen las proteínas del sustrato.
Las subunidades activas catalizan la transferencia de fosfato desde el ATP a residuos específicos de serina o treonina de sustratos proteicos. Las proteínas fosforiladas pueden actuar directamente sobre los canales iónicos de la célula, o pueden convertirse en enzimas activadas o inhibidas. La proteína quinasa A también puede fosforilar proteínas específicas que se unen a regiones promotoras del ADN, lo que provoca aumentos en la transcripción. No todas las proteínas quinasas responden al AMPc. Varias clases de proteínas quinasas , incluida la proteína quinasa C, no dependen del AMPc.
Otros efectos dependen principalmente de la proteína quinasa dependiente de AMPc , que varía según el tipo de célula.
Aun así, existen algunas funciones menores del AMPc independientes de PKA, por ejemplo, la activación de los canales de calcio , que proporciona una vía menor por la cual la hormona liberadora de la hormona del crecimiento provoca la liberación de la hormona del crecimiento .
Sin embargo, la idea de que la mayoría de los efectos del AMPc están controlados por la PKA es obsoleta. En 1998 se descubrió una familia de proteínas sensibles al AMPc con actividad del factor de intercambio de nucleótidos de guanina (GEF). Estas se denominan proteínas de intercambio activadas por AMPc (Epac) y la familia comprende Epac1 y Epac2 . [3] El mecanismo de activación es similar al de la PKA: el dominio GEF suele estar enmascarado por la región N-terminal que contiene el dominio de unión del AMPc. Cuando el AMPc se une, el dominio se disocia y expone el dominio GEF ahora activo, lo que permite que Epac active pequeñas proteínas GTPasa similares a Ras, como Rap1 .
Función adicional del AMPc secretado en las amebas sociales
En la especie Dictyostelium discoideum , el AMPc actúa fuera de la célula como una señal secretada. La agregación quimiotáctica de las células está organizada por ondas periódicas de AMPc que se propagan entre las células a lo largo de distancias de varios centímetros. Las ondas son el resultado de una producción y secreción regulada de AMPc extracelular y un oscilador biológico espontáneo que inicia las ondas en los centros de los territorios. [4]
Papel en las bacterias
En las bacterias , el nivel de AMPc varía según el medio utilizado para el crecimiento. En particular, el AMPc es bajo cuando la glucosa es la fuente de carbono. Esto ocurre a través de la inhibición de la enzima productora de AMPc, la adenilato ciclasa , como un efecto secundario del transporte de glucosa a la célula. El factor de transcripción proteína receptora de AMPc (CRP), también llamada CAP (proteína activadora del gen del catabolito), forma un complejo con el AMPc y, por lo tanto, se activa para unirse al ADN. La PCR-AMPc aumenta la expresión de una gran cantidad de genes, incluidas algunas enzimas codificantes que pueden suministrar energía independientemente de la glucosa.
El AMPc, por ejemplo, está involucrado en la regulación positiva del operón lac . En un entorno con una baja concentración de glucosa, el AMPc se acumula y se une al sitio alostérico de la PCR ( proteína del receptor de AMPc ), una proteína activadora de la transcripción. La proteína asume su forma activa y se une a un sitio específico aguas arriba del promotor lac, lo que facilita que la ARN polimerasa se una al promotor adyacente para iniciar la transcripción del operón lac, aumentando la tasa de transcripción del operón lac. Con una alta concentración de glucosa, la concentración de AMPc disminuye y la PCR se desvincula del operón lac.
Patología
Dado que el AMP cíclico es un segundo mensajero y desempeña un papel vital en la señalización celular, se lo ha implicado en varios trastornos, pero no se limita a las funciones que se detallan a continuación:
Papel en el carcinoma humano
Algunas investigaciones han sugerido que una desregulación de las vías del AMPc y una activación aberrante de los genes controlados por el AMPc están relacionadas con el crecimiento de algunos cánceres. [5] [6] [7]
Papel en los trastornos de la corteza prefrontal
Investigaciones recientes sugieren que el AMPc afecta la función del pensamiento de orden superior en la corteza prefrontal a través de su regulación de canales iónicos llamados canales regulados por nucleótidos cíclicos activados por hiperpolarización (HCN). Cuando el AMPc estimula el HCN, los canales se abren. Esta investigación, especialmente los déficits cognitivos en enfermedades relacionadas con la edad y el TDAH, es de interés para los investigadores que estudian el cerebro. [8]
El AMPc está involucrado en la activación del sistema trigéminocervical, lo que conduce a la inflamación neurogénica y causa migraña. [9]
Papel en la patogénesis de los agentes de enfermedades infecciosas
Se ha observado que el funcionamiento alterado del AMPc es uno de los mecanismos de varias exotoxinas bacterianas.
Se pueden subagrupar en dos categorías distintas: [10]
- Toxinas que interfieren con las enzimas ADP-ribosil-transferasas y
- adenilato ciclasas invasivas .
Toxinas relacionadas con las ADP-ribosil-transferasas
- La toxina del cólera es una toxina AB que tiene cinco subunidades B y una subunidad A. La toxina actúa mediante el siguiente mecanismo: primero, el anillo de la subunidad B de la toxina del cólera se une a los gangliósidos GM1 en la superficie de las células diana. Si una célula carece de GM1, lo más probable es que la toxina se una a otros tipos de glicanos, como Lewis Y y Lewis X, unidos a proteínas en lugar de lípidos. [11] [12] [13] [10]
Usos
La forskolina se utiliza comúnmente como herramienta en bioquímica para aumentar los niveles de AMPc en el estudio y la investigación de la fisiología celular . [14]
Véase también
- Monofosfato de guanosina cíclico (cGMP)
- Monofosfato cíclico 3',5' de 8-bromoadenosina (8-Br-cAMP)
- Acrasina específica para uso quimiotáctico en Dictyostelium discoideum .
- fosfodiesterasa 4 (PDE 4) que degrada el AMPc
Referencias
- ^ Rahman N, Buck J, Levin LR (noviembre de 2013). "Detección de pH a través de la adenilato ciclasa "soluble" regulada por bicarbonato (sAC)". Front Physiol . 4 : 343. doi : 10.3389/fphys.2013.00343 . PMC 3838963 . PMID 24324443.
- ^ Ali ES, Hua J, Wilson CH, Tallis GA, Zhou FH, Rychkov GY, Barritt GJ (2016). "El análogo del péptido similar al glucagón-1, exendina-4, revierte la señalización intracelular de Ca2+ alterada en hepatocitos esteatósicos". Biochimica et Biophysica Acta (BBA) - Investigación celular molecular . 1863 (9): 2135–46. doi : 10.1016/j.bbamcr.2016.05.006 . PMID 27178543.
- ^ Bos, Johannes L. (diciembre de 2006). "Proteínas Epac: objetivos multipropósito del AMPc". Tendencias en ciencias bioquímicas . 31 (12): 680–686. doi :10.1016/j.tibs.2006.10.002. PMID 17084085.
- ^ Anderson, Peter AV (11 de noviembre de 2013). Evolución de los primeros sistemas nerviosos. Springer Science & Business Media. ISBN 978-1-4899-0921-3.
- ^ Abramovitch, Rinat; Tavor, Einat; Jacob-Hirsch, Jasmine; Zeira, Evelyne; Amariglio, Ninette; Pappo, Orit; Rechavi, Gedeón; Galún, Eithan; Honigman, Alik (15 de febrero de 2004). "Asociación Estadounidense para la Investigación del Cáncer (genes que responden a AMPc y progresión tumoral)". Investigación del cáncer . 64 (4): 1338-1346. doi :10.1158/0008-5472.CAN-03-2089. PMID 14973073. S2CID 14047485.
- ^ Dumaz, Nicolas; Hayward, Robert; Martin, Jan; Ogilvie, Lesley; Hedley, Douglas; Curtin, John A.; Bastian, Boris C.; Springer, Caroline; Marais, Richard (octubre de 2006). "Asociación Estadounidense para la Investigación del Cáncer (Desregulación del AMPc y melonoma)". Investigación del cáncer . 66 (19): 9483–9491. doi : 10.1158/0008-5472.CAN-05-4227 . PMID 17018604.
- ^ Simpson, BJ; Ramage, AD; Hulme, MJ; Burns, DJ; Katsaros, D.; Langdon, SP; Miller, WR (enero de 1996). "Asociación Americana para la Investigación del Cáncer (Presencia de Proteínas de Unión a AMPc en Tumores)". Investigación Clínica del Cáncer . 2 (1): 201–206.
- ^ "ScienceDaily ::Las redes cerebrales se fortalecen al cerrar los canales iónicos; la investigación podría conducir al tratamiento del TDAH".
- ^ Segatto, Marco (2021). "Inflamación neurogénica: el participante en la migraña y avances recientes en la investigación traslacional". Biomedicinas . 10 (1): 76. doi : 10.3390/biomedicines10010076 . PMC 8773152 . PMID 35052756.
- ^ ab Kather, H; Aktories, K (15 de noviembre de 1983). "cAMP-System und bakterielle Toxine [El sistema cAMP y las toxinas bacterianas]". Klin Wochenschr . 61 (22): 1109-1114. doi :10.1007/BF01530837. PMID 6317939. S2CID 33162709 . Consultado el 26 de febrero de 2022 .
- ^ Amberlyn M Wands; Akiko Fujita (octubre de 2015). "La fucosilación y la glicosilación de proteínas crean receptores funcionales para la toxina del cólera". eLife . Vol. 4. doi : 10.7554/eLife.09545 .
- ^ Cervin J, Wands AM, Casselbrant A, Wu H, Krishnamurthy S, Cvjetkovic A, et al. (2018) Intoxicación independiente del gangliósido GM1 por la toxina del cólera. PLoS Pathog 14(2): e1006862. https://doi.org/10.1371/journal.ppat.1006862
- ^ Las moléculas fucosiladas interfieren competitivamente con la unión de la toxina del cólera a las células huésped; Amberlyn M. Wands, Jakob Cervin, He Huang, Ye Zhang, Gyusaang Youn, Chad A. Brautigam, Maria Matson Dzebo, Per Björklund, Ville Wallenius, Danielle K. Bright, Clay S. Bennett, Pernilla Wittung-Stafshede, Nicole S. Sampson, Ulf Yrlid y Jennifer J. Kohler; Artículo de ACS Infectious Diseases ASAP, DOI: 10.1021/acsinfecdis.7b00085
- ^ Alasbahi, RH; Melzig, MF (enero de 2012). "Forskolina y derivados como herramientas para estudiar el papel del AMPc". Die Pharmazie . 67 (1): 5–13. PMID 22393824.


