Receptor de VLDL
| VLDLR | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | VLDLR , CAMRQ1, CARMQ1, CHRMQ1, VLDLRCH, VLDL-R, receptor de lipoproteínas de muy baja densidad | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 192977; MGI : 98935; HomoloGene : 443; Tarjetas genéticas : VLDLR; OMA :VLDLR - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
El receptor de lipoproteína de muy baja densidad ( VLDLR ) es un receptor de lipoproteína transmembrana de la familia de receptores de lipoproteína de baja densidad (LDL) . VLDLR muestra una homología considerable con los miembros de este linaje. Descubierto en 1992 por T. Yamamoto, VLDLR está ampliamente distribuido en todos los tejidos del cuerpo, incluidos el corazón, el músculo esquelético , el tejido adiposo y el cerebro, pero está ausente en el hígado. [5] Este receptor tiene un papel importante en la captación de colesterol, el metabolismo de las lipoproteínas ricas en triacilglicerol que contienen apolipoproteína E y la migración neuronal en el cerebro en desarrollo. En los humanos, VLDLR está codificado por el gen VLDLR . Las mutaciones de este gen pueden provocar una variedad de síntomas y enfermedades, que incluyen lisencefalia tipo I , hipoplasia cerebelosa y aterosclerosis .
Estructura de la proteína
VLDLR es un miembro de la familia de receptores de lipoproteínas de baja densidad (LDL) , que está compuesta enteramente por receptores de lipoproteínas transmembrana tipo I.
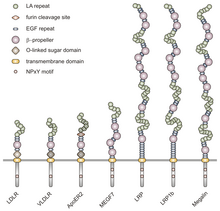
Todos los miembros de esta familia comparten cinco dominios estructurales altamente conservados: un dominio de unión al ligando N-terminal extracelular con repeticiones ricas en cisteína (también llamadas repeticiones de unión al ligando), un factor de crecimiento epidérmico (EGF), un dominio de azúcar de glicosilación O-ligado , una única secuencia transmembrana y un dominio citoplasmático que contiene una secuencia NPxY. El motivo NPxY funciona en la transducción de señales y la orientación de los receptores a las fosas recubiertas y consiste en la secuencia Asparagina-Prolina-X-Tirosina, donde X puede ser cualquier aminoácido. [6] Imitando esta estructura general, VLDLR tiene ocho repeticiones ricas en cisteína de 40 aminoácidos de longitud en su dominio de unión al ligando N-terminal extracelular. [6] Esta es la principal diferencia con el miembro principal de la familia del receptor LDL, LDLR , que tiene solo siete repeticiones ricas en cisteína que también tienen 40 aminoácidos de longitud. [7] Cada una de estas repeticiones ricas en cisteína, tanto en VLDLR como en LDLR, tiene tres enlaces disulfuro y un ion Ca 2+ coordinado . El extremo N también consta de un residuo de glicina seguido de 27 residuos hidrófobos que constituyen el péptido señal . [6] Después de esta región hay una repetición de EGF, un segmento de hélice β que desempeña un papel en la disociación dependiente del pH del complejo ligando-receptor, [8] y dos repeticiones de EGF más. [9] El dominio de glicosilación O-ligado de VLDLR, siguiente en la secuencia, tiene muchos residuos de treonina y serina y totaliza 46 aminoácidos. El dominio transmembrana, que funciona en el anclaje de los receptores a la membrana, tiene 22 aminoácidos de longitud. [6] Por último en la secuencia se encuentra el dominio citoplasmático de 54 aminoácidos, que contiene el motivo NPxY. [8]
Isoformas
El genoma humano VLDLR de longitud completa se encuentra en el locus 9p24 en el cromosoma 9. Consiste en un segmento de 40 kb que incluye 19 secuencias codificantes de exones , que es un exón más que el codificado por LDLR . Este exón adicional en el gen VLDLR explica la repetición de unión a cisteína adicional que no se encuentra en LDLR. [7] Juntos, los exones que forman el gen VLDLR codifican una proteína que tiene 873 residuos de aminoácidos de longitud. Se sabe que VLDLR existe como cuatro isoformas proteicas diferentes : tipo I, II, III y IV. Estas diferentes isoformas resultan de variaciones en el empalme alternativo . La transcripción de VLDLR tipo I (VLDLR-I) está compuesta por los 19 exones. VLDLR-II, por otro lado, carece del exón 16, que codifica el dominio de O-glicosilación entre regiones de azúcar. El VLDLR-III carece del exón 4 que codifica la tercera repetición de unión al ligando . Por último, las transcripciones VLDLR-IV carecen tanto del exón 16 como del exón 4. Se ha demostrado que el 75% de las transcripciones VLDLR existen como isoforma tipo II en modelos de cerebro de ratón . Esto demuestra que la mayoría de las VLDLR en el cerebro no están glicosiladas, ya que el tipo II carece del exón 16 que codifica el dominio de O-glicosilación. Se sabe que la isoforma tipo IV es la segunda más importante. [6]
Conservación evolutiva
Existe un alto nivel de conservación dentro de la familia de receptores LDL . En particular, hay un 50% de homología de secuencia general entre VLDLR y ApoER2 , otro receptor de lipoproteína de esta familia. [6] Al comparar LDLR y VLDLR, se encontró que sus estructuras primarias son 55% idénticas dentro de sus regiones de unión a ligando . Las estructuras modulares de estas dos proteínas son casi superponibles, con la única diferencia siendo la repetición rica en cisteína adicional en VLDLR. Esto se demuestra a través de la alineación de los dos receptores de acuerdo con su región de enlace; en LDLR, la región de enlace se encuentra entre las repeticiones ricas en cisteína cuatro y cinco de sus siete repeticiones, mientras que en VLDLR, la región de enlace parece estar entre las repeticiones cinco y seis de sus ocho repeticiones. [10]
La VLDLR también muestra una alta homología entre varias especies. Se ha identificado que la VLDLR de humanos, ratones, ratas y conejos es idéntica en un 95 %. Además, existe aproximadamente un 84 % de conservación con la proteína respectiva en los pollos. Este nivel de homología entre especies es mucho mayor que el encontrado para la LDLR. Por lo tanto, estas comparaciones de genes sugieren que la VLDLR y la LDLR divergieron antes que las LDLR entre los vertebrados. [10]
Unión de ligando
El receptor de lipoproteínas de baja densidad (VLDLR) se une a compuestos que contienen apolipoproteína E (apoE). Estos ligandos se unen a las repeticiones de unión de cisteína en el extremo N-terminal. La diferencia en las repeticiones ricas en cisteína entre los miembros de la familia de receptores de LDL conduce a las diferencias en la afinidad de unión. El VLDLR, en particular, se une a las VLDL y a las lipoproteínas de densidad intermedia (IDL), pero no a las LDL . Esta incapacidad para unirse a las LDL se debe a la incapacidad del VLDLR para unirse a la apolipoproteína B (apoB), que está presente en las LDL. [11]
Inhibidores
La proteína asociada al receptor (RAP) y la trombospondina-1 (THBS1) se han identificado como compuestos que se unen a VLDLR. En muchos casos, estos compuestos exhiben efectos inhibidores. THBS1 se une a VLDLR y bloquea la unión del ligando. [11] Esto juega un papel importante en la vía de la reelina , ya que THBS1 puede bloquear la unión de reelina, mientras que estimula simultáneamente los factores de transcripción normalmente activados por reelina. Sin embargo, esta unión de THBS1 no induce la degradación posterior de estos factores de transcripción, como lo hace la reelina, y por lo tanto puede conducir a efectos muy amplificados. [6] La proteína RAP actúa de manera similar al bloquear la unión de reelina a VLDLR. Sin embargo, en este caso, la fosforilación de los factores de transcripción, generalmente realizada por reelina, también se bloquea. [12]
Distribución y expresión tisular
El VLDLR se encuentra en todo el cuerpo, con una expresión particularmente alta en los tejidos de ácidos grasos debido a su alto nivel de triglicéridos , el ligando primario del VLDLR. Estos tejidos incluyen los del corazón, el músculo esquelético y la capa adiposa . Además, el receptor se encuentra en macrófagos, células endoteliales de capilares, [8] y en el cerebro, donde tiene una función muy diferente de la que se encuentra en el resto del cuerpo. Existe una expresión preferida para el VLDLR tipo I en el corazón, el músculo esquelético y el cerebro, a diferencia del tipo II, que se expresa principalmente en tejidos no musculares, incluido el cerebro , el cerebelo , el riñón, el bazo y las células endoteliales aórticas. [7] [11] La expresión más alta de VLDLR se encuentra en el cerebro. Aunque el VLDLR se encuentra en casi todas las regiones del cerebro, su expresión más alta está restringida a la corteza y el cerebelo. Aquí, el receptor se puede encontrar en la microglia en reposo o activada que está asociada con placas seniles y neuronas corticales, neuroblastos , células de la matriz, células de Cajal-Retzius , glioblastos , astrocitos , oligodendrocitos y neuronas piramidales específicas de la región . [6] A pesar de su papel principal en el metabolismo del colesterol y los ácidos grasos, VLDLR no se encuentra en el hígado. Este fenómeno se atribuye principalmente a los niveles muy altos de LDLR en estas áreas. [7] Además, se ha descubierto que este receptor se encuentra, subcelularmente, en las secciones de las membranas celulares que no son balsas lipídicas . [6]
Regulación
A diferencia de LDLR , VLDLR no exhibe ningún mecanismo de retroalimentación y, por lo tanto, las lipoproteínas intracelulares son incapaces de regularlo. Este fenómeno se debe a una diferencia en el elemento regulador de esterol -1 (SRE-1) de VLDLR. Las secuencias normales de SRE-1, como las que se encuentran en LDLR, se caracterizan por dos repeticiones del codón CAC separadas por dos nucleótidos C intermedios (5'-CACCCCAC-3'). La proteína de unión al elemento regulador de esterol -1 (SREBP-1), un factor de transcripción , se dirige a las repeticiones CAC de SRE-1 para regular la transcripción de la proteína. Sin embargo, el gen VLDLR está codificado por dos secuencias similares a SRE-1 que contienen polimorfismos de un solo nucleótido . Estos polimorfismos interrumpen la unión de SREBP-1 a las repeticiones CAC y, por lo tanto, eliminan el mecanismo de retroalimentación observado en otras proteínas. [7]
La expresión de VLDLR está regulada por el receptor activado por el proliferador de peroxisomas gamma (PPAR-γ). Un estudio de 2010 mostró que el fármaco de venta con receta pioglitazona , un agonista de PPAR-γ, aumenta la expresión de ARNm de VLDLR y los niveles de proteína en experimentos con fibroblastos de ratón. Los ratones tratados con pioglitazona mostraron una mayor tasa de conversión de triglicéridos plasmáticos en grasas epididimarias. Como se esperaba, los ratones deficientes en VLDLR no mostraron esta misma respuesta. [8] Estos resultados sugieren que VLDLR es importante en la acumulación de grasa. [8]
Muchas otras hormonas y factores dietéticos también regulan la expresión de VLDLR. La hormona tiroidea regula positivamente la expresión de VLDLR en los músculos esqueléticos de ratas, pero no en los tejidos adiposos o cardíacos. En conejos, la expresión de VLDLR en el músculo cardíaco es regulada al alza por el estrógeno y regulada a la baja por el factor estimulante de colonias de granulocitos y macrófagos . En las líneas celulares derivadas del trofoblasto , la expresión de VLDLR se regula al alza cuando las células se incuban con agentes hipolipidémicos como la insulina y el clofibrato . Por el contrario, el 8-bromoadenosina 3',5'-monofosfato cíclico (8-bromo-cAMP) regula a la baja la expresión de VLDLR. Finalmente, VLDLR se ve afectado por la presencia de apoE y LDLR. La presencia de apoE es necesaria para la regulación de la expresión de VLDLR, mientras que la ausencia de LDLR altera las secuencias similares al elemento regulador de esterol 1 de VLDLR para hacerlas funcionales solo en el corazón y el músculo esquelético. [7]
Función
Más allá del sistema nervioso
El VLDLR es un receptor de lipoproteína periférico que actúa en el metabolismo de lipoproteínas, el metabolismo de ácidos grasos cardíacos y la deposición de grasa. En efecto, el VLDLR permitirá que el colesterol llegue a los tejidos desde el torrente sanguíneo, donde puede ser utilizado en las membranas celulares. Además, permitirá que los ácidos grasos entren en las células, donde pueden ser utilizados como fuente de energía. [7] En general, el VLDLR modula principalmente el metabolismo extrahepático de lipoproteínas ricas en triglicéridos . [8]
Captación de lipoproteínas
El VLDLR solo desempeña un papel discreto en el metabolismo de los lípidos, pero es más significativo en situaciones de estrés. Los ratones con doble knockout en VLDLR y LDLR tienen niveles séricos de triglicéridos más altos que aquellos con solo un knockout en el gen LDLR . Además, los ratones knockout de LDLR que sobreexpresan VLDLR tienen niveles séricos de triglicéridos reducidos. Aunque la deposición de grasa es cercana a lo normal sin VLDLR, su papel gana importancia cuando LDLR es deficiente. A pesar de este conocimiento sobre su papel en la captación de lipoproteínas, el mecanismo completo del metabolismo de los lípidos realizado por VLDLR no se entiende completamente. [11]
Endocitosis
Se sabe que VLDLR emplea endocitosis , aunque se desconoce el mecanismo exacto de este proceso para esta proteína. La endocitosis está mediada por secuencias NPxY que se sabe que señalan la internalización del receptor a través de fosas recubiertas de clatrina . La presencia de esta secuencia en la cola citoplasmática de VLDLR hace posible la endocitosis. [11] En general, los receptores de lipoproteínas experimentan un proceso por el cual son endocitados con su ligando en fosas recubiertas de clatrina. Desde aquí, son transportados juntos a endosomas tempranos y tardíos hasta llegar al lisosoma . En este punto, se produce la hidrólisis y la lipoproteína se libera en el citoplasma mientras los receptores se reciclan de nuevo a la superficie celular. Todavía no se ha confirmado si VLDLR sigue este mecanismo exacto, pero es probable que haya uno estrechamente relacionado con él. [8]
En el sistema nervioso

Además de su función en todo el cuerpo, VLDLR tiene un papel único en el cerebro. Es un componente clave de la vía reelina , que funciona por un lado en la migración neuronal durante el desarrollo del cerebro, por otro lado en la retención de nuevos rastros de memoria en la formación del hipocampo . [13] [14] VLDLR vincula la proteína reelina a una proteína de señalización intracelular, Dab1 , que le dice a las neuronas individuales dónde ir dentro de la anatomía del cerebro. Las mutaciones en VLDLR a menudo no conducen a una desorganización importante como se ve en las mutaciones de reelina. Sin embargo, una mutación de VLDLR conduce a cierta desorganización ubicada principalmente en el cerebelo , donde se cree que VLDLR es más prominente. [6]
Migración neuronal
El receptor VLDLR se expresa en las neuronas que migran para ayudar a guiarlas a su ubicación adecuada en el cerebro. Este proceso es parte de la vía de la reelina , que es responsable de la formación de adentro hacia afuera del neocórtex de seis capas . [6] A pesar del descubrimiento de esta vía, muchos de los detalles y mecanismos moleculares de este proceso aún están siendo debatidos. La presencia de dos receptores de reelina, VLDLR y ApoER2 , ha dificultado la distinción de la función específica de cada proteína. [15]

VLDLR es el principal responsable de la correcta estratificación de las células piramidales en la capa 1 de la corteza cerebral . En particular, la ausencia de VLDLR puede conducir a la acumulación ectópica de células piramidales en esta región. [15] VLDLR no afecta la migración de células nacidas tempranamente a una capa organizada, pero dado que su ausencia resulta en la invasión de estos neuroblastos en la zona marginal, se teoriza que VLDLR puede codificar una "señal de parada". Esto está respaldado por el hecho de que VLDLR se expresa principalmente en la placa cortical adyacente a las células que expresan reelina, las células de Cajal-Retzius , y en la zona intermedia. Sin embargo, aún no se ha encontrado evidencia definitiva. [6] En general, la reelina se une a VLDLR y sufre endocitosis a través de vesículas recubiertas de clatrina . [6] Mientras tanto, una proteína intracelular, Dab1 , tiene un dominio PI/PTB que interactúa con la secuencia NPxY que se encuentra en la cola citoplasmática de VLDLR. [12] Como resultado, Dab1 se fosforila en tirosina y la reelina se degrada. Finalmente, Dab1 fosforilado activa una cascada de señalización intracelular que dirige a los neuroblastos a su ubicación adecuada a través de la alteración del citoesqueleto . [12] [16] Muchos de los detalles específicos de esta vía aún se están investigando. Todavía no se sabe si Dab1 se fosforila como resultado de la endocitosis de la reelina, o si hay otro mecanismo en juego. Además de la organización del neocórtex, VLDLR también desempeña un papel en la migración neuronal del hipocampo y las células de Purkinje del cerebelo . Sin embargo, todavía se desconoce mucha información sobre este proceso. [6]
Trastornos asociados
Las mutaciones en el gen VLDLR dan lugar a una multitud de trastornos de distinta gravedad. Estos trastornos suelen estar asociados a la homeostasis del colesterol o a una desorganización del ordenamiento neuronal en el cerebro debido a la interrupción de la vía de la reelina . Las más destacadas de estas enfermedades son la lisencefalia de tipo I, la hipoplasia cerebelosa asociada a VLDR y la aterosclerosis . En contraste con causar enfermedades, la VLDLR también se ha identificado como un posible remedio para algunos trastornos. La aplicación de VLDLR en el hígado puede curar la hipercolesterolemia familiar (HF) en pacientes que tienen LDLR defectuoso o sistemas inmunitarios defectuosos que atacan a esta proteína. Dado que la VLDLR no es inmunogénica, no inicia una respuesta inmunitaria, por lo que puede funcionar normalmente en sistemas inmunitarios defectuosos. [7] Además, dado que apoE , un ligando principal de VLDLR, es un factor de riesgo genético importante para la enfermedad de Alzheimer , VLDLR puede desempeñar un papel en la modulación del riesgo de este trastorno [6], lo que se explica por el hecho de que se supone que una disminución en la señalización de reelina en la fascia dentata inicia la enfermedad de Alzheimer. [17] También se ha demostrado que VLDLR reduce las probabilidades de enfermedad cardíaca prematura y accidente cerebrovascular porque VLDLR elimina la lipoproteína A (Lp(a)), un importante factor de riesgo hereditario para estas enfermedades. [7]
Lisencefalia tipo 1
La lisencefalia tipo I , o agiria-paquigiria, es un trastorno del desarrollo poco frecuente que se caracteriza por la ausencia de circunvoluciones y surcos en el cerebro. Estas malformaciones graves son el resultado de una migración neuronal aberrante . En la lisencefalia tipo I clásica, la migración neuronal comienza pero no puede continuar hasta completarse. Es probable que este proceso se vea interrumpido por alteraciones en varios genes, incluidos VLDLR , DCX , ARX , TUBA1A , RELN y LIS1 . Por lo tanto, la gravedad de la lisencefalia tipo I varía con el tipo de mutación. Una deleción homocigótica que afecta al gen VLDLR da como resultado un bajo grado de engrosamiento cortical y la ausencia de una zona con pocas células. La zona con pocas células describe la región entre las capas corticales externa e interna de las neuronas detenidas. [18] Además, la lisencefalia tipo 1 está estrechamente asociada con la hipoplasia cerebelosa .
Hipoplasia cerebelosa asociada a VLDLR
El síndrome de desequilibrio (DES) se describió por primera vez en la década de 1970 como un trastorno neurológico no progresivo. [19] En un estudio de 2005, el DES pasó a denominarse hipoplasia cerebelosa asociada a VLDLR (VLDLRCH) después de que su causa se vinculara a una alteración en el gen VLDLR . [20] Se han identificado al menos seis mutaciones que afectan al alelo recesivo homocigótico del gen VLDLR y se ha descubierto que causan VLDLRCH. Varias de estas mutaciones se han localizado en exones específicos que codifican el gen. Una de estas mutaciones es una transición de citosina a timina en el par de bases 1342 en el exón 10 que provoca una sustitución en Arg 448 por una señal de terminación . Asimismo, hay evidencia de una transición de citosina a timina en el par de bases número 769 en el exón 5 que provoca una sustitución en Arg 257 por una señal de terminación. Una tercera mutación conocida es causada por una deleción homocigótica de un par de bases en el exón 17 que causa un cambio de marco y una terminación prematura en el dominio de azúcar ligado a O. [21] Todas estas alteraciones del gen VLDLR impiden la producción de VLDLR y, por lo tanto, se denominan mutaciones de pérdida de función. Los síntomas reconocidos de VLDLRCH son discapacidad intelectual moderada a grave, convulsiones, disartria , estrabismo y retraso en la locomoción. En algunos casos, los niños con VLDLRCH aprenden a caminar muy tarde en el desarrollo después de los seis años, o nunca aprenden a caminar de forma independiente. La frecuencia de este trastorno es desconocida porque el diagnóstico temprano de VLDLRCH es difícil utilizando técnicas de imagen. Está asociado con la consanguinidad parental y se encuentra en comunidades aisladas como los huteritas y las familias endogámicas de Irán y Turquía. [22]
Aterosclerosis
La aterosclerosis se caracteriza por una acumulación excesiva de colesterol por parte de los macrófagos , lo que lleva a su transformación en células espumosas . Esta acumulación de colesterol es causada por la desregulación de la entrada y salida de colesterol. Dado que los macrófagos no tienen la capacidad de limitar la entrada de colesterol, el equilibrio depende completamente de las vías de salida. VLDLR es expresado por los macrófagos y funciona en la captación de lipoproteínas nativas . Excepcionalmente, VLDLR no responde a la carga de colesterol, probablemente debido a su falta de mecanismos de retroalimentación. La incapacidad de controlar su captación de lipoproteínas nativas hace que VLDLR sea un factor proaterogénico. [23] Esta característica está respaldada por los resultados de un estudio de 2005, en el que la reintroducción de VLDLR en ratones knock out de VLDLR condujo a un desarrollo de lesiones ateroscleróticas considerablemente mayor. [23 ]
Véase también
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000147852 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000024924 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia PubMed de ratón:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU . .
- ^ Nimpf J, Schneider WJ (diciembre de 2000). "Del transporte de colesterol a la transducción de señales: receptor de lipoproteína de baja densidad, receptor de lipoproteína de muy baja densidad y receptor-2 de apolipoproteína E". Biochim. Biophys. Acta . 1529 (1–3): 287–98. doi :10.1016/S1388-1981(00)00155-4. PMID 11111096.
- ^ abcdefghijklmno Reddy SS, Connor TE, Weeber EJ, Rebeck W (2011). "Similitudes y diferencias en la estructura, expresión y funciones de VLDLR y ApoER2". Mol Neurodegener . 6 : 30. doi : 10.1186/1750-1326-6-30 . PMC 3113299 . PMID 21554715.
- ^ abcdefghi Takahashi S, Sakai J, Fujino T, Hattori H, Zenimaru Y, Suzuki J, Miyamori I, Yamamoto TT (2004). "El receptor de lipoproteína de muy baja densidad (VLDL): caracterización y funciones como receptor de lipoproteína periférica". J. Atheroscler. Thromb . 11 (4): 200–8. doi : 10.5551/jat.11.200 . PMID 15356379.
- ^ abcdefg Go GW, Mani A (marzo de 2012). "La familia de receptores de lipoproteínas de baja densidad (LDLR) organiza la homeostasis del colesterol". Yale J Biol Med . 85 (1): 19–28. PMC 3313535 . PMID 22461740.
- ^ Tissir F, Goffinet AM (junio de 2003). "Reelin y desarrollo cerebral". Nat. Rev. Neurosci . 4 (6): 496–505. doi :10.1038/nrn1113. PMID 12778121. S2CID 12039624.
- ^ ab Nimpf J, Schneider WJ (diciembre de 1998). "El receptor de VLDL: un pariente del receptor de LDL con ocho repeticiones de unión a ligando, LR8". Aterosclerosis . 141 (2): 191–202. doi :10.1016/s0021-9150(98)00172-5. PMID 9862168.
- ^ abcde GUPEA: Mecanismos y consecuencias de la acumulación de lípidos celulares - Función del receptor de lipoproteínas de muy baja densidad (VLDL) . 2011-12-02. hdl :2077/27815. ISBN 9789162883560.
- ^ abc Rice DS, Curran T (2001). "El papel de la vía de señalización de reelina en el desarrollo del sistema nervioso central". Annu. Rev. Neurosci . 24 : 1005–39. doi :10.1146/annurev.neuro.24.1.1005. PMID 11520926. S2CID 17258257.
- ^ Kovács KA (septiembre de 2020). "Memorias episódicas: ¿cómo cooperan el hipocampo y los atractores del anillo entorinal para crearlas?". Frontiers in Systems Neuroscience . 14 : 68. doi : 10.3389/fnsys.2020.559186 . PMC 7511719 . PMID 33013334.
- ^ Kovács KA (diciembre de 2021). "Relevancia de un nuevo modelo a nivel de circuito de memorias episódicas para la enfermedad de Alzheimer". Revista Internacional de Ciencias Moleculares . 23 (1): 462. doi : 10.3390/ijms23010462 . PMC 8745479 . PMID 35008886.
- ^ ab Valiente M, Marín O (febrero de 2010). "Mecanismos de migración neuronal en el desarrollo y la enfermedad". Curr. Opin. Neurobiol . 20 (1): 68–78. doi :10.1016/j.conb.2009.12.003. PMID 20053546. S2CID 18658808.
- ^ Bielas S, Higginbotham H, Koizumi H, Tanaka T, Gleeson JG (2004). "Los mutantes de migración neuronal cortical sugieren vías separadas pero que se entrecruzan". Annu. Rev. Cell Dev. Biol . 20 : 593–618. doi :10.1146/annurev.cellbio.20.082503.103047. PMID 15473853.
- ^ Kovács KA (diciembre de 2021). "Relevancia de un nuevo modelo a nivel de circuito de memorias episódicas para la enfermedad de Alzheimer". Revista Internacional de Ciencias Moleculares . 23 (1): 462. doi : 10.3390/ijms23010462 . PMC 8745479 . PMID 35008886.
- ^ Spalice A, Parisi P, Nicita F, Pizzardi G, Del Balzo F, Iannetti P (marzo de 2009). "Trastornos de la migración neuronal: aspectos clínicos, neurorradiológicos y genéticos". Acta Pediatría . 98 (3): 421–33. doi : 10.1111/j.1651-2227.2008.01160.x . PMID 19120042. S2CID 21620197.
- ^ Moheb LA, Tzschach A, Garshasbi M, Kahrizi K, Darvish H, Heshmati Y, Kordi A, Najmabadi H, Ropers HH, Kuss AW (febrero de 2008). "Identificación de una mutación sin sentido en el gen del receptor de lipoproteínas de muy baja densidad (VLDLR) en una familia iraní con síndrome de desequilibrio". Eur. J. Hum. Genet . 16 (2): 270–3. doi : 10.1038/sj.ejhg.5201967 . PMID 18043714.
- ^ Boycott KM, Flavelle S, Bureau A, Glass HC, Fujiwara TM, Wirrell E, Davey K, Chudley AE, Scott JN, McLeod DR, Parboosingh JS (septiembre de 2005). "La deleción homocigótica del gen del receptor de lipoproteína de muy baja densidad causa hipoplasia cerebelosa autosómica recesiva con simplificación de la circunvolución cerebral". Am. J. Hum. Genet . 77 (3): 477–83. doi :10.1086/444400. PMC 1226212. PMID 16080122 .
- ^ Herencia mendeliana en línea en el hombre (OMIM): hipoplasia cerebelosa asociada a VLDLR; VLDLRCH - 224050
- ^ Boycott KM, Parboosingh JS (2008). "Hipoplasia cerebelosa asociada a VLDLR". En Pagon RA, Bird TD, Dolan CR, Stephens K, Adam MP (eds.). GeneReviews [Internet] . Universidad de Washington, Seattle. PMID 20301729.
- ^ ab Pennings M, Meurs I, Ye D, Out R, Hoekstra M, Van Berkel TJ, Van Eck M (octubre de 2006). "Regulación de la homeostasis del colesterol en macrófagos y consecuencias para el desarrollo de lesiones ateroscleróticas". FEBS Lett . 580 (23): 5588–96. doi : 10.1016/j.febslet.2006.08.022 . PMID 16935283. S2CID 42158329.
Lectura adicional
- Oka K, Ishimura-Oka K, Chu MJ, Sullivan M, Krushkal J, Li WH, Chan L (septiembre de 1994). "Clonación de ADNc del receptor de lipoproteína de muy baja densidad (VLDLR) de ratón, expresión específica de tejido y relación evolutiva con el receptor de lipoproteína de baja densidad". Eur. J. Biochem . 224 (3): 975–82. doi : 10.1111/j.1432-1033.1994.00975.x . PMID 7925422.
- Ananyeva NM, Makogonenko YM, Kouiavskaia DV, Ruiz J, Limburg V, Meijer AB, Khrenov AV, Shima M, Strickland DK, Saenko EL (marzo de 2008). "Los sitios de unión para el receptor de lipoproteína de muy baja densidad y la proteína relacionada con el receptor de lipoproteína de baja densidad se comparten dentro del factor de coagulación VIII". Blood Coagul. Fibrinolysis . 19 (2): 166–77. doi :10.1097/MBC.0b013e3282f5457b. PMID 18277139. S2CID 10380641.
- Ananyeva NM, Makogonenko YM, Sarafanov AG, Pechik IV, Gorlatova N, Radtke KP, Shima M, Saenko EL (septiembre de 2008). "La interacción del factor VIII de coagulación con miembros de la familia de receptores de lipoproteínas de baja densidad sigue un mecanismo común e involucra residuos de consenso dentro del sitio de unión A2 484-509". Blood Coagul. Fibrinolysis . 19 (6): 543–55. doi :10.1097/MBC.0b013e3283068859. PMID 18685438. S2CID 31127950.
- Llorca J, Rodríguez-Rodríguez E, Dierssen-Sotos T, Delgado-Rodríguez M, Berciano J, Combarros O (enero de 2008). "Metaanálisis de la variabilidad genética en las vías metabólicas de producción, agregación y degradación de beta-amiloide y el riesgo de enfermedad de Alzheimer". Acta Neurol. Escanear . 117 (1): 070914011339003––. doi : 10.1111/j.1600-0404.2007.00899.x . PMID 17854420. S2CID 25781860.
- Ozcelik T, Akarsu N, Uz E, Caglayan S, Gulsuner S, Onat OE, Tan M, Tan U (marzo de 2008). "Las mutaciones en el receptor de lipoproteína de muy baja densidad VLDLR causan hipoplasia cerebelosa y locomoción cuadrúpeda en humanos". Proc. Natl. Sci. USA . 105 (11): 4232–6. Bibcode :2008PNAS..105.4232O. doi : 10.1073/pnas.0710010105 . PMC 2393756 . PMID 18326629.
- Türkmen S, Hoffmann K, Demirhan O, Aruoba D, Humphrey N, Mundlos S (septiembre de 2008). "Hipoplasia cerebelosa, con locomoción cuadrúpeda, causada por mutaciones en el gen del receptor de lipoproteína de muy baja densidad". Eur. J. Hum. Genet . 16 (9): 1070–4. doi : 10.1038/ejhg.2008.73 . PMID 18364738.
- Oganesian A, Armstrong LC, Migliorini MM, Strickland DK, Bornstein P (febrero de 2008). "Las trombospondinas utilizan el receptor VLDL y una vía no apoptótica para inhibir la división celular en células endoteliales microvasculares". Mol. Biol. Cell . 19 (2): 563–71. doi :10.1091/mbc.E07-07-0649. PMC 2230579. PMID 18032585 .
- Wruss J, Rünzler D, Steiger C, Chiba P, Köhler G, Blaas D (mayo de 2007). "Fijación de receptores VLDL a un virus icosaédrico a lo largo del eje de simetría quíntuple: múltiples modos de unión evidenciados por espectroscopia de correlación de fluorescencia". Bioquímica . 46 (21): 6331–9. doi :10.1021/bi700262w. PMID 17472347.
- Suzuki K, Nakamura K, Iwata Y, Sekine Y, Kawai M, Sugihara G, Tsuchiya KJ, Suda S, Matsuzaki H, Takei N, Hashimoto K, Mori N (enero de 2008). "Disminución de la expresión del receptor de reelina VLDLR en linfocitos periféricos de pacientes esquizofrénicos sin tratamiento previo". Esquizofrenia. Res . 98 (1–3): 148–56. doi :10.1016/j.schres.2007.09.029. PMID 17936586. S2CID 45594329.
- Francis PJ, Hamon SC, Ott J, Weleber RG, Klein ML (mayo de 2009). "Los polimorfismos en C2, CFB y C3 están asociados con la progresión a la degeneración macular relacionada con la edad avanzada asociada con la pérdida visual". J. Med. Genet . 46 (5): 300–7. doi :10.1136/jmg.2008.062737. PMID 19015224. S2CID 22940548.
- Zhang G, Assadi AH, McNeil RS, Beffert U, Wynshaw-Boris A, Herz J, Clark GD, D'Arcangelo G (2007). "El complejo Pafah1b interactúa con el receptor de reelina VLDLR". PLOS ONE . 2 (2): e252. Bibcode :2007PLoSO...2..252Z. doi : 10.1371/journal.pone.0000252 . PMC 1800349 . PMID 17330141.
- Poirier S, Mayer G, Benjannet S, Bergeron E, Marcinkiewicz J, Nassoury N, Mayer H, Nimpf J, Prat A, Seidah NG (enero de 2008). "La proproteína convertasa PCSK9 induce la degradación del receptor de lipoproteína de baja densidad (LDLR) y sus miembros más cercanos, VLDLR y ApoER2". J. Biol. Chem . 283 (4): 2363–72. doi : 10.1074/jbc.M708098200 . PMID 18039658.
- Crawford DC, Nord AS, Badzioch MD, Ranchalis J, McKinstry LA, Ahearn M, Bertucci C, Shephard C, Wong M, Rieder MJ, Schellenberg GD, Nickerson DA, Heagerty PJ, Wijsman EM, Jarvik GP (marzo de 2008). "Un polimorfismo VLDLR común interactúa con el genotipo APOE en la predicción del riesgo de enfermedad de la arteria carótida". J. Lipid Res . 49 (3): 588–96. doi : 10.1194/jlr.M700409-JLR200 . PMID 18056683.
- Yamada Y, Ando F, Shimokata H (julio de 2005). "Asociación de polimorfismos en CYP17A1, MTP y VLDLR con densidad mineral ósea en mujeres y hombres japoneses que viven en la comunidad". Genomics . 86 (1): 76–85. doi :10.1016/j.ygeno.2005.03.005. PMID 15953542.
- Chen Y, Hu Y, Lu K, Flannery JG, Ma JX (noviembre de 2007). "Receptor de lipoproteína de muy baja densidad, un regulador negativo de la vía de señalización de WNT y la neovascularización coroidea". J. Biol. Chem . 282 (47): 34420–8. doi : 10.1074/jbc.M611289200 . PMID 17890782.
- Haines JL, Schnetz-Boutaud N, Schmidt S, Scott WK, Agarwal A, Postel EA, Olson L, Kenealy SJ, Hauser M, Gilbert JR, Pericak-Vance MA (enero de 2006). "Genes candidatos funcionales en la degeneración macular relacionada con la edad: asociación significativa con VEGF, VLDLR y LRP6". Invest. Ophthalmol. Vis. Sci . 47 (1): 329–35. doi : 10.1167/iovs.05-0116 . PMID 16384981.
- Sakai K, Tiebel O, Ljungberg MC, Sullivan M, Lee HJ, Terashima T, Li R, Kobayashi K, Lu HC, Chan L, Oka K (junio de 2009). "Una variante neuronal de VLDLR que carece de la tercera repetición de tipo complemento exhibe una alta capacidad de unión de lipoproteínas que contienen apoE". Brain Res . 1276 : 11–21. doi :10.1016/j.brainres.2009.04.030. PMC 2733343 . PMID 19393635.
- Moser R, Snyers L, Wruss J, Angulo J, Peters H, Peters T, Blaas D (agosto de 2005). "La neutralización de un virus del resfriado común por concatémeros del tercer módulo de unión al ligando del receptor VLDL depende en gran medida del número de módulos". Virology . 338 (2): 259–69. doi : 10.1016/j.virol.2005.05.016 . PMID 15950998.





