Triglicérido
| Tipos de grasas en los alimentos |
|---|
| Componentes |
| Grasas fabricadas |

Un triglicérido (de tri- y glicérido ; también TG , triacilglicerol , TAG o triacilglicérido ) es un éster derivado del glicerol y tres ácidos grasos . [1] Los triglicéridos son los principales componentes de la grasa corporal en humanos y otros vertebrados, así como la grasa vegetal . [2] También están presentes en la sangre para permitir la transferencia bidireccional de grasa adiposa y glucosa en sangre desde el hígado y son un componente principal de los aceites de la piel humana . [3]
Existen muchos tipos de triglicéridos. Una clasificación específica se centra en los tipos saturados e insaturados . Las grasas saturadas no tienen grupos C=C; las grasas insaturadas presentan uno o más grupos C=C. Las grasas insaturadas tienden a tener un punto de fusión más bajo que sus análogos saturados; como resultado, suelen ser líquidas a temperatura ambiente.
Estructura química

Los tres sustituyentes de los ácidos grasos pueden ser los mismos, pero normalmente son diferentes. Muchos triglicéridos son conocidos porque se conocen muchos ácidos grasos . Las longitudes de cadena de los grupos de ácidos grasos varían en los triglicéridos naturales. Los que contienen 16, 18 o 20 átomos de carbono se definen como triglicéridos de cadena larga , mientras que los triglicéridos de cadena media contienen ácidos grasos más cortos. Los animales sintetizan ácidos grasos de número par, pero las bacterias poseen la capacidad de sintetizar ácidos grasos de cadena impar y ramificada. Como resultado, la grasa animal de los rumiantes contiene ácidos grasos de número impar, como el 15, debido a la acción de las bacterias en el rumen . Muchos ácidos grasos son insaturados; algunos son poliinsaturados (p. ej., los derivados del ácido linoleico ). [4]
La mayoría de las grasas naturales contienen una mezcla compleja de triglicéridos individuales. Debido a su heterogeneidad, se funden en un amplio rango de temperaturas. La manteca de cacao es inusual porque está compuesta por solo unos pocos triglicéridos, derivados de los ácidos palmítico , oleico y esteárico en las posiciones 1, 2 y 3 del glicerol, respectivamente. [4]
Los triglicéridos más simples son aquellos en los que los tres ácidos grasos son idénticos. Sus nombres indican el ácido graso: estearina derivada del ácido esteárico, trioleína derivada del ácido oleico , palmitina derivada del ácido palmítico , etc. Estos compuestos se pueden obtener en tres formas cristalinas ( polimorfos ): α, β y β′, diferenciándose las tres formas en sus puntos de fusión. [4] [5]
Un triglicérido que contiene diferentes ácidos grasos se conoce como triglicérido mixto . [6] Estos son más comunes en la naturaleza.
Si el primer y tercer ácido graso del glicerol difieren, entonces el triglicérido mixto es quiral . [7]
Propiedades físicas
Los triglicéridos son incoloros, aunque las muestras degradadas pueden parecer amarillentas. La estearina, un triglicérido simple, saturado y simétrico, es un sólido cerca de la temperatura ambiente, pero la mayoría de los ejemplos son aceites. Su densidad es cercana a 0,-0,9 g/cm 3 .
Biosíntesis
Los triglicéridos son triésteres derivados de la reacción de condensación del glicerol con tres ácidos grasos . Su formación se puede resumir mediante la siguiente ecuación general:
- CH(OH)(CH2OH ) 2 + RCOOH + R'COOH + R"COOH → RC(O)OCH2 −CH (OC( O )R')−CH2C ( O)OR" + 3H2O
En la naturaleza, la formación de triglicéridos no es aleatoria; más bien, los ácidos grasos específicos se condensan selectivamente con los grupos funcionales hidroxilo del glicerol. Las grasas animales suelen tener residuos de ácidos grasos insaturados en los átomos de carbono 1 y 3. Ejemplos extremos de grasas no aleatorias son la manteca de cacao (mencionada anteriormente) y la manteca de cerdo , que contiene aproximadamente un 20% de triglicéridos con ácido palmítico en el carbono 2 y ácido oleico en los carbonos 1 y 3. [4] Un paso temprano en la biosíntesis es la formación del glicerol-1-fosfato : [4]
- CH( OH )( CH2OH ) 2 + H2PO−4 → HOCH 2 −CH(OH)−CH 2 −OPO 3 H − + H 2 O
Los tres átomos de oxígeno en este éster de fosfato están diferenciados, lo que prepara el escenario para la formación regioespecífica de triglicéridos, ya que el diol reacciona selectivamente con los derivados de la coenzima A de los ácidos grasos, RC(O)S–CoA:
- HOCH2 - CH(OH)-CH2 - OPO3H- + RC(O)S-CoA + R'C(O)S-CoA → RC(O)O-CH2- CH ( -OC ( O)R')-CH2 - OPO3H- + 2HS -CoA
Luego, el enlace éster de fosfato se hidroliza para dar paso a la introducción de un tercer éster de ácido graso:
- RC(O)O−CH 2 −CH(−OC(O)R')−CH 2 −OPO 3 H − + H 2 O → RC(O)O−CH 2 −CH(−OC(O)R' ) -CH2OH + H2PO−4
- RC(O)O−CH2 − CH(−OC(O)R')−CH2OH + R"C(O)S−CoA → RC(O)O−CH2 − CH (−OC(O)R')−CH2 − OC(O)R" + HS−CoA
Nomenclatura
Nombres comunes de grasas
Las grasas suelen recibir su nombre según su origen (como el aceite de oliva , el aceite de hígado de bacalao , la manteca de karité , la grasa de cola ) o tienen nombres tradicionales propios (como la mantequilla, la manteca de cerdo, el ghee y la margarina ). Algunos de estos nombres hacen referencia a productos que contienen cantidades importantes de otros componentes además de las grasas propiamente dichas.
Nombres químicos de los ácidos grasos
Los triglicéridos se denominan comúnmente ésteres de esos ácidos, como en el caso del 1,2-dioleato de glicerilo 3-palmitato, el nombre de una feromona de cría de la abeja melífera. [8] Cuando los residuos de ácidos grasos de un triglicérido son todos iguales, son comunes nombres como oleína (para el trioleato de glicerilo) y palmitina (para el tripalmitato de glicerilo).
Unión Internacional de Química Pura y Aplicada (IUPAC)
En la nomenclatura química general para compuestos orgánicos de la Unión Internacional de Química Pura y Aplicada (IUPAC) , [9] cualquier estructura orgánica puede nombrarse comenzando por su hidrocarburo correspondiente y luego especificando las diferencias para describir su estructura completamente. Para los ácidos grasos, por ejemplo, la posición y orientación de los dobles enlaces carbono-carbono se especifica contando desde el grupo funcional carboxilo . Así, el ácido oleico se denomina formalmente ácido (9 Z )-octadec-9-enoico, lo que describe que el compuesto tiene:
- una cadena de 18 carbonos ("octadec-") con el carbono del carboxilo ("ácido -oico") asignado al número 1
- Todos los enlaces carbono-carbono son simples excepto el enlace doble que une el carbono 9 ("9-en") al carbono 10.
- la cadena se conecta a cada uno de los carbonos del doble enlace del mismo lado (de ahí, cis , o "(9 Z )", siendo " Z " una abreviatura de la palabra alemana zusammen , que significa juntos).
La nomenclatura IUPAC también puede manejar cadenas ramificadas y derivados donde los átomos de hidrógeno son reemplazados por otros grupos químicos. Los triglicéridos toman nombres formales IUPAC de acuerdo con la regla que rige la denominación de ésteres. Por ejemplo, el nombre formal propano-1,2,3-tril 1,2-bis((9 Z )-octadec-9-enoato) 3-(hexadecanoato) se aplica a la feromona informalmente denominada gliceril 1,2-dioleato-3-palmitato, [8] y también conocida por otros nombres comunes que incluyen 1,2-dioleoil-3-palmitoilglicerol, palmitato de dioleato de glicerol y 3-palmito-1,2-dioleína.
Código de ácidos grasos
Una notación específica para los ácidos grasos con cadena no ramificada, que es tan precisa como la de la IUPAC pero más fácil de analizar, es un código de la forma "{N}:{D} cis -{CCC} trans -{TTT}", donde {N} es el número de carbonos (incluido el carboxílico), {D} es el número de dobles enlaces, {CCC} es una lista de las posiciones de los dobles enlaces cis y {TTT} es una lista de las posiciones de los enlaces trans . Se omiten una o ambas listas cis y trans y sus etiquetas si no hay enlaces múltiples con esa geometría. Por ejemplo, los códigos para los ácidos esteárico, oleico, elaídico y vaccénico son "18:0", "18:1 cis -9", "18:1 trans -9" y "18:1 trans -11", respectivamente. El ácido catálpico , (9E , 11E , 13Z ) -octadeca-9,11,13-trienoico según la nomenclatura IUPAC, tiene el código "18:3 cis -13 trans -9,11".
Grasas saturadas e insaturadas
Para la nutrición humana, una clasificación importante de las grasas se basa en el número y la posición de los dobles enlaces en los ácidos grasos constituyentes. La grasa saturada tiene un predominio de ácidos grasos saturados , sin ningún doble enlace, mientras que la grasa insaturada tiene predominantemente ácidos insaturados con dobles enlaces. (Los nombres se refieren al hecho de que cada doble enlace significa dos átomos de hidrógeno menos en la fórmula química. Así, un ácido graso saturado, al no tener dobles enlaces, tiene el número máximo de átomos de hidrógeno para un número dado de átomos de carbono, es decir, está "saturado" con átomos de hidrógeno.) [10] [11]
Los ácidos grasos insaturados se clasifican además en monoinsaturados (MUFA), con un solo doble enlace, y poliinsaturados (PUFA), con dos o más. [10] [11] Las grasas naturales suelen contener varios ácidos saturados e insaturados diferentes, incluso en la misma molécula. Por ejemplo, en la mayoría de los aceites vegetales, los residuos de ácido palmítico (C16:0) y esteárico (C18:0) saturados suelen estar unidos a las posiciones 1 y 3 (sn1 y sn3) del centro de glicerol, mientras que la posición media (sn2) suele estar ocupada por un ácido insaturado, como el oleico (C18:1, ω–9) o el linoleico (C18:2, ω–6). [12 ]
 | Ácido esteárico (saturado, C18:0) |
 | Ácido palmitoleico (monoinsaturado, C16:1 cis -9, omega-7) |
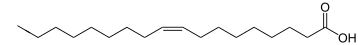 | Ácido oleico (monoinsaturado, C18:1 cis -9, omega-9) |
 | Ácido α-linolénico (poliinsaturado, C18:3 cis -9,12,15, omega-3) |
 | Ácido γ-linolénico (poliinsaturado, C18:3 cis -6,9,12, omega-6) |
Si bien los aspectos nutricionales de los ácidos grasos poliinsaturados son generalmente los de mayor interés, estos materiales también tienen aplicaciones no alimentarias. Entre ellos se incluyen los aceites secantes , como el de linaza , el de tung , el de amapola , el de perilla y el de nuez , que se polimerizan al exponerse al oxígeno para formar películas sólidas y se utilizan para fabricar pinturas y barnices .
Las grasas saturadas suelen tener un punto de fusión más alto que las insaturadas con el mismo peso molecular y, por lo tanto, es más probable que sean sólidas a temperatura ambiente. Por ejemplo, las grasas animales, como el sebo y la manteca de cerdo, tienen un alto contenido de ácidos grasos saturados y son sólidas. Los aceites de oliva y de linaza, por otro lado, son insaturados y líquidos. Las grasas insaturadas son propensas a la oxidación por el aire, lo que hace que se vuelvan rancias y no comestibles.
Los enlaces dobles de las grasas insaturadas se pueden convertir en enlaces simples mediante la reacción con hidrógeno efectuada por un catalizador. Este proceso, llamado hidrogenación , se utiliza para convertir los aceites vegetales en grasas vegetales sólidas o semisólidas como la margarina , que puede sustituir al sebo y la mantequilla y (a diferencia de las grasas insaturadas) se puede almacenar indefinidamente sin ponerse rancia. Sin embargo, la hidrogenación parcial también crea algunos ácidos trans no deseados a partir de ácidos cis . [13]
En el metabolismo celular , las moléculas de grasa insaturada producen ligeramente menos energía (es decir, menos calorías ) que una cantidad equivalente de grasa saturada. Los calores de combustión de los ésteres de ácidos grasos de 18 carbonos saturados, mono-, di- y tri-insaturados se han medido como 2859, 2828, 2794 y 2750 kcal/mol, respectivamente; o, en base al peso, 10,75, 10,71, 10,66 y 10,58 kcal/g – una disminución de aproximadamente el 0,6% por cada doble enlace adicional. [14]
Cuanto mayor sea el grado de insaturación de un ácido graso (es decir, cuantos más enlaces dobles tenga), más vulnerable será a la peroxidación lipídica ( rancidez ). Los antioxidantes pueden proteger a las grasas insaturadas de la peroxidación lipídica.
Usos industriales
El aceite de linaza y los aceites relacionados son componentes importantes de productos útiles que se utilizan en pinturas al óleo y revestimientos relacionados. El aceite de linaza es rico en componentes de ácidos grasos diinsaturados y triinsaturados, que tienden a endurecerse en presencia de oxígeno. Este proceso de endurecimiento que produce calor es peculiar de estos llamados aceites secantes . Es causado por un proceso de polimerización que comienza con las moléculas de oxígeno que atacan la cadena principal de carbono.
Los triglicéridos también se descomponen en sus componentes mediante transesterificación durante la fabricación de biodiésel . Los ésteres de ácidos grasos resultantes se pueden utilizar como combustible en motores diésel . La glicerina tiene muchos usos, como en la fabricación de alimentos y en la producción de productos farmacéuticos.
Tinción
La tinción de ácidos grasos, triglicéridos, lipoproteínas y otros lípidos se realiza mediante el uso de lisocromos (colorantes liposolubles). Estos colorantes pueden permitir la cualificación de una determinada grasa de interés tiñendo el material de un color específico. Algunos ejemplos: Sudan IV , Oil Red O y Sudan Black B.
Mapa interactivo de rutas
Haga clic en los genes, proteínas y metabolitos que aparecen a continuación para acceder a los artículos correspondientes. [§ 1]
- ^ El mapa interactivo de la ruta se puede editar en WikiPathways: "Statin_Pathway_WP430".
Véase también
- Diglicérido aciltransferasa , una enzima que produce triglicéridos.
- Aciltransferasas de glicerol-3-fosfato , enzimas implicadas en el paso inicial de la biosíntesis de triglicéridos
- Ácidos fosfatídicos , que desempeñan un papel en la biosíntesis de triglicéridos.
- Triglicéridos de cadena media
- Perfil lipídico
- Lípidos
- Perfil automático vertical
- Hipertrigliceridemia , presencia de altas cantidades de triglicéridos en la sangre.
Referencias
- ^ "Nomenclatura de lípidos". Comisión de Nomenclatura Bioquímica IUPAC-IUB (CBN) . Consultado el 8 de marzo de 2007 .
- ^ Nelson, DL; Cox, MM (2000). Lehninger, Principios de bioquímica (3.ª ed.). Nueva York: Worth Publishing. ISBN 1-57259-153-6.
- ^ Lampe, MA; Burlingame, AL; Whitney, J.; Williams, ML; Brown, BE; Roitman, E.; Elias, M. (1983). "Lípidos del estrato córneo humano: caracterización y variaciones regionales". J. Lipid Res . 24 (2): 120–130. doi : 10.1016/S0022-2275(20)38005-6 . PMID 6833889.
- ^ abcde Alfred Thomas (2002). "Grasas y aceites grasos". Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH . doi :10.1002/14356007.a10_173. ISBN 3527306730.
- ^ Charbonnet, GH; Singleton, WS (1947). "Propiedades térmicas de grasas y aceites". J. Am. Oil Chem. Soc. 24 (5): 140. doi :10.1007/BF02643296. S2CID 101805872.
- ^ "Triglicérido mixto | compuesto químico | Britannica". www.britannica.com . Consultado el 13 de febrero de 2023 .
- ^ Lok, CM; Ward, JP; van Dorp, DA (1976). "La síntesis de glicéridos quirales a partir de D- y L-serina". Química y física de lípidos . 16 (2): 115–122. doi :10.1016/0009-3084(76)90003-7. PMID 1269065.
- ^ ab N. Koeniger y HJ Veith (1983): "Gliceril-1,2-dioleato-3-palmitato, una feromona de cría de la abeja melífera ( Apis mellifera L.)". Experientia , volumen 39, páginas 1051–1052 doi :10.1007/BF01989801
- ^ Henri A. Favre; Warren H. Powell; et al. (Unión Internacional de Química Pura y Aplicada) (2014). Nomenclatura de la química orgánica: recomendaciones y nombres preferidos de la IUPAC, 2013 (PDF) . Cambridge, Inglaterra: Royal Society of Chemistry . ISBN 978-1-84973-306-9.OCLC 865143943 .
- ^ ab "Ácidos grasos esenciales". Centro de información sobre micronutrientes, Universidad Estatal de Oregón, Corvallis, Oregón. Mayo de 2014. Consultado el 24 de mayo de 2017 .
- ^ ab «Ácidos grasos omega-3, aceite de pescado, ácido alfa-linolénico». Mayo Clinic. 2017. Consultado el 24 de mayo de 2017 .
- ^ Instituto de mantecas y aceites comestibles (2006). «Grasas y aceites alimentarios» (PDF) . Archivado desde el original (PDF) el 26 de marzo de 2007. Consultado el 19 de febrero de 2009 .
- ^ Marchand, V (2010). "Grasas trans: lo que los médicos deben saber". Sociedad Canadiense de Pediatría . 6 (15): 373–375. doi :10.1093/pch/15.6.373. PMC 2921725. PMID 21731420 .
- ^ Krisnangkura, Kanit (1991). "Estimación del calor de combustión de triglicéridos y ésteres metílicos de ácidos grasos". Revista de la Sociedad Americana de Químicos del Petróleo . 68 : 56–58. doi :10.1007/BF02660311. S2CID : 84433984.
Enlaces externos
- Cómo reducir los triglicéridos (EMedicineHealth.com; octubre de 2020)