Metal de transición
| Parte de una serie sobre el |
| Tabla periódica |
|---|
En química, un metal de transición (o elemento de transición ) es un elemento químico del bloque d de la tabla periódica (grupos 3 a 12), aunque a veces se excluyen los elementos del grupo 12 (y con menos frecuencia, del grupo 3 ). Los elementos lantánidos y actínidos ( bloque f ) se denominan metales de transición interna y, a veces, también se consideran metales de transición.
Dado que son metales, son lustrosos y tienen buena conductividad eléctrica y térmica. La mayoría (con excepción del grupo 11 y el grupo 12) son duros y fuertes, y tienen altas temperaturas de fusión y ebullición. Forman compuestos en cualquiera de dos o más estados de oxidación diferentes y se unen a una variedad de ligandos para formar complejos de coordinación que a menudo son coloreados. Forman muchas aleaciones útiles y a menudo se emplean como catalizadores en forma elemental o en compuestos como complejos de coordinación y óxidos . La mayoría son fuertemente paramagnéticos debido a sus electrones d desapareados , al igual que muchos de sus compuestos. Todos los elementos que son ferromagnéticos cerca de la temperatura ambiente son metales de transición ( hierro , cobalto y níquel ) o metales de transición interna ( gadolinio ).
El químico inglés Charles Rugeley Bury (1890-1968) utilizó por primera vez la palabra transición en este contexto en 1921, cuando se refirió a una serie de transición de elementos durante el cambio de una capa interna de electrones (por ejemplo, n = 3 en la cuarta fila de la tabla periódica) de un grupo estable de 8 a uno de 18, o de 18 a 32. [1] [2] [3] Estos elementos ahora se conocen como el bloque d.

Definición y clasificación
Los Principios de nomenclatura química de la IUPAC de 2011 describen un "metal de transición" como cualquier elemento de los grupos 3 a 12 de la tabla periódica . [4] Esto corresponde exactamente a los elementos del bloque d , y muchos científicos utilizan esta definición. [5] [6] En la práctica, las series de lantánidos y actínidos del bloque f se denominan "metales de transición interna". El Libro Rojo de 2005 permite excluir los elementos del grupo 12, pero no los Principios de 2011. [7]
El Libro de Oro de la IUPAC [8] define un metal de transición como "un elemento cuyo átomo tiene una subcapa d parcialmente llena, o que puede dar lugar a cationes con una subcapa d incompleta", pero esta definición está tomada de una edición antigua del Libro Rojo y ya no está presente en la edición actual. [7]
En el bloque d, los átomos de los elementos tienen entre cero y diez electrones d.
| Grupo | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|---|---|---|---|---|---|---|---|---|---|---|
| Periodo 4 | 21 Sc | 22Ti | 23 voltios | 24 créditos | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 pies cúbicos | 30Zn |
| 5 | 39 años | 40 Zr | 41 Nb | 42 meses | 43 Tc | 44 Ru | 45 Rh | 46 páginas | 47 de agosto | 48 cd |
| 6 | 71 Lu | 72 alta frecuencia | 73 Ta | 74 W | 75 Re | 76 os | 77 Ir | 78 puntos | 79 Au | 80 Hg |
| 7 | 103 Lr | 104 RF | 105 dB | 106 sg | 107 bh | 108 horas | 109 Mt | 110 D | 111 Rg | 112 Cn |
Los textos publicados y las tablas periódicas muestran variaciones con respecto a los miembros más pesados del grupo 3. [ 9] La colocación común del lantano y el actinio en estas posiciones no está respaldada por evidencia física, química y electrónica , [10] [11] [12] que favorece abrumadoramente colocar al lutecio y al lawrencio en esos lugares. [13] [14] Algunos autores prefieren dejar los espacios debajo del itrio en blanco como una tercera opción, pero existe confusión sobre si este formato implica que el grupo 3 contiene solo escandio e itrio, o si también contiene todos los lantánidos y actínidos; [15] [16] [17] [18] [19] además, crea un bloque f de 15 elementos de ancho, cuando la mecánica cuántica dicta que el bloque f solo debe tener 14 elementos de ancho. [15] La forma con lutecio y lawrencio en el grupo 3 está respaldada por un informe de la IUPAC de 1988 sobre bases físicas, químicas y electrónicas, [20] y nuevamente por un informe preliminar de la IUPAC de 2021, ya que es la única forma que permite simultáneamente (1) la preservación de la secuencia de números atómicos crecientes, (2) un bloque f de 14 elementos de ancho y (3) evitar la división en el bloque d. [15] Todavía se pueden encontrar argumentos en la literatura contemporánea que pretenden defender la forma con lantano y actinio en el grupo 3, pero muchos autores la consideran lógicamente inconsistente (un punto particular de discordia es el diferente tratamiento del actinio y el torio , que ambos pueden usar 5f como orbital de valencia pero no tienen ocupación de 5f como átomos individuales); [14] [21] [22] La mayoría de los investigadores que consideran el problema están de acuerdo con la forma actualizada con lutecio y lawrencio. [14]
Los elementos del grupo 12 zinc , cadmio y mercurio a veces se excluyen de los metales de transición. [1] Esto se debe a que tienen la configuración electrónica [ ]d 10 s 2 , donde la capa d está completa, [23] y todavía tienen una capa d completa en todos sus estados de oxidación conocidos . Por lo tanto, los elementos del grupo 12 Zn, Cd y Hg pueden, bajo ciertos criterios, clasificarse como metales post-transición en este caso. Sin embargo, a menudo es conveniente incluir estos elementos en una discusión de los elementos de transición. Por ejemplo, cuando se discute la energía de estabilización del campo cristalino de los elementos de transición de la primera fila, es conveniente incluir también los elementos calcio y zinc, ya que ambos Ca2+
y Zn2+
tienen un valor de cero, con el que se puede comparar el valor de otros iones de metales de transición. Otro ejemplo se da en la serie de Irving-Williams de constantes de estabilidad de complejos. Además, Zn, Cd y Hg pueden usar sus orbitales d para enlazarse aunque no se conozcan en estados de oxidación que formalmente requerirían romper la subcapa d, lo que los distingue de los elementos del bloque p. [24] [25] [26]
La síntesis de fluoruro de mercurio (IV) ( HgF ) de 2007 (aunque controvertida y hasta ahora no reproducida de forma independiente)
4) ha sido tomado por algunos para reforzar la opinión de que los elementos del grupo 12 deben considerarse metales de transición, [27] pero algunos autores aún consideran que este compuesto es excepcional. [28] Se espera que el copernicio pueda usar sus electrones d para la química ya que su subcapa 6d está desestabilizada por fuertes efectos relativistas debido a su número atómico muy alto, y como tal se espera que tenga un comportamiento similar al de un metal de transición y muestre estados de oxidación más altos que +2 (que no se conocen definitivamente para los elementos más ligeros del grupo 12). Incluso en dicationes simples, se predice que Cn 2+ es 6d 8 7s 2 , a diferencia de Hg 2+ que es 5d 10 6s 0 .
Aunque el meitnerio , el darmstadtio y el roentgenio se encuentran dentro del bloque d y se espera que se comporten como metales de transición análogos a sus congéneres más ligeros, el iridio , el platino y el oro , esto aún no se ha confirmado experimentalmente. No está claro si el copernicio se comporta más como el mercurio o tiene propiedades más similares a las del gas noble radón . La inercia relativa del Cn provendría de la brecha de energía 7s–7p 1/2 expandida relativistamente , que ya está esbozada en la brecha 6s–6p 1/2 para el Hg, debilitando el enlace metálico y causando sus conocidos puntos de fusión y ebullición bajos.
Los metales de transición con números de grupo más bajos o más altos se describen como "anteriores" o "posteriores", respectivamente. Cuando se describen en un esquema de clasificación de dos vías, los metales de transición temprana están en el lado izquierdo del bloque d del grupo 3 al grupo 7. Los metales de transición tardía están en el lado derecho del bloque d, del grupo 8 al 11 (o 12, si se cuentan como metales de transición). En un esquema alternativo de tres vías, los grupos 3, 4 y 5 se clasifican como metales de transición temprana, 6, 7 y 8 se clasifican como metales de transición media, y 9, 10 y 11 (y a veces el grupo 12) se clasifican como metales de transición tardía.
Los elementos pesados del grupo 2, calcio , estroncio y bario , no tienen orbitales d llenos como átomos individuales, pero se sabe que tienen participación en enlaces de orbitales d en algunos compuestos , y por esa razón se los ha llamado metales de transición "honorarios". [29] Probablemente lo mismo sea cierto para el radio . [30]
Los elementos del bloque f La–Yb y Ac–No tienen actividad química de la capa (n−1)d, pero también tienen actividad química de la capa (n−2)f, que está ausente en los elementos del bloque d. Por ello, a menudo se los trata por separado como elementos de transición interna.
Configuración electrónica
La configuración electrónica general de los átomos del bloque d es [gas noble]( n − 1)d 0–10 n s 0–2 n p 0–1 . Aquí "[gas noble]" es la configuración electrónica del último gas noble que precede al átomo en cuestión, y n es el número cuántico principal más alto de un orbital ocupado en ese átomo. Por ejemplo, Ti ( Z = 22) está en el periodo 4, de modo que n = 4, los primeros 18 electrones tienen la misma configuración de Ar al final del periodo 3, y la configuración general es [Ar]3d 2 4s 2 . Los metales de transición de los periodos 6 y 7 también añaden al núcleo ( n − 2)f 14 electrones, que se omiten en las tablas siguientes. Los orbitales p casi nunca se llenan en átomos libres (la única excepción es el laurencio debido a los efectos relativistas que se vuelven importantes a un Z tan alto ), pero pueden contribuir al enlace químico en compuestos de metales de transición.
La regla de Madelung predice que el orbital d interno se llena después del orbital s de la capa de valencia . La estructura electrónica típica de los átomos de metales de transición se escribe entonces como [gas noble] n s 2 ( n − 1)d m . Esta regla es aproximada, pero se cumple para la mayoría de los metales de transición. Incluso cuando falla para el estado fundamental neutro, describe con precisión un estado excitado de baja altitud.
La subcapa d es la penúltima y se denota como subcapa ( n − 1)d. El número de electrones s en la subcapa s más externa es generalmente uno o dos, excepto en el caso del paladio (Pd), que no tiene ningún electrón en esa subcapa s en su estado fundamental. La subcapa s en la capa de valencia se representa como la subcapa n s, por ejemplo, 4s. En la tabla periódica, los metales de transición están presentes en diez grupos (3 a 12).
Los elementos del grupo 3 tienen una configuración n s 2 ( n − 1)d 1 , excepto el laurencio (Lr): su configuración 7s 2 7p 1 excepcionalmente no llena los orbitales 6d en absoluto. La primera serie de transición está presente en el cuarto período, y comienza después del Ca ( Z = 20) del grupo 2 con la configuración [Ar]4s 2 , o escandio (Sc), el primer elemento del grupo 3 con número atómico Z = 21 y configuración [Ar]4s 2 3d 1 , dependiendo de la definición utilizada. A medida que nos movemos de izquierda a derecha, se agregan electrones a la misma subcapa d hasta que se completa. Dado que los electrones agregados llenan los orbitales ( n − 1)d, las propiedades de los elementos del bloque d son bastante diferentes de las de los elementos del bloque s y p en los que el llenado ocurre ya sea en los orbitales s o en los p de la capa de valencia. La configuración electrónica de los elementos individuales presentes en todas las series del bloque d se da a continuación: [31]
| Grupo | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|---|---|---|---|---|---|---|---|---|---|---|
| Número atómico | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Elemento | Carolina del Sur | Sí | V | Cr | Minnesota | Fé | Co | Ni | Cu | Zinc |
Configuración electrónica | 3d 1 4s 2 | 3d 2 4s 2 | 3d 3 4s 2 | 3d 5 4s 1 | 3d 5 4s 2 | 3d 6 4s 2 | 3d 7 4s 2 | 3d 8 4s 2 | 3d 10 4s 1 | 3d 10 4s 2 |
| Número atómico | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 |
|---|---|---|---|---|---|---|---|---|---|---|
| Elemento | Y | Zr | Nótese bien | Mes | Tc | Ru | Rh | Pd | Ag | Cd |
Configuración electrónica | 4d 1 5s 2 | 4d 2 5s 2 | 4d 4 5s 1 | 4d 5 5s 1 | 4d 5 5s 2 | 4d 7 5s 1 | 4d 8 5s 1 | 4d 10 5s 0 | 4d 10 5s 1 | 4d 10 5s 2 |
| Número atómico | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 |
|---|---|---|---|---|---|---|---|---|---|---|
| Elemento | Lu | alta frecuencia | Ejército de reserva | Yo | Re | El sistema operativo | Ir | En | Au | Hg |
Configuración electrónica | 5d 1 6s 2 | 5d 2 6s 2 | 5d 3 6s 2 | 5d 4 6s 2 | 5d 5 6s 2 | 5d 6 6s 2 | 5d 7 6s 2 | 5d 9 6s 1 | 5d 10 6s 1 | 5d 10 6s 2 |
| Número atómico | 103 | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 |
|---|---|---|---|---|---|---|---|---|---|---|
| Elemento | Lr | Rf | Db | Sg | Bh | Hs | Monte | Ds | Rg | En |
Configuración electrónica | 7s 2 7p 1 | 6d 2 7s 2 | 6d 3 7s 2 | 6d 4 7s 2 | 6d 5 7s 2 | 6d 6 7s 2 | 6d 7 7s 2 | 6d 8 7s 2 | 6d 9 7s 2 | 6d 10 7s 2 |
Una mirada cuidadosa a la configuración electrónica de los elementos revela que hay ciertas excepciones a la regla de Madelung . Para Cr como ejemplo la regla predice la configuración 3d 4 4s 2 , pero los espectros atómicos observados muestran que el estado fundamental real es 3d 5 4s 1 . Para explicar tales excepciones, es necesario considerar los efectos del aumento de la carga nuclear en las energías orbitales, así como las interacciones electrón-electrón incluyendo tanto la repulsión de Coulomb como la energía de intercambio . [31] Las excepciones en cualquier caso no son muy relevantes para la química porque la diferencia de energía entre ellas y la configuración esperada es siempre bastante baja. [32]
Los orbitales ( n − 1)d que intervienen en los metales de transición son muy importantes porque influyen en propiedades como el carácter magnético, los estados de oxidación variables, la formación de compuestos coloreados, etc. Los orbitales de valencia s y p ( n s y n p) tienen muy poca contribución en este sentido, ya que apenas cambian al moverse de izquierda a derecha en una serie de transición. En los metales de transición, existen mayores similitudes horizontales en las propiedades de los elementos en un período en comparación con los períodos en los que los orbitales d no están involucrados. Esto se debe a que en una serie de transición, la configuración electrónica de la capa de valencia de los elementos no cambia. Sin embargo, también existen algunas similitudes de grupo.
Propiedades características
Hay una serie de propiedades compartidas por los elementos de transición que no se encuentran en otros elementos, lo que resulta de la capa d parcialmente llena. Estas incluyen:
- La formación de compuestos cuyo color se debe a transiciones electrónicas d–d.
- la formación de compuestos en muchos estados de oxidación, debido a la brecha de energía relativamente baja entre los diferentes estados de oxidación posibles [33]
- La formación de muchos compuestos paramagnéticos se debe a la presencia de electrones d desapareados. Algunos compuestos de elementos del grupo principal también son paramagnéticos (por ejemplo, óxido nítrico , oxígeno ).
La mayoría de los metales de transición se pueden unir a una variedad de ligandos , lo que permite una amplia variedad de complejos de metales de transición. [34]
Compuestos coloreados

3)
2(rojo); K
2Cr
2Oh
7(naranja); K
2Cromo
4(amarillo); NiCl
2(turquesa); CuSO
4(azul); KMnO
4(púrpura).
El color en los compuestos metálicos de series de transición se debe generalmente a transiciones electrónicas de dos tipos principales.
- Transiciones de transferencia de carga . Un electrón puede saltar de un orbital predominantemente ligando a un orbital predominantemente metálico, dando lugar a una transición de transferencia de carga de ligando a metal (LMCT). Estas pueden ocurrir más fácilmente cuando el metal está en un alto estado de oxidación. Por ejemplo, el color de los iones cromato , dicromato y permanganato se debe a las transiciones LMCT. Otro ejemplo es que el yoduro de mercurio , HgI 2 , es rojo debido a una transición LMCT.
Una transición de transferencia de carga de metal a ligando (MLCT) será más probable cuando el metal esté en un estado de oxidación bajo y el ligando se reduzca fácilmente.
En general, las transiciones de transferencia de carga dan como resultado colores más intensos que las transiciones d–d.
- Transiciones d–d. Un electrón salta de un orbital d a otro. En los complejos de los metales de transición, los orbitales d no tienen todos la misma energía. El patrón de división de los orbitales d se puede calcular utilizando la teoría del campo cristalino . La extensión de la división depende del metal en particular, su estado de oxidación y la naturaleza de los ligandos. Los niveles de energía reales se muestran en los diagramas de Tanabe-Sugano .
En complejos centrosimétricos , como los complejos octaédricos, las transiciones d–d están prohibidas por la regla de Laporte y solo ocurren debido al acoplamiento vibrónico en el que ocurre una vibración molecular junto con la transición ad–d. Los complejos tetraédricos tienen un color algo más intenso porque es posible mezclar orbitales d y p cuando no hay un centro de simetría, por lo que las transiciones no son transiciones d–d puras. La absortividad molar (ε) de las bandas causadas por las transiciones d–d es relativamente baja, aproximadamente en el rango de 5-500 M −1 cm −1 (donde M = mol dm −3 ). [35] Algunas transiciones d–d están prohibidas por espín . Un ejemplo ocurre en los complejos octaédricos de alto espín de manganeso (II), que tiene una configuración ad 5 en la que los cinco electrones tienen espines paralelos; el color de tales complejos es mucho más débil que en los complejos con transiciones permitidas por espín. Muchos compuestos de manganeso (II) parecen casi incoloros. El espectro de [Mn(H
2O)
6]2+
muestra una absortividad molar máxima de aproximadamente 0,04 M −1 cm −1 en el espectro visible .
Estados de oxidación
Una característica de los metales de transición es que presentan dos o más estados de oxidación , que suelen diferir en uno. Por ejemplo, los compuestos de vanadio se conocen en todos los estados de oxidación entre −1, como [V(CO)
6]−
, y +5, como VO3−
4.
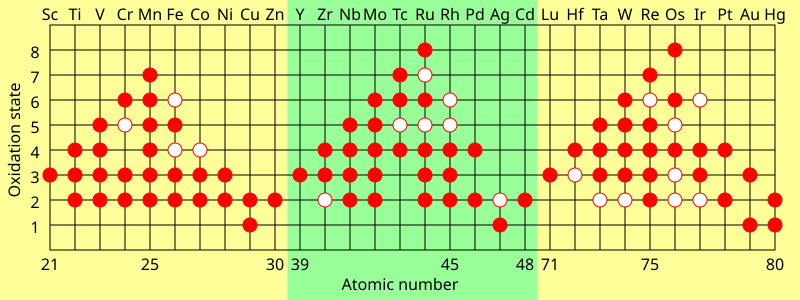
Los elementos del grupo principal de los grupos 13 a 18 también presentan múltiples estados de oxidación. Los estados de oxidación "comunes" de estos elementos suelen diferir en dos en lugar de uno. Por ejemplo, existen compuestos de galio en estados de oxidación +1 y +3 en los que hay un solo átomo de galio. Los compuestos de Ga(II) tendrían un electrón desapareado y se comportarían como un radical libre y generalmente se destruirían rápidamente, pero se conocen algunos radicales estables de Ga(II). [36] El galio también tiene un estado de oxidación formal de +2 en compuestos diméricos, como [Ga
2Cl
6]2−
, que contienen un enlace Ga-Ga formado a partir del electrón desapareado en cada átomo de Ga. [37] Por lo tanto, la principal diferencia en los estados de oxidación, entre los elementos de transición y otros elementos, es que se conocen estados de oxidación en los que hay un solo átomo del elemento y uno o más electrones desapareados.
El estado de oxidación máximo en los metales de transición de la primera fila es igual al número de electrones de valencia desde el titanio (+4) hasta el manganeso (+7), pero disminuye en los elementos posteriores. En la segunda fila, el máximo se da con el rutenio (+8), y en la tercera fila, el máximo se da con el iridio (+9). En compuestos como [MnO
4]−
y OsO
4Los elementos logran una configuración estable mediante enlace covalente .
Los estados de oxidación más bajos se exhiben en complejos de carbonilo metálico como Cr(CO)
6(estado de oxidación cero) y [Fe(CO)
4]2−
(estado de oxidación −2) en el que se cumple la regla de los 18 electrones . Estos complejos también son covalentes.
Los compuestos iónicos se forman principalmente con estados de oxidación +2 y +3. En solución acuosa, los iones son hidratados por (normalmente) seis moléculas de agua dispuestas octaédricamente.
Magnetismo
Los compuestos de metales de transición son paramagnéticos cuando tienen uno o más electrones d desapareados. [38] En complejos octaédricos con entre cuatro y siete electrones d son posibles estados de espín alto y espín bajo . Los complejos de metales de transición tetraédricos como [FeCl
4]2−
Tienen un espín alto porque la división del campo cristalino es pequeña, de modo que la energía que se obtiene en virtud de que los electrones están en orbitales de menor energía es siempre menor que la energía necesaria para emparejar los espines. Algunos compuestos son diamagnéticos . Estos incluyen complejos octaédricos, de espín bajo, d 6 y d 8 cuadrado-planares . En estos casos, la división del campo cristalino es tal que todos los electrones están emparejados.
El ferromagnetismo se produce cuando los átomos individuales son paramagnéticos y los vectores de espín están alineados en paralelo entre sí en un material cristalino. El hierro metálico y la aleación alnico son ejemplos de materiales ferromagnéticos que involucran metales de transición. El antiferromagnetismo es otro ejemplo de una propiedad magnética que surge de una alineación particular de espines individuales en el estado sólido.
Propiedades catalíticas
Los metales de transición y sus compuestos son conocidos por su actividad catalítica homogénea y heterogénea . Esta actividad se atribuye a su capacidad de adoptar múltiples estados de oxidación y formar complejos. El óxido de vanadio (V) (en el proceso de contacto ), el hierro finamente dividido (en el proceso Haber ) y el níquel (en la hidrogenación catalítica ) son algunos de los ejemplos. Los catalizadores en una superficie sólida ( catalizadores basados en nanomateriales ) implican la formación de enlaces entre las moléculas reactivas y los átomos de la superficie del catalizador (los metales de transición de primera fila utilizan electrones 3d y 4s para la unión). Esto tiene el efecto de aumentar la concentración de los reactivos en la superficie del catalizador y también debilitar los enlaces en las moléculas reaccionantes (se reduce la energía de activación). Además, debido a que los iones de los metales de transición pueden cambiar sus estados de oxidación, se vuelven más efectivos como catalizadores .
Un tipo interesante de catálisis ocurre cuando los productos de una reacción catalizan la reacción produciendo más catalizador ( autocatálisis ). Un ejemplo es la reacción del ácido oxálico con permanganato de potasio acidificado (o manganato (VII)). [39] Una vez que se ha producido un poco de Mn 2+ , puede reaccionar con MnO 4 − formando Mn 3+ . Este luego reacciona con iones C 2 O 4 − formando Mn 2+ nuevamente.
Propiedades físicas
Como lo indica su nombre, todos los metales de transición son metales y, por lo tanto, conductores de electricidad.
En general, los metales de transición poseen una alta densidad y altos puntos de fusión y ebullición . Estas propiedades se deben al enlace metálico por electrones d deslocalizados, lo que lleva a una cohesión que aumenta con el número de electrones compartidos. Sin embargo, los metales del grupo 12 tienen puntos de fusión y ebullición mucho más bajos ya que sus subcapas d completas impiden el enlace d–d, lo que nuevamente tiende a diferenciarlos de los metales de transición aceptados. El mercurio tiene un punto de fusión de −38,83 °C (−37,89 °F) y es un líquido a temperatura ambiente.
Véase también
- Elemento de transición interna , nombre que se le da a cualquier miembro del bloque f
- Elemento del grupo principal , un elemento distinto de un metal de transición
- La teoría del campo de ligandos es un desarrollo de la teoría del campo cristalino que tiene en cuenta la covalencia.
- La teoría del campo cristalino es un modelo que describe la ruptura de las degeneraciones de los estados orbitales electrónicos.
- Metal postransicional , elemento metálico situado a la derecha de los metales de transición en la tabla periódica.
Referencias
- ^ ab Jensen, William B. (2003). "El lugar del cinc, el cadmio y el mercurio en la tabla periódica" (PDF) . Journal of Chemical Education . 80 (8): 952–961. Bibcode :2003JChEd..80..952J. doi :10.1021/ed080p952.
- ^ Bury, CR (1921). "Teoría de Langmuir sobre la disposición de los electrones en átomos y moléculas". J. Am. Chem. Soc . 43 (7): 1602–1609. doi :10.1021/ja01440a023.
- ^ Bury, Charles Rugeley. Encyclopedia.com Diccionario completo de biografía científica (2008).
- ^ Leigh, GJ, ed. (2011). Principios de nomenclatura química (PDF) . The Royal Society of Chemistry. pág. 9. ISBN 978-1-84973-007-5.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). Química general: principios y aplicaciones modernas (8.ª ed.). Upper Saddle River, NJ: Prentice Hall. págs. 341–342. ISBN 978-0-13-014329-7. OCLC 46872308 .
- ^ Housecroft, C. E. y Sharpe, A. G. (2005) Química inorgánica , 2.ª ed., Pearson Prentice-Hall, págs. 20-21.
- ^ ab Connelly, NG; Damhus, T.; Hartshorn, RM; Hutton, AT, eds. (2005). Nomenclatura de la química inorgánica (PDF) . RSC – IUPAC . ISBN 0-85404-438-8.
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "elemento de transición". doi :10.1351/goldbook.T06456
- ^ Scerri, Eric R. (2020). La tabla periódica: su historia y su importancia . Nueva York, NY. ISBN 978-0-19-091436-3.OCLC 1096234740 .
{{cite book}}: CS1 maint: location missing publisher (link) - ^ LD Landau , EM Lifshitz (1958). Mecánica cuántica: teoría no relativista . Vol. 3 (1.ª ed.). Pergamon Press . Págs. 256–7.
- ^ Wittig, Jörg (1973). "La variable de presión en la física del estado sólido: ¿Qué pasa con los superconductores de banda 4f?". En HJ Queisser (ed.). Festkörper Probleme: conferencias plenarias de las divisiones de Física de semiconductores, Física de superficies, Física de bajas temperaturas, Polímeros de alto rendimiento, Termodinámica y Mecánica estadística de la Sociedad Alemana de Física, Münster, 19-24 de marzo de 1973. Avances en física del estado sólido. Vol. 13. Berlín, Heidelberg: Springer. págs. 375-396. doi :10.1007/BFb0108579. ISBN . 978-3-528-08019-8.
- ^ Matthias, BT (1969). "Sistemática de la superconductividad". En Wallace, PR (ed.). Superconductividad . Vol. 1. Gordon y Breach. págs. 225–294. ISBN 9780677138107.
- ^ William B. Jensen (1982). "Las posiciones del lantano (actinio) y el lutecio (lawrencio) en la tabla periódica". J. Chem. Educ . 59 (8): 634–636. Bibcode :1982JChEd..59..634J. doi :10.1021/ed059p634.
- ^ abc Jensen, William B. (2015). «Las posiciones del lantano (actinio) y el lutecio (lawrencio) en la tabla periódica: una actualización». Fundamentos de la química . 17 : 23–31. doi :10.1007/s10698-015-9216-1. S2CID 98624395. Archivado desde el original el 30 de enero de 2021. Consultado el 28 de enero de 2021 .
- ^ abc Scerri, Eric (18 de enero de 2021). «Provisional Report on Discussions on Group 3 of the Periodic Table» (PDF) . Chemistry International . 43 (1): 31–34. doi :10.1515/ci-2021-0115. S2CID 231694898. Archivado (PDF) del original el 13 de abril de 2021 . Consultado el 9 de abril de 2021 .
- ^ Thyssen, P.; Binnemans, K. (2011). "Acomodación de las tierras raras en la tabla periódica: un análisis histórico". En Gschneidner, KA Jr.; Bünzli, JC.G; Vecharsky, Bünzli (eds.). Manual sobre la física y la química de las tierras raras . Vol. 41. Ámsterdam: Elsevier. págs. 1–94. doi :10.1016/B978-0-444-53590-0.00001-7. ISBN 978-0-444-53590-0.
- ^ Barber, Robert C.; Karol, Paul J; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, Erich W. (2011). "Descubrimiento de los elementos con números atómicos mayores o iguales a 113 (Informe técnico de la IUPAC)". Pure Appl. Chem . 83 (7): 1485. doi : 10.1351/PAC-REP-10-05-01 .
- ^ Karol, Paul J.; Barber, Robert C.; Sherrill, Bradley M.; Vardaci, Emanuele; Yamazaki, Toshimitsu (22 de diciembre de 2015). "Descubrimiento de los elementos con números atómicos Z = 113, 115 y 117 (Informe técnico de la IUPAC)". Pure Appl. Chem . 88 (1–2): 139–153. doi : 10.1515/pac-2015-0502 .
- ^ Pyykkö, Pekka (2019). "Un ensayo sobre las tablas periódicas" (PDF) . Química pura y aplicada . 91 (12): 1959–1967. doi :10.1515/pac-2019-0801. S2CID 203944816 . Consultado el 27 de noviembre de 2022 .
- ^ Fluck, E. (1988). "New Notations in the Periodic Table" (PDF) . Pure Appl. Chem. 60 (3): 431–436. doi :10.1351/pac198860030431. S2CID 96704008. Archivado (PDF) desde el original el 25 de marzo de 2012 . Consultado el 24 de marzo de 2012 .
- ^ Scerri, Eric (2009). "¿Qué elementos pertenecen al grupo 3?". Journal of Chemical Education . 86 (10): 1188. Bibcode :2009JChEd..86.1188S. doi :10.1021/ed086p1188 . Consultado el 1 de enero de 2023 .
- ^ Chemey, Alexander T.; Albrecht-Schmitt, Thomas E. (2019). "Evolución de la tabla periódica a través de la síntesis de nuevos elementos". Radiochimica Acta . 107 (9–11): 771–801. doi :10.1515/ract-2018-3082. S2CID 104470619.
- ^ Algodón, F. Albert; Wilkinson, G.; Murillo, CA (1999). Química inorgánica avanzada (6.ª ed.). Nueva York: Wiley, ISBN 978-0-471-19957-1 .
- ^ Tossell, JA (1 de noviembre de 1977). "Estudios teóricos de las energías de enlace de los orbitales de valencia en sulfuro de cinc sólido, óxido de cinc y fluoruro de cinc". Química inorgánica . 16 (11): 2944–2949. doi :10.1021/ic50177a056.
- ^ Farberovich, OV; Kurganskii, SI; Domashevskaya, EP (1980). "Problemas del método OPW. II. Cálculo de la estructura de bandas de ZnS y CdS". Physica Status Solidi B . 97 (2): 631–640. Código Bibliográfico :1980PSSBR..97..631F. doi :10.1002/pssb.2220970230.
- ^ Singh, Prabhakar P. (1994). "Efectos relativistas en el mercurio: átomos, cúmulos y volumen". Physical Review B . 49 (7): 4954–4958. Bibcode :1994PhRvB..49.4954S. doi :10.1103/PhysRevB.49.4954. PMID 10011429.
- ^ Wang, Xuefang; Andrews, Lester; Riedel, Sebastian; Kaupp, Martin (2007). "El mercurio es un metal de transición: la primera evidencia experimental de HgF 4 ". Angew. Chem. Int. Ed . 46 (44): 8371–8375. doi :10.1002/anie.200703710. PMID 17899620.
- ^ Jensen, William B. (2008). "¿Es el mercurio ahora un elemento de transición?". J. Chem. Educ . 85 (9): 1182–1183. Bibcode :2008JChEd..85.1182J. doi : 10.1021/ed085p1182 .
- ^ Fernández, Israel; Holzmann, Nicole; Frenking, Gernot (2020). "Los orbitales de valencia de los átomos alcalinotérreos". Química: una revista europea . 26 (62): 14194–14210. doi : 10.1002/chem.202002986 . PMC 7702052 . PMID 32666598. S2CID 220529532.
- ^ Pyykkö, Pekka; Desclaux, Jean-Paul (1979). "Relatividad y el sistema periódico de elementos". Accounts of Chemical Research . 12 (8): 276–281. doi :10.1021/ar50140a002.
- ^ ab Miessler, GL y Tarr, DA (1999) Química inorgánica , 2.ª ed., Prentice-Hall, pág. 38-39 ISBN 978-0-13-841891-5
- ^ Jørgensen, Christian (1973). "La conexión débil entre la configuración electrónica y el comportamiento químico de los elementos pesados (transuránicos)". Angewandte Chemie International Edition . 12 (1): 12–19. doi :10.1002/anie.197300121.
- ^ Matsumoto, Paul S (2005). "Tendencias en la energía de ionización de elementos metálicos de transición". Journal of Chemical Education . 82 (11): 1660. Bibcode :2005JChEd..82.1660M. doi :10.1021/ed082p1660.
- ^ Hogan, C. Michael (2010). "Heavy metal" en Encyclopedia of Earth . Consejo Nacional para la Ciencia y el Medio Ambiente. E. Monosson y C. Cleveland (eds.) Washington DC.
- ^ Orgel, LE (1966). Introducción a la química de los metales de transición, Teoría del campo de ligandos (2.ª ed.). Londres: Methuen.
- ^ Protchenko, Andrey V.; Dange, Deepak; Harmer, Jeffrey R.; Tang, Christina Y.; Schwarz, Andrew D.; Kelly, Michael J.; Phillips, Nicholas; Tirfoin, Remi; Birjkumar, Krishna Hassomal; Jones, Cameron; Kaltsoyannis, Nikolas; Mountford, Philip; Aldridge, Simon (16 de febrero de 2014). "Radicales estables GaX 2 , InX 2 y TlX 2 ". Nature Chemistry . 6 (4): 315–319. Bibcode :2014NatCh...6..315P. doi :10.1038/nchem.1870. PMID 24651198.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.pág. 240
- ^ Figgis, BN; Lewis, J. (1960). Lewis, J.; Wilkins, RG (eds.). La magnetoquímica de compuestos complejos . Química de coordinación moderna. Nueva York: Wiley Interscience. págs. 400–454.
- ^ Kovacs KA, Grof P, Burai L, Riedel M (2004). "Revisión del mecanismo de la reacción permanganato/oxalato". J. Phys. Chem. A . 108 (50): 11026–11031. Código Bibliográfico :2004JPCA..10811026K. doi :10.1021/jp047061u.
