Dimorfismo sexual

| Parte de una serie sobre |
| Sexo |
|---|
 |
| Términos biológicos |
| Sexual reproduction |
| Sexuality |
| Sexual system |
El dimorfismo sexual es la condición en la que los sexos de la misma especie exhiben diferentes características morfológicas , incluidas características que no están directamente involucradas en la reproducción . [1] La condición ocurre en la mayoría de las especies dioicas , que consisten en la mayoría de los animales y algunas plantas. Las diferencias pueden incluir características sexuales secundarias , tamaño, peso, color, marcas o rasgos conductuales o cognitivos. La competencia reproductiva entre machos ha desarrollado una variedad diversa de rasgos sexualmente dimórficos. Los rasgos de utilidad agresiva, como los dientes de "batalla" y las cabezas romas reforzadas como arietes, se utilizan como armas en interacciones agresivas entre rivales. Las exhibiciones pasivas, como el plumaje ornamental o el canto de llamadas, también han evolucionado principalmente a través de la selección sexual. [2] Estas diferencias pueden ser sutiles o exageradas y pueden estar sujetas a la selección sexual y la selección natural . Lo opuesto al dimorfismo es el monomorfismo , cuando ambos sexos biológicos son fenotípicamente indistinguibles entre sí. [3]
Descripción general


Ornamentación y coloración

Los tipos de dimorfismo más comunes y fáciles de identificar son la ornamentación y la coloración, aunque no siempre son evidentes. Una diferencia en la coloración de los sexos dentro de una especie determinada se denomina dicromatismo sexual, que se observa comúnmente en muchas especies de aves y reptiles. [4] La selección sexual conduce a rasgos dimórficos exagerados que se utilizan predominantemente en la competencia por las parejas. [5] La mayor aptitud física resultante de la ornamentación compensa su costo de producción o mantenimiento, lo que sugiere implicaciones evolutivas complejas, pero los costos y las implicaciones evolutivas varían de una especie a otra. [6]
Los pavos reales constituyen un ejemplo claro de este principio. El vistoso plumaje de los pavos reales, tal como se utiliza en el cortejo, atrae a las pavas reales . A primera vista, uno podría confundir a los pavos reales y a las pavas reales con especies completamente diferentes debido a los colores vibrantes y al gran tamaño del plumaje del macho; la pava real es de una coloración marrón tenue. [7] El plumaje del pavo real aumenta su vulnerabilidad a los depredadores porque es un obstáculo en el vuelo y hace que el ave sea llamativa en general. [7] Hay múltiples ejemplos similares, como en las aves del paraíso [8] y los faisanes argus . [ cita requerida ]
Otro ejemplo de dicromatismo sexual es el de los polluelos de herrerillos azules . Los machos son cromáticamente más amarillos que las hembras. Se cree que esto se obtiene por la ingestión de larvas verdes de lepidópteros , que contienen grandes cantidades de los carotenoides luteína y zeaxantina . [9] Esta dieta también afecta a los colores sexualmente dimórficos en el espectro ultravioleta invisible para los humanos. [10] [11] Por lo tanto, los pájaros machos, aunque parecen amarillos para los humanos, en realidad tienen un plumaje teñido de violeta que es visible para las hembras. Se cree que este plumaje es un indicador de las habilidades parentales de los machos. [12] Quizás este sea un buen indicador para las hembras porque muestra que son buenas para obtener un suministro de alimentos del que se obtiene el carotenoide. Existe una correlación positiva entre los cromas de las plumas de la cola y el pecho y la condición corporal. [13] Los carotenoides juegan un papel importante en la función inmunológica de muchos animales, por lo que las señales dependientes de los carotenoides podrían indicar salud. [14]
Las ranas constituyen otra ilustración conspicua de este principio. Existen dos tipos de dicromatismo en las especies de ranas: ontogenético y dinámico. Las ranas ontogenéticas son más comunes y presentan cambios de color permanentes en los machos o las hembras. Ranoidea lesueuri es un ejemplo de rana dinámica con cambios de color temporales en los machos durante la temporada de reproducción. [15] Hyperolius ocellatus es una rana ontogenética con diferencias dramáticas tanto en el color como en el patrón entre los sexos. En la madurez sexual, los machos muestran un color verde brillante con líneas dorsolaterales blancas. [16] En contraste, las hembras son de color rojo oxidado a plateado con pequeñas manchas. La coloración brillante en la población de machos atrae a las hembras y es una señal aposemática para los depredadores potenciales.
Las hembras a menudo muestran una preferencia por características sexuales secundarias masculinas exageradas en la selección de pareja. [17] La hipótesis del hijo sexy explica que las hembras prefieren machos más elaborados y seleccionan en contra de machos de color opaco, independientemente de la visión de la especie. [18]
En muchas especies de peces también se observa un dimorfismo sexual y una elección de apareamiento similares. Por ejemplo, los guppies machos tienen manchas y ornamentaciones coloridas, mientras que las hembras son generalmente grises. Las hembras prefieren machos de colores brillantes a machos más apagados. [19] [ página necesaria ]
En los blénidos de labios rojos , sólo los machos desarrollan un órgano en la región ano-urogenital que produce sustancias antimicrobianas. Durante el cuidado parental, los machos frotan sus regiones ano-urogenitales sobre las superficies internas de sus nidos, protegiendo así sus huevos de infecciones microbianas, una de las causas más comunes de mortalidad en los peces jóvenes. [20]
Plantas
La mayoría de las plantas con flores son hermafroditas , pero aproximadamente el 6% de las especies tienen machos y hembras separados ( dioecia ). [21] El dimorfismo sexual es común en plantas dioicas [22] : 403 y especies dioicas . [23] : 71
Los machos y las hembras de las especies polinizadas por insectos generalmente se parecen entre sí porque las plantas proporcionan recompensas (por ejemplo, néctar ) que alientan a los polinizadores a visitar otra flor similar , completando la polinización . Las orquídeas Catasetum son una excepción interesante a esta regla. Las orquídeas Catasetum macho adhieren violentamente las polinias a las abejas polinizadoras euglosinas . Las abejas evitarán otras flores masculinas pero pueden visitar a la hembra, que se ve diferente de los machos. [24]
Otras excepciones dioicas, como Loxostylis alata , tienen sexos visiblemente diferentes, con el efecto de provocar el comportamiento más eficiente de los polinizadores, quienes luego utilizan la estrategia más eficiente para visitar cada género de flor en lugar de buscar, por ejemplo, polen en una flor femenina que contiene néctar. [ cita requerida ]
Algunas plantas, como algunas especies de geranio, presentan un dimorfismo sexual serial. Las flores de estas especies pueden, por ejemplo, presentar sus anteras al abrirse, luego desprenderse de las anteras agotadas después de un día o dos y tal vez cambiar también sus colores mientras el pistilo madura; los polinizadores especializados tienden a concentrarse en la apariencia exacta de las flores a las que sirven, lo que les ahorra tiempo y esfuerzo y, en consecuencia, beneficia a los intereses de la planta. Algunas de estas plantas van incluso más allá y cambian su apariencia una vez fertilizadas, desalentando así futuras visitas de polinizadores. Esto es ventajoso para ambas partes porque evita dañar el fruto en desarrollo y desperdiciar el esfuerzo del polinizador en visitas infructuosas. En efecto, la estrategia garantiza que los polinizadores puedan esperar una recompensa cada vez que visiten una flor que se anuncia adecuadamente. [ cita requerida ]
Las hembras de la planta acuática Vallisneria americana tienen flores flotantes unidas por un largo tallo floral que se fertilizan si entran en contacto con una de las miles de flores flotantes liberadas por un macho. [25] [ se necesita una mejor fuente ] El dimorfismo sexual se asocia con mayor frecuencia con la polinización por el viento en las plantas debido a la selección para la dispersión eficiente del polen en los machos frente a la captura de polen en las hembras, por ejemplo, Leucadendron rubrum . [26]
El dimorfismo sexual en las plantas también puede depender del desarrollo reproductivo. Esto se puede observar en Cannabis sativa , un tipo de cáñamo, que tiene tasas de fotosíntesis más altas en los machos durante el crecimiento, pero tasas más altas en las hembras una vez que las plantas alcanzan la madurez sexual. [27]
Todas las especies de plantas vasculares que se reproducen sexualmente hasta nuestros días tienen una alternancia de generaciones; las plantas que vemos a nuestro alrededor generalmente son esporofitos diploides , pero sus descendientes no son las semillas que la gente comúnmente reconoce como la nueva generación. La semilla en realidad es la descendencia de la generación haploide de microgametofitos ( polen ) y megagametofitos (los sacos embrionarios en los óvulos ). En consecuencia, cada grano de polen puede considerarse una planta masculina por derecho propio; produce un espermatozoide y es radicalmente diferente de la planta femenina, el megagametofito que produce el gameto femenino. [ cita requerida ]
Insectos

Los insectos muestran una amplia variedad de dimorfismo sexual entre taxones, incluyendo tamaño, ornamentación y coloración. [28] El dimorfismo sexual de tamaño sesgado hacia las hembras observado en muchos taxones evolucionó a pesar de la intensa competencia entre machos por aparearse. [29] En Osmia rufa , por ejemplo, la hembra es más grande/ancha que los machos, con los machos midiendo entre 8 y 10 mm y las hembras entre 10 y 12 mm. [30] En el emperador almez, las hembras son igualmente más grandes que los machos. [31] La razón del dimorfismo sexual se debe a la masa de tamaño de provisión, en la que las hembras consumen más polen que los machos. [32]
En algunas especies, hay evidencia de dimorfismo masculino, pero parece ser por distinciones de roles. Esto se ve en la especie de abeja Macrotera portalis en la que hay un morfo de cabeza pequeña, capaz de volar, y un morfo de cabeza grande, incapaz de volar, para los machos. [33] Anthidium manicatum también muestra dimorfismo sexual con sesgo masculino. La selección de mayor tamaño en los machos en lugar de las hembras en esta especie puede haber resultado debido a su comportamiento territorial agresivo y el posterior éxito diferencial de apareamiento. [34] Otro ejemplo es Lasioglossum hemichalceum , que es una especie de abeja del sudor que muestra dimorfismos físicos drásticos entre las crías masculinas. [35] No todo dimorfismo tiene que tener una diferencia drástica entre los sexos. Andrena agilissima es una abeja minera donde las hembras solo tienen una cabeza ligeramente más grande que los machos. [36]
El uso de armas aumenta la aptitud física al aumentar el éxito en la competencia entre machos en muchas especies de insectos. [37] Los cuernos del escarabajo en Onthophagus taurus son crecimientos agrandados de la cabeza o el tórax que se expresan solo en los machos. Copris ochus también tiene un dimorfismo sexual y masculino distintivo en los cuernos de la cabeza. [38] Otro escarabajo con un dimorfismo sexual distintivo relacionado con los cuernos es Allomyrina dichotoma, también conocido como escarabajo rinoceronte japonés . [39] Estas estructuras son impresionantes debido a los tamaños exagerados. [40] Existe una correlación directa entre las longitudes de los cuernos de los machos y el tamaño corporal y un mayor acceso a parejas y aptitud física. [40] En otras especies de escarabajos, tanto los machos como las hembras pueden tener ornamentación como cuernos. [38] Generalmente, el dimorfismo sexual del tamaño (SSD) de los insectos dentro de las especies aumenta con el tamaño corporal. [41]
El dimorfismo sexual en los insectos también se manifiesta por el dicromatismo. En los géneros de mariposas Bicyclus y Junonia , los patrones de alas dimórficas evolucionaron debido a la expresión limitada por el sexo, que media el conflicto sexual intralocus y conduce a una mayor aptitud en los machos. [42] La naturaleza dicromática sexual de Bicyclus anynana se refleja en la selección femenina sobre la base de pupilas dorsales con manchas oculares que reflejan la radiación ultravioleta. [43] El azufre común también muestra dicromatismo sexual; los machos tienen alas amarillas e iridiscentes, mientras que las alas de las hembras son blancas y no iridiscentes. [44] La desviación seleccionada naturalmente en la coloración protectora de las hembras se muestra en mariposas miméticas. [45]
Arañas y canibalismo sexual

.jpg/440px-Hammock_Spiders_(Pityohyphantes).jpg)
Muchos grupos de arácnidos presentan dimorfismo sexual, [46] pero se estudia más ampliamente en las arañas. En la araña tejedora de orbes Zygiella x-notata , por ejemplo, las hembras adultas tienen un tamaño corporal mayor que los machos adultos. [47] El dimorfismo de tamaño muestra una correlación con el canibalismo sexual , [48] que es prominente en las arañas (también se encuentra en insectos como las mantis religiosas ). En la araña lobo dimórfica de tamaño Tigrosa helluo , las hembras con alimentos limitados canibalizan con mayor frecuencia. [49] Por lo tanto, existe un alto riesgo de baja aptitud para los machos debido al canibalismo precopulatorio, lo que llevó a la selección masculina de hembras más grandes por dos razones: mayor fecundidad y menores tasas de canibalismo. [49] Además, la fecundidad femenina se correlaciona positivamente con el tamaño corporal de la hembra y se selecciona el tamaño corporal femenino grande, lo que se observa en la familia Araneidae . Todas las especies de Argiope , incluida Argiope bruennichi , utilizan este método. Algunos machos desarrollaron ornamentación [ vago ] que incluye atar a la hembra con seda, tener patas proporcionalmente más largas, modificar la red de la hembra, aparearse mientras la hembra se alimenta o proporcionar un regalo nupcial en respuesta al canibalismo sexual. [49] El tamaño corporal del macho no está bajo selección debido al canibalismo en todas las especies de arañas, como Nephila pilipes , pero se selecciona de manera más prominente en especies de arañas menos dimórficas, que a menudo seleccionan un tamaño macho más grande. [50] En la especie Maratus volans , los machos son conocidos por su característico abanico colorido que atrae a las hembras durante el apareamiento. [51]
Pez
Los peces con aletas radiadas son una clase antigua y diversa, con el mayor grado de dimorfismo sexual de todas las clases animales. Fairbairn señala que "las hembras son generalmente más grandes que los machos, pero los machos suelen ser más grandes en especies en las que hay combates entre machos o cuidados paternales entre machos... [los tamaños varían] desde machos enanos hasta machos más de 12 veces más pesados que las hembras". [52] [ página necesaria ]
Hay casos en los que los machos son sustancialmente más grandes que las hembras. Un ejemplo es Lamprologus callipterus , un tipo de pez cíclido. En este pez, los machos se caracterizan por ser hasta 60 veces más grandes que las hembras. Se cree que el mayor tamaño del macho es ventajoso porque los machos recolectan y defienden las conchas vacías de los caracoles en cada una de las cuales una hembra se reproduce. [53] Los machos deben ser más grandes y más poderosos para poder recolectar las conchas más grandes. El tamaño corporal de la hembra debe seguir siendo pequeño porque para reproducirse, debe poner sus huevos dentro de las conchas vacías. Si crece demasiado, no cabrá en las conchas y no podrá reproducirse. El pequeño tamaño corporal de la hembra también es probablemente beneficioso para sus posibilidades de encontrar una concha desocupada. Las conchas más grandes, aunque preferidas por las hembras, a menudo tienen una disponibilidad limitada. [54] Por lo tanto, la hembra está limitada al crecimiento del tamaño de la concha y, de hecho, puede cambiar su tasa de crecimiento según la disponibilidad del tamaño de la concha. [55] En otras palabras, la capacidad del macho para recolectar conchas grandes depende de su tamaño. Cuanto más grande sea el macho, más grandes serán las conchas que puede recolectar. Esto permite que las hembras sean más grandes en su nido de cría, lo que hace que la diferencia entre los tamaños de los sexos sea menos sustancial. La competencia entre machos en esta especie de pez también selecciona el gran tamaño en los machos. Existe una competencia agresiva por parte de los machos por el territorio y el acceso a conchas más grandes. Los machos grandes ganan peleas y roban conchas a los competidores. Otro ejemplo es el dragonet , en el que los machos son considerablemente más grandes que las hembras y poseen aletas más largas.
El dimorfismo sexual también se presenta en peces hermafroditas. Estas especies se conocen como hermafroditas secuenciales . En los peces, las historias reproductivas a menudo incluyen el cambio de sexo de hembra a macho donde hay una fuerte conexión entre el crecimiento, el sexo de un individuo y el sistema de apareamiento dentro del cual opera. [56] En los sistemas de apareamiento protóginos donde los machos dominan el apareamiento con muchas hembras, el tamaño juega un papel significativo en el éxito reproductivo masculino. [57] Los machos tienen una propensión a ser más grandes que las hembras de una edad comparable, pero no está claro si el aumento de tamaño se debe a un brote de crecimiento en el momento de la transición sexual o debido a la historia de crecimiento más rápido en los individuos que cambian de sexo. [58] Los machos más grandes pueden sofocar el crecimiento de las hembras y controlar los recursos ambientales. [ cita requerida ]
La organización social desempeña un papel importante en el cambio de sexo de los peces. A menudo se observa que un pez cambia de sexo cuando no hay un macho dominante dentro de la jerarquía social. Las hembras que cambian de sexo suelen ser aquellas que consiguen y conservan una ventaja de tamaño inicial en etapas tempranas de la vida. En cualquier caso, las hembras que cambian de sexo a machos son más grandes y suelen ser un buen ejemplo de dimorfismo.
En otros casos, los machos sufren cambios notables en el tamaño corporal y las hembras sufren cambios morfológicos que solo se pueden ver en el interior del cuerpo. Por ejemplo, en el salmón rojo , los machos desarrollan un mayor tamaño corporal en la madurez, incluido un aumento en la profundidad corporal, la altura de la joroba y la longitud del hocico. Las hembras experimentan cambios menores en la longitud del hocico, pero la diferencia más notable es el enorme aumento en el tamaño de las gónadas , que representan aproximadamente el 25% de la masa corporal. [59]
Se observó selección sexual para la ornamentación femenina en Gobiusculus flavescens , conocidos como gobios de dos manchas. [60] Las hipótesis tradicionales sugieren que la competencia entre machos impulsa la selección. Sin embargo, la selección para la ornamentación dentro de esta especie sugiere que los rasgos femeninos llamativos pueden seleccionarse a través de la competencia entre hembras o la elección de pareja del macho. [60] Dado que la ornamentación basada en carotenoides sugiere calidad de pareja, las hembras de guppies de dos manchas que desarrollan vientres anaranjados coloridos durante la temporada de reproducción se consideran favorables para los machos. [61] Los machos invierten mucho en la descendencia durante la incubación, lo que conduce a la preferencia sexual por las hembras coloridas debido a la mayor calidad de los huevos. [61]
Anfibios y reptiles no aviares
_female_&_male.jpg/440px-Mississippi_map_turtles_(Graptemys_pseudogeographica_kohni)_female_&_male.jpg)
En los anfibios y reptiles, el grado de dimorfismo sexual varía ampliamente entre los grupos taxonómicos . El dimorfismo sexual en anfibios y reptiles puede reflejarse en cualquiera de los siguientes aspectos: anatomía; longitud relativa de la cola; tamaño relativo de la cabeza; tamaño general como en muchas especies de víboras y lagartijas ; coloración como en muchos anfibios , serpientes y lagartijas, así como en algunas tortugas ; un adorno como en muchos tritones y lagartijas; la presencia de un comportamiento específico relacionado con el sexo es común a muchos lagartos; y cualidades vocales que se observan con frecuencia en las ranas . [ cita requerida ]
Los lagartos anolis muestran un dimorfismo de tamaño prominente, siendo los machos típicamente significativamente más grandes que las hembras. Por ejemplo, el Anolis sagrei macho promedio fue de 53,4 mm contra 40 mm en las hembras. [62] Los diferentes tamaños de las cabezas en los anolis se han explicado por diferencias en la vía del estrógeno. [63] El dimorfismo sexual en los lagartos generalmente se atribuye a los efectos de la selección sexual, pero otros mecanismos, incluyendo la divergencia ecológica y la selección de la fecundidad, proporcionan explicaciones alternativas. [64] El desarrollo del dimorfismo de color en los lagartos es inducido por cambios hormonales al inicio de la madurez sexual, como se ve en Psamodromus algirus , Sceloporus gadoviae y S. undulates erythrocheilus . [64] El dimorfismo sexual en tamaño también se ve en especies de ranas como P. bibroni i .
Los machos de lagarto dragón pintado, Ctenophorus pictus , son muy llamativos en su coloración reproductiva, pero el color del macho disminuye con la edad . La coloración del macho parece reflejar una capacidad antioxidante innata que protege contra el daño oxidativo del ADN . [65] La coloración reproductiva del macho es probablemente un indicador para las hembras del nivel subyacente de daño oxidativo del ADN (un componente significativo del envejecimiento) en las parejas potenciales. [65]
Pájaros





Se han propuesto posibles mecanismos para explicar la macroevolución del dimorfismo sexual de tamaño en las aves. Estos incluyen la selección sexual, la selección para la fecundidad en las hembras, la divergencia de nicho entre los sexos y la alometría, pero su importancia relativa aún no se entiende completamente. [66] [67] El dimorfismo sexual en las aves se puede manifestar en diferencias de tamaño o plumaje entre los sexos. El dimorfismo sexual de tamaño varía entre taxones, siendo los machos típicamente más grandes, aunque este no es siempre el caso, por ejemplo, las aves rapaces , los colibríes y algunas especies de aves no voladoras. [68] [69] El dimorfismo del plumaje, en forma de ornamentación o coloración, también varía, aunque los machos son típicamente el sexo más ornamentado o de colores brillantes. [70] Tales diferencias se han atribuido a las contribuciones reproductivas desiguales de los sexos. [71] Esta diferencia produce una elección femenina más fuerte ya que tienen más riesgo en producir descendencia. En algunas especies, la contribución del macho a la reproducción termina en la cópula, mientras que en otras especies el macho se convierte en el cuidador principal (o único). Los polimorfismos del plumaje han evolucionado para reflejar estas diferencias y otras medidas de aptitud reproductiva, como la condición corporal [72] o la supervivencia. [73] El fenotipo masculino envía señales a las hembras, que luego eligen al macho "más apto" disponible.
El dimorfismo sexual es un producto tanto de la genética como de factores ambientales. Un ejemplo de polimorfismo sexual determinado por las condiciones ambientales existe en el hada de espalda roja . Los machos de hada de espalda roja pueden clasificarse en tres categorías durante la temporada de reproducción : reproductores negros, reproductores marrones y auxiliares marrones. [72] Estas diferencias surgen en respuesta a la condición corporal del ave: si están saludables producirán más andrógenos convirtiéndose así en reproductores negros, mientras que las aves menos saludables producirán menos andrógenos y se convertirán en auxiliares marrones. [72] El éxito reproductivo del macho está determinado por su éxito durante la temporada no reproductiva de cada año, lo que hace que el éxito reproductivo varíe con las condiciones ambientales de cada año.
Los patrones y comportamientos migratorios también influyen en los dimorfismos sexuales. Este aspecto también se remonta al dimorfismo de tamaño en las especies. Se ha demostrado que los machos más grandes son mejores para hacer frente a las dificultades de la migración y, por lo tanto, tienen más éxito en la reproducción cuando llegan al destino de reproducción. [74] Al considerar esto desde un punto de vista evolutivo, entran en consideración muchas teorías y explicaciones. Si estos son los resultados para cada migración y temporada de reproducción, los resultados esperados deberían ser un cambio hacia una población de machos más grande mediante la selección sexual. La selección sexual es fuerte cuando también se introduce el factor de selección ambiental. La selección ambiental puede apoyar un tamaño de polluelo más pequeño si estos polluelos nacieron en un área que les permitió crecer hasta un tamaño mayor, incluso aunque en condiciones normales no podrían alcanzar este tamaño óptimo para la migración. Cuando el entorno ofrece ventajas y desventajas de este tipo, la fuerza de la selección se debilita y las fuerzas ambientales adquieren un mayor peso morfológico. El dimorfismo sexual también podría producir un cambio en el momento de la migración que conduce a diferencias en el éxito de apareamiento dentro de la población de aves. [75] Cuando el dimorfismo produce una variación tan grande entre los sexos y entre los miembros de los sexos, pueden tener lugar múltiples efectos evolutivos. Este momento podría incluso conducir a un fenómeno de especiación si la variación se vuelve fuertemente drástica y favorable hacia dos resultados diferentes. El dimorfismo sexual se mantiene por las presiones contrarrestantes de la selección natural y la selección sexual. Por ejemplo, el dimorfismo sexual en la coloración aumenta la vulnerabilidad de las especies de aves a la depredación por parte de los gavilanes europeos en Dinamarca. [76] Presumiblemente, el aumento del dimorfismo sexual significa que los machos son más brillantes y más llamativos, lo que lleva a un aumento de la depredación. [76] Además, la producción de adornos más exagerados en los machos puede tener el costo de la función inmune suprimida. [72] Siempre que los beneficios reproductivos del rasgo debido a la selección sexual sean mayores que los costos impuestos por la selección natural, entonces el rasgo se propagará por toda la población. Los beneficios reproductivos surgen en forma de un mayor número de crías, mientras que la selección natural impone costos en forma de supervivencia reducida. Esto significa que, incluso si el rasgo hace que los machos mueran antes, el rasgo sigue siendo beneficioso siempre que los machos con el rasgo produzcan más crías que los machos que carecen del rasgo. Este equilibrio mantiene vivo el dimorfismo en estas especies y garantiza que la próxima generación de machos exitosos también exhibirá estos rasgos que resultan atractivos para las hembras.
Estas diferencias en la forma y los roles reproductivos a menudo causan diferencias en el comportamiento. Como se dijo anteriormente, los machos y las hembras a menudo tienen diferentes roles en la reproducción. El comportamiento de cortejo y apareamiento de machos y hembras están regulados en gran medida por hormonas a lo largo de la vida de un ave. [77] Las hormonas de activación ocurren durante la pubertad y la adultez y sirven para "activar" ciertos comportamientos cuando es apropiado, como la territorialidad durante la temporada de reproducción. [77] Las hormonas organizativas ocurren solo durante un período crítico temprano en el desarrollo, ya sea justo antes o justo después de la eclosión en la mayoría de las aves, y determinan patrones de comportamiento para el resto de la vida del ave. [77] Estas diferencias de comportamiento pueden causar sensibilidades desproporcionadas a las presiones antropogénicas. [78] Las hembras de la codorniz norteña en Suiza se reproducen en pastizales intensamente manejados. [78] La cosecha temprana de los pastos durante la temporada de reproducción conduce a más muertes de hembras. [78] Las poblaciones de muchas aves a menudo están sesgadas hacia los machos y cuando las diferencias sexuales en el comportamiento aumentan esta proporción, las poblaciones disminuyen a un ritmo más rápido. [78] Además, no todos los rasgos dimórficos masculinos se deben a hormonas como la testosterona, sino que son una parte natural del desarrollo, por ejemplo, el plumaje. [79] Además, la fuerte influencia hormonal en las diferencias fenotípicas sugiere que el mecanismo genético y la base genética de estos rasgos sexualmente dimórficos pueden involucrar factores de transcripción o cofactores en lugar de secuencias reguladoras. [80]
El dimorfismo sexual también puede influir en las diferencias en la inversión parental durante épocas de escasez de alimentos. Por ejemplo, en el piquero patiazul , los polluelos hembra crecen más rápido que los machos, lo que da como resultado que los padres piqueros produzcan el sexo más pequeño, los machos, durante épocas de escasez de alimentos. Esto luego da como resultado la maximización del éxito reproductivo de por vida de los padres. [81] En las agujas colinegras Limosa limosa limosa, las hembras también son el sexo más grande, y las tasas de crecimiento de los polluelos hembras son más susceptibles a condiciones ambientales limitadas. [82]
El dimorfismo sexual también puede aparecer solo durante la temporada de apareamiento; algunas especies de aves solo muestran rasgos dimórficos en la variación estacional. Los machos de estas especies mudarán su color a un tono menos brillante o menos exagerado durante la temporada de apareamiento. [80] Esto ocurre porque la especie está más centrada en la supervivencia que en la reproducción, lo que provoca un cambio hacia un estado menos ornamentado. [ dudoso – discutir ]
En consecuencia, el dimorfismo sexual tiene ramificaciones importantes para la conservación. Sin embargo, el dimorfismo sexual no solo se encuentra en las aves y, por lo tanto, es importante para la conservación de muchos animales. Tales diferencias en la forma y el comportamiento pueden conducir a la segregación sexual , definida como diferencias sexuales en el uso del espacio y los recursos. [83] La mayoría de las investigaciones sobre la segregación sexual se han realizado en ungulados, [83] pero dicha investigación se extiende a los murciélagos , [84] canguros , [85] y aves. [86] Incluso se han sugerido planes de conservación específicos para cada sexo para especies con segregación sexual pronunciada. [84]
El término sesquimorfismo (el prefijo numeral latino sesqui - significa uno y medio, por lo que está a medio camino entre mono - (uno) y di - (dos)) se ha propuesto para las especies de aves en las que "ambos sexos tienen básicamente el mismo patrón de plumaje, aunque la hembra es claramente distinguible por su color más pálido o descolorido ". [87] : 14 Los ejemplos incluyen al gorrión del Cabo ( Passer melanurus ), [87] : 67 gorrión rufo (subespecie P. motinensis motinensis ), [87] : 80 y el gorrión saxaul ( P. ammodendri ). [87] : 245
Dinosaurios no aviares
El examen de fósiles de dinosaurios no aviares en busca de características sexualmente dimórficas requiere el suministro de restos óseos y tisulares completos y articulados. Como organismos terrestres, los cadáveres de dinosaurios están sujetos a influencias ecológicas y geográficas que inevitablemente constituyen el grado de conservación. La disponibilidad de restos bien conservados no es un resultado probable como consecuencia de la descomposición y la fosilización . Algunos paleontólogos han buscado dimorfismo sexual entre los dinosaurios utilizando estadísticas y comparaciones con animales modernos relacionados ecológica o filogenéticamente .
Apatosaurus y Diplodocus
Las hembras de Apatosaurus y Diplodocus tenían vértebras caudales interconectadas que les permitían mantener la cola elevada para facilitar la cópula. El descubrimiento de que esta fusión se producía solo en el 50% de los esqueletos de Apatosaurus y Diplodocus y en el 25% de los esqueletos de Camarasaurus indicó que se trata de un rasgo sexualmente dimórfico.
Terópodos
Se ha planteado la hipótesis de que los terópodos machos poseían un pene retráctil, una característica similar a la de los cocodrilos actuales . Se examinaron los esqueletos de los cocodrilos para determinar si existe un componente esquelético distintivo entre ambos sexos, para ayudar a proporcionar una idea de las disparidades físicas entre los terópodos machos y hembras. Los hallazgos revelaron que los chevrones caudales de los cocodrilos machos, utilizados para sujetar los músculos del pene, eran significativamente más grandes que los de las hembras. Ha habido críticas a estos hallazgos, pero sigue siendo un tema de debate entre los defensores y los adversarios. [ cita requerida ]
Ornitópodos
Los estudios sobre el dimorfismo sexual en los hadrosáuridos se han centrado generalmente en las distintivas crestas craneales , que probablemente cumplían una función en la exhibición sexual. Un estudio biométrico de 36 cráneos descubrió que el dimorfismo sexual se exhibía en la cresta de 3 especies de hadrosáuridos. Las crestas se podían clasificar como completas (machos) o estrechas (hembras) y podrían haber proporcionado alguna ventaja en la competencia intrasexual por el apareamiento.
Ceratopsianos
Según Scott D. Sampson, si los ceratópsidos exhibieran dimorfismo sexual, los análogos ecológicos modernos sugieren que se encontraría en estructuras de exhibición, como cuernos y volantes. No se conoce evidencia convincente de dimorfismo sexual en tamaño corporal o señales de apareamiento en ceratópsidos, aunque hay evidencia de que el ceratópsido más primitivo Protoceratopsian andrewsi poseía sexos que se distinguían según el tamaño del volante y la prominencia nasal. Esto es consistente con otros grupos de tetrápodos conocidos donde los animales de tamaño mediano tienden a exhibir marcadamente más dimorfismo sexual que los más grandes. Sin embargo, se ha propuesto que estas diferencias pueden explicarse mejor por variación intraespecífica y ontogénica en lugar de dimorfismo sexual. [88] Además, muchos rasgos sexualmente dimórficos que pueden haber existido en ceratópsidos incluyen variaciones de tejidos blandos como coloración o papada , que sería poco probable que se hayan conservado en el registro fósil.
Estegosaurios
Un estudio de 2015 sobre especímenes de Hesperosaurus mjosi encontró evidencia de dimorfismo sexual en la forma de las placas dérmicas. Se describieron dos formas de placa: una era corta, ancha y ovalada, la otra más alta y más estrecha. [89] [90]
Mamíferos
En una gran proporción de especies de mamíferos, los machos son más grandes que las hembras. Tanto los genes como las hormonas afectan la formación de muchos cerebros animales antes del " nacimiento " (o eclosión ), y también el comportamiento de los individuos adultos. Las hormonas afectan significativamente la formación del cerebro humano, y también el desarrollo cerebral en la pubertad. Una revisión de 2004 en Nature Reviews Neuroscience observó que "como es más fácil manipular los niveles hormonales que la expresión de los genes de los cromosomas sexuales, los efectos de las hormonas se han estudiado mucho más extensamente, y se comprenden mucho mejor, que las acciones directas en el cerebro de los genes de los cromosomas sexuales". Concluyó que si bien "los efectos diferenciadores de las secreciones gonadales parecen ser dominantes", el conjunto de investigaciones existentes "apoya la idea de que las diferencias sexuales en la expresión neuronal de los genes X e Y contribuyen significativamente a las diferencias sexuales en las funciones cerebrales y las enfermedades". [91]
Pinnípedos

Los mamíferos marinos muestran algunas de las mayores diferencias de tamaño sexual de los mamíferos, debido a la selección sexual y a factores ambientales como el lugar de reproducción. [92] El sistema de apareamiento de los pinnípedos varía desde la poligamia hasta la monogamia en serie . Los pinnípedos son conocidos por su crecimiento diferencial temprano y su inversión materna, ya que los únicos nutrientes para las crías recién nacidas son la leche proporcionada por la madre. [93] Por ejemplo, los machos son significativamente más grandes (alrededor de un 10% más pesados y un 2% más largos) que las hembras al nacer en las crías de león marino. [94] El patrón de inversión diferencial puede variar principalmente de forma prenatal y postnatal. [95] Mirounga leonina , el elefante marino del sur , es uno de los mamíferos más dimórficos. [96]
Primates
Humanos
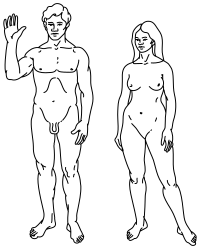 | |
 |  |
Arriba: Ilustración estilizada de humanos en la placa de Pioneer , que muestra tanto a un hombre (izquierda) como a una mujer (derecha). | |
Según Clark Spencer Larsen, el Homo sapiens actual muestra una gama de dimorfismo sexual, con una masa corporal promedio entre los sexos que difiere aproximadamente en un 15%. [97] Un debate sustancial en la literatura académica considera las posibles ventajas evolutivas asociadas con la competencia sexual (tanto intrasexual como intersexual), así como las estrategias sexuales a corto y largo plazo. [98] Según Daly y Wilson, "Los sexos difieren más en los seres humanos que en los mamíferos monógamos, pero mucho menos que en los mamíferos extremadamente polígamos". [99]
La tasa metabólica basal promedio es aproximadamente un 6 por ciento más alta en los adolescentes varones que en las mujeres y aumenta a aproximadamente un 10 por ciento más alta después de la pubertad. Las mujeres tienden a convertir más alimentos en grasa , mientras que los hombres convierten más en músculo y reservas de energía circulante desechables. Según Tim Hewett, director de investigación en el departamento de medicina deportiva en el Centro Médico Wexner de la Universidad Estatal de Ohio , las mujeres tienen, en promedio, un 50-60% de la fuerza del cuerpo superior de los hombres, y un 80-90% de la fuerza del cuerpo inferior de los hombres, en relación con el tamaño corporal, pero las mujeres tienen mayor resistencia que los hombres. [100]
La diferencia de fuerza en relación con la masa corporal es menos pronunciada en individuos entrenados. En el levantamiento de pesas olímpico, los récords masculinos varían de 5,5× masa corporal en la categoría de peso más baja a 4,2× en la categoría de peso más alta, mientras que los récords femeninos varían de 4,4× a 3,8×, una diferencia ajustada al peso de solo el 10-20%, y una diferencia absoluta de aproximadamente el 30% (es decir, 492 kg frente a 348 kg para categorías de peso ilimitadas; consulte los récords de levantamiento de pesas olímpico ). Un estudio, realizado mediante el análisis de las clasificaciones mundiales anuales de 1980 a 1996, encontró que los tiempos de carrera de los hombres fueron, en promedio, un 10% más rápidos que los de las mujeres. [101]
En la adolescencia temprana, las mujeres son en promedio más altas que los hombres (ya que las mujeres tienden a atravesar la pubertad antes ), pero los hombres, en promedio, las superan en altura en la adolescencia posterior y la edad adulta. En los Estados Unidos, los hombres adultos son en promedio un 9% más altos [102] y un 16,5% más pesados [103] que las mujeres adultas.
Los hombres suelen tener tráqueas y bronquios ramificados más grandes , con un volumen pulmonar aproximadamente un 30 por ciento mayor por masa corporal . En promedio, los hombres tienen corazones más grandes , un recuento de glóbulos rojos un 10 por ciento más alto , mayor hemoglobina y, por lo tanto, mayor capacidad de transporte de oxígeno. También tienen factores de coagulación circulantes más altos ( vitamina K , protrombina y plaquetas ) . Estas diferencias conducen a una curación más rápida de las heridas y una menor sensibilidad al dolor nervioso después de una lesión. [104] En los hombres, la lesión que causa dolor en el nervio periférico ocurre a través de la microglia , mientras que en las mujeres ocurre a través de las células T (excepto en las mujeres embarazadas, que siguen un patrón masculino). [105]
Las hembras suelen tener más glóbulos blancos (almacenados y circulantes), así como más granulocitos y linfocitos B y T. Además, producen más anticuerpos a un ritmo más rápido que los machos, por lo que desarrollan menos enfermedades infecciosas y sucumben durante períodos más cortos. [104] Los etólogos sostienen que las hembras, al interactuar con otras hembras y múltiples crías en grupos sociales, han experimentado estos rasgos como una ventaja selectiva . [106] [107] [108] [109] [110] [ citas excesivas ] Las hembras tienen una mayor sensibilidad al dolor debido a las diferencias nerviosas antes mencionadas que aumentan la sensación, y por lo tanto las hembras requieren niveles más altos de analgésicos después de una lesión. [105] Los cambios hormonales en las hembras afectan la sensibilidad al dolor, y las mujeres embarazadas tienen la misma sensibilidad que los machos. La tolerancia al dolor agudo también es más constante a lo largo de la vida en las mujeres que en los hombres, a pesar de estos cambios hormonales. [111] A pesar de las diferencias en la sensación física, ambos sexos tienen una tolerancia psicológica similar al dolor (o la capacidad de afrontarlo e ignorarlo). [112]
En el cerebro humano , se observó una diferencia entre sexos en la transcripción del par de genes PCDH11X /Y exclusivo del Homo sapiens . [113] La diferenciación sexual en el cerebro humano a partir del estado indiferenciado se desencadena por la testosterona del testículo fetal. La testosterona se convierte en estrógeno en el cerebro a través de la acción de la enzima aromatasa. La testosterona actúa en muchas áreas del cerebro, incluido el SDN-POA , para crear el patrón cerebral masculinizado. [114] Los cerebros de las mujeres embarazadas que llevan fetos masculinos pueden estar protegidos de los efectos masculinizantes de los andrógenos a través de la acción de la globulina transportadora de hormonas sexuales . [115]
La relación entre las diferencias sexuales en el cerebro y el comportamiento humano es un tema de controversia en la psicología y la sociedad en general. [116] [117] Muchas mujeres tienden a tener una mayor proporción de materia gris en el hemisferio izquierdo del cerebro en comparación con los hombres. [118] [119] Los hombres en promedio tienen cerebros más grandes que las mujeres; sin embargo, cuando se ajusta al volumen cerebral total, las diferencias de materia gris entre sexos son casi inexistentes. Por lo tanto, el porcentaje de materia gris parece estar más relacionado con el tamaño del cerebro que con el sexo. [120] [121] Las diferencias en la fisiología cerebral entre sexos no necesariamente se relacionan con diferencias en el intelecto. Haier et al. encontraron en un estudio de 2004 que "los hombres y las mujeres aparentemente logran resultados de CI similares con diferentes regiones cerebrales, lo que sugiere que no hay una estructura neuroanatómica subyacente singular para la inteligencia general y que diferentes tipos de diseños cerebrales pueden manifestar un rendimiento intelectual equivalente". [122] (Ver el artículo sobre sexo e inteligencia para más información sobre este tema.) Un análisis gráfico-teórico estricto de las conexiones cerebrales humanas reveló [123] que en numerosos parámetros gráfico-teóricos (por ejemplo, ancho mínimo de bipartición, número de aristas, propiedad gráfica expansora , cobertura mínima de vértices ), el conectoma estructural de las mujeres está significativamente "mejor" conectado que el conectoma de los hombres. Se demostró [124] que las diferencias gráfico-teóricas se deben al sexo y no a las diferencias en el volumen cerebral, al analizar los datos de 36 mujeres y 36 hombres, donde el volumen cerebral de cada hombre en el grupo era menor que el volumen cerebral de cada mujer en el grupo.
El dimorfismo sexual también se ha descrito a nivel genético y se ha demostrado que se extiende a partir de los cromosomas sexuales. En total, se ha descubierto que unos 6500 genes tienen una expresión diferencial según el sexo en al menos un tejido. Muchos de estos genes no están directamente asociados con la reproducción, sino más bien vinculados a características biológicas más generales. Además, se ha demostrado que los genes con expresión específica según el sexo sufren una menor eficiencia de selección, lo que conduce a frecuencias más altas de mutaciones deletéreas en la población y contribuye a la prevalencia de varias enfermedades humanas. [125] [126]
Función inmunológica
El dimorfismo sexual en la función inmunológica es un patrón común en los vertebrados y también en varios invertebrados. En la mayoría de los casos, las hembras son más "inmunocompetentes" que los machos. Este rasgo no es uniforme en todos los animales, sino que difiere según la taxonomía; los sistemas inmunológicos más favorecidos por las hembras se encuentran en los insectos. [127] En los mamíferos, esto da como resultado infecciones más frecuentes y graves en los machos y tasas más altas de trastornos autoinmunes en las hembras. Una posible causa puede ser las diferencias en la expresión genética de las células inmunes entre los sexos. [128] Otra explicación es que las diferencias endocrinológicas entre los sexos afectan al sistema inmunológico; por ejemplo, la testosterona actúa como un agente inmunosupresor. [129]
Células
Las diferencias fenotípicas entre sexos son evidentes incluso en células cultivadas de tejidos. [130] Por ejemplo, las células madre derivadas de músculos femeninos tienen una mejor eficiencia de regeneración muscular que las masculinas. [131] Hay informes de varias diferencias metabólicas entre células masculinas y femeninas [132] y también responden al estrés de manera diferente. [133]
Ventajoso desde el punto de vista reproductivo
En teoría, las hembras más grandes se ven favorecidas por la competencia por las parejas, especialmente en las especies polígamas. Las hembras más grandes ofrecen una ventaja en la fertilidad, ya que las demandas fisiológicas de la reproducción son limitantes en las hembras. Por lo tanto, existe una expectativa teórica de que las hembras tienden a ser más grandes en las especies que son monógamas. Las hembras son más grandes en muchas especies de insectos , muchas arañas , muchos peces , muchos reptiles, búhos , aves rapaces y ciertos mamíferos como la hiena moteada y las ballenas barbadas como la ballena azul . Como ejemplo, en algunas especies, las hembras son sedentarias, por lo que los machos deben buscarlas. Fritz Vollrath y Geoff Parker argumentan que esta diferencia en el comportamiento conduce a presiones de selección radicalmente diferentes en los dos sexos, evidentemente favoreciendo a los machos más pequeños. [134] También se han estudiado casos en los que el macho es más grande que la hembra, [134] y requieren explicaciones alternativas.
Un ejemplo de este tipo de dimorfismo sexual en tamaño es el murciélago Myotis nigricans , (murciélago myotis negro) donde las hembras son sustancialmente más grandes que los machos en términos de peso corporal, medida del cráneo y longitud del antebrazo. [135] La interacción entre los sexos y la energía necesaria para producir crías viables hace que sea favorable que las hembras sean más grandes en esta especie. Las hembras soportan el coste energético de producir óvulos, que es mucho mayor que el coste de producir esperma por parte de los machos. La hipótesis de la ventaja de la fecundidad establece que una hembra más grande es capaz de producir más crías y darles condiciones más favorables para asegurar su supervivencia; esto es cierto para la mayoría de los ectotérmicos. Una hembra más grande puede proporcionar cuidados parentales durante más tiempo mientras la cría madura. Los períodos de gestación y lactancia son bastante largos en M. nigricans , las hembras amamantan a sus crías hasta que alcanzan casi el tamaño adulto. [136] No podrían volar y atrapar presas si no compensaran la masa adicional de la cría durante este tiempo. El tamaño más pequeño de los machos puede ser una adaptación para aumentar la maniobrabilidad y la agilidad, lo que les permite competir mejor con las hembras por el alimento y otros recursos.

Algunas especies de rape también muestran un dimorfismo sexual extremo. Las hembras tienen una apariencia más típica de otros peces, mientras que los machos son diminutas criaturas rudimentarias con sistemas digestivos atrofiados. Un macho debe encontrar una hembra y fusionarse con ella: entonces vive como parásito, convirtiéndose en poco más que un cuerpo productor de esperma en lo que equivale a un organismo compuesto efectivamente hermafrodita. Una situación similar se encuentra en la chinche de agua de Zeus Phoreticovelia disparata , donde la hembra tiene un área glandular en su espalda que puede servir para alimentar a un macho, que se adhiere a ella (aunque los machos pueden sobrevivir lejos de las hembras, generalmente no viven en libertad). [137] Esto se lleva al extremo lógico en los crustáceos Rhizocephala , como Sacculina , donde el macho se inyecta en el cuerpo de la hembra y se convierte en nada más que células productoras de esperma, hasta el punto de que el superorden solía confundirse con hermafrodita. [138]
Algunas especies de plantas también presentan dimorfismo en el que las hembras son significativamente más grandes que los machos, como en el musgo Dicranum [139] y la hepática Sphaerocarpos . [140] Hay alguna evidencia de que, en estos géneros, el dimorfismo puede estar ligado a un cromosoma sexual, [140] [141] o a la señalización química de las hembras. [142]
Otro ejemplo complicado de dimorfismo sexual se da en Vespula squamosa , la avispa chaqueta amarilla del sur. En esta especie de avispa, las obreras hembras son las más pequeñas, los machos son ligeramente más grandes y las reinas hembras son significativamente más grandes que las obreras hembras y los machos. [ cita requerida ]
Evolución

En 1871, Charles Darwin propuso la teoría de la selección sexual , que relacionaba el dimorfismo sexual con la selección sexual . [144]
El primer paso hacia el dimorfismo sexual es la diferenciación de tamaño de los espermatozoides y los óvulos ( anisogamia ). [145] [146] [147] [148] : 917 La anisogamia y el número generalmente grande de gametos masculinos pequeños en relación con los gametos femeninos más grandes generalmente se encuentran en el desarrollo de una fuerte competencia espermática , [149] [150] porque los espermatozoides pequeños permiten a los organismos producir una gran cantidad de espermatozoides y hacen que los machos (o la función masculina de los hermafroditas [151] ) sean más redundantes.
Las algas volvocinas han sido útiles para comprender la evolución del dimorfismo sexual [152] y especies como el escarabajo C. maculatus , donde las hembras son más grandes que los machos, se utilizan para estudiar sus mecanismos genéticos subyacentes. [153]
En muchas especies no monógamas, el beneficio para la aptitud reproductiva de un macho al aparearse con múltiples hembras es grande, mientras que el beneficio para la aptitud reproductiva de una hembra al aparearse con múltiples machos es pequeño o inexistente. [154] En estas especies, existe una presión selectiva para cualquier característica que permita a un macho tener más apareamientos. Por lo tanto, el macho puede llegar a tener características diferentes de las de la hembra.

Estos rasgos podrían ser aquellos que le permiten luchar contra otros machos por el control del territorio o de un harén , como el gran tamaño o las armas; [155] o podrían ser rasgos que las hembras, por cualquier razón, prefieren en sus parejas. [156] La competencia entre machos no plantea preguntas teóricas profundas [157] pero la elección de pareja sí.
Las hembras pueden elegir machos que parezcan fuertes y saludables, y por lo tanto probablemente posean "buenos alelos " y den lugar a crías sanas. [158] En algunas especies, sin embargo, las hembras parecen elegir machos con rasgos que no mejoran las tasas de supervivencia de la descendencia, e incluso rasgos que la reducen (lo que potencialmente conduce a rasgos como la cola del pavo real). [157] Dos hipótesis para explicar este hecho son la hipótesis del hijo sexy y el principio de handicap .
La hipótesis del hijo sexy plantea que las hembras pueden elegir inicialmente un rasgo porque mejora la supervivencia de sus crías, pero una vez que esta preferencia se ha generalizado, las hembras deben seguir eligiendo el rasgo, incluso si se vuelve perjudicial. Las que no lo hagan tendrán hijos que no resultarán atractivos para la mayoría de las hembras (ya que la preferencia está generalizada) y, por lo tanto, recibirán pocos apareamientos. [159]
El principio de la desventaja establece que un macho que sobrevive a pesar de poseer algún tipo de desventaja demuestra que el resto de sus genes son “alelos buenos”. Si los machos con “alelos malos” no pudieran sobrevivir a la desventaja, las hembras podrían evolucionar para elegir machos con este tipo de desventaja; el rasgo actúa como una señal de aptitud difícil de falsificar. [160]
Véase también
Referencias
- ^ Enciclopedia del comportamiento animal. Vol. 2. Academic Press. 21 de enero de 2019. pág. 7. ISBN 978-0-12-813252-4.
- ^ Ralls K, Mesnick S (2009). "Dimorfismo sexual". Academic Press . 1 (1): 1005–1011. doi :10.1016/B978-0-12-373553-9.00233-9. ISBN 9780123735539.
- ^ "Diccionario de la evolución humana y la biología". Human-biology.key-spot.ru . Archivado desde el original el 7 de noviembre de 2017 . Consultado el 3 de noviembre de 2017 .
- ^ Armenta JK, Dunn PO, Whittingham LA (agosto de 2008). "Cuantificación del dicromatismo sexual aviar: una comparación de métodos". The Journal of Experimental Biology . 211 (Pt 15): 2423–30. doi : 10.1242/jeb.013094 . PMID 18626076.
- ^ Andersson 1994, pág. 8
- ^ Zahavi A (septiembre de 1975). «Mate selection-a selection for a handicap» (PDF) . Journal of Theoretical Biology . 53 (1): 205–14. Bibcode :1975JThBi..53..205Z. CiteSeerX 10.1.1.586.3819 . doi :10.1016/0022-5193(75)90111-3. PMID 1195756. Archivado desde el original (PDF) el 10 de agosto de 2017. Consultado el 14 de mayo de 2011 .
- ^ ab Zi J, Yu X, Li Y, Hu X, Xu C, Wang X, et al. (octubre de 2003). "Estrategias de coloración en plumas de pavo real". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (22): 12576–8. Bibcode :2003PNAS..10012576Z. doi : 10.1073/pnas.2133313100 . PMC 240659 . PMID 14557541.
- ^ "Aves del paraíso: reyes de la belleza". National Geographic Society. 19 de octubre de 2023. Consultado el 22 de noviembre de 2023 .
- ^ Slagsvold T, Lifjeld JT (1985). "Variación del color del plumaje del carbonero común Parus major en relación con el hábitat, la estación y la alimentación". Journal of Zoology . 206 (3): 321–328. doi :10.1111/j.1469-7998.1985.tb05661.x.
- ^ Bowmaker JK, Heath LA, Wilkie SE, Hunt DM (agosto de 1997). "Pigmentos visuales y gotitas de aceite de seis clases de fotorreceptores en las retinas de las aves". Vision Research . 37 (16): 2183–94. doi :10.1098/rspb.1998.0315. PMC 1688915 . PMID 9578901.
- ^ Bowmaker JK, Heath LA, Wilkie SE , Hunt DM (agosto de 1997). "Pigmentos visuales y gotitas de aceite de seis clases de fotorreceptores en las retinas de las aves". Vision Research . 37 (16): 2183–94. doi :10.1098/rspb.1998.0316. JSTOR 50814. PMC 1688906. PMID 9578901.
- ^ Senar JC, Figuerola J, Pascual J (febrero de 2002). "Los herrerillos azules de color amarillo brillante son mejores padres". Actas. Ciencias Biológicas . 269 (1488): 257–61. doi :10.1098/rspb.2001.1882. PMC 1690890. PMID 11839194 .
- ^ Johnsen A, Delhey K, Andersson S, Kempenaers B (junio de 2003). "Color del plumaje en polluelos de herrerillos azules: dicromatismo sexual, dependencia de la condición y efectos genéticos". Actas. Ciencias biológicas . 270 (1521): 1263–70. doi :10.1098/rspb.2003.2375. JSTOR 3558810. PMC 1691364. PMID 12816639 .
- ^ Lozano GA (1994). "Carotenoides, parásitos y selección sexual" (PDF) . Oikos . 70 (2): 309–311. Bibcode :1994Oikos..70..309L. doi :10.2307/3545643. JSTOR 3545643.
- ^ Donnellan, SC y Mahony, MJ (2004). Variabilidad morfológica, cromosómica y de alozimas en el grupo de especies Litoria lesueuri (Anura: Hylidae), incluida una descripción de una nueva especie. Revista australiana de zoología
- ^ Bell, RC y Zamudio, KR (2012). Dicromatismo sexual en ranas: selección natural, selección sexual y diversidad inesperada. Actas de la Royal Society B: Biological Sciences.
- ^ Ryan MJ, Rand AS (abril de 1993). "Reconocimiento de especies y selección sexual como un problema unitario en la comunicación animal". Evolución; Revista internacional de evolución orgánica . 47 (2): 647–657. doi :10.2307/2410076. JSTOR 2410076. PMID 28568715.
- ^ Rubolini D, Spina F, Saino N (2004). "Protandria y dimorfismo sexual en aves migratorias transsaharianas". Ecología del comportamiento . 15 (4): 592–601. CiteSeerX 10.1.1.498.7541 . doi :10.1093/beheco/arh048.
- ^ Short RV, Balaban E (4 de agosto de 1994). Las diferencias entre los sexos. Cambridge University Press. ISBN 9780521448789. Recuperado el 3 de noviembre de 2017 – vía Google Books.
- ^ Giacomello E, Marchini D, Rasotto MB (septiembre de 2006). "Un rasgo sexualmente dimórfico masculino proporciona antimicrobianos a los huevos de los peces blenio". Biology Letters . 2 (3): 330–3. doi :10.1098/rsbl.2006.0492. PMC 1686180 . PMID 17148395.
- ^ Renner SS, Ricklefs RE (1995). "Dioecia y sus correlatos en las plantas con flores". American Journal of Botany . 82 (5): 596–606. doi :10.2307/2445418. JSTOR 2445418.
- ^ Behnke H, Lüttge U, Esser K, Kadereit JW, Runge M (6 de diciembre de 2012). Progreso en botánica / Fortschritte der Botanik: Botánica estructural Fisiología Genética Taxonomía Geobotánica / Struktur Physiologie Genetik Systematik Geobotanik. Medios de ciencia y negocios de Springer. ISBN 978-3-642-79844-3.
- ^ Ramawat KG, Merillon JM, Shivanna KR (19 de abril de 2016). Biología reproductiva de las plantas. CRC Press. ISBN 978-1-4822-0133-8.
- ^ Romero GA, Nelson CE (junio de 1986). "Dimorfismo sexual en orquídeas Catasetum: emplazamiento forzado del polen y competencia por flores masculinas". Science . 232 (4757): 1538–40. Bibcode :1986Sci...232.1538R. doi :10.1126/science.232.4757.1538. JSTOR 1698050. PMID 17773505. S2CID 31296391.
- ^ "Hierba marina (también conocida como apio silvestre, hierba de cinta)". Universidad de Massachusetts . Archivado desde el original el 12 de julio de 2011.
- ^ Friedman J, Barrett SC (junio de 2009). "Vientos de cambio: nuevos conocimientos sobre la ecología y la evolución de la polinización y el apareamiento en plantas polinizadas por el viento". Anales de botánica . 103 (9): 1515–27. doi :10.1093/aob/mcp035. PMC 2701749 . PMID 19218583.
- ^ Geber MA (1999). Género y dimorfismo sexual en plantas con flores. Berlín: Springer. ISBN 978-3-540-64597-9.pág. 206
- ^ Bonduriansky R (enero de 2007). "La evolución del dimorfismo sexual dependiente de la condición". The American Naturalist . 169 (1): 9–19. doi :10.1086/510214. PMID 17206580. S2CID 17439073.
- ^ Barreto FS, Avise JC (agosto de 2011). "El sistema de apareamiento genético de una araña marina con dimorfismo sexual de tamaño con sesgo hacia los machos: evidencia de sesgo de paternidad a pesar del éxito de apareamiento aleatorio". Ecología del comportamiento y sociobiología . 65 (8): 1595–1604. Bibcode :2011BEcoS..65.1595B. doi :10.1007/s00265-011-1170-x. PMC 3134710 . PMID 21874083.
- ^ Gruber B, Eckel K, Everaars J, Dormann CF (30 de junio de 2011). "Sobre el manejo de la abeja albañil roja (Osmia bicornis) en los manzanos" (PDF) . Apidología . 42 (5): 564–576. doi :10.1007/s13592-011-0059-z. ISSN 0044-8435. S2CID 22935710.
- ^ "Asterocampa celtis (Boisduval & Leconte)". entnemdept.ufl.edu . Consultado el 15 de noviembre de 2017 .
- ^ Rust R, Torchio P, Trostle G (1989). "Embriogénesis tardía y desarrollo inmaduro de Osmia rufa cornigera (Rossi) (Hymenoptera: Megachilidae)". Apidologie . 20 (4): 359–367. doi : 10.1051/apido:19890408 .
- ^ Danforth B (1991). "La morfología y el comportamiento de los machos dimórficos en Perdita portalis (Hymenoptera: Andrenidae)". Ecología del comportamiento y sociobiología . 29 (4): 235–247. Bibcode :1991BEcoS..29..235D. doi :10.1007/bf00163980. S2CID 37651908.
- ^ Jaycox Elbert R (1967). "Comportamiento territorial entre machos de Anthidium Bamngense". Revista de la Sociedad Entomológica de Kansas . 40 (4): 565–570.
- ^ Kukuk PF (1 de octubre de 1996). "Dimorfismo masculino en Lasioglossum (Chilalictus) hemichalceum: el papel de la nutrición larval". Revista de la Sociedad Entomológica de Kansas . 69 (4): 147–157. JSTOR 25085712.
- ^ Paxton RJ, Giovanetti M, Andrietti F, Scamoni E, Scanni B (1 de octubre de 1999). "Apareamiento en una abeja comunal, Andrena agilissima (Hymenoptera Andrenidae)". Etología Ecología y Evolución . 11 (4): 371–382. Código Bib : 1999EtEcE..11..371P. doi :10.1080/08927014.1999.9522820. ISSN 0394-9370.
- ^ Wang MQ, Yang D (2005). "Dimorfismo sexual en insectos". Boletín Chino de Entomología . 42 : 721–725.
- ^ ab Sugiura S, Yamaura Y, Makihara H (noviembre de 2007). "Dimorfismo sexual y del cuerno masculino en Copris ochus (Coleoptera: Scarabaeidae)". Zoological Science . 24 (11): 1082–1085. doi : 10.2108/zsj.24.1082 . PMID 18348608. S2CID 34705415.
- ^ Hongo, Yoshihito (1 de diciembre de 2007). "Evolución de la alometría dimórfica masculina en una población del escarabajo cornudo japonés Trypoxylus dichotomus septentrionalis". Ecología del comportamiento y sociobiología . 62 (2): 245–253. Bibcode :2007BEcoS..62..245H. doi :10.1007/s00265-007-0459-2. ISSN 1432-0762.
- ^ ab Emlen DJ, Marangelo J, Ball B, Cunningham CW (mayo de 2005). "Diversidad en las armas de la selección sexual: evolución de los cuernos en el género de escarabajos Onthophagus (Coleoptera: Scarabaeidae)". Evolución; Revista internacional de evolución orgánica . 59 (5): 1060–1084. CiteSeerX 10.1.1.133.7557 . doi :10.1111/j.0014-3820.2005.tb01044.x. PMID 16136805. S2CID 221736269.
- ^ Teder, T., y Tammaru, T. (2005). "El dimorfismo sexual en cuanto al tamaño de las especies aumenta con el tamaño corporal en los insectos". Oikos [ ISBN no disponible ]
- ^ Oliver JC, Monteiro A (julio de 2011). "Sobre los orígenes del dimorfismo sexual en las mariposas". Actas. Ciencias Biológicas . 278 (1714): 1981–1988. doi :10.1098/rspb.2010.2220. PMC 3107650. PMID 21123259 .
- ^ Robertson KA, Monteiro A (agosto de 2005). "Las mariposas hembras de Bicyclus anynana eligen a los machos en función de sus pupilas dorsales con manchas oculares que reflejan la radiación ultravioleta". Actas. Ciencias biológicas . 272 (1572): 1541–1546. doi :10.1098/rspb.2005.3142. PMC 1559841. PMID 16048768 .
- ^ Wiklund C, Lindfors V, Forsberg J (1996). "Aparición temprana de machos y fenología reproductiva de la mariposa adulta invernante Gonepteryx rhamni en Suecia". Oikos . 75 (2): 227–240. Bibcode :1996Oikos..75..227W. doi :10.2307/3546246. JSTOR 3546246.
- ^ Kunte K (julio de 2008). "Las mariposas miméticas respaldan el modelo de dimorfismo sexual de Wallace". Actas. Ciencias biológicas . 275 (1643): 1617–1624. doi :10.1098/rspb.2008.0171. PMC 2602815. PMID 18426753 .
- ^ McLean CJ, Garwood RJ, Brassey CA (2018). "Dimorfismo sexual en los órdenes de los arácnidos". PeerJ . 6 : e5751. doi : 10.7717/peerj.5751 . PMC 6225839 . PMID 30416880.
- ^ Smith T. Descubriendo el patrón de actividad diaria de Zygiella x-notata y su relación con la luz (PDF) (tesis de maestría).
- ^ Prenter J, Elwood RW, Montgomery WI (diciembre de 1999). "Dimorfismo sexual en tamaño e inversión reproductiva de las arañas hembra: un análisis comparativo". Evolución; Revista internacional de evolución orgánica . 53 (6): 1987–1994. doi :10.2307/2640458. JSTOR 2640458. PMID 28565440.
- ^ abc Wilder SM, Rypstra AL (2008). "El dimorfismo sexual en función del tamaño media la ocurrencia de canibalismo sexual dependiente del estado en una araña lobo". Animal Behaviour . 76 (2): 447–454. doi :10.1016/j.anbehav.2007.12.023. S2CID 54373571.
- ^ Foellmer MW, Fairbairn DJ (2004). "Machos bajo ataque: canibalismo sexual y sus consecuencias para la morfología y el comportamiento de los machos en una araña tejedora de orbes". Evolutionary Ecology Research . 6 : 163–181.
- ^ Girard MB, Elias DO, Kasumovic MM (diciembre de 2015). "Preferencia de las hembras por el cortejo multimodal: las señales múltiples son importantes para el éxito del apareamiento de los machos en las arañas pavo real". Actas. Ciencias biológicas . 282 (1820): 20152222. doi :10.1098/rspb.2015.2222. PMC 4685782. PMID 26631566 .
- ^ Fairbairn D (28 de abril de 2013). Odd Couples: diferencias extraordinarias entre los sexos en el reino animal . Princeton. ISBN 978-0691141961.
- ^ Ota K, Kohda M, Sato T (junio de 2010). "Alometría inusual para el dimorfismo sexual de tamaño en un cíclido donde los machos son extremadamente más grandes que las hembras". Journal of Biosciences . 35 (2): 257–65. doi :10.1007/s12038-010-0030-6. PMID 20689182. S2CID 12396902.
- ^ Sato T (1994). "Acumulación activa de sustrato para el desove: un determinante de poliginia extrema en un pez cíclido que cría en concha". Animal Behaviour . 48 (3): 669–678. doi :10.1006/anbe.1994.1286. S2CID 53192909.
- ^ Schütz D, Taborsky M (2005). "Elección de pareja y conflicto sexual en la araña acuática dimórfica de tamaño Argyroneta aquatica (Araneae: Argyronetidae)" (PDF) . Journal of Arachnology . 33 (3): 767–775. doi :10.1636/S03-56.1. S2CID 26712792. Archivado desde el original (PDF) el 20 de marzo de 2012 . Consultado el 14 de mayo de 2011 .
- ^ McCormick MI, Ryen CA, Munday PL, Walker SP (mayo de 2010). Briffa M (ed.). "Differing mechanisms underlie sexual size-dimorphism in two populations of a sex-changing fish" (Diferentes mecanismos subyacen al dimorfismo sexual por tamaño en dos poblaciones de un pez que cambia de sexo). PLOS ONE . 5 (5): e10616. Bibcode :2010PLoSO...510616M. doi : 10.1371/journal.pone.0010616 . PMC 2868897 . PMID 20485547.
- ^ Warner RR (junio de 1988). "Cambio de sexo y el modelo de ventaja de tamaño". Tendencias en ecología y evolución . 3 (6): 133–6. Bibcode :1988TEcoE...3..133W. doi :10.1016/0169-5347(88)90176-0. PMID 21227182.
- ^ Adams S, Williams AJ (2001). "Una prueba preliminar de la hipótesis del brote de crecimiento transicional utilizando la trucha coral protógina Plectropomus maculatus ". Journal of Fish Biology . 59 (1): 183–185. Bibcode :2001JFBio..59..183A. doi :10.1111/j.1095-8649.2001.tb02350.x.
- ^ Hendry A, Berg OK (1999). "Caracteres sexuales secundarios, uso de energía, senescencia y el costo de reproducción en el salmón rojo". Revista Canadiense de Zoología . 77 (11): 1663–1675. doi :10.1139/cjz-77-11-1663.
- ^ ab Amundsen T, Forsgren E (noviembre de 2001). "La elección de pareja de los machos determina la coloración de las hembras en un pez". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 98 (23): 13155–60. Bibcode :2001PNAS...9813155A. doi : 10.1073/pnas.211439298 . PMC 60840 . PMID 11606720.
- ^ ab Svensson PA, Pélabon C, Blount JD, Surai PF, Amundsen T (2006). "¿La coloración nupcial femenina refleja los carotenoides del huevo y la calidad de la nidada en el gobio de dos manchas (Gobiusculus flavescens, Gobiidae)?". Ecología Funcional . 20 (4): 689–698. Código Bib : 2006FuEco..20..689S. doi : 10.1111/j.1365-2435.2006.01151.x . hdl : 10536/DRO/DU:30038904 .
- ^ Butler MA, Schoener TW, Losos JB (febrero de 2000). "La relación entre el dimorfismo sexual en tamaño y el uso del hábitat en lagartijas Anolis de las Antillas Mayores". Evolución; Revista Internacional de Evolución Orgánica . 54 (1): 259–72. doi : 10.1111/j.0014-3820.2000.tb00026.x . PMID 10937202. S2CID 7887284.
- ^ Sanger TJ, Seav SM, Tokita M, Langerhans RB, Ross LM, Losos JB, Abzhanov A (junio de 2014). "La vía del estrógeno subyace a la evolución de formas craneales exageradas en machos de lagartijas Anolis". Actas. Ciencias biológicas . 281 (1784): 20140329. doi :10.1098/rspb.2014.0329. PMC 4043096. PMID 24741020 .
- ^ ab Pinto, A., Wiederhecker, H. y Colli, G. (2005). Dimorfismo sexual en el lagarto neotropical, Tropidurus torquatus (Squamata, Tropiduridae). Anfibios-Reptilia.
- ^ ab Olsson M, Tobler M, Healey M, Perrin C, Wilson M (agosto de 2012). "Un componente significativo del envejecimiento (daño del ADN) se refleja en la pérdida de los colores de reproducción: una prueba experimental utilizando miméticos antioxidantes innatos en lagartijas dragón pintadas". Evolución; Revista internacional de evolución orgánica . 66 (8): 2475–83. doi : 10.1111/j.1558-5646.2012.01617.x . PMID 22834746. S2CID 205783815.
- ^ Caron FS, Pie MR (2024). "La macroevolución del dimorfismo sexual del tamaño en las aves". Revista biológica de la Sociedad Linneana . 141 (5): en prensa. doi : 10.1093/biolinnean/blad168 .
- ^ Bravo CR, Bautista-Sopelana LM, Alonso JC (2024). "Revisitando la hipótesis de divergencia de nicho en aves sexualmente dimórficas: ¿Está correlacionada la superposición de dietas con el dimorfismo sexual en tamaño?". Journal of Animal Ecology . 93 (4): 460–474. Bibcode :2024JAnEc..93..460B. doi :10.1111/1365-2656.14058. hdl : 10261/360371 . PMID 38462717.
- ^ Andersson 1994, pág. 269
- ^ Berns CM, Adams DC (11 de noviembre de 2012). "Diferentes pero siempre iguales: patrones de dimorfismo sexual en forma y tamaño en los picos de los colibríes". Biología evolutiva . 40 (2): 246–260. doi :10.1007/s11692-012-9206-3. ISSN 0071-3260. S2CID 276492.
- ^ McGraw KJ, Hill GE, Stradi R, Parker RS (febrero de 2002). "El efecto del acceso a carotenoides en la dieta sobre el dicromatismo sexual y la composición de pigmentos del plumaje en el jilguero americano" (PDF) . Comparative Biochemistry and Physiology. Parte B, Biochemistry & Molecular Biology . 131 (2): 261–9. doi :10.1016/S1096-4959(01)00500-0. PMID 11818247. Archivado desde el original (PDF) el 28 de agosto de 2005.
- ^ Gibbs HL, Weatherhead PJ, Boag PT, White BN, Tabak LM, Hoysak DJ (diciembre de 1990). "Éxito reproductivo de mirlos de alas rojas poligínicos revelado por marcadores de ADN". Science . 250 (4986): 1394–7. doi :10.1098/rspb.1998.0308. JSTOR 50849. PMC 1688905. PMID 17754986 .
- ^ abcd Lindsay WR, Webster MS, Varian CW, Schwabl H (2009). "La adquisición del color del plumaje y el comportamiento están asociados con los andrógenos en un ave fenotípicamente plástica". Animal Behaviour . 77 (6): 1525–1532. doi :10.1016/j.anbehav.2009.02.027. S2CID 15799876.
- ^ Petrie M (1994). "Mejora del crecimiento y la supervivencia de las crías de pavos reales con colas más elaboradas". Nature . 371 (6498): 598–599. Bibcode :1994Natur.371..598P. doi :10.1038/371598a0. S2CID 4316752.
- ^ Rubolini D, Spina F, Saino N (2004). "Protandria y dimorfismo sexual en aves migratorias transsaharianas". Ecología del comportamiento . 15 (4): 592–601. doi : 10.1093/beheco/arh048 .
- ^ Kissner KJ, Weatherhead PJ, Francis CM (enero de 2003). "Dimorfismo sexual en tamaño y momento de la migración primaveral en aves". Journal of Evolutionary Biology . 16 (1): 154–62. CiteSeerX 10.1.1.584.2867 . doi :10.1046/j.1420-9101.2003.00479.x. PMID 14635890. S2CID 13830052.
- ^ ab Møller AP, Nielsen JT (2006). "Vulnerabilidad de las presas en relación con la coloración sexual de las presas". Ecología del comportamiento y sociobiología . 60 (2): 227–233. Bibcode :2006BEcoS..60..227M. doi :10.1007/s00265-006-0160-x. S2CID 36836956.
- ^ abc Adkins-Regan E (2007). "Hormonas y desarrollo de diferencias sexuales en el comportamiento". Journal of Ornithology . 148 (Suplemento 1): S17–S26. Bibcode :2007JOrn..148...17A. doi :10.1007/s10336-007-0188-3. S2CID 13868097.
- ^ abcd Martin U, Grüebler HS, Müller M, Spaar R, Horch P, Naef-Daenzer B (2008). "La mortalidad sesgada de hembras causada por la pérdida antropogénica de nidos contribuye a la disminución de la población y la proporción de sexos de adultos de un ave de pradera". Conservación biológica . 141 (12): 3040–3049. Código Bibliográfico :2008BCons.141.3040G. doi :10.1016/j.biocon.2008.09.008.
- ^ Owens, IPF, Short, RV,. (1995). Base hormonal del dimorfismo sexual en aves: Implicaciones para nuevas teorías de selección sexual. Tendencias en ecología y evolución., 10(REF), 44.
- ^ ab Coyne JA, Kay EH, Pruett-Jones S (enero de 2008). "La base genética del dimorfismo sexual en las aves". Evolución; Revista internacional de evolución orgánica . 62 (1): 214–9. doi : 10.1111/j.1558-5646.2007.00254.x . PMID 18005159. S2CID 11490688.
- ^ Velando A (2002). "La manipulación experimental del esfuerzo materno produce efectos diferenciales en hijos e hijas: implicaciones para las proporciones sexuales adaptativas en el piquero de patas azules". Ecología del comportamiento . 13 (4): 443–449. doi : 10.1093/beheco/13.4.443 .
- ^ Loonstra AJ, Verhoeven MA, Piersma T (2018). "Crecimiento específico del sexo en polluelos de la aguja colipinta sexualmente dimórfica" (PDF) . Ibis . 160 (1): 89–100. doi :10.1111/ibi.12541. S2CID 90880117.
- ^ ab Main MB (marzo de 2008). "Reconciliación de explicaciones ecológicas en pugna sobre la segregación sexual en ungulados". Ecología . 89 (3): 693–704. Bibcode :2008Ecol...89..693M. doi :10.1890/07-0645.1. PMID 18459333.
- ^ ab Safi K, König B, Kerth G (2007). «Diferencias de sexo en la genética de poblaciones, tamaño del área de distribución y uso del hábitat del murciélago parti-colorido (Vespertilio murinus, Linnaeus 1758) en Suiza y sus consecuencias para la conservación» (PDF) . Conservación biológica . 137 (1): 28–36. Código Bibliográfico :2007BCons.137...28S. doi :10.1016/j.biocon.2007.01.011. Archivado desde el original (PDF) el 25 de septiembre de 2017. Consultado el 2 de febrero de 2019 .
- ^ Coulson G, MacFarlane AM, Parsons SE, Cutter J (2006). "Evolución de la segregación sexual en mamíferos herbívoros: los canguros como modelos marsupiales". Revista Australiana de Zoología . 54 (3): 217–224. doi :10.1071/ZO05062.
- ^ González-Solís J, Croxall JP, Wood AG (2000). "Dimorfismo sexual y segregación sexual en las estrategias de alimentación de los petreles gigantes del norte, Macronectes halli , durante la incubación". Oikos . 90 (2): 390–398. Bibcode :2000Oikos..90..390G. doi :10.1034/j.1600-0706.2000.900220.x.
- ^ abcd Summers-Smith JD (1988). Los gorriones. Calton, Staffordshire, Reino Unido: T. & AD Poyser . ISBN 978-0-85661-048-6.
- ^ Maiorino, Leonardo; Farke, Andrew A.; Kotsakis, Tassos; Piras, Paolo (7 de mayo de 2015). "Los machos se parecen a las hembras: reevaluación del dimorfismo sexual en Protoceratops andrewsi (Neoceratopsia, Protoceratopsidae)". PLOS ONE . 10 (5): e0126464. doi : 10.1371/journal.pone.0126464 . ISSN 1932-6203. PMC 4423778 . PMID 25951329.
- ^ Saitta, Evan Thomas (22 de abril de 2015). "Evidencia de dimorfismo sexual en el dinosaurio Stegosaurus mjosi (Ornithischia, Stegosauria) de la Formación Morrison (Jurásico superior) del oeste de Estados Unidos". PLOS ONE . 10 (4): e0123503. Bibcode :2015PLoSO..1023503S. doi : 10.1371/journal.pone.0123503 . ISSN 1932-6203. PMC 4406738 . PMID 25901727.
- ^ "Las placas de Stegosaurus pueden haber sido diferentes entre machos y hembras". ScienceDaily . Consultado el 12 de marzo de 2024 .
- ^ Arnold AP (septiembre de 2004). "Cromosomas sexuales y género cerebral". Nature Reviews. Neuroscience . 5 (9): 701–8. doi :10.1038/nrn1494. PMID 15322528. S2CID 7419814.
- ^ Cassini MH (enero de 2020). "Un modelo mixto de la evolución de la poligamia y el dimorfismo sexual del tamaño en mamíferos". Mammal Review . 50 (1): 112–120. doi :10.1111/mam.12171. ISSN 0305-1838. S2CID 208557639.
- ^ Cappozzo HL, Campagna C, Monserrat J (1991). "Dimorfismo sexual en leones marinos del sur recién nacidos". Marine Mammal Science . 7 (4): 385–394. Código Bibliográfico :1991MMamS...7..385C. doi :10.1111/j.1748-7692.1991.tb00113.x.
- ^ Salogni E, Galimberti F, Sanvito S, Miller EH (marzo de 2019). "Las crías macho y hembra del elefante marino del norte (Mirounga angustirostris), que presenta un alto grado de dimorfismo sexual, difieren ligeramente en el tamaño corporal". Revista Canadiense de Zoología . 97 (3): 241–250. doi :10.1139/cjz-2018-0220. ISSN 0008-4301. S2CID 91796880.
- ^ Ono KA, Boness DJ (enero de 1996). "Dimorfismo sexual en crías de león marino: inversión materna diferencial o diferencias específicas de cada sexo en la asignación de energía?". Ecología del comportamiento y sociobiología . 38 (1): 31–41. Bibcode :1996BEcoS..38...31O. doi :10.1007/s002650050214. S2CID 25307359.
- ^ Tarnawski BA, Cassini GH, Flores DA (2014). "Alometría del cráneo y dimorfismo sexual en la ontogenia del elefante marino del sur (Mirounga leonina)". Revista Canadiense de Zoología . 31 : 19–31. doi :10.1139/cjz-2013-0106. hdl : 11336/29893 .
- ^ Larsen CS (agosto de 2003). "¿Igualdad de sexos en la evolución humana? Dimorfismo sexual de los primeros homínidos e implicaciones para los sistemas de apareamiento y el comportamiento social". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (16): 9103–4. Bibcode :2003PNAS..100.9103L. doi : 10.1073/pnas.1633678100 . PMC 170877 . PMID 12886010.
- ^ Buss DM (2007). «La evolución del apareamiento humano» (PDF) . Acta Psychologica Sinica . 39 (3): 502–512. Archivado desde el original (PDF) el 12 de agosto de 2011. Consultado el 14 de mayo de 2011 .
- ^ Daly M, Wilson M (1996). "Psicología evolutiva y conflicto marital". En Buss DM , Malamuth NM (eds.). Sexo, poder, conflicto: perspectivas evolutivas y feministas . Oxford University Press . pág. 13. ISBN. 978-0-19-510357-1.
- ^ Rettner, Rachel (3 de enero de 2014). "Por qué las dominadas son más difíciles para las mujeres". LiveScience .
- ^ Sparling PB, O'Donnell EM, Snow TK (diciembre de 1998). "La diferencia de género en el rendimiento en carreras de larga distancia se ha estancado: un análisis de las clasificaciones mundiales de 1980 a 1996". Medicina y ciencia en deportes y ejercicio . 30 (12): 1725–9. doi : 10.1097/00005768-199812000-00011 . PMID 9861606.
- ^ "Informes de estadísticas sanitarias nacionales" (PDF) . Informes de estadísticas sanitarias nacionales . 10 . 22 de octubre de 2008 . Consultado el 21 de abril de 2012 .
- ^ "Encuesta nacional de salud y nutrición de los Estados Unidos, 1999-2002" (PDF) . Consultado el 1 de mayo de 2014 .
- ^ ab Glucksman A (1981). Dimorfismo sexual en la biología y patología de humanos y mamíferos . Academic Press . págs. 66–75. ISBN 978-0-12-286960-0.OCLC 7831448 .
- ^ ab Dance A (27 de marzo de 2019). «Por qué los sexos no sienten el dolor de la misma manera». Nature . 567 (7749): 448–450. Bibcode :2019Natur.567..448D. doi : 10.1038/d41586-019-00895-3 . PMID 30918396. S2CID 85527866.
- ^ Durden-Smith J, deSimone D (1983). Sexo y cerebro. Nueva York: Arbor House . ISBN 978-0-87795-484-2.
- ^ Gersh ES, Gersh I (1981). "Biología de las mujeres" . Nature . 306 (5942). Baltimore: University Park Press (original de la Universidad de Michigan): 511. Bibcode :1983Natur.306..511.. doi :10.1038/306511b0. ISBN. 978-0-8391-1622-6. Número de identificación del sujeto 28060318.
- ^ Stein JH (1987). Medicina interna (2.ª ed.). Boston: Little, Brown . ISBN 978-0-316-81236-8.
- ^ McLaughlin M, Shryer T (8 de agosto de 1988). "Hombres versus mujeres: el nuevo debate sobre las diferencias sexuales". US News & World Report : 50–58.
- ^ McEwen BS (marzo de 1981). "Acciones de los esteroides gonadales neuronales". Science . 211 (4488): 1303–11. Bibcode :1981Sci...211.1303M. doi :10.1126/science.6259728. PMID 6259728.
- ^ "La tolerancia al dolor agudo es más constante a lo largo del tiempo en las mujeres que en los hombres, según una nueva investigación". NCCIH . Consultado el 11 de mayo de 2022 .
- ^ Woznicki K. "Tolerancia y sensibilidad al dolor en hombres, mujeres, pelirrojos y más". WebMD . Consultado el 11 de mayo de 2022 .
- ^ Lopes AM, Ross N, Close J, Dagnall A, Amorim A, Crow TJ (abril de 2006). "Estado de inactivación de PCDH11X: dimorfismos sexuales en los niveles de expresión génica en el cerebro". Genética humana . 119 (3): 267–75. doi :10.1007/s00439-006-0134-0. PMID 16425037. S2CID 19323646.
- ^ Lombardo MV, Ashwin E, Auyeung B, Chakrabarti B, Taylor K, Hackett G, et al. (enero de 2012). "La testosterona fetal influye en la materia gris sexualmente dimórfica en el cerebro humano". The Journal of Neuroscience . 32 (2): 674–80. doi :10.1523/JNEUROSCI.4389-11.2012. PMC 3306238 . PMID 22238103.
- ^ "Diversos roles de la globulina transportadora de hormonas sexuales en la reproducción". biolreprod.org . Archivado desde el original el 23 de septiembre de 2015.
- ^ Fine C (agosto de 2010). Delirios de género: cómo nuestras mentes, la sociedad y el neurosexismo crean diferencias (1.ª ed.). WW Norton & Company . ISBN 978-0-393-06838-2.
- ^ Jordan-Young R (septiembre de 2010). Brain Storm: The Flaws in the Science of Sex Differences [Lluvia de ideas: los defectos de la ciencia de las diferencias sexuales]. Harvard University Press . ISBN 978-0-674-05730-2.
- ^ Marner L, Nyengaard JR, Tang Y, Pakkenberg B (julio de 2003). "Pérdida marcada de fibras nerviosas mielinizadas en el cerebro humano con la edad". The Journal of Comparative Neurology . 462 (2): 144–52. doi :10.1002/cne.10714. PMID 12794739. S2CID 35293796.
- ^ Gur RC, Turetsky BI, Matsui M, Yan M, Bilker W, Hughett P, Gur RE (mayo de 1999). "Diferencias de sexo en la materia gris y blanca del cerebro en adultos jóvenes sanos: correlaciones con el rendimiento cognitivo". The Journal of Neuroscience . 19 (10): 4065–72. doi :10.1523/JNEUROSCI.19-10-04065.1999. PMC 6782697 . PMID 10234034.
- ^ Leonard CM, Towler S, Welcome S, Halderman LK, Otto R, Eckert MA, Chiarello C (diciembre de 2008). "El tamaño importa: el volumen cerebral influye en las diferencias sexuales en neuroanatomía". Corteza cerebral . 18 (12): 2920–31. doi :10.1093/cercor/bhn052. PMC 2583156 . PMID 18440950.
- ^ Lüders E, Steinmetz H, Jäncke L (diciembre de 2002). "Tamaño del cerebro y volumen de materia gris en el cerebro humano sano". NeuroReport . 13 (17): 2371–4. doi :10.1097/00001756-200212030-00040. PMID 12488829.
- ^ Haier RJ, Jung RE, Yeo RA, Head K, Alkire MT (marzo de 2005). "La neuroanatomía de la inteligencia general: el sexo importa" (PDF) . NeuroImage . 25 (1): 320–7. doi :10.1016/j.neuroimage.2004.11.019. PMID 15734366. S2CID 4127512. Archivado desde el original (PDF) el 24 de mayo de 2010.
- ^ Szalkai B, Varga B, Grolmusz V (2015). "El análisis teórico de grafos revela que los cerebros de las mujeres están mejor conectados que los de los hombres". PLOS ONE . 10 (7): e0130045. arXiv : 1501.00727 . Bibcode :2015PLoSO..1030045S. doi : 10.1371/journal.pone.0130045 . PMC 4488527 . PMID 26132764.
- ^ Szalkai B, Varga B, Grolmusz V (junio de 2018). "Los parámetros teóricos de grafos compensados por el sesgo del tamaño del cerebro también son mejores en los conectomas estructurales de las mujeres". Brain Imaging and Behavior . 12 (3): 663–673. doi :10.1007/s11682-017-9720-0. PMID 28447246. S2CID 4028467.
- ^ Gershoni M, Pietrokovski S (febrero de 2017). "El panorama del transcriptoma diferencial sexual y su consiguiente selección en adultos humanos". BMC Biology . 15 (1): 7. doi : 10.1186/s12915-017-0352-z . PMC 5297171 . PMID 28173793.
- ^ Gershoni M, Pietrokovski S (julio de 2014). "Reducción de la selección y acumulación de mutaciones deletéreas en genes expresados exclusivamente en hombres". Nature Communications . 5 : 4438. Bibcode :2014NatCo...5.4438G. doi : 10.1038/ncomms5438 . PMID 25014762.
- ^ Kelly CD, Stoehr AM, Nunn C, Smyth KN, Prokop ZM (diciembre de 2018). "Dimorfismo sexual en la inmunidad entre animales: un metaanálisis". Ecology Letters . 21 (12): 1885–1894. Bibcode :2018EcolL..21.1885K. doi : 10.1111/ele.13164 . PMID 30288910.
- ^ Gal-Oz ST, Maier B, Yoshida H, Seddu K, Elbaz N, Czysz C, et al. (septiembre de 2019). "Informe ImmGen: dimorfismo sexual en el transcriptoma del sistema inmunológico". Nature Communications . 10 (1): 4295. Bibcode :2019NatCo..10.4295G. doi :10.1038/s41467-019-12348-6. PMC 6754408 . PMID 31541153.
- ^ Grossman C (1989). "Posibles mecanismos subyacentes del dimorfismo sexual en la respuesta inmune, hechos e hipótesis". Journal of Steroid Biochemistry . 34 (1–6): 241–251. doi :10.1016/0022-4731(89)90088-5. PMID 2696846.
- ^ Pollitzer E (agosto de 2013). "Biología: el sexo celular es importante". Nature . 500 (7460): 23–4. Bibcode :2013Natur.500...23P. doi : 10.1038/500023a . PMID 23903733. S2CID 4318641.
- ^ Deasy BM, Lu A, Tebbets JC, Feduska JM, Schugar RC, Pollett JB, et al. (abril de 2007). "Un papel para el sexo celular en la regeneración del músculo esquelético mediada por células madre: las células femeninas tienen una mayor eficiencia de regeneración muscular". The Journal of Cell Biology . 177 (1): 73–86. doi :10.1083/jcb.200612094. PMC 2064113 . PMID 17420291.
- ^ Mittelstrass K, Ried JS, Yu Z, Krumsiek J, Gieger C, Prehn C, et al. (agosto de 2011). McCarthy MI (ed.). "Descubrimiento de dimorfismos sexuales en biomarcadores metabólicos y genéticos". PLOS Genetics . 7 (8): e1002215. doi : 10.1371/journal.pgen.1002215 . PMC 3154959 . PMID 21852955.
- ^ Penaloza C, Estevez B, Orlanski S, Sikorska M, Walker R, Smith C, et al. (junio de 2009). "El sexo de la célula dicta su respuesta: expresión genética diferencial y sensibilidad al estrés inductor de muerte celular en células masculinas y femeninas". FASEB Journal . 23 (6): 1869–79. doi : 10.1096/fj.08-119388 . PMC 2698656 . PMID 19190082.
- ^ ab Vollrath F, Parker GA (1992). "Dimorfismo sexual y proporciones sexuales distorsionadas en arañas". Nature . 360 (6400): 156–159. Bibcode :1992Natur.360..156V. doi :10.1038/360156a0. S2CID 4320130.
- ^ Bornholdt R, Oliveira LR, Fabián ME (noviembre de 2008). "Dimorfismo sexual de tamaño en Myotis nigricans (Schinz, 1821) (Chiroptera: Vespertilionidae) del sur de Brasil" (PDF) . Revista Brasileña de Biología . 68 (4): 897–904. doi : 10.1590/S1519-69842008000400028 . PMID 19197511.
- ^ Hayssen V, Kunz TH (1996). "Alometría de la masa de la camada en murciélagos: comparaciones con el tamaño materno, la morfología del ala y la filogenia". Journal of Mammalogy . 77 (2): 476–490. doi : 10.2307/1382823 . JSTOR 1382823.
- ^ Arnqvist G, Jones TM, Elgar MA (julio de 2003). "Comportamiento de los insectos: inversión de los roles sexuales en la alimentación nupcial" (PDF) . Nature . 424 (6947): 387. Bibcode :2003Natur.424..387A. doi :10.1038/424387a. PMID 12879056. S2CID 4382038. Archivado desde el original (PDF) el 15 de septiembre de 2004.
- ^ Mecanismo de fertilización: de las plantas a los humanos , editado por Brian Dale
- ^ Shaw AJ (2000). "Ecología de poblaciones, genética de poblaciones y microevolución". En Shaw AJ, Goffinet B (eds.). Biología de briofitas . Cambridge: Cambridge University Press. págs. 379–380. ISBN 978-0-521-66097-6.
- ^ ab Schuster RM (1984). "Anatomía comparada y morfología de las hepáticas". Nuevo manual de briología . Vol. 2. Nichinan, Miyazaki, Japón: El laboratorio botánico Hattori. pág. 891.
- ^ Crum HA, Anderson LE (1980). Musgos del este de Norteamérica . Vol. 1. Nueva York: Columbia University Press. pág. 196. ISBN. 978-0-231-04516-2.
- ^ Briggs D (1965). "Taxonomía experimental de algunas especies británicas del género Dicranum". New Phytologist . 64 (3): 366–386. doi : 10.1111/j.1469-8137.1965.tb07546.x . JSTOR 2430169.
- ^ Dies Alvarez ME, Rushton AW, Gozalo R, Pillola GL, Linan E, Ahlberg P (2010). "Paradoxides brachyrhachis Linnarsson, 1883 versus Paradoxides mediterraneus Pompeckj, 1901: una determinación problemática". GFF . 132 (2): 95–104. Bibcode :2010GFF...132...95D. doi :10.1080/11035897.2010.481363. S2CID 129620469.
- ^ Padian K, Horner JR (1 de noviembre de 2014). "La selección sexual de Darwin: comprensión de sus ideas en contexto". Comptes Rendus Palevol . 13 (8): 709–715. Bibcode :2014CRPal..13..709P. doi :10.1016/j.crpv.2014.09.001. ISSN 1631-0683.
- ^ Togashi T, Bartelt JL, Yoshimura J, Tainaka K, Cox PA (agosto de 2012). "Las trayectorias evolutivas explican la evolución diversificada de la isogamia y la anisogamia en las algas verdes marinas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 109 (34): 13692–7. Bibcode :2012PNAS..10913692T. doi : 10.1073/pnas.1203495109 . PMC 3427103 . PMID 22869736.
- ^ Hanschen, Erik R.; Herron, Matthew D.; Wiens, John J.; Nozaki, Hisayoshi; Michod, Richard E. (septiembre de 2018). "La multicelularidad impulsa la evolución de los rasgos sexuales". The American Naturalist . 192 (3): E93–E105. doi :10.1086/698301. ISSN 0003-0147. PMC 6685534 . PMID 30125231.
- ^ Siljestam, Mattias; Martinossi-Allibert, Ivain (2024). "La anisogamia no siempre promueve la evolución de los rasgos de competencia de apareamiento en los machos". The American Naturalist . 203 (2): 230–253. doi :10.1086/727968. PMID 38306281.
- ^ Resh, Vincent H. ; Cardé, Ring T. (22 de julio de 2009). Enciclopedia de insectos. Academic Press. ISBN 978-0-08-092090-0.
- ^ Parker GA (mayo de 1982). "¿Por qué hay tantos espermatozoides diminutos? La competencia entre los espermatozoides y el mantenimiento de dos sexos". Journal of Theoretical Biology . 96 (2): 281–94. Bibcode :1982JThBi..96..281P. doi :10.1016/0022-5193(82)90225-9. PMID 7121030. S2CID 29879237.
- ^ Yang JN (mayo de 2010). "Cooperación y evolución de la anisogamia". Journal of Theoretical Biology . 264 (1): 24–36. Bibcode :2010JThBi.264...24Y. doi :10.1016/j.jtbi.2010.01.019. PMID 20097207.
- ^ Bell G (1985). "Sobre la función de las flores". Actas de la Royal Society B: Biological Sciences . 224 (1235): 223–266. Bibcode :1985RSPSB.224..223B. doi :10.1098/rspb.1985.0031. JSTOR 36033. S2CID 84275261.
- ^ Geng S, De Hoff P, Umen JG (julio de 2014). "Evolución de los sexos a partir de una vía de especificación del tipo de apareamiento ancestral". PLOS Biology . 12 (7): e1001904. doi : 10.1371/journal.pbio.1001904 . PMC 4086717 . PMID 25003332.
- ^ Kaufmann P, Wolak ME, Husby A, Immonen E (octubre de 2021). "Evolución rápida del dimorfismo sexual en tamaño facilitado por la varianza genética ligada al cromosoma Y". Nature Ecology & Evolution . 5 (10): 1394–1402. Bibcode :2021NatEE...5.1394K. doi :10.1038/s41559-021-01530-z. PMID 34413504. S2CID 237242736.
- ^ Futuyma 2005, pág. 330
- ^ Futuyma 2005, pág. 331
- ^ Futuyma 2005, pág. 332
- ^ por Ridley 2004, pág. 328
- ^ Futuyma 2005, pág. 335
- ^ Ridley 2004, pág. 330
- ^ Ridley 2004, pág. 332
Fuentes
- Andersson MB (1994). Selección sexual. Princeton University Press . ISBN 978-0-691-00057-2.
- Futuyma D (2005). Evolución (1.ª ed.). Sunderland, Massachusetts: Sinauer Associates. ISBN 978-0-87893-187-3.
- Ridley M (2004). Evolución (3.ª ed.). Malden, Massachusetts: Blackwell Publishing. ISBN 978-1-4051-0345-9.
Lectura adicional
- Bonduriansky R (enero de 2007). "La evolución del dimorfismo sexual dependiente de la condición". The American Naturalist . 169 (1): 9–19. doi :10.1086/510214. PMID 17206580. S2CID 17439073.
- Figuerola J (1999). "Un estudio comparativo sobre la evolución del dimorfismo de tamaño invertido en limícolas monógamas". Revista Biológica de la Sociedad Linneana . 67 (1): 1–18. doi :10.1111/j.1095-8312.1999.tb01926.x. hdl : 10261/44557 . S2CID 85330510.
- Székely T, Lislevand T, Figuerola J, Fairbairn D, Blanckenhorn W (2007). Sexo, tamaño y roles de género: estudios evolutivos del dimorfismo sexual en función del tamaño. pp. 16–26.
Enlaces externos
- Dimorfismo sexual en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.

