Promotor (genética)
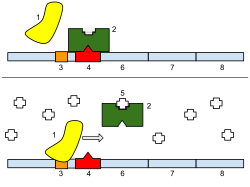
Abajo : El gen está activado. La lactosa inhibe al represor, lo que permite que la ARN polimerasa se una al promotor y exprese los genes, que sintetizan la lactasa. Finalmente, la lactasa digerirá toda la lactosa, hasta que no haya nada para unirse al represor. Entonces, el represor se unirá al operador, deteniendo la fabricación de lactasa.
En genética , un promotor es una secuencia de ADN a la que se unen las proteínas para iniciar la transcripción de un único transcrito de ARN a partir del ADN aguas abajo del promotor. El transcrito de ARN puede codificar una proteína ( ARNm ), o puede tener una función en sí mismo, como el ARNt o el ARNr . Los promotores se encuentran cerca de los sitios de inicio de la transcripción de los genes, aguas arriba en el ADN (hacia la región 5' de la cadena sentido ). Los promotores pueden tener una longitud de entre 100 y 1000 pares de bases , cuya secuencia depende en gran medida del gen y el producto de la transcripción, el tipo o la clase de ARN polimerasa reclutada en el sitio y la especie del organismo. [1] [2]
Los promotores controlan la expresión génica en bacterias y eucariotas . [3] La ARN polimerasa debe unirse al ADN cerca de un gen para que se produzca la transcripción. Las secuencias de ADN promotoras proporcionan un sitio de unión a la enzima . La secuencia -10 es TATAAT. Las secuencias -35 se conservan en promedio, pero no en la mayoría de los promotores.
Los promotores artificiales con elementos -10 y -35 conservados se transcriben más lentamente. Todos los ADN tienen "promotores muy espaciados". Son posibles las orientaciones divergentes, en tándem y convergentes. Es probable que dos promotores muy espaciados interfieran. Los elementos reguladores pueden estar a varias kilobases del sitio de inicio de la transcripción en los promotores de genes (potenciadores).
En los eucariotas, el complejo transcripcional puede doblar el ADN, lo que permite colocar secuencias reguladoras lejos del sitio de transcripción. El promotor distal está aguas arriba del gen y puede contener elementos reguladores adicionales con una influencia más débil. La ARN polimerasa II (RNAP II) unida al promotor del sitio de inicio de la transcripción puede iniciar la síntesis de ARNm. También contiene típicamente islas CpG , una caja TATA y elementos de reconocimiento TFIIB .
La hipermetilación regula a la baja ambos genes, mientras que la desmetilación los regula al alza. Los ARN no codificantes están vinculados a las regiones promotoras del ARNm. Los promotores subgenómicos tienen entre 24 y 100 nucleótidos (virus de la vena amarilla necrótica de la remolacha). La expresión génica depende de la unión del promotor. Los cambios genéticos no deseados pueden aumentar el riesgo de cáncer de una célula.
Los promotores de microARN suelen contener islas CpG. La metilación del ADN forma 5-metilcitosinas en el anillo de pirimidina 5' de los residuos de citosina CpG. Algunos genes del cáncer se silencian por mutación, pero la mayoría se silencian por metilación del ADN. Otros son promotores regulados. La selección puede favorecer una unión transcripcional menos energética.
Las variaciones en los promotores o en los factores de transcripción causan algunas enfermedades. El uso de una secuencia canónica para describir un promotor puede dar lugar a malentendidos.
Descripción general
Para que se produzca la transcripción, la enzima que sintetiza el ARN, conocida como ARN polimerasa , debe unirse al ADN cerca de un gen. Los promotores contienen secuencias de ADN específicas, como elementos de respuesta que proporcionan un sitio de unión inicial seguro para la ARN polimerasa y para proteínas llamadas factores de transcripción que reclutan a la ARN polimerasa. Estos factores de transcripción tienen secuencias activadoras o represoras específicas de nucleótidos correspondientes que se unen a promotores específicos y regulan la expresión génica. [ cita requerida ]
- En bacterias
- El promotor es reconocido por la ARN polimerasa y un factor sigma asociado , que a su vez suelen ser llevados al ADN promotor por la unión de una proteína activadora a su propio sitio de unión al ADN cercano.
- En eucariotas
- El proceso es más complicado y son necesarios al menos siete factores diferentes para la unión de una ARN polimerasa II al promotor.
Los promotores representan elementos críticos que pueden trabajar en conjunto con otras regiones reguladoras ( potenciadores , silenciadores , elementos límite/ aislantes ) para dirigir el nivel de transcripción de un gen determinado. Un promotor se induce en respuesta a cambios en la abundancia o conformación de las proteínas reguladoras en una célula, lo que permite activar factores de transcripción para reclutar a la ARN polimerasa. [4] [5]
Dadas las secuencias cortas de la mayoría de los elementos promotores, los promotores pueden evolucionar rápidamente a partir de secuencias aleatorias. Por ejemplo, en E. coli , aproximadamente el 60 % de las secuencias aleatorias pueden desarrollar niveles de expresión comparables a los del promotor lac de tipo salvaje con solo una mutación, y aproximadamente el 10 % de las secuencias aleatorias pueden servir como promotores activos incluso sin evolución. [6]
Identificación de ubicación relativa
Como los promotores suelen estar inmediatamente adyacentes al gen en cuestión, las posiciones en el promotor se designan en relación con el sitio de inicio de la transcripción , donde comienza la transcripción del ADN para un gen en particular (es decir, las posiciones aguas arriba son números negativos contando hacia atrás desde -1, por ejemplo -100 es una posición 100 pares de bases aguas arriba). [ cita requerida ]
Elementos
Bacteriano
En las bacterias , el promotor contiene dos elementos de secuencia corta aproximadamente 10 ( Pribnow Box ) y 35 nucleótidos aguas arriba del sitio de inicio de la transcripción . [2]
- La secuencia en -10 (el elemento -10) tiene la secuencia de consenso TATAAT.
- La secuencia en -35 (el elemento -35) tiene la secuencia de consenso TTGACA.
- Las secuencias de consenso mencionadas anteriormente, si bien se conservan en promedio, no se encuentran intactas en la mayoría de los promotores. En promedio, solo se encuentran de 3 a 4 de los 6 pares de bases en cada secuencia de consenso en un promotor determinado. Hasta la fecha, se han identificado pocos promotores naturales que posean secuencias de consenso intactas tanto en el -10 como en el -35; se ha descubierto que los promotores artificiales con conservación completa de los elementos -10 y -35 transcriben a frecuencias más bajas que aquellos con algunos desajustes con el consenso.
- El espaciado óptimo entre las secuencias -35 y -10 es de 17 pb.
- Algunos promotores contienen uno o más subsitios del elemento promotor ascendente (elemento UP) [7] ( secuencia de consenso 5'-AAAAAARNR-3' cuando está centrado en la región -42; secuencia de consenso 5'-AWWWWWTTTTT-3' cuando está centrado en la región -52; W = A o T; R = A o G; N = cualquier base). [8]
Las secuencias promotoras anteriores son reconocidas únicamente por la holoenzima de la ARN polimerasa que contiene sigma-70 . Las holoenzimas de la ARN polimerasa que contienen otros factores sigma reconocen diferentes secuencias promotoras centrales.
← aguas arriba aguas abajo →5'-XXXXXXXXXPPPPPPXXXXXXPPPPPPXXXXGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGGXXXX-3' -35 -10 Gen a transcribir
Probabilidad de ocurrencia de cada nucleótido
para secuencia -10 TATAAT77% 76% 60% 61% 56% 82%
para la secuencia -35 TTGACA69% 79% 61% 56% 54% 54%
Bidireccional (procariota)
Los promotores pueden estar ubicados muy cerca en el ADN. Estos "promotores con un espaciado muy cercano" se han observado en el ADN de todas las formas de vida, desde los humanos [9] hasta los procariotas [10] y están altamente conservados. [11] Por lo tanto, pueden proporcionar algunas ventajas (actualmente desconocidas). Estos pares de promotores pueden ubicarse en direcciones divergentes, en tándem y convergentes. También pueden estar regulados por factores de transcripción y difieren en varias características, como la distancia de nucleótidos entre ellos, la fuerza de los dos promotores, etc. El aspecto más importante de dos promotores con un espaciado muy cercano es que, muy probablemente, interferirán entre sí. Varios estudios han explorado esto utilizando modelos tanto analíticos como estocásticos. [12] [13] [14] También hay estudios que midieron la expresión génica en genes sintéticos o de uno a unos pocos genes controlados por promotores bidireccionales. [15]

Más recientemente, un estudio midió la mayoría de los genes controlados por promotores en tándem en E. coli . [16] En ese estudio, se midieron dos formas principales de interferencia. Una es cuando una ARN polimerasa está en el promotor aguas abajo, bloqueando el movimiento de las ARN polimerasas que se alargan desde el promotor aguas arriba. La otra es cuando los dos promotores están tan cerca que cuando una ARN polimerasa se asienta en uno de los promotores, bloquea cualquier otra ARN polimerasa que llegue al otro promotor. Estos eventos son posibles porque la ARN polimerasa ocupa varios nucleótidos cuando está unida al ADN, incluso en los sitios de inicio de la transcripción. Eventos similares ocurren cuando los promotores están en formaciones divergentes y convergentes. Los eventos posibles también dependen de la distancia entre ellos.
Eucariota
Los promotores de genes se ubican típicamente aguas arriba del gen y pueden tener elementos reguladores a varias kilobases del sitio de inicio de la transcripción (potenciadores). En eucariotas, el complejo transcripcional puede hacer que el ADN se doble sobre sí mismo, lo que permite la ubicación de secuencias reguladoras lejos del sitio real de la transcripción. Los promotores eucariotas dependientes de la ARN-polimerasa-II pueden contener una caja TATA ( secuencia de consenso TATAAA), que es reconocida por el factor de transcripción general proteína de unión a TATA (TBP); y un elemento de reconocimiento B (BRE), que es reconocido por el factor de transcripción general TFIIB . [17] [18] [19] El elemento TATA y BRE típicamente se ubican cerca del sitio de inicio de la transcripción (típicamente dentro de 30 a 40 pares de bases).
Las secuencias reguladoras de los promotores eucariotas suelen unirse a proteínas llamadas factores de transcripción que participan en la formación del complejo transcripcional. Un ejemplo es la E-box (secuencia CACGTG), que se une a los factores de transcripción de la familia básica hélice-bucle-hélice (bHLH) (por ejemplo, BMAL1-Clock , cMyc ). [20] Algunos promotores que son el objetivo de múltiples factores de transcripción pueden alcanzar un estado hiperactivo, lo que conduce a una mayor actividad transcripcional. [21]
- Promotor central: la porción mínima del promotor necesaria para iniciar correctamente la transcripción [17]
- Incluye el sitio de inicio de la transcripción (TSS) y elementos directamente aguas arriba
- Un sitio de unión para la ARN polimerasa
- ARN polimerasa I : transcribe genes que codifican ARN ribosómicos 18S, 5.8S y 28S
- ARN polimerasa II : transcribe genes que codifican el ARN mensajero y ciertos ARN nucleares pequeños y microARN.
- ARN polimerasa III : transcribe genes que codifican ARN de transferencia , ARN ribosómicos 5s y otros ARN pequeños
- Sitios de unión de factores de transcripción generales, por ejemplo, caja TATA , elemento de reconocimiento B.
- Pueden estar presentes muchos otros elementos o motivos. No existe un conjunto de "elementos universales" que se encuentren en cada promotor central. [22]
- Promotor proximal: la secuencia proximal aguas arriba del gen que tiende a contener elementos reguladores primarios
- Aproximadamente 250 pares de bases aguas arriba del sitio de inicio
- Sitios de unión de factores de transcripción específicos
- Promotor distal : la secuencia distal aguas arriba del gen que puede contener elementos reguladores adicionales, a menudo con una influencia más débil que el promotor proximal.
- Cualquier cosa que se encuentre más arriba (pero no un potenciador u otra región reguladora cuya influencia sea independiente de la posición/orientación)
- Sitios de unión de factores de transcripción específicos
Promotores de mamíferos
Es posible que sea necesario limpiar esta sección para cumplir con los estándares de calidad de Wikipedia . El problema específico es: Texto sobre mamíferos muy duplicado entre usos de la misma imagen. ¿Podemos hacer una versión "canónica" y redirigir a las personas allí? ( Septiembre de 2021 ) |

La expresión regulada al alza de los genes en mamíferos se inicia cuando se transmiten señales a los promotores asociados con los genes. Las secuencias de ADN promotoras pueden incluir diferentes elementos como islas CpG (presentes en aproximadamente el 70% de los promotores), una caja TATA (presente en aproximadamente el 24% de los promotores), iniciador (Inr) (presente en aproximadamente el 49% de los promotores), elementos de reconocimiento TFIIB aguas arriba y aguas abajo (BREu y BREd) (presentes en aproximadamente el 22% de los promotores), y elemento promotor central aguas abajo (DPE) (presente en aproximadamente el 12% de los promotores). [23] La presencia de múltiples sitios CpG metilados en islas CpG de promotores causa silenciamiento estable de genes. [24] Sin embargo, la presencia o ausencia de los otros elementos tiene efectos relativamente pequeños en la expresión génica en experimentos. [25] Dos secuencias, la caja TATA e Inr, causaron aumentos pequeños pero significativos en la expresión (aumentos del 45% y 28%, respectivamente). Los elementos BREu y BREd redujeron significativamente la expresión en un 35% y un 20%, respectivamente, y el elemento DPE no tuvo ningún efecto detectado sobre la expresión. [25]
Los módulos cis-reguladores que se localizan en regiones de ADN distantes de los promotores de genes pueden tener efectos muy grandes en la expresión génica, y algunos genes experimentan una expresión hasta 100 veces mayor debido a dicho módulo cis-regulador. [26] Estos módulos cis-reguladores incluyen potenciadores , silenciadores , aisladores y elementos de anclaje. [27] Entre esta constelación de elementos, los potenciadores y sus factores de transcripción asociados tienen un papel principal en la regulación de la expresión génica. [28]
Los potenciadores son regiones del genoma que son elementos reguladores de genes importantes. Los potenciadores controlan programas de expresión de genes específicos de cada tipo de célula, la mayoría de las veces mediante bucles que recorren largas distancias para acercarse físicamente a los promotores de sus genes objetivo. [29] En un estudio de neuronas corticales cerebrales, se encontraron 24.937 bucles que llevaban potenciadores a promotores. [26] Múltiples potenciadores, cada uno a menudo a decenas o cientos de miles de nucleótidos de distancia de sus genes objetivo, se unen a sus promotores de genes objetivo y se coordinan entre sí para controlar la expresión de su gen objetivo común. [29]
La ilustración esquemática de esta sección muestra un potenciador que forma un bucle para acercarse físicamente al promotor de un gen diana. El bucle se estabiliza mediante un dímero de una proteína conectora (por ejemplo, el dímero de CTCF o YY1 ), con un miembro del dímero anclado a su motivo de unión en el potenciador y el otro miembro anclado a su motivo de unión en el promotor (representado por los zigzags rojos en la ilustración). [30] Varios factores de transcripción específicos de la función celular (hay alrededor de 1.600 factores de transcripción en una célula humana [31] ) generalmente se unen a motivos específicos en un potenciador [32] y una pequeña combinación de estos factores de transcripción unidos al potenciador, cuando se acercan a un promotor mediante un bucle de ADN, gobiernan el nivel de transcripción del gen diana. El mediador (coactivador) (un complejo que generalmente consta de alrededor de 26 proteínas en una estructura interactuante) comunica señales reguladoras de los factores de transcripción potenciadores unidos al ADN directamente a la enzima ARN polimerasa II (pol II) unida al promotor. [33]
Los potenciadores, cuando están activos, generalmente se transcriben a partir de ambas cadenas de ADN con ARN polimerasas que actúan en dos direcciones diferentes, produciendo dos eARN como se ilustra en la Figura. [34] Un potenciador inactivo puede estar unido a un factor de transcripción inactivo. La fosforilación del factor de transcripción puede activarlo y ese factor de transcripción activado puede entonces activar el potenciador al que está unido (ver la pequeña estrella roja que representa la fosforilación del factor de transcripción unido al potenciador en la ilustración). [35] Un potenciador activado comienza la transcripción de su ARN antes de activar un promotor para iniciar la transcripción del ARN mensajero de su gen objetivo. [36]
Bidireccional (mamífero)
Los promotores bidireccionales son regiones intergénicas cortas (<1 kbp) de ADN entre los extremos 5' de los genes en un par de genes bidireccionales. [37] Un "par de genes bidireccionales" se refiere a dos genes adyacentes codificados en cadenas opuestas, con sus extremos 5' orientados uno hacia el otro. [38] Los dos genes a menudo están relacionados funcionalmente, y la modificación de su región promotora compartida permite que se co-regulen y, por lo tanto, se co-expresen. [39] Los promotores bidireccionales son una característica común de los genomas de los mamíferos . [40] Aproximadamente el 11% de los genes humanos están emparejados bidireccionalmente. [37]
Los genes emparejados bidireccionalmente en la base de datos Gene Ontology compartieron al menos una categoría funcional asignada por la base de datos con sus socios el 47% del tiempo. [41] El análisis de microarrays ha demostrado que los genes emparejados bidireccionalmente se coexpresan en un grado mayor que los genes aleatorios o los genes unidireccionales vecinos. [37] Aunque la coexpresión no necesariamente indica corregulación, se ha demostrado que la metilación de las regiones promotoras bidireccionales regula a la baja ambos genes, y la desmetilación regula al alza ambos genes. [42] Sin embargo, existen excepciones a esto. En algunos casos (alrededor del 11%), solo se expresa un gen de un par bidireccional. [37] En estos casos, el promotor está implicado en la supresión del gen no expresado. El mecanismo detrás de esto podría ser la competencia por las mismas polimerasas o la modificación de la cromatina . La transcripción divergente podría cambiar los nucleosomas para regular al alza la transcripción de un gen, o eliminar los factores de transcripción unidos para regular a la baja la transcripción de un gen. [43]
Algunas clases funcionales de genes tienen más probabilidades de estar emparejados bidireccionalmente que otras. Los genes implicados en la reparación del ADN tienen cinco veces más probabilidades de estar regulados por promotores bidireccionales que por promotores unidireccionales. Las proteínas chaperonas tienen tres veces más probabilidades, y los genes mitocondriales tienen más del doble de probabilidades. Muchos genes metabólicos celulares y de mantenimiento básico están regulados por promotores bidireccionales. [37] La sobrerrepresentación de genes de reparación del ADN emparejados bidireccionalmente asocia estos promotores con el cáncer . El cuarenta y cinco por ciento de los oncogenes somáticos humanos parecen estar regulados por promotores bidireccionales, significativamente más que los genes que no causan cáncer. La hipermetilación de los promotores entre los pares de genes WNT9A /CD558500, CTDSPL /BC040563 y KCNK15 /BF195580 se ha asociado con tumores. [42]
Se han observado ciertas características de secuencia en promotores bidireccionales, incluyendo una falta de cajas TATA , una abundancia de islas CpG y una simetría alrededor del punto medio de Cs y As dominantes en un lado y Gs y Ts en el otro. Recientemente se ha demostrado que un motivo con la secuencia de consenso de TCTCGCGAGA, también llamado elemento CGCG, impulsa la transcripción bidireccional impulsada por PolII en islas CpG. [44] Las cajas CCAAT son comunes, como lo son en muchos promotores que carecen de cajas TATA. Además, los motivos NRF-1, GABPA , YY1 y ACTACAnnTCCC están representados en promotores bidireccionales a tasas significativamente más altas que en promotores unidireccionales. La ausencia de cajas TATA en promotores bidireccionales sugiere que las cajas TATA desempeñan un papel en la determinación de la direccionalidad de los promotores, pero los contraejemplos de promotores bidireccionales poseen cajas TATA y los promotores unidireccionales sin ellas indican que no pueden ser el único factor. [45]
Aunque el término "promotor bidireccional" se refiere específicamente a las regiones promotoras de los genes que codifican el ARNm , los ensayos de luciferasa han demostrado que más de la mitad de los genes humanos no tienen un sesgo direccional fuerte. Las investigaciones sugieren que los ARN no codificantes se asocian con frecuencia con las regiones promotoras de los genes que codifican el ARNm. Se ha planteado la hipótesis de que el reclutamiento y la iniciación de la ARN polimerasa II suelen comenzar de forma bidireccional, pero la transcripción divergente se detiene en un punto de control más adelante durante la elongación. Los posibles mecanismos detrás de esta regulación incluyen secuencias en la región promotora, modificación de la cromatina y la orientación espacial del ADN. [43]
Subgenómico
Un promotor subgenómico es un promotor añadido a un virus para un gen heterólogo específico , lo que da como resultado la formación de ARNm para ese gen solo. Muchos virus de ARN de sentido positivo producen estos ARNm subgenómicos (sgRNA) como una de las técnicas de infección comunes utilizadas por estos virus y generalmente transcriben genes virales tardíos. Los promotores subgenómicos varían de 24 nucleótidos ( virus Sindbis ) a más de 100 nucleótidos ( virus de la vena amarilla necrótica de la remolacha ) y generalmente se encuentran aguas arriba del inicio de la transcripción. [46]
Detección
Se ha desarrollado una amplia variedad de algoritmos para facilitar la detección de promotores en la secuencia genómica, y la predicción de promotores es un elemento común de muchos métodos de predicción de genes . Una región promotora se ubica antes de las secuencias de consenso -35 y -10. Cuanto más cerca esté la región promotora de las secuencias de consenso, más a menudo se producirá la transcripción de ese gen. No existe un patrón establecido para las regiones promotoras, como sí lo hay para las secuencias de consenso.
Vinculante
El inicio de la transcripción es un proceso secuencial de varios pasos que involucra varios mecanismos: ubicación del promotor, unión reversible inicial de la ARN polimerasa, cambios conformacionales en la ARN polimerasa, cambios conformacionales en el ADN, unión del trifosfato de nucleósido (NTP) al complejo funcional ARN polimerasa-promotor e inicio no productivo y productivo de la síntesis de ARN. [47] [2]
El proceso de unión del promotor es crucial para comprender el proceso de expresión génica. El ajuste de los sistemas genéticos sintéticos depende de promotores sintéticos diseñados con precisión y con niveles conocidos de tasas de transcripción. [2]
Ubicación
Aunque la holoenzima ARN polimerasa muestra una alta afinidad por sitios no específicos del ADN, esta característica no permite esclarecer el proceso de localización del promotor. [48] Este proceso de localización del promotor se ha atribuido a la estructura de la holoenzima al ADN y de los complejos sigma 4 al ADN. [49]
Enfermedades asociadas con función aberrante
La mayoría de las enfermedades tienen causas heterogéneas, lo que significa que una "enfermedad" suele ser un conjunto de muchas enfermedades diferentes a nivel molecular, aunque los síntomas que se presentan y la respuesta al tratamiento pueden ser idénticos. La farmacogenómica aborda parcialmente la forma en que las enfermedades de diferente origen molecular responden a los tratamientos .
No se enumeran aquí los numerosos tipos de cáncer que implican una regulación transcripcional aberrante debido a la creación de genes quiméricos a través de una translocación cromosómica patológica . Es importante destacar que la intervención en el número o la estructura de las proteínas unidas al promotor es una clave para tratar una enfermedad sin afectar la expresión de genes no relacionados que comparten elementos con el gen objetivo. [50] Algunos genes cuyo cambio no es deseable son capaces de influir en el potencial de una célula de volverse cancerosa. [51]
Islas CpG en promotores
En los seres humanos, aproximadamente el 70% de los promotores ubicados cerca del sitio de inicio de la transcripción de un gen (promotores proximales) contienen una isla CpG . [52] [53] Las islas CpG generalmente tienen una longitud de 200 a 2000 pares de bases, un contenido de pares de bases C:G >50% y tienen regiones de ADN donde un nucleótido de citosina es seguido por un nucleótido de guanina y esto ocurre con frecuencia en la secuencia lineal de bases a lo largo de su dirección 5' → 3' .
Los promotores distales también contienen frecuentemente islas CpG, como el promotor del gen de reparación de ADN ERCC1 , donde el promotor que contiene la isla CpG se encuentra aproximadamente 5.400 nucleótidos aguas arriba de la región codificante del gen ERCC1 . [54] Las islas CpG también aparecen con frecuencia en los promotores de ARN funcionales no codificantes, como los microARN .
La metilación de las islas CpG silencia genes de forma estable
En los seres humanos, la metilación del ADN se produce en la posición 5' del anillo de pirimidina de los residuos de citosina dentro de los sitios CpG para formar 5-metilcitosinas . La presencia de múltiples sitios CpG metilados en las islas CpG de los promotores provoca el silenciamiento estable de los genes. [24] El silenciamiento de un gen puede iniciarse por otros mecanismos, pero a menudo esto es seguido por la metilación de los sitios CpG en la isla CpG del promotor para provocar el silenciamiento estable del gen. [24]
Hiper/hipometilación del promotor CpG en el cáncer
En general, durante la progresión hacia el cáncer, cientos de genes se silencian o se activan . Aunque el silenciamiento de algunos genes en los cánceres ocurre por mutación, una gran proporción del silenciamiento de genes cancerígenos es resultado de una metilación alterada del ADN (ver Metilación del ADN en el cáncer ). La metilación del ADN que causa el silenciamiento en el cáncer ocurre típicamente en múltiples sitios CpG en las islas CpG que están presentes en los promotores de los genes codificadores de proteínas.
Las expresiones alteradas de microARN también silencian o activan muchos genes en la progresión hacia el cáncer (ver microARN en el cáncer ). La expresión alterada de microARN ocurre a través de la hiper/hipometilación de sitios CpG en islas CpG en promotores que controlan la transcripción de los microARN .
El silenciamiento de los genes de reparación del ADN a través de la metilación de las islas CpG en sus promotores parece ser especialmente importante en la progresión al cáncer (ver metilación de genes de reparación del ADN en el cáncer ).
Secuencias canónicas y de tipo salvaje
El uso del término secuencia canónica para referirse a un promotor suele ser problemático y puede dar lugar a malentendidos sobre las secuencias promotoras. Canónico implica, en cierto sentido, perfecto.
En el caso de un sitio de unión de un factor de transcripción, puede haber una única secuencia que se una a la proteína con mayor fuerza en determinadas condiciones celulares. Esto podría denominarse canónico.
Sin embargo, la selección natural puede favorecer la unión menos energética como forma de regular la producción transcripcional. En este caso, podemos llamar a la secuencia más común en una población la secuencia de tipo salvaje. Puede que ni siquiera sea la secuencia más ventajosa en las condiciones prevalecientes.
Evidencias recientes también indican que varios genes (incluido el protooncogén c-myc ) tienen motivos G-quadruplex como posibles señales reguladoras.
Diseño e ingeniería de promotores sintéticos
Los promotores son elementos reguladores genéticos importantes que se utilizan para ajustar circuitos genéticos y redes metabólicas diseñados sintéticamente . Por ejemplo, para sobreexpresar un gen importante en una red y obtener una mayor producción de la proteína objetivo, los biólogos sintéticos diseñan promotores para regular positivamente su expresión . Se pueden utilizar algoritmos automatizados para diseñar ADN neutro o aisladores que no desencadenen la expresión génica de secuencias posteriores. [55] [2]
Enfermedades que pueden estar asociadas a variaciones
Algunos casos de muchas enfermedades genéticas están asociados con variaciones en los promotores o factores de transcripción.
Algunos ejemplos incluyen:
- Asma [56] [57]
- Talasemia beta [58]
- Síndrome de Rubinstein-Taybi [59]
Constitutivo vs regulado
Algunos promotores se denominan constitutivos porque son activos en todas las circunstancias de la célula, mientras que otros son regulados y se activan en la célula sólo en respuesta a estímulos específicos.
Promotor específico de tejido
Un promotor específico de tejido es un promotor que tiene actividad sólo en ciertos tipos de células.
Uso del término
Al referirse a un promotor, algunos autores en realidad se refieren a promotor + operador ; es decir, el promotor lac es inducible por IPTG, lo que significa que además del promotor lac, también está presente el operón lac . Si el operador lac no estuviera presente, el IPTG no tendría un efecto inducible. [ cita requerida ] Otro ejemplo es el sistema Tac-Promoter (Ptac). Observe cómo tac se escribe como un promotor tac, mientras que, de hecho, tac es en realidad tanto un promotor como un operador. [60]
Véase también
Referencias
- ^ Sharan R (4 de enero de 2007). «Análisis de redes biológicas: redes transcripcionales – Análisis de secuencias promotoras» (PDF) . Universidad de Tel Aviv . Consultado el 30 de diciembre de 2012 .
- ^ abcde LaFleur TL, Hossain A, Salis HM (septiembre de 2022). "Diseño predictivo de modelos automatizados de promotores sintéticos para controlar los perfiles transcripcionales en bacterias". Nature Communications . 13 (1): 5159. Bibcode :2022NatCo..13.5159L. doi :10.1038/s41467-022-32829-5. PMC 9440211 . PMID 36056029.
- ^ Vaishnav ED, de Boer CG, Molinet J, Yassour M, Fan L, Adiconis X, et al. (marzo de 2022). "La evolución, la capacidad de evolución y la ingeniería del ADN regulador de genes". Nature . 603 (7901): 455–463. Bibcode :2022Natur.603..455V. doi :10.1038/s41586-022-04506-6. PMC 8934302 . PMID 35264797.
- ^ Yaniv M (septiembre de 2014). "Remodelación de la cromatina: de la transcripción al cáncer". Genética del cáncer . 207 (9): 352–7. doi :10.1016/j.cancergen.2014.03.006. PMID 24825771.
- ^ Civas A, Génin P, Morin P, Lin R, Hiscott J (febrero de 2006). "La organización del promotor de los genes del interferón A afecta de manera diferencial la expresión y la respuesta inducidas por el virus a TBK1 e IKKepsilon". The Journal of Biological Chemistry . 281 (8): 4856–66. doi : 10.1074/jbc.M506812200 . PMID 16380379.
- ^ Yona AH, Alm EJ, Gore J (abril de 2018). "Las secuencias aleatorias evolucionan rápidamente hacia promotores de novo". Nature Communications . 9 (1): 1530. Bibcode :2018NatCo...9.1530Y. doi :10.1038/s41467-018-04026-w. PMC 5906472 . PMID 29670097.
- ^ Ross W, Gosink KK, Salomon J, Igarashi K, Zou C, Ishihama A, et al. (noviembre de 1993). "Un tercer elemento de reconocimiento en los promotores bacterianos: la unión del ADN por la subunidad alfa de la ARN polimerasa". Ciencia . 262 (5138): 1407-1413. Código Bib : 1993 Ciencia... 262.1407R. doi : 10.1126/ciencia.8248780. PMID 8248780.
- ^ Estrem ST, Ross W, Gaal T, Chen ZW, Niu W, Ebright RH, Gourse RL (agosto de 1999). "Arquitectura del promotor bacteriano: estructura del subsitio de los elementos UP e interacciones con el dominio carboxiterminal de la subunidad alfa de la ARN polimerasa". Genes & Development . 13 (16): 2134–2147. doi :10.1101/gad.13.16.2134. PMC 316962 . PMID 10465790.
- ^ Adachi N, Lieber MR (junio de 2002). "Organización génica bidireccional: una característica arquitectónica común del genoma humano". Cell . 109 (7): 807–809. doi : 10.1016/S0092-8674(02)00758-4 . PMID 12110178.
- ^ Herbert M, Kolb A, Buc H (mayo de 1986). "Promotores superpuestos y su control en Escherichia coli: el caso gal". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 83 (9): 2807–2811. Bibcode :1986PNAS...83.2807H. doi : 10.1073/pnas.83.9.2807 . PMC 323395 . PMID 3010319.
- ^ Korbel JO, Jensen LJ, von Mering C, Bork P (julio de 2004). "Análisis del contexto genómico: predicción de asociaciones funcionales a partir de pares de genes transcritos bidireccionalmente conservados". Nature Biotechnology . 22 (7): 911–917. doi :10.1038/nbt988. PMID 15229555. S2CID 3546895.
- ^ Sneppen K, Dodd IB, Shearwin KE, Palmer AC, Schubert RA, Callen BP, Egan JB (febrero de 2005). "Un modelo matemático para la interferencia transcripcional por el tráfico de la ARN polimerasa en Escherichia coli". Journal of Molecular Biology . 346 (2): 399–409. doi :10.1016/j.jmb.2004.11.075. PMID 15670592.
- ^ Martins L, Mäkelä J, Häkkinen A, Kandhavelu M, Yli-Harja O, Fonseca JM, Ribeiro AS (mayo de 2012). "Dinámica de la transcripción de promotores muy espaciados en Escherichia coli, un evento a la vez". Journal of Theoretical Biology . 301 : 83–94. Bibcode :2012JThBi.301...83M. doi :10.1016/j.jtbi.2012.02.015. PMID 22370562.
- ^ Häkkinen A, Oliveira SM, Neeli-Venkata R, Ribeiro AS (diciembre de 2019). "La formación de complejos cerrados y abiertos de transcripción coordina la expresión de genes con una región promotora compartida". Journal of the Royal Society, Interface . 16 (161): 20190507. doi : 10.1098/rsif.2019.0507 . PMC 6936044 . PMID 31822223.
- ^ Bordoy AE, Varanasi US, Courtney CM, Chatterjee A (diciembre de 2016). "Interferencia transcripcional en promotores convergentes como medio para la expresión genética ajustable". ACS Synthetic Biology . 5 (12): 1331–1341. doi :10.1021/acssynbio.5b00223. PMID 27346626.
- ^ Chauhan V, Bahrudeen MN, Palma CS, Baptista IS, Almeida BL, Dash S, et al. (enero de 2022). "Modelo cinético analítico de promotores tándem nativos en E. coli". PLOS Computational Biology . 18 (1): e1009824. Bibcode :2022PLSCB..18E9824C. doi : 10.1371/journal.pcbi.1009824 . PMC 8830795 . PMID 35100257.
- ^ ab Smale ST, Kadonaga JT (2003). "El promotor central de la ARN polimerasa II". Revisión anual de bioquímica . 72 : 449–479. doi :10.1146/annurev.biochem.72.121801.161520. PMID 12651739.
- ^ Gershenzon NI, Ioshikhes IP (abril de 2005). "Sinergia de elementos promotores centrales de la Pol II humana revelada por análisis estadístico de secuencias". Bioinformática . 21 (8): 1295–1300. doi : 10.1093/bioinformatics/bti172 . PMID 15572469.
- ^ Lagrange T, Kapanidis AN, Tang H, Reinberg D, Ebright RH (enero de 1998). "Nuevo elemento promotor central en la transcripción dependiente de la ARN polimerasa II: unión al ADN específica de la secuencia por el factor de transcripción IIB". Genes & Development . 12 (1): 34–44. doi :10.1101/gad.12.1.34. PMC 316406 . PMID 9420329.
- ^ Levine M, Tjian R (julio de 2003). "Regulación de la transcripción y diversidad animal". Nature . 424 (6945): 147–151. Bibcode :2003Natur.424..147L. doi :10.1038/nature01763. PMID 12853946. S2CID 4373712.
- ^ Liefke R, Windhof-Jaidhauser IM, Gaedcke J, Salinas-Riester G, Wu F, Ghadimi M, Dango S (junio de 2015). "La desmetilasa oxidativa ALKBH3 marca promotores de genes hiperactivos en células cancerosas humanas". Genome Medicine . 7 (1): 66. doi : 10.1186/s13073-015-0180-0 (inactivo 2024-04-27). PMC 4517488 . PMID 26221185.
{{cite journal}}: CS1 maint: DOI inactivo a partir de abril de 2024 ( enlace ) - ^ Juven-Gershon T, Kadonaga JT (marzo de 2010). "Regulación de la expresión génica a través del promotor central y la maquinaria transcripcional basal". Biología del desarrollo . 339 (2): 225–229. doi :10.1016/j.ydbio.2009.08.009. PMC 2830304 . PMID 19682982.
- ^ Yang C, Bolotin E, Jiang T, Sladek FM, Martinez E (marzo de 2007). "Prevalencia del iniciador sobre la caja TATA en genes humanos y de levadura e identificación de motivos de ADN enriquecidos en promotores centrales humanos sin TATA". Gene . 389 (1): 52–65. doi :10.1016/j.gene.2006.09.029. PMC 1955227 . PMID 17123746.
- ^ abc Bird A (enero de 2002). "Patrones de metilación del ADN y memoria epigenética". Genes & Development . 16 (1): 6–21. doi : 10.1101/gad.947102 . PMID 11782440.
- ^ ab Weingarten-Gabbay S, Nir R, Lubliner S, Sharon E, Kalma Y, Weinberger A, Segal E (febrero de 2019). "Interrogatorio sistemático de promotores humanos". Genome Research . 29 (2): 171–183. doi :10.1101/gr.236075.118. PMC 6360817 . PMID 30622120.
- ^ ab Beagan JA, Pastuzyn ED, Fernandez LR, Guo MH, Feng K, Titus KR, et al. (junio de 2020). "Reestructuración tridimensional del genoma a través de escalas temporales de expresión génica neuronal inducida por actividad". Nature Neuroscience . 23 (6): 707–717. doi :10.1038/s41593-020-0634-6. PMC 7558717 . PMID 32451484.
- ^ Verheul TC, van Hijfte L, Perenthaler E, Barakat TS (2020). "El porqué de YY1: mecanismos de regulación transcripcional por Yin Yang 1". Frontiers in Cell and Developmental Biology . 8 : 592164. doi : 10.3389/fcell.2020.592164 . PMC 7554316 . PMID 33102493.
- ^ Spitz F, Furlong EE (septiembre de 2012). "Factores de transcripción: desde la unión de potenciadores hasta el control del desarrollo". Nature Reviews. Genetics . 13 (9): 613–626. doi :10.1038/nrg3207. PMID 22868264. S2CID 205485256.
- ^ ab Schoenfelder S, Fraser P (agosto de 2019). "Contactos promotor-potenciador de largo alcance en el control de la expresión génica". Nature Reviews. Genética . 20 (8): 437–455. doi :10.1038/s41576-019-0128-0. PMID 31086298. S2CID 152283312.
- ^ Weintraub AS, Li CH, Zamudio AV, Sigova AA, Hannett NM, Day DS, et al. (diciembre de 2017). "YY1 es un regulador estructural de los bucles potenciador-promotor". Cell . 171 (7): 1573–1588.e28. doi :10.1016/j.cell.2017.11.008. PMC 5785279 . PMID 29224777.
- ^ Lambert SA, Jolma A, Campitelli LF, Das PK, Yin Y, Albu M, et al. (febrero de 2018). "Los factores de transcripción humanos". Cell . 172 (4): 650–665. doi : 10.1016/j.cell.2018.01.029 . PMID 29425488.
- ^ Grossman SR, Engreitz J, Ray JP, Nguyen TH, Hacohen N, Lander ES (julio de 2018). "Especificidad posicional de diferentes clases de factores de transcripción dentro de potenciadores". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 115 (30): E7222–E7230. Bibcode :2018PNAS..115E7222G. doi : 10.1073/pnas.1804663115 . PMC 6065035 . PMID 29987030.
- ^ Allen BL, Taatjes DJ (marzo de 2015). "El complejo mediador: un integrador central de la transcripción". Nature Reviews. Molecular Cell Biology . 16 (3): 155–166. doi :10.1038/nrm3951. PMC 4963239 . PMID 25693131.
- ^ Mikhaylichenko O, Bondarenko V, Harnett D, Schor IE, Males M, Viales RR, Furlong EE (enero de 2018). "El grado de actividad potenciadora o promotora se refleja en los niveles y la direccionalidad de la transcripción del ARNm". Genes & Development . 32 (1): 42–57. doi :10.1101/gad.308619.117. PMC 5828394 . PMID 29378788.
- ^ Li QJ, Yang SH, Maeda Y, Sladek FM, Sharrocks AD, Martins-Green M (enero de 2003). "La activación dependiente de la fosforilación de la quinasa MAP de Elk-1 conduce a la activación del coactivador p300". The EMBO Journal . 22 (2): 281–291. doi :10.1093/emboj/cdg028. PMC 140103 . PMID 12514134.
- ^ Carullo NV, Phillips Iii RA, Simon RC, Soto SA, Hinds JE, Salisbury AJ, et al. (septiembre de 2020). "Los ARN potenciadores predicen los vínculos reguladores entre genes potenciadores y son fundamentales para la función potenciadora en los sistemas neuronales". Nucleic Acids Research . 48 (17): 9550–9570. doi :10.1093/nar/gkaa671. PMC 7515708 . PMID 32810208.
- ^ abcde Trinklein ND, Aldred SF, Hartman SJ, Schroeder DI, Otillar RP, Myers RM (enero de 2004). "Una abundancia de promotores bidireccionales en el genoma humano". Genome Research . 14 (1): 62–66. doi :10.1101/gr.1982804. PMC 314279 . PMID 14707170.
- ^ Yang MQ, Koehly LM, Elnitski LL (abril de 2007). "La anotación integral de promotores bidireccionales identifica la co-regulación entre genes de cáncer de mama y ovario". PLOS Computational Biology . 3 (4): e72. Bibcode :2007PLSCB...3...72Y. doi : 10.1371/journal.pcbi.0030072 . PMC 1853124 . PMID 17447839.
- ^ Adachi N, Lieber MR (junio de 2002). "Organización génica bidireccional: una característica arquitectónica común del genoma humano". Cell . 109 (7): 807–809. doi : 10.1016/S0092-8674(02)00758-4 . PMID 12110178. S2CID 8556921.
- ^ Koyanagi KO, Hagiwara M, Itoh T, Gojobori T, Imanishi T (julio de 2005). "Genómica comparativa de pares de genes bidireccionales y sus implicaciones para la evolución de un sistema de regulación transcripcional". Gene . 353 (2): 169–176. doi :10.1016/j.gene.2005.04.027. PMID 15944140.
- ^ Liu B, Chen J, Shen B (mayo de 2011). "Análisis de todo el genoma de la preferencia de unión de factores de transcripción de promotores bidireccionales humanos y anotación funcional de pares de genes relacionados". BMC Systems Biology . 5 (Supl 1): S2. doi : 10.1186/1752-0509-5-S1-S2 . PMC 3121118 . PMID 21689477.
- ^ ab Shu J, Jelinek J, Chang H, Shen L, Qin T, Chung W, et al. (mayo de 2006). "Silenciamiento de promotores bidireccionales por metilación del ADN en la tumorigénesis". Cancer Research . 66 (10): 5077–5084. doi : 10.1158/0008-5472.CAN-05-2629 . PMID 16707430.
- ^ ab Wei W, Pelechano V, Järvelin AI, Steinmetz LM (julio de 2011). "Consecuencias funcionales de los promotores bidireccionales". Tendencias en genética . 27 (7): 267–276. doi :10.1016/j.tig.2011.04.002. PMC 3123404 . PMID 21601935.
- ^ Mahpour A, Scruggs BS, Smiraglia D, Ouchi T, Gelman IH (17 de octubre de 2018). "Un elemento sensible al metilo induce la transcripción bidireccional en promotores asociados a islas CpG sin TATA". PLOS ONE . 13 (10): e0205608. Bibcode :2018PLoSO..1305608M. doi : 10.1371/journal.pone.0205608 . PMC 6192621 . PMID 30332484.
- ^ Lin JM, Collins PJ, Trinklein ND, Fu Y, Xi H, Myers RM, Weng Z (junio de 2007). "Unión de factores de transcripción e histonas modificadas en promotores bidireccionales humanos". Genome Research . 17 (6): 818–827. doi :10.1101/gr.5623407. PMC 1891341 . PMID 17568000.
- ^ Koev G, Miller WA (julio de 2000). "Un virus de ARN de cadena positiva con tres promotores de ARN subgenómicos muy diferentes". Journal of Virology . 74 (13): 5988–5996. doi :10.1128/jvi.74.13.5988-5996.2000. PMC 112095 . PMID 10846080.
- ^ deHaseth PL, Zupancic ML, Record MT (junio de 1998). "Interacciones entre la ARN polimerasa y el promotor: las idas y venidas de la ARN polimerasa". Journal of Bacteriology . 180 (12): 3019–3025. doi :10.1128/jb.180.12.3019-3025.1998. PMC 107799 . PMID 9620948.
- ^ Singer P, Wu CW (octubre de 1987). "Búsqueda de promotores por la ARN polimerasa de Escherichia coli en una plantilla de ADN circular". The Journal of Biological Chemistry . 262 (29): 14178–14189. doi : 10.1016/S0021-9258(18)47921-5 . PMID 3308887.
- ^ Borukhov S, Nudler E (abril de 2003). "Holoenzima ARN polimerasa: estructura, función e implicaciones biológicas". Current Opinion in Microbiology . 6 (2): 93–100. doi :10.1016/s1369-5274(03)00036-5. PMID 12732296.
- ^ Copland JA, Sheffield-Moore M, Koldzic-Zivanovic N, Gentry S, Lamprou G, Tzortzatou-Stathopoulou F, et al. (junio de 2009). "Receptores de esteroides sexuales en la diferenciación esquelética y la neoplasia epitelial: ¿es posible una intervención específica de tejido?". BioEssays . 31 (6): 629–641. doi :10.1002/bies.200800138. PMID 19382224. S2CID 205469320.
- ^ Vlahopoulos SA, Logotheti S, Mikas D, Giarika A, Gorgoulis V, Zoumpourlis V (abril de 2008). "El papel de ATF-2 en la oncogénesis". Bioensayos . 30 (4): 314–327. doi :10.1002/bies.20734. PMID 18348191. S2CID 678541.
- ^ Saxonov S, Berg P, Brutlag DL (enero de 2006). "Un análisis de todo el genoma de los dinucleótidos CpG en el genoma humano distingue dos clases distintas de promotores". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (5): 1412–1417. Bibcode :2006PNAS..103.1412S. doi : 10.1073/pnas.0510310103 . PMC 1345710 . PMID 16432200.
- ^ Deaton AM, Bird A (mayo de 2011). "Islas CpG y regulación de la transcripción". Genes & Development . 25 (10): 1010–1022. doi :10.1101/gad.2037511. PMC 3093116 . PMID 21576262.
- ^ Chen HY, Shao CJ, Chen FR, Kwan AL, Chen ZP (abril de 2010). "Función de la hipermetilación del promotor ERCC1 en la resistencia a fármacos como el cisplatino en gliomas humanos". Revista internacional del cáncer . 126 (8): 1944–1954. doi : 10.1002/ijc.24772 . PMID 19626585.
- ^ Hossain A, Lopez E, Halper SM, Cetnar DP, Reis AC, Strickland D, et al. (diciembre de 2020). "Diseño automatizado de miles de piezas no repetitivas para la ingeniería de sistemas genéticos estables". Nature Biotechnology . 38 (12): 1466–1475. doi :10.1038/s41587-020-0584-2. PMID 32661437. S2CID 220506228.
- ^ Hobbs K, Negri J, Klinnert M, Rosenwasser LJ, Borish L (diciembre de 1998). "Polimorfismos del promotor de interleucina-10 y factor de crecimiento transformante beta en alergias y asma". American Journal of Respiratory and Critical Care Medicine . 158 (6): 1958–1962. doi :10.1164/ajrccm.158.6.9804011. PMID 9847292.
- ^ Burchard EG, Silverman EK, Rosenwasser LJ, Borish L, Yandava C, Pillari A, et al. (septiembre de 1999). "Asociación entre una variante de secuencia en el promotor del gen IL-4 y el FEV(1) en el asma". American Journal of Respiratory and Critical Care Medicine . 160 (3): 919–922. doi :10.1164/ajrccm.160.3.9812024. PMID 10471619.
- ^ Kulozik AE, Bellan-Koch A, Bail S, Kohne E, Kleihauer E (mayo de 1991). "Talasemia intermedia: reducción moderada de la actividad transcripcional del gen de la beta-globina por una nueva mutación del elemento promotor proximal CACCC". Blood . 77 (9): 2054–2058. doi : 10.1182/blood.V77.9.2054.2054 . PMID 2018842.
- ^ Petrij F, Giles RH, Dauwerse HG, Saris JJ, Hennekam RC, Masuno M, et al. (Julio de 1995). "Síndrome de Rubinstein-Taybi causado por mutaciones en el coactivador transcripcional CBP". Naturaleza . 376 (6538): 348–351. Código Bib :1995Natur.376..348P. doi :10.1038/376348a0. PMID 7630403. S2CID 4254507.
- ^ Maloy S. "Vectores de expresión". Universidad Estatal de San Diego .
Enlaces externos
- ORegAnno – Base de datos abierta de anotaciones regulatorias
- Video tutorial de YouTube sobre cómo identificar los sitios de unión de proteínas en la molécula de ADN
- Proyecto Promotor de las Pléyades: un proyecto de investigación cuyo objetivo es generar 160 promotores de ADN humano completamente caracterizados de menos de 4 kb (minipromotores) para impulsar la expresión genética en regiones cerebrales definidas de interés terapéutico.
- ENCODE enhebra patrones de modificación de cromatina y ARN de Explorer alrededor de promotores. Nature (revista)

