Alcaloide

Los alcaloides son una clase de compuestos orgánicos básicos que se encuentran en la naturaleza y que contienen al menos un átomo de nitrógeno . Este grupo también incluye algunos compuestos relacionados con propiedades neutras [2] e incluso débilmente ácidas . [3] Algunos compuestos sintéticos de estructura similar también pueden denominarse alcaloides. [4] Además de carbono , hidrógeno y nitrógeno , los alcaloides también pueden contener oxígeno o azufre . Más raramente aún, pueden contener elementos como fósforo , cloro y bromo . [5]
Los alcaloides son producidos por una gran variedad de organismos, incluyendo bacterias , hongos , plantas y animales . [6] Se pueden purificar a partir de extractos crudos de estos organismos por extracción ácido-base , o extracciones de solventes seguidas de cromatografía en columna de gel de sílice . [7] Los alcaloides tienen una amplia gama de actividades farmacológicas , incluyendo antipalúdicas (p. ej. quinina ), antiasmáticas (p. ej. efedrina ), anticancerígenas (p. ej. homoharringtonina ), [8] colinomiméticas (p. ej. galantamina ), [9] vasodilatadoras (p. ej. vincamina ), antiarrítmicas (p . ej. quinidina ), analgésicas (p. ej. morfina ), [10] antibacterianas (p. ej. queleritrina ), [11] y antihiperglucémicas (p. ej. berberina ). [12] [13] Muchos han encontrado uso en la medicina tradicional o moderna , o como puntos de partida para el descubrimiento de fármacos . Otros alcaloides poseen actividades psicotrópicas (p. ej. psilocina ) y estimulantes (p. ej. cocaína , cafeína , nicotina , teobromina ), [14] y se han utilizado en rituales enteogénicos o como drogas recreativas . Los alcaloides también pueden ser tóxicos (p. ej. atropina , tubocurarina ). [15] Aunque los alcaloides actúan sobre una diversidad de sistemas metabólicos en humanos y otros animales, evocan casi uniformemente un sabor amargo . [16]
El límite entre los alcaloides y otros compuestos naturales que contienen nitrógeno no está claro. [17] Compuestos como aminoácidos , péptidos , proteínas , nucleótidos , ácidos nucleicos , aminas y antibióticos no suelen llamarse alcaloides. [2] Los compuestos naturales que contienen nitrógeno en posición exocíclica ( mescalina , serotonina , dopamina , etc.) suelen clasificarse como aminas en lugar de alcaloides. [18] Sin embargo, algunos autores consideran a los alcaloides un caso especial de aminas. [19] [20] [21]
Nombramiento

El nombre "alcaloides" (en alemán: Alkaloide ) fue introducido en 1819 por el químico alemán Carl Friedrich Wilhelm Meissner, y se deriva de la raíz latina tardía alkali y el sufijo del idioma griego -οειδής - ('como'). [nb 1] Sin embargo, el término comenzó a usarse ampliamente solo después de la publicación de un artículo de revisión, por Oscar Jacobsen en el diccionario químico de Albert Ladenburg en la década de 1880. [22] [23]
No existe un método único para nombrar a los alcaloides. [24] Muchos nombres individuales se forman añadiendo el sufijo "ine" al nombre de la especie o del género. [25] Por ejemplo, la atropina se aísla de la planta Atropa belladonna ; la estricnina se obtiene de la semilla del árbol de estricnina ( Strychnos nux-vomica L.). [5] Cuando se extraen varios alcaloides de una planta, sus nombres a menudo se distinguen por variaciones en el sufijo: "idina", "anina", "alina", "inina", etc. También hay al menos 86 alcaloides cuyos nombres contienen la raíz "vin" porque se extraen de plantas de vinca como Vinca rosea ( Catharanthus roseus ); [26] estos se llaman alcaloides de vinca . [27] [28] [29]
Historia

Las plantas que contienen alcaloides han sido utilizadas por los seres humanos desde la antigüedad con fines terapéuticos y recreativos. Por ejemplo, las plantas medicinales se conocen en Mesopotamia desde aproximadamente el año 2000 a. C. [30] La Odisea de Homero hace referencia a un regalo que la reina egipcia le dio a Helena, una droga que trae el olvido. Se cree que el regalo era una droga que contenía opio. [31] Un libro chino sobre plantas de interior escrito entre los siglos I y III a. C. menciona un uso médico de la efedra y las amapolas del opio . [32] Además, las hojas de coca han sido utilizadas por los indígenas sudamericanos desde la antigüedad. [33]
Los extractos de plantas que contienen alcaloides tóxicos, como la aconitina y la tubocurarina , se han utilizado desde la antigüedad para envenenar flechas. [30]
Los estudios sobre los alcaloides comenzaron en el siglo XIX. En 1804, el químico alemán Friedrich Sertürner aisló del opio un «principio soporífero» (en latín, principium somniferum ), al que llamó «morphium», en referencia a Morfeo , el dios griego de los sueños; en alemán y en algunas otras lenguas centroeuropeas, este es todavía el nombre de la droga. El término «morfina», utilizado en inglés y francés, fue acuñado por el físico francés Joseph Louis Gay-Lussac .
Una contribución significativa a la química de los alcaloides en los primeros años de su desarrollo fue hecha por los investigadores franceses Pierre Joseph Pelletier y Joseph Bienaimé Caventou , quienes descubrieron la quinina (1820) y la estricnina (1818). Varios otros alcaloides fueron descubiertos alrededor de esa época, incluyendo la xantina (1817), la atropina (1819), la cafeína (1820), la coniina (1827), la nicotina (1828), la colchicina (1833), la esparteína (1851) y la cocaína (1860). [34] El desarrollo de la química de los alcaloides fue acelerado por la aparición de métodos espectroscópicos y cromatográficos en el siglo XX, de modo que para 2008 se habían identificado más de 12.000 alcaloides. [35]
La primera síntesis completa de un alcaloide fue lograda en 1886 por el químico alemán Albert Ladenburg . Produjo coniina mediante la reacción de 2-metilpiridina con acetaldehído y la reducción de la 2-propenilpiridina resultante con sodio. [36] [37]

Clasificaciones

En comparación con la mayoría de las demás clases de compuestos naturales, los alcaloides se caracterizan por una gran diversidad estructural. No existe una clasificación uniforme. [38] Inicialmente, cuando se carecía de conocimientos sobre las estructuras químicas, se confiaba en la clasificación botánica de las plantas de origen. Esta clasificación ahora se considera obsoleta. [5] [39]
Las clasificaciones más recientes se basan en la similitud del esqueleto carbonado ( por ejemplo , similar a indol , isoquinolina y piridina ) o precursor bioquímico ( ornitina , lisina , tirosina , triptófano , etc.). [5] Sin embargo, requieren compromisos en casos límite; [38] por ejemplo, la nicotina contiene un fragmento de piridina de nicotinamida y una parte de pirrolidina de ornitina [40] y, por lo tanto, puede asignarse a ambas clases. [41]
Los alcaloides a menudo se dividen en los siguientes grupos principales: [42]
- Los "alcaloides verdaderos" contienen nitrógeno en el heterociclo y se originan a partir de aminoácidos . [43] Sus ejemplos característicos son la atropina , la nicotina y la morfina . Este grupo también incluye algunos alcaloides que además del heterociclo de nitrógeno contienen terpenos ( por ejemplo , evonina [44] ) o fragmentos peptídicos ( por ejemplo, ergotamina [45] ). Los alcaloides de piperidina coniina y coniceína pueden considerarse alcaloides verdaderos (en lugar de pseudoalcaloides: véase más adelante) [46] aunque no se originan a partir de aminoácidos. [47]
- "Protoalcaloides", que contienen nitrógeno (pero no el heterociclo de nitrógeno) y también se originan a partir de aminoácidos. [43] Algunos ejemplos son la mescalina , la adrenalina y la efedrina .
- Alcaloides de poliamina : derivados de la putrescina , la espermidina y la espermina .
- Alcaloides peptídicos y ciclopeptídicos . [48]
- Pseudoalcaloides: compuestos similares a los alcaloides que no se originan a partir de aminoácidos. [49] Este grupo incluye alcaloides similares a terpenos y esteroides , [50] así como alcaloides similares a purinas como cafeína , teobromina , teacrina y teofilina . [51] Algunos autores clasifican la efedrina y la catinona como pseudoalcaloides. Estos se originan a partir del aminoácido fenilalanina , pero adquieren su átomo de nitrógeno no del aminoácido sino a través de la transaminación . [51] [52]
Algunos alcaloides no tienen el esqueleto carbonado característico de su grupo. Así, la galantamina y las homoaporfinas no contienen fragmentos de isoquinolina , pero, en general, se las considera alcaloides de isoquinolina. [53]
Las principales clases de alcaloides monoméricos se enumeran en la siguiente tabla:
| Clase | Grupos principales | Principales pasos de síntesis | Ejemplos |
|---|---|---|---|
| Alcaloides con heterociclos nitrogenados (alcaloides verdaderos) | |||
Derivados de pirrolidina [54]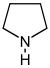 | Ornitina o arginina → putrescina → N-metilputrescina → N-metil-Δ 1 -pirrolina [55] | Cuscohigrina , higrina , higrolina, estaquidrina [54] [56] | |
Derivados del tropano [57] | Sustitución del grupo atropina en las posiciones 3, 6 o 7 | Ornitina o arginina → putrescina → N-metilputrescina → N-metil-Δ 1 -pirrolina [55] | Atropina , escopolamina , hiosciamina [54] [57] [58] |
| Grupo cocaína Sustitución en posiciones 2 y 3 | Cocaína , ecgonina [57] [59] | ||
Derivados de pirrolizidina [60] | No ésteres | En plantas: ornitina o arginina → putrescina → homospermidina → retronecina [55] | Retronecina , heliotridina, laburnina [60] [61] |
| Ésteres complejos de ácidos monocarboxílicos | Indicina, lindelofina, sarracina [60] | ||
| Diésteres macrocíclicos | Platifilina, tricodesmina [60] | ||
| 1-aminopirrolizidinas ( lolinas ) | En hongos : L -prolina + L -homoserina → N -(3-amino-3-carboxipropil)prolina → norlolina [62] [63] | Lolina, N -formilolina, N -acetilolina [64] | |
Derivados de la piperidina [65] | Lisina → cadaverina → Δ 1 -piperideína [66] | Sedamina, lobelina, anaferina, piperina [46] [67] | |
| Ácido octanoico → coniceína → coniina [47] | Coniina , coniceína [47] | ||
Derivados de quinolizidina [68] [69]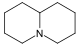 | Grupo de lupinina | Lisina → cadaverina → Δ 1 -piperideína [70] | Lupinina , nufaridina [68] |
| Grupo citisina | Citisina [68] | ||
| Grupo de esparteína | Esparteína , lupanina, anahigrina [68] | ||
| Grupo matrino . | Matrina, oximatrina, alomatridina [68] [71] [72] | ||
| Grupo de ormosanina | Ormosanina, piptantina [68] [73] | ||
Derivados de indolizidina [74] | Lisina → δ-semialdehído del ácido α-aminoadípico → ácido pipecólico → 1 indolizidinona [75] | Swainsonina , castanospermina [76] | |
Derivados de piridina [77] [78]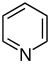 | Derivados simples de la piridina | Ácido nicotínico → ácido dihidronicotínico → 1,2-dihidropiridina [79] | Trigonelina , ricinina , arecolina [77] [80] |
| Derivados de piridina policíclicos no condensables | Nicotina , nornicotina , anabasina , anatabina [77] [80] | ||
| Derivados de piridina condensada policíclica | Actinidina , gentianina , pediculina [81] | ||
| Derivados de piridina sesquiterpénica | Ácido nicotínico , isoleucina [21] | Evonina, hipocrateína, triptonina [78] [79] | |
Derivados de isoquinolina y alcaloides relacionados [82]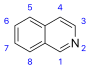 | Derivados simples de la isoquinolina [83] | Tirosina o fenilalanina → dopamina o tiramina (para alcaloides Amarillis) [84] [85] | Salsolina , lofocerina [82] [83] |
| Derivados de 1- y 3-isoquinolinas [86] | N-metilcoridaldina, noroxihidrastinina [86] | ||
| Derivados de 1- y 4-feniltetrahidroisoquinolinas [83] | Criptostilina [83] [87] | ||
| Derivados de la 5-naftil-isoquinolina [88] | Ancistrocladina [88] | ||
| Derivados de 1- y 2-bencil-izoquinolinas [89] | Papaverina , laudanosina , sendaverina | ||
| Grupo cularino [90] | Cularina, yagonina [90] | ||
| Pavinas e isopavinas [91] | Argemonina, amurensina [91] | ||
| Benzopirrocolinas [92] | Criptaustolina [83] | ||
| Protoberberinas [83] | Berberina , canadina , ofiocarpina, mecambridina, coridalina [93] | ||
| Ftalidisoquinolinas [83] | Hidrastina , narcotina (Noscapina) [94] | ||
| Espirobencilisoquinolinas [83] | Fumaricina [91] | ||
| Alcaloides de la ipecacuana [95] | Emetina, protoemetina, ipecósido [95] | ||
| Benzofenantridinas [83] | Sanguinarina, oxinitidina, corinoloxina [96] | ||
| Aporfinas [83] | Glaucina , coridina, liriodenina [97] | ||
| Proaporfinas [83] | Pronuciferina, glaziovina [83] [92] | ||
| Homoaporfinas [98] | Kreysiginine, multifloramina [98] | ||
| Homoproaporfinas [98] | Bulbocodina [90] | ||
| Morfinas [99] | Morfina , codeína , tebaína , sinomenina [100] | ||
| Homomorfinas [101] | Kreysiginine, androcymbine [99] | ||
| Tropoloisoquinolinas [83] | Imerubrina [83] | ||
| Azofluorantenos [83] | Rufescina, imeluteína [102] | ||
| Alcaloides de la amaryllis [103] | Licorina , ambelina, tazetina, galantamina , montanina [104] | ||
| Alcaloides de Erythrina [87] | Erisodina, eritroidina [87] | ||
| Derivados del fenantreno [83] | Ateroespermina [83] [93] | ||
| Protopinas [83] | Protopina , oxomuramina, coricavidina [96] | ||
| Aristolactama [83] | Doriflavina [83] | ||
Derivados del oxazol [105]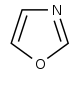 | Tirosina → tiramina [106] | Anulolina, halfordinol, texalina, texamina [107] | |
Derivados del isoxazol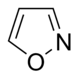 | Ácido iboténico → Muscimol | Ácido iboténico, Muscimol | |
Derivados del tiazol [108]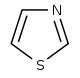 | 1-Desoxi-D-xilulosa 5-fosfato (DOXP), tirosina , cisteína [109] | Nostociclamida, tioestreptona [108] [110] | |
Derivados de quinazolina [111] | Derivados de 3,4-dihidro-4-quinazolona | Ácido antranílico o fenilalanina u ornitina [112] | Febrifugio [113] |
| Derivados de 1,4-dihidro-4-quinazolona | Glicorina, arborina, glicosmina [113] | ||
| Derivados de quinazolina pirrolidina y piperidina | Vacuna (peganina) [105] | ||
Derivados de la acridina [105] | Ácido antranílico [114] | Rutacridona, acronicina [115] [116] | |
Derivados de quinolina [117] [118]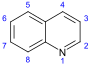 | Derivados simples de quinolina derivados de 2-quinolonas y 4-quinolonas | Ácido antranílico → 3-carboxiquinolina [119] | Cusparina, equinopsina, evocarpina [118] [120] [121] |
| Terpenoides tricíclicos | Flindersine [118] [122] | ||
| Derivados de furanoquinolina | Dictaminina, fagarina, skimmianina [118] [123] [124] | ||
| Quininas | Triptófano → triptamina → estrictósidina (con secologanina ) → korinanteal → cinhoninon [85] [119] | Quinina , quinidina , cinconina , cinonidina [122] | |
Derivados del indol [100] | Alcaloides indólicos no isoprenos | ||
| Derivados simples del indol [125] | Triptófano → triptamina o 5-hidroxitriptófano [126] | Serotonina , psilocibina , dimetiltriptamina (DMT), bufotenina [127] [128] | |
| Derivados simples de β-carbolina [129] | Harman, harmina , harmalina , eleagnina [125] | ||
| Alcaloides de pirroloindólico [130] | Fisostigmina (eserina), eteramina, fisovenina, eptastigmina [130] | ||
| Alcaloides indólicos semiterpenoides | |||
| Alcaloides del cornezuelo [100] | Triptófano → canoclavina → agroclavina → elimoclavina → ácido paspálico → ácido lisérgico [130] | Ergotamina , ergobasina, ergosina [131] | |
| Alcaloides indólicos monoterpenoides | |||
| Alcaloides del tipo Corynanthe [126] | Triptófano → triptamina → estrictósidina (con secologanina ) [126] | Ajmalicina, sarpagina, vobasina, ajmalina , yohimbina , reserpina , mitragynina , [132] [133] grupo estricnina y ( Estricnina brucina , aquamicina, vomicina [134] ) | |
| Alcaloides de tipo iboga [126] | Ibogamina , ibogaína , voacangina [126] | ||
| Alcaloides del tipo Aspidosperma [126] | Vincamina , alcaloides de la vinca , [27] [135] vincotina, aspidospermina [136] [137] | ||
Derivados del imidazol [105]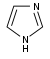 | Directamente de la histidina [138] | Histamina , pilocarpina , pilosina, estevensina [105] [138] | |
Derivados de purina [139]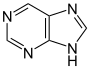 | Xantosina (formada en la biosíntesis de purina) → 7-metilxantosina → 7-metilxantina → teobromina → cafeína [85] | Cafeína , teobromina , teofilina , saxitoxina [140] [141] | |
| Alcaloides con nitrógeno en la cadena lateral (protoalcaloides) | |||
Derivados de β- feniletilamina [92]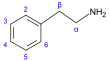 | Tirosina o fenilalanina → dioxifenilalanina → dopamina → adrenalina y mescalina tirosina → tiramina fenilalanina → 1-fenilpropano-1,2-diona → catinona → efedrina y pseudoefedrina [21] [52] [142] | Tiramina , efedrina , pseudoefedrina , mescalina , catinona , catecolaminas ( adrenalina , noradrenalina , dopamina ) [21] [143] | |
Alcaloides de la colchicina [144] | Tirosina o fenilalanina → dopamina → otoalina → colchicina [145] | Colchicina , colchamina [144] | |
Muscarina [146] | Ácido glutámico → Ácido 3-cetoglutámico → muscarina (con ácido pirúvico ) [147] | Muscarina , alomuscarina, epimuscarina, epiallomuscarina [146] | |
Bencilamina [148] | Fenilalanina con valina , leucina o isoleucina [149] | Capsaicina , dihidrocapsaicina , nordihidrocapsaicina, vainilamina [148] [150] | |
| Alcaloides de poliaminas | |||
Derivados de la putrescina [151] | ornitina → putrescina → espermidina → espermina [152] | Paucina [151] | |
Derivados de la espermidina [151] | Lunarina, codonocarpina [151] | ||
Derivados de la espermina [151] | Verbascenina, afelandrina [151] | ||
| Alcaloides peptídicos (ciclopeptídicos) | |||
| Alcaloides peptídicos con un ciclo de 13 miembros [48] [153] | Tipo C de Nummularine | A partir de diferentes aminoácidos [48] | Nummularina C, Nummularina S [48] |
| Tipo zizifina | Zizifina A, sativanina H [48] | ||
| Alcaloides peptídicos con un ciclo de 14 miembros [48] [153] | Tipo frangulanina | Frangulanina, escutianina J [153] | |
| Escutianina tipo A | Escutianina A [48] | ||
| Tipo entero | Integerrina, discarina D [153] | ||
| Anfibio tipo F | Anfibina F, espinanina A [48] | ||
| Anfibina tipo B | Anfibina B, lotusina C [48] | ||
| Alcaloides peptídicos con un ciclo de 15 miembros [153] | Mucronina tipo A | Mucronina A [45] [153] | |
| Pseudoalcaloides ( terpenos y esteroides ) | |||
Diterpenos [45] | Tipo de licoctonina | Ácido mevalónico → Pirofosfato de isopentenilo → Pirofosfato de geranilo [154] [155] | Aconitina , delfinina [45] [156] |
Alcaloides esteroides [157] | Colesterol , arginina [158] | Solanidina , ciclopamina , batracotoxina [159] | |
Propiedades
La mayoría de los alcaloides contienen oxígeno en su estructura molecular; estos compuestos suelen ser cristales incoloros en condiciones ambientales. Los alcaloides libres de oxígeno, como la nicotina [160] o la coniina [36] , son típicamente líquidos volátiles, incoloros y aceitosos. [161] Algunos alcaloides son coloreados, como la berberina (amarilla) y la sanguinarina (naranja). [161]
La mayoría de los alcaloides son bases débiles, pero algunos, como la teobromina y la teofilina , son anfóteros . [162] Muchos alcaloides se disuelven mal en agua, pero se disuelven fácilmente en disolventes orgánicos , como el éter dietílico , el cloroformo o el 1,2-dicloroetano . La cafeína , [163] la cocaína , [164] la codeína [165] y la nicotina [166] son ligeramente solubles en agua (con una solubilidad de ≥1 g/L), mientras que otros, como la morfina [167] y la yohimbina [168] son muy ligeramente solubles en agua (0,1–1 g/L). Los alcaloides y los ácidos forman sales de diversas concentraciones. Estas sales suelen ser muy solubles en agua y etanol y poco solubles en la mayoría de los disolventes orgánicos. Las excepciones incluyen el bromhidrato de escopolamina , que es soluble en disolventes orgánicos, y el sulfato de quinina soluble en agua. [161]
La mayoría de los alcaloides tienen un sabor amargo o son venenosos cuando se ingieren. La producción de alcaloides en las plantas parece haber evolucionado en respuesta a la alimentación de los animales herbívoros; sin embargo, algunos animales han desarrollado la capacidad de desintoxicar los alcaloides. [169] Algunos alcaloides pueden producir defectos de desarrollo en la descendencia de animales que consumen pero no pueden desintoxicar los alcaloides. Un ejemplo es el alcaloide ciclopamina , producido en las hojas del lirio de maíz . Durante la década de 1950, hasta el 25% de los corderos nacidos de ovejas que habían pastado en el lirio de maíz tenían graves deformaciones faciales. Estas iban desde mandíbulas deformadas hasta ciclopía (ver imagen). Después de décadas de investigación, en la década de 1980, el compuesto responsable de estas deformidades fue identificado como el alcaloide 11-desoxijervina, posteriormente rebautizado como ciclopamina. [170]
Distribución en la naturaleza

Los alcaloides son generados por varios organismos vivos, especialmente por plantas superiores : alrededor del 10 al 25% de ellos contienen alcaloides. [171] [172] Por lo tanto, en el pasado el término "alcaloide" se asociaba con las plantas. [173]
El contenido de alcaloides en las plantas suele ser de unos pocos porcentajes y no es homogéneo en los tejidos vegetales. Según el tipo de planta, la concentración máxima se observa en las hojas (por ejemplo, beleño negro ), frutos o semillas ( árbol de estricnina ), raíz ( Rauvolfia serpentina ) o corteza ( quina ). [174] Además, diferentes tejidos de la misma planta pueden contener diferentes alcaloides. [175]
Además de las plantas, los alcaloides se encuentran en ciertos tipos de hongos , como la psilocibina en los cuerpos fructíferos del género Psilocybe , y en animales, como la bufotenina en la piel de algunos sapos [24] y varios insectos, notablemente las hormigas. [176] Muchos organismos marinos también contienen alcaloides. [177] Algunas aminas , como la adrenalina y la serotonina , que desempeñan un papel importante en los animales superiores, son similares a los alcaloides en su estructura y biosíntesis y, a veces, se denominan alcaloides. [178]
Extracción

Debido a la diversidad estructural de los alcaloides, no existe un único método para su extracción a partir de materias primas naturales. [179] La mayoría de los métodos explotan la propiedad de la mayoría de los alcaloides de ser solubles en solventes orgánicos [7] pero no en agua, y la tendencia opuesta de sus sales.
La mayoría de las plantas contienen varios alcaloides. Su mezcla se extrae primero y luego se separan los alcaloides individuales. [180] Las plantas se muelen completamente antes de la extracción. [179] [181] La mayoría de los alcaloides están presentes en las plantas crudas en forma de sales de ácidos orgánicos. [179] Los alcaloides extraídos pueden permanecer sales o transformarse en bases. [180] La extracción de bases se logra procesando la materia prima con soluciones alcalinas y extrayendo las bases alcaloides con solventes orgánicos, como 1,2-dicloroetano, cloroformo, éter dietílico o benceno. Luego, las impurezas se disuelven con ácidos débiles; esto convierte las bases alcaloides en sales que se eliminan con agua. Si es necesario, una solución acuosa de sales alcaloides se vuelve a alcalinizar y se trata con un solvente orgánico. El proceso se repite hasta que se logra la pureza deseada.
En la extracción ácida, la materia prima vegetal se procesa con una solución ácida débil ( por ejemplo , ácido acético en agua, etanol o metanol). Luego se agrega una base para convertir los alcaloides en formas básicas que se extraen con un solvente orgánico (si la extracción se realizó con alcohol, se elimina primero y el resto se disuelve en agua). La solución se purifica como se describió anteriormente. [179] [182]
Los alcaloides se separan de su mezcla utilizando su diferente solubilidad en ciertos solventes y diferente reactividad con ciertos reactivos o por destilación . [183]
Se han identificado varios alcaloides de los insectos , entre los cuales los alcaloides del veneno de las hormigas de fuego , conocidos como solenopsinas, han recibido mayor atención por parte de los investigadores. [184] Estos alcaloides de insectos se pueden extraer de manera eficiente mediante inmersión en solvente de hormigas de fuego vivas [7] o mediante centrifugación de hormigas vivas [185] seguida de purificación por cromatografía en gel de sílice. [186] Se ha descrito que el seguimiento y la dosificación de los alcaloides de hormigas solenopsinas extraídos es posible en función de su pico de absorbancia alrededor de 232 nanómetros. [187]
Biosíntesis
Los precursores biológicos de la mayoría de los alcaloides son aminoácidos , como la ornitina , la lisina , la fenilalanina , la tirosina , el triptófano , la histidina , el ácido aspártico y el ácido antranílico . [188] El ácido nicotínico se puede sintetizar a partir del triptófano o del ácido aspártico. Las formas de biosíntesis de alcaloides son demasiado numerosas y no se pueden clasificar fácilmente. [85] Sin embargo, hay algunas reacciones típicas involucradas en la biosíntesis de varias clases de alcaloides, incluida la síntesis de bases de Schiff y la reacción de Mannich . [188]
Síntesis de bases de Schiff
Las bases de Schiff se pueden obtener haciendo reaccionar aminas con cetonas o aldehídos. [189] Estas reacciones son un método común para producir enlaces C=N. [190]
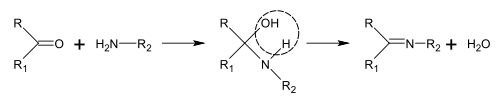
En la biosíntesis de alcaloides, tales reacciones pueden tener lugar dentro de una molécula, [188] como en la síntesis de piperidina: [41]

Reacción de Mannich
Un componente integral de la reacción de Mannich, además de una amina y un compuesto carbonílico , es un carbanión , que desempeña el papel de nucleófilo en la adición nucleofílica al ion formado por la reacción de la amina y el carbonilo. [190]

La reacción de Mannich puede ocurrir tanto intermolecular como intramolecularmente: [191] [192]

Alcaloides dímeros
Además de los alcaloides monoméricos descritos anteriormente, también existen alcaloides diméricos , e incluso triméricos y tetraméricos que se forman por condensación de dos, tres y cuatro alcaloides monoméricos. Los alcaloides diméricos se forman generalmente a partir de monómeros del mismo tipo a través de los siguientes mecanismos: [193]
- Reacción de Mannich , que produce, por ejemplo , voacamina
- Reacción de Michael (villalstonine)
- Condensación de aldehídos con aminas (toxiferina)
- Adición oxidativa de fenoles (dauricina, tubocurarina)
- Lactonización (carpaína).
También hay alcaloides diméricos formados a partir de dos monómeros distintos, como los alcaloides de la vinca vinblastina y vincristina, [27] [135] que se forman a partir del acoplamiento de la catarantina y la vindolina . [194] [195] El nuevo agente quimioterapéutico semisintético vinorelbina se utiliza en el tratamiento del cáncer de pulmón de células no pequeñas . [135] [196] Es otro dímero derivado de la vindolina y la catarantina y se sintetiza a partir de la anhidrovinblastina , [197] a partir de la leurosina [198] [199] o de los propios monómeros. [135] [195]

Papel biológico
Los alcaloides se encuentran entre los metabolitos secundarios más importantes y mejor conocidos , es decir, sustancias biógenas que no participan directamente en el crecimiento , desarrollo o reproducción normales del organismo. En cambio, generalmente median interacciones ecológicas , que pueden producir una ventaja selectiva para el organismo al aumentar su capacidad de supervivencia o fecundidad . En algunos casos, su función, si la hay, sigue sin estar clara. [200] Una hipótesis temprana, de que los alcaloides son los productos finales del metabolismo del nitrógeno en las plantas, como lo son la urea y el ácido úrico en los mamíferos, fue refutada por el hallazgo de que su concentración fluctúa en lugar de aumentar de manera constante. [17]
La mayoría de las funciones conocidas de los alcaloides están relacionadas con la protección. Por ejemplo, el alcaloide de aporfina liriodenina producido por el tulipán lo protege de los hongos parásitos. Además, la presencia de alcaloides en la planta evita que los insectos y los animales cordados la coman. Sin embargo, algunos animales están adaptados a los alcaloides e incluso los utilizan en su propio metabolismo. [201] Las sustancias relacionadas con los alcaloides como la serotonina , la dopamina y la histamina son neurotransmisores importantes en los animales. También se sabe que los alcaloides regulan el crecimiento de las plantas. [202] Un ejemplo de un organismo que utiliza alcaloides para protegerse es la Utetheisa ornatrix , más comúnmente conocida como polilla adornada. Los alcaloides de pirrolizidina hacen que estas larvas y polillas adultas sean desagradables para muchos de sus enemigos naturales como los escarabajos coccinélidos, las crisopas verdes, los hemípteros insectívoros y los murciélagos insectívoros. [203] Otro ejemplo de alcaloides utilizados se da en la polilla de la cicuta venenosa ( Agonopterix alstroemeriana). Esta polilla se alimenta de su planta huésped altamente tóxica y rica en alcaloides, la cicuta venenosa ( Conium maculatum ), durante su etapa larvaria. La A. alstroemeriana puede beneficiarse doblemente de la toxicidad de los alcaloides naturales, tanto por la falta de palatabilidad de la especie para los depredadores como por la capacidad de la A. alstroemeriana de reconocer a Conium maculatum como el lugar correcto para la oviposición. [204] Se ha demostrado que un alcaloide del veneno de las hormigas de fuego conocido como solenopsina protege a las reinas de las hormigas de fuego invasoras durante la fundación de nuevos nidos, desempeñando así un papel central en la propagación de esta especie de hormiga plaga en todo el mundo. [205]
Aplicaciones
En medicina
El uso médico de las plantas que contienen alcaloides tiene una larga historia y, por lo tanto, cuando se aislaron los primeros alcaloides en el siglo XIX, inmediatamente encontraron aplicación en la práctica clínica. [206] Muchos alcaloides todavía se utilizan en medicina, generalmente en forma de sales ampliamente utilizadas, incluidas las siguientes: [17] [207]
Muchos fármacos sintéticos y semisintéticos son modificaciones estructurales de los alcaloides, que fueron diseñados para mejorar o cambiar el efecto primario del fármaco y reducir los efectos secundarios no deseados. [208] Por ejemplo, la naloxona , un antagonista del receptor opioide , es un derivado de la tebaína que está presente en el opio . [209]
En la agricultura
Antes del desarrollo de una amplia gama de pesticidas sintéticos de toxicidad relativamente baja , algunos alcaloides, como las sales de nicotina y anabasina , se utilizaban como insecticidas . Su uso estaba limitado por su alta toxicidad para los seres humanos. [210]
Uso como drogas psicoactivas
Las preparaciones de plantas y hongos que contienen alcaloides y sus extractos, y más tarde alcaloides puros, se han utilizado durante mucho tiempo como sustancias psicoactivas . La cocaína , la cafeína y la catinona son estimulantes del sistema nervioso central . [211] [212] La mescalina y muchos alcaloides indólicos (como la psilocibina , la dimetiltriptamina y la ibogaína ) tienen un efecto alucinógeno . [213] [214] La morfina y la codeína son analgésicos narcóticos potentes. [215]
Existen alcaloides que no tienen un efecto psicoactivo fuerte por sí mismos, pero son precursores de drogas psicoactivas semisintéticas. Por ejemplo, la efedrina y la pseudoefedrina se utilizan para producir metcatinona y metanfetamina . [216] La tebaína se utiliza en la síntesis de muchos analgésicos como la oxicodona .
Véase también
Notas explicativas
- ^ Meissner, W. (1819). "Über Pflanzenalkalien: II. Über ein neues Pflanzenalkali (Alcaloide)" [Acerca de los álcalis vegetales: II. Acerca de un álcali (alcaloide) vegetal nuevo]. Revista para química y física . 25 : 379–381. Archivado desde el original el 18 de mayo de 2023.
En la penúltima frase de su artículo, Meissner escribió: "Überhaupt scheint es mir auch angemessen, die bis jetzt bekannten Pflanzenstoffe nicht mit dem Namen Alkalien, sondern Alkaloide zu belegen, da sie doch in manchen Eigenschaften von den Alkalien sehr abweichen, sie würden daher in dem Abschnitt der Pflanzenchemie vor den Pflanzensäuren ihre Stelle finden." ["En general, me parece apropiado imponer a las sustancias vegetales actualmente conocidas no el nombre de 'álcalis' sino el de 'alcaloides', ya que difieren mucho de los álcalis en algunas propiedades; entre los capítulos de la química vegetal, por lo tanto, encuentran su lugar antes de los ácidos vegetales (ya que 'Alcaloide' precedería a 'Säure' (ácido) pero seguiría a 'Alkalien')".]
Citas
- ^ Luch, Andreas (2009). Toxicología molecular, clínica y ambiental, volumen 1: Toxicología molecular. Vol. 1. Springer. pág. 20. ISBN 9783764383367.OCLC 1056390214 .
- ^ ab IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "alkaloids". doi :10.1351/goldbook.A00220
- ^ Manske, RHF (12 de mayo de 2014). Los alcaloides: química y fisiología, volumen 8. Vol. 8. Saint Louis: Elsevier. págs. 683–695. ISBN 9781483222004.OCLC 1090491824 .
- ^ Lewis, Robert Alan (23 de marzo de 1998). Diccionario de toxicología de Lewis. CRC Press. pág. 51. ISBN 9781566702232.OCLC 1026521889 .
- ^ abcd "АЛКАЛОИДЫ - Химическая энциклопедия" [Alcaloides - Enciclopedia química]. www.xumuk.ru (en ruso) . Consultado el 18 de mayo de 2023 .
- ^ Roberts, MF (Margaret F.); Wink, Michael (1998). Alcaloides: bioquímica, ecología y aplicaciones medicinales . Boston: Springer US. ISBN 9781475729054.OCLC 851770197 .
- ^ abc Gonçalves Paterson Fox, Eduardo; Russ Solís, Daniel; Delazari dos Santos, Lucilene; Aparecido dos Santos Pinto, José Roberto; Ribeiro da Silva Menegasso, Anally; Cardoso Maciel Costa Silva, Rafael; Sergio Palma, Mario; Correa Bueno, Odair; de Alcântara Machado, Ednildo (abril de 2013). "Un método sencillo y rápido para la extracción de veneno completo de hormiga brava (Insecta: Formicidae: Solenopsis)". Toxico . 65 : 5–8. Código Bib : 2013Txcn...65....5G. doi : 10.1016/j.toxicon.2012.12.009 . hdl : 11449/74946 . PMID 23333648.
- ^ Kittakoop P, Mahidol C, Ruchirawat S (2014). "Alcaloides como armazones importantes en fármacos terapéuticos para el tratamiento del cáncer, la tuberculosis y el abandono del hábito de fumar". Curr Top Med Chem . 14 (2): 239–252. doi :10.2174/1568026613666131216105049. PMID 24359196.
- ^ Russo P, Frustaci A, Del Bufalo A, Fini M, Cesario A (2013). "Fármacos multidiana de origen vegetal que actúan sobre la enfermedad de Alzheimer". Curr Med Chem . 20 (13): 1686–93. doi :10.2174/0929867311320130008. PMID 23410167.
- ^ Raymond S. Sinatra; Jonathan S. Jahr; J. Michael Watkins-Pitchford (2010). La esencia de la analgesia y los analgésicos . Cambridge University Press. págs. 82-90. ISBN 978-1139491983.
- ^ Cushnie TP, Cushnie B, Lamb AJ (2014). "Alcaloides: una descripción general de sus actividades antibacterianas, potenciadoras de antibióticos y antivirulentas". Int J Antimicrob Agents . 44 (5): 377–386. doi :10.1016/j.ijantimicag.2014.06.001. PMID 25130096. S2CID 205171789.
- ^ Singh, Sukhpal; Bansal, Abhishek; Singh, Vikramjeet; Chopra, Tanya; Poddar, Jit (junio de 2022). "Flavonoides, alcaloides y terpenoides: una nueva esperanza para el tratamiento de la diabetes mellitus". Revista de diabetes y trastornos metabólicos . 21 (1): 941–950. doi :10.1007/s40200-021-00943-8. ISSN 2251-6581. PMC 9167359 . PMID 35673446.
- ^ ab Behl, Tapan; Gupta, Amit; Albratty, Mohammed; Najmi, Asim; Meraya, Abdulkarim M.; Alhazmi, Hassan A.; Anwer, Md. Khalid; Bhatia, Saurabh; Bungau, Simona Gabriela (9 de septiembre de 2022). "Fitoconstituyentes alcaloides para el tratamiento de la diabetes: exploración del potencial no revelado". Moléculas . 27 (18): 5851. doi : 10.3390/molecules27185851 . ISSN 1420-3049. PMC 9501853 . PMID 36144587.
- ^ "Alcaloide". 18 de diciembre de 2007.
- ^ Robbers JE, Speedie MK, Tyler VE (1996). "Capítulo 9: Alcaloides". Farmacognosia y farmacobiotecnología . Filadelfia: Lippincott, Williams & Wilkins. págs. 143-185. ISBN. 978-0683085006.
- ^ Rhoades, David F (1979). "Evolución de la defensa química de las plantas contra los herbívoros". En Rosenthal, Gerald A.; Janzen, Daniel H (eds.). Herbívoros: su interacción con los metabolitos secundarios de las plantas . Nueva York: Academic Press. p. 41. ISBN 978-0-12-597180-5.
- ^ abc Robert A. Meyers Enciclopedia de ciencia física y tecnología – Alcaloides, 3.ª edición. ISBN 0-12-227411-3
- ^ Cseke, Leland J.; Kirakosyan, Ara; Kaufman, Peter B.; Warber, Sara; Duke, James A.; Brielmann, Harry L. (19 de abril de 2016). Productos naturales de plantas. CRC Press. p. 30. ISBN 978-1-4200-0447-2.
- ^ Johnson, Alyn William (1999). Invitación a la química orgánica. Jones & Bartlett Learning. pág. 433. ISBN 978-0-7637-0432-2.
- ^ Bansal, Raj K. (2003). Un libro de texto de química orgánica. New Age International Limited. pág. 644. ISBN 978-81-224-1459-2.
- ^ abcd Aniszewski, pág. 110
- ^ Hesse, págs. 1-3
- ^ Ladenburg, Albert (1882). Handwörterbuch der chemie (en alemán). E. Trewendt. págs. 213–422.
- ^ de Hesse, pág. 5
- ^ El sufijo «ine» es un sufijo patronímico femenino griego y significa «hija de»; por lo tanto, por ejemplo, «atropina» significa «hija de Atropa» (belladona): «Desarrollo de nombres sistemáticos para los alcanos simples» . yale.edu . Archivado desde el original el 16 de marzo de 2012.
- ^ Hesse, pág. 7
- ^ abc van der Heijden, Robert; Jacobs, Denise I.; Snoeijer, Wim; Hallard, Didier; Verpoorte, Robert (2004). "Los alcaloides de Catharanthus : farmacognosia y biotecnología". Química medicinal actual . 11 (5): 607–628. doi :10.2174/0929867043455846. PMID 15032608.
- ^ Cooper, Raymond; Deakin, Jeffrey John (2016). "El regalo de África al mundo". Milagros botánicos: la química de las plantas que cambiaron el mundo . CRC Press . pp. 46–51. ISBN 9781498704304.
- ^ Raviña, Enrique (2011). "Alcaloides de la vinca". La evolución del descubrimiento de fármacos: de las medicinas tradicionales a los fármacos modernos . John Wiley & Sons . pp. 157–159. ISBN 9783527326693.
- ^ por Aniszewski, pág. 182
- ^ Hesse, pág. 338
- ^ Hesse, pág. 304
- ^ Hesse, pág. 350
- ^ Hesse, págs. 313-316
- ^ Begley, Productos naturales en plantas .
- ^ ab Кониин en la Gran Enciclopedia Soviética , 1969–1978 (en ruso)
- ^ Hesse, pág. 204
- ^ de Hesse, pág. 11
- ^ Orekhov, pág. 6
- ^ Aniszewski, pág. 109
- ^ por Dewick, pág. 307
- ^ Hesse, pág. 12
- ^ de Plemenkov, pág. 223
- ^ Aniszewski, pág. 108
- ^ abcd Hesse, pág. 84
- ^ de Hesse, pág. 31
- ^ abc Dewick, pág. 381
- ^ abcdefghi Dimitris C. Gournelif; Gregory G. Laskarisb; Robert Verpoorte (1997). "Alcaloides ciclopeptídicos". Nat. Prod. Rep . 14 (1): 75–82. doi :10.1039/NP9971400075. PMID 9121730.
- ^ Aniszewski, pág. 11
- ^ Plemenkov, pág. 246
- ^ por Aniszewski, pág. 12
- ^ por Dewick, pág. 382
- ^ Hesse, págs. 44, 53
- ^ abc Plemenkov, pág. 224
- ^ abc Aniszewski, pág. 75
- ^ Orekhov, pág. 33
- ^ abc "Enciclopedia química: alcaloides tropánicos". xumuk.ru .
- ^ Hesse, pág. 34
- ^ Aniszewski, pág. 27
- ^ abcd "Enciclopedia química: alcaloides de pirrolizidina". xumuk.ru .
- ^ Plemenkov, pág. 229
- ^ Blankenship JD, Houseknecht JB, Pal S, Bush LP, Grossman RB, Schardl CL (2005). "Precursores biosintéticos de pirrolizidinas fúngicas, los alcaloides de lolina". ChemBioChem . 6 (6): 1016–1022. doi :10.1002/cbic.200400327. PMID 15861432. S2CID 13461396.
- ^ Faulkner JR, Hussaini SR, Blankenship JD, Pal S, Branan BM, Grossman RB, Schardl CL (2006). "Sobre la secuencia de formación de enlaces en la biosíntesis del alcaloides de lolina". ChemBioChem . 7 (7): 1078–1088. doi :10.1002/cbic.200600066. PMID 16755627. S2CID 34409048.
- ^ Schardl CL, Grossman RB, Nagabhyru P, Faulkner JR, Mallik UP (2007). "Alcaloides de lolina: monedas de mutualismo". Fitoquímica . 68 (7): 980–996. Bibcode :2007PChem..68..980S. doi :10.1016/j.phytochem.2007.01.010. PMID 17346759.
- ^ Plemenkov, pág. 225
- ^ Aniszewski, pág. 95
- ^ Orejov, pág. 80
- ^ abcdef "Enciclopedia química: alcaloides de quinolizidina". xumuk.ru .
- ^ Saxton, vol. 1, pág. 93
- ^ Aniszewski, pág. 98
- ^ Saxton, vol. 1, pág. 91
- ^ Joseph P. Michael (2002). "Alcaloides de indolizidina y quinolizidina". Nat. Prod. Rep . 19 (5): 458–475. doi :10.1039/b208137g. PMID 14620842.
- ^ Saxton, vol. 1, pág. 92
- ^ Dewick, pág. 310
- ^ Aniszewski, pág. 96
- ^ Aniszewski, pág. 97
- ^ abc Plemenkov, pág. 227
- ^ ab "Enciclopedia química: alcaloides de piridina". xumuk.ru .
- ^ por Aniszewski, pág. 107
- ^ por Aniszewski, pág. 85
- ^ Plemenkov, pág. 228
- ^ de Hesse, pág. 36
- ^ abcdefghijklmnopqrst "Enciclopedia química: alcaloides isoquinolínicos". xumuk.ru .
- ^ Aniszewski, págs. 77-78
- ^ abcd Begley, Biosíntesis de alcaloides
- ^ por Saxton, vol. 3, pág. 122
- ^ abc Hesse, pág. 54
- ^ de Hesse, pág. 37
- ^ Hesse, pág. 38
- ^ abc Hesse, pág. 46
- ^ abc Hesse, pág. 50
- ^ abc Kenneth W. Bentley (1997). "β-feniletilaminas y alcaloides de isoquinolina" (PDF) . Nat. Prod. Rep . 14 (4): 387–411. doi :10.1039/NP9971400387. PMID 9281839. Archivado (PDF) desde el original el 9 de octubre de 2022.
- ^ de Hesse, pág. 47
- ^ Hesse, pág. 39
- ^ de Hesse, pág. 41
- ^ de Hesse, pág. 49
- ^ Hesse, pág. 44
- ^ abc Saxton, vol. 3, pág. 164
- ^ de Hesse, pág. 51
- ^ abc Plemenkov, pág. 236
- ^ Saxton, vol. 3, pág. 163
- ^ Saxton, vol. 3, pág. 168
- ^ Hesse, pág. 52
- ^ Hesse, pág. 53
- ^ abcde Plemenkov, pág. 241
- ^ Brossi, vol. 35, pág. 261
- ^ Brossi, vol. 35, págs. 260-263
- ^ de Plemenkov, pág. 242
- ^ Begley, Biosíntesis de cofactores
- ^ John R. Lewis (2000). "Amaryllidaceae, muscarina, imidazol, oxazol, tiazol y alcaloides peptídicos, y otros alcaloides diversos". Nat. Prod. Rep . 17 (1): 57–84. doi :10.1039/a809403i. PMID 10714899.
- ^ "Enciclopedia química: alcaloides de quinazolina". xumuk.ru .
- ^ Aniszewski, pág. 106
- ^ por Aniszewski, pág. 105
- ^ Richard B. Herbert; Herbert, Richard B.; Herbert, Richard B. (1999). "La biosíntesis de alcaloides vegetales y metabolitos nitrogenados microbianos". Nat. Prod. Rep . 16 (2): 199–208. doi :10.1039/a705734b.
- ^ Plemenkov, págs. 231, 246
- ^ Hesse, pág. 58
- ^ Plemenkov, pág. 231
- ^ abcd "Enciclopedia química: alcaloides de quinolina". xumuk.ru .
- ^ por Aniszewski, pág. 114
- ^ Orekhov, pág. 205
- ^ Hesse, pág. 55
- ^ de Plemenkov, pág. 232
- ^ Orejov, pág. 212
- ^ Aniszewski, pág. 118
- ^ por Aniszewski, pág. 112
- ^ abcdef Aniszewski, pág. 113
- ^ Hesse, pág. 15
- ^ Saxton, vol. 1, pág. 467
- ^ Dewick, págs. 349-350
- ^ abc Aniszewski, pág. 119
- ^ Hesse, pág. 29
- ^ Hesse, págs. 23-26
- ^ Saxton, vol. 1, pág. 169
- ^ Saxton, vol. 5, pág. 210
- ^ abc Keglevich, Péter; Hazai, Laszlo; Kalaus, György; Szántay, Csaba (2012). "Modificaciones en los esqueletos básicos de vinblastina y vincristina". Moléculas . 17 (5): 5893–5914. doi : 10,3390/moléculas17055893 . PMC 6268133 . PMID 22609781.
- ^ Hesse, págs. 17-18
- ^ Dewick, pág. 357
- ^ por Aniszewski, pág. 104
- ^ Hesse, pág. 72
- ^ Hesse, pág. 73
- ^ Dewick, pág. 396
- ^ "PlantCyc Pathway: biosíntesis de efedrina". Archivado desde el original el 10 de diciembre de 2011.
- ^ Hesse, pág. 76
- ^ ab "Enciclopedia química: alcaloides de la colchicina". xumuk.ru .
- ^ Aniszewski, pág. 77
- ^ de Hesse, pág. 81
- ^ Brossi, vol. 23, pág. 376
- ^ de Hesse, pág. 77
- ^ Brossi, vol. 23, pág. 268
- ^ Brossi, vol. 23, pág. 231
- ^ abcdef Hesse, pág. 82
- ^ "Biosíntesis de espermina". www.qmul.ac.uk . Archivado desde el original el 13 de noviembre de 2003.
- ^ abcdef Plemenkov, pág. 243
- ^ "Enciclopedia química: terpenos". xumuk.ru .
- ^ Begley, Productos naturales: una descripción general
- ^ Atta-ur-Rahman y M. Iqbal Choudhary (1997). "Alcaloides diterpenoides y esteroides". Nat. Prod. Rep . 14 (2): 191–203. doi :10.1039/np9971400191. PMID 9149410.
- ^ Hesse, pág. 88
- ^ Dewick, pág. 388
- ^ Plemenkov, pág. 247
- ^ Nikotín en la Gran Enciclopedia Soviética , 1969-1978 (en ruso)
- ^ abc Grinkevich, pág. 131
- ^ Spiller, Gene A. (23 de abril de 2019). Cafeína. Prensa CRC. pag. 140.ISBN 978-1-4200-5013-4.
- ^ "Cafeína". DrugBank . Consultado el 12 de febrero de 2013 .
- ^ "Cocaína". DrugBank . Consultado el 12 de febrero de 2013 .
- ^ "Codeína". DrugBank . Consultado el 12 de febrero de 2013 .
- ^ "Nicotina". DrugBank . Consultado el 12 de febrero de 2013 .
- ^ "Morfina". DrugBank . Consultado el 12 de febrero de 2013 .
- ^ "Yohimbina". DrugBank . Archivado desde el original el 30 de enero de 2013 . Consultado el 12 de febrero de 2013 .
- ^ Fatorusso, pág. 53
- ^ Thomas Acamovic; Colin S. Stewart; TW Pennycott (2004). Plantas venenosas y toxinas relacionadas, volumen 2001. CABI. p. 362. ISBN 978-0-85199-614-1.
- ^ Aniszewski, pág. 13
- ^ Orekhov, pág. 11
- ^ Hesse, pág. 4
- ^ Grinkevich, págs. 122-123
- ^ Orekhov, pág. 12
- ^ Touchard, Axel; Aili, Samira; Zorro, Eduardo; Escoubas, Pierre; Orivel, Jérôme; Nicholson, Graham; Dejean, Alain (20 de enero de 2016). "El arsenal de toxinas bioquímicas de los venenos de hormigas". Toxinas . 8 (1): 30. doi : 10.3390/toxinas8010030 . ISSN 2072-6651. PMC 4728552 . PMID 26805882.
- ^ Fattorusso, pág. XVII
- ^ Aniszewski, págs. 110-111
- ^ abcd Hesse, pág. 116
- ^ de Grinkevich, pág. 132
- ^ Grinkevich, pág. 5
- ^ Grinkevich, págs. 132-134
- ^ Grinkevich, págs. 134-136
- ^ Fox, Eduardo Gonçalves Paterson (2016). "Toxinas del veneno de las hormigas de fuego". En Gopalakrishnakone, P.; Calvete, Juan J. (eds.). Genómica y proteómica del veneno . Springer Netherlands. págs. 149–167. doi :10.1007/978-94-007-6416-3_38. ISBN 978-94-007-6415-6.
- ^ Fox, Eduardo GP; Xu, Meng; Wang, Lei; Chen, Li; Lu, Yong-Yue (1 de mayo de 2018). "Ordeño rápido de veneno fresco de himenópteros aculeatos". Toxico . 146 : 120-123. Código Bib : 2018Txcn..146..120F. doi :10.1016/j.toxicon.2018.02.050. ISSN 0041-0101. PMID 29510162.
- ^ Chen, Jian; Cantrell, Charles L.; Shang, Han-wu; Rojas, Maria G. (22 de abril de 2009). "Alcaloides de piperideína de la glándula venenosa de la hormiga roja de fuego importada (Hymenoptera: Formicidae)". Revista de química agrícola y alimentaria . 57 (8): 3128–3133. doi :10.1021/jf803561y. ISSN 0021-8561. PMID 19326861.
- ^ Fox, Eduardo GP; Xu, Meng; Wang, Lei; Chen, Li; Lu, Yong-Yue (1 de junio de 2018). "Cromatografía de gases y espectroscopia UV de venenos de himenópteros obtenidos por centrifugación trivial". Datos breves . 18 : 992–998. Bibcode :2018DIB....18..992F. doi :10.1016/j.dib.2018.03.101. ISSN 2352-3409. PMC 5996826 . PMID 29900266.
- ^ abc Plemenkov, pág. 253
- ^ Plemenkov, pág. 254
- ^ por Dewick, pág. 19
- ^ Plemenkov, pág. 255
- ^ Dewick, pág. 305
- ^ Hesse, págs. 91-105
- ^ Hirata, K.; Miyamoto, K.; Miura, Y. (1994). "Catharanthus roseus L. (Periwinkle): Producción de vindolina y catarantina en cultivos de múltiples brotes". En Bajaj, YPS (ed.). Biotecnología en agricultura y silvicultura 26. Plantas medicinales y aromáticas. Vol. VI. Springer-Verlag . págs. 46–55. ISBN 9783540563914.
- ^ ab Gansäuer, Andreas; Justicia, José; Fan, Chun-An; Worgull, Dennis; Piestert, Frederik (2007). "Formación de enlace C—C reductor después de la apertura del epóxido mediante transferencia de electrones". En Krische, Michael J. (ed.). Formación de enlace C—C reductor catalizado por metales: una desviación de los reactivos organometálicos preformados . Temas de química actual. Vol. 279. Springer Science & Business Media . págs. 25–52. doi :10.1007/128_2007_130. ISBN 9783540728795.
- ^ Faller, Bryan A.; Pandi, Trailokya N. (2011). "Seguridad y eficacia de la vinorelbina en el tratamiento del cáncer de pulmón de células no pequeñas". Clinical Medicine Insights: Oncology . 5 : 131–144. doi :10.4137/CMO.S5074. PMC 3117629 . PMID 21695100.
- ^ Ngo, Quoc Anh; Roussi, Fanny; Cormier, Anthony; Thoret, Sylviane; Knossow, Marcel; Guénard, Daniel; Guéritte, Françoise (2009). "Síntesis y evaluación biológica de alcaloides de la vinca e híbridos de fomopsina". Revista de química medicinal . 52 (1): 134–142. doi :10.1021/jm801064y. PMID 19072542.
- ^ Hardouin, Christophe; Doris, Eric; Rousseau, Bernard; Mioskowski, Charles (2002). "Síntesis concisa de anhidrovinblastina a partir de leurosina". Organic Letters . 4 (7): 1151–1153. doi :10.1021/ol025560c. PMID 11922805.
- ^ Morcillo, Sara P.; Miguel, Delia; Campaña, Araceli G.; Cienfuegos, Luis Álvarez de; Justicia, José; Cuerva, Juan M. (2014). "Aplicaciones recientes de Cp2TiCl en síntesis de productos naturales". Fronteras de la química orgánica . 1 (1): 15–33. doi : 10.1039/c3qo00024a . hdl : 10481/47295 .
- ^ Aniszewski, pág. 142
- ^ Hesse, págs. 283-291
- ^ Aniszewski, págs. 142-143
- ^ WE Conner (2009). Polillas tigre y osos lanudos: comportamiento, ecología y evolución de los Arctiidae . Nueva York: Oxford University Press. pp. 1–10. ISBN 0195327373 .
- ^ Castells, Eva; Berenbaum, May R. (junio de 2006). "Cría en laboratorio de Agonopterix alstroemeriana, la polilla defoliadora de la cicuta (Conium maculatum L.), y efectos de los alcaloides de piperidina en la preferencia y el rendimiento". Entomología ambiental . 35 (3): 607–615. doi : 10.1603/0046-225x-35.3.607 . S2CID 45478867 – vía ResearchGate.
- ^ Fox, Eduardo GP; Wu, Xiaoqing; Wang, Lei; Chen, Li; Lu, Yong-Yue; Xu, Yijuan (1 de febrero de 2019). "La isosolenopsina A del veneno de la reina proporciona una rápida incapacitación de las hormigas de fuego competidoras". Toxicon . 158 : 77–83. Bibcode :2019Txcn..158...77F. doi :10.1016/j.toxicon.2018.11.428. ISSN 0041-0101. PMID 30529381. S2CID 54481057.
- ^ Hesse, pág. 303
- ^ Hesse, págs. 303-309
- ^ Hesse, pág. 309
- ^ Dewick, pág. 335
- ^ Matolcsy, G.; Nadasy, M.; Andriska, V. (1 de enero de 1989). Química de plaguicidas. Elsevier. págs. 21-22. ISBN 978-0-08-087491-3.
- ^ Veselovskaya, pág. 75
- ^ Hesse, pág. 79
- ^ Veselovskaya, pág. 136
- ^ Ibogaína: Actas de la Primera Conferencia Internacional (The Alkaloids Book 56) . Elsevier Science. 1950. pág. 8. ISBN 978-0-12-469556-6.
- ^ Veselovskaya, pág. 6
- ^ Veselovskaya, págs. 51-52
Referencias generales y citadas
- Aniszewski, Tadeusz (2007). Alcaloides: secretos de la vida . Ámsterdam: Elsevier . ISBN. 978-0-444-52736-3.
- Begley, Tadhg P. (2009). Enciclopedia de biología química . Vol. 10. Wiley. Págs. 1569-1570. doi :10.1002/cbic.200900262. ISBN . 978-0-471-75477-0.
- Brossi, Arnold (1989). Los alcaloides: química y farmacología . Academic Press.
- Dewick, Paul M. (2002). Productos naturales medicinales: un enfoque biosintético (segunda edición). Wiley. ISBN 978-0-471-49640-3.
- Fattorusso, E.; Taglialatela-Scafati, O. (2008). Alcaloides modernos: estructura, aislamiento, síntesis y biología . Wiley-VCH. ISBN 978-3-527-31521-5.
- Grinkevich NI; Safronich LN, eds. (1983). El análisis químico de las plantas medicinales (en ruso). Moscú: Vysshaya Shkola.
- Hesse, Manfred (2002). Alcaloides: ¿maldición o bendición de la naturaleza? . Wiley-VCH. ISBN 978-3-906390-24-6.
- Knunyants, IL (1988). Enciclopedia química. Enciclopedia soviética.
- Orekhov, AP (1955). Química de alcaloides (Acad. 2.ª ed.). Moscú.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - Plemenkov, VV (2001). Introducción a la química de compuestos naturales . Kazán.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - Saxton, JE (1971). Los alcaloides: un informe periódico especializado . Londres: The Chemical Society.
- Veselovskaya, NB; Kovalenko, AE (2000). Drogas . Moscú: Triada-X.
- Wink, M (2009). "Modo de acción y toxicología de toxinas vegetales y plantas venenosas". Mitt. Julius Kühn-Inst . 421 : 93–112x.