Punto de control del husillo

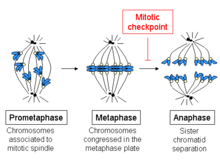
El punto de control del huso , también conocido como transición de metafase a anafase , punto de control de ensamblaje del huso ( SAC ), punto de control de metafase o punto de control mitótico , es un punto de control del ciclo celular durante la metafase de la mitosis o meiosis que impide la separación de los cromosomas duplicados ( anafase ) hasta que cada cromosoma esté correctamente unido al huso . Para lograr una segregación adecuada, los dos cinetocoros de las cromátidas hermanas deben estar unidos a polos opuestos del huso (orientación bipolar). [1] Solo este patrón de unión garantizará que cada célula hija reciba una copia del cromosoma. La característica bioquímica definitoria de este punto de control es la estimulación del complejo promotor de anafase por los complejos ciclina-CDK de fase M , que a su vez provoca la destrucción proteolítica de las ciclinas y las proteínas que mantienen unidas a las cromátidas hermanas . [2]
Visión general e importancia
El inicio de la metafase se caracteriza por la conexión de los microtúbulos a los cinetocoros de los cromosomas, así como por la alineación de los cromosomas en el centro de la célula. Cada cromátida tiene su propio cinetocoro, y todos los microtúbulos que están unidos a los cinetocoros de las cromátidas hermanas irradian desde polos opuestos de la célula. Estos microtúbulos ejercen una fuerza de tracción sobre los cromosomas hacia los extremos opuestos de las células, mientras que la cohesión entre las cromátidas hermanas se opone a esta fuerza.
En la transición de metafase a anafase, esta cohesión entre las cromátidas hermanas se disuelve y las cromátidas separadas son atraídas hacia lados opuestos de la célula por los microtúbulos del huso. Las cromátidas se separan aún más por el movimiento físico de los propios polos del huso. La disociación prematura de las cromátidas puede provocar una segregación incorrecta de los cromosomas y aneuploidía en las células hijas. Por lo tanto, la función del punto de control del huso es impedir esta transición a la anafase hasta que los cromosomas estén correctamente unidos, antes de que las cromátidas hermanas se separen.
Para preservar la identidad y el funcionamiento adecuado de la célula, es necesario mantener el número adecuado de cromosomas después de cada división celular . Un error en la generación de células hijas con un número de cromosomas menor o mayor que el esperado (una situación denominada aneuploidía ), puede conducir en el mejor de los casos a la muerte celular o, alternativamente, puede generar resultados fenotípicos catastróficos. [3] [4] Algunos ejemplos incluyen:
- En las células cancerosas, la aneuploidía es un evento frecuente, lo que indica que estas células presentan un defecto en la maquinaria involucrada en la segregación cromosómica , así como en el mecanismo que asegura que dicha segregación se realice correctamente.
- En los seres humanos, el síndrome de Down aparece en niños que portan en sus células una copia extra del cromosoma 21 , como resultado de un defecto en la segregación cromosómica durante la meiosis en uno de los progenitores. Este defecto generará un gameto (espermatozoide u ovocito) con un cromosoma 21 extra. Tras la fecundación , este gameto generará un embrión con tres copias del cromosoma 21.
Descubrimiento del punto de control del ensamblaje del husillo (SAC)

Zirkle (en 1970) fue uno de los primeros investigadores en observar que, cuando un solo cromosoma se retrasa en llegar a la placa metafásica, el inicio de la anafase se pospone hasta algunos minutos después de su llegada. [5] Esta observación, junto con otras similares, sugirió que existe un mecanismo de control en la transición de metafase a anafase. Usando fármacos como nocodazol y colchicina , el huso mitótico se desmonta y el ciclo celular se bloquea en la transición de metafase a anafase. Usando estos fármacos (ver la revisión de Rieder y Palazzo en 1992 [6] ), el supuesto mecanismo de control se denominó Punto de Control de Ensamblaje del Huso (SAC). Este mecanismo regulador ha sido estudiado intensivamente desde entonces. [7]
Utilizando diferentes tipos de estudios genéticos, se ha establecido que diversos tipos de defectos son capaces de activar el SAC: despolimerización del huso, [8] [9] presencia de cromosomas dicéntricos (con dos centrómeros), [10] centrómeros segregándose de forma aberrante, [11] defectos en los cuerpos polares del huso en S. cerevisiae , [12] defectos en las proteínas del cinetocoro, [13] mutaciones en el ADN centromérico [14] o defectos en los motores moleculares activos durante la mitosis. [8] Un resumen de estas observaciones se puede encontrar en el artículo de Hardwick y colaboradores en 1999. [15]
Zirkle [5] , basándose en sus propias observaciones, fue el primero en proponer que “alguna (…) sustancia, necesaria para que la célula pase a la anafase, aparece algunos minutos después de C (momento de la llegada del último cromosoma a la placa metafásica), o después de un cambio drástico en la condición citoplasmática , justo en C o inmediatamente después de C”, sugiriendo que esta función se localiza en cinetocoros no unidos al huso mitótico. McIntosh amplió esta propuesta, sugiriendo que una enzima sensible a la tensión ubicada en los centrómeros produce un inhibidor del inicio de la anafase cuando los dos cinetocoros hermanos no están bajo tensión bipolar. [16] De hecho, los datos disponibles sugerían que la señal “esperar para entrar en anafase” se produce principalmente en o cerca de cinetocoros no unidos. [17] Sin embargo, el evento primario asociado a la unión del cinetocoro al huso, que es capaz de inactivar la señal inhibidora y liberar el arresto de la metafase, podría ser la adquisición de microtúbulos por el cinetocoro (como propusieron Rieder y colaboradores en 1995 [17] ), o la tensión que estabiliza el anclaje de los microtúbulos a los cinetocoros (como lo sugieren los experimentos realizados en el laboratorio de Nicklas [18] ). Estudios posteriores en células que contienen dos husos mitóticos independientes en un solo citoplasma mostraron que el inhibidor de la transición de metafase a anafase es generado por cinetocoros no unidos y no es libremente difundible en el citoplasma. [19] Sin embargo, en el mismo estudio se demostró que, una vez iniciada la transición de metafase a anafase en una parte de la célula, esta información se extiende a todo el citoplasma , y puede superar la señal "esperar para entrar en anafase" asociada a un segundo huso que contiene cinetocoros no unidos.
Antecedentes sobre la duplicación, cohesión y segregación de las cromátidas hermanas
División celular: duplicación de material y distribución a células hijas

Cuando las células están listas para dividirse, porque el tamaño celular es lo suficientemente grande o porque reciben el estímulo apropiado, [20] activan el mecanismo para entrar en el ciclo celular, y duplican la mayoría de los orgánulos durante la fase S (síntesis), incluido su centrosoma . Por lo tanto, cuando finalice el proceso de división celular, cada célula hija recibirá un juego completo de orgánulos. Al mismo tiempo, durante la fase S todas las células deben duplicar su ADN de forma muy precisa, un proceso denominado replicación del ADN . Una vez finalizada la replicación del ADN, en los eucariotas la molécula de ADN se compacta y condensa, para formar los cromosomas mitóticos , cada uno constituido por dos cromátidas hermanas , que se mantienen unidas por el establecimiento de cohesión entre ellas; cada cromátida es una molécula de ADN completa, unida mediante microtúbulos a uno de los dos centrosomas de la célula en división, ubicados en polos opuestos de la célula. La estructura formada por los centrosomas y los microtúbulos recibe el nombre de huso mitótico , debido a su forma característica, albergando los cromosomas entre los dos centrosomas. Las cromátidas hermanas se mantienen juntas hasta la anafase , momento en el que cada una de ellas se desplaza hacia el centrosoma al que está unida. De esta forma, cuando las dos células hijas se separen al final del proceso de división, cada una contendrá un juego completo de cromátidas. El mecanismo responsable de la correcta distribución de las cromátidas hermanas durante la división celular se denomina segregación cromosómica .
Para que la segregación cromosómica se produzca correctamente, las células han desarrollado un mecanismo preciso y complejo. En primer lugar, las células deben coordinar la duplicación del centrosoma con la replicación del ADN, y un fallo en esta coordinación generará husos mitóticos monopolares o multipolares, que generalmente producirán una segregación cromosómica anormal, [21] porque en este caso la distribución cromosómica no se producirá de forma equilibrada.
Mitosis: anclaje de los cromosomas al huso y segregación cromosómica

Durante la fase S, el centrosoma comienza a duplicarse. Justo al comienzo de la mitosis, ambos centriolos alcanzan su longitud máxima, reclutan material adicional y aumenta su capacidad para nucleación de microtúbulos. A medida que progresa la mitosis, ambos centrosomas se separan para generar el huso mitótico. [22] De esta manera, el huso mitótico tiene dos polos que emanan microtúbulos. Los microtúbulos (MT) son filamentos proteicos largos, con extremidades asimétricas: un extremo denominado "menos" (-), relativamente estable y cercano al centrosoma, y un extremo denominado "más" (+), con fases alternas de crecimiento y retracción, explorando el centro de la célula en busca de los cromosomas. Cada cromátida tiene una región especial, llamada centrómero , sobre la cual se ensambla una estructura proteica denominada cinetocoro , que es capaz de estabilizar el extremo positivo del microtúbulo. Por lo tanto, si por casualidad un microtúbulo que explora el centro de la célula encuentra un cinetocoro, puede suceder que el cinetocoro lo capture, de modo que el cromosoma se adhiera al huso a través del cinetocoro de una de sus cromátidas hermanas. El cromosoma desempeña un papel activo en la unión de los cinetocoros al huso. Unido a la cromatina hay un factor de intercambio de nucleótidos de guanina Ran (GEF) que estimula la Ran citosólica cerca del cromosoma para que se una a GTP en lugar de GDP. La forma activada de Ran unida a GTP libera proteínas estabilizadoras de microtúbulos, como TPX2, de complejos proteicos en el citosol, lo que induce la nucleación y polimerización de microtúbulos alrededor de los cromosomas. [23] Estos microtúbulos derivados del cinetocoro, junto con las proteínas motoras de kinesina en el cinetocoro externo, facilitan las interacciones con la superficie lateral de un microtúbulo derivado del polo del huso. Sin embargo, estas uniones laterales son inestables y deben convertirse en uniones de extremo a extremo. La conversión de uniones laterales a uniones de extremo a extremo permite que el crecimiento y la contracción de los extremos positivos de los microtúbulos se conviertan en fuerzas que empujan y tiran de los cromosomas para lograr una biorientación adecuada. Como sucede que las cromátidas hermanas están unidas entre sí y ambos cinetocoros están ubicados uno detrás del otro en ambas cromátidas, cuando un cinetocoro se une a un centrosoma, el cinetocoro hermano queda expuesto al centrosoma ubicado en el polo opuesto; por esta razón, en la mayoría de los casos el segundo cinetocoro se asocia al centrosoma en el polo opuesto, a través de sus microtúbulos, [24] de modo que los cromosomas se vuelven "biorientados", una configuración fundamental (también llamada anfitélica ) para garantizar que la segregación cromosómica se lleve a cabo correctamente cuando la célula se divida. [25] [26]Ocasionalmente, uno de los dos cinetocoros hermanos puede unirse simultáneamente a MTs generados por ambos polos, una configuración denominada merotélica , que no es detectada por el punto de control del huso pero que puede generar cromosomas rezagados durante la anafase y, en consecuencia, aneuploidía. La orientación merotélica (caracterizada por la ausencia de tensión entre cinetocoros hermanos) es frecuente al inicio de la mitosis, pero la proteína Aurora B (una quinasa conservada desde levaduras hasta vertebrados) detecta y elimina este tipo de anclaje. [27] (Aurora B se sobreexpresa con frecuencia en varios tipos de tumores y actualmente es un objetivo para el desarrollo de fármacos anticancerígenos. [28] )
Cohesión de las cromátidas hermanas durante la mitosis
Cohesina: proteínas SMC
Las cromátidas hermanas permanecen asociadas desde la fase S (cuando el ADN se replica para generar dos copias idénticas, las dos cromátidas) hasta la anafase. En este punto, las dos cromátidas hermanas se separan y viajan a polos opuestos en la célula en división. Estudios genéticos y bioquímicos en levadura y en extractos de huevo en Xenopus laevis identificaron un complejo poliproteico como un jugador esencial en la cohesión de las cromátidas hermanas (ver la revisión de Hirano en 2000 [29] ). Este complejo se conoce como el complejo de cohesión y en Saccharomyces cerevisiae está compuesto por al menos cuatro subunidades: Smc1p, Smc3p, Scc1p (o Mcd1p) y Scc3p. Tanto Smc1p como Smc3p pertenecen a la familia de proteínas para el Mantenimiento Estructural de Cromosomas (SMC), que constituyen un grupo de ATPasas cromosómicas altamente conservadas, y forman un heterodímero (Smc1p/Smc3p). Scc1p es el homólogo en S. cerevisiae de Rad21, identificado por primera vez como una proteína involucrada en la reparación del ADN en S. pombe . Estas cuatro proteínas son esenciales en levadura, y una mutación en cualquiera de ellas producirá una separación prematura de las cromátidas hermanas. En levadura, la cohesina se une a sitios preferenciales a lo largo de los brazos cromosómicos, y es muy abundante cerca de los centrómeros, como se demostró en un estudio utilizando inmunoprecipitación de cromatina. [30]
El papel de la heterocromatina
Las observaciones citológicas clásicas sugirieron que las cromátidas hermanas están unidas más fuertemente en las regiones heterocromáticas , [31] y esto sugirió que la estructura o composición especial de la heterocromatina podría favorecer el reclutamiento de cohesina. [32] De hecho, se ha demostrado que Swi6 (el homólogo de HP-1 en S. pombe ) se une a la Lys 9 metilada de la histona H3 y promueve la unión de la cohesina a las repeticiones centroméricas en S. pombe . [33] [34] Estudios más recientes indican que la maquinaria de ARNi regula el establecimiento de la heterocromatina, que a su vez recluta cohesina a esta región, tanto en S. pombe [35] como en células de vertebrados. [36] Sin embargo, deben existir otros mecanismos además de la heterocromatina para asegurar una cohesión aumentada en los centrómeros, porque S. cerevisiae carece de heterocromatina junto a los centrómeros, pero la presencia de un centrómero funcional induce un aumento de la asociación de cohesión en una región contigua, que abarca 20-50 kb. [37]
En esta dirección, Orc2 (una proteína incluida en el complejo de reconocimiento de origen , ORC, implicado en el inicio de la replicación del ADN durante la fase S ) también se encuentra en los cinetocoros durante la mitosis en células humanas; [38] de acuerdo con esta localización, algunas observaciones indican que Orc2 en levadura está implicado en la cohesión de las cromátidas hermanas, y su eliminación induce la activación de SAC. [39] También se ha observado que otros componentes del complejo ORC (como orc5 en S. pombe ) están implicados en la cohesión. [40] Sin embargo, la vía molecular que involucra a las proteínas ORC parece ser aditiva a la vía de las cohesinas, y es en su mayoría desconocida.
Función de cohesión y su disolución

La cohesión centromérica resiste las fuerzas ejercidas por los microtúbulos del huso hacia los polos, que generan tensión entre cinetocoros hermanos. A su vez, esta tensión estabiliza la unión microtúbulo-cinetocoro, a través de un mecanismo que involucra a la proteína Aurora B (una revisión sobre este tema: Hauf y Watanabe 2004 [41] ).
De hecho, una disminución en los niveles celulares de cohesina genera la separación prematura de las cromátidas hermanas, así como defectos en la congresividad cromosómica en la placa metafásica y deslocalización de las proteínas en el complejo pasajero cromosómico , que contiene la proteína Aurora B. [42] [43] La estructura propuesta para el complejo de cohesina sugiere que este complejo conecta directamente ambas cromátidas hermanas. [44] En esta estructura propuesta, los componentes SMC de la cohesina juegan un papel estructural, de modo que el heterodímero SMC puede funcionar como una proteína de unión al ADN, cuya conformación está regulada por ATP . [45] Scc1p y Scc3p, sin embargo, jugarían un papel regulador. [29]
En S. cerevisiae , Pds1p (también conocida como securina ) regula la cohesión de las cromátidas hermanas, porque se une e inhibe la proteasa Esp1p ( separarina o separasa ). Cuando se desencadena el inicio de la anafase, el complejo promotor de la anafase ( APC/C o ciclosoma) degrada la securina. APC/C es una ligasa de ubiquitina de anillo E3 que recluta una enzima conjugadora de ubiquitina E2 cargada con ubiquitina. La securina se reconoce solo si Cdc20, la subunidad activadora, está unida al núcleo de APC/C. Cuando securina, Cdc20 y E2 están todos unidos a APC/C, E2 ubiquitina la securina y la degrada selectivamente. La degradación de la securina libera la proteasa Esp1p/separasa, que degrada los anillos de cohesión que unen las dos cromátidas hermanas, promoviendo así la separación de las cromátidas hermanas. [46] También se ha demostrado que la quinasa Polo/Cdc5 fosforila residuos de serina próximos al sitio de corte para Scc1, y esta fosforilación facilitaría la actividad de corte. [47]
Aunque esta maquinaria se conserva a través de la evolución, [48] [49] en vertebrados la mayoría de las moléculas de cohesión se liberan en profase, independientemente de la presencia de APC/C, en un proceso dependiente de Polo-like 1 ( PLK1 ) y Aurora B. [50] Sin embargo, se ha demostrado que una pequeña cantidad de Scc1 permanece asociada a los centrómeros en células humanas hasta la metafase, y una cantidad similar se corta en anafase, cuando desaparece de los centrómeros. [51] Por otro lado, algunos experimentos muestran que la cohesión de las cromátidas hermanas en los brazos se pierde gradualmente después de que los centrómeros hermanos se han separado, y las cromátidas hermanas se mueven hacia los polos opuestos de la célula. [52] [53]
Según algunas observaciones, una fracción de las cohesinas de los brazos cromosómicos y las cohesinas centroméricas están protegidas por la proteína Shugoshin (Sgo1), evitando su liberación durante la profase. [54] [55] Para poder funcionar como protector de la cohesión centromérica, Sgo1 debe ser inactivada al inicio de la anafase, al igual que Pds1p. De hecho, tanto Pds1p como Sgo1 son sustratos de APC/C en vertebrados. [56]
Mitosis
En los ovocitos de ratón , el daño del ADN induce el arresto de la profase I meiótica que está mediada por el punto de control del ensamblaje del huso. [57] Los ovocitos arrestados no entran en la etapa posterior, anafase I. Las roturas de doble cadena de ADN, el daño del ADN inducido por UVB y la radiación ionizante causan un bloqueo efectivo a la actividad del complejo promotor de la anafase. [57] Este punto de control puede ayudar a prevenir que los ovocitos con ADN dañado progresen para convertirse en óvulos maduros fertilizables. [57] Durante el arresto de la profase, los ovocitos de ratón parecen utilizar tanto la reparación recombinacional homóloga como la unión de extremos no homólogos para reparar las roturas de doble cadena de ADN. [58]
Descripción general del punto de control del conjunto del husillo
El punto de control del ensamblaje del huso (SAC) es una señal activa producida por cinetocoros incorrectamente unidos , que se conserva en todos los eucariotas . El SAC detiene el ciclo celular al regular negativamente CDC20, evitando así la activación de las actividades de poliubiquitinación del complejo promotor de anafase (APC). Las proteínas responsables de la señal SAC componen el complejo de punto de control mitótico (MCC), que incluye las proteínas SAC, MAD2 /MAD3 (arresto mitótico deficiente), BUB3 (gemación no inhibida por benzimidazol) y CDC20 . [59] Otras proteínas involucradas en el SAC incluyen MAD1 , BUB1 , MPS1 y Aurora B. Para eucariotas superiores, los reguladores adicionales del SAC incluyen constituyentes del complejo ROD-ZW10 , p31comet, MAPK , CDK1-ciclina-B , NEK2 y PLK1 . [60]
Activación del punto de control
El SAC monitorea la interacción entre los cinetocoros conectados incorrectamente y los microtúbulos del huso , y se mantiene hasta que los cinetocoros se unen correctamente al huso. Durante la prometafase , CDC20 y las proteínas SAC se concentran en los cinetocoros antes de la unión al ensamblaje del huso. Estas proteínas mantienen el SAC activado hasta que se eliminan y se realiza la unión correcta cinetocoro-microtúbulo. Incluso un solo cinetocoro no unido puede mantener el punto de control del huso. [59] Después de la unión de los extremos positivos de los microtúbulos y la formación de los microtúbulos del cinetocoro, MAD1 y MAD2 se agotan del ensamblaje del cinetocoro. Otro regulador de la activación del punto de control es la tensión del cinetocoro. Cuando los cinetocoros hermanos están unidos correctamente a los polos opuestos del huso, las fuerzas en el huso mitótico generan tensión en los cinetocoros. Los cinetocoros hermanos biorientados estabilizan el ensamblaje cinetocoro-microtúbulo, mientras que la tensión débil tiene un efecto desestabilizador. En respuesta a las uniones incorrectas del cinetocoro, como la unión sintélica , donde ambos cinetocoros se unen a un polo del huso, la tensión débil generada desestabiliza la unión incorrecta y permite que el cinetocoro se vuelva a unir correctamente al cuerpo del huso. Durante este proceso, los cinetocoros que están unidos al huso mitótico pero que no están bajo tensión activan el punto de control del huso. La quinasa Aurora-B/Ipl1 del complejo pasajero cromosómico funciona como el sensor de tensiones en las uniones incorrectas del cinetocoro. Detecta y desestabiliza las uniones incorrectas a través del control de la kinesina KINI MCAK que corta los microtúbulos, el complejo DASH y el complejo Ndc80/Hec1 [61] en la interfaz microtúbulo-cinetocoro. [60] La quinasa Aurora-B/Ipl1 también es fundamental para corregir las uniones merotélicas , donde un cinetocoro está unido simultáneamente a ambos polos del huso. Las uniones merotélicas generan suficiente tensión y no son detectadas por el SAC y, sin corrección, pueden dar lugar a una segregación incorrecta de los cromosomas debido a la velocidad lenta de migración de las cromátidas. Si bien la unión de los microtúbulos es necesaria de forma independiente para la activación del SAC, no está claro si la tensión es un regulador independiente del SAC, aunque está claro que surgen diferentes comportamientos reguladores con la tensión.
Una vez activado, el punto de control del huso bloquea la entrada en la anafase inhibiendo el complejo promotor de la anafase a través de la regulación de la actividad del complejo de punto de control mitótico. El mecanismo de inhibición de la APC por el complejo de punto de control mitótico es poco conocido, aunque se plantea la hipótesis de que el MCC se une a la APC como un pseudosustrato utilizando el motivo KEN-box en BUBR1. Al mismo tiempo que se activa el complejo de punto de control mitótico, la proteína centrómero CENP-E activa BUBR1, que también bloquea la anafase. [60]
Formación del complejo de puntos de control mitótico
El complejo de punto de control mitótico está compuesto por BUB3 junto con MAD2 y MAD3 unidos a Cdc20 . MAD2 y MAD3 tienen sitios de unión distintos en CDC20 y actúan sinérgicamente para inhibir APC/C. El complejo MAD3 está compuesto por BUB3, que se une a Mad3 y BUB1B a través del motivo lineal corto conocido como motivo GLEBS. El orden exacto de las uniones que deben tener lugar para formar el MCC sigue siendo desconocido. Es posible que Mad2-Cdc20 forme un complejo al mismo tiempo que BUBR1-BUB3-Cdc20 forme otro complejo, y estos dos subcomplejos se combinen en consecuencia para formar el complejo de punto de control mitótico. [59] En las células humanas, la unión de BUBR1 a CDC20 requiere la unión previa de MAD2 a CDC20, por lo que es posible que el subcomplejo MAD2-CDC20 actúe como iniciador para la formación de MCC. La disminución de BUBR1 solo produce una reducción leve de los niveles de Mad2-Cdc20, mientras que Mad2 es necesaria para la unión de BubR1-Bub3 a Cdc20. No obstante, BUBR1 sigue siendo necesaria para la activación de los puntos de control. [60]
El mecanismo de formación del MCC no está claro y existen teorías que compiten tanto para la formación dependiente del cinetocoro como para la formación independiente del cinetocoro. En apoyo de la teoría independiente del cinetocoro, el MCC es detectable en células de S. cerevisiae en las que se han mutado las proteínas de ensamblaje del núcleo del cinetocoro y en células en las que se ha desactivado el SAC, lo que sugiere que el MCC podría ensamblarse durante la mitosis sin la localización del cinetocoro. En un modelo, los cinetocoros prometafásicos no unidos pueden "sensibilizar" a las APC a la inhibición del MCC al reclutar a las APC a los cinetocoros a través de un SAC funcional. Además, las depleciones de varias proteínas SAC han revelado que las depleciones de MAD2 y BUBR1 afectan el momento de la mitosis independientemente de los cinetocoros, mientras que las depleciones de otras proteínas SAC dan como resultado un SAC disfuncional sin alterar la duración de la mitosis. Por lo tanto, es posible que el SAC funcione a través de un temporizador de dos etapas donde MAD2 y BUBR1 controlan la duración de la mitosis en la primera etapa, que puede extenderse en la segunda etapa si hay cinetocoros no unidos, así como otras proteínas del SAC. [60] Sin embargo, existen líneas de evidencia que están en desfavor del ensamblaje independiente del cinetocoro. El MCC aún no se ha encontrado durante la interfase , mientras que el MCC no se forma a partir de sus constituyentes en extractos de meiosis II de X. laevis sin la adición de esperma de núcleos y nocodazol para prevenir el ensamblaje del huso.
El modelo principal de formación de MCC es el "modelo MAD2-template", que depende de la dinámica del cinetocoro de MAD2 para crear el MCC. MAD1 se localiza en cinetocoros no unidos mientras se une fuertemente a MAD2. La localización de MAD2 y BubR1 en el cinetocoro también puede depender de la quinasa Aurora B. [ 62] Las células que carecen de Aurora B no se detienen en metafase incluso cuando los cromosomas carecen de unión a microtúbulos. [63] Los cinetocoros no unidos primero se unen a un complejo cometa MAD1-C-MAD2-p31 y liberan el cometa p31 a través de mecanismos desconocidos. El complejo MAD1-C-MAD2 resultante recluta el confórmero abierto de Mad2 (O-Mad2) a los cinetocoros. Este O-Mad2 cambia su conformación a Mad2 cerrado (C-Mad2) y se une a Mad1. Este complejo Mad1/C-Mad2 es responsable del reclutamiento de más O-Mad2 a los cinetocoros, que cambia su conformación a C-Mad2 y se une a Cdc20 en una reacción de autoamplificación. Dado que MAD1 y CDC20 contienen un motivo de unión a MAD2 similar, la conformación vacía de O-MAD2 cambia a C-MAD2 mientras se une a CDC20. Este ciclo de retroalimentación positiva está regulado negativamente por p31 comet , que se une competitivamente a C-MAD2 unido a MAD1 o CDC20 y reduce aún más la unión de O-MAD2 a C-MAD2. También pueden existir otros mecanismos de control, considerando que p31 comet no está presente en eucariotas inferiores. La nomenclatura del "modelo de plantilla" se deriva, por tanto, del proceso en el que MAD1-C-MAD2 actúa como plantilla para la formación de copias de C-MAD2-CDC20. Este secuestro de Cdc20 es esencial para mantener el punto de control del huso. [59]
Desactivación del punto de control
Existen varios mecanismos para desactivar el SAC después de la correcta biorientación de las cromátidas hermanas . Tras la unión de los microtúbulos al cinetocoro, un mecanismo de desprendimiento a través de un complejo motor dineína-dineína transporta las proteínas de punto de control del huso fuera de los cinetocoros. [60] Las proteínas desprendidas, que incluyen MAD1, MAD2, MPS1 y CENP-F , se redistribuyen luego a los polos del huso . El proceso de desprendimiento depende en gran medida de la estructura intacta de los microtúbulos, así como de la motilidad de la dineína a lo largo de los microtúbulos. Además de funcionar como un regulador del ciclo de retroalimentación positiva C-MAD2, p31 comet también puede actuar como un desactivador del SAC. Los cinetocoros no unidos inactivan temporalmente p31 comet , pero la unión reactiva la proteína e inhibe la activación de MAD2, posiblemente por fosforilación inhibidora. Otro posible mecanismo de inactivación del SAC resulta de la disociación dependiente de la energía del complejo MAD2-CDC20 a través de la ubiquitilación no degradativa de CDC20. Por el contrario, la enzima desubiquitilante protectina es necesaria para mantener el SAC. Por lo tanto, los cinetocoros no unidos mantienen el punto de control recreando continuamente el subcomplejo MAD2-CDC20 a partir de sus componentes. El SAC también puede desactivarse por proteólisis inducida por activación de APC . Dado que el SAC no se reactiva por la pérdida de cohesión de las cromátidas hermanas durante la anafase, la proteólisis de la ciclina B y la inactivación de la quinasa CDK1-ciclina-B también inhibe la actividad del SAC. La degradación de MPS1 durante la anafase impide la reactivación del SAC después de la eliminación de la cohesión de las cromátidas hermanas. Después de la desactivación del punto de control y durante la anafase normal del ciclo celular, el complejo promotor de la anafase se activa mediante la disminución de la actividad de MCC. Cuando esto sucede, el complejo enzimático poliubiquitina el inhibidor de la anafase securina . La ubiquitinación y destrucción de la securina al final de la metafase libera la proteasa activa llamada separasa. La separasa escinde las moléculas de cohesión que mantienen unidas a las cromátidas hermanas para activar la anafase. [23]
Nuevo modelo para la desactivación del SAC enS. cerevisiae:el interruptor mecánico
Se ha sugerido un nuevo mecanismo para explicar cómo la unión de microtúbulos en el extremo del cinetocoro puede interrumpir pasos específicos en la señalización SAC. En un cinetocoro no unido, el primer paso en la formación del MCC es la fosforilación de Spc105 por la quinasa Mps1. El Spc105 fosforilado puede entonces reclutar las proteínas de señalización descendentes Bub1 y 3; Mad 1,2 y 3; y Cdc20. La asociación con Mad1 en cinetocoros no unidos hace que Mad2 experimente un cambio conformacional que lo convierte de una forma abierta (O-Mad2) a una forma cerrada (C-Mad2). El C-Mad2 unido a Mad1 luego dimeriza con un segundo O-Mad2 y cataliza su cierre alrededor de Cdc20. Este complejo C-Mad2 y Cdc20, el MCC, deja a Mad1 y C-Mad2 en el cinetocoro para formar otro MCC. Cada uno de los MCC secuestra dos moléculas de Cdc20 para evitar su interacción con el APC/C, manteniendo así el SAC. [23] La fosforilación de Spc105 por parte de Mps1 es necesaria y suficiente para iniciar la vía de señalización del SAC, pero este paso solo puede ocurrir en ausencia de unión de microtúbulos al cinetocoro. Se ha demostrado que Mps1 endógeno se asocia con el dominio de homología de calponina (CH) de Ndc80, que se encuentra en la región del cinetocoro externo que está distante del cromosoma. Aunque Mps1 está acoplado en el cinetocoro externo, aún puede localizarse dentro del cinetocoro interno y fosforilar Spc105 debido a las regiones de bisagra flexibles en Ndc80. Sin embargo, el modelo de interruptor mecánico propone que la unión de un microtúbulo al cinetocoro desactiva el SAC a través de dos mecanismos. La presencia de un microtúbulo unido aumenta la distancia entre el dominio CH de Ndc80 y Spc105. Además, Dam1/DASH, un gran complejo que consta de 160 proteínas que forma un anillo alrededor del microtúbulo unido, actúa como una barrera entre las dos proteínas. La separación evita las interacciones entre Mps1 y Spc105 y, por lo tanto, inhibe la vía de señalización del SAC. [64]
Este modelo no es aplicable a la regulación del SAC en organismos de orden superior, incluidos los animales. Una faceta principal del mecanismo de cambio mecánico es que en S. cerevisiae la estructura del cinetocoro solo permite la unión de un microtúbulo. Los cinetocoros en animales, por otro lado, son redes mucho más complejas que contienen sitios de unión para una multitud de microtúbulos. [65] La unión de microtúbulos en todos los sitios de unión del cinetocoro no es necesaria para la desactivación del SAC y la progresión a la anafase. Por lo tanto, los estados de microtúbulos unidos y no unidos coexisten en el cinetocoro animal mientras que el SAC está inhibido. Este modelo no incluye una barrera que impida que Mps1 asociado con un cinetocoro unido fosforile Spc105 en un cinetocoro adyacente no unido. Además, el complejo Dam1/DASH de levadura no está presente en las células animales.
Defectos en los puntos de control del huso mitótico y cáncer
Cuando el punto de control del huso funciona mal, esto puede conducir a una segregación incorrecta de cromosomas, aneuploidía e incluso tumorigénesis . [60] La transformación ocurre y se acelera cuando el mantenimiento de la integridad genómica se rompe, especialmente a nivel macroscópico de cromosomas completos o grandes porciones de ellos. De hecho, la aneuploidía es la característica más común de los tumores sólidos humanos y, por lo tanto, el punto de control de ensamblaje del huso podría considerarse como un posible objetivo para la terapia antitumoral. [66] Este es un hecho muy subestimado ya que se cree que las mutaciones en genes específicos conocidos como oncogenes o supresores de tumores están principalmente detrás de la inestabilidad genética y la tumorigénesis. Por lo general, los diversos puntos de control en el ciclo celular se encargan de la integridad genómica a través de mecanismos redundantes altamente conservados que son importantes para mantener la homeostasis celular y prevenir la tumorigénesis. Varias proteínas de punto de control de ensamblaje del huso actúan como reguladores positivos y negativos para garantizar la segregación cromosómica adecuada en cada ciclo celular, previniendo la inestabilidad cromosómica (CIN), también conocida como inestabilidad del genoma .

En la actualidad, la integridad genómica se aprecia en varios niveles: algunos tumores muestran inestabilidad que se manifiesta como sustituciones, inserciones y deleciones de bases, mientras que la mayoría muestra ganancias o pérdidas de cromosomas enteros. [67]
Debido a que las alteraciones en las proteínas reguladoras mitóticas pueden llevar a aneuploidía y este es un evento frecuente en el cáncer , [68] inicialmente se pensó que estos genes podrían estar mutados en tejidos cancerosos. [69]
Genes mutados en cánceres
En algunos cánceres, los genes que subyacen a los defectos que resultan en la transformación están bien caracterizados. En los cánceres hematológicos, como el mieloma múltiple, las anomalías citogenéticas son muy comunes debido a la naturaleza inherente de las roturas de ADN necesarias para la reorganización del gen de inmunoglobulina. Sin embargo, los defectos en proteínas como MAD2 que funcionan predominantemente en el SAC también se caracterizan en el mieloma múltiple. [70] La mayoría de los tumores sólidos también son predominantemente aneuploides. Para el cáncer colorrectal, BUB1 y BUBR1 y la amplificación de STK15 son reguladores clave que se han implicado en la inestabilidad genómica que resulta en cáncer. [71] En el cáncer de mama, la forma genética caracterizada por el gen BRCA-1 exhibe mayores niveles de inestabilidad genómica que las formas esporádicas. Los experimentos mostraron que los ratones nulos de BRCA-1 tienen una expresión disminuida de la proteína clave del punto de control del huso MAD2. [72] Para otros cánceres, se justifica más trabajo para identificar las causas de la aneuploidía.
Otros genes no tradicionalmente asociados con el SAC en el cáncer
Claramente, las variaciones en los niveles fisiológicos de estas proteínas (como Mad2 o BubR1) están asociadas con aneuploidía y tumorigénesis, y esto se ha demostrado utilizando modelos animales . [73] [74] Sin embargo, estudios recientes indican que lo que parece suceder es un escenario más complicado: la aneuploidía impulsaría una alta incidencia de tumorigénesis solo cuando las alteraciones en los niveles de componentes específicos del punto de control mitótico (ya sea reducción o sobreexpresión) en los tejidos también están induciendo otros defectos capaces de predisponerlos a tumores. [75] Es decir, defectos como un aumento en el daño del ADN, reordenamientos cromosómicos y/o una disminución en la incidencia de muerte celular. Para algunos componentes del punto de control mitótico, se sabe que están implicados en funciones fuera de la mitosis: importación nuclear (Mad1), represión transcripcional (Bub3) y muerte celular, respuesta al daño del ADN, envejecimiento y megacariopoyesis para BubR1. Todo esto apoya la conclusión de que el aumento de la tumorigénesis está asociado con otros defectos además de la aneuploidía únicamente. [75]
Las mutaciones asociadas al cáncer que afectan a genes de puntos de control conocidos como BUB1 o BUBR1 son realmente raras. Sin embargo, varias proteínas implicadas en el cáncer tienen intersecciones con redes de ensamblaje del huso. Los supresores tumorales clave como p53 también juegan un papel en el punto de control del huso. La ausencia de p53, el gen mutado más comúnmente en el cáncer humano, tiene un efecto importante en los reguladores del punto de control del ciclo celular y se ha demostrado que actúa en el punto de control G1 en el pasado, pero ahora parece ser importante también en la regulación del punto de control del huso. [76] Otro aspecto clave del cáncer es la inhibición de la muerte celular o apoptosis . La survivina , un miembro de la familia de inhibidores de la apoptosis (IAP), se localiza en grupos en los microtúbulos del huso mitótico cerca de los centrosomas y en los cinetocoros de los cromosomas en metafase. La survivina no sólo inhibe la apoptosis para promover la tumorigénesis, sino que también se la ha implicado (a través de ratones knock out experimentales) como un importante regulador de la segregación cromosómica y la mitosis en etapa tardía, de manera similar a su función en organismos más primitivos. [77]
Es probable que otros aspectos del punto de control del ensamblaje del huso, como la unión del cinetocoro, la función de los microtúbulos y la cohesión de las cromátidas hermanas, también sean defectuosos y provoquen aneuploidía. Se ha observado que las células cancerosas se dividen en múltiples direcciones al evadir el punto de control del ensamblaje del huso, lo que da lugar a mitosis multipolares. [78] La transición multipolar de metafase a anafase se produce a través de un ciclo de separasa incompleto que da lugar a frecuentes eventos de no disyunción que amplifican la aneuploidía en las células cancerosas.
Terapias contra el cáncer con SAC

Los avances en este campo han llevado a la introducción del desarrollo de algunas terapias dirigidas a los defectos de ensamblaje del huso. Los tratamientos más antiguos, como los alcaloides de la vinca y los taxanos, se dirigen a los microtúbulos que acompañan la formación del huso mitótico a través de la interrupción de la dinámica de los microtúbulos que activan el SAC deteniendo la célula y finalmente conduciendo a su muerte. [79] El taxol y el docetaxel , que pueden inducir una catástrofe mitótica , todavía se utilizan en el tratamiento del cáncer de mama, el cáncer de ovario y otros tipos de cáncer epitelial. [80] Sin embargo, estos tratamientos a menudo se caracterizan por altas tasas de efectos secundarios y resistencia a los medicamentos.
También se están buscando otros objetivos dentro de la red de reguladores que influyen en el SAC; el fuerte interés se ha desplazado hacia las proteínas quinasas Aurora . [81] El gen de la quinasa Aurora A cuando se amplifica actúa como un oncogén que anula el SAC, lo que lleva a la iniciación anormal de la anafase y la aneuploidía posterior y también a la resistencia al TAXOL. [82] De manera emocionante, un inhibidor de moléculas pequeñas de Aurora A ha mostrado efectos antitumorales en un modelo in vivo, lo que sugiere que este podría ser un buen objetivo para un mayor desarrollo clínico. [83] Los inhibidores de Aurora B , que también están en desarrollo clínico, conducen a una unión anormal del cinetocoro a los microtúbulos y también anulan el punto de control mitótico. [81] La survivina también es un objetivo molecular atractivo para el desarrollo terapéutico clínico, ya que actúa como un nodo principal en una multitud de vías, una de las cuales es la formación del huso y el control del punto de control. [84] Incluso otros enfoques han incluido una mirada a la inhibición de las proteínas motoras mitóticas como KSP. Estos inhibidores, que recientemente han entrado en ensayos clínicos, provocan un arresto mitótico y, al activar el punto de control del ensamblaje del huso, inducen la apoptosis. [85] [3]
Referencias
- ^ Santaguida S, Musacchio A (septiembre de 2009). "La vida y los milagros de los cinetocoros". Revista EMBO . 28 (17): 2511–31. doi :10.1038/emboj.2009.173. PMC 2722247 . PMID 19629042.
- ^ Morgan, David Owen, 1958- (2007). El ciclo celular: principios de control . Londres: New Science Press. ISBN 978-0-19-920610-0.OCLC 70173205 .
{{cite book}}: CS1 maint: nombres múltiples: lista de autores ( enlace ) CS1 maint: nombres numéricos: lista de autores ( enlace ) - ^ ab Sinha, D.; Duijf, PHG; Khanna, KK (2019), "Deslizamiento mitótico: una vieja historia con un nuevo giro", Cell Cycle , 18 (1): 7–15, doi :10.1080/15384101.2018.1559557, PMC 6343733 , PMID 30601084
- ^ Santaguida S, Amon A (agosto de 2015). "Efectos a corto y largo plazo de la segregación incorrecta de cromosomas y la aneuploidía". Nature Reviews Molecular Cell Biology . 16 (8): 473–85. doi :10.1038/nrm4025. hdl : 1721.1/117201 . PMID 26204159. S2CID 205495880.
- ^ ab Zirkle RE (marzo de 1970). "Irradiación con microhaz ultravioleta del citoplasma de células de tritón: destrucción del huso, falsa anafase y retraso de la anafase verdadera". Radiation Research . 41 (3): 516–37. Bibcode :1970RadR...41..516Z. doi :10.2307/3572841. JSTOR 3572841. PMID 5438206.
- ^ Rieder CL, Palazzo RE (julio de 1992). "Colcemid y el ciclo mitótico". Journal of Cell Science . 102 (Pt 3) (3): 387–92. doi :10.1242/jcs.102.3.387. PMID 1506421.
- ^ Burke DJ, Stukenberg PT (abril de 2008). "Vinculación de la unión cinetocoro-microtúbulo con el punto de control del huso". Developmental Cell . 14 (4): 474–9. doi :10.1016/j.devcel.2008.03.015. PMC 2696048 . PMID 18410725.
- ^ ab Li R, Murray AW (agosto de 1991). "Control de retroalimentación de la mitosis en levaduras en ciernes". Cell . 66 (3): 519–31. doi :10.1016/0092-8674(81)90015-5. PMID 1651172. S2CID 11306198.
- ^ Hoyt MA, Totis L, Roberts BT (agosto de 1991). "Genes de S. cerevisiae necesarios para la detención del ciclo celular en respuesta a la pérdida de la función de los microtúbulos". Cell . 66 (3): 507–17. doi : 10.1016/0092-8674(81)90014-3 . PMID 1651171. S2CID 10832842.
- ^ Neff MW, Burke DJ (septiembre de 1992). "Un retraso en el ciclo celular de Saccharomyces cerevisiae inducido por un cromosoma dicéntrico y dependiente de puntos de control mitóticos". Biología molecular y celular . 12 (9): 3857–64. doi :10.1128/MCB.12.9.3857. PMC 360258 . PMID 1324407.
- ^ Wells WA, Murray AW (abril de 1996). "Los centrómeros segregantes aberrantes activan el punto de control del ensamblaje del huso en la levadura en ciernes". The Journal of Cell Biology . 133 (1): 75–84. doi :10.1083/jcb.133.1.75. PMC 2120768 . PMID 8601615.
- ^ Hardwick KG, Weiss E, Luca FC, Winey M, Murray AW (agosto de 1996). "Activación del punto de control de ensamblaje del huso de levadura en ciernes sin interrupción del huso mitótico". Science . 273 (5277): 953–6. Bibcode :1996Sci...273..953H. doi :10.1126/science.273.5277.953. PMID 8688079. S2CID 37404757.
- ^ Wang Y, Burke DJ (diciembre de 1995). "Los genes de punto de control necesarios para retrasar la división celular en respuesta al nocodazol responden a la función cinetocórica alterada en la levadura Saccharomyces cerevisiae". Biología molecular y celular . 15 (12): 6838–44. doi :10.1128/MCB.15.12.6838. PMC 230938 . PMID 8524250.
- ^ Spencer F, Hieter P (octubre de 1992). "Las mutaciones del ADN del centrómero inducen un retraso mitótico en Saccharomyces cerevisiae". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 89 (19): 8908–12. Bibcode :1992PNAS...89.8908S. doi : 10.1073/pnas.89.19.8908 . JSTOR 2360300. PMC 50033 . PMID 1409584.
- ^ Hardwick KG, Li R, Mistrot C, Chen RH, Dann P, Rudner A, Murray AW (junio de 1999). "Las lesiones en muchos componentes diferentes del huso mitótico activan el punto de control del huso mitótico en la levadura en ciernes Saccharomyces cerevisiae". Genética . 152 (2): 509–18. doi :10.1093/genetics/152.2.509. PMC 1460633 . PMID 10353895.
- ^ McIntosh JR (1991). "Control estructural y mecánico de la progresión mitótica". Simposios de Cold Spring Harbor sobre biología cuantitativa . 56 : 613–9. doi :10.1101/sqb.1991.056.01.070. PMID 1819511.
- ^ ab Rieder CL, Cole RW, Khodjakov A, Sluder G (agosto de 1995). "El punto de control que retrasa la anafase en respuesta a la monoorientación cromosómica está mediado por una señal inhibidora producida por cinetocoros no unidos". The Journal of Cell Biology . 130 (4): 941–8. doi :10.1083/jcb.130.4.941. PMC 2199954 . PMID 7642709.
- ^ Li X, Nicklas RB (marzo de 1997). "Fosforilación del cinetocoro sensible a la tensión y punto de control de distribución cromosómica en espermatocitos de mantis religiosa". Journal of Cell Science . 110 ( Pt 5) (5): 537–45. doi : 10.1242/jcs.110.5.537 . PMID 9092936.
- ^ Rieder CL, Khodjakov A, Paliulis LV, Fortier TM, Cole RW, Sluder G (mayo de 1997). "Mitosis en células somáticas de vertebrados con dos husos: implicaciones para el punto de control y la división de la transición metafase/anafase". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 94 (10): 5107–12. Bibcode :1997PNAS...94.5107R. doi : 10.1073/pnas.94.10.5107 . PMC 24639 . PMID 9144198.
- ^ Conlon I, Raff M (enero de 1999). "Control de tamaño en el desarrollo animal". Cell . 96 (2): 235–44. doi : 10.1016/S0092-8674(00)80563-2 . PMID 9988218.
- ^ Meraldi P, Lukas J, Fry AM, Bartek J, Nigg EA (junio de 1999). "La duplicación del centrosoma en células somáticas de mamíferos requiere E2F y Cdk2-ciclina A". Nature Cell Biology . 1 (2): 88–93. doi :10.1038/10054. PMID 10559879. S2CID 24795991.
- ^ Mayor T, Meraldi P, Stierhof YD, Nigg EA, Fry AM (junio de 1999). "Proteínas quinasas en el control del ciclo del centrosoma". FEBS Letters . 452 (1–2): 92–5. doi :10.1016/S0014-5793(99)00534-7. PMID 10376685. S2CID 22671038.
- ^ abc Morgan, David O. (6 de septiembre de 2006). El ciclo celular: principios de control (Primers in Biology) (1.ª ed.). New Science Press, Ltd. ISBN 978-0-87893-508-6.
- ^ Nicklas RB (enero de 1997). "Cómo las células obtienen los cromosomas correctos". Science . 275 (5300): 632–7. doi :10.1126/science.275.5300.632. PMID 9005842. S2CID 30090031.
- ^ Loncarek J, Kisurina-Evgenieva O, Vinogradova T, Hergert P, La Terra S, Kapoor TM, Khodjakov A (noviembre de 2007). "La geometría del centrómero esencial para mantener la mitosis libre de errores está controlada por las fuerzas del huso". Nature . 450 (7170): 745–9. Bibcode :2007Natur.450..745L. doi :10.1038/nature06344. PMC 2586812 . PMID 18046416.
- ^ Dewar H, Tanaka K, Nasmyth K, Tanaka TU (marzo de 2004). "La tensión entre dos cinetocoros es suficiente para su biorientación en el huso mitótico". Nature . 428 (6978): 93–7. Bibcode :2004Natur.428...93D. doi :10.1038/nature02328. PMID 14961024. S2CID 4418232.
- ^ Cimini D, Wan X, Hirel CB, Salmon ED (septiembre de 2006). "La quinasa Aurora promueve la renovación de los microtúbulos del cinetocoro para reducir los errores de segregación cromosómica". Current Biology . 16 (17): 1711–8. doi : 10.1016/j.cub.2006.07.022 . PMID 16950108. S2CID 18117282.
- ^ Gautschi O, Heighway J, Mack PC, Purnell PR, Lara PN, Gandara DR (marzo de 2008). "Aurora quinasas como dianas farmacológicas contra el cáncer". Clinical Cancer Research . 14 (6): 1639–48. doi : 10.1158/1078-0432.CCR-07-2179 . PMID 18347165.
- ^ ab Hirano T (2000). "Cohesión, condensación y separación de cromosomas". Revista anual de bioquímica . 69 : 115–44. doi :10.1146/annurev.biochem.69.1.115. PMID 10966455.
- ^ Tanaka K, Hao Z, Kai M, Okayama H (octubre de 2001). "Establecimiento y mantenimiento de la cohesión de cromátidas hermanas en levaduras de fisión mediante un mecanismo único". The EMBO Journal . 20 (20): 5779–90. doi :10.1093/emboj/20.20.5779. PMC 125673 . PMID 11598020.
- ^ Gonzalez C, Casal Jimenez J, Ripoll P, Sunkel CE (enero de 1991). "El huso es necesario para el proceso de separación de las cromátidas hermanas en los neuroblastos de Drosophila". Experimental Cell Research . 192 (1): 10–5. doi :10.1016/0014-4827(91)90150-S. PMID 1898588.
- ^ Losada A, Hirano T (octubre de 2001). "Dando forma al cromosoma metafásico: coordinación de la cohesión y la condensación". BioEssays . 23 (10): 924–35. doi :10.1002/bies.1133. PMID 11598959. S2CID 31210810.
- ^ Bernard P, Maure JF, Partridge JF, Genier S, Javerzat JP, Allshire RC (diciembre de 2001). "Requisitos de heterocromatina para la cohesión en los centrómeros". Science . 294 (5551): 2539–42. Bibcode :2001Sci...294.2539B. doi :10.1126/science.1064027. PMID 11598266. S2CID 31166180.
- ^ Nonaka N, Kitajima T, Yokobayashi S, Xiao G, Yamamoto M, Grewal SI, Watanabe Y (enero de 2002). "Reclutamiento de cohesina en regiones heterocromáticas por Swi6/HP1 en levadura de fisión". Biología celular de la naturaleza . 4 (1): 89–93. doi : 10.1038/ncb739 . PMID 11780129. S2CID 23036084.
- ^ Hall IM, Noma K, Grewal SI (enero de 2003). "La maquinaria de interferencia del ARN regula la dinámica cromosómica durante la mitosis y la meiosis en la levadura de fisión". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (1): 193–8. Bibcode :2003PNAS..100..193H. doi : 10.1073/pnas.232688099 . PMC 140924 . PMID 12509501.
- ^ Fukagawa T, Nogami M, Yoshikawa M, Ikeno M, Okazaki T, Takami Y, Nakayama T, Oshimura M (agosto de 2004). "Dicer es esencial para la formación de la estructura de la heterocromatina en células de vertebrados". Nature Cell Biology . 6 (8): 784–91. doi :10.1038/ncb1155. PMID 15247924. S2CID 24798145.
- ^ Weber SA, Gerton JL, Polancic JE, DeRisi JL, Koshland D, Megee PC (septiembre de 2004). "El cinetocoro es un potenciador de la unión de la cohesión pericéntrica". PLOS Biology . 2 (9): E260. doi : 10.1371/journal.pbio.0020260 . PMC 490027 . PMID 15309047.

- ^ Prasanth SG, Prasanth KV, Siddiqui K, Spector DL, Stillman B (julio de 2004). "Orc2 humano se localiza en centrosomas, centrómeros y heterocromatina durante la herencia cromosómica". The EMBO Journal . 23 (13): 2651–63. doi :10.1038/sj.emboj.7600255. PMC 449767 . PMID 15215892.
- ^ Shimada K, Gasser SM (enero de 2007). "El complejo de reconocimiento de origen funciona en la cohesión de cromátidas hermanas en Saccharomyces cerevisiae". Cell . 128 (1): 85–99. doi : 10.1016/j.cell.2006.11.045 . PMID 17218257.
- ^ Kato H, Matsunaga F, Miyazaki S, Yin L, D'Urso G, Tanaka K, Murakami Y (abril de 2008). "Schizosaccharomyces pombe Orc5 desempeña múltiples funciones en el mantenimiento de la estabilidad del genoma a lo largo del ciclo celular". Ciclo celular . 7 (8): 1085–96. doi : 10.4161/cc.7.8.5710 . PMID 18414064.
- ^ Hauf S, Watanabe Y (octubre de 2004). "Orientación del cinetocoro en la mitosis y la meiosis". Cell . 119 (3): 317–27. doi : 10.1016/j.cell.2004.10.014 . PMID 15507205.
- ^ Sonoda E, Matsusaka T, Morrison C, Vagnarelli P, Hoshi O, Ushiki T, Nojima K, Fukagawa T, Waizenegger IC, Peters JM, Earnshaw WC, Takeda S (diciembre de 2001). "Scc1/Rad21/Mcd1 es necesaria para la cohesión de las cromátidas hermanas y la función del cinetocoro en células de vertebrados". Developmental Cell . 1 (6): 759–70. doi : 10.1016/S1534-5807(01)00088-0 . PMID 11740938.
- ^ Vass S, Cotterill S, Valdeolmillos AM, Barbero JL, Lin E, Warren WD, Heck MM (febrero de 2003). "El agotamiento de Drad21/Scc1 en células de Drosophila conduce a la inestabilidad del complejo de cohesión y a la interrupción de la progresión mitótica" (PDF) . Current Biology . 13 (3): 208–18. doi :10.1016/S0960-9822(03)00047-2. hdl : 20.500.11820/b75b5706-3f21-4cfe-85be-466268afc918 . PMID: 12573216. S2CID : 16037196.
- ^ Haering CH, Löwe J, Hochwagen A, Nasmyth K (abril de 2002). "Arquitectura molecular de las proteínas SMC y el complejo de cohesión de la levadura". Molecular Cell . 9 (4): 773–88. doi : 10.1016/S1097-2765(02)00515-4 . PMID 11983169.
- ^ Hirano T (enero de 1999). "Mecánica cromosómica mediada por SMC: ¿un esquema conservado desde las bacterias hasta los vertebrados?". Genes & Development . 13 (1): 11–9. doi : 10.1101/gad.13.1.11 . PMID 9887095.
- ^ Ciosk R, Zachariae W, Michaelis C, Shevchenko A, Mann M, Nasmyth K (junio de 1998). "Un complejo ESP1/PDS1 regula la pérdida de cohesión de las cromátidas hermanas en la transición de metafase a anafase en levadura". Cell . 93 (6): 1067–76. doi : 10.1016/S0092-8674(00)81211-8 . PMID 9635435.
- ^ Alexandru G, Uhlmann F, Mechtler K, Poupart MA, Nasmyth K (mayo de 2001). "La fosforilación de la subunidad de cohesión Scc1 por la quinasa Polo/Cdc5 regula la separación de las cromátidas hermanas en la levadura". Cell . 105 (4): 459–72. doi : 10.1016/S0092-8674(01)00362-2 . PMID 11371343.
- ^ Leismann O, Herzig A, Heidmann S, Lehner CF (septiembre de 2000). "La degradación de PIM de Drosophila regula la separación de las cromátidas hermanas durante la mitosis". Genes & Development . 14 (17): 2192–205. doi :10.1101/gad.176700. PMC 316890 . PMID 10970883.
- ^ Zur A, Brandeis M (febrero de 2001). "La degradación de la securina está mediada por fzy y fzr, y es necesaria para la separación completa de las cromátidas, pero no para la citocinesis". The EMBO Journal . 20 (4): 792–801. doi :10.1093/emboj/20.4.792. PMC 145417 . PMID 11179223.
- ^ Sumara I, Vorlaufer E, Gieffers C, Peters BH, Peters JM (noviembre de 2000). "Caracterización de complejos de cohesión de vertebrados y su regulación en profase". The Journal of Cell Biology . 151 (4): 749–62. doi :10.1083/jcb.151.4.749. PMC 2169443 . PMID 11076961.
- ^ Losada A, Yokochi T, Kobayashi R, Hirano T (agosto de 2000). "Identificación y caracterización de las subunidades SA/Scc3p en los complejos de cohesión de Xenopus y humanos". The Journal of Cell Biology . 150 (3): 405–16. doi :10.1083/jcb.150.3.405. PMC 2175199 . PMID 10931856.
- ^ Giménez-Abián JF, Sumara I, Hirota T, Hauf S, Gerlich D, de la Torre C, Ellenberg J, Peters JM (julio de 2004). "Regulación de la cohesión de las cromátidas hermanas entre los brazos cromosómicos". Current Biology . 14 (13): 1187–93. doi : 10.1016/j.cub.2004.06.052 . PMID 15242616.
- ^ Paliulis LV, Nicklas RB (diciembre de 2004). "La micromanipulación de cromosomas revela que la liberación de la cohesión durante la división celular es gradual y no requiere tensión". Current Biology . 14 (23): 2124–9. doi : 10.1016/j.cub.2004.11.052 . PMID 15589155.
- ^ Nakajima M, Kumada K, Hatakeyama K, Noda T, Peters JM, Hirota T (diciembre de 2007). "La eliminación completa de la cohesina de los brazos cromosómicos depende de la separasa". Revista de ciencia celular . 120 (parte 23): 4188–96. doi : 10.1242/jcs.011528 . PMID 18003702.
- ^ McGuinness BE, Hirota T, Kudo NR, Peters JM, Nasmyth K (marzo de 2005). "La shugoshin previene la disociación de la cohesina de los centrómeros durante la mitosis en células de vertebrados". PLOS Biology . 3 (3): e86. doi : 10.1371/journal.pbio.0030086 . PMC 1054882 . PMID 15737064.

- ^ Salic A, Waters JC, Mitchison TJ (septiembre de 2004). "Los shugoshin vertebrados vinculan la cohesión de los centrómeros hermanos y la estabilidad de los microtúbulos del cinetocoro en la mitosis". Cell . 118 (5): 567–78. doi : 10.1016/j.cell.2004.08.016 . PMID 15339662.
- ^ abc Collins JK, Lane SI, Merriman JA, Jones KT (noviembre de 2015). "El daño del ADN induce un arresto meiótico en ovocitos de ratón mediado por el punto de control del ensamblaje del huso". Nat Commun . 6 : 8553. doi :10.1038/ncomms9553. PMC 4659839 . PMID 26522232.
- ^ Lee C, Leem J, Oh JS (abril de 2023). "Utilización selectiva de la unión de extremos no homólogos y la recombinación homóloga para la reparación del ADN durante la maduración meiótica en ovocitos de ratón". Cell Prolif . 56 (4): e13384. doi :10.1111/cpr.13384. PMC 10068936 . PMID 36564861.
- ^ abcd De Antoni A, Pearson CG, Cimini D, Canman JC, Sala V, Nezi L, Mapelli M, Sironi L, Faretta M, Salmon ED, Musacchio A (febrero de 2005). "El complejo Mad1/Mad2 como plantilla para la activación de Mad2 en el punto de control del conjunto del husillo". Biología actual . 15 (3): 214–25. doi : 10.1016/j.cub.2005.01.038 . PMID 15694304. S2CID 3224122.
- ^ abcdefg Musacchio A, Salmon ED (mayo de 2007). "El punto de control del ensamblaje del huso en el espacio y el tiempo". Nature Reviews. Biología celular molecular . 8 (5): 379–93. doi :10.1038/nrm2163. PMID 17426725. S2CID 205494124.
- ^ Martin-Lluesma S, Stucke VM, Nigg EA (septiembre de 2002). "Función de Hec1 en la señalización del punto de control del huso y el reclutamiento del cinetocoro de Mad1/Mad2". Science . 297 (5590): 2267–70. Bibcode :2002Sci...297.2267M. doi :10.1126/science.1075596. PMID 12351790. S2CID 7879023.
- ^ Lens SM, Wolthuis RM, Klompmaker R, Kauw J, Agami R, Brummelkamp T, Kops G, Medema RH (junio de 2003). "La survivina es necesaria para una detención sostenida del punto de control del huso en respuesta a la falta de tensión". The EMBO Journal . 22 (12): 2934–47. doi :10.1093/emboj/cdg307. PMC 162159 . PMID 12805209.
- ^ Hauf S, Cole RW, LaTerra S, Zimmer C, Schnapp G, Walter R, Heckel A, van Meel J, Rieder CL, Peters JM (abril de 2003). "La pequeña molécula Hesperadin revela un papel para Aurora B en la corrección de la unión cinetocoro-microtúbulo y en el mantenimiento del punto de control del ensamblaje del huso". The Journal of Cell Biology . 161 (2): 281–94. doi :10.1083/jcb.200208092. PMC 2172906 . PMID 12707311.
- ^ Aravamudhan P, Goldfarb AA, Joglekar AP (julio de 2015). "El cinetocoro codifica un interruptor mecánico para interrumpir la señalización del punto de control del ensamblaje del huso". Nature Cell Biology . 17 (7): 868–79. doi :10.1038/ncb3179. PMC 4630029 . PMID 26053220.
- ^ Alberts B, Johnson A, Lewis J, Morgan D, Raff M, Roberts K, Walter P (2015). Biología molecular de la célula (6ª ed.) . Nueva York, NY: Garland Science, Taylor & Francis Group. pag. 988.ISBN 978-0-8153-4432-2.
- ^ Kops GJ, Weaver BA, Cleveland DW (octubre de 2005). "En el camino hacia el cáncer: aneuploidía y el punto de control mitótico". Nature Reviews. Cancer . 5 (10): 773–85. doi :10.1038/nrc1714. PMID 16195750. S2CID 2515388.
- ^ Lengauer C, Kinzler KW, Vogelstein B (diciembre de 1998). "Inestabilidades genéticas en cánceres humanos". Nature . 396 (6712): 643–9. Bibcode :1998Natur.396..643L. doi :10.1038/25292. PMID 9872311. S2CID 204996480.
- ^ Weaver BA, Cleveland DW (diciembre de 2006). "¿La aneuploidía causa cáncer?". Current Opinion in Cell Biology . 18 (6): 658–67. doi :10.1016/j.ceb.2006.10.002. PMID 17046232.
- ^ Cahill DP, Lengauer C, Yu J, Riggins GJ, Willson JK, Markowitz SD, Kinzler KW, Vogelstein B (marzo de 1998). "Mutaciones de genes de puntos de control mitóticos en cánceres humanos". Nature . 392 (6673): 300–3. Bibcode :1998Natur.392..300C. doi :10.1038/32688. PMID 9521327. S2CID 4416376.
- ^ Díaz-Rodríguez E, Álvarez-Fernández S, Chen X, Paiva B, López-Pérez R, García-Hernández JL, San Miguel JF, Pandiella A (2011). "Punto de control de ensamblaje de huso deficiente en mieloma múltiple". MÁS UNO . 6 (11): e27583. Código Bib : 2011PLoSO...627583D. doi : 10.1371/journal.pone.0027583 . PMC 3223182 . PMID 22132115.

- ^ Grady, William M. (2004). "Inestabilidad genómica y cáncer de colon". Cancer and Metastasis Reviews . 23 (1–2): 11–27. doi :10.1023/A:1025861527711. PMID 15000146. S2CID 1177511.
- ^ Wang RH, Yu H, Deng CX (diciembre de 2004). "Un requisito para el gen 1 asociado al cáncer de mama (BRCA1) en el punto de control del huso". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 101 (49): 17108–13. Bibcode :2004PNAS..10117108W. doi : 10.1073/pnas.0407585101 . PMC 535394 . PMID 15563594.
- ^ Sotillo R, Hernando E, Díaz-Rodríguez E, Teruya-Feldstein J, Cordón-Cardo C, Lowe SW, Benezra R (enero de 2007). "La sobreexpresión de Mad2 promueve la aneuploidía y la tumorigénesis en ratones". Célula cancerosa . 11 (1): 9–23. doi :10.1016/j.ccr.2006.10.019. PMC 1850996 . PMID 17189715.
- ^ Yamamoto Y, Matsuyama H, Chochi Y, Okuda M, Kawauchi S, Inoue R, Furuya T, Oga A, Naito K, Sasaki K (abril de 2007). "La sobreexpresión de BUBR1 se asocia con inestabilidad cromosómica en el cáncer de vejiga". Genética y Citogenética del Cáncer . 174 (1): 42–7. doi :10.1016/j.cancergencyto.2006.11.012. PMID 17350465.
- ^ ab Weaver BA, Cleveland DW (junio de 2009). "El papel de la aneuploidía en la promoción y supresión de tumores". The Journal of Cell Biology . 185 (6): 935–7. doi :10.1083/jcb.200905098. PMC 2711620 . PMID 19528293.
- ^ Cross, Shawn M.; Sanchez, Carissa A; Morgan, Catherine A.; Schimke, Melana K.; Reid, Brian J. (1995). "Un punto de control del huso de ratón dependiente de p53". Science . 3 (5202): 1353–1356. Bibcode :1995Sci...267.1353C. doi :10.1126/science.7871434. PMID 7871434. S2CID 38128370.
- ^ Altieri DC (diciembre de 2001). "Base molecular y función potencial de la survivina en el diagnóstico y la terapia del cáncer". Tendencias en medicina molecular . 7 (12): 542–7. doi :10.1016/S1471-4914(01)02243-2. PMID 11733216.
- ^ Gisselsson D, Håkanson U, Stoller P, Marti D, Jin Y, Rosengren AH, Stewénius Y, Kahl F, Panagopoulos I (abril de 2008). "Cuando el genoma juega a los dados: elusión del punto de control de ensamblaje del huso y segregación cromosómica casi aleatoria en mitosis de células cancerosas multipolares". PLOS ONE . 3 (4): e1871. Bibcode :2008PLoSO...3.1871G. doi : 10.1371/journal.pone.0001871 . PMC 2289843 . PMID 18392149.

- ^ Zhou J, Giannakakou P (enero de 2005). "Microtúbulos como diana en la quimioterapia contra el cáncer". Química medicinal actual. Agentes anticáncer . 5 (1): 65–71. doi :10.2174/1568011053352569. PMID 15720262.
- ^ Denisenko, Tatiana V.; Sorokina, Irina V.; Gogvadze, Vladimir; Zhivotovsky, Boris (1 de enero de 2016). "Catástrofe mitótica y resistencia a los fármacos contra el cáncer: un vínculo que debe romperse". Actualizaciones sobre resistencia a los fármacos . 24 : 1–12. doi :10.1016/j.drup.2015.11.002. ISSN 1368-7646. PMID 26830311.
- ^ ab Carvajal RD, Tse A, Schwartz GK (diciembre de 2006). "Aurora quinasas: nuevos objetivos para la terapia del cáncer". Clinical Cancer Research . 12 (23): 6869–75. doi : 10.1158/1078-0432.CCR-06-1405 . PMID 17145803.
- ^ Anand S, Penrhyn-Lowe S, Venkitaraman AR (enero de 2003). "La amplificación de AURORA-A anula el punto de control de ensamblaje del huso mitótico, lo que induce resistencia al Taxol". Cancer Cell . 3 (1): 51–62. doi : 10.1016/S1535-6108(02)00235-0 . PMID 12559175.
- ^ Harrington EA, Bebbington D, Moore J, Rasmussen RK, Ajose-Adeogun AO, Nakayama T, Graham JA, Demur C, Hercend T, Diu-Hercend A, Su M, Golec JM, Miller KM (marzo de 2004). "VX-680, un inhibidor potente y selectivo de moléculas pequeñas de las quinasas Aurora, suprime el crecimiento tumoral in vivo". Nature Medicine . 10 (3): 262–7. doi :10.1038/nm1003. PMID 14981513. S2CID 12918452.
- ^ Altieri DC (enero de 2008). "Survivin, redes de cáncer y descubrimiento de fármacos dirigidos por vías". Nature Reviews. Cancer . 8 (1): 61–70. doi :10.1038/nrc2293. PMID 18075512. S2CID 25597711.
- ^ Tao W, South VJ, Zhang Y, Davide JP, Farrell L, Kohl NE, Sepp-Lorenzino L, Lobell RB (julio de 2005). "La inducción de la apoptosis por un inhibidor de la kinesina mitótica KSP requiere tanto la activación del punto de control del ensamblaje del huso como el deslizamiento mitótico". Cancer Cell . 8 (1): 49–59. doi : 10.1016/j.ccr.2005.06.003 . PMID 16023598.
Lectura adicional
- Larsen NA, Al-Bassam J, Wei RR, Harrison SC (enero de 2007). "Análisis estructural de las interacciones de Bub3 en el punto de control del huso mitótico". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 104 (4): 1201–6. Bibcode :2007PNAS..104.1201L. doi : 10.1073/pnas.0610358104 . PMC 1770893 . PMID 17227844.
- Wang X, Babu JR, Harden JM, Jablonski SA, Gazi MH, Lingle WL, de Groen PC, Yen TJ, van Deursen JM (julio de 2001). "La proteína de punto de control mitótico hBUB3 y el factor de exportación de ARNm hRAE1 interactúan con proteínas que contienen la secuencia de unión a GLE2p (GLEBS)". The Journal of Biological Chemistry . 276 (28): 26559–67. doi : 10.1074/jbc.M101083200 . PMID 11352911.
- Kitagawa R, Rose AM (diciembre de 1999). "Los componentes del punto de control del ensamblaje del huso son esenciales en Caenorhabditis elegans". Nature Cell Biology . 1 (8): 514–21. doi :10.1038/70309. PMID 10587648. S2CID 25953096.
Enlaces externos
- El laboratorio de Ted Salmon: películas de células en división. [1]
- Laboratorio de Andrea Musacchio: esquemas de puntos de control del huso. [2]
- http://www.uniprot.org/uniprot/O60566

