Ácido antranílico
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Ácido 2-aminobenzoico [1] | |||
| Nombre sistemático de la IUPAC Ácido 2-aminobencenocarboxílico | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 3DMet |
| ||
| 471803 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.003.898 | ||
| Número CE |
| ||
| 3397 | |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD |
| ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C7H7NO2 | |||
| Masa molar | 137,138 g·mol −1 | ||
| Apariencia | sólido blanco o amarillo | ||
| Olor | inodoro | ||
| Densidad | 1,412 g/ cm3 | ||
| Punto de fusión | 146 a 148 °C (295 a 298 °F; 419 a 421 K) [3] | ||
| Punto de ebullición | 200 °C (392 °F; 473 K) (sublimes) | ||
| 0,572 g/100 ml (25 °C) | |||
| Solubilidad | muy soluble en cloroformo , piridina soluble en etanol , éter , éter etílico ligeramente soluble en ácido trifluoroacético , benceno | ||
| registro P | 1.21 | ||
| Presión de vapor | 0,1 Pa (52,6 °C) | ||
| Acidez (p K a ) |
| ||
| -77,18·10 −6 cm3 / mol | |||
Índice de refracción ( n D ) | 1.578 (144 °C) | ||
| Termoquímica | |||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | -380,4 kJ/mol | ||
| Peligros | |||
| Etiquetado SGA : | |||
  | |||
| Peligro | |||
| H318 , H319 | |||
| P264 , P280 , P305+P351+P338 , P310 , P337+P313 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | > 150 °C (302 °F; 423 K) | ||
| > 530 °C (986 °F; 803 K) | |||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 1400 mg/kg (oral, rata) | ||
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa | ||
| Estatus legal |
| ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El ácido antranílico es un ácido aromático con la fórmula C 6 H 4 (NH 2 )(CO 2 H) y tiene un sabor dulce. [5] [6] [7] La molécula consta de un anillo de benceno, orto -sustituido con un ácido carboxílico y una amina . Como resultado de contener grupos funcionales tanto ácidos como básicos , el compuesto es anfótero . El ácido antranílico es un sólido blanco cuando es puro, aunque las muestras comerciales pueden parecer amarillas. El anión [C 6 H 4 (NH 2 )(CO 2 )] − , obtenido por la desprotonación del ácido antranílico, se llama antranilato . Alguna vez se pensó que el ácido antranílico era una vitamina y se lo conocía como vitamina L 1 en ese contexto, pero ahora se sabe que no es esencial en la nutrición humana. [8]
Estructura
Aunque no suele denominarse como tal, es un aminoácido . El ácido antranílico sólido normalmente consta tanto del ácido aminocarboxílico como de las formas zwitteriónicas de carboxilato de amonio, y tiene una estructura cristalina monoclínica con el grupo espacial P2 1 . [9] Es triboluminiscente . [10] Por encima de los 81 °C (178 °F; 354 K), se convierte en una forma ortorrómbica con el grupo espacial Pbca, que no es triboluminiscente; también se conoce una fase monoclínica no triboluminiscente con una estructura similar. [10]
Producción
Se han descrito muchas rutas para obtener ácido antranílico. Industrialmente se produce a partir del anhídrido ftálico , comenzando por la aminación:
- C 6 H 4 (CO) 2 O + NH 3 + NaOH → C 6 H 4 (C(O)NH 2 )CO 2 Na + H 2 O
La sal de sodio resultante del ácido ftalámico se descarbonila mediante un reordenamiento de Hofmann del grupo amida, inducido por hipoclorito : [11]
- C 6 H 4 (C(O)NH 2 )CO 2 Na + HOCl → C 6 H 4 NH 2 CO 2 H + NaCl + CO 2
Un método relacionado implica el tratamiento de la ftalimida con hipobromito de sodio en hidróxido de sodio acuoso, seguido de neutralización. [12] En la era en que el tinte índigo se obtenía de las plantas, se degradaba para dar ácido antranílico.
El ácido antranílico se obtuvo por primera vez mediante la degradación inducida por bases del índigo. [13]
Biosíntesis
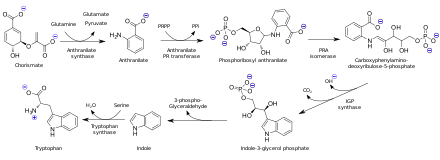
El ácido antranílico se biosintetiza a partir del ácido corísmico por acción de la antranilato sintasa . En los organismos capaces de sintetizar triptófano, el antranilato es un precursor del aminoácido triptófano a través de la unión del pirofosfato de fosforribosil al grupo amino . Después, se produce la ciclización para producir indol .
Usos
En la industria, el ácido antranílico es un intermediario en la producción de colorantes azoicos y sacarina . Este y sus ésteres se utilizan en la preparación de perfumes que imitan al jazmín y la naranja , productos farmacéuticos ( diuréticos de asa , como la furosemida ) y absorbentes de rayos UV, así como inhibidores de corrosión para metales e inhibidores de moho en la salsa de soja .
Se han propuesto repelentes de insectos a base de antranilato como sustitutos del DEET .
El ácido fenámico es un derivado del ácido antranílico, [14] : 235 que a su vez es un isóstero nitrogenado del ácido salicílico , que es el metabolito activo de la aspirina . [14] : 235 Varios fármacos antiinflamatorios no esteroides , incluidos el ácido mefenámico , el ácido tolfenámico , el ácido flufenámico y el ácido meclofenámico , se derivan del ácido fenámico o del ácido antranílico y se denominan "derivados del ácido antranílico" o "fenamatos". [15] : 17
Reacciones
El ácido antranílico se puede diazotar para dar el catión diazonio [C 6 H 4 (CO 2 H)(N 2 )] + . Este catión se puede utilizar para generar bencina , [16] dimerizar para dar ácido difénico , [17] o experimentar reacciones de acoplamiento de diazonio como en la síntesis de rojo de metilo . [18]
Reacciona con fosgeno para dar anhídrido isatoico , un reactivo versátil. [19]
La cloración del ácido antranílico produce el derivado 2,4-dicloro, que puede sufrir acoplamiento reductor para formar un compuesto biarílico . [20]
Seguridad y regulación
También es una sustancia química de la Lista I de la DEA debido a su uso en la fabricación de metacualona, un fármaco sedante eufórico ampliamente prohibido (Quaalude, Mandrax). [21]
Véase también
Referencias
- ^ "Presentación preliminar". Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. pág. 748. doi :10.1039/9781849733069-FP001. ISBN . 978-0-85404-182-4.
- ^ Haynes, William M., ed. (2016). Manual de química y física del CRC (97.ª edición). CRC Press . pp. 5–89. ISBN 978-1498754286.
- ^ IPS
- ^ Anvisa (31 de marzo de 2023). "RDC Nº 784 - Listas de Substâncias Entorpecentes, Psicotrópicas, Precursoras e Outras sob Controle Especial" [Resolución del Consejo Colegiado N° 784 - Listas de Sustancias Estupefacientes, Psicotrópicas, Precursoras y Otras Sustancias Bajo Control Especial] (en portugués brasileño). Diario Oficial da União (publicado el 4 de abril de 2023). Archivado desde el original el 3 de agosto de 2023 . Consultado el 15 de agosto de 2023 .
- ^ Acton, Q. Ashton (2013). Ácidos aminobenzoicos: avances en investigación y aplicación (edición de 2013). Atlanta: ScholarlyEditions. pág. 23. ISBN 9781481684842– a través de Google Books.
- ^ Hardy, Mark R. (1997). "Etiquetado de glicanos con los fluoróforos 2-aminobenzamida y ácido antranílico". En Townsend, R. Reid; Hotchkiss, Arland T. Jr. (eds.). Técnicas en glicobiología. Marcel Dekker, Inc. pág. 360. ISBN 9780824798222– a través de Google Books.
- ^ Índice Merck, 10.ª edición (1983), pág. 62, Rahway: Merck & Co.
- ^ Davidson, Michael W. (2004). "Ácido antranílico (vitamina L)]". Universidad Estatal de Florida . Consultado el 20 de noviembre de 2019 .
- ^ Brown, CJ (1968). "La estructura cristalina del ácido antranílico". Actas de la Royal Society de Londres. Serie A. Ciencias matemáticas y físicas . 302 (1469): 185–199. Bibcode :1968RSPSA.302..185B. doi :10.1098/rspa.1968.0003. S2CID 93221347.
- ^ ab Hardy, Gordon E.; Kaska, William C.; Chandra, BP; Zink, Jeffrey I. (marzo de 1981). "Relaciones triboluminiscente-estructurales en polimorfos de hexafenilcarbodifosforano y ácido antranílico, cristales moleculares y sales". Revista de la Sociedad Química Americana . 103 (5): 1074–1079. doi :10.1021/ja00395a014.
- ^ Maki, Takao; Takeda, Kazuo (2000). "Ácido benzoico y derivados". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a03_555. ISBN . 3527306730..
- ^ Vogel's Textbook of Practical Organic Chemistry, 4.ª ed. , (BS Furniss et al., Eds.) (1978), pág. 666, Londres: Longman.
- ^ Sheibley, Fred E. (1943). "Carl Julius Fritzsche y el descubrimiento del ácido antranílico, 1841". Revista de Educación Química . 20 (3): 115. Bibcode :1943JChEd..20..115S. doi :10.1021/ed020p115.
- ^ ab Sriram D, Yogeeswari P. Química medicinal, 2.ª edición. Pearson Education India, 2010. ISBN 9788131731444
- ^ Material del curso de la Universidad de Auburn. Jack DeRuiter, Principles of Drug Action 2, otoño de 2002 1: Medicamentos antiinflamatorios no esteroides (AINE)
- ^ Logullo, FM; Seitz, AH; Friedman, L. (1968). "Bencenodiazonio-2-carboxi- y bifenileno". Síntesis orgánicas . 48 : 12.
- ^ Atkinson, ER; Lawler, HJ (1927). "Ácido difénico". Síntesis orgánicas . 7 : 30. doi :10.15227/orgsyn.007.0030.
- ^ Clarke, HT; Kirner, WR (1922). "Metil rojo". Síntesis orgánicas . 2 : 47.
- ^ Wagner, CE; Fegley, Marion F. (1947). "Anhídrido isatoico". Org. Sintetizador . 27 : 45. doi : 10.15227/orgsyn.027.0045.
- ^ Atkinson, Edward R.; Murphy, Donald M.; Lufkin, James E. (1951). "Ácido dl-4,4',6,6'-tetraclorodifénico". Síntesis orgánicas . 31 : 96.
- ^ Angelos SA, Meyers JA (1985). "El aislamiento y la identificación de precursores y productos de reacción en la fabricación clandestina de metacualona y meclocualona". Revista de Ciencias Forenses . 30 (4): 1022–1047. doi :10.1520/JFS11044J. PMID 3840834.