Infección adquirida en el hospital
| Infección nosocomial | |
|---|---|
| Otros nombres | Infecciones asociadas a la atención sanitaria (HAI) |
 | |
| Las superficies contaminadas aumentan la transmisión cruzada | |
| Especialidad | Enfermedad infecciosa |
Una infección adquirida en el hospital , también conocida como infección nosocomial (del griego nosokomeion , que significa "hospital"), es una infección que se adquiere en un hospital u otro centro de atención médica . [1] Para enfatizar tanto los entornos hospitalarios como los no hospitalarios, a veces se la llama infección asociada a la atención médica . [2] Dicha infección puede adquirirse en un hospital, un hogar de ancianos , un centro de rehabilitación , una clínica ambulatoria, un laboratorio de diagnóstico u otros entornos clínicos. Una serie de procesos dinámicos pueden llevar la contaminación a los quirófanos y otras áreas dentro de los entornos nosocomiales. [3] [4] La infección se transmite al paciente susceptible en el entorno clínico por varios medios. El personal sanitario también propaga la infección, además de equipos contaminados, ropa de cama o gotitas de aire. La infección puede originarse en el entorno exterior, otro paciente infectado, personal que puede estar infectado o, en algunos casos, no se puede determinar la fuente de la infección. En algunos casos, el microorganismo se origina en la propia microbiota cutánea del paciente , volviéndose oportunista después de una cirugía u otros procedimientos que comprometen la barrera protectora de la piel. Aunque el paciente puede haber contraído la infección a través de su propia piel, la infección se sigue considerando nosocomial, ya que se desarrolla en el ámbito sanitario. [5] El término infección nosocomial se utiliza cuando no hay pruebas de que la infección estuviera presente cuando el paciente ingresó al ámbito sanitario, lo que significa que se adquirió o se volvió problemática después del ingreso. [5] [6]
Efectos
Durante 2002 en los Estados Unidos, los Centros para el Control y la Prevención de Enfermedades estimaron que aproximadamente 1,7 millones de infecciones asociadas a la atención médica, de todo tipo de microorganismos , incluidas bacterias y hongos combinados, causaron o contribuyeron a 99.000 muertes. [7] En Europa , donde se han realizado encuestas hospitalarias, se estima que la categoría de infecciones por gramnegativos representa dos tercios de las 25.000 muertes cada año. [8] Las infecciones nosocomiales pueden causar neumonía grave e infecciones del tracto urinario , el torrente sanguíneo y otras partes del cuerpo. [9] [10] Muchos tipos muestran resistencia a los antimicrobianos , lo que puede complicar el tratamiento . [11]
En el Reino Unido, unos 300.000 pacientes se vieron afectados en 2017, y se estima que esto le costó al NHS alrededor de £1.000 millones al año. [12]
Tipos
Organismos
Causa
Transmisión
Recientemente se ha identificado que los catéteres permanentes causan infecciones adquiridas en el hospital. [14] Para tratar esta complicación, se utilizan procedimientos llamados terapia de bloqueo antimicrobiano intravascular , que pueden reducir las infecciones que no están expuestas a antibióticos transmitidos por la sangre. [15] La introducción de antibióticos, incluido el etanol, en el catéter (sin enjuagarlo en el torrente sanguíneo) reduce la formación de biopelículas . [13]
| Ruta | Descripción |
|---|---|
| Transmisión de contacto | El modo de transmisión más importante y frecuente de las infecciones nosocomiales es el contacto directo. |
| Transmisión por gotitas | La transmisión ocurre cuando gotitas que contienen microbios de la persona infectada son impulsadas a una corta distancia a través del aire y depositadas en el cuerpo del paciente; las gotitas se generan desde la persona fuente principalmente al toser, estornudar y hablar, y durante la realización de ciertos procedimientos, como la broncoscopia. |
| Transmisión aérea | La diseminación puede ser a través de núcleos de gotitas en el aire (residuos de partículas pequeñas {de 5 μm o menos} de gotitas evaporadas que contienen microorganismos que permanecen suspendidos en el aire durante largos períodos de tiempo) o partículas de polvo que contienen el agente infeccioso. Los microorganismos transportados de esta manera pueden dispersarse ampliamente por las corrientes de aire y pueden ser inhalados por un huésped susceptible dentro de la misma habitación o a una distancia mayor del paciente fuente, dependiendo de los factores ambientales; por lo tanto, se requiere un manejo especial del aire y ventilación para prevenir la transmisión aérea. Los microorganismos transmitidos por transmisión aérea incluyen Legionella , Mycobacterium tuberculosis y los virus de la rubéola y la varicela . |
| Transmisión de vehículos comunes | Esto se aplica a los microorganismos transmitidos al huésped a través de fómites contaminados , como alimentos, agua, medicamentos, dispositivos y equipos. |
| Transmisión por vectores | Esto ocurre cuando vectores como mosquitos, moscas, ratas y otros alimañas transmiten microorganismos. |
La transmisión por contacto se divide en dos subgrupos: transmisión por contacto directo y transmisión por contacto indirecto.
| Ruta | Descripción |
|---|---|
| Transmisión por contacto directo | Esto implica un contacto directo entre superficies corporales y la transferencia física de microorganismos entre un huésped susceptible y una persona infectada o colonizada, como cuando una persona gira a un paciente, lo baña o realiza otras actividades de atención al paciente que requieren contacto personal directo. La transmisión por contacto directo también puede ocurrir entre dos pacientes, en los que uno actúa como fuente de los microorganismos infecciosos y el otro como huésped susceptible. |
| Transmisión por contacto indirecto | Esto implica el contacto de un huésped susceptible con un objeto intermedio contaminado, generalmente inanimado, como instrumentos, agujas o apósitos contaminados, o guantes contaminados que no se cambian entre pacientes. Además, el uso inadecuado de jeringas, viales y bolsas de solución salina se ha relacionado con la transmisión de enfermedades en los EE. UU., incluso cuando los trabajadores de la salud tenían acceso a guantes, agujas desechables, dispositivos intravenosos y soluciones de lavado. [16] |
Susceptibilidad del paciente
Además de reducir los vectores de transmisión, es necesario tener en cuenta la susceptibilidad de los pacientes a las infecciones adquiridas en el hospital. Entre los factores que aumentan el riesgo de infecciones de los pacientes se incluyen los siguientes:
- Recepción de medicamentos inmunosupresores como glucocorticoides [17] o fármacos inmunosupresores como parte de tratamientos para el cáncer , trasplante de órganos o enfermedades autoinmunes.
- Inmunidad deteriorada debido a enfermedades como neoplasias hematológicas , inmunodeficiencia primaria , VIH/SIDA o enfermedades críticas , [18] incluida la COVID-19 grave [17] [19]
- Presencia de dispositivos permanentes que violan las defensas naturales, incluidos tubos endotraqueales , catéteres venosos centrales y catéteres urinarios .
- El uso de antibióticos, por sí mismo, no aumenta el riesgo de infecciones adquiridas en el hospital, pero sí contribuye a la prevalencia de organismos resistentes a los antimicrobianos entre los pacientes con infecciones adquiridas en el hospital [20].
Infecciones asociadas a dispositivos
Dada la asociación entre los dispositivos invasivos y las infecciones adquiridas en el hospital, se utilizan términos específicos para delimitar dichas infecciones y permitir su seguimiento y prevención. Entre las infecciones asociadas a dispositivos se encuentran la neumonía asociada a respiradores , las infecciones del torrente sanguíneo asociadas a catéteres, las infecciones del tracto urinario asociadas a catéteres y la ventriculitis asociada a dispositivos . La vigilancia de estas infecciones es realizada y reportada comúnmente por organismos como el Centro Europeo para la Prevención y el Control de Enfermedades y los Centros para el Control y la Prevención de Enfermedades . [ cita requerida ]
Prevención

El control de las infecciones nosocomiales implica la implementación de medidas de control de calidad en los sectores de la atención de la salud , y la gestión basada en evidencia puede ser un enfoque viable. En el caso de las personas con neumonía asociada a ventilación mecánica o adquirida en el hospital, el control y la vigilancia de la calidad del aire interior del hospital deben ser una prioridad en el tratamiento, [21] mientras que en el caso de las infecciones nosocomiales por rotavirus , se debe aplicar un protocolo de higiene de manos . [22] [23] [24]
Para reducir la cantidad de infecciones adquiridas en hospitales, el estado de Maryland implementó el Programa de Condiciones Adquiridas en Hospitales de Maryland, que ofrece recompensas financieras y sanciones a hospitales individuales. Una adaptación de la política de pago de los Centros de Servicios de Medicare y Medicaid hace que los hospitales con un desempeño deficiente pierdan hasta el 3% de sus ingresos por pacientes hospitalizados, mientras que los hospitales que logran reducir las infecciones adquiridas en hospitales pueden ganar hasta un 3% en recompensas. Durante los dos primeros años del programa, las tasas de complicaciones cayeron un 15,26% en todas las enfermedades adquiridas en hospitales que monitorea el estado (incluidas las que no están cubiertas por el programa), de una tasa de complicaciones ajustada al riesgo de 2,38 por cada 1.000 personas en 2009 a una tasa de 2,02 en 2011. La disminución del 15,26% se traduce en un ahorro de más de 100 millones de dólares en costos para el sistema de atención de la salud en Maryland, y los mayores ahorros provienen de la prevención de infecciones del tracto urinario, sepsis y otras infecciones graves, y neumonía y otras infecciones pulmonares. Si se pudieran lograr resultados similares en todo el país, el programa Medicare ahorraría aproximadamente 1.300 millones de dólares en dos años, mientras que el sistema de atención de la salud de los EE. UU. en su conjunto ahorraría 5.300 millones de dólares. [25]
Saneamiento
Los hospitales tienen protocolos de saneamiento en cuanto a uniformes , esterilización de equipos , lavado y otras medidas preventivas. El lavado minucioso de manos y/o el uso de desinfectantes con alcohol por parte de todo el personal médico antes y después de cada contacto con un paciente es una de las formas más eficaces de combatir las infecciones nosocomiales. [26] También se considera vital un uso más cuidadoso de los agentes antimicrobianos , como los antibióticos . [27] Como muchas infecciones adquiridas en el hospital causadas por bacterias como Staphylococcus aureus resistente a la meticilina, Staphylococcus aureus sensible a la meticilina y Clostridioides difficile son causadas por el incumplimiento de estos protocolos, es común que los pacientes afectados presenten reclamos por negligencia médica contra el hospital en cuestión. [28]
La desinfección de superficies es parte de las medidas de control para reducir las infecciones nosocomiales en los entornos sanitarios. Los métodos de desinfección modernos, como los sistemas de vapor de alcohol no inflamable en dióxido de carbono, han sido eficaces contra la gastroenteritis, el Staphylococcus aureus resistente a la meticilina y los agentes de la gripe. Se ha demostrado clínicamente que el uso de vapor de peróxido de hidrógeno reduce las tasas de infección y el riesgo de adquisición. El peróxido de hidrógeno es eficaz contra las bacterias formadoras de endosporas, como Clostridioides difficile , mientras que el alcohol es ineficaz. [29] [ se necesita una fuente no primaria ] También se pueden utilizar dispositivos de limpieza ultravioleta para desinfectar las habitaciones de los pacientes infectados con Clostridioides difficile o Staphylococcus aureus resistente a la meticilina después del alta. [30] [ se necesita una fuente no primaria ]
A pesar de los protocolos sanitarios, no es posible aislar por completo a los pacientes de los agentes infecciosos. Además, a menudo se les recetan antibióticos y otros medicamentos antimicrobianos para tratar la enfermedad, lo que puede aumentar la presión selectiva para la aparición de cepas resistentes. [31]
Esterilización
La esterilización va más allá de la simple higienización. Mata todos los microorganismos presentes en los equipos y las superficies mediante la exposición a sustancias químicas, radiación ionizante, calor seco o vapor a presión. [32]
Aislamiento
El aislamiento es la implementación de precauciones de aislamiento diseñadas para prevenir la transmisión de microorganismos por vías comunes en los hospitales. (Véase Precauciones universales y Precauciones basadas en la transmisión ). Debido a que los factores del agente y del huésped son más difíciles de controlar, la interrupción de la transferencia de microorganismos está dirigida principalmente a la transmisión, por ejemplo, el aislamiento de casos infecciosos en hospitales especiales y el aislamiento de pacientes con heridas infectadas en habitaciones especiales, así como el aislamiento de pacientes con trasplantes articulares en habitaciones específicas. [ cita requerida ]
Lavarse las manos
El lavado frecuente de manos se considera la medida más importante para reducir los riesgos de transmisión de microorganismos de la piel de una persona a otra o de un sitio a otro en el mismo paciente. Lavarse las manos lo más rápido y minuciosamente posible entre los contactos con los pacientes y después del contacto con sangre , fluidos corporales , secreciones , excreciones y equipos o artículos contaminados por ellos es un componente importante del control de infecciones y las precauciones de aislamiento. La propagación de infecciones nosocomiales, entre pacientes inmunodeprimidos, está relacionada con la contaminación de las manos de los trabajadores de la salud en casi el 40% de los casos y es un problema desafiante en los hospitales modernos. La mejor manera de que los trabajadores superen este problema es llevando a cabo procedimientos correctos de higiene de manos; por eso la OMS lanzó en 2005 el Desafío GLOBAL de Seguridad del Paciente. [33]
En las manos de los trabajadores sanitarios pueden encontrarse dos categorías de microorganismos: la flora transitoria y la flora residente. La primera está formada por los microorganismos que los trabajadores recogen del entorno y cuyas bacterias son capaces de sobrevivir en la piel humana y, en ocasiones, de multiplicarse. El segundo grupo está formado por los microorganismos permanentes que viven en la superficie de la piel (en el estrato córneo o inmediatamente debajo de ella). Son capaces de sobrevivir en la piel humana y de multiplicarse libremente en ella. Tienen una baja patogenicidad y una tasa de infección baja y crean una especie de protección frente a la colonización por parte de otras bacterias más patógenas. La piel de los trabajadores está colonizada por 3,9 × 10 4 – 4,6 × 10 6 ufc /cm 2 . Los microbios que componen la flora residente son: Staphylococcus epidermidis , Staphylococcus hominis y Micrococcus , Propionibacterium , Corynebacterium , Dermabacter y Pittosporum spp., mientras que los organismos transitorios son Staphylococcus aureus y Klebsiella pneumoniae , y Acinetobacter, Enterobacter y Candida spp. El objetivo de la higiene de manos es eliminar la flora transitoria con un lavado de manos cuidadoso y adecuado, utilizando diferentes tipos de jabón (normal y antiséptico) y geles a base de alcohol. Los principales problemas encontrados en la práctica de la higiene de manos están relacionados con la falta de lavabos disponibles y el lavado de manos que requiere mucho tiempo. Una forma fácil de resolver este problema podría ser el uso de desinfectantes para manos a base de alcohol, debido a su aplicación más rápida en comparación con el lavado de manos correcto. [34]
También se ha demostrado que mejorar el lavado de manos de los pacientes reduce la tasa de infecciones nosocomiales. Los pacientes que están postrados en cama a menudo no tienen tanto acceso a limpiarse las manos a la hora de comer o después de tocar superficies o manipular desechos como pañuelos de papel. Al reforzar la importancia del lavado de manos y proporcionar gel desinfectante o toallitas al alcance de la cama, las enfermeras pudieron reducir directamente las tasas de infección. Un estudio publicado en 2017 demostró esto al mejorar la educación de los pacientes tanto sobre el procedimiento adecuado de lavado de manos como sobre los momentos importantes para usar desinfectante y redujo con éxito la tasa de enterococos y Staphylococcus aureus . [35]
Todos los visitantes deben seguir los mismos procedimientos que el personal del hospital para controlar adecuadamente la propagación de infecciones. Además, las infecciones resistentes a múltiples fármacos pueden salir del hospital y convertirse en parte de la flora comunitaria si no se toman medidas para detener esta transmisión. [ cita requerida ]
No está claro si el esmalte de uñas o los anillos afectaron las tasas de infección de heridas quirúrgicas. [36]
Guantes
Además del lavado de manos, los guantes desempeñan un papel importante en la reducción de los riesgos de transmisión de microorganismos. Los guantes se utilizan por tres razones importantes en los hospitales. En primer lugar, se utilizan para proporcionar una barrera protectora para el personal, evitando la contaminación a gran escala de las manos al tocar sangre, fluidos corporales, secreciones, excreciones, membranas mucosas y piel no intacta. En los Estados Unidos, la Administración de Seguridad y Salud Ocupacional ha ordenado el uso de guantes para reducir el riesgo de infecciones por patógenos transmitidos por la sangre . [37] En segundo lugar, se utilizan guantes para reducir la probabilidad de que los microorganismos presentes en las manos del personal se transmitan a los pacientes durante procedimientos invasivos u otros procedimientos de atención al paciente que impliquen tocar las membranas mucosas y la piel no intacta de un paciente. En tercer lugar, se utilizan para reducir la probabilidad de que las manos del personal contaminadas con microorganismos de un paciente o un fómite puedan transmitir esos microorganismos a otro paciente. En esta situación, los guantes deben cambiarse entre los contactos con el paciente y las manos deben lavarse después de quitarse los guantes. [ cita requerida ]
Superficies antimicrobianas
Se sabe que los microorganismos sobreviven en superficies inanimadas "táctiles" durante períodos prolongados de tiempo. [38] [39] Esto puede ser especialmente problemático en entornos hospitalarios donde los pacientes inmunodeficientes tienen un mayor riesgo de contraer infecciones nosocomiales. Los pacientes con infecciones adquiridas en el hospital son hospitalizados predominantemente en diferentes tipos de unidades de cuidados intensivos (UCI). [40]
Se sabe que las superficies táctiles que se encuentran comúnmente en las habitaciones de los hospitales, como las barandillas de las camas, los botones de llamada, las placas táctiles, las sillas, las manijas de las puertas, los interruptores de la luz, las barras de apoyo, los postes intravenosos, los dispensadores (gel de alcohol, toallas de papel, jabón), los carros de vendaje y las encimeras y las mesas están contaminadas con Staphylococcus , Staphylococcus aureus resistente a la meticilina (una de las cepas más virulentas de bacterias resistentes a los antibióticos) y Enterococcus resistente a la vancomicina . [41] Los objetos más cercanos a los pacientes tienen los niveles más altos de Staphylococcus aureus resistente a la meticilina y Enterococcus resistente a la vancomicina . Es por eso que las superficies táctiles en las habitaciones de los hospitales pueden servir como fuentes o reservorios para la propagación de bacterias de las manos de los trabajadores de la salud y los visitantes de los pacientes. [42]
Varios compuestos pueden reducir el riesgo de que crezcan bacterias en las superficies, entre ellos: cobre , plata y germicidas . [43]
Se han realizado varios estudios que evalúan el uso de sistemas de limpieza sin contacto, en particular el uso de dispositivos ultravioleta C. Una revisión no fue concluyente debido a la falta de evidencia o a la mala calidad de la misma. [44] Otras revisiones han encontrado cierta evidencia, y evidencia creciente, de su efectividad. [45] [46]
Tratamiento
Dos de las especies de bacterias que tienen más probabilidades de infectar a los pacientes son las cepas Gram-positivas de Staphylococcus aureus resistente a la meticilina y las Gram-negativas de Acinetobacter baumannii . Si bien existen medicamentos antibióticos para tratar enfermedades causadas por Staphylococcus aureus resistente a la meticilina , hay pocos medicamentos efectivos disponibles para Acinetobacter . Las bacterias de Acinetobacter están evolucionando y se están volviendo inmunes a los antibióticos, por lo que en muchos casos, se necesitan usar antibacterianos de tipo polimixina . "En muchos aspectos es mucho peor que MRSA", dijo un especialista de la Universidad Case Western Reserve . [47]
Otra enfermedad en aumento, especialmente prevalente en los hospitales de la ciudad de Nueva York , es la Klebsiella pneumoniae , una bacteria gramnegativa resistente a los medicamentos . Se estima que más del 20% de las infecciones por Klebsiella en los hospitales de Brooklyn "son resistentes a prácticamente todos los antibióticos modernos, y esos supergérmenes se están extendiendo por todo el mundo". [47]
Las bacterias, clasificadas como Gram-negativas debido a su color en la tinción de Gram , pueden causar neumonía grave e infecciones del tracto urinario , el torrente sanguíneo y otras partes del cuerpo. Sus estructuras celulares las hacen más difíciles de atacar con antibióticos que los organismos Gram-positivos como el Staphylococcus aureus resistente a la meticilina . En algunos casos, la resistencia a los antibióticos se está extendiendo a las bacterias Gram-negativas que pueden infectar a las personas fuera del hospital. "Para las bacterias Gram-positivas necesitamos mejores medicamentos; para las Gram-negativas necesitamos cualquier medicamento", dijo Brad Spellberg, un especialista en enfermedades infecciosas en el Centro Médico Harbor-UCLA y autor de Rising Plague , un libro sobre patógenos resistentes a los medicamentos. [47]
La neumonía adquirida en el hospital (NAH) es la segunda infección nosocomial más común y representa aproximadamente una cuarta parte de todas las infecciones en la unidad de cuidados intensivos (UCI). [48] La NAH, o neumonía nosocomial, es una infección de las vías respiratorias inferiores que no estaba en incubación en el momento del ingreso hospitalario y que se presenta clínicamente dos o más días después de la hospitalización. [49] La neumonía asociada a la ventilación mecánica (NAV) se define como NAH en pacientes que reciben ventilación mecánica. La incidencia de NAV es del 10 al 30 % entre los pacientes que requieren ventilación mecánica durante >48 h. [50] Un protocolo de tratamiento estándar se basa en definiciones de diagnóstico precisas, confirmación microbiológica de NAV y la administración de imipenem más ciprofloxacino como tratamiento antibiótico empírico inicial. [51]
Se considera que una tercera parte de las infecciones nosocomiales son prevenibles. Los CDC estiman que 687.000 personas en los Estados Unidos se infectaron por infecciones adquiridas en el hospital en 2015, lo que resultó en 72.000 muertes. [52] Las infecciones nosocomiales más comunes son las del tracto urinario , el sitio quirúrgico y diversas neumonías . [7]
Un tratamiento alternativo dirigido a infecciones localizadas es el uso de irradiación con luz ultravioleta C. [53]
Epidemiología
Los métodos utilizados difieren de un país a otro (definiciones utilizadas, tipo de infecciones nosocomiales cubiertas, unidades de salud encuestadas, inclusión o exclusión de infecciones importadas, etc.), por lo que las comparaciones internacionales de las tasas de infecciones nosocomiales deben realizarse con el máximo cuidado. [ cita requerida ]
Bélgica
En Bélgica, la prevalencia de infecciones nosocomiales es de aproximadamente el 6,2%. Anualmente, unos 125.500 pacientes contraen una infección nosocomial, lo que provoca casi 3.000 muertes. Se estima que los costes adicionales para el seguro de salud ascienden a unos 400 millones de euros al año. [54]
Francia
Las estimaciones oscilaron entre el 6,7% en 1990 y el 7,4% (los pacientes pueden tener varias infecciones). [55] A nivel nacional, la prevalencia entre los pacientes en los centros de atención de salud fue del 6,7% en 1996, [56] del 5,9% en 2001 [57] y del 5,0% en 2006. [58] Las tasas de infecciones nosocomiales fueron del 7,6% en 1996, del 6,4% en 2001 y del 5,4% en 2006. [ cita requerida ]
En 2006, las infecciones más frecuentes fueron las infecciones del tracto urinario (30,3%), las neumopatías (14,7%), las infecciones en el sitio quirúrgico (14,2%), las infecciones de la piel y las mucosas (10,2%), otras infecciones respiratorias (6,8%) y las infecciones bacterianas/intoxicación de la sangre (6,4%). [59] Las tasas entre los pacientes adultos en cuidados intensivos fueron del 13,5% en 2004, del 14,6% en 2005, del 14,1% en 2006 y del 14,4% en 2007. [60]
Se estima que las infecciones nosocomiales hacen que los pacientes permanezcan en el hospital entre cuatro y cinco días más. Alrededor de 2004-2005, alrededor de 9.000 personas murieron cada año por una infección nosocomial, de las cuales unas 4.200 habrían sobrevivido sin esta infección. [61]
Finlandia
La tasa se estimó en 8,5% de los pacientes en 2005. [62]
Italia
Desde el año 2000, las estimaciones muestran una tasa de infección de alrededor del 6,7%, es decir, entre 450.000 y 700.000 pacientes, que causaron entre 4.500 y 7.000 muertes. [63] Una encuesta realizada en Lombardía arrojó una tasa del 4,9% de los pacientes en el año 2000. [64]
Suiza
Las estimaciones oscilan entre el 2 y el 14%. [65] Una encuesta nacional arrojó una tasa del 7,2% en 2004. [66]
Reino Unido
En 2012, la Agencia de Protección de la Salud informó que la tasa de prevalencia de infecciones adquiridas en el hospital en Inglaterra fue del 6,4% en 2011, frente a una tasa del 8,2% en 2006, [67] siendo las infecciones del tracto respiratorio , del tracto urinario y del sitio quirúrgico los tipos de infecciones notificados más comunes. [67] En 2018, se informó que las infecciones intrahospitalarias habían aumentado de 5.972 en 2008 a 48.815 en 2017. [68]
Estados Unidos
Los Centros para el Control y la Prevención de Enfermedades (CDC) estimaron que aproximadamente 1,7 millones de infecciones asociadas a hospitales, de todos los tipos de bacterias combinadas, causan o contribuyen a 99.000 muertes cada año. [69] Otras estimaciones indican que el 10%, o 2 millones, de pacientes al año se infectan, con un costo anual que varía entre $4.5 mil millones y $11 mil millones. [70] En los EE. UU., el tipo más frecuente de infección hospitalaria es la infección del tracto urinario (36%), seguida de la infección del sitio quirúrgico (20%) y la infección del torrente sanguíneo y la neumonía (ambas 11%). [47] [ necesita actualización ]
Historia
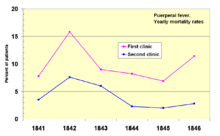
En 1841, Ignaz Semmelweis , un obstetra húngaro , trabajaba en un hospital de maternidad de Viena. Estaba "conmocionado" por la tasa de mortalidad de las mujeres que desarrollaban fiebre puerperal . Documentó que la mortalidad era tres veces mayor en la sala donde los estudiantes de medicina estaban atendiendo partos que en la sala contigua, que estaba atendida por estudiantes de obstetricia . [71] Los estudiantes de medicina también trabajaban rutinariamente con cadáveres . Comparó las tasas de infección con un hospital similar en Dublín, Irlanda , y planteó la hipótesis de que eran los estudiantes de medicina quienes de alguna manera estaban infectando a las mujeres después del parto. Instituyó el lavado de manos obligatorio en mayo de 1847 y las tasas de infección cayeron drásticamente. Louis Pasteur propuso la teoría de los gérmenes de la enfermedad y comenzó su trabajo sobre el cólera en 1865 al identificar que eran los microorganismos los que estaban asociados con la enfermedad . [72] [73]
Véase también
- Cortina de cubículo
- ESCAPE
- Control de infecciones
- Iatrogenia
- Fototerapia
- Procedimientos operativos estándar de saneamiento
Referencias
- ^ Rosenthal VD, Bijie H, Maki DG, Mehta Y, Apisarnthanarak A, Medeiros EA, Leblebicioglu H, Fisher D, Álvarez-Moreno C, Khader IA, Martínez MD, Cuellar LE, Navoa-Ng JA, Abouqal R, Garcell HG ( junio de 2012). "Informe del Consorcio Internacional para el Control de Infecciones Nosocomiales (INICC), resumen de datos de 36 países, para 2004-2009" (PDF) . Revista estadounidense de control de infecciones . 40 (5): 396–407. doi :10.1016/j.ajic.2011.05.020. PMID 21908073.
- ^ "Datos y estadísticas de HAI". cdc.gov . 10 de enero de 2018 . Consultado el 13 de enero de 2018 .
- ^ Carroll GT, Kirschman DL, Mammana A (2022). "El aumento de los niveles de CO2 en el quirófano se correlaciona con el número de trabajadores sanitarios presentes: un imperativo para el control intencional de multitudes". Seguridad del paciente en cirugía . 16 (1): 35. doi : 10.1186/s13037-022-00343-8 . PMC 9672642 . PMID 36397098. S2CID 253556197.
- ^ Carroll GT, Kirschman DL (2022). "Las caídas de presión discretas en la sala predicen la apertura de puertas y los niveles de contaminación en el entorno de la sala de operaciones". Atención perioperatoria y manejo de la sala de operaciones . 29 : 100291. doi : 10.1016/j.pcorm.2022.100291 . S2CID 252640995.
- ^ ab Monegro AF, Muppidi V, Regunath H (2020), "Infecciones adquiridas en el hospital", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 28722887 , consultado el 1 de febrero de 2021
- ^ Sydnor ER, Perl TM (enero de 2011). "Epidemiología hospitalaria y control de infecciones en entornos de cuidados intensivos". Clinical Microbiology Reviews . 24 (1): 141–173. doi : 10.1128/CMR.00027-10 . ISSN 1098-6618. PMC 3021207 . PMID 21233510.
- ^ ab Klevens RM, Edwards JR, Richards CL, Horan TC, Gaynes RP, Pollock DA, Cardo DM (2007). "Estimación de infecciones y muertes asociadas a la atención médica en hospitales de EE. UU., 2002". Public Health Reports . 122 (2): 160–166. doi : 10.1177/003335490712200205 . PMC 1820440 . PMID 17357358.
- ^ Pollack A (26 de febrero de 2010). "Los médicos luchan por tratar las infecciones bacterianas gramnegativas" . The New York Times . ISSN 0362-4331 . Consultado el 15 de noviembre de 2019 .
- ^ Burke A Cunha (30 de julio de 2018). John L Brusch (ed.). "Neumonía adquirida en el hospital (neumonía nosocomial) y neumonía asociada al respirador: descripción general, fisiopatología, etiología". Webscape .
- ^ Su LH, Ou JT, Leu HS, Chiang PC, Chiu YP, Chia JH, Kuo AJ, Chiu CH, Chu C (1 de octubre de 2003). "Epidemia extendida de infecciones nosocomiales del tracto urinario causadas por Serratia marcescens". Revista de microbiología clínica . 41 (10): 4726–4732. doi : 10.1128/JCM.41.10.4726-4732.2003 . ISSN 0095-1137. PMC 254321 . PMID 14532211.
- ^ Nimer NA (25 de febrero de 2022). "Infección nosocomial y amenaza de resistencia a los antibióticos en Oriente Medio". Infección y resistencia a los fármacos . 15 : 631–639. doi : 10.2147/IDR.S351755 . ISSN 1178-6973. PMC 8887909 . PMID 35241915.
- ^ Hunt J (2022). Zero . Londres: Swift Press. pág. 71. ISBN 9781800751224.
- ^ abcdef Akbari F, Kjellerup B (2015). "Eliminación de infecciones del torrente sanguíneo asociadas con biopelículas de Candida albicans en catéteres intravasculares". Patógenos . 4 (3): 457–469. doi : 10.3390/pathogens4030457 . ISSN 2076-0817. PMC 4584267 . PMID 26131615.
- ^ "Infecciones del tracto urinario asociadas al uso de catéteres (CAUTI)". cdc.gov . 19 de julio de 2017 . Consultado el 13 de enero de 2018 .
- ^ Justo JA, Bookstaver PB (2014). "Terapia de bloqueo antibiótico: revisión de la técnica y desafíos logísticos". Infección y resistencia a fármacos . 7 : 343–63. doi : 10.2147/IDR.S51388 . PMC 4271721 . PMID 25548523.
- ^ Jain SK, Persaud D, Perl TM, et al. (julio de 2005). "Malaria nosocomial y lavado con solución salina". Emerging Infect. Dis . 11 (7): 1097–9. doi : 10.3201/eid1107.050092 . PMC 3371795. PMID 16022788 .
- ^ ab Conway Morris A, Kohler K, De Corte T, Ercole A, De Grooth HJ, Elbers PW, Povoa P, Morais R, Koulenti D, Jog S, Nielsen N, Jubb A, Cecconi M, De Waele J, para los investigadores de ESICM UNITE COVID (diciembre de 2022). "Co-infección e infección adquirida en la UCI en pacientes de la UCI con COVID-19: un análisis secundario del conjunto de datos UNITE-COVID". Cuidados críticos . 26 (1): 236. doi : 10.1186/s13054-022-04108-8 . ISSN 1364-8535. PMC 9347163 . PMID 35922860.
- ^ Conway Morris A, Datta D, Shankar-Hari M, Stephen J, Weir CJ, Rennie J, Antonelli J, Bateman A, Warner N, Judge K, Keenan J, Wang A, Burpee T, Brown KA, Lewis SM (mayo de 2018). "Las firmas de la superficie celular de la disfunción inmunitaria estratifican el riesgo de los pacientes con enfermedades graves: estudio INFECT". Medicina de cuidados intensivos . 44 (5): 627–635. doi : 10.1007/s00134-018-5247-0 . ISSN 0342-4642. PMC 6006236 . PMID 29915941.
- ^ Maes M, Higginson E, Pereira-Dias J, Curran MD, Parmar S, Khokhar F, Cuchet-Lourenço D, Lux J, Sharma-Hajela S, Ravenhill B, Hamed I, Heales L, Mahroof R, Soderholm A, Forrest S (diciembre de 2021). "Neumonía asociada a ventilador en pacientes críticos con COVID-19". Cuidados críticos . 25 (1): 25. doi : 10.1186/s13054-021-03460-5 . ISSN 1364-8535. PMC 7797892 . PMID 33430915.
- ^ Centro Europeo para la Prevención y el Control de Enfermedades. (Octubre de 2019). «Infecciones asociadas a la atención sanitaria adquiridas en unidades de cuidados intensivos. En: ECDC. Informe epidemiológico anual de 2017. Estocolmo: ECDC; 2019» (PDF) . CDC Europeo . Consultado el 15 de agosto de 2022 .
- ^ Leung M, Chan AH (marzo de 2006). "Control y gestión de la calidad del aire interior en hospitales". Med. Sci. Monit . 12 (3): SR17–23. PMID 16501436.
- ^ Chan PC, Huang LM, Lin HC, et al. (abril de 2007). "Control de un brote de colonización e infección por Acinetobacter baumannii resistente a múltiples fármacos en una unidad de cuidados intensivos neonatales". Infect Control Hosp Epidemiol . 28 (4): 423–9. doi :10.1086/513120. PMID 17385148. S2CID 25876369.
- ^ Traub-Dargatz JL, Weese JS, Rousseau JD, Dunowska M, Morley PS, Dargatz DA (julio de 2006). "Estudio piloto para evaluar 3 protocolos de higiene sobre la reducción de la carga bacteriana en las manos del personal veterinario que realiza exámenes físicos de rutina en equinos". Can. Vet. J. 47 ( 7): 671–6. PMC 1482439. PMID 16898109 .
- ^ Katz JD (septiembre de 2004). "Lavado y desinfección de manos: más de lo que te enseñó tu madre". Anesthesiol Clin North America . 22 (3): 457–71, vi. doi :10.1016/j.atc.2004.04.002. PMID 15325713.
- ^ "Los incentivos financieros estatales para todos los pagadores reducen significativamente las enfermedades adquiridas en hospitales de Maryland". Agencia para la Investigación y la Calidad de la Atención Médica. 3 de julio de 2013. Consultado el 6 de julio de 2013 .
- ^ McBryde ES, Bradley LC, Whitby M, McElwain DL (octubre de 2004). "Una investigación de la transmisión por contacto de Staphylococcus aureus resistente a la meticilina". Journal of Hospital Infection . 58 (2): 104–8. doi :10.1016/j.jhin.2004.06.010. PMID 15474180.
- ^ Lautenbach E (2001). "Capítulo 14. Impacto de los cambios en las prácticas de uso de antibióticos en las infecciones nosocomiales y la resistencia a los antimicrobianos: Clostridium difficile y Enterococcus resistente a la vancomicina (VRE)". En Markowitz AJ (ed.). Hacer que la atención sanitaria sea más segura: un análisis crítico de las prácticas de seguridad del paciente. Agencia para la Investigación y la Calidad de la Atención Sanitaria.
- ^ "Reclamaciones por negligencia hospitalaria". PatientClaimLine.com . Consultado el 21 de agosto de 2019 .
- ^ Otter JA, French GL (enero de 2009). "Supervivencia de bacterias y esporas nosocomiales en superficies e inactivación por vapor de peróxido de hidrógeno". J. Clin. Microbiol . 47 (1): 205–7. doi : 10.1128/JCM.02004-08 . PMC 2620839 . PMID 18971364.
- ^ "La retroalimentación del rendimiento, el dispositivo de limpieza ultravioleta y el equipo de limpieza dedicado mejoran significativamente la limpieza de las habitaciones y reducen el potencial de propagación de infecciones comunes y peligrosas". Agencia para la Investigación y la Calidad de la Atención Sanitaria. 15 de enero de 2014. Consultado el 20 de enero de 2014 .
- ^ Kolár M, Urbánek K, Látal T (mayo de 2001). "Presión selectiva de antibióticos y desarrollo de resistencia bacteriana". Revista internacional de agentes antimicrobianos . 17 (5): 357–363. doi :10.1016/S0924-8579(01)00317-X. ISSN 0924-8579. PMID 11337221.
- ^ "Los diferentes métodos de esterilización de equipos médicos". Laboratorios Gibraltar . 31 de mayo de 2013. Archivado desde el original el 6 de diciembre de 2018 . Consultado el 6 de diciembre de 2018 .
- ^ Alianza Mundial para la Seguridad del Paciente. Directrices de la OMS sobre Higiene de Manos en la Atención Sanitaria. [1] [ enlace roto ] . 2009
- ^ Hugonnet S, Perneger TV, Pittet D (13 de mayo de 2002). "La preparación de manos a base de alcohol mejora el cumplimiento de la higiene de manos en las unidades de cuidados intensivos". Archivos de Medicina Interna . 162 (9): 1037–1043. doi : 10.1001/archinte.162.9.1037 . PMID 11996615.
- ^ Haverstick, Stacy, Goodrich, Cara, Freeman, Regi, James, Shandra, Kullar, Rajkiran, Ahrens, Melissa (junio de 2017). "Lavado de manos de los pacientes y reducción de infecciones adquiridas en el hospital". Enfermera de cuidados críticos . 37 (3): e1–e8. doi : 10.4037/ccn2017694 . PMID 28572111.
- ^ Arrowsmith VA, Taylor R (4 de agosto de 2014). "Eliminación del esmalte de uñas y de los anillos en los dedos para prevenir la infección quirúrgica". Base de datos Cochrane de revisiones sistemáticas . 2014 (8): CD003325. doi : 10.1002/14651858.CD003325.pub3 . PMC 7163182. PMID 25089848 .
- ^ "Exposición ocupacional a patógenos transmitidos por la sangre; lesiones por pinchazos de aguja y otros objetos punzantes; norma definitiva. – 66:5317–5325". Osha.gov . Consultado el 11 de julio de 2011 .
- ^ Wilks S, Michels H, Keevil C (2005). "La supervivencia de Escherichia coli O157 en una variedad de superficies metálicas". Revista internacional de microbiología de alimentos . 105 (3): 445–454. doi :10.1016/j.ijfoodmicro.2005.04.021. PMID 16253366.
- ^ Michels, HT (2006), Características antimicrobianas del cobre, ASTM Standardization News, octubre, págs. 28-31
- ^ Wang M, Wei H, Zhao Y, Shang L, Di L, Lyu C, Liu J (2019). "Análisis de bacterias resistentes a múltiples fármacos en 3223 pacientes con infecciones adquiridas en el hospital (HAI) de un hospital general terciario en China". Revista bosnia de ciencias médicas básicas . 19 (1): 86–93. doi : 10.17305/bjbms.2018.3826 . PMC 6387671 . PMID 30579325.
- ^ Ensayos clínicos financiados por el Departamento de Defensa de los EE. UU., tal como se presentó en la Conferencia Interscience sobre agentes antimicrobianos y quimioterapia en Washington, DC, el 28 de octubre de 2008
- ^ Russotto V, Cortegiani A, Raineri SM, Giarratano A (10 de diciembre de 2015). "Contaminación bacteriana de superficies y equipos inanimados en la unidad de cuidados intensivos". Journal of Intensive Care . 3 : 54. doi : 10.1186/s40560-015-0120-5 . ISSN 2052-0492. PMC 4676153 . PMID 26693023.
- ^ Weber DJ, Rutala, WA (mayo de 2013). "Superficies autodesinfectantes: revisión de las metodologías actuales y perspectivas futuras". American Journal of Infection Control . 41 (5 Suppl): S31-5. doi :10.1016/j.ajic.2012.12.005. PMID 23622745.
- ^ Health Quality O (2018). "Dispositivos portátiles de desinfección de superficies con luz ultravioleta para la prevención de infecciones adquiridas en el hospital: una evaluación de la tecnología sanitaria". Serie de evaluación de la tecnología sanitaria de Ontario . 18 (1): 1–73. PMC 5824029 . PMID 29487629.
- ^ Weber DJ, Kanamori H, Rutala WA (agosto de 2016). "Tecnologías 'sin contacto' para la descontaminación ambiental: enfoque en dispositivos ultravioleta y sistemas de peróxido de hidrógeno". Current Opinion in Infectious Diseases . 29 (4): 424–31. doi :10.1097/QCO.0000000000000284. PMID 27257798. S2CID 23252531.
- ^ Weber DJ, Rutala WA, Anderson DJ, Chen LF, Sickbert-Bennett EE, Boyce JM (2 de mayo de 2016). "Eficacia de los dispositivos ultravioleta y los sistemas de peróxido de hidrógeno para la descontaminación de salas terminales: enfoque en ensayos clínicos". American Journal of Infection Control . 44 (5 Suppl): e77–84. doi : 10.1016/j.ajic.2015.11.015 . PMC 7132689 . PMID 27131140.
- ^ abcd Pollack A (26 de febrero de 2010). "La creciente amenaza de infecciones no se ve afectada por los antibióticos" . The New York Times . Consultado el 27 de octubre de 2022 .
- ^ Torres A, Ferrer M, Badia JR (2010). "Pautas de tratamiento y resultados de la neumonía adquirida en el hospital y asociada a la ventilación mecánica". Enfermedades infecciosas clínicas . 51 : S48–S53. doi : 10.1086/653049 . PMID 20597672.
- ^ "Neumonía adquirida en el hospital (neumonía nosocomial) y neumonía asociada al respirador". 17 de octubre de 2021.
- ^ Torres A, Ewig S, Lode H, Carlet J, Grupo de trabajo europeo HAP (2009). "Definición, tratamiento y prevención de la neumonía adquirida en el hospital: perspectiva europea". Medicina de cuidados intensivos . 35 (1): 9–29. doi : 10.1007/s00134-008-1336-9 . PMID 18989656.
- ^ Ibrahim EH, Ward S, Sherman G, Schaiff R, Fraser VJ, Kollef MH (2001). "Experiencia con una guía clínica para el tratamiento de la neumonía asociada a la ventilación mecánica". Medicina de cuidados críticos . 29 (6): 1109–1115. doi :10.1097/00003246-200106000-00003. PMID 11395584. S2CID 19045707.
- ^ "Infecciones asociadas a la atención médica: portal de datos". Centros para el Control y la Prevención de Enfermedades de EE. UU. 3 de noviembre de 2022. Consultado el 1 de agosto de 2023 .
- ^ Dai T, Vrahas MS, Murray CK, Hamblin MR (febrero de 2012). "Irradiación ultravioleta C: ¿un enfoque antimicrobiano alternativo para infecciones localizadas?". Revisión experta de terapia antiinfecciosa . 10 (2): 185–95. doi :10.1586/eri.11.166. PMC 3292282. PMID 22339192 .
- ^ Federaal Kenniscentrum voor de Gezondheidszorg (2009) Infecciones nosocomiales en Bélgica, parte II: Impact op Mortaliteit en Kosten. Informe KCE 102A.
- ^ Quenon JL, Gottot S, Duneton P, Lariven S, Carlet J, Régnier B, Brücker G. Enquête nationale de prévalence des infecciones nosocomiales en Francia: Hôpital Propre (octubre de 1990). BEH nº 39/1993.
- ^ Comité técnico de infecciones nosocomiales (CTIN), Infecciones celulares nosocomiales, CClin Est, CClin Ouest, CClin Paris-Nord, CClin Sud-Est, CClin Sud-Ouest, con la participación de 830 établissements de santé. Enquête nationale de prévalence desfections nosocomiales, 1996 Archivado el 11 de agosto de 2009 en Wayback Machine , BEH n° 36/1997, 2 de septiembre de 1997, 4 págs.. Currículum Archivado el 25 de septiembre de 2009 en Wayback Machine .
- ^ Lepoutre A, Branger B, Garreau N, Boulétreau A, Ayzac L, Carbonne A, Maugat S, Gayet S, Hommel C, Parneix P, Tran B pour le Réseau d'alerte, d'investigation et de vigilancia de infecciones nosocomiales ( Pasa). Deuxième enquête nationale de prévalence desfections nosocomiales, Francia, 2001 Archivado el 26 de noviembre de 2009 en Wayback Machine , Surveillance nationale des maladies infectieuses, 2001-2003. Institut de veille sanitaire, septiembre. 2005, 11 págs. Currículum Archivado el 8 de agosto de 2009 en Wayback Machine .
- ^ Institut de veille sanitaire Enquête nationale de prévalence desfections nosocomiales, Francia, junio de 2006 , Volumen 1 - Métodos, resultados, perspectivas Archivado el 7 de octubre de 2009 en Wayback Machine , marzo de 2009, ii + 81 págs. Volumen 2 - Anexos Archivado el 7 de octubre 2009 en Wayback Machine , marzo 2009, ii + 91 págs. Synthèse des résultats Archivado el 7 de octubre de 2009 en Wayback Machine , marzo 2009, 11 págs.
- ^ Institut de veille sanitaire Enquête nationale de prévalence desfections nosocomiales, Francia, junio de 2006 , vol. 1, cuadro 31, pág. 24.
- ^ Réseau REA-Raisin «Vigilancia de infecciones nosocomiales en reanimación de adultos. Francia, resultados 2007 » Archivado el 12 de septiembre de 2009 en Wayback Machine , Institut de veille sanitaire, septiembre de 2009, ii + 60 págs.
- ^ Vasselle, Alain «Rapport sur la politique de lutte contre lesfections nosocomiales», Oficina parlamentaria de evaluación de las políticas de salud, junio de 2006, 290 págs. (III.5. Quelle est l'estimation de la mortalité atribuible aux IN? ).
- ^ Lyytikainen O, Kanerva M, Agthe N, Mottonen T y el Grupo de Estudio de Encuestas de Prevalencia de Finlandia. Encuesta nacional de prevalencia de infecciones nosocomiales en hospitales finlandeses de cuidados agudos, 2005. 10º Seminario científico de Epiet. Mahón, Menorca, España, 13-15 de octubre de 2005 [Póster].
- ^ L'Italie Scandisée par "l'hôpital de l'horreur" , Éric Jozsef, Libération , 17 de enero de 2007 (en francés)
- ^ Lizioli A, Privitera G, Alliata E, Antonietta Banfi E, Boselli L, Panceri M, Perna M, Porretta A, Santini M, Carreri V (junio de 2003). "Prevalencia de infecciones nosocomiales en Italia: resultado de la encuesta de Lombardía en 2000". Revista de infección hospitalaria . 54 (2): 141-148. doi :10.1016/s0195-6701(03)00078-1. PMID 12818589.
- ^ "Ficha técnica - Campaña suiza de higiene de manos" (en francés). Archivado desde el original (.doc) el 30 de septiembre de 2007.
- ^ Saxo H, Pittet D (2005). "Resultados de la encuesta nacional de prevalencia de infecciones nosocomiales de 2004 (snip04)". Suiza-NOSO (en francés). 12 (1): 1–4. Archivado desde el original el 11 de noviembre de 2007.
- ^ ab "Encuesta nacional de prevalencia puntual de infecciones asociadas a la atención médica y uso de antimicrobianos, 2011" (PDF) . Agencia de Protección de la Salud. Archivado desde el original (PDF) el 8 de diciembre de 2015 . Consultado el 28 de noviembre de 2015 .
- ^ Bagot M (24 de octubre de 2018). "Las infecciones hospitalarias mortales se cuadruplican mientras el personal lucha por combatir las superbacterias". Daily Mirror . Consultado el 2 de diciembre de 2018 .
- ^ Klevens RM, Edwards JR, Richards CL, Horan TC, Gaynes RP, Pollock DA, Cardo DM (marzo de 2007). "Estimación de infecciones y muertes asociadas a la atención médica en hospitales de EE. UU., 2002". Public Health Reports . 122 (2): 160–166. doi : 10.1177/003335490712200205 . PMC 1820440 . PMID 17357358.
- ^ Se prevé que el mercado de diagnóstico de infecciones adquiridas en el hospital (HAI) alcance los $4386,6 millones para 2023, creciendo a una CAGR del 7,6 % durante 2017-2023, según P&S Intelligence
- ^ Kadar N (enero de 2019). "Redescubriendo a Ignaz Philipp Semmelweis (1818–1865)". Am. J. Obstet. Gynecol . 220 (1): 26–39. doi :10.1016/j.ajog.2018.11.1084. PMID 30444981. S2CID 53567650.
- ^ Pommerville J (2014). Fundamentos de microbiología . Burlington, MA: Jones & Bartlett Learning. ISBN 9781449647964.
- ^ Wyklicky H, Skopec M (septiembre-octubre de 1983). «Ignaz Philipp Semmelweis, el profeta de la bacteriología». Infect Control . 4 (5): 367–70. doi :10.1017/S0195941700059762. PMID 6354955. S2CID 25830725. Archivado desde el original el 4 de abril de 2008 . Consultado el 28 de noviembre de 2015 .
