Polaridad química
Este artículo necesita citas adicionales para su verificación . ( enero de 2015 ) |

En química , la polaridad es una separación de carga eléctrica que lleva a que una molécula o sus grupos químicos tengan un momento dipolar eléctrico , con un extremo cargado negativamente y un extremo cargado positivamente.
Las moléculas polares deben contener uno o más enlaces polares debido a una diferencia de electronegatividad entre los átomos enlazados. Las moléculas que contienen enlaces polares no tienen polaridad molecular si los dipolos de enlace se cancelan entre sí por simetría.
Las moléculas polares interactúan a través de fuerzas intermoleculares dipolo-dipolo y enlaces de hidrógeno . La polaridad subyace a una serie de propiedades físicas, entre ellas, la tensión superficial , la solubilidad y los puntos de fusión y ebullición.
Polaridad de los enlaces
No todos los átomos atraen electrones con la misma fuerza. La cantidad de "atracción" que ejerce un átomo sobre sus electrones se denomina electronegatividad . Los átomos con electronegatividades altas, como el flúor , el oxígeno y el nitrógeno , ejercen una mayor atracción sobre los electrones que los átomos con electronegatividades más bajas, como los metales alcalinos y los metales alcalinotérreos . En un enlace, esto conduce a una distribución desigual de electrones entre los átomos, ya que los electrones se sentirán más atraídos hacia el átomo con la electronegatividad más alta.
Debido a que los electrones tienen una carga negativa, la distribución desigual de electrones dentro de un enlace conduce a la formación de un dipolo eléctrico : una separación de carga eléctrica positiva y negativa. Debido a que la cantidad de carga separada en tales dipolos suele ser menor que una carga fundamental , se denominan cargas parciales , denotadas como δ+ ( delta más) y δ− (delta menos). Estos símbolos fueron introducidos por Sir Christopher Ingold y Edith Hilda (Usherwood) Ingold en 1926. [1] [2] El momento dipolar del enlace se calcula multiplicando la cantidad de carga separada por la distancia entre las cargas.
Estos dipolos dentro de las moléculas pueden interactuar con dipolos en otras moléculas, creando fuerzas intermoleculares dipolo-dipolo .
Clasificación
Los enlaces pueden estar entre uno de dos extremos: completamente no polares o completamente polares. Un enlace completamente no polar se produce cuando las electronegatividades son idénticas y, por lo tanto, poseen una diferencia de cero. Un enlace completamente polar se denomina más correctamente enlace iónico y se produce cuando la diferencia entre electronegatividades es lo suficientemente grande como para que un átomo realmente le quite un electrón al otro. Los términos "polar" y "no polar" se aplican generalmente a los enlaces covalentes , es decir, enlaces en los que la polaridad no es completa. Para determinar la polaridad de un enlace covalente mediante medios numéricos, se utiliza la diferencia entre las electronegatividades de los átomos.
La polaridad de los enlaces se divide generalmente en tres grupos que se basan, en líneas generales, en la diferencia de electronegatividad entre los dos átomos enlazados. Según la escala de Pauling :
- Los enlaces no polares generalmente ocurren cuando la diferencia de electronegatividad entre los dos átomos es menor a 0,5.
- Los enlaces polares generalmente ocurren cuando la diferencia de electronegatividad entre los dos átomos está aproximadamente entre 0,5 y 2,0.
- Los enlaces iónicos generalmente ocurren cuando la diferencia de electronegatividad entre los dos átomos es mayor a 2,0.
Pauling basó este esquema de clasificación en el carácter iónico parcial de un enlace, que es una función aproximada de la diferencia de electronegatividad entre los dos átomos enlazados. Estimó que una diferencia de 1,7 corresponde a un 50% de carácter iónico, de modo que una diferencia mayor corresponde a un enlace que es predominantemente iónico. [3]
Como descripción mecánico-cuántica , Pauling propuso que la función de onda para una molécula polar AB es una combinación lineal de funciones de onda para moléculas covalentes e iónicas: ψ = aψ(A:B) + bψ(A + B − ). La cantidad de carácter covalente e iónico depende de los valores de los coeficientes al cuadrado a 2 y b 2 . [4]
Momentos dipolares de enlace

El momento dipolar de enlace [5] utiliza la idea del momento dipolar eléctrico para medir la polaridad de un enlace químico dentro de una molécula . Se produce siempre que hay una separación de cargas positivas y negativas.
El dipolo de enlace μ viene dado por:
- .
El dipolo de enlace se modela como δ + — δ – con una distancia d entre las cargas parciales δ + y δ – . Es un vector, paralelo al eje de enlace, que apunta de menos a más, [6] como es convencional para los vectores de momento dipolar eléctrico .
Los químicos a menudo dibujan el vector apuntando de más a menos. [7] Este vector se puede interpretar físicamente como el movimiento que experimentan los electrones cuando los dos átomos se colocan a una distancia d y se les permite interactuar, los electrones se moverán desde sus posiciones de estado libre para localizarse más alrededor del átomo más electronegativo .
La unidad del SI para el momento dipolar eléctrico es el coulomb-metro. Esta es demasiado grande para ser práctica en la escala molecular. Los momentos dipolares de enlace se miden comúnmente en debyes , representados por el símbolo D, que se obtiene midiendo la carga en unidades de 10 −10 statcoulomb y la distancia d en angstroms . Basándonos en el factor de conversión de 10 −10 statcoulomb siendo 0,208 unidades de carga elemental, entonces 1,0 debye resulta de un electrón y un protón separados por 0,208 Å. Un factor de conversión útil es 1 D = 3,335 64 × 10 -30 °C m. [8]
Para las moléculas diatómicas solo hay un enlace (sencillo o múltiple), por lo que el momento dipolar del enlace es el momento dipolar molecular, con valores típicos en el rango de 0 a 11 D. En un extremo, una molécula simétrica como el bromo , Br
2, tiene un momento dipolar cero, mientras que cerca del otro extremo, el bromuro de potasio en fase gaseosa , KBr, que es altamente iónico, tiene un momento dipolar de 10,41 D. [9] [ página necesaria ] [10] [ verificación necesaria ]
En el caso de las moléculas poliatómicas, existe más de un enlace. El momento dipolar molecular total se puede calcular de forma aproximada como la suma vectorial de los momentos dipolares de enlace individuales. A menudo, los dipolos de enlace se obtienen mediante el proceso inverso: un dipolo total conocido de una molécula se puede descomponer en dipolos de enlace. Esto se hace para transferir momentos dipolares de enlace a moléculas que tienen los mismos enlaces, pero para las que aún no se conoce el momento dipolar total. La suma vectorial de los dipolos de enlace transferidos proporciona una estimación del dipolo total (desconocido) de la molécula.
Polaridad de las moléculas
Una molécula está compuesta por uno o más enlaces químicos entre orbitales moleculares de diferentes átomos. Una molécula puede ser polar como resultado de enlaces polares debido a diferencias en electronegatividad como se describió anteriormente, o como resultado de una disposición asimétrica de enlaces covalentes no polares y pares de electrones no enlazantes, conocida como orbital molecular completo .
Si bien las moléculas pueden describirse como "covalentes polares", "covalentes no polares" o "iónicas", este término suele ser relativo, ya que una molécula es simplemente más polar o más no polar que otra. Sin embargo, las siguientes propiedades son típicas de dichas moléculas.
Punto de ebullición
Al comparar una molécula polar y una no polar con masas molares similares, la molécula polar en general tiene un punto de ebullición más alto, porque la interacción dipolo-dipolo entre moléculas polares da como resultado atracciones intermoleculares más fuertes. Una forma común de interacción polar es el enlace de hidrógeno , que también se conoce como enlace de H. Por ejemplo, el agua forma enlaces de H y tiene una masa molar M = 18 y un punto de ebullición de +100 °C, en comparación con el metano no polar con M = 16 y un punto de ebullición de -161 °C.
Solubilidad
Debido a la naturaleza polar de la molécula de agua, otras moléculas polares generalmente pueden disolverse en agua. La mayoría de las moléculas no polares son insolubles en agua ( hidrófobas ) a temperatura ambiente. Muchos solventes orgánicos no polares , como la trementina , pueden disolver sustancias no polares.
Tensión superficial
Los compuestos polares tienden a tener una tensión superficial mayor que los compuestos no polares. [ cita requerida ]
Acción capilar
Los líquidos polares tienen una tendencia a elevarse contra la gravedad en un tubo de diámetro pequeño. [ cita requerida ]
Viscosidad
Los líquidos polares tienden a ser más viscosos que los líquidos no polares. [ cita requerida ] Por ejemplo, el hexano no polar es mucho menos viscoso que el agua polar. Sin embargo, el tamaño de la molécula es un factor mucho más importante en la viscosidad que la polaridad, donde los compuestos con moléculas más grandes son más viscosos que los compuestos con moléculas más pequeñas. [ cita requerida ] Por lo tanto, el agua (moléculas polares pequeñas) es menos viscosa que el hexadecano (moléculas no polares grandes).
Ejemplos
Moléculas polares

Una molécula polar tiene un dipolo neto como resultado de las cargas opuestas (es decir, tener cargas parcialmente positivas y parcialmente negativas) de los enlaces polares dispuestos asimétricamente. El agua (H 2 O) es un ejemplo de una molécula polar ya que tiene una ligera carga positiva en un lado y una ligera carga negativa en el otro. Los dipolos no se cancelan, lo que resulta en un dipolo neto. El momento dipolar del agua depende de su estado. En la fase gaseosa, el momento dipolar es ≈ 1,86 debye (D), [11] mientras que el agua líquida (≈ 2,95 D) [12] y el hielo (≈ 3,09 D) [13] son más altos debido a diferentes entornos de enlaces de hidrógeno. Otros ejemplos incluyen azúcares (como la sacarosa ), que tienen muchos grupos polares de oxígeno-hidrógeno (−OH) y son en general altamente polares.
Si los momentos dipolares de enlace de la molécula no se cancelan, la molécula es polar. Por ejemplo, la molécula de agua (H 2 O) contiene dos enlaces polares O−H en una geometría doblada (no lineal). Los momentos dipolares de enlace no se cancelan, de modo que la molécula forma un dipolo molecular con su polo negativo en el oxígeno y su polo positivo a medio camino entre los dos átomos de hidrógeno. En la figura, cada enlace une el átomo central de O con una carga negativa (rojo) a un átomo de H con una carga positiva (azul).
La molécula de fluoruro de hidrógeno , HF, es polar en virtud de los enlaces covalentes polares: en el enlace covalente los electrones se desplazan hacia el átomo de flúor, más electronegativo.

El amoniaco , NH 3 , es una molécula cuyos tres enlaces N−H tienen una polaridad muy baja (hacia el átomo de nitrógeno, más electronegativo). La molécula tiene dos electrones solitarios en un orbital que apunta hacia el cuarto vértice de un tetraedro aproximadamente regular, como predice la teoría VSEPR . Este orbital no participa en el enlace covalente; es rico en electrones, lo que da como resultado un potente dipolo en toda la molécula de amoniaco.

En las moléculas de ozono (O 3 ), los dos enlaces O−O son no polares (no hay diferencia de electronegatividad entre átomos del mismo elemento). Sin embargo, la distribución de otros electrones es desigual: dado que el átomo central tiene que compartir electrones con otros dos átomos, pero cada uno de los átomos externos tiene que compartir electrones con solo otro átomo, el átomo central está más privado de electrones que los demás (el átomo central tiene una carga formal de +1, mientras que los átomos externos tienen una carga formal de − 1 ⁄ 2 ). Dado que la molécula tiene una geometría curva, el resultado es un dipolo a lo largo de toda la molécula de ozono.
Moléculas no polares
Una molécula puede ser apolar cuando los electrones se reparten de forma igualitaria entre los dos átomos de una molécula diatómica o debido a la disposición simétrica de los enlaces polares en una molécula más compleja. Por ejemplo, el trifluoruro de boro (BF3 ) tiene una disposición trigonal plana de tres enlaces polares a 120°. Esto da como resultado que no haya ningún dipolo global en la molécula.

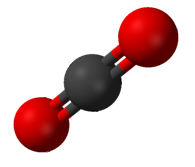
El dióxido de carbono (CO 2 ) tiene dos enlaces polares C=O, pero la geometría del CO 2 es lineal, de modo que los dos momentos dipolares de enlace se cancelan y no hay un momento dipolar molecular neto; la molécula es no polar.

Entre los ejemplos de compuestos domésticos no polares se incluyen las grasas, el aceite y la gasolina.
En la molécula de metano (CH 4 ), los cuatro enlaces C−H están dispuestos tetraédricamente alrededor del átomo de carbono. Cada enlace tiene polaridad (aunque no es muy fuerte). Los enlaces están dispuestos simétricamente, por lo que no hay un dipolo global en la molécula. La molécula de oxígeno diatómico (O 2 ) no tiene polaridad en el enlace covalente debido a la electronegatividad igual, por lo tanto, no hay polaridad en la molécula.
Moléculas anfifílicas
Las moléculas grandes que tienen un extremo con grupos polares unidos y otro extremo con grupos no polares se describen como anfifílicas o moléculas anfifílicas . Son buenos surfactantes y pueden ayudar en la formación de emulsiones estables, o mezclas, de agua y grasas. Los surfactantes reducen la tensión interfacial entre el aceite y el agua al adsorberse en la interfaz líquido-líquido.
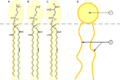
- Esta molécula anfifílica tiene varios grupos polares ( hidrofílicos , amantes del agua ) en el lado derecho y una larga cadena no polar ( lipófila , amante de las grasas ) en el lado izquierdo. Esto le confiere propiedades tensioactivas .
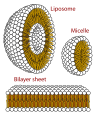
- Una micela : los extremos lipofílicos de las moléculas de surfactante se disuelven en el aceite, mientras que los extremos cargados hidrofílicos permanecen afuera en la fase acuosa, protegiendo al resto de la micela hidrofóbica . De esta manera, la pequeña gota de aceite se vuelve soluble en agua.
- Los fosfolípidos son surfactantes naturales eficaces que tienen importantes funciones biológicas.
- Vista en sección transversal de las estructuras que pueden formar los fosfolípidos . Pueden formar una micela y son vitales para la formación de las membranas celulares.
Predicción de la polaridad de las moléculas
| Fórmula | Descripción | Ejemplo | Nombre | Momento dipolar | |
|---|---|---|---|---|---|
| Polar | De | Moléculas lineales | CO | Monóxido de carbono | 0,112 |
| HAx | Moléculas con un solo H | alta frecuencia | Fluoruro de hidrógeno | 1.86 | |
| A x OH | Moléculas con un OH en un extremo | C2H5OH | Etanol | 1.69 | |
| Oxígeno | Moléculas con una O en un extremo | H2O | Agua | 1,85 | |
| NxAy | Moléculas con una N en un extremo | NH3 | Amoníaco | 1.42 | |
| No polar | Un 2 | Moléculas diatómicas del mismo elemento | O2 | Dioxígeno | 0.0 |
| CxAy | La mayoría de los compuestos de hidrocarburos | C3H8 | Propano | 0,083 | |
| CxAy | Hidrocarburo con centro de inversión | C4H10 | Butano | 0.0 |
Determinar el grupo puntual es una forma útil de predecir la polaridad de una molécula. En general, una molécula no poseerá un momento dipolar si los momentos dipolares de los enlaces individuales de la molécula se cancelan entre sí. Esto se debe a que los momentos dipolares son magnitudes vectoriales euclidianas con magnitud y dirección, y dos vectores iguales que se oponen entre sí se cancelarán.
Cualquier molécula con un centro de inversión ("i") o un plano de espejo horizontal ("σ h ") no poseerá momentos dipolares. Del mismo modo, una molécula con más de un eje de rotación C n no poseerá un momento dipolar porque los momentos dipolares no pueden estar en más de una dimensión . Como consecuencia de esa restricción, todas las moléculas con simetría diedral (D n ) no tendrán un momento dipolar porque, por definición, los grupos puntuales D tienen dos o múltiples ejes C n .
Dado que los grupos puntuales C 1 , C s ,C ∞h C n y C n v no tienen un centro de inversión, planos especulares horizontales o ejes C n múltiples , las moléculas en uno de esos grupos puntuales tendrán momento dipolar.
Desviación eléctrica del agua
Contrariamente a la idea errónea popular, la desviación eléctrica de una corriente de agua desde un objeto cargado no se basa en la polaridad. La desviación se produce debido a las gotas cargadas eléctricamente en la corriente, que el objeto cargado induce. Una corriente de agua también puede desviarse en un campo eléctrico uniforme, que no puede ejercer fuerza sobre las moléculas polares. Además, una corriente de agua, una vez que se conecta a tierra, ya no puede desviarse. La desviación débil es posible incluso para líquidos no polares. [14]
Véase también
- Propiedades químicas
- Coloide
- Detergente
- Electronegatividades de los elementos (página de datos)
- Grupo de puntos polares
Referencias
- ^ Jensen, William B. (2009). "El origen del símbolo "Delta" para cargas fraccionarias". J. Chem. Educ . 86 (5): 545. Bibcode :2009JChEd..86..545J. doi :10.1021/ed086p545.
- ^ Ingold, CK; Ingold, EH (1926). "La naturaleza del efecto alternante en las cadenas de carbono. Parte V. Una discusión de la sustitución aromática con especial referencia a los papeles respectivos de la disociación polar y no polar; y un estudio adicional de las eficiencias directivas relativas del oxígeno y el nitrógeno". J. Chem. Soc . 129 : 1310–1328. doi :10.1039/jr9262901310.
- ^ Pauling, L. (1960). La naturaleza del enlace químico (3.ª ed.). Oxford University Press. pp. 98-100. ISBN 0801403332.
- ^ Pauling, L. (1960). La naturaleza del enlace químico (3.ª ed.). Oxford University Press. pág. 66. ISBN 0801403332.
- ^ Blaber, Mike (2018). "Dipole_Moments". Textos libres . Universidad Estatal de California.
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "momento dipolar eléctrico, p". doi :10.1351/goldbook.E01929
- ^ Hovick, James W.; Poler, JC (2005). "Conceptos erróneos en las convenciones de signos: Inversión del momento dipolar eléctrico". J. Chem. Educ . 82 (6): 889. Bibcode :2005JChEd..82..889H. doi :10.1021/ed082p889.
- ^ Atkins, Peter; de Paula, Julio (2006). Química física (8.ª ed.). WH Freeman. pág. 620 (y portada interior). ISBN 0-7167-8759-8.
- ^ Química física 2.a edición (1966) GM Barrow McGraw Hill
- ^ Van Wachem, R.; De Leeuw, FH; Dymanus, A. (1967). "Momentos dipolares de KF y KBr medidos por el método de resonancia eléctrica de haz molecular". J. Chem. Phys . 47 (7): 2256. Bibcode :1967JChPh..47.2256V. doi :10.1063/1.1703301.
- ^ Clough, Shepard A.; Beers, Yardley; Klein, Gerald P.; Rothman, Laurence S. (1 de septiembre de 1973). "Momento dipolar del agua a partir de mediciones de Stark de H2O, HDO y D2O". The Journal of Chemical Physics . 59 (5): 2254–2259. Código Bibliográfico :1973JChPh..59.2254C. doi :10.1063/1.1680328.
- ^ Gubskaya, Anna V.; Kusalik, Peter G. (27 de agosto de 2002). "El momento dipolar molecular total para el agua líquida". The Journal of Chemical Physics . 117 (11): 5290–5302. Bibcode :2002JChPh.117.5290G. doi : 10.1063/1.1501122 .
- ^ Batista, Enrique R.; Xantheas, Sotiris S.; Jónsson, Hannes (15 de septiembre de 1998). "Momentos moleculares multipolares de moléculas de agua en hielo Ih". La Revista de Física Química . 109 (11): 4546–4551. Código Bib : 1998JChPh.109.4546B. doi : 10.1063/1.477058.
- ^ Ziaei-Moayyed, Maryam; Goodman, Edward; Williams, Peter (1 de noviembre de 2000). "Desviación eléctrica de corrientes de líquido polar: una demostración mal entendida". Revista de educación química . 77 (11): 1520. Bibcode :2000JChEd..77.1520Z. doi :10.1021/ed077p1520. ISSN 0021-9584.
Enlaces externos
- Enlace químico
- Polaridad de enlaces y moléculas (archivado)
- Polaridad de las moléculas