Metano
 | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Metano [1] | |||
| Nombre sistemático de la IUPAC Carbane (nunca recomendado [1] ) | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 3DMet |
| ||
| 1718732 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.000.739 | ||
| Número CE |
| ||
| 59 | |||
| BARRIL | |||
| Malla | Metano | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1971 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades | |||
| C4 | |||
| Masa molar | 16,043 g·mol −1 | ||
| Apariencia | Gas incoloro | ||
| Olor | Inodoro | ||
| Densidad |
| ||
| Punto de fusión | -182,456 °C (-296,421 °F; 90,694 K) [3] | ||
| Punto de ebullición | -161,5 °C (-258,7 °F; 111,6 K) [3] | ||
| Punto crítico ( T , P ) | 190,56 K (−82,59 °C; −116,66 °F), 4,5992 MPa (45,391 atm) | ||
| 22,7 mg/l [4] | |||
| Solubilidad | Soluble en etanol , éter dietílico , benceno , tolueno , metanol , acetona e insoluble en agua. | ||
| registro P | 1.09 | ||
Constante de la ley de Henry ( k H ) | 14 nmol/(Pa·kg) | ||
| Ácido conjugado | Metanio | ||
| Base conjugada | Anión metilo | ||
| −17,4 × 10 −6 cm3 /mol [ 5 ] | |||
| Estructura | |||
| T.D. | |||
| Tetraédrico en el átomo de carbono | |||
| 0 D | |||
| Termoquímica [6] | |||
Capacidad calorífica ( C ) | 35,7 J/(K·mol) | ||
Entropía molar estándar ( S ⦵ 298 ) | 186,3 J/(K·mol) | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −74,6 kJ/mol | ||
Energía libre de Gibbs (Δ f G ⦵ ) | -50,5 kJ/mol | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | -891 kJ/mol | ||
| Peligros [7] | |||
| Etiquetado SGA : | |||
 | |||
| Peligro | |||
| H220 | |||
| P210 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | -188 °C (-306,4 °F; 85,1 K) | ||
| 537 °C (999 °F; 810 K) | |||
| Límites de explosividad | 4,4–17% | ||
| Compuestos relacionados | |||
Alcanos relacionados | |||
Compuestos relacionados | |||
| Página de datos complementarios | |||
| Metano (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El metano ( EE. UU .: / ˈmɛθeɪn / METH - ayn , Reino Unido : / ˈm iːθeɪn / MEE -thayn ) es un compuesto químico con la fórmula química CH4 ( un átomo de carbono unido a cuatro átomos de hidrógeno ). Es un hidruro del grupo 14 , el alcano más simple y el principal constituyente del gas natural . La abundancia de metano en la Tierra lo convierte en un combustible económicamente atractivo , aunque capturarlo y almacenarlo es difícil porque es un gas a temperatura y presión estándar . En la atmósfera terrestre, el metano es transparente a la luz visible, pero absorbe la radiación infrarroja, actuando como un gas de efecto invernadero . El metano es un compuesto orgánico y uno de los compuestos orgánicos más simples. El metano también es un hidrocarburo .
El metano natural se encuentra tanto bajo tierra como bajo el fondo marino y se forma mediante procesos geológicos y biológicos. La mayor reserva de metano se encuentra bajo el fondo marino en forma de clatratos de metano . Cuando el metano alcanza la superficie y la atmósfera , se lo conoce como metano atmosférico . [9]
La concentración atmosférica de metano en la Tierra ha aumentado alrededor de un 160% desde 1750, y el porcentaje abrumador se debe a la actividad humana. [10] Representó el 20% del forzamiento radiativo total de todos los gases de efecto invernadero de larga duración y mezclados a nivel mundial , según el informe de 2021 del Grupo Intergubernamental de Expertos sobre el Cambio Climático . [11] Unas reducciones fuertes, rápidas y sostenidas de las emisiones de metano podrían limitar el calentamiento a corto plazo y mejorar la calidad del aire al reducir el ozono superficial global. [12]
También se ha detectado metano en otros planetas, incluido Marte , lo que tiene implicaciones para la investigación astrobiológica . [13]
Propiedades y enlaces
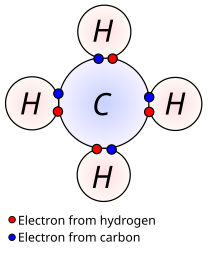
El metano es una molécula tetraédrica con cuatro enlaces C–H equivalentes . Su estructura electrónica se describe mediante cuatro orbitales moleculares de enlace (OM) resultantes de la superposición de los orbitales de valencia de C y H. El OM de menor energía es el resultado de la superposición del orbital 2s del carbono con la combinación en fase de los orbitales 1s de los cuatro átomos de hidrógeno. Por encima de este nivel de energía hay un conjunto triplemente degenerado de OM que implica la superposición de los orbitales 2p del carbono con varias combinaciones lineales de los orbitales 1s del hidrógeno. El esquema de enlace "tres sobre uno" resultante es coherente con las mediciones espectroscópicas de fotoelectrones.
El metano es un gas inodoro, incoloro y transparente. [14] Absorbe la luz visible, especialmente en el extremo rojo del espectro, debido a las bandas de sobretonos , pero el efecto solo se nota si el recorrido de la luz es muy largo. Esto es lo que da a Urano y Neptuno sus colores azul o verde azulado, ya que la luz pasa a través de sus atmósferas que contienen metano y luego se dispersa de nuevo. [15]
El olor familiar del gas natural que se utiliza en los hogares se consigue añadiendo un odorante , normalmente mezclas que contienen terc -butiltiol , como medida de seguridad. El metano tiene un punto de ebullición de -161,5 °C a una presión de una atmósfera . [3] Como gas, es inflamable en un rango de concentraciones (5,4%–17%) en el aire a presión estándar .
El metano sólido existe en varias modificaciones . Actualmente se conocen nueve. [16] El enfriamiento del metano a presión normal da como resultado la formación de metano I. Esta sustancia cristaliza en el sistema cúbico ( grupo espacial Fm 3 m). Las posiciones de los átomos de hidrógeno no son fijas en el metano I, es decir, las moléculas de metano pueden rotar libremente. Por lo tanto, es un cristal plástico . [17]
Reacciones químicas
Las reacciones químicas principales del metano son la combustión , la reformación con vapor para generar gas de síntesis y la halogenación . En general, las reacciones del metano son difíciles de controlar.
Oxidación selectiva
La oxidación parcial del metano a metanol ( C H 3 OH ), un combustible líquido más conveniente, es un desafío porque la reacción generalmente progresa hasta el dióxido de carbono y el agua incluso con un suministro insuficiente de oxígeno . La enzima metano monooxigenasa produce metanol a partir de metano, pero no se puede utilizar para reacciones a escala industrial. [18] Se han desarrollado algunos sistemas catalizados homogéneamente y sistemas heterogéneos, pero todos tienen desventajas significativas. Estos generalmente funcionan generando productos protegidos que están protegidos de la sobreoxidación. Los ejemplos incluyen el sistema Catalytica , las zeolitas de cobre y las zeolitas de hierro que estabilizan el sitio activo del oxígeno alfa . [19]
Un grupo de bacterias cataliza la oxidación del metano con nitrito como oxidante en ausencia de oxígeno , dando lugar a la llamada oxidación anaeróbica del metano . [20]
Reacciones ácido-base
Al igual que otros hidrocarburos , el metano es un ácido extremadamente débil . Se estima que su p K a en DMSO es 56. [21] No se puede desprotonar en solución, pero la base conjugada se conoce en formas como el metil-litio .
Se han observado diversos iones positivos derivados del metano, principalmente como especies inestables en mezclas de gases a baja presión. Entre ellos se encuentran el catión metenio o metilo CH+3, catión metano CH+4, y metanio o metano protonado CH+5Algunos de estos se han detectado en el espacio exterior . El metanio también se puede producir como soluciones diluidas a partir de metano con superácidos . Los cationes con mayor carga, como el CH2+6y CH3+7, se han estudiado teóricamente y se ha conjeturado que son estables. [22]
A pesar de la fuerza de sus enlaces C–H, existe un intenso interés en los catalizadores que facilitan la activación del enlace C–H en el metano (y otros alcanos de menor número ). [23]
Combustión

El calor de combustión del metano es de 55,5 MJ/kg. [24] La combustión del metano es una reacción de varios pasos que se resume a continuación:
La química de cuatro pasos de Peters es una química de cuatro pasos sistemáticamente reducida que explica la combustión de metano.
Reacciones radicales del metano
Dadas las condiciones adecuadas, el metano reacciona con radicales halógenos de la siguiente manera:
- •X + CH4 → HX + • CH3
- •CH3 + X2 → CH3X + •X
donde X es un halógeno : flúor (F), cloro (Cl), bromo (Br) o yodo (I). Este mecanismo para este proceso se llama halogenación de radicales libres . Se inicia cuando la luz UV o algún otro iniciador de radicales (como peróxidos ) produce un átomo de halógeno. Se produce una reacción en cadena de dos pasos en la que el átomo de halógeno abstrae un átomo de hidrógeno de una molécula de metano, lo que da como resultado la formación de una molécula de haluro de hidrógeno y un radical metilo ( •CH 3 ). El radical metilo reacciona luego con una molécula del halógeno para formar una molécula de halometano, con un nuevo átomo de halógeno como subproducto. [25] Pueden ocurrir reacciones similares en el producto halogenado, lo que lleva al reemplazo de átomos de hidrógeno adicionales por átomos de halógeno con estructuras de dihalometano , trihalometano y, en última instancia, tetrahalometano , dependiendo de las condiciones de reacción y la relación halógeno-metano.
Esta reacción se utiliza habitualmente con cloro para producir diclorometano y cloroformo a partir de clorometano . El tetracloruro de carbono se puede preparar con un exceso de cloro.
Usos
El metano puede transportarse como líquido refrigerado (gas natural licuado o GNL ). Si bien las fugas de un contenedor de líquido refrigerado son inicialmente más pesadas que el aire debido a la mayor densidad del gas frío, el gas a temperatura ambiente es más liviano que el aire. Los gasoductos distribuyen grandes cantidades de gas natural, del cual el metano es el componente principal.
Combustible
El metano se utiliza como combustible para hornos, hogares, calentadores de agua, hornos, automóviles, [26] [27] turbinas, etc.
Como componente principal del gas natural , el metano es importante para la generación de electricidad al quemarlo como combustible en una turbina de gas o un generador de vapor . En comparación con otros combustibles de hidrocarburos , el metano produce menos dióxido de carbono por cada unidad de calor liberada. Con aproximadamente 891 kJ/mol, el calor de combustión del metano es menor que el de cualquier otro hidrocarburo, pero la relación entre el calor de combustión (891 kJ/mol) y la masa molecular (16,0 g/mol, de los cuales 12,0 g/mol son carbono) muestra que el metano, al ser el hidrocarburo más simple, produce más calor por unidad de masa (55,7 kJ/g) que otros hidrocarburos complejos. En muchas áreas con una población lo suficientemente densa, el metano se transporta por tuberías a hogares y empresas para calefacción , cocina y usos industriales. En este contexto, generalmente se lo conoce como gas natural , que se considera que tiene un contenido energético de 39 megajulios por metro cúbico o 1000 BTU por pie cúbico estándar . El gas natural licuado (GNL) es predominantemente metano ( CH 4 ) convertido en forma líquida para facilitar su almacenamiento o transporte.
Propulsor de cohetes
El metano líquido refinado , así como el GNL, se utilizan como combustible para cohetes , [28] cuando se combinan con oxígeno líquido , como en los motores TQ-12 , BE-4 , Raptor y YF-215 . [29] Debido a las similitudes entre el metano y el GNL, estos motores se agrupan comúnmente bajo el término methalox .
Como propulsor líquido para cohetes , una combinación de metano/ oxígeno líquido ofrece la ventaja sobre la combinación de queroseno / oxígeno líquido , o kerolox, de producir moléculas de escape pequeñas, reduciendo la coquización o la deposición de hollín en los componentes del motor. El metano es más fácil de almacenar que el hidrógeno debido a su punto de ebullición y densidad más altos, así como a su falta de fragilización por hidrógeno . [30] [31] El menor peso molecular del escape también aumenta la fracción de energía térmica que está en forma de energía cinética disponible para la propulsión, lo que aumenta el impulso específico del cohete. En comparación con el hidrógeno líquido , la energía específica del metano es menor, pero esta desventaja se compensa con la mayor densidad y rango de temperatura del metano, lo que permite un tanque más pequeño y liviano para una masa de combustible dada. El metano líquido tiene un rango de temperatura (91–112 K) casi compatible con el oxígeno líquido (54–90 K). El combustible actualmente se utiliza en vehículos de lanzamiento operativos como Zhuque-2 y Vulcan , así como en lanzadores en desarrollo como Starship , Neutron y Terran R. [32]
Materia prima química
El gas natural , que se compone principalmente de metano, se utiliza para producir gas hidrógeno a escala industrial. El reformado de metano con vapor (SMR), o simplemente conocido como reformado con vapor, es el método industrial estándar para producir gas hidrógeno comercial a granel. Más de 50 millones de toneladas métricas se producen anualmente en todo el mundo (2013), principalmente a partir del SMR de gas natural. [33] Gran parte de este hidrógeno se utiliza en refinerías de petróleo , en la producción de productos químicos y en el procesamiento de alimentos. Se utilizan cantidades muy grandes de hidrógeno en la síntesis industrial de amoníaco .
A altas temperaturas (700–1100 °C) y en presencia de un catalizador a base de metal ( níquel ), el vapor reacciona con el metano para producir una mezcla de CO y H 2 , conocida como "gas de agua" o " gas de síntesis ":
- CH4 + H2O⇌CO + 3H2
Esta reacción es fuertemente endotérmica (consume calor, Δ H r = 206 kJ/mol). Se obtiene hidrógeno adicional mediante la reacción de CO con agua mediante la reacción de desplazamiento de agua-gas :
- CO + H2O ⇌ CO2 + H2
Esta reacción es ligeramente exotérmica (produce calor, Δ H r = −41 kJ/mol).
El metano también se somete a cloración de radicales libres en la producción de clorometanos, aunque el metanol es un precursor más típico. [34]
El hidrógeno también se puede producir a través de la descomposición directa del metano, también conocida como pirólisis del metano , que, a diferencia del reformado con vapor, no produce gases de efecto invernadero (GEI). El calor necesario para la reacción también puede estar libre de emisiones de GEI, por ejemplo, a partir de luz solar concentrada, electricidad renovable o quemando parte del hidrógeno producido. Si el metano proviene del biogás , entonces el proceso puede ser un sumidero de carbono . Se requieren temperaturas superiores a 1200 °C para romper los enlaces del metano y producir gas hidrógeno y carbono sólido. [35]
Sin embargo, mediante el uso de un catalizador adecuado, la temperatura de reacción se puede reducir a entre 550 y 900 °C, dependiendo del catalizador elegido. Se han probado docenas de catalizadores, incluidos catalizadores metálicos soportados y no soportados, catalizadores carbonosos y catalizadores de metal-carbono. [36]
La reacción es moderadamente endotérmica como se muestra en la ecuación de reacción a continuación. [37]
- CH4 (g) → C(s) + 2 H2 ( g )
- ( ΔH° = 74,8 kJ/mol )
Refrigerante
Como refrigerante , el metano tiene la designación ASHRAE R-50 .
Generación

El metano puede generarse a través de rutas geológicas, biológicas o industriales.
Rutas geológicas

Las dos principales rutas para la generación geológica de metano son (i) orgánica (generada térmicamente o termogénica) y (ii) inorgánica ( abiótica ). [13] El metano termogénico se produce debido a la ruptura de materia orgánica a temperaturas y presiones elevadas en estratos sedimentarios profundos . La mayor parte del metano en cuencas sedimentarias es termogénico; por lo tanto, el metano termogénico es la fuente más importante de gas natural. Los componentes del metano termogénico generalmente se consideran reliquias (de una época anterior). Generalmente, la formación de metano termogénico (en profundidad) puede ocurrir a través de la ruptura de materia orgánica o síntesis orgánica. Ambas formas pueden involucrar microorganismos ( metanogénesis ), pero también pueden ocurrir de manera inorgánica. Los procesos involucrados también pueden consumir metano, con y sin microorganismos.
La fuente más importante de metano en profundidad (roca cristalina) es abiótica. Abiótico significa que el metano se crea a partir de compuestos inorgánicos, sin actividad biológica, ya sea a través de procesos magmáticos [ se necesita un ejemplo ] o mediante reacciones entre el agua y la roca que ocurren a bajas temperaturas y presiones, como la serpentinización . [38] [39]
Rutas biológicas
La mayor parte del metano de la Tierra es biogénico y se produce por metanogénesis , [40] [41] una forma de respiración anaeróbica que solo se sabe que realizan algunos miembros del dominio Archaea . [42] Los metanógenos se encuentran en vertederos y suelos , [43] rumiantes (por ejemplo, ganado ), [44] los intestinos de las termitas y los sedimentos anóxicos debajo del lecho marino y el fondo de los lagos.
Estos microorganismos utilizan este proceso de varios pasos para obtener energía. La reacción neta de la metanogénesis es:
- CO 2 + 4 H 2 → CH 4 + 2 H 2 O
El paso final del proceso es catalizado por la enzima metil coenzima M reductasa (MCR). [45]

Humedales
Los humedales son las mayores fuentes naturales de metano a la atmósfera, [46] y representan aproximadamente entre el 20 y el 30 % del metano atmosférico. [47] El cambio climático está aumentando la cantidad de metano liberado por los humedales debido al aumento de las temperaturas y a la alteración de los patrones de precipitaciones. Este fenómeno se denomina retroalimentación de metano de los humedales . [48]
El cultivo de arroz genera hasta un 12% de las emisiones globales totales de metano debido a las inundaciones a largo plazo de los arrozales. [49]
Rumiantes
Los rumiantes, como el ganado, emiten metano, que representa aproximadamente el 22% de las emisiones anuales de metano de los Estados Unidos a la atmósfera. [50] Un estudio informó que el sector ganadero en general (principalmente ganado, pollos y cerdos) produce el 37% de todo el metano inducido por el hombre. [51] Un estudio de 2013 estimó que el ganado representaba el 44% del metano inducido por el hombre y aproximadamente el 15% de las emisiones de gases de efecto invernadero inducidas por el hombre. [52] Se están realizando muchos esfuerzos para reducir la producción de metano del ganado, como tratamientos médicos y ajustes dietéticos, [53] [54] y para atrapar el gas para utilizar su energía de combustión. [55]
Sedimentos del fondo marino
La mayor parte del subsuelo marino es anóxico porque el oxígeno es eliminado por microorganismos aeróbicos dentro de los primeros centímetros del sedimento . Debajo del fondo marino repleto de oxígeno, los metanógenos producen metano que es utilizado por otros organismos o queda atrapado en hidratos de gas . [42] Estos otros organismos que utilizan el metano como energía se conocen como metanótrofos ('comedores de metano'), y son la razón principal por la que el poco metano generado en profundidad llega a la superficie del mar. [42] Se ha descubierto que los consorcios de arqueas y bacterias oxidan el metano a través de la oxidación anaeróbica del metano (AOM); los organismos responsables de esto son las arqueas metanotróficas anaeróbicas (ANME) y las bacterias reductoras de sulfato (SRB). [56]
Rutas industriales

Dada su abundancia y bajo precio en el gas natural, existen pocos incentivos para producir metano de manera industrial. El metano se puede producir hidrogenando dióxido de carbono mediante el proceso Sabatier . El metano también es un subproducto de la hidrogenación de monóxido de carbono en el proceso Fischer-Tropsch , que se practica a gran escala para producir moléculas de cadena más larga que el metano.
Un ejemplo de gasificación de carbón a metano a gran escala es la planta Great Plains Synfuels , que comenzó a construirse en 1984 en Beulah, Dakota del Norte , como una forma de desarrollar los abundantes recursos locales de lignito de baja calidad , un recurso que de otro modo sería difícil de transportar debido a su peso, contenido de cenizas , bajo valor calorífico y propensión a la combustión espontánea durante el almacenamiento y el transporte. Existen varias plantas similares en todo el mundo, aunque la mayoría de ellas están destinadas a la producción de alcanos de cadena larga para su uso como gasolina , diésel o materia prima para otros procesos.
La conversión de energía a metano es una tecnología que utiliza energía eléctrica para producir hidrógeno a partir de agua mediante electrólisis y utiliza la reacción de Sabatier para combinar hidrógeno con dióxido de carbono para producir metano.
Síntesis de laboratorio
El metano se puede producir mediante la protonación de metil litio o un reactivo de Grignard de metilo como el cloruro de metilmagnesio . También se puede fabricar a partir de acetato de sodio anhidro e hidróxido de sodio seco , mezclados y calentados a más de 300 °C (con carbonato de sodio como subproducto). [ cita requerida ] En la práctica, la necesidad de metano puro se puede satisfacer fácilmente con botellas de gas de acero de proveedores de gas estándar.
Aparición
El metano es el componente principal del gas natural, aproximadamente el 87% en volumen. La principal fuente de metano es la extracción de depósitos geológicos conocidos como campos de gas natural , siendo la extracción de gas de veta de carbón una fuente importante (véase extracción de metano de lecho de carbón , un método para extraer metano de un depósito de carbón , mientras que la recuperación mejorada de metano de lecho de carbón es un método para recuperar metano de vetas de carbón no explotables). Está asociado con otros combustibles de hidrocarburos y, a veces, acompañado de helio y nitrógeno . El metano se produce a niveles superficiales (baja presión) por descomposición anaeróbica de materia orgánica y metano reelaborado de las profundidades de la superficie de la Tierra. En general, los sedimentos que generan gas natural están enterrados a mayor profundidad y a temperaturas más altas que los que contienen petróleo .
El metano generalmente se transporta a granel por gasoductos en su forma de gas natural, o por buques metaneros en su forma licuada; pocos países lo transportan en camión.
Metano atmosférico y cambio climático
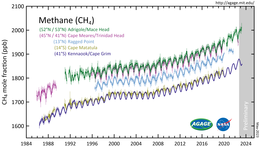
El metano es un importante gas de efecto invernadero , responsable de alrededor del 30% del aumento de las temperaturas globales desde la revolución industrial. [57]
El metano tiene un potencial de calentamiento global (GWP) de 29,8 ± 11 en comparación con el CO2 (potencial de 1) durante un período de 100 años, y de 82,5 ± 25,8 durante un período de 20 años. [58] Esto significa que, por ejemplo, una fuga de una tonelada de metano equivale a emitir 82,5 toneladas de dióxido de carbono. La quema de metano y la producción de dióxido de carbono también reducen el impacto de los gases de efecto invernadero en comparación con la simple emisión de metano a la atmósfera.

A medida que el metano se convierte gradualmente en dióxido de carbono (y agua) en la atmósfera, estos valores incluyen el forzamiento climático del dióxido de carbono producido a partir del metano en estas escalas de tiempo.
Las emisiones anuales globales de metano son actualmente de aproximadamente 580 Mt, [59] de las cuales el 40% proviene de fuentes naturales y el 60% restante se origina de la actividad humana, conocidas como emisiones antropogénicas. La mayor fuente antropogénica es la agricultura , responsable de alrededor de una cuarta parte de las emisiones, seguida de cerca por el sector energético , que incluye las emisiones del carbón, el petróleo, el gas natural y los biocombustibles. [60]
Las concentraciones históricas de metano en la atmósfera mundial han oscilado entre 300 y 400 nmol/mol durante los períodos glaciares, comúnmente conocidos como eras de hielo , y entre 600 y 700 nmol/mol durante los períodos cálidos interglaciares . Un sitio web de la NASA de 2012 afirmó que los océanos eran una fuente potencial importante de metano del Ártico, [61] pero estudios más recientes asocian el aumento de los niveles de metano con la actividad humana. [10]
El monitoreo global de las concentraciones atmosféricas de metano comenzó en la década de 1980. [10] La concentración atmosférica de metano de la Tierra ha aumentado un 160% desde los niveles preindustriales de mediados del siglo XVIII. [10] En 2013, el metano atmosférico representó el 20% del forzamiento radiativo total de todos los gases de efecto invernadero de larga duración y mezclados a nivel global. [62] Entre 2011 y 2019, el aumento promedio anual de metano en la atmósfera fue de 1866 ppb. [11] De 2015 a 2019 se registraron fuertes aumentos en los niveles de metano atmosférico. [63] [64]
En 2019, la concentración atmosférica de metano fue mayor que en cualquier otro momento de los últimos 800.000 años. Como se afirma en el AR6 del IPCC , "desde 1750, los aumentos en las concentraciones de CO2 (47%) y CH4 (156%) superan con creces, y los aumentos en N2O ( 23 % ) son similares, a los cambios naturales multimilenarios entre períodos glaciales e interglaciales durante al menos los últimos 800.000 años (nivel de confianza muy alto)". [ 11] [a] [65]
En febrero de 2020, se informó que las emisiones fugitivas y el venteo de gases de la industria de los combustibles fósiles pueden haber sido subestimadas significativamente. [66] [67] El mayor aumento anual ocurrió en 2021 y el porcentaje abrumador fue causado por la actividad humana. [10]
El cambio climático puede aumentar los niveles atmosféricos de metano al incrementar la producción de metano en los ecosistemas naturales, lo que genera una retroalimentación del cambio climático . [42] [68] Otra explicación para el aumento de las emisiones de metano podría ser una desaceleración de la reacción química que elimina el metano de la atmósfera. [69]
Más de 100 países han firmado el Compromiso Global sobre el Metano, lanzado en 2021, en el que prometen reducir sus emisiones de metano en un 30% para 2030. [70] Esto podría evitar un calentamiento global de 0,2 ˚C para 2050, aunque se han hecho llamamientos para que se asuman mayores compromisos para alcanzar este objetivo. [71] El informe de 2022 de la Agencia Internacional de la Energía afirma que "las oportunidades más rentables para la reducción del metano se encuentran en el sector energético, especialmente en las operaciones de petróleo y gas". [72]
Clatratos
Los clatratos de metano (también conocidos como hidratos de metano) son jaulas sólidas de moléculas de agua que atrapan moléculas individuales de metano. Se han encontrado importantes reservorios de clatratos de metano en el permafrost ártico y a lo largo de los márgenes continentales debajo del fondo del océano dentro de la zona de estabilidad del clatrato de gas , ubicada a altas presiones (1 a 100 MPa; el extremo inferior requiere una temperatura más baja) y bajas temperaturas (< 15 °C; el extremo superior requiere una presión más alta). [73] Los clatratos de metano pueden formarse a partir de metano biogénico, metano termogénico o una mezcla de los dos. Estos depósitos son tanto una fuente potencial de combustible de metano como un posible contribuyente al calentamiento global. [74] [75] La masa global de carbono almacenado en clatratos de gas aún es incierta y se ha estimado tan alta como 12,500 Gt de carbono y tan baja como 500 Gt de carbono. [48] La estimación ha disminuido con el tiempo con una estimación más reciente de ≈1800 Gt de carbono. [76] Una gran parte de esta incertidumbre se debe a nuestra brecha de conocimiento en las fuentes y sumideros de metano y la distribución de clatratos de metano a escala global. Por ejemplo, una fuente de metano fue descubierta relativamente recientemente en una dorsal de expansión ultralenta en el Ártico. [47] Algunos modelos climáticos sugieren que el régimen actual de emisión de metano desde el fondo del océano es potencialmente similar al del período del Máximo Térmico del Paleoceno-Eoceno ( PETM ) hace unos 55,5 millones de años, aunque no hay datos que indiquen que el metano de la disociación de clatratos alcance actualmente la atmósfera. [76] La liberación de metano del Ártico desde el permafrost y los clatratos de metano del fondo marino es una consecuencia potencial y una causa adicional del calentamiento global ; esto se conoce como la hipótesis del cañón de clatratos . [77] [78] [79] [80] Los datos de 2016 indican que el permafrost del Ártico se descongela más rápido de lo previsto. [81]
Seguridad pública y medio ambiente

El metano “degrada la calidad del aire y afecta negativamente la salud humana, el rendimiento agrícola y la productividad de los ecosistemas”. [82]
El metano es extremadamente inflamable y puede formar mezclas explosivas con el aire. Las explosiones de gas metano son responsables de muchos desastres mineros mortales. [83] Una explosión de gas metano fue la causa del desastre de la mina de carbón Upper Big Branch en Virginia Occidental el 5 de abril de 2010, matando a 29 personas. [84] La liberación accidental de gas natural también ha sido un foco importante en el campo de la ingeniería de seguridad , debido a liberaciones accidentales pasadas que concluyeron en la formación de desastres de fuego de chorro . [85] [86]
La fuga de gas metano de 2015-2016 en Aliso Canyon, California, fue considerada la peor en términos de su efecto ambiental en la historia de Estados Unidos. [87] [88] [89] También fue descrita como más dañina para el medio ambiente que la fuga de Deepwater Horizon en el Golfo de México. [90]
En mayo de 2023, The Guardian publicó un informe en el que acusaba a Turkmenistán de ser el peor país del mundo en cuanto a emisiones de metano . Los datos recopilados por los investigadores de Kayrros indican que dos grandes yacimientos de combustibles fósiles de Turkmenistán filtraron 2,6 millones y 1,8 millones de toneladas métricas de metano solo en 2022, lo que provocó que se expulsaran a la atmósfera el equivalente a 366 millones de toneladas de CO2, superando así las emisiones anuales de CO2 del Reino Unido . [91]
El metano también es asfixiante si la concentración de oxígeno se reduce por debajo del 16 % aproximadamente por desplazamiento, ya que la mayoría de las personas pueden tolerar una reducción del 21 % al 16 % sin efectos nocivos . La concentración de metano a la que el riesgo de asfixia se vuelve significativo es mucho mayor que la concentración del 5 al 15 % en una mezcla inflamable o explosiva. Los gases de escape de metano pueden penetrar en el interior de los edificios cercanos a los vertederos y exponer a los ocupantes a niveles significativos de metano. Algunos edificios tienen sistemas de recuperación especialmente diseñados debajo de sus sótanos para capturar activamente este gas y ventilarlo fuera del edificio.
Metano extraterrestre
Medio interestelar
En esta sección falta información sobre el origen del metano abiótico extraterrestre (¿Big Bang? ¿Supernova? ¿Reacción de depósitos minerales?). ( Junio de 2024 ) |
El metano es abundante en muchas partes del Sistema Solar y potencialmente podría ser recolectado en la superficie de otro cuerpo del Sistema Solar (en particular, utilizando la producción de metano a partir de materiales locales encontrados en Marte [92] o Titán ), proporcionando combustible para un viaje de regreso. [28] [93]
Marte
Se ha detectado metano en todos los planetas del Sistema Solar y en la mayoría de las lunas más grandes. [ cita requerida ] Con la posible excepción de Marte , se cree que proviene de procesos abióticos . [94] [95]

El rover Curiosity ha documentado fluctuaciones estacionales de los niveles de metano atmosférico en Marte. Estas fluctuaciones alcanzaron su punto máximo al final del verano marciano, con 0,6 partes por mil millones. [96] [97] [98] [99] [100] [101] [102] [103]
Se ha propuesto el metano como posible propulsor de cohetes en futuras misiones a Marte debido en parte a la posibilidad de sintetizarlo en el planeta mediante la utilización de recursos in situ . [104] Se puede utilizar una adaptación de la reacción de metanización de Sabatier con un lecho catalizador mixto y un cambio inverso de agua-gas en un solo reactor para producir metano y oxígeno a partir de las materias primas disponibles en Marte, utilizando agua del subsuelo marciano y dióxido de carbono en la atmósfera marciana . [92]
El metano podría producirse mediante un proceso no biológico llamado serpentinización [b] que involucra agua, dióxido de carbono y el mineral olivino , que se sabe que es común en Marte. [105]
Titán

Se ha detectado metano en gran abundancia en Titán , la luna más grande de Saturno ; constituye una parte importante de su atmósfera y también existe en forma líquida en su superficie, donde constituye la mayor parte del líquido en los vastos lagos de hidrocarburos de Titán; se cree que el segundo más grande de ellos es metano casi puro en composición. [106]
La presencia de lagos estables de metano líquido en Titán, así como el hecho de que la superficie de Titán es altamente activa químicamente y rica en compuestos orgánicos, ha llevado a los científicos a considerar la posibilidad de que exista vida dentro de los lagos de Titán, utilizando metano como solvente en lugar de agua para la vida en la Tierra [107] y utilizando hidrógeno en la atmósfera para derivar energía con acetileno , de la misma manera que la vida en la Tierra utiliza glucosa . [108]
Historia
-Portrait-Portr_02303.tif/lossy-page1-440px-ETH-BIB-Volta,_Alessandro_(1745-1827)-Portrait-Portr_02303.tif.jpg)
El descubrimiento del metano se atribuye al físico italiano Alessandro Volta , quien caracterizó numerosas propiedades, incluido su límite de inflamabilidad y su origen a partir de materia orgánica en descomposición. [109]
Volta se sintió motivado inicialmente por los informes de su amigo, el padre Carlo Guiseppe Campi, sobre la presencia de aire inflamable en los pantanos. Durante un viaje de pesca al lago Maggiore , a caballo entre Italia y Suiza , en noviembre de 1776, notó la presencia de burbujas en los pantanos cercanos y decidió investigar. Volta recogió el gas que salía del pantano y demostró que era inflamable. [109] [110]
Volta señala que observaciones similares de aire inflamable existían previamente en la literatura científica, incluida una carta escrita por Benjamin Franklin . [111]
Tras el desastre de la mina Felling de 1812, en el que perecieron 92 hombres, Sir Humphry Davy estableció que el temido grisú era en realidad, en gran parte, metano. [112]
El nombre "metano" fue acuñado en 1866 por el químico alemán August Wilhelm von Hofmann . [113] [114] El nombre se derivó de metanol .
Etimología
Etimológicamente, la palabra metano se acuña a partir del sufijo químico " -ane ", que denota sustancias pertenecientes a la familia de los alcanos; y la palabra metilo , que se deriva del alemán Methyl (1840) o directamente del francés méthyle , que es una formación inversa del francés méthylène (que corresponde al inglés "metileno"), cuya raíz fue acuñada por Jean-Baptiste Dumas y Eugène Péligot en 1834 a partir del griego μέθυ methy (vino) (relacionado con el inglés "mead") y ὕλη hyle (que significa "madera"). El radical recibe este nombre porque se detectó por primera vez en el metanol , un alcohol aislado por primera vez por destilación de madera. El sufijo químico -ane proviene del sufijo químico coordinante -ine que a su vez proviene del sufijo femenino latino -ina que se aplica para representar abstractos. La coordinación de "-ano", "-eno", "-ona", etc. fue propuesta en 1866 por el químico alemán August Wilhelm von Hofmann . [115]
Abreviaturas
La abreviatura CH 4 -C puede significar la masa de carbono contenida en una masa de metano, y la masa de metano es siempre 1,33 veces la masa de CH 4 -C. [116] [117] CH 4 -C también puede significar la relación metano-carbono, que es 1,33 en masa. [118] El metano a escalas de la atmósfera se mide comúnmente en teragramos (Tg CH 4 ) o millones de toneladas métricas (MMT CH 4 ), que significan lo mismo. [119] También se utilizan otras unidades estándar, como nanomol (nmol, una milmillonésima parte de un mol), mol (mol), kilogramo y gramo .
Véase también
- Desastre de la mina Zasyadko en 2007
- Origen abiogénico del petróleo
- Producción aeróbica de metano
- Digestión anaeróbica
- Respiración anaeróbica
- Emisiones de metano del Ártico
- Metano atmosférico
- Biogás
- Campo de filtración de Coal Oil Point
- Densidad de energía
- Emisiones fugitivas de gases
- Iniciativa mundial sobre el metano
- Thomas Oro
- Halometano , derivados halogenados del metano.
- Ciclo del hidrógeno
- Gas industrial
- Lago Kivu (más general: erupción límnica )
- Lista de alcanos de cadena lineal
- Metanización
- Emisiones de metano
- Metano en Marte:
- Metanógeno , arqueas que producen metano.
- Metanogénesis , microbios que producen metano.
- Metanótrofo , bacteria que crece con metano.
- Grupo metilo , un grupo funcional relacionado con el metano.
Notas explicativas
- ^ En 2013, los científicos del Grupo Intergubernamental de Expertos sobre el Cambio Climático (IPCC) advirtieron que las concentraciones atmosféricas de metano habían "superado los niveles preindustriales en aproximadamente un 150%, lo que representaba "niveles sin precedentes en al menos los últimos 800.000 años".
- ^ Existen muchas reacciones de serpentinización . El olivino es una solución sólida entre la forsterita y la fayalita cuya fórmula general es (Fe,Mg) 2 SiO 4 . La reacción que produce metano a partir del olivino se puede escribir como: Forsterita + Fayalita + Agua + Ácido carbónico → Serpentina + Magnetita + Metano , o (en forma balanceada):
- 18 Mg 2 SiO 4 + 6 Fe 2 SiO 4 + 26 H 2 O + CO 2 → 12 Mg 3 Si 2 O 5 (OH) 4 + 4 Fe 3 O 4 + CH 4
Citas
- ^ ab "Principios generales, reglas y convenciones". Nomenclatura de la química orgánica. Recomendaciones y nombres preferidos de la IUPAC 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. P-12.1. doi :10.1039/9781849733069-00001. ISBN . 978-0-85404-182-4.
Metano es un nombre conservado (ver P-12.3) que se prefiere al nombre sistemático 'carbano', un nombre nunca recomendado para reemplazar al metano, pero utilizado para derivar los nombres 'carbeno' y 'carbino' para los radicales H 2 C 2• y HC 3• , respectivamente.
- ^ "Enciclopedia del gas". Archivado desde el original el 26 de diciembre de 2018. Consultado el 7 de noviembre de 2013 .
- ^ abcd Haynes, pág. 3.344
- ^ Haynes, pág. 5.156
- ^ Haynes, pág. 3.578
- ^ Haynes, págs. 5.26, 5.67
- ^ "Hoja de datos de seguridad, nombre del material: metano" (PDF) . EE. UU.: Metheson Tri-Gas Incorporated. 4 de diciembre de 2009. Archivado desde el original (PDF) el 4 de junio de 2012 . Consultado el 4 de diciembre de 2011 .
- ^ Oficina de Respuesta y Restauración de la NOAA, US GOV. "METHANE". noaa.gov . Archivado desde el original el 9 de enero de 2019. Consultado el 20 de marzo de 2015 .
- ^ Khalil, MAK (1999). "Gases de efecto invernadero distintos del CO2 en la atmósfera". Revista anual de energía y medio ambiente . 24 : 645–661. doi :10.1146/annurev.energy.24.1.645.
- ^ abcde Evaluación mundial del metano (PDF) . Programa de las Naciones Unidas para el Medio Ambiente y Coalición por el Clima y el Aire Limpio (informe). Nairobi. 2022. p. 12 . Consultado el 15 de marzo de 2023 .
- ^ abc "Cambio climático 2021. Bases de la ciencia física. Resumen para los responsables de políticas. Contribución del Grupo de trabajo I al Sexto informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático". IPCC . El Grupo Intergubernamental de Expertos sobre el Cambio Climático. Archivado desde el original el 22 de agosto de 2021 . Consultado el 22 de agosto de 2021 .
- ^ IPCC, 2023: Resumen para los responsables de políticas. En: Cambio climático 2023: Informe de síntesis. Informe del Grupo Intergubernamental de Expertos sobre el Cambio Climático. Contribución de los Grupos de trabajo I, II y III al Sexto informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático [Equipo de redacción principal, H. Lee y J. Romero (eds.)]. IPCC, Ginebra, Suiza, página 26, sección C.2.3
- ^ ab Etiope, Giuseppe; Lollar, Barbara Sherwood (2013). "Metano abiótico en la Tierra". Reseñas de Geofísica . 51 (2): 276–299. Bibcode :2013RvGeo..51..276E. doi :10.1002/rog.20011. S2CID 56457317.
- ^ Hensher, David A.; Button, Kenneth J. (2003). Manual de transporte y medio ambiente. Emerald Group Publishing. pág. 168. ISBN 978-0-08-044103-0. Archivado desde el original el 19 de marzo de 2015 . Consultado el 22 de febrero de 2016 .
- ^ PGJ Irwin; et al. (12 de enero de 2022). "Mundos azules brumosos: un modelo holístico de aerosoles para Urano y Neptuno, incluidas las manchas oscuras". Revista de investigación geofísica: planetas . 127 (6): e2022JE007189. arXiv : 2201.04516 . Código Bibliográfico :2022JGRE..12707189I. doi :10.1029/2022JE007189. PMC 9286428 . PMID 35865671. S2CID 245877540.
- ^ Bini, R.; Pratesi, G. (1997). "Estudio infrarrojo de alta presión del metano sólido: Diagrama de fases hasta 30 GPa". Physical Review B . 55 (22): 14800–14809. Código Bibliográfico :1997PhRvB..5514800B. doi :10.1103/physrevb.55.14800.
- ^ Wendelin Himmelheber. «Estructuras cristalinas». Archivado desde el original el 12 de febrero de 2020. Consultado el 10 de diciembre de 2019 .
- ^ Baik, Mu-Hyun; Newcomb, Martin; Friesner, Richard A.; Lippard, Stephen J. (2003). "Estudios mecanicistas sobre la hidroxilación del metano por la metano monooxigenasa". Chemical Reviews . 103 (6): 2385–419. doi :10.1021/cr950244f. PMID 12797835.
- ^ Snyder, Benjamin ER; Bols, Max L.; Schoonheydt, Robert A.; Sels, Bert F.; Solomon, Edward I. (19 de diciembre de 2017). "Sitios activos de hierro y cobre en zeolitas y su correlación con metaloenzimas". Chemical Reviews . 118 (5): 2718–2768. doi :10.1021/acs.chemrev.7b00344. PMID 29256242.
- ^ Reimann, Joachim; Jetten, Mike SM; Keltjens, Jan T. (2015). "Enzimas metálicas en microorganismos "imposibles" que catalizan la oxidación anaeróbica de amonio y metano". En Peter MH Kroneck y Martha E. Sosa Torres (ed.). Sustentando la vida en el planeta Tierra: metaloenzimas que dominan el dioxígeno y otros gases masticables . Iones metálicos en las ciencias de la vida. Vol. 15. Springer. págs. 257–313. doi :10.1007/978-3-319-12415-5_7. ISBN 978-3-319-12414-8. Número de identificación personal 25707470.
- ^ Bordwell, Frederick G. (1988). "Acidez de equilibrio en solución de dimetilsulfóxido". Accounts of Chemical Research . 21 (12): 456–463. doi :10.1021/ar00156a004. S2CID 26624076.
- ^ Rasul, G.; Surya Prakash, GK; Olah, GA (2011). "Estudio comparativo de los iones de carbonio hipercoordinados y sus análogos de boro: un desafío para los espectroscopistas". Chemical Physics Letters . 517 (1): 1–8. Bibcode :2011CPL...517....1R. doi :10.1016/j.cplett.2011.10.020.
- ^ Bernskoetter, WH; Schauer, CK; Goldberg, KI; Brookhart, M. (2009). "Caracterización de un complejo de rodio(I) σ-metano en solución". Science . 326 (5952): 553–556. Bibcode :2009Sci...326..553B. doi :10.1126/science.1177485. PMID 19900892. S2CID 5597392.
- ^ Contenido energético de algunos combustibles (en MJ/kg) Archivado el 9 de enero de 2014 en Wayback Machine . People.hofstra.edu. Recuperado el 30 de marzo de 2014.
- ^ March, Jerry (1968). Química orgánica avanzada: reacciones, mecanismos y estructura . Nueva York: McGraw-Hill Book Company. págs. 533–534.
- ^ "Empresa maderera ubica hornos en vertedero para utilizar metano – Energy Manager Today". Energy Manager Today . 23 de septiembre de 2015. Archivado desde el original el 9 de julio de 2019. Consultado el 11 de marzo de 2016 .
- ^ Cornell, Clayton B. (29 de abril de 2008). "Automóviles a gas natural: combustible de GNC casi gratuito en algunas partes del país". Archivado desde el original el 20 de enero de 2019. Consultado el 25 de julio de 2009.
El gas natural comprimido se promociona como el combustible alternativo de "combustión más limpia" disponible, ya que la simplicidad de la molécula de metano reduce las emisiones de los tubos de escape de diferentes contaminantes entre un 35 y un 97%. No tan dramática es la reducción de las emisiones netas de gases de efecto invernadero, que es aproximadamente la misma que la del etanol de grano de maíz, con una reducción de aproximadamente el 20% con respecto a la gasolina.
- ^ ab Thunnissen, Daniel P.; Guernsey, CS; Baker, RS; Miyake, RN (2004). "Propulsores avanzados almacenables en el espacio para la exploración de planetas exteriores" (PDF) . Instituto Americano de Aeronáutica y Astronáutica (4–0799): 28. Archivado desde el original (PDF) el 10 de marzo de 2016.
- ^ "Motor BE-4 de Blue Origin". Archivado del original el 1 de octubre de 2021. Consultado el 14 de junio de 2019. Elegimos el GNL porque es muy eficiente, de bajo costo y ampliamente disponible .
A diferencia del queroseno, el GNL se puede utilizar para autopresurizar su tanque. Esto, conocido como represurización autógena, elimina la necesidad de sistemas costosos y complejos que aprovechan las escasas reservas de helio de la Tierra. El GNL también posee características de combustión limpia incluso a bajo acelerador, lo que simplifica la reutilización del motor en comparación con los combustibles de queroseno.
- ^ "El jefe de propulsión de SpaceX eleva a la multitud en Santa Bárbara". Pacific Business Times. 19 de febrero de 2014. Consultado el 22 de febrero de 2014 .
- ^ Belluscio, Alejandro G. (7 de marzo de 2014). «SpaceX avanza en el impulso de un cohete marciano mediante la potencia del Raptor». NASAspaceflight.com . Consultado el 7 de marzo de 2014 .
- ^ "China supera a sus rivales y lanza con éxito el primer cohete de metano líquido". Reuters . 12 de julio de 2023.
- ^ Informe del Panel de expertos en producción de hidrógeno: un subcomité del Comité asesor técnico sobre hidrógeno y pilas de combustible Archivado el 14 de febrero de 2020 en Wayback Machine . Departamento de Energía de los Estados Unidos (mayo de 2013).
- ^ Rossberg, M. et al. (2006) "Hidrocarburos clorados" en Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, Weinheim. doi :10.1002/14356007.a06_233.pub2.
- ^ Lumbers, Brock (2022). "Modelado matemático y simulación de la descomposición termocatalítica del metano para una producción de hidrógeno económicamente mejorada". Revista Internacional de Energía del Hidrógeno . 47 (7): 4265–4283. Código Bibliográfico :2022IJHE...47.4265L. doi :10.1016/j.ijhydene.2021.11.057. S2CID 244814932 . Consultado el 15 de junio de 2022 .
- ^ Hamdani, Iqra R.; Ahmad, Adeel; Chulliyil, Haleema M.; Srinivasakannan, Chandrasekar; Shoaibi, Ahmed A.; Hossain, Mohammad M. (15 de agosto de 2023). "Descomposición termocatalítica del metano: una revisión de los catalizadores basados en carbono". ACS Omega . 8 (32): 28945–28967. doi :10.1021/acsomega.3c01936. ISSN 2470-1343. PMC 10433352 . PMID 37599913.
- ^ Lumbers, Brock (2022). "Producción de hidrógeno con bajas emisiones mediante la descomposición termocatalítica del metano para la descarbonización de minas de mineral de hierro en Australia Occidental". Revista Internacional de Energía del Hidrógeno . 47 (37): 16347–16361. Código Bibliográfico :2022IJHE...4716347L. doi :10.1016/j.ijhydene.2022.03.124. S2CID 248018294 . Consultado el 10 de julio de 2022 .
- ^ Kietäväinen y Purkamo (2015). "El origen, la fuente y el ciclo del metano en la biosfera de rocas cristalinas profundas". Portada. Microbiol . 6 : 725. doi : 10.3389/fmicb.2015.00725 . PMC 4505394. PMID 26236303 .
- ^ Cramer y Franke (2005). «Indicaciones de un sistema petrolero activo en el mar de Laptev, noreste de Siberia». Journal of Petroleum Geology . 28 (4): 369–384. Código Bibliográfico :2005JPetG..28..369C. doi :10.1111/j.1747-5457.2005.tb00088.x. S2CID 129445357. Archivado desde el original el 1 de octubre de 2021 . Consultado el 23 de mayo de 2017 .
- ^ Lessner, Daniel J. (diciembre de 2009) Bioquímica de la metanogénesis. En: eLS. John Wiley & Sons Ltd, Chichester. http://www.els.net Archivado el 13 de mayo de 2011 en Wayback Machine.
- ^ Thiel, Volker (2018), "El ciclo del carbono metano en el pasado: perspectivas a partir de biomarcadores de hidrocarburos y lípidos", en Wilkes, Heinz (ed.), Hidrocarburos, aceites y lípidos: diversidad, origen, química y destino , Manual de microbiología de hidrocarburos y lípidos, Springer International Publishing, págs. 1–30, doi :10.1007/978-3-319-54529-5_6-1, ISBN 9783319545295, Número de identificación del sujeto 105761461
- ^ abcdDecano , Joshua F.; Middelburg, Jack J.; Röckmann, Thomas; Aerts, Rien; Blauw, Lucas G.; Egger, Matías; Jetten, Mike SM; de Jong, Anniek EE; Meisel, Ove H. (2018). "Retroalimentación del metano al sistema climático global en un mundo más cálido". Reseñas de Geofísica . 56 (1): 207–250. Código Bib : 2018RvGeo..56..207D. doi : 10.1002/2017RG000559 . hdl : 1874/366386 .
- ^ Serrano-Silva, N.; Sarría-Guzmán, Y.; Dendooven, L.; Luna-Guido, M. (2014). "Metanogénesis y metanotrofia en suelo: una revisión". Pedosfera . 24 (3): 291–307. Código Bib :2014Pedos..24..291S. doi :10.1016/s1002-0160(14)60016-3.
- ^ Sirohi, SK; Pandey, Neha; Singh, B.; Puniya, AK (1 de septiembre de 2010). "Metanógenos del rumen: una revisión". Revista India de Microbiología . 50 (3): 253–262. doi :10.1007/s12088-010-0061-6. PMC 3450062 . PMID 23100838.
- ^ Lyu, Zhe; Shao, Nana; Akinyemi, Taiwo; Whitman, William B. (2018). "Metanogénesis". Current Biology . 28 (13): R727–R732. Código Bibliográfico :2018CBio...28.R727L. doi : 10.1016/j.cub.2018.05.021 . PMID 29990451.
- ^ Tandon, Ayesha (20 de marzo de 2023). «El aumento «excepcional» de las emisiones de metano de los humedales preocupa a los científicos». Carbon Brief . Consultado el 18 de septiembre de 2023 .
- ^ ab «Descubren nueva fuente de metano en el océano Ártico». phys.org . 1 de mayo de 2015. Archivado desde el original el 10 de abril de 2019 . Consultado el 10 de abril de 2019 .
- ^ ab Boswell, Ray; Collett, Timothy S. (2011). "Perspectivas actuales sobre los recursos de hidratos de gas". Energy Environ. Sci . 4 (4): 1206–1215. doi :10.1039/c0ee00203h.
- ^ Fondo para el Medio Ambiente Mundial (7 de diciembre de 2019). "Podemos cultivar un arroz más respetuoso con el clima". Climate Home News . Consultado el 18 de septiembre de 2023 .
- ^ "Inventario de emisiones y sumideros de gases de efecto invernadero en Estados Unidos: 1990-2014". 2016. Archivado desde el original el 12 de abril de 2019. Consultado el 11 de abril de 2019 .[ página necesaria ]
- ^ FAO (2006). La larga sombra del ganado: cuestiones ambientales y opciones. Roma (Italia): Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO). Archivado desde el original el 26 de julio de 2008. Consultado el 27 de octubre de 2009 .
- ^ Gerber, PJ; Steinfeld, H.; Henderson, B.; Mottet, A.; Opio, C.; Dijkman, J.; Falcucci, A. y Tempio, G. (2013). "Abordar el cambio climático a través de la ganadería". Roma: Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO). Archivado desde el original el 19 de julio de 2016 . Consultado el 15 de julio de 2016 .
- ^ Roach, John (13 de mayo de 2002). «Nueva Zelanda intenta poner coto a los eructos gaseosos de las ovejas». National Geographic . Archivado desde el original el 4 de junio de 2011. Consultado el 2 de marzo de 2011 .
- ^ Roque, Breanna M.; Venegas, Marielena; Kinley, Robert D.; Nys, Rocky de; Duarte, Toni L.; Yang, Xiang; Kebreab, Ermias (17 de marzo de 2021). "La suplementación con algas rojas (Asparagopsis taxiformis) reduce el metano entérico en más del 80 por ciento en novillos de carne". MÁS UNO . 16 (3): e0247820. Código Bib : 2021PLoSO..1647820R. doi : 10.1371/journal.pone.0247820 . ISSN 1932-6203. PMC 7968649 . PMID 33730064.
- ^ Silverman, Jacob (16 de julio de 2007). "¿Las vacas contaminan tanto como los automóviles?". HowStuffWorks.com. Archivado desde el original el 4 de noviembre de 2012. Consultado el 7 de noviembre de 2012 .
- ^ Knittel, K.; Wegener, G.; Boetius, A. (2019), McGenity, Terry J. (ed.), "Oxidadores anaeróbicos de metano", Comunidades microbianas que utilizan hidrocarburos y lípidos: miembros, metagenómica y ecofisiología , Manual de microbiología de hidrocarburos y lípidos, Springer International Publishing, págs. 1–21, doi :10.1007/978-3-319-60063-5_7-1, ISBN 9783319600635
- ^ "Metano y cambio climático – Global Methane Tracker 2022 – Análisis". IEA . 2022 . Consultado el 18 de septiembre de 2023 .
- ^ Forster, P.; Storelvmo, T.; Armour, K.; Collins, W.; Dufresne, J.-L.; Frame, D.; Lunt, DJ; Mauritsen, T.; Palmer, MD; Watanabe, M.; Wild, M.; Zhang, H. (2021). "El presupuesto energético de la Tierra, las retroalimentaciones climáticas y la sensibilidad climática". Cambio climático 2021: la base científica física. Contribución del Grupo de trabajo I al Sexto Informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático . Cambridge, Reino Unido y Nueva York, NY, EE. UU.: Cambridge University Press. págs. 923–1054.
- ^ "Presupuesto mundial de metano 2020". www.globalcarbonproject.org . Consultado el 18 de septiembre de 2023 .
- ^ "Metano y cambio climático – Global Methane Tracker 2022 – Análisis". IEA . Consultado el 18 de septiembre de 2023 .
- ^ "Estudio descubre fuente sorprendente de emisiones de metano en el Ártico". NASA . 22 de abril de 2012. Archivado desde el original el 4 de agosto de 2014 . Consultado el 30 de marzo de 2014 .
- ^ IPCC. "Forzamiento radiativo natural y antropogénico", Cambio climático 2013: la base científica física. Contribución del Grupo de trabajo I al quinto informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático. , Cambridge University Press, págs. 659–740, 2013, doi :10.1017/cbo9781107415324.018, ISBN 9781107057999, consultado el 18 de septiembre de 2023
- ^ Nisbet, EG (5 de febrero de 2019). "Un crecimiento muy fuerte del metano atmosférico en los cuatro años 2014-2017: implicaciones para el Acuerdo de París". Ciclos biogeoquímicos globales . 33 (3): 318–342. Bibcode :2019GBioC..33..318N. doi : 10.1029/2018GB006009 .
- ^ McKie, Robin (2 de febrero de 2017). «El brusco aumento de los niveles de metano amenaza los objetivos climáticos mundiales». The Observer . ISSN 0029-7712. Archivado desde el original el 30 de julio de 2019. Consultado el 14 de julio de 2019 .
- ^ IPCC (2013). Stocker, TF; Qin, D.; Plattner, G.-K.; Tignor, M.; et al. (eds.). Cambio climático 2013: la base científica física (PDF) (Informe). Contribución del Grupo de trabajo I al quinto informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático.
- ^ Hmiel, Benjamin; Petrenko, VV; Dyonisius, MN; Buizert, C.; Smith, AM; Place, PF; Harth, C.; Beaudette, R.; Hua, Q.; Yang, B.; Vimont, I.; Michel, SE; Severinghaus, JP; Etheridge, D.; Bromley, T.; Schmitt, J.; Faïn, X.; Weiss, RF; Dlugokencky, E. (febrero de 2020). "El 14CH4 preindustrial indica mayores emisiones de CH4 fósil antropogénico". Nature . 578 (7795): 409–412. Bibcode :2020Natur.578..409H. doi :10.1038/s41586-020-1991-8. ISSN 1476-4687. PMID 32076219. S2CID 211194542. Consultado el 15 de marzo de 2023 .
- ^ Harvey, Chelsea (21 de febrero de 2020). "Las emisiones de metano del petróleo y el gas pueden estar significativamente subestimadas; las estimaciones de metano proveniente de fuentes naturales han sido demasiado altas, lo que traslada la carga a las actividades humanas". E&E News vía Scientific American . Archivado desde el original el 24 de febrero de 2020.
- ^ Carrington, Damian (21 de julio de 2020) Se descubre la primera fuga activa de metano del lecho marino en la Antártida Archivado el 22 de julio de 2020 en Wayback Machine , The Guardian
- ^ Ravilious, Kate (5 de julio de 2022). «El metano es mucho más sensible al calentamiento global de lo que se creía, según un estudio». The Guardian . Consultado el 5 de julio de 2022 .
- ^ Compromiso Global de Metano. «Página de inicio | Compromiso Global de Metano». www.globalmethanepledge.org . Consultado el 2 de agosto de 2023 .
- ^ Forster, Piers; Smith, Chris; Rogelj, Joeri (2 de noviembre de 2021). "Publicación invitada: El Compromiso Global sobre el Metano debe ir más allá para ayudar a limitar el calentamiento a 1,5 °C". Carbon Brief . Consultado el 2 de agosto de 2023 .
- ^ IEA (2022). «Global Methane Tracker 2022». IEA . Consultado el 2 de agosto de 2023 .
- ^ Bohrmann, Gerhard; Torres, Marta E. (2006), Schulz, Horst D.; Zabel, Matthias (eds.), "Hidratos de gas en sedimentos marinos", Geoquímica marina , Springer Berlin Heidelberg, págs. 481–512, doi :10.1007/3-540-32144-6_14, ISBN 9783540321446
- ^ Miller, G. Tyler (2007). Sustain the Earth: An Integrated Approach [Sostener la Tierra: un enfoque integrado] . EE. UU.: Thomson Advantage Books, pág. 160. ISBN 0534496725
- ^ Dean, JF (2018). "Retroalimentaciones del metano al sistema climático global en un mundo más cálido". Reseñas de Geofísica . 56 (1): 207–250. Bibcode :2018RvGeo..56..207D. doi : 10.1002/2017RG000559 . hdl : 1874/366386 .
- ^ ab Ruppel; Kessler (2017). «La interacción del cambio climático y los hidratos de metano». Reseñas de Geofísica . 55 (1): 126–168. Bibcode :2017RvGeo..55..126R. doi : 10.1002/2016RG000534 . hdl : 1912/8978 . Archivado desde el original el 7 de febrero de 2020. Consultado el 16 de septiembre de 2019 .
- ^ "Las emisiones de metano de la plataforma ártica pueden ser mucho mayores y más rápidas de lo previsto" (Comunicado de prensa). National Science Foundation (NSF). 10 de marzo de 2010. Archivado desde el original el 1 de agosto de 2018. Consultado el 6 de abril de 2018 .
- ^ Connor, Steve (13 de diciembre de 2011). «Se observan enormes columnas de metano en el océano Ártico a medida que se retira el hielo marino». The Independent . Archivado desde el original el 25 de diciembre de 2011. Consultado el 4 de septiembre de 2017 .
- ^ "El hielo marino del Ártico alcanza su extensión más baja del año y del récord satelital" (Comunicado de prensa). Centro Nacional de Datos sobre Nieve y Hielo (NSIDC). 19 de septiembre de 2012. Archivado desde el original el 4 de octubre de 2012 . Consultado el 7 de octubre de 2012 .
- ^ "Fronteras 2018/19: cuestiones emergentes de interés ambiental". ONU Medio Ambiente . Archivado desde el original el 6 de marzo de 2019. Consultado el 6 de marzo de 2019 .
- ^ "Los científicos se sorprenden por el deshielo del permafrost del Ártico 70 años antes de lo previsto". The Guardian . Reuters. 18 de junio de 2019. ISSN 0261-3077. Archivado desde el original el 6 de octubre de 2019 . Consultado el 14 de julio de 2019 .
- ^ Shindell, Drew; Kuylenstierna, Johan CI; Vignati, Elisabetta; van Dingenen, Rita; Amann, Markus; Klimont, Zbigniew; Anenberg, Susan C.; Muller, Nicholas; Janssens-Maenhout, Greet; Raes, Frank; Schwartz, Joel; Faluvegi, Greg; Pozzoli, Luca; Kupiainen, Kaarle; Höglund-Isaksson, Lena; Emberson, Lisa; Streets, David; Ramanathan, V.; Hicks, Kevin; Oanh, NT Kim; Milly, George; Williams, Martin; Demkine, Volodymyr; Fowler, David (13 de enero de 2012). "Mitigar simultáneamente el cambio climático a corto plazo y mejorar la salud humana y la seguridad alimentaria". Science . 335 (6065): 183–189. Código Bibliográfico : 2012Sci...335..183S. doi :10.1126/science.1210026. ISSN 1095-9203. PMID 22246768. S2CID 14113328.
- ^ Dozolme, Philippe. «Accidentes mineros habituales». About.com. Archivado desde el original el 11 de noviembre de 2012. Consultado el 7 de noviembre de 2012 .
- ^ Messina, Lawrence y Bluestein, Greg (8 de abril de 2010). "Funcionario de la Reserva Federal: todavía es demasiado pronto para el rescate de la mina de West Virginia". News.yahoo.com. Archivado desde el original el 8 de abril de 2010. Consultado el 8 de abril de 2010 .
- ^ OSMAN, Karim; GENIAUT, Baptiste; HERCHIN, Nicolas; BLANCHETIERE, Vincent (2015). "Una revisión de los daños observados después de eventos catastróficos experimentados en la industria del gas midstream en comparación con las herramientas de modelado de consecuencias" (PDF) . Serie de simposios . 160 (25) . Consultado el 1 de julio de 2022 .
- ^ Casal, Joaquim; Gómez-Mares, Mercedes; Muñoz, Miguel; Palacios, Adriana (2012). "Incendios a reacción: ¿un peligro de incendio" menor "?" (PDF) . Transacciones de Ingeniería Química . 26 : 13-20. doi :10.3303/CET1226003 . Consultado el 1 de julio de 2022 .
- ^ "Fuga de gas en Porter Ranch tapada permanentemente, dicen funcionarios". Los Angeles Times . Consultado el 18 de febrero de 2016 .
- ^ Matt McGrath (26 de febrero de 2016). «Fuga de metano en California, la más grande de la historia de Estados Unidos». BBC . Consultado el 26 de febrero de 2016 .
- ^ Davila Fragoso, Alejandro (26 de febrero de 2016). "La masiva explosión de metano en Aliso Canyon fue la más grande en la historia de Estados Unidos". ThinkProgress . Consultado el 26 de febrero de 2016 .
- ^ Tim Walker (2 de enero de 2016). «Fuga de gas metano en California 'más perjudicial que el desastre de Deepwater Horizon'» . The Independent . Archivado desde el original el 4 de enero de 2016 . Consultado el 6 de julio de 2017 .
- ^ Carrington, Damian (9 de mayo de 2023). «Revelan emisiones de metano 'alucinantes' de Turkmenistán». The Guardian . Consultado el 9 de mayo de 2023 .
- ^ ab Zubrin, RM; Muscatello, AC; Berggren, M. (2013). "Sistema integrado de producción de propulsante in situ en Marte". Revista de ingeniería aeroespacial . 26 : 43–56. doi :10.1061/(ASCE)AS.1943-5525.0000201.
- ^ "Explosión de metano". NASA. 4 de mayo de 2007. Archivado desde el original el 16 de noviembre de 2019. Consultado el 7 de julio de 2012 .
- ^ Chang, Kenneth (2 de noviembre de 2012). «La esperanza de metano en Marte se desvanece». The New York Times . Archivado desde el original el 8 de junio de 2019. Consultado el 3 de noviembre de 2012 .
- ^ Atreya, Sushil K.; Mahaffy, Paul R.; Wong, Ah-San (2007). "Metano y especies traza relacionadas en Marte: origen, pérdida, implicaciones para la vida y habitabilidad". Ciencias Planetarias y Espaciales . 55 (3): 358–369. Bibcode :2007P&SS...55..358A. doi :10.1016/j.pss.2006.02.005. hdl : 2027.42/151840 .
- ^ Brown, Dwayne; Wendel, JoAnna; Steigerwald, Bill; Jones, Nancy; Good, Andrew (7 de junio de 2018). «Comunicado 18-050: La NASA encuentra material orgánico antiguo y metano misterioso en Marte». NASA . Archivado desde el original el 7 de junio de 2018 . Consultado el 7 de junio de 2018 .
- ^ NASA (7 de junio de 2018). «Ancient Organics Discovered on Mars – video (03:17)». NASA . Archivado desde el original el 7 de junio de 2018. Consultado el 7 de junio de 2018 .
- ^ Wall, Mike (7 de junio de 2018). «Curiosity Rover encuentra antiguos 'bloques de construcción para la vida' en Marte». Space.com . Archivado desde el original el 7 de junio de 2018. Consultado el 7 de junio de 2018 .
- ^ Chang, Kenneth (7 de junio de 2018). "¿Vida en Marte? El último descubrimiento del rover la pone 'sobre la mesa': la identificación de moléculas orgánicas en rocas del planeta rojo no necesariamente indica que haya vida allí, pasada o presente, pero sí indica que algunos de los componentes básicos estaban presentes". The New York Times . Archivado desde el original el 8 de junio de 2018. Consultado el 8 de junio de 2018 .
- ^ Voosen, Paul (7 de junio de 2018). "El rover de la NASA encuentra mina orgánica en Marte". Science . doi :10.1126/science.aau3992. S2CID 115442477.
- ^ ten Kate, Inge Loes (8 de junio de 2018). "Moléculas orgánicas en Marte". Science . 360 (6393): 1068–1069. Bibcode :2018Sci...360.1068T. doi :10.1126/science.aat2662. hdl : 1874/366378 . PMID 29880670. S2CID 46952468.
- ^ Webster, Christopher R.; et al. (8 de junio de 2018). "Los niveles de fondo de metano en la atmósfera de Marte muestran fuertes variaciones estacionales". Science . 360 (6393): 1093–1096. Bibcode :2018Sci...360.1093W. doi : 10.1126/science.aaq0131 . PMID 29880682.
- ^ Eigenbrode, Jennifer L. ; et al. (8 de junio de 2018). "Materia orgánica preservada en lutitas de 3 mil millones de años en el cráter Gale, Marte". Science . 360 (6393): 1096–1101. Bibcode :2018Sci...360.1096E. doi : 10.1126/science.aas9185 . hdl : 10044/1/60810 . PMID 29880683.
- ^ Richardson, Derek (27 de septiembre de 2016). «Elon Musk muestra su sistema de transporte interplanetario». Spaceflight Insider. Archivado desde el original el 1 de octubre de 2016. Consultado el 3 de octubre de 2016 .
- ^ Oze, C.; Sharma, M. (2005). "Si hay olivino, habrá gas: serpentinización y producción abiogénica de metano en Marte". Geophysical Research Letters . 32 (10): L10203. Bibcode :2005GeoRL..3210203O. doi : 10.1029/2005GL022691 . S2CID 28981740.
- ^ "Cassini explora un mar de metano en Titán". Jet Propulsion Laboratory News . 26 de abril de 2016.
- ^ Comité sobre los Límites de la Vida Orgánica en Sistemas Planetarios, Comité sobre los Orígenes y la Evolución de la Vida, Consejo Nacional de Investigación; Los Límites de la Vida Orgánica en Sistemas Planetarios; The National Academies Press, 2007; página 74.
- ^ McKay, CP; Smith, HD (2005). "Posibilidades de vida metanogénica en metano líquido en la superficie de Titán". Icarus . 178 (1): 274–276. Bibcode :2005Icar..178..274M. doi :10.1016/j.icarus.2005.05.018.
- ^ ab Volta, Alessandro (1777) Lettere del Signor Don Alessandro Volta ... Sull' Aria Inflammable Nativa Delle Paludi Archivado el 6 de noviembre de 2018 en Wayback Machine [Cartas del Signor Don Alessandro Volta ... sobre el aire nativo inflamable de las marismas], Milán, Italia: Giuseppe Marelli.
- ^ Sethi, Anand Kumar (9 de agosto de 2016). Los Edison europeos: Volta, Tesla y Tigerstedt. Springer. ISBN 978-1-137-49222-7.
- ^ "Founders Online: From Benjamin Franklin to Joseph Priestley, 10 April 1774" (Fundadores en línea: de Benjamin Franklin a Joseph Priestley, 10 de abril de 1774). founders.archives.gov . Consultado el 27 de septiembre de 2024 .
- ^ Holland, John (1841). Historia y descripción de los combustibles fósiles, las minas de carbón y el comercio del carbón en Gran Bretaña. Londres, Whittaker and Co. pp. 271–272 . Consultado el 16 de mayo de 2021 .
- ^ Hofmann, AW (1866). «Sobre la acción del tricloruro de fósforo sobre las sales de las monoaminas aromáticas». Actas de la Royal Society de Londres . 15 : 55–62. JSTOR 112588. Archivado desde el original el 3 de mayo de 2017. Consultado el 14 de junio de 2016 .; véase la nota al pie de las págs. 57-58
- ^ McBride, James Michael (1999) "Desarrollo de nombres sistemáticos para los alcanos simples". Departamento de Química, Universidad de Yale (New Haven, Connecticut). Archivado el 16 de marzo de 2012 en Wayback Machine.
- ^ Harper, Douglas. "metano". Diccionario Etimológico Online .
- ^ Jayasundara, Susantha (3 de diciembre de 2014). "¿Existe alguna diferencia al expresar los gases de efecto invernadero como CH4Kg/ha y CH4-C Kg/ha?". ResearchGate . Archivado desde el original el 1 de octubre de 2021. Consultado el 26 de agosto de 2020 .
- ^ "Guía del usuario para estimar las emisiones de dióxido de carbono, metano y óxido nitroso de la agricultura mediante la herramienta de inventario estatal" (PDF) . EPA de EE. UU . . 26 de noviembre de 2019. Archivado (PDF) del original el 1 de octubre de 2021 . Consultado el 26 de agosto de 2020 .
- ^ "¿Qué significa CH4-C? – Definición de CH4-C – CH4-C significa relación metano-carbono". accordionsandslang.com . Archivado desde el original el 11 de abril de 2015 . Consultado el 26 de agosto de 2020 .
- ^ Oficina de Aire y Radiación, EPA de EE. UU. (7 de octubre de 1999). "Emisiones de metano de EE. UU. 1990-2020: inventarios, proyecciones y oportunidades de reducción (EPA 430-R-99-013)" (PDF) . ourenergypolicy.org . Archivado (PDF) del original el 26 de octubre de 2020 . Consultado el 26 de agosto de 2020 .
Fuentes citadas
- Haynes, William M., ed. (2016). Manual de química y física del CRC (97.ª edición). CRC Press . ISBN 9781498754293.
Enlaces externos
- El metano en la tabla periódica de vídeos (Universidad de Nottingham)
- Ficha internacional de seguridad química 0291
- Hidratos de gas (metano): una nueva frontera – Servicio Geológico de los Estados Unidos (archivado el 6 de febrero de 2004)
- Lunsford, Jack H. (2000). "Conversión catalítica de metano en productos químicos y combustibles más útiles: un desafío para el siglo XXI". Catalysis Today . 63 (2–4): 165–174. doi :10.1016/S0920-5861(00)00456-9.
- CDC – Manual para el control del metano en la minería (PDF)








