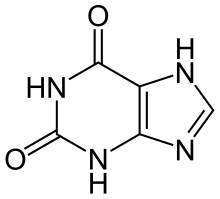
Xantina
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido 3,7-Dihidro-1 H -purina-2,6-diona | |
| Otros nombres 1 H -Purina-2,6-diona | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos | |
| Tarjeta informativa de la ECHA | 100.000.653 |
| |
| BARRIL | |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C5H4N4O2 | |
| Masa molar | 152,11 g/mol |
| Apariencia | Sólido blanco |
| Punto de fusión | se descompone |
| 1 g/14,5 L a 16 °C 1 g/1,4 L a 100 °C | |
| Peligros | |
| NFPA 704 (rombo cortafuegos) | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La xantina ( / ˈzænθiːn / o / ˈzænθaɪn / , del griego antiguo ξανθός xanthós ' amarillo ' por su apariencia blanco amarillenta; arcaicamente ácido xántico ; nombre sistemático 3,7 - dihidropurina -2,6-diona ) es una base de purina que se encuentra en la mayoría de los tejidos y fluidos del cuerpo humano, así como en otros organismos. [ 2] Varios estimulantes se derivan de la xantina, incluida la cafeína , la teofilina y la teobromina . [3] [4]
La xantina es un producto de la vía de degradación de las purinas . [2]
- Se crea a partir de guanina por acción de la guanina desaminasa .
- Se crea a partir de hipoxantina por acción de la xantina oxidorreductasa .
- También se crea a partir de xantosina por la purina nucleósido fosforilasa .
La xantina se convierte posteriormente en ácido úrico por la acción de la enzima xantina oxidasa . [2]
Uso y fabricación
La xantina se utiliza como precursor de fármacos para medicamentos humanos y animales y se fabrica como ingrediente de pesticidas . [2]
Importancia clínica
Los derivados de la xantina (conocidos colectivamente como xantinas ) son un grupo de alcaloides comúnmente utilizados por sus efectos como estimulantes suaves y como broncodilatadores , en particular en el tratamiento de los síntomas del asma o la gripe . [2] A diferencia de otros estimulantes más potentes como las aminas simpaticomiméticas , las xantinas actúan principalmente para oponerse a las acciones de la adenosina y aumentar el estado de alerta en el sistema nervioso central . [2]
Toxicidad
Las metilxantinas ( xantinas metiladas ), que incluyen cafeína , aminofilina , IBMX , paraxantina , pentoxifilina , teobromina , teofilina y 7-metilxantina (heteroxantina), entre otras, afectan las vías respiratorias, aumentan la frecuencia cardíaca y la fuerza de contracción, y en altas concentraciones pueden causar arritmias cardíacas. [2] En dosis altas, pueden provocar convulsiones que son resistentes a los anticonvulsivos. [2] Las metilxantinas inducen secreciones de ácido gástrico y pepsina en el tracto gastrointestinal . [2] Las metilxantinas son metabolizadas por el citocromo P450 en el hígado. [2]
Si se ingieren, inhalan o se exponen a los ojos en grandes cantidades, las xantinas pueden ser dañinas y pueden causar una reacción alérgica si se aplican tópicamente . [2]
Farmacología
En estudios farmacológicos in vitro , las xantinas actúan como:
- inhibidores no selectivos competitivos de la fosfodiesterasa que aumentan el AMPc intracelular , activan la PKA , inhiben la síntesis de TNF-α [2] [5] [4] y leucotrienos [6] y reducen la inflamación y la inmunidad innata [6] y
- antagonistas no selectivos del receptor de adenosina [7] que inhiben la adenosina que induce somnolencia . [2]
Sin embargo, diferentes análogos muestran una potencia variable en los numerosos subtipos, y se ha desarrollado una amplia gama de xantinas sintéticas (algunas no metiladas) en busca de compuestos con mayor selectividad para la enzima fosfodiesterasa o los subtipos de receptores de adenosina . [2] [8] [9] [10] [11] [12]

Cafeína: R 1 = R 2 = R 3 = CH 3
Teobromina: R 1 = H, R 2 = R 3 = CH 3
Teofilina: R 1 = R 2 = CH 3 , R 3 = H
| Nombre | R1 | R2 | R3 | R8 | Nomenclatura IUPAC | Encontrado en |
|---|---|---|---|---|---|---|
| Xantina | yo | yo | yo | yo | 3,7-Dihidro-purina-2,6-diona | Plantas, animales |
| 7-Metilxantina | yo | yo | Capítulo 3 | yo | 7-metil- 3H -purina-2,6-diona | Metabolito de la cafeína y la teobromina |
| Teobromina | yo | Capítulo 3 | Capítulo 3 | yo | 3,7-Dihidro-3,7-dimetil-1H - purina-2,6-diona | Cacao ( chocolate ), yerba mate , cola , guayusa |
| Teofilina | Capítulo 3 | Capítulo 3 | yo | yo | 1,3-Dimetil-7H - purina-2,6-diona | Té , cacao ( chocolate ), yerba mate , cola. |
| Paraxantina | Capítulo 3 | yo | Capítulo 3 | yo | 1,7-Dimetil-7 H -purina-2,6-diona | Animales que han consumido cafeína |
| Cafeína | Capítulo 3 | Capítulo 3 | Capítulo 3 | yo | 1,3,7-Trimetil-1 H -purina-2,6(3 H ,7 H )-diona | Café , guaraná , yerba mate , té , cola , guayusa , cacao ( chocolate ) |
| 8-Cloroteofilina | Capítulo 3 | Capítulo 3 | yo | Cl | 8-Cloro-1,3-dimetil-7H - purina-2,6-diona | Ingrediente farmacéutico sintético |
| 8-Bromoteofilina | Capítulo 3 | Capítulo 3 | yo | Es | 8-Bromo-1,3-dimetil-7H - purina-2,6-diona | Medicamento diurético Pamabrom |
| Diprofilina | Capítulo 3 | Capítulo 3 | C3H7O2 | yo | 7-(2,3-Dihidroxipropil)-1,3-dimetil-3,7-dihidro-1 H -purina-2,6-diona | Ingrediente farmacéutico sintético |
| IBMX | Capítulo 3 | C4H9 | yo | yo | 1-Metil-3-(2-metilpropil)-7H - purina-2,6-diona | |
| Ácido úrico | yo | yo | yo | Oh | 7,9-Dihidro-1 H -purina-2,6,8(3 H )-triona | Subproducto del metabolismo de los nucleótidos de purina y componente normal de la orina. |
Patología
Las personas con trastornos genéticos raros , específicamente xantinuria y síndrome de Lesch-Nyhan , carecen de suficiente xantina oxidasa y no pueden convertir la xantina en ácido úrico . [2]
Posible formación en ausencia de vida
Estudios publicados en 2008, basados en las proporciones isotópicas de 12 C/ 13 C de los compuestos orgánicos encontrados en el meteorito Murchison , sugirieron que la xantina y sustancias químicas relacionadas, incluido el componente de ARN uracilo , se han formado extraterrestremente . [13] [14] En agosto de 2011, se publicó un informe, basado en estudios de la NASA con meteoritos encontrados en la Tierra, que sugería que la xantina y moléculas orgánicas relacionadas, incluidos los componentes de ADN y ARN adenina y guanina , se encontraron en el espacio exterior . [15] [16] [17]
Véase también
- DMPX
- Meteorito de Murchison
- Intoxicación por teobromina
- Xanteno
- Xantona
- Xanthidrol
- Enfermedad de cálculos renales
Referencias
- ^ Índice Merck , 11.ª edición, 9968 .
- ^ abcdefghijklmno "Xantina, CID 1188". PubChem, Biblioteca Nacional de Medicina, Institutos Nacionales de Salud de EE. UU. 2019. Consultado el 28 de septiembre de 2019 .
- ^ Spiller, Gene A. (1998). Cafeína . Boca Ratón: Prensa CRC. ISBN 0-8493-2647-8.
- ^ ab Katzung, Bertram G. (1995). Farmacología básica y clínica . East Norwalk, Connecticut: Paramount Publishing. págs. 310, 311. ISBN 0-8385-0619-4.
- ^ Marques LJ, Zheng L, Poulakis N, Guzman J, Costabel U (febrero de 1999). "La pentoxifilina inhibe la producción de TNF-alfa de los macrófagos alveolares humanos". Soy. J. Respirar. Crítico. Cuidado médico . 159 (2): 508–11. doi :10.1164/ajrccm.159.2.9804085. PMID 9927365.
- ^ ab Peters-Golden M, Canetti C, Mancuso P, Coffey MJ (2005). "Leucotrienos: mediadores poco apreciados de las respuestas inmunitarias innatas". J. Immunol . 174 (2): 589–94. doi : 10.4049/jimmunol.174.2.589 . PMID: 15634873.
- ^ Daly JW, Jacobson KA, Ukena D (1987). "Receptores de adenosina: desarrollo de agonistas y antagonistas selectivos". Prog Clin Biol Res . 230 (1): 41–63. PMID 3588607.
- ^ Daly JW, Padgett WL, Shamim MT (julio de 1986). "Análogos de la cafeína y la teofilina: efecto de las alteraciones estructurales sobre la afinidad en los receptores de adenosina". Journal of Medicinal Chemistry . 29 (7): 1305–8. doi :10.1021/jm00157a035. PMID 3806581.
- ^ Daly JW, Jacobson KA, Ukena D (1987). "Receptores de adenosina: desarrollo de agonistas y antagonistas selectivos". Progreso en la investigación clínica y biológica . 230 : 41–63. PMID 3588607.
- ^ Daly JW, Hide I, Müller CE, Shamim M (1991). "Análogos de cafeína: relaciones estructura-actividad en los receptores de adenosina". Farmacología . 42 (6): 309–21. doi :10.1159/000138813. PMID 1658821.
- ^ González MP, Terán C, Teijeira M (mayo de 2008). "Búsqueda de nuevos ligandos antagonistas para los receptores de adenosina desde el punto de vista de QSAR. ¿Qué tan cerca estamos?". Medicinal Research Reviews . 28 (3): 329–71. doi :10.1002/med.20108. PMID 17668454. S2CID 23923058.
- ^ Baraldi PG, Tabrizi MA, Gessi S, Borea PA (enero de 2008). "Antagonistas del receptor de adenosina: traducción de la química medicinal y la farmacología a la utilidad clínica". Chemical Reviews . 108 (1): 238–63. doi :10.1021/cr0682195. PMID 18181659.
- ^ Martins, Z.; Botta, O.; Fogel, ML; Sephton, MA; Glavin, DP; Watson, JS; Dworkin, JP; Schwartz, AW; Ehrenfreund, P. (2008). "Nucleobases extraterrestres en el meteorito Murchison". Earth and Planetary Science Letters . 270 (1–2): 130–136. arXiv : 0806.2286 . Código Bibliográfico :2008E&PSL.270..130M. doi :10.1016/j.epsl.2008.03.026. S2CID 14309508.
- ^ Redacción AFP (13 de junio de 2008). «Todos podríamos ser extraterrestres: estudio». AFP . Archivado desde el original el 17 de junio de 2008. Consultado el 14 de agosto de 2011 .
- ^ Callahan, MP; Smith, KE; Cleaves, HJ; Ruzicka, J.; Stern, JC; Glavin, DP; House, CH; Dworkin, JP (2011). "Los meteoritos carbonáceos contienen una amplia gama de nucleobases extraterrestres". Actas de la Academia Nacional de Ciencias . 108 (34): 13995–8. Bibcode :2011PNAS..10813995C. doi : 10.1073/pnas.1106493108 . PMC 3161613 . PMID 21836052.
- ^ Steigerwald, John (8 de agosto de 2011). "Investigadores de la NASA: los bloques de construcción del ADN se pueden fabricar en el espacio". NASA . Consultado el 10 de agosto de 2011 .
- ^ Personal de ScienceDaily (9 de agosto de 2011). «Los componentes básicos del ADN se pueden fabricar en el espacio, según sugiere la evidencia de la NASA». ScienceDaily . Consultado el 9 de agosto de 2011 .



