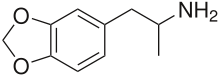
3,4-Metilendioxianfetamina
 | |
 | |
| Datos clínicos | |
|---|---|
| Vías de administración | Oral, sublingual, insuflación, intravenosa. |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Metabolismo | Hepático ( CYP ampliamente involucrado) |
| Excreción | Renal |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.230.706 |
| Datos químicos y físicos | |
| Fórmula | C10H13NO2 |
| Masa molar | 179,219 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
 norte norte Y (¿que es esto?) (verificar) Y (¿que es esto?) (verificar) | |
La 3,4-metilendioxianfetamina (también conocida como MDA y sass ) es un empatógeno-entactógeno , psicoestimulante y droga psicodélica de la familia de las anfetaminas que se encuentra principalmente como droga recreativa . En su farmacología , la MDA es un agente liberador de serotonina-norepinefrina-dopamina (SNDRA). En la mayoría de los países, la droga es una sustancia controlada y su posesión y venta son ilegales.
La MDA rara vez se utiliza como droga recreativa en comparación con otras anfetaminas; sin embargo, sigue siendo ampliamente utilizada debido a que es un metabolito primario, [2] el producto de la N-desalquilación hepática, [3] de la MDMA (éxtasis). También es un adulterante común de la MDMA producida ilícitamente. [4] [5]
Usos
Médico
Actualmente el MDA no tiene ningún uso médico aceptado.
Recreativo
El MDA se compra, se vende y se utiliza como una «droga del amor» recreativa, debido a que mejora el estado de ánimo y la empatía . [6] A veces se cita una dosis recreativa de MDA entre 100 y 160 mg. [7]
Efectos adversos
El MDA puede producir efectos neurotóxicos serotoninérgicos en roedores, [8] [9] que se cree que se activan por el metabolismo inicial del MDA. [3] Además, el MDA activa una respuesta de la neuroglia , aunque esta desaparece después del uso. [8]
Sobredosis
Los síntomas de toxicidad aguda pueden incluir agitación , sudoración, aumento de la presión arterial y la frecuencia cardíaca , aumento drástico de la temperatura corporal , convulsiones y muerte. La muerte suele estar causada por efectos cardíacos y posterior hemorragia en el cerebro ( accidente cerebrovascular ). [10] [ cita médica necesaria ]
Farmacología
Farmacodinamia
El MDA es un sustrato de los transportadores de serotonina , noradrenalina , dopamina y monoamina vesicular , así como un agonista de TAAR1 , [11] y por estas razones actúa como un inhibidor de la recaptación y agente liberador de serotonina , noradrenalina y dopamina (es decir, es un SNDRA) .Agente liberador de serotonina, noradrenalina y dopamina). [12] También es un agonista de los receptores de serotonina 5-HT 2A , [13] 5-HT 2B , [14] y 5-HT 2C [15] y muestra afinidad por los receptores adrenérgicos α 2A - , α 2B - y α 2C - y los receptores de serotonina 5-HT 1A y 5-HT 7 . [16]
El isómero óptico ( S ) del MDA es más potente que el isómero óptico ( R ) como psicoestimulante y posee mayor afinidad por los tres transportadores de monoamina .
En términos de los efectos subjetivos y conductuales del MDA, se cree que la liberación de serotonina es necesaria para sus efectos empatógenos, la liberación de dopamina es necesaria para sus efectos euforizantes ( gratificantes y adictivos ), la liberación de dopamina y norepinefrina es necesaria para sus efectos psicoestimulantes , y el agonismo directo del receptor de serotonina 5-HT 2A es necesario para sus efectos psicodélicos leves. [ cita médica necesaria ]
Farmacocinética
Se ha informado que la duración del efecto del fármaco es de aproximadamente 6 a 8 horas. [7]
Química
La MDA es un derivado sustituido de la fenetilamina y la anfetamina metilendioxilada . En relación con otras fenetilaminas y anfetaminas, es el derivado 3,4-metilendioxi, α-metil de la β-feniletilamina , el derivado 3,4-metilendioxi de la anfetamina y el derivado N - desmetil del MDMA.
Sinónimos
Además de 3,4-metilendioxianfetamina , la MDA también se conoce por otros sinónimos químicos como los siguientes:
- α-Metil-3,4-metilendioxi-β-feniletilamina
- 1-(3,4-metilendioxifenil)-2-propanamina
- 1-(1,3-Benzodioxol-5-il)-2-propanamina
Síntesis
El MDA se sintetiza normalmente a partir de aceites esenciales como el safrol o el piperonal . Los métodos habituales para obtener estos precursores incluyen:
- Reacción del grupo funcional alqueno del safrol con un ácido mineral que contiene halógeno seguida de alquilación de amina . [17] [18]
- Oxidación de Wacker de safrol para producir 3,4-metilendioxifenilpropan-2-ona (MDP2P) seguida de aminación reductora [18] [19] o mediante reducción de su oxima . [20]
- Reacción de Henry de piperonal con nitroetano seguida de reducción del compuesto nitro . [18] [21] [22] [23] [24]
- La reacción de Darzens sobre heliotropina también fue realizada por J. Elks, et al. [25] Esto produce MDP2P , que luego se sometió a una reacción de Leuckart.
- El método clandestino de los “dos perros” o “el drogadicto”, que comienza con el helional como precursor. Primero se crea una oxima utilizando hidroxilamina. Luego se realiza un reordenamiento de Beckmann con acetato de níquel para formar la amida. Luego se realiza un reordenamiento de Hofmann para formar la amina de base libre de MDA. Luego se purifica con una extracción ácido-base . [26]
Detección en fluidos corporales
La MDA se puede cuantificar en sangre, plasma u orina para controlar su uso, confirmar un diagnóstico de envenenamiento o ayudar en la investigación forense de una infracción de tránsito u otra infracción penal o una muerte súbita. Algunos programas de detección del abuso de drogas se basan en el cabello, la saliva o el sudor como muestras. La mayoría de las pruebas de detección de inmunoensayo de anfetaminas comerciales reaccionan de forma cruzada de manera significativa con la MDA y los principales metabolitos de la MDMA, pero las técnicas cromatográficas pueden distinguir fácilmente y medir por separado cada una de estas sustancias. Las concentraciones de MDA en la sangre o la orina de una persona que ha tomado solo MDMA son, en general, menos del 10% de las de la droga original. [27] [28] [29]
Derivados
El MDA constituye parte de la estructura central del agonista del receptor β-adrenérgico protokylol .
Historia
El MDA fue sintetizado por primera vez por Carl Mannich y W. Jacobsohn en 1910. [20] Fue ingerido por primera vez en julio de 1930 por Gordon Alles , quien más tarde licenció el fármaco a Smith, Kline & French . [30] El MDA se utilizó por primera vez en pruebas con animales en 1939, y los ensayos en humanos comenzaron en 1941 en la exploración de posibles terapias para la enfermedad de Parkinson . De 1949 a 1957, más de quinientos sujetos humanos recibieron MDA en una investigación de su uso potencial como antidepresivo y/o anoréxico por Smith, Kline & French . El Ejército de los Estados Unidos también experimentó con el fármaco, cuyo nombre en código era EA-1298, mientras trabajaba para desarrollar un fármaco de la verdad o un agente incapacitante. Harold Blauer murió en enero de 1953 después de que le inyectaran por vía intravenosa, sin su conocimiento o consentimiento, 450 mg del fármaco como parte del Proyecto MKUltra . La MDA fue patentada como ataráctico por Smith, Kline & French en 1960, y como anorexígeno bajo el nombre comercial "Amphedoxamine" en 1961. La MDA comenzó a aparecer en el panorama de las drogas recreativas alrededor de 1963 a 1964. En ese entonces era barata y fácilmente disponible como sustancia química de investigación en varias casas de suministros científicos. Varios investigadores, entre ellos Claudio Naranjo y Richard Yensen, han explorado la MDA en el campo de la psicoterapia . [31] [32]
Sociedad y cultura

Nombre
Cuando la MDA estaba en desarrollo como posible fármaco farmacéutico, se le dio el nombre común internacional (DCI) de tenamfetamina .
Estatus legal
Australia
La MDA es una sustancia prohibida de la lista 9 según las Normas sobre venenos . [33] Una sustancia de la lista 9 está catalogada como "Sustancias que pueden ser objeto de abuso o uso indebido, cuya fabricación, posesión, venta o uso debe estar prohibido por ley, excepto cuando sea necesario para investigación médica o científica, o para fines analíticos, de enseñanza o de capacitación con la aprobación de las autoridades sanitarias de la Commonwealth y/o de los estados o territorios". [33]
Estados Unidos
La MDA es una sustancia controlada de la Lista I en los EE. UU.
Investigación
En 2010, se estudió la capacidad del MDA para invocar experiencias místicas y alterar la visión en voluntarios sanos. El estudio concluyó que el MDA es una "herramienta potencial para investigar las experiencias místicas y la percepción visual". [7]
En un estudio doble ciego de 2019 se administraron tanto MDA como MDMA a voluntarios sanos. El estudio descubrió que el MDA compartía muchas propiedades con el MDMA, incluidos los efectos entactógenos y estimulantes, pero en general duraba más y producía mayores aumentos en los efectos similares a los psicodélicos, como imágenes complejas, sinestesia y experiencias espirituales. [34]
Véase también
Referencias
- ^ "RDC Nº 804 - Listas de Substâncias Entorpecentes, Psicotrópicas, Precursoras e Outras sob Controle Especial" [Resolución del Consejo Colegiado N° 804 - Listas de Sustancias Estupefacientes, Psicotrópicas, Precursoras y Otras bajo Control Especial]. Agencia Brasileña de Regulación Sanitaria (en portugués brasileño). Diário Oficial da União (publicado el 25 de julio de 2023). 24 de julio de 2023. Archivado desde el original el 27 de agosto de 2023 . Consultado el 27 de agosto de 2023 .
- ^ Crean RD, Davis SA, Von Huben SN, Lay CC, Katner SN, Taffe MA (octubre de 2006). "Efectos de (+/-)3,4-metilendioximetanfetamina, (+/-)3,4-metilendioxianfetamina y metanfetamina sobre la temperatura y la actividad en macacos rhesus". Neurociencia . 142 (2): 515–525. doi :10.1016/j.neuroscience.2006.06.033. PMC 1853374 . PMID 16876329.
- ^ ab de la Torre R, Farré M, Roset PN, Pizarro N, Abanades S, Segura M, et al. (abril de 2004). "Farmacología humana del MDMA: farmacocinética, metabolismo y disposición". Monitorización terapéutica de fármacos . 26 (2): 137–144. doi :10.1097/00007691-200404000-00009. PMID 15228154.
- ^ "EcstasyData.org: Estadísticas de resultados de pruebas: sustancias por año". EcstasyData.org . Consultado el 27 de junio de 2017 .
- ^ "Trans European Drug Information" (Información transeuropea sobre medicamentos). idpc.net . Archivado desde el original el 4 de noviembre de 2021. Consultado el 27 de junio de 2017 .
- ^ Monte AP, Marona-Lewicka D, Cozzi NV, Nichols DE (noviembre de 1993). "Síntesis y examen farmacológico de análogos de benzofurano, indano y tetralina de 3,4-(metilendioxi)anfetamina". Journal of Medicinal Chemistry . 36 (23): 3700–3706. doi :10.1021/jm00075a027. PMID 8246240.
- ^ abc Baggott MJ, Siegrist JD, Galloway GP, Robertson LC, Coyle JR, Mendelson JE (diciembre de 2010). "Investigación de los mecanismos de las visiones inducidas por alucinógenos utilizando 3,4-metilendioxianfetamina (MDA): un ensayo controlado aleatorio en humanos". PLOS ONE . 5 (12): e14074. Bibcode :2010PLoSO...514074B. doi : 10.1371/journal.pone.0014074 . PMC 2996283 . PMID 21152030.
- ^ ab Herndon JM, Cholanians AB, Lau SS, Monks TJ (marzo de 2014). "Respuesta de las células gliales a la 3,4-(+/-)-metilendioximetanfetamina y sus metabolitos". Toxicological Sciences . 138 (1): 130–138. doi :10.1093/toxsci/kft275. PMC 3930364 . PMID 24299738.
- ^ Kalant H (octubre de 2001). "La farmacología y toxicología del "éxtasis" (MDMA) y drogas relacionadas". CMAJ . 165 (7): 917–928. PMC 81503 . PMID 11599334.
- ^ Diaz J (1996). Cómo influyen las drogas en el comportamiento . Englewood Cliffs: Prentice Hall.
- ^ Lewin AH, Miller GM, Gilmour B (diciembre de 2011). "El receptor 1 asociado a aminas traza es un sitio de unión estereoselectivo para compuestos de la clase de las anfetaminas". Química bioorgánica y medicinal . 19 (23): 7044–7048. doi :10.1016/j.bmc.2011.10.007. PMC 3236098. PMID 22037049 .
- ^ Rothman RB, Baumann MH (2006). "Potencial terapéutico de los sustratos transportadores de monoamina". Temas actuales en química medicinal . 6 (17): 1845–1859. doi :10.2174/156802606778249766. PMID 17017961.
- ^ Di Giovanni G, Di Matteo V, Esposito E (2008). Interacción serotonina-dopamina: evidencia experimental y relevancia terapéutica. Elsevier. pp. 294–. ISBN 978-0-444-53235-0.
- ^ Rothman RB, Baumann MH (mayo de 2009). "Fármacos serotoninérgicos y enfermedad cardíaca valvular". Opinión de expertos sobre seguridad de los fármacos . 8 (3): 317–329. doi :10.1517/14740330902931524. PMC 2695569 . PMID 19505264.
- ^ Nash JF, Roth BL , Brodkin JD, Nichols DE, Gudelsky GA (agosto de 1994). "Efecto de los isómeros R(−) y S(+) de MDA y MDMA en el recambio de fosfatidil inositol en células cultivadas que expresan receptores 5-HT2A o 5-HT2C". Neuroscience Letters . 177 (1–2): 111–115. doi :10.1016/0304-3940(94)90057-4. PMID 7824160. S2CID 41352480.
- ^ Ray TS (febrero de 2010). "Psicodélicos y el receptoroma humano". PLOS ONE . 5 (2): e9019. Bibcode :2010PLoSO...5.9019R. doi : 10.1371/journal.pone.0009019 . PMC 2814854 . PMID 20126400.
- ^ Muszynski E (1961). "[Producción de algunos derivados de la anfetamina]". Acta Poloniae Pharmaceutica . 18 : 471–478. PMID 14477621.
- ^ abc Shulgin A, Manning T, Daley P (2011). Índice Shulgin, volumen uno: Fenetilaminas psicodélicas y compuestos relacionados (1.ª ed.). Berkeley, CA: Transform Press. pág. 165. ISBN 978-0-9630096-3-0.
- ^ Noggle FT, DeRuiter J, Long MJ (1986). "Identificación espectrofotométrica y cromatográfica líquida de 3,4-metilendioxifenilisopropilamina y sus homólogos N-metil y N-etilo". Revista de la Asociación de Químicos Analíticos Oficiales . 69 (4): 681–686. PMID 2875058.
- ^ ab Mannich C, Jacobsohn W, Mannich HC (1910). "Über oxifenilalquilamina y dioxifenilalquilamina". Berichte der Deutschen Chemischen Gesellschaft . 41 (1): 189-197. doi :10.1002/cber.19100430126.
- ^ Ho BT, McIsaac WM, An R, Tansey LW, Walker KE, Englert LF, Noel MB (enero de 1970). "Análogos de alfa-metilfenetilamina (anfetamina). I. Síntesis y actividad farmacológica de algunos análogos metoxi y/o metilo". Journal of Medicinal Chemistry . 13 (1): 26–30. doi :10.1021/jm00295a007. PMID 5412110.
- ^ Butterick JR, Unrau AM (1974). "Reducción de β-nitrostireno con bis-(2-metoxietoxi)-dihidruro de aluminio y sodio. Una ruta conveniente para obtener fenilisopropilaminas sustituidas". Journal of the Chemical Society, Chemical Communications . 8 (8): 307–308. doi :10.1039/C39740000307.
- ^ Toshitaka O, Hiroaka A (1992). "Síntesis de derivados de fenetilamina como alucinógeno". Revista japonesa de toxicología y salud ambiental . 38 (6): 571–580. doi : 10.1248/jhs1956.38.571 . Consultado el 20 de junio de 2014 .
- ^ Shulgin A, Shulgin A (1991). PiHKAL: Una historia de amor químico. Lafayette, CA: Transform Press. ISBN 978-0-9630096-0-9.
- ^ Elks J, Hey DH (1943). "7. β-3: 4-Metilendioxifenilisopropilamina". J. Chem. Soc. : 15–16. doi :10.1039/JR9430000015. ISSN 0368-1769.
- ^ "¿El método de síntesis clandestina 'Two Dogs' utiliza precursores que no están regulados legalmente en la costa este de Australia? por Victor Chiruta, Robert D Renshaw :: SSRN". 28 de noviembre de 2021. SSRN 3973132 . Consultado el 11 de febrero de 2024 .
- ^ Kolbrich EA, Goodwin RS, Gorelick DA, Hayes RJ, Stein EA, Huestis MA. Farmacocinética plasmática de 3,4-metilendioximetanfetamina
después de la administración oral controlada a adultos jóvenes. Ther. Drug Monit. 30: 320–332, 2008. - ^ Barnes AJ, De Martinis BS, Gorelick DA, Goodwin RS, Kolbrich EA, Huestis MA (marzo de 2009). "Disposición de MDMA y metabolitos en el sudor humano tras la administración controlada de MDMA". Química clínica . 55 (3): 454–462. doi :10.1373/clinchem.2008.117093. PMC 2669283 . PMID 19168553.
- ^ R. Baselt, Disposición de fármacos y productos químicos tóxicos en el hombre , 9.ª edición, Biomedical Publications, Seal Beach, California, 2011, págs. 1078-1080.
- ^ "El primer viaje con MDA y la medición de la 'experiencia mística' después de la MDA, el LSD y la psilocibina". Investigación psicodélica. 18 de julio de 2008. Archivado desde el original el 13 de julio de 2012.
- ^ Naranjo C, Shulgin AT, Sargent T (1967). "Evaluación de la 3,4-metilendioxianfetamina (MDA) como complemento a la psicoterapia". Medicina et Pharmacologia Experimentalis. Revista Internacional de Medicina Experimental . 17 (4): 359–364. doi :10.1159/000137100. PMID 5631047.
- ^ Yensen R, Di Leo FB, Rhead JC, Richards WA, Soskin RA, Turek B, Kurland AA (octubre de 1976). "Psicoterapia asistida por MDA con pacientes ambulatorios neuróticos: un estudio piloto". Revista de enfermedades nerviosas y mentales . 163 (4): 233–245. doi :10.1097/00005053-197610000-00002. PMID 972325. S2CID 41155810.
- ^ Norma sobre venenos (octubre de 2015) comlaw.gov.au
- ^ Baggott MJ, Garrison KJ, Coyle JR, Galloway GP, Barnes AJ, Huestis MA, Mendelson JE (15 de marzo de 2019). "Efectos de la anfetamina psicodélica MDA (3,4-metilendioxianfetamina) en voluntarios sanos". Revista de drogas psicoactivas . 51 (2): 108–117. doi :10.1080/02791072.2019.1593560. PMID 30967099. S2CID 106410946.
Enlaces externos
- Bóveda de MDA de Erowid
- Entrada de la MDA en PiHKAL
- Entrada de MDA en PiHKAL • información
