Melanina
| Melanina | |
|---|---|
 Una posible estructura de la eumelanina | |
| Tipo de material | Biopolímero heterogéneo |

Melanina ( / ˈ m ɛ l ə n ɪ n / ; delgriego antiguo μέλας(mélas) 'negro, oscuro') es una familia debiomoléculasorganizadas comooligómerosopolímeros, que entre otras funciones proporcionan lospigmentosde muchosorganismos.[1]Los pigmentos de melanina se producen en un grupo especializado de células conocidas comomelanocitos.
Existen cinco tipos básicos de melanina: eumelanina, feomelanina, neuromelanina , alomelanina y piomelanina. [2] La eumelanina se produce a través de un proceso químico de múltiples etapas conocido como melanogénesis , donde la oxidación del aminoácido tirosina es seguida por la polimerización . La eumelanina es el tipo más común. La feomelanina, que se produce cuando los melanocitos funcionan mal debido a la derivación del gen a su formato recesivo, es un derivado de cisteína que contiene porciones de polibenzotiazina que son en gran parte responsables del tinte rojo o amarillo dado a algunos colores de piel o cabello. La neuromelanina se encuentra en el cerebro. Se han realizado investigaciones para investigar su eficacia en el tratamiento de trastornos neurodegenerativos como el Parkinson . [3] La alomelanina y la piomelanina son dos tipos de melanina libre de nitrógeno.
En la piel humana, la melanogénesis se inicia con la exposición a la radiación UV , lo que hace que la piel se oscurezca. La eumelanina es un absorbente eficaz de la luz; el pigmento es capaz de disipar más del 99,9% de la radiación UV absorbida. [4] Debido a esta propiedad, se cree que la eumelanina protege las células de la piel del daño de la radiación UVA y UVB, reduciendo el riesgo de agotamiento del folato y la degradación dérmica. La exposición a la radiación UV está asociada con un mayor riesgo de melanoma maligno , un cáncer de melanocitos (células de melanina). Los estudios han demostrado una menor incidencia de cáncer de piel en individuos con melanina más concentrada, es decir, un tono de piel más oscuro . [5]
Tipos de melanina
Eumelanina

La eumelanina tiene dos formas ligadas al 5,6-dihidroxiindol (DHI) y al ácido 5,6-dihidroxiindol-2-carboxílico (DHICA). La eumelanina derivada del DHI es de color marrón oscuro o negro e insoluble, y la eumelanina derivada del DHICA es más clara y soluble en álcali. Ambas eumelaninas surgen de la oxidación de la tirosina en orgánulos especializados llamados melanosomas . Esta reacción es catalizada por la enzima tirosinasa . El producto inicial, la dopaquinona , puede transformarse en 5,6-dihidroxiindol (DHI) o en ácido 5,6-dihidroxiindol-2-carboxílico (DHICA). El DHI y el DHICA se oxidan y luego se polimerizan para formar las dos eumelaninas. [6]
En condiciones naturales, el DHI y el DHICA suelen copolimerizarse, lo que da lugar a una variedad de polímeros de eumelanina. Estos polímeros contribuyen a la variedad de componentes de melanina en la piel y el cabello humanos, que van desde la feomelanina amarilla clara/roja hasta la eumelanina marrón clara enriquecida con DHICA y la eumelanina marrón oscura o negra enriquecida con DHI. Estos polímeros finales difieren en solubilidad y color. [6]
El análisis de la piel altamente pigmentada ( tipo Fitzpatrick V y VI) descubre que la DHI-eumelanina comprende la porción más grande, aproximadamente 60-70%, seguida de DHICA-eumelanina con 25-35%, y feomelanina solo 2-8%. Cabe destacar que, si bien se produce un enriquecimiento de DHI-eumelanina durante el bronceado solar , se acompaña de una disminución de DHICA-eumelanina y feomelanina. [6] Una pequeña cantidad de eumelanina negra en ausencia de otros pigmentos causa cabello gris. Una pequeña cantidad de eumelanina en ausencia de otros pigmentos causa cabello rubio. [7] La eumelanina está presente en la piel y el cabello, etc.
Feomelanina
Las feomelaninas (o feomelaninas) imparten una gama de colores que van del amarillento al rojizo. [8] Las feomelaninas se concentran particularmente en los labios, los pezones, el glande del pene y la vagina. [9] Cuando una pequeña cantidad de eumelanina en el cabello (que de otro modo causaría cabello rubio) se mezcla con feomelanina, el resultado es un cabello anaranjado, que normalmente se llama cabello "rojo" o "pelirrojo" . La feomelanina también está presente en la piel y, en consecuencia, los pelirrojos también suelen tener un tono más rosado en su piel. La exposición de la piel a la luz ultravioleta aumenta el contenido de feomelanina, al igual que ocurre con la eumelanina; pero en lugar de absorber la luz, la feomelanina dentro del cabello y la piel refleja la luz amarilla a roja, lo que puede aumentar el daño por la exposición a la radiación UV. [10]
La producción de feomelanina depende en gran medida de la disponibilidad de cisteína , que se transporta al melanosoma y reacciona con la dopaquinona para formar cis-dopa. Luego, la cis-dopa sufre varias transformaciones antes de formar feomelanina. [6] En términos químicos, las feomelaninas se diferencian de las eumelaninas en que la estructura del oligómero incorpora unidades de benzotiazina y benzotiazol que se producen, [11] en lugar de DHI y DHICA , cuando está presente el aminoácido L-cisteína .
Las feomelaninas, a diferencia de las euemaninas, son raras en los organismos inferiores [12] y se afirma que son una "innovación evolutiva en el linaje de los tetrápodos" [13], pero investigaciones recientes también las encuentran en algunos peces. [14]
Neuromelanina
La neuromelanina (NM) es un pigmento polimérico insoluble producido en poblaciones específicas de neuronas catecolaminérgicas del cerebro. Los humanos tienen la mayor cantidad de NM, que está presente en cantidades menores en otros primates y totalmente ausente en muchas otras especies. [15] La función biológica sigue siendo desconocida, aunque se ha demostrado que la NM humana se une de manera eficiente a metales de transición como el hierro, así como a otras moléculas potencialmente tóxicas. Por lo tanto, puede desempeñar un papel crucial en la apoptosis y la enfermedad de Parkinson relacionada . [16]
Otras formas de melaninas
Hasta los años 60, la melanina se clasificaba en eumelanina y feomelanina. Sin embargo, en 1955 se descubrió una melanina asociada a las células nerviosas, la neuromelanina. En 1972 se descubrió una forma soluble en agua, la piomelanina. En 1976 se encontró en la naturaleza la alomelanina, la quinta forma de las melaninas. [2]
Peptidomelanina


La peptidomelanina es otra forma soluble en agua de melanina. [17] Se descubrió que se secretaba al medio circundante mediante la germinación de esporas de Aspergillus niger (cepa: melanoliber). La peptidomelanina se forma como un copolímero entre la eumelanina L-DOPA y péptidos cortos que forman una "corona", que son responsables de la solubilidad de la sustancia. Las cadenas de péptidos están unidas al polímero central L-DOPA a través de enlaces peptídicos. Esto condujo a un proceso biosintético propuesto que implica la hidroxilación de péptidos tirosinilados formados a través de proteasas durante la esporogénesis, que luego se incorporan de forma autooxidativa a un polímero central L-DOPA en crecimiento.
Selenomelanina
Es posible enriquecer la melanina con selenio en lugar de azufre . Este análogo de selenio de la feomelanina se ha sintetizado con éxito a través de rutas químicas y biosintéticas utilizando selenocistina como materia prima. [18] Debido al mayor número atómico del selenio, se puede esperar que la selenomelanina obtenida proporcione una mejor protección contra la radiación ionizante en comparación con las otras formas conocidas de melanina. Esta protección se ha demostrado con experimentos de radiación en células humanas y bacterias, lo que abre la posibilidad de aplicaciones en viajes espaciales. [19]
Tricocromos
Los tricocromos (antes llamados tricosiderinas) son pigmentos producidos a partir de la misma vía metabólica que las eumelaninas y las feomelaninas, pero a diferencia de estas moléculas, tienen un peso molecular bajo. Se encuentran en algunos cabellos humanos de color rojo. [20]
Humanos

En los seres humanos, la melanina es el principal determinante del color de la piel . También se encuentra en el cabello, el tejido pigmentado que se encuentra debajo del iris del ojo y la estría vascular del oído interno . En el cerebro, los tejidos con melanina incluyen el bulbo raquídeo y las neuronas que contienen pigmento dentro de áreas del tronco encefálico , como el locus coeruleus . También se encuentra en la zona reticularis de la glándula suprarrenal . [12]
La melanina de la piel es producida por los melanocitos , que se encuentran en la capa basal de la epidermis . Aunque, en general, los seres humanos poseen una concentración similar de melanocitos en su piel, los melanocitos en algunos individuos y grupos étnicos producen cantidades variables de melanina. La proporción de eumelanina (74%) y feomelanina (26%) en la epidermis es constante independientemente del grado de pigmentación. [21] Algunos humanos tienen muy poca o ninguna síntesis de melanina en sus cuerpos, una condición conocida como albinismo . [22]
Como la melanina es un agregado de moléculas más pequeñas, existen muchos tipos diferentes de melanina con diferentes proporciones y patrones de unión de estas moléculas componentes. Tanto la feomelanina como la eumelanina se encuentran en la piel y el cabello humanos, pero la eumelanina es la melanina más abundante en los humanos, así como la forma que es más probable que sea deficiente en el albinismo. [23]
Otros organismos
Las melaninas tienen papeles y funciones muy diversos en varios organismos. Una forma de melanina compone la tinta utilizada por muchos cefalópodos (ver tinta de cefalópodo ) como mecanismo de defensa contra los depredadores. Las melaninas también protegen a los microorganismos, como las bacterias y los hongos, contra estreses que implican daño celular como la radiación UV del sol y las especies reactivas de oxígeno . La melanina también protege contra el daño de las altas temperaturas, estreses químicos (como metales pesados y agentes oxidantes ) y amenazas bioquímicas (como las defensas del huésped contra microbios invasores). [24] Por lo tanto, en muchos microbios patógenos (por ejemplo, en Cryptococcus neoformans , un hongo) las melaninas parecen desempeñar papeles importantes en la virulencia y patogenicidad al proteger al microbio contra las respuestas inmunes de su huésped . En los invertebrados, un aspecto importante del sistema de defensa inmune innato contra patógenos invasores involucra a la melanina. A los pocos minutos de la infección, el microbio queda encapsulado en melanina (melanización) y se cree que la generación de radicales libres durante la formación de esta cápsula ayuda a matarlos. [25] Algunos tipos de hongos, llamados hongos radiotróficos , parecen ser capaces de utilizar la melanina como pigmento fotosintético que les permite capturar rayos gamma [26] y aprovechar esta energía para el crecimiento. [27]
En los peces , la melanina no solo se encuentra en la piel, sino también en órganos internos como los ojos. La mayoría de las especies de peces utilizan eumelanina, [28] [13] pero Stegastes apicalis y Cyprinus carpio utilizan feomelanina en su lugar. [14] [29]
Las plumas más oscuras de las aves deben su color a la melanina y son menos fácilmente degradadas por las bacterias que las no pigmentadas o las que contienen pigmentos carotenoides . [30] Las plumas que contienen melanina también son un 39% más resistentes a la abrasión que las que no la contienen porque los gránulos de melanina ayudan a llenar el espacio entre las hebras de queratina que forman las plumas. [31] [32] La síntesis de feomelanina en las aves implica el consumo de cisteína, un aminoácido semiesencial que es necesario para la síntesis del antioxidante glutatión (GSH) pero que puede ser tóxico si se encuentra en exceso en la dieta. De hecho, muchas aves carnívoras, que tienen un alto contenido de proteínas en su dieta, exhiben coloración basada en feomelanina. [33]
La melanina también es importante en la pigmentación de los mamíferos . [34] El patrón del pelaje de los mamíferos está determinado por el gen agouti que regula la distribución de la melanina. [35] [36] Los mecanismos del gen se han estudiado ampliamente en ratones para proporcionar una idea de la diversidad de patrones de pelaje de los mamíferos. [37]
Se ha observado que la melanina en los artrópodos se deposita en capas, lo que produce un reflector de Bragg con un índice de refracción alterno. Cuando la escala de este patrón coincide con la longitud de onda de la luz visible, surge la coloración estructural , que otorga a varias especies un color iridiscente . [38] [39]
Los arácnidos son uno de los pocos grupos en los que no se ha detectado fácilmente la melanina, aunque los investigadores encontraron datos que sugieren que las arañas de hecho producen melanina. [40]
Algunas especies de polillas, incluida la polilla tigre de los bosques , convierten los recursos en melanina para mejorar su termorregulación. Como la polilla tigre de los bosques tiene poblaciones en un amplio rango de latitudes, se ha observado que las poblaciones más septentrionales mostraron mayores tasas de melanización. En los fenotipos masculinos tanto amarillos como blancos de la polilla tigre de los bosques, los individuos con más melanina tenían una mayor capacidad para atrapar el calor, pero una mayor tasa de depredación debido a una señal aposemática más débil y menos eficaz . [41]
La melanina protege a las moscas y ratones de Drosophila contra el daño del ADN de la radiación no ultravioleta. [42] Estudios importantes en modelos de Drosophila incluyen Hopwood et al. , 1985. [42] Gran parte de nuestro conocimiento de los efectos radioprotectores de la melanina contra la radiación gamma proviene de los laboratorios y grupos de investigación de Irma Mosse. [43] [44] [45] [46] [47] [48] [49] : 1151 Mosse comenzó en radiobiología en la era soviética, fue apoyada cada vez más por la financiación del gobierno a raíz del descubrimiento de microbios radiotróficos en Chernobyl , y a partir de 2022 continúa bajo el Instituto Bielorruso de Genética y Citología. [48] Su contribución más significativa es Mosse et al. , 2000 en ratones [43] [44] [45] [46] [47] [48] [49] : 1151 pero también incluye a Mosse et al. , 1994, [47] Mosse et al. , 1997, [47] Mosse et al. , 1998, [46] Mosse et al. , 2001, [47] Mosse et al. , 2002, [46] [47] Mosse et al. , 2006, [46] [47] Mosse et al. , 2007 [47] y Mosse et al. , 2008. [47][actualizar]
Plantas

La melanina producida por las plantas se denomina a veces "melaninas catecol", ya que pueden producir catecol mediante fusión alcalina. Se observa comúnmente en el oscurecimiento enzimático de frutas como los plátanos. La melanina de la cáscara de castaña se puede utilizar como antioxidante y agente colorante. [50] La biosíntesis implica la oxidación de la indol-5,6-quinona por la polifenol oxidasa del tipo tirosinasa a partir de tirosina y catecolaminas , lo que conduce a la formación de melanina catecol. A pesar de esto, muchas plantas contienen compuestos que inhiben la producción de melaninas. [51]
Interpretación como un solo monómero
Ahora se entiende que las melaninas no tienen una única estructura o estequiometría. [ cita requerida ] No obstante, las bases de datos químicas como PubChem incluyen fórmulas estructurales y empíricas; típicamente 3,8-Dimetil-2,7-dihidrobenzo[1,2,3- cd :4,5,6- c ′ d ′]diindol-4,5,9,10-tetrona . Esto puede considerarse como un único monómero que explica la composición elemental medida y algunas propiedades de la melanina, pero es poco probable que se encuentre en la naturaleza. [52] Solano [52] afirma que esta tendencia engañosa proviene de un informe de una fórmula empírica en 1948, [53] pero no proporciona ningún otro detalle histórico.
![3,8-Dimetil-2,7-dihidrobenzo[1,2,3-cd:4,5,6-c′d′]diindol-4,5,9,10-tetrona](http://upload.wikimedia.org/wikipedia/commons/thumb/2/20/Melanin.svg/240px-Melanin.svg.png) | |
![Modelo de bola y varilla de 3,8-dimetil-2,7-dihidrobenzo[1,2,3-cd:4,5,6-c′d′]diindol-4,5,9,10-tetrona](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7b/Melanin_ball_and_stick.png/240px-Melanin_ball_and_stick.png) | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido 3,8-Dimetil-2,7-dihidrobenzo[1,2,3- cd :4,5,6- c ′ d ′]diindol-4,5,9,10-tetrona | |
| Identificadores | |
| |
| Araña química | |
Identificador de centro de PubChem |
|
| Propiedades | |
| C18H10N2O4 | |
| Masa molar | 318,288 g·mol −1 |
| Densidad | 1,6 a 1,8 g/ cm3 |
| Punto de fusión | < −20 °C (−4 °F; 253 K) |
| Punto de ebullición | 450 a 550 °C (842 a 1022 °F; 723 a 823 K) |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
Vías biosintéticas
El primer paso de la vía biosintética tanto de las eumelaninas como de las feomelaninas está catalizado por la tirosinasa . [54]
- Tirosina → DOPA → dopaquinona
La dopaquinona puede combinarse con la cisteína a través de dos vías: las benzotiazinas y las feomelaninas.
- dopaquinona + cisteína → 5-S-cisteinildopa → intermedio de benzotiazina → feomelanina
- dopaquinona + cisteína → 2-S-cisteinildopa → intermediario de benzotiazina → feomelanina
Además, la dopaquinona puede convertirse en leucodopacromo y seguir dos vías más hasta las eumelaninas.
- dopaquinona → leucodopacromo → dopacromo → ácido 5,6-dihidroxiindol-2-carboxílico → quinona → eumelanina
- dopaquinona → leucodopacromo → dopacromo → 5,6-dihidroxiindol → quinona → eumelanina
Las vías metabólicas detalladas se pueden encontrar en la base de datos KEGG (ver enlaces externos).
- L-tirosina
- L-DOPA
- L-dopaquinona
- L-leucodopacromo
- L-dopacromo
Aspecto microscópico
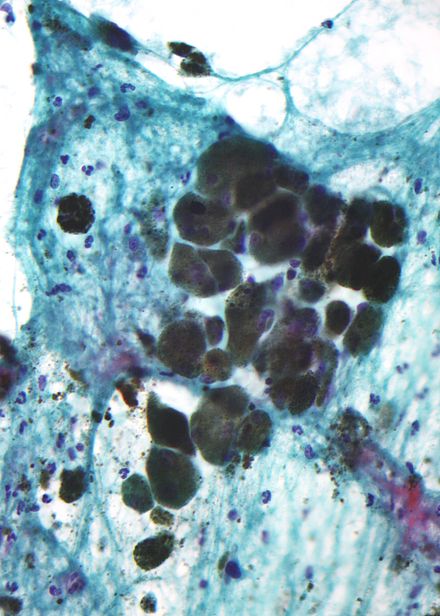
La melanina es marrón, no refractaria y finamente granular, con gránulos individuales que tienen un diámetro de menos de 800 nanómetros. Esto diferencia a la melanina de los pigmentos de degradación sanguínea comunes , que son más grandes, gruesos y refractarios, y varían en color desde verde a amarillo o marrón rojizo. En lesiones muy pigmentadas, los agregados densos de melanina pueden ocultar los detalles histológicos. Una solución diluida de permanganato de potasio es un blanqueador de melanina eficaz. [55]
Trastornos genéticos y estados patológicos
Existen aproximadamente nueve tipos de albinismo oculocutáneo , que es principalmente un trastorno autosómico recesivo. Ciertas etnias tienen mayores incidencias de diferentes formas. Por ejemplo, el tipo más común, llamado albinismo oculocutáneo tipo 2 (OCA2), es especialmente frecuente entre personas de ascendencia africana negra y europeos blancos. Las personas con OCA2 suelen tener la piel clara, pero a menudo no son tan pálidas como las OCA1. Tienen cabello rubio pálido a dorado, rubio fresa o incluso castaño, y los ojos más comúnmente azules. Entre el 98,7 y el 100 % de los europeos modernos son portadores del alelo derivado SLC24A5 , una causa conocida de albinismo oculocutáneo no sindrómico. Es un trastorno autosómico recesivo que se caracteriza por una reducción congénita o ausencia del pigmento melanina en la piel, el cabello y los ojos. La frecuencia estimada de OCA2 entre los afroamericanos es de 1 en 10.000, lo que contrasta con una frecuencia de 1 en 36.000 en los estadounidenses blancos. [56] En algunas naciones africanas, la frecuencia del trastorno es incluso mayor, oscilando entre 1 en 2.000 y 1 en 5.000. [57] Otra forma de albinismo, el "albinismo oculocutáneo amarillo", parece ser más frecuente entre los Amish , que son principalmente de ascendencia suiza y alemana. Las personas con esta variante IB del trastorno suelen tener el pelo y la piel blancos al nacer, pero desarrollan rápidamente una pigmentación normal de la piel en la infancia. [57]
El albinismo ocular no solo afecta la pigmentación ocular, sino también la agudeza visual. Las personas con albinismo suelen tener un resultado bajo en las pruebas, con un rango de 20/60 a 20/400. Además, dos formas de albinismo, con una prevalencia de aproximadamente 1 en 2700 entre las personas de origen puertorriqueño, están asociadas con una mortalidad que va más allá de las muertes relacionadas con el melanoma.
La conexión entre el albinismo y la sordera es bien conocida, aunque poco entendida. En su tratado de 1859 El origen de las especies , Charles Darwin observó que "los gatos que son completamente blancos y tienen ojos azules son generalmente sordos". [58] En los humanos, la hipopigmentación y la sordera ocurren juntas en el raro síndrome de Waardenburg , observado predominantemente entre los hopi en América del Norte. [59] La incidencia del albinismo en los indios hopi se ha estimado en aproximadamente 1 en 200 individuos. Se han encontrado patrones similares de albinismo y sordera en otros mamíferos, incluidos perros y roedores. Sin embargo, la falta de melanina per se no parece ser directamente responsable de la sordera asociada con la hipopigmentación, ya que la mayoría de los individuos que carecen de las enzimas necesarias para sintetizar melanina tienen una función auditiva normal. [60] En cambio, la ausencia de melanocitos en la estría vascular del oído interno produce deterioro coclear , [61] aunque las razones de esto no se comprenden completamente.
En la enfermedad de Parkinson, un trastorno que afecta el funcionamiento neuromotor , hay una disminución de la neuromelanina en la sustancia negra y el locus coeruleus como consecuencia de la pérdida específica de neuronas pigmentadas dopaminérgicas y noradrenérgicas. Esto da como resultado una disminución de la síntesis de dopamina y noradrenalina . Si bien no se ha informado de ninguna correlación entre la raza y el nivel de neuromelanina en la sustancia negra, la incidencia significativamente menor de Parkinson en los negros que en los blancos ha "llevado a algunos a sugerir que la melanina cutánea podría servir de alguna manera para proteger la neuromelanina en la sustancia negra de las toxinas externas". [62]
Además de la deficiencia de melanina, el peso molecular del polímero de melanina puede disminuir por varios factores como el estrés oxidativo, la exposición a la luz, la perturbación en su asociación con las proteínas de la matriz melanosómica , los cambios en el pH o en las concentraciones locales de iones metálicos. Se ha propuesto que un peso molecular disminuido o una disminución en el grado de polimerización de la melanina ocular convierte al polímero normalmente antioxidante en un prooxidante . En su estado prooxidante, se ha sugerido que la melanina está involucrada en la causa y progresión de la degeneración macular y el melanoma . [63] La rasagilina , un importante fármaco de monoterapia en la enfermedad de Parkinson, tiene propiedades de unión a la melanina y propiedades reductoras del tumor del melanoma. [64]
Sin embargo, los niveles elevados de eumelanina también pueden ser una desventaja, más allá de una mayor predisposición a la deficiencia de vitamina D. La piel oscura es un factor que complica la eliminación con láser de las manchas de vino de Oporto . Si bien son eficaces para tratar la piel blanca, en general, los láseres tienen menos éxito en la eliminación de las manchas de vino de Oporto en personas de ascendencia asiática o africana. Las concentraciones más altas de melanina en personas de piel más oscura simplemente difunden y absorben la radiación láser, inhibiendo la absorción de luz por el tejido objetivo. De manera similar, la melanina puede complicar el tratamiento con láser de otras afecciones dermatológicas en personas de piel más oscura.
Las pecas y los lunares se forman en zonas donde hay una concentración localizada de melanina en la piel. Están muy asociados a la piel pálida.
La nicotina tiene afinidad por los tejidos que contienen melanina debido a su función precursora en la síntesis de melanina o a su unión irreversible con la misma. Se ha sugerido que esto es la base de la mayor dependencia de la nicotina y de las menores tasas de abandono del hábito de fumar en las personas con piel más oscura. [65]
Adaptaciones humanas
Fisiología
Los melanocitos insertan gránulos de melanina en vesículas celulares especializadas llamadas melanosomas . Estos luego son transferidos a las células queratinocitos de la epidermis humana . Los melanosomas en cada célula receptora se acumulan sobre el núcleo celular , donde protegen el ADN nuclear de las mutaciones causadas por la radiación ionizante de los rayos ultravioleta del sol . En general, las personas cuyos antepasados vivieron durante largos períodos en las regiones del globo cercanas al ecuador tienen mayores cantidades de eumelanina en sus pieles. Esto hace que su piel sea marrón o negra y las protege contra altos niveles de exposición al sol, que con mayor frecuencia resultan en melanomas en personas de piel más clara. [66]
No todos los efectos de la pigmentación son beneficiosos. La pigmentación aumenta la carga térmica en climas cálidos y las personas de piel oscura absorben un 30% más de calor de la luz solar que las personas de piel muy clara, aunque este factor puede compensarse con una sudoración más profusa. En climas fríos, la piel oscura conlleva una mayor pérdida de calor por radiación. La pigmentación también dificulta la síntesis de vitamina D. Dado que la pigmentación parece no ser del todo ventajosa para la vida en los trópicos, se han propuesto otras hipótesis sobre su importancia biológica; por ejemplo, un fenómeno secundario inducido por la adaptación a los parásitos y las enfermedades tropicales. [67]
Orígenes evolutivos
Los primeros humanos desarrollaron un color de piel oscuro, como una adaptación a la pérdida de vello corporal que aumentaba los efectos de la radiación UV. Antes del desarrollo de la falta de pelo, los primeros humanos podrían haber tenido piel clara debajo de su pelaje, similar a la que se encuentra en otros primates . [68] Los humanos anatómicamente modernos evolucionaron en África hace entre 200.000 y 100.000 años, [69] y luego poblaron el resto del mundo a través de la migración hace entre 80.000 y 50.000 años, en algunas áreas cruzándose con ciertas especies humanas arcaicas ( neandertales , denisovanos y posiblemente otros). [70] Los primeros humanos modernos tenían la piel más oscura que los pueblos indígenas de África hoy. Después de la migración y el asentamiento en Asia y Europa, la presión selectiva de la piel oscura que protege la radiación UV disminuyó donde la radiación del sol era menos intensa. Esto resultó en la gama actual de color de piel humana. De las dos variantes genéticas comunes que se sabe que están asociadas con la piel humana pálida, Mc1r no parece haber sufrido una selección positiva, [71] mientras que SLC24A5 sí ha sufrido una selección positiva. [72]
Efectos
Al igual que los pueblos que han migrado hacia el norte, aquellos con piel clara que migran hacia el ecuador se aclimatan a la radiación solar mucho más fuerte. La naturaleza selecciona menos melanina cuando la radiación ultravioleta es débil. La piel de la mayoría de las personas se oscurece cuando se expone a la luz ultravioleta, lo que les da más protección cuando es necesaria. Este es el propósito fisiológico del bronceado solar . Las personas de piel oscura, que producen más eumelanina protectora de la piel, tienen una mayor protección contra las quemaduras solares y el desarrollo del melanoma, una forma potencialmente mortal de cáncer de piel, así como otros problemas de salud relacionados con la exposición a una fuerte radiación solar , incluida la fotodegradación de ciertas vitaminas como las riboflavinas , los carotenoides , el tocoferol y el folato . [73]
La melanina en los ojos, en el iris y la coroides , ayuda a proteger de la luz ultravioleta y la luz visible de alta frecuencia ; las personas con ojos azules, verdes y grises tienen más riesgo de sufrir problemas oculares relacionados con el sol. Además, el cristalino ocular se amarillea con la edad, lo que proporciona una protección adicional. Sin embargo, el cristalino también se vuelve más rígido con la edad, perdiendo la mayor parte de su acomodación (la capacidad de cambiar de forma para enfocar de lejos a cerca), un detrimento probablemente debido a la reticulación de proteínas causada por la exposición a los rayos UV.
Investigaciones recientes sugieren que la melanina puede cumplir una función protectora además de la fotoprotección. [74] La melanina es capaz de quelar eficazmente los iones metálicos a través de sus grupos carboxilato e hidroxilo fenólico, a menudo de forma mucho más eficiente que el potente ligando quelante etilendiaminotetraacetato (EDTA). Por lo tanto, puede servir para secuestrar iones metálicos potencialmente tóxicos, protegiendo al resto de la célula. Esta hipótesis está respaldada por el hecho de que la pérdida de neuromelanina, observada en la enfermedad de Parkinson, va acompañada de un aumento de los niveles de hierro en el cerebro.
Propiedades físicas y aplicaciones tecnológicas
Existe evidencia de un heteropolímero altamente reticulado unido covalentemente a las melanoproteínas que forman el andamiaje de la matriz. [75] Se ha propuesto que la capacidad de la melanina para actuar como antioxidante es directamente proporcional a su grado de polimerización o peso molecular . [76] Las condiciones subóptimas para la polimerización efectiva de los monómeros de melanina pueden conducir a la formación de melanina prooxidante con menor peso molecular, implicada en la causa y progresión de la degeneración macular y el melanoma . [77] Las vías de señalización que regulan positivamente la melanización en el epitelio pigmentario de la retina (EPR) también pueden estar implicadas en la regulación negativa de la fagocitosis del segmento externo de los bastones por el EPR. Este fenómeno se ha atribuido en parte a la preservación foveal en la degeneración macular . [78]
Papel en la metástasis del melanoma
Las células de melanoma muy pigmentadas tienen un módulo de Young de aproximadamente 4,93 kPa, en comparación con las células no pigmentadas, con un valor de 0,98 kPa. [79] La elasticidad de las células de melanoma es crucial para la metástasis y el crecimiento; los tumores no pigmentados eran más grandes que los pigmentados y se propagaban mucho más fácilmente. Tanto las células pigmentadas como las no pigmentadas están presentes en los tumores de melanoma , por lo que ambos pueden ser resistentes a los fármacos y metastásicos. [79]
Véase también
- Albino
- El albinismo en la biología
- Síndrome de Griscelli , un síndrome caracterizado por hipopigmentación.
- Color de la piel humana
- Teoría de la melanina
- Melanismo
- Melanogénesis , producción de melanina.
- Riesgos y beneficios de la exposición al sol
- Blanqueamiento de la piel
- Vitamina D
Referencias
- ^ Casadevall A (2018). "La melanina desencadena las defensas antifúngicas". Nature . 555 (7696): 319–320. Código Bibliográfico :2018Natur.555..319C. doi :10.1038/d41586-018-02370-x. ISSN 0028-0836. PMID 29542711. S2CID 3832753.
- ^ ab Cao W, Zhou X, McCallum NC, Hu Z, Ni QZ, Kapoor U, et al. (9 de febrero de 2021). "Descifrando la estructura y función de la melanina a través de la síntesis". Revista de la Sociedad Química Estadounidense . 143 (7): 2622–2637. doi :10.1021/jacs.0c12322. hdl : 1854/LU-8699336 . ISSN: 0002-7863. PMID: 33560127. S2CID: 231872855. Archivado desde el original el 30 de agosto de 2024. Consultado el 13 de febrero de 2021 .
- ^ Haining RL, Achat-Mendes C (marzo de 2017). "La neuromelanina, una de las moléculas más ignoradas en la medicina moderna, no es una espectadora". Neural Regeneration Research . 12 (3): 372–375. doi : 10.4103/1673-5374.202928 . PMC 5399705 . PMID 28469642.
- ^ Meredith P, Riesz J (2004). "Rendimiento cuántico de relajación radiativa para eumelanina sintética". Fotoquímica y fotobiología . 79 (2): 211–6. arXiv : cond-mat/0312277 . doi :10.1111/j.1751-1097.2004.tb00012.x. PMID 15068035. S2CID 222101966.
- ^ Brenner M, Hearing VJ (2008). "El papel protector de la melanina contra el daño UV en la piel humana". Fotoquímica y fotobiología . 84 (3): 539–49. doi :10.1111/j.1751-1097.2007.00226.x. PMC 2671032 . PMID 18435612.
- ^ abcd Alaluf S, Heath A, Carter N, Atkins D, Mahalingam H, Barrett K, et al. (2001). "Variación en el contenido y la composición de melanina en la piel humana fotoexpuesta y fotoprotegida de tipo V y VI: el papel dominante de DHI". Pigment Cell Research . 14 (5): 337–347. doi :10.1034/j.1600-0749.2001.140505.x. ISSN 0893-5785. PMID 11601655.
- ^ Ito S, Wakamatsu K (diciembre de 2011). "Diversidad de la pigmentación del cabello humano estudiada mediante análisis químico de eumelanina y feomelanina". Revista de la Academia Europea de Dermatología y Venereología . 25 (12): 1369–1380. doi :10.1111/j.1468-3083.2011.04278.x. ISSN 1468-3083. PMID 22077870. S2CID 5121042.
- ^ Slominski A, Tobin DJ, Shibahara S, Wortsman J (octubre de 2004). "Pigmentación de melanina en la piel de mamíferos y su regulación hormonal". Physiological Reviews . 84 (4): 1155–228. doi :10.1152/physrev.00044.2003. PMID 15383650. S2CID 21168932.
- ^ "feomelanina". Base de datos de vías metabólicas MetaCyc . 2010. Archivado desde el original el 11 de febrero de 2020. Consultado el 24 de agosto de 2019 . [ Se necesita cita completa ]
- ^ Thody AJ, Higgins EM, Wakamatsu K, Ito S, Burchill SA, Marks JM (agosto de 1991). "Tanto la feomelanina como la eumelanina están presentes en la epidermis humana". The Journal of Investigative Dermatology . 97 (2): 340–344. doi :10.1111/1523-1747.ep12480680. PMID 2071942. Archivado desde el original el 25 de septiembre de 2022 . Consultado el 25 de septiembre de 2022 .
- ^ Greco G, Panzella L, Verotta L, d'Ischia M, Napolitano A (abril de 2011). "Descubrimiento de la estructura de la feomelanina del cabello rojo humano: benzotiazoliltiazinodihidroisoquinolinas como bloques de construcción clave". Journal of Natural Products . 74 (4): 675–82. doi :10.1021/np100740n. PMID 21341762.
- ^ ab Solano F (2014). "Melaninas: pigmentos de la piel y mucho más: tipos, modelos estructurales, funciones biológicas y rutas de formación". New Journal of Science . 2014 : 1–28. doi : 10.1155/2014/498276 .
- ^ ab Kottler VA, Künstner A, Schartl M (mayo de 2015). "Feomelanina en peces?". Pigment Cell & Melanoma Research . 28 (3): 355–356. doi :10.1111/pcmr.12359. ISSN 1755-1471. PMID 25660115. S2CID 8877527. Archivado desde el original el 22 de febrero de 2024. Consultado el 22 de febrero de 2024 .
- ^ ab Xu P, Zhang X, Wang X, Li J, Liu G, Kuang Y, et al. (noviembre de 2014). "Secuencia del genoma y diversidad genética de la carpa común, Cyprinus carpio". Genética de la Naturaleza . 46 (11): 1212-1219. doi : 10.1038/ng.3098 . ISSN 1061-4036. PMID 25240282.
- ^ Fedorow H, Tribl F, Halliday G, Gerlach M, Riederer P, Double KL (2005). "Neuromelanina en neuronas dopaminérgicas humanas: comparación con melaninas periféricas y relevancia para la enfermedad de Parkinson". Prog Neurobiol . 75 (2): 109–124. doi :10.1016/j.pneurobio.2005.02.001. PMID 15784302. S2CID 503902.
- ^ Double KL (2006). "Efectos funcionales de la neuromelanina y la melanina sintética en sistemas modelo". J Neural Transm . 113 (6): 751–756. doi :10.1007/s00702-006-0450-5. PMID 16755379. S2CID 23096297.
- ^ Kolipakala RS, Basu S, Sarkar S, Biju BM, Salazar D, Reddy L, et al. (7 de agosto de 2024). "Peptidomelanina fúngica: un nuevo biopolímero para la quelación de metales pesados". ACS Omega . doi :10.1021/acsomega.4c03704. ISSN 2470-1343. PMC 11359623 .
- ^ Cao W, McCallum NC, Ni QZ, Li W, Boyce H, Mao H, et al. (22 de julio de 2020). "Selenomelanina: un análogo abiótico de selenio de feomelanina". Revista de la Sociedad Química Estadounidense . 142 (29): 12802–12810. doi :10.1021/jacs.0c05573. ISSN 0002-7863. PMID 32638590. S2CID 220413025. Archivado desde el original el 6 de septiembre de 2023 . Consultado el 30 de agosto de 2024 .
{{cite journal}}: Mantenimiento CS1: fecha y año ( enlace ) - ^ Mark Heiden (8 de julio de 2020). «Nuevo biomaterial podría proteger contra la radiación dañina». Universidad Northwestern. Archivado desde el original el 30 de agosto de 2024. Consultado el 29 de enero de 2023 .
- ^ Prota, G., Searle, AG (1978). "Sitios bioquímicos de acción genética para la melanogénesis en mamíferos". Annales de Génétique et de Sélection Animale . 10 (1): 1–8. doi : 10.1186/1297-9686-10-1-1 . PMC 2757330 . PMID 22896083. Archivado desde el original el 30 de agosto de 2024 . Consultado el 24 de agosto de 2019 .
- ^ Del Bino S, Ito S, Sok J, Wakamatsu K (2022). "Contenido de 5,6-dihidroxiindol eumelanina en la piel humana con distintos grados de pigmentación constitutiva". Pigment Cell & Melanoma Research . 35 (6): 622–626. doi :10.1111/pcmr.13062. ISSN 1755-1471. PMC 9804219 . PMID 35933709.
- ^ Cichorek M, Wachulska M, Stasiewicz A, Tymińska A (20 de febrero de 2013). "Melanocitos de la piel: biología y desarrollo". Avances en dermatología y alergología . 30 (1): 30–41. doi :10.5114/pdia.2013.33376. PMC 3834696 . PMID 24278043.
- ^ "albinismo oculocutáneo". Genetics Home Reference . Archivado desde el original el 17 de julio de 2020. Consultado el 25 de septiembre de 2017 .
- ^ Hamilton AJ, Gomez BL (marzo de 2002). "Melaninas en patógenos fúngicos". Revista de Microbiología Médica . 51 (3): 189–91. doi : 10.1099/0022-1317-51-3-189 . PMID 11871612.
- ^ Cerenius L, Söderhäll K (abril de 2004). "El sistema activador de la profenoloxidasa en invertebrados". Reseñas inmunológicas . 198 : 116–26. doi :10.1111/j.0105-2896.2004.00116.x. PMID 15199959. S2CID 10614298.
- ^ Castelvecchi D (26 de mayo de 2007). "Poder oscuro: el pigmento parece darle un buen uso a la radiación". Science News . 171 (21): 325. doi :10.1002/scin.2007.5591712106.
- ^ Dadachova E, Bryan RA, Huang X, et al. (2007). "La radiación ionizante cambia las propiedades electrónicas de la melanina y mejora el crecimiento de hongos melanizados". PLOS ONE . 2 (5): e457. Bibcode :2007PLoSO...2..457D. doi : 10.1371/journal.pone.0000457 . PMC 1866175 . PMID 17520016.
- ^ Sköld HN, Aspengren S, Cheney KL, Wallin M (2016). "Capítulo cuatro: cromatóforos de peces: de motores moleculares a comportamiento animal". Revista internacional de biología celular y molecular . 321 : 171–219. doi :10.1016/bs.ircmb.2015.09.005. PMID 26811288.
- ^ Mouchet SR, Cortesi F, Bokic B, Lazovic V, Vukusic P, Marshall NJ, et al. (1 de noviembre de 2023). "Modificación morfológica y óptica de los melanosomas en los tegumentos de los peces tras la oxidación". Óptica . 4 (4): 563–562. doi : 10.3390/opt4040041 .
- ^ Gunderson AR, Frame AM, Swaddle JP, Forsyth MH (1 de septiembre de 2008). "Resistencia de las plumas melanizadas a la degradación bacteriana: ¿es realmente tan blanco y negro?". Journal of Avian Biology . 39 (5): 539–545. doi :10.1111/j.0908-8857.2008.04413.x.
- ^ Bonser RH (1995). «Melanina y resistencia a la abrasión de las plumas». Condor . 97 (2): 590–591. doi :10.2307/1369048. JSTOR 1369048. Archivado desde el original el 23 de enero de 2020 . Consultado el 25 de septiembre de 2017 .
- ^ Galván I, Solano F (8 de abril de 2016). "Melaninas tegumentarias de aves: biosíntesis, formas, función y evolución". Revista Internacional de Ciencias Moleculares . 17 (4): 520. doi : 10.3390/ijms17040520 . PMC 4848976 . PMID 27070583.
- ^ Rodríguez-Martínez S, Galván I (2020). "La coloración del plumaje basada en feomelanina juvenil ha evolucionado con mayor frecuencia en especies carnívoras". Ibis . 162 (1): 238–244. doi :10.1111/ibi.12770. hdl : 10261/207451 . ISSN 1474-919X. S2CID 202018215.
- ^ Jimbow K, Quevedo WC J, Fitzpatrick TB, Szabo G (julio de 1976). "Algunos aspectos de la biología de la melanina: 1950-1975". The Journal of Investigative Dermatology . 67 (1): 72-89. doi : 10.1111/1523-1747.ep12512500 . PMID 819593.
- ^ Meneely P (2014). Análisis genético: genes, genomas y redes en eucariotas. Oxford University Press. ISBN 9780199681266Archivado desde el original el 30 de agosto de 2024 . Consultado el 26 de agosto de 2020 .
- ^ Griffiths AJ, Miller JH, Suzuki DT, Lewontin RC, Gelbart WM (2000). "Interacción genética en el color del pelaje de los mamíferos". NCBI .[ enlace muerto permanente ]
- ^ Millar SE, Miller MW, Stevens ME, Barsh GS (octubre de 1995). "Los estudios de expresión y transgénicos del gen agouti del ratón proporcionan información sobre los mecanismos por los que se generan los patrones de color del pelaje de los mamíferos". Desarrollo . 121 (10): 3223–3232. doi :10.1242/dev.121.10.3223. PMID 7588057.
- ^ Neville AC (2012). Biología de la cutícula de los artrópodos. Springer Science & Business Media. ISBN 9783642809101Archivado desde el original el 30 de agosto de 2024 . Consultado el 26 de agosto de 2020 .
- ^ Mouchet SR, Deparis O (2021), Fotónica natural y bioinspiración (1.ª ed.), Artech House, ISBN 978-163-081-797-8, archivado del original el 12 de noviembre de 2023 , consultado el 7 de noviembre de 2023
- ^ Hsiung BK, Blackledge TA, Shawkey MD (2015). "Las arañas tienen melanina después de todo". Journal of Experimental Biology . 218 (22): 3632–3635. doi : 10.1242/jeb.128801 . PMID 26449977.
- ^ Hegna RH, Nokelainen O, Hegna JR, Mappes J (2013). "Temblar o estremecerse: el aumento de la melanización beneficia la termorregulación, pero reduce la eficacia de la señal de advertencia en la polilla tigre de la madera". Proc. R. Soc. B . 280 (1755): 20122812. doi :10.1098/rspb.2012.2812. PMC 3574392 . PMID 23363631.
- ^ ab Mosse IB, Dubovic BV, Plotnikova SI, Kostrova LN, Molophei V, Subbot ST, et al. (20–25 de mayo de 2001). Obelic B, Ranogajev-Komor M, Miljanic S, Krajcar Btronic I (eds.). La melanina es un radioprotector eficaz contra la irradiación crónica y las dosis bajas de radiación . Congreso regional de la IRPA sobre protección radiológica en Europa central: protección radiológica y salud. INIS . Dubrovnik (Croacia): Asociación Croata de Protección Radiológica. pág. 35 (de 268).
- ^ ab Gessler NN, Egorova AS, Belozerskaya TA (2014). "Pigmentos de melanina de hongos en condiciones ambientales extremas (revisión)". Applied Biochemistry and Microbiology . 50 (2). Pleiades Publishing: 105–113. doi : 10.1134/s0003683814020094 . ISSN 0003-6838. PMID 25272728. S2CID 8570835.
- ^ ab Nenoi M, Wang B, Vares G (12 de junio de 2014). "Respuesta radioadaptativa in vivo". Toxicología . 34 (3). Sage : 272–283. doi :10.1177/0960327114537537. ISSN 0960-3271. PMC 4442823 . PMID 24925363.
- ^ ab Liu H, Yang Y, Liu Y, Pan J, Wang J, Man F, et al. (7 de febrero de 2020). "Nanomateriales similares a la melanina para aplicaciones biomédicas avanzadas: una plataforma versátil con una promesa extraordinaria". Ciencia avanzada . 7 (7). Wiley-VCH : 1903129. doi :10.1002/advs.201903129. ISSN 2198-3844. PMC 7141020 . PMID 32274309.
- ^ abcde Mosse IB (2012). "Efectos genéticos de la radiación ionizante: algunas preguntas sin respuestas". Journal of Environmental Radioactivity . 112 . Elsevier : 70–75. Bibcode :2012JEnvR.112...70M. doi :10.1016/j.jenvrad.2012.05.009. ISSN 0265-931X. PMID 22683898.
- ^ abcdefghi Mosse I, Kilchevsky A, Nikolova N, Zhelev N (14 de diciembre de 2016). "Algunos problemas y errores en la biodosimetría citogenética". Biotecnología y equipamiento biotecnológico . 31 (3). Taylor & Francis : 460–468. doi : 10.1080/13102818.2016.1259018 . ISSN 1310-2818. S2CID 59398089.
- ^ abc Mosse I (18 de enero de 2022). "Radiobiología en mi vida – Irma Mosse". Revista Internacional de Biología de la Radiación . 98 (3: Mujeres en radiobiología). Taylor & Francis : 474–478. doi :10.1080/09553002.2022.2026517. ISSN 0955-3002. PMID 34994663. S2CID 245823003.
- ^ ab Dadachova E, Casadevall A (2011). Horikoshi K (ed.). Manual de extremófilos . Tokio, Nueva York: Springer . Págs. xxix+1247. ISBN. 978-4-431-53898-1.OCLC 700199222 . ISBN 978-4-431-53897-4 . OCLC 711778164.
- ^ Yao ZY, Qi JH (22 de abril de 2016). "Comparación de las actividades antioxidantes de las fracciones de melanina de la cáscara de castaña". Moléculas . 21 (4): 487. doi : 10.3390/molecules21040487 . PMC 6273334 . PMID 27110763.
- ^ Kim YJ, Uyama H (15 de mayo de 2005). "Inhibidores de tirosinasa de fuentes naturales y sintéticas: estructura, mecanismo de inhibición y perspectivas para el futuro". Ciencias de la vida celular y molecular . 62 (15): 1707–1723. doi :10.1007/s00018-005-5054-y. PMC 11139184. PMID 15968468. S2CID 8280251 .
- ^ ab Solano F (2014). "Melaninas: pigmentos de la piel y mucho más: tipos, modelos estructurales, funciones biológicas y rutas de formación". New Journal of Science . 2014 (498276): 1–28. doi : 10.1155/2014/498276 .
- ^ Mason HS (1948). "La química de la melanina. Mecanismo de oxidación de la dihidroxifenilalanina por la tirosinasa". Journal of Biological Chemistry . 172 (1): 83–99. doi : 10.1016/S0021-9258(18)35614-X . PMID 18920770.
- ^ Zaidi KU, Ali AS, Ali SA, Naaz I (2014). "Tirosinasas microbianas: enzimas prometedoras para la industria farmacéutica, de bioprocesamiento de alimentos y medioambiental". Biochemistry Research International . 2014 : 1–16 (véase la figura 3). doi : 10.1155/2014/854687 . PMC 4033337 . PMID 24895537.
- ^ "Melanina". pubchem.ncbi.nlm.nih.gov . Archivado desde el original el 25 de septiembre de 2017 . Consultado el 25 de septiembre de 2017 .
- ^ "Albinismo oculocutáneo". Archivado desde el original el 23 de diciembre de 2008.
- ^ ab Peracha MO, Cosgrove FM, Garcia-Valenzuela E, Eliott D (5 de noviembre de 2015). Roy H Sr, Talavera F, Rowsey JJ (eds.). "Manifestaciones oculares del albinismo: antecedentes, fisiopatología, epidemiología" . Medscape . Contribuciones adicionales de Kilbourn Gordon, III. WebMD . Archivado desde el original el 28 de marzo de 2017. Consultado el 8 de septiembre de 2022 – vía eMedicine .
- ^ "Causas de variabilidad". Archivado desde el original el 23 de septiembre de 2006 . Consultado el 18 de septiembre de 2006 .
- ^ EntrezGene 300700
- ^ EntrezGene 606933
- ^ Cable J, Huszar D, Jaenisch R, Steel KP (febrero de 1994). "Efectos de las mutaciones en el locus W (c-kit) sobre la pigmentación y la función del oído interno en el ratón". Pigment Cell Research . 7 (1): 17–32. doi :10.1111/j.1600-0749.1994.tb00015.x. PMID 7521050.
- ^ "Enfermedad de cuerpos de Lewy". Archivado desde el original el 21 de julio de 2009.
- ^ Meyskens FL, Farmer P, Fruehauf JP (junio de 2001). "Regulación redox en melanocitos humanos y melanoma" (PDF) . Pigment Cell Research . 14 (3): 148–54. doi : 10.1034/j.1600-0749.2001.140303.x . PMID 11434561. Archivado (PDF) desde el original el 30 de agosto de 2024 . Consultado el 24 de agosto de 2019 .
- ^ Meier-Davis SR, Dines K, Arjmand FM, et al. (diciembre de 2012). "Comparación de la administración oral y transdérmica de mesilato de rasagilina en el crecimiento de tumores de melanoma humano in vivo". Toxicología cutánea y ocular . 31 (4): 312–7. doi :10.3109/15569527.2012.676119. PMID 22515841. S2CID 30344869.
- ^ King G, Yerger VB, Whembolua GL, Bendel RB, Kittles R, Moolchan ET (junio de 2009). "Vínculo entre la melanina facultativa y el consumo de tabaco entre los afroamericanos". Farmacología, bioquímica y comportamiento . 92 (4): 589–96. doi :10.1016/j.pbb.2009.02.011. PMID 19268687. S2CID 3070838.
- ^ "Variación del color de la piel humana". Programa de Orígenes Humanos del Instituto Smithsoniano . 20 de junio de 2012. Consultado el 24 de agosto de 2019 .
- ^ Berth-Jones, J. (2010). "Pigmentación constitutiva, pigmentación humana y respuesta a la exposición al sol". En Burns T, Breathnach S, Cox N, Griffiths C (eds.). Rook's Textbook of Dermatology . Vol. 3 (8.ª ed.). Wiley-Blackwell. pág. 58.9. ISBN 978-1-4051-6169-5.
- ^ Wade N (19 de agosto de 2003). "Why Humans and Their Fur Parted Ways". The New York Times . ISSN 0362-4331. Archivado desde el original el 18 de junio de 2009. Consultado el 24 de agosto de 2019 .
- ^ Tishkoff SA, Reed FA, Friedlaender FR, et al. (mayo de 2009). "La estructura genética y la historia de los africanos y los afroamericanos". Science . 324 (5930): 1035–44. Bibcode :2009Sci...324.1035T. doi :10.1126/science.1172257. PMC 2947357 . PMID 19407144.
- ^ "Una sola migración desde África pobló el mundo, según los estudios". The New York Times . 22 de septiembre de 2016. Archivado desde el original el 2 de mayo de 2019 . Consultado el 2 de marzo de 2017 .
- ^ Harding RM, Healy E, Ray AJ, Ellis NS, Flanagan N, Todd C, et al. (abril de 2000). "Evidencia de presiones selectivas variables en MC1R". The American Journal of Human Genetics . 66 (4): 1351–1361. doi :10.1086/302863. PMC 1288200 . PMID 10733465.
- ^ Lamason RL, Mohideen MA, Mest JR, et al. (diciembre de 2005). "SLC24A5, un posible intercambiador de cationes, afecta la pigmentación en el pez cebra y los seres humanos". Science . 310 (5755): 1782–6. Bibcode :2005Sci...310.1782L. doi :10.1126/science.1116238. PMID 16357253. S2CID 2245002.
- ^ Jablonski NG, Chaplin G (11 de mayo de 2010). "Pigmentación de la piel humana como adaptación a la radiación UV". Actas de la Academia Nacional de Ciencias . 107 (Suplemento 2): 8962–8968. Bibcode :2010PNAS..107.8962J. doi : 10.1073/pnas.0914628107 . PMC 3024016 . PMID 20445093.
- ^ Liu Y, Hong L, Kempf VR, Wakamatsu K, Ito S, Simon JD (junio de 2004). "Intercambio iónico y adsorción de Fe(III) por la melanina de Sepia". Pigment Cell Research . 17 (3): 262–9. doi :10.1111/j.1600-0749.2004.00140.x. PMID 15140071.
- ^ Donatien PD, Orlow SJ (agosto de 1995). "Interacción de las proteínas melanosomales con la melanina". Revista Europea de Bioquímica . 232 (1): 159–64. doi :10.1111/j.1432-1033.1995.tb20794.x. PMID 7556145.
- ^ Sarangarajan R, Apte SP (2005). "Agregación y polimerización de melanina: posibles implicaciones en la degeneración macular relacionada con la edad". Investigación oftálmica . 37 (3): 136–41. doi :10.1159/000085533. PMID 15867475. S2CID 27499198.
- ^ Meyskens FL, Farmer PJ, Anton-Culver H (abril de 2004). "Patogénesis etiológica del melanoma: una hipótesis unificadora para el riesgo atribuible faltante" (PDF) . Clinical Cancer Research . 10 (8): 2581–3. doi : 10.1158/1078-0432.ccr-03-0638 . PMID 15102657. S2CID 26079375. Archivado (PDF) del original el 3 de agosto de 2020 . Consultado el 24 de agosto de 2019 .
- ^ Sarangarajan R, Apte SP (2005). "Melanización y fagocitosis: implicaciones para la degeneración macular relacionada con la edad". Molecular Vision . 11 : 482–90. PMID 16030499.
- ^ ab Sarna M, Krzykawska-Serda M, Jakubowska M, Zadlo A, Urbanska K (26 de junio de 2019). "La presencia de melanina inhibe la propagación de células de melanoma en ratones de una forma mecánica única". Informes científicos . 9 (1): 9280. Código bibliográfico : 2019NatSR...9.9280S. doi : 10.1038/s41598-019-45643-9 . ISSN 2045-2322. PMC 6594928 . PMID 31243305.
Enlaces externos
- "Espectro de absorción de la melanina". Departamento de Ciencias Informáticas y Tecnología.
- "Metabolismo de la tirosina: vía de referencia". Enciclopedia de Kyoto de genes y genomas . Consultado el 13 de junio de 2024 .
- "Melanogénesis". Enciclopedia de genes y genomas de Kioto . Consultado el 13 de junio de 2024 .








