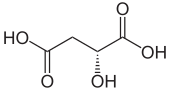
Ácido málico
 | |
 | |
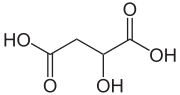
 Ácido DL -málico | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Ácido 2-hidroxibutanodioico | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.027.293 |
| Número CE |
|
| Número E | E296 (conservantes) |
| |
| BARRIL | |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C4H6O5 | |
| Masa molar | 134,09 g/mol |
| Apariencia | Incoloro |
| Densidad | 1,609 g·cm −3 |
| Punto de fusión | 130 °C (266 °F; 403 K) |
| 558 g/L (a 20 °C) [1] | |
| Acidez (p K a ) | pKa1 = 3,40 pKa2 = 5,20 [ 2 ] pKa3 = 14,5 [ 3 ] |
| Peligros | |
| Etiquetado SGA : | |
 | |
| punto de inflamabilidad | 203 °C [4] |
| Compuestos relacionados | |
Otros aniones | Malato |
Ácidos carboxílicos relacionados | Ácido succínico Ácido tartárico Ácido fumárico |
Compuestos relacionados | Butanol Butiraldehído Crotonaldehído Malato de sodio |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El ácido málico es un compuesto orgánico con la fórmula molecular HO2CCH (OH)CH2CO2H . Es un ácido dicarboxílico que producen todos los organismos vivos, contribuye al sabor ácido de las frutas y se utiliza como aditivo alimentario . El ácido málico tiene dos formas estereoisoméricas ( enantiómeros L y D ), aunque solo el isómero L existe de forma natural. Las sales y ésteres del ácido málico se conocen como malatos . El anión malato es un intermediario metabólico en el ciclo del ácido cítrico .
Etimología
La palabra «málico» se deriva del latín mālum , que significa «manzana». La palabra latina relacionada mālus , que significa «manzano», se utiliza como nombre del género Malus , que incluye todas las manzanas y manzanos silvestres; [5] y es el origen de otras clasificaciones taxonómicas como Maloideae , Malinae y Maleae .
Bioquímica
El ácido L -málico es la forma natural, mientras que una mezcla de ácido L -málico y D -málico se produce sintéticamente.
- Ácido L -málico ( S )
- Ácido D -málico ( R )
El malato desempeña un papel importante en la bioquímica . En el proceso de fijación del carbono C4 , el malato es una fuente de CO2 en el ciclo de Calvin . En el ciclo del ácido cítrico , el ( S )-malato es un intermediario, formado por la adición de un grupo -OH en la cara si del fumarato. También se puede formar a partir del piruvato mediante reacciones anapleróticas .
El malato también se sintetiza mediante la carboxilación del fosfoenolpiruvato en las células oclusivas de las hojas de las plantas. El malato, como anión doble, suele acompañar a los cationes de potasio durante la absorción de solutos en las células oclusivas para mantener el equilibrio eléctrico en la célula. La acumulación de estos solutos dentro de la célula oclusiva disminuye el potencial de soluto, lo que permite que el agua entre en la célula y promueva la apertura de los estomas.
En la comida
El ácido málico fue aislado por primera vez del jugo de manzana por Carl Wilhelm Scheele en 1785. [6] Antoine Lavoisier en 1787 propuso el nombre acide malique , que se deriva de la palabra latina para manzana, mālum —al igual que su nombre de género Malus . [7] [8] En alemán se llama Äpfelsäure (o Apfelsäure ) por el plural o singular de una cosa agria de la fruta de la manzana, pero la(s) sal(es) se llaman Malat(e) . El ácido málico es el ácido principal en muchas frutas, incluidos los albaricoques , las moras , los arándanos , las cerezas , las uvas , las ciruelas mirabel , los melocotones , las peras , las ciruelas y los membrillos , [9] y está presente en concentraciones más bajas en otras frutas, como los cítricos. Contribuye a la acidez de las manzanas verdes. Las manzanas ácidas contienen altas proporciones del ácido. Está presente en las uvas y en la mayoría de los vinos con concentraciones que a veces llegan a los 5 g/L. [10] Confiere un sabor ácido al vino ; la cantidad disminuye a medida que aumenta la madurez de la fruta . El sabor del ácido málico es muy claro y puro en el ruibarbo , una planta de la que es el sabor principal. También es el compuesto responsable del sabor ácido de la especia de zumaque . También es un componente de algunos sabores artificiales de vinagre , como las patatas fritas con sabor a "sal y vinagre". [11]
El proceso de fermentación maloláctica convierte el ácido málico en ácido láctico , mucho más suave . El ácido málico se encuentra de forma natural en todas las frutas y en muchas verduras, y se genera en el metabolismo de la fruta. [12]
El ácido málico, cuando se añade a los productos alimenticios, se denota con el número E E296. A veces se utiliza con o en lugar del ácido cítrico menos ácido en caramelos ácidos. Estos caramelos a veces se etiquetan con una advertencia que indica que el consumo excesivo puede causar irritación de la boca. Está aprobado para su uso como aditivo alimentario en la UE [13] , EE. UU. [14] y Australia y Nueva Zelanda [15] (donde figura con su número INS 296).
El ácido málico contiene 10 kJ (2,39 kilocalorías) de energía por gramo. [16]
Producción y reacciones principales
El ácido málico racémico se produce industrialmente mediante la doble hidratación del anhídrido maleico . En 2000, la capacidad de producción estadounidense era de 5.000 toneladas al año. Los enantiómeros se pueden separar mediante resolución quiral de la mezcla racémica. El ácido S -málico se obtiene por fermentación del ácido fumárico . [17]
La autocondensación del ácido málico en presencia de ácido sulfúrico fumante produce el ácido pirocumálico : [ 18]
- 2 HO 2 CCH(OH)CH 2 CO 2 H → HO 2 CC 4 H 3 O 2 + 2 CO + 4 H 2 O
Durante esta reacción se liberan monóxido de carbono y agua.
El ácido málico fue importante en el descubrimiento de la inversión de Walden y el ciclo de Walden , en el que el ácido (−)-málico primero se convierte en ácido (+)-clorosuccínico por acción del pentacloruro de fósforo . Luego, el óxido de plata húmedo convierte el compuesto de cloro en ácido (+)-málico, que luego reacciona con PCl 5 para formar el ácido (−)-clorosuccínico. El ciclo se completa cuando el óxido de plata convierte este compuesto nuevamente en ácido (−)-málico.
El ácido L -málico se utiliza para resolver la α-feniletilamina , un agente de resolución versátil por sí mismo. [19]
Defensa de las plantas
La suplementación del suelo con melaza aumenta la síntesis microbiana de ácido málico. Se cree que esto ocurre de forma natural como parte de la supresión de enfermedades por parte de los microbios del suelo , por lo que la enmienda del suelo con melaza se puede utilizar como tratamiento de cultivos en horticultura. [20]
Mapa interactivo de rutas
Haga clic en los genes, proteínas y metabolitos que aparecen a continuación para acceder a los artículos correspondientes. [§ 1]
- ^ El mapa de la ruta interactiva se puede editar en WikiPathways: "GlycolysisGluconeogenesis_WP534".
Véase también
- Acidos en el vino
- Lanzadera citrato-malato
- Metabolismo ácido de las crasuláceas
- Lanzadera de malato-aspartato
- Ácido maleico , resultante de la deshidratación del ácido málico.
Referencias
- ^ "Base de datos de sustancias químicas de todo el mundo de chemBlink". chemblink.com . Archivado desde el original el 22 de enero de 2009.
- ^ Datos para la investigación bioquímica (3.ª ed.). Oxford: Clarendon Press. 1986. ISBN 0-19-855358-7.OCLC 11865673 .
- ^ Silva, Andre MN; Kong, Xiaole; Hider, Robert C. (2009). "Determinación del valor pKa del grupo hidroxilo en los α-hidroxicarboxilatos citrato, malato y lactato por RMN de 13C: implicaciones para la coordinación de metales en sistemas biológicos". BioMetals . 22 (5): 771–778. doi :10.1007/s10534-009-9224-5. ISSN 0966-0844. PMID 19288211.
- ^ "Ácido DL-málico - (Ácido DL-málico) SDS". Merck Millipore .
- ^ Peffley, Ellen. "Peffley: Las manzanas silvestres se roban el espectáculo en otoño". Lubbock Avalanche-Journal . Consultado el 8 de agosto de 2022 .
- ^ Carl Wilhelm Scheele (1785) "Om Frukt- och Bår-syran" (Sobre el ácido de frutas y bayas), Kongliga Vetenskaps Academiens Nya Handlingar (Nuevas actas de la Real Academia de Ciencias), 6 : 17-27. De la página 21: "... vil jag hådanefter kalla den Åple-syran ". (... de ahora en adelante lo llamaré ácido de manzana ).
- ^ de Morveau, Lavoisier, Bertholet y de Fourcroy, Méthode de Nomenclature Chimique (París, Francia: Cuchet, 1787), p. 108.
- ^ Jensen, William B. (junio de 2007). "El origen de los nombres de ácido málico, maleico y malónico". Journal of Chemical Education . 84 (6): 924. Bibcode :2007JChEd..84..924J. doi :10.1021/ed084p924. ISSN 0021-9584.
- ^ Tabla I de "Fruchtsäuren". Wissenschaft Online Lexikon der Biologie . Archivado desde el original el 15 de mayo de 2016.
- ^ Ough, CS (1988). Métodos de análisis de mostos y vinos (2.ª ed.). Nueva York: J. Wiley. pág. 67. ISBN 0-471-62757-7.OCLC 16866762 .
- ^ "La ciencia detrás de las patatas fritas con sal y vinagre". seriouseats.com .
- ^ Ácido málico Archivado el 25 de junio de 2018 en Wayback Machine , Ingredientes de Bartek (consultado el 2 de febrero de 2012)
- ^ Agencia de Normas Alimentarias del Reino Unido: "Aditivos aprobados actualmente por la UE y sus números E" . Consultado el 27 de octubre de 2011 .
- ^ "Lista de estados de aditivos alimentarios". FDA . 26 de agosto de 2021 . Consultado el 5 de mayo de 2022 .
- ^ Código de normas alimentarias de Australia y Nueva Zelanda "Norma 1.2.4 - Etiquetado de ingredientes". 8 de septiembre de 2011. Consultado el 27 de octubre de 2011 .
- ^ Greenfield, Heather; Southgate, DAT (2003). Datos de composición de alimentos: producción, gestión y uso (2.ª ed.). Roma: Organización de las Naciones Unidas para la Alimentación y la Agricultura. p. 146. ISBN 978-92-5-104949-5. Recuperado el 10 de febrero de 2014 .
- ^ Karlheinz Miltenberge. "Ácidos hidroxicarboxílicos alifáticos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a13_507. ISBN 978-3527306732.
- ^ Richard H. Wiley, Newton R. Smith (1951). "Ácido cumálico". Síntesis orgánicas . 31 : 23. doi :10.15227/orgsyn.031.0023.
- ^ AW Ingersoll (1937). "D- y l-α-feniletilamina". Síntesis orgánicas . 17 : 80. doi :10.15227/orgsyn.017.0080.
- ^ Rosskopf, Erin; Di Gioia, Francesco; Hong, Jason C.; Pisani, Cristina; Kokalis-Burelle, Nancy (25 de agosto de 2020). "Enmiendas orgánicas para el control de patógenos y nematodos". Revisión anual de fitopatología . 58 (1). Revisiones anuales : 277–311. doi :10.1146/annurev-phyto-080516-035608. ISSN 0066-4286. PMID 32853099. S2CID 221360634.
Enlaces externos
- Calculadora: actividades de agua y solutos en ácido málico acuoso