Hierro
El hierro es un elemento químico ; tiene el símbolo Fe (del latín ferrum 'hierro') y número atómico 26. Es un metal que pertenece a la primera serie de transición y al grupo 8 de la tabla periódica . Es, por masa, el elemento más común en la Tierra , formando gran parte del núcleo externo e interno terrestre . Es el cuarto elemento más abundante en la corteza terrestre , siendo depositado principalmente por meteoritos en su estado metálico.
La extracción de metal utilizable de los minerales de hierro requiere hornos capaces de alcanzar 1.500 °C (2.730 °F), unos 500 °C (932 °F) más que los necesarios para fundir el cobre . Los humanos comenzaron a dominar ese proceso en Eurasia durante el segundo milenio a. C. y el uso de herramientas y armas de hierro comenzó a desplazar a las aleaciones de cobre , en algunas regiones, solo alrededor del 1200 a. C. Ese evento se considera la transición de la Edad del Bronce a la Edad del Hierro . En el mundo moderno , las aleaciones de hierro, como el acero , el acero inoxidable , el hierro fundido y los aceros especiales , son con diferencia los metales industriales más comunes, debido a sus propiedades mecánicas y su bajo coste. La industria siderúrgica es, pues, muy importante económicamente, y el hierro es el metal más barato, con un precio de unos pocos dólares por kilogramo o libra.
Las superficies de hierro puro prístinas y lisas son de un gris plateado similar a un espejo. El hierro reacciona fácilmente con el oxígeno y el agua para producir óxidos de hierro hidratados de color marrón a negro , comúnmente conocidos como óxido . A diferencia de los óxidos de algunos otros metales que forman capas pasivantes , el óxido ocupa más volumen que el metal y, por lo tanto, se desprende, exponiendo más superficies frescas a la corrosión. Químicamente, los estados de oxidación más comunes del hierro son el hierro (II) y el hierro (III) . El hierro comparte muchas propiedades de otros metales de transición, incluidos los otros elementos del grupo 8 , el rutenio y el osmio . El hierro forma compuestos en una amplia gama de estados de oxidación , de −4 a +7. El hierro también forma muchos compuestos de coordinación ; algunos de ellos, como el ferroceno , el ferrioxalato y el azul de Prusia , tienen importantes aplicaciones industriales, médicas o de investigación.
El cuerpo de un ser humano adulto contiene alrededor de 4 gramos (0,005% del peso corporal) de hierro, principalmente en la hemoglobina y la mioglobina . Estas dos proteínas desempeñan papeles esenciales en el transporte de oxígeno por la sangre y el almacenamiento de oxígeno en los músculos . Para mantener los niveles necesarios, el metabolismo del hierro humano requiere un mínimo de hierro en la dieta. El hierro también es el metal en el sitio activo de muchas enzimas redox importantes que se ocupan de la respiración celular y la oxidación y reducción en plantas y animales. [10]
Características
Alótropos

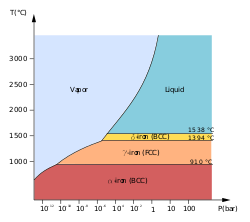
Se conocen al menos cuatro alótropos del hierro (disposiciones atómicas diferentes en el sólido), denominados convencionalmente α , γ , δ y ε .
Las primeras tres formas se observan a presiones ordinarias. A medida que el hierro fundido se enfría más allá de su punto de congelación de 1538 °C, cristaliza en su alótropo δ, que tiene una estructura cristalina cúbica centrada en el cuerpo (bcc) . A medida que se enfría aún más hasta 1394 °C, cambia a su alótropo de hierro γ, una estructura cristalina cúbica centrada en las caras (fcc), o austenita . A 912 °C y menos, la estructura cristalina vuelve a convertirse en el alótropo de hierro α bcc. [11]
Las propiedades físicas del hierro a presiones y temperaturas muy altas también se han estudiado ampliamente, [12] [13] debido a su relevancia para las teorías sobre los núcleos de la Tierra y otros planetas. Por encima de aproximadamente 10 GPa y temperaturas de unos pocos cientos de kelvin o menos, el hierro α cambia a otra estructura hexagonal compacta (hcp), que también se conoce como hierro ε . La fase γ de mayor temperatura también cambia a hierro ε, pero lo hace a mayor presión.
Existe evidencia experimental controvertida de una fase β estable a presiones superiores a 50 GPa y temperaturas de al menos 1500 K. Se supone que tiene una estructura ortorrómbica o doble hcp. [14] (De manera confusa, el término "hierro β" a veces también se usa para referirse al hierro α por encima de su punto de Curie, cuando cambia de ferromagnético a paramagnético, aunque su estructura cristalina no haya cambiado. [11] )
En general, se supone que el núcleo interno de la Tierra consiste en una aleación de hierro y níquel con estructura ε (o β). [15]
Puntos de fusión y ebullición
Los puntos de fusión y ebullición del hierro, junto con su entalpía de atomización , son más bajos que los de los elementos 3d anteriores, desde el escandio hasta el cromo , lo que muestra la menor contribución de los electrones 3d a la unión metálica a medida que son atraídos cada vez más hacia el núcleo inerte por el núcleo; [16] sin embargo, son más altos que los valores para el elemento anterior, el manganeso, porque ese elemento tiene una subcapa 3d medio llena y, en consecuencia, sus electrones d no se deslocalizan fácilmente. Esta misma tendencia aparece para el rutenio, pero no para el osmio . [17]
El punto de fusión del hierro está bien definido experimentalmente para presiones inferiores a 50 GPa. Para presiones mayores, los datos publicados (hasta 2007) aún varían en decenas de gigapascales y más de mil kelvin. [18]
Propiedades magnéticas

Por debajo de su punto de Curie de 770 °C (1420 °F; 1040 K), el hierro α cambia de paramagnético a ferromagnético : los espines de los dos electrones desapareados en cada átomo generalmente se alinean con los espines de sus vecinos, creando un campo magnético general . [20] Esto sucede porque los orbitales de esos dos electrones (d z 2 y d x 2 − y 2 ) no apuntan hacia átomos vecinos en la red y, por lo tanto, no están involucrados en el enlace metálico. [11]
En ausencia de una fuente externa de campo magnético, los átomos se dividen espontáneamente en dominios magnéticos de unos 10 micrómetros de diámetro [21] , de modo que los átomos de cada dominio tienen espines paralelos, pero algunos dominios tienen otras orientaciones. Por lo tanto, una pieza macroscópica de hierro tendrá un campo magnético general casi nulo.
La aplicación de un campo magnético externo hace que los dominios que están magnetizados en la misma dirección general crezcan a expensas de los adyacentes que apuntan en otras direcciones, reforzando el campo externo. Este efecto se explota en dispositivos que necesitan canalizar campos magnéticos para cumplir la función de diseño, como transformadores eléctricos , cabezales de grabación magnética y motores eléctricos . Las impurezas, los defectos de la red o los límites de grano y partículas pueden "fijar" los dominios en las nuevas posiciones, de modo que el efecto persista incluso después de que se elimine el campo externo, convirtiendo así el objeto de hierro en un imán (permanente) . [20]
Algunos compuestos de hierro, como las ferritas , que incluyen el mineral magnetita , una forma cristalina del óxido mixto de hierro (II, III) Fe 3 O 4 (aunque el mecanismo a escala atómica, el ferrimagnetismo , es algo diferente), exhiben un comportamiento similar. Los trozos de magnetita con magnetización permanente natural ( piedras imán ) proporcionaron las primeras brújulas para la navegación. Las partículas de magnetita se usaron ampliamente en medios de grabación magnéticos como memorias de núcleo , cintas magnéticas , disquetes y discos , hasta que fueron reemplazados por materiales a base de cobalto .
Isótopos
El hierro tiene cuatro isótopos estables : 54 Fe (5,845% del hierro natural), 56 Fe (91,754%), 57 Fe (2,119%) y 58 Fe (0,282%). También se han creado veinticuatro isótopos artificiales. De estos isótopos estables, solo 57 Fe tiene un espín nuclear (− 1 ⁄ 2 ). El nucleido 54 Fe teóricamente puede sufrir una doble captura de electrones para formar 54 Cr, pero el proceso nunca se ha observado y solo se ha establecido un límite inferior para la vida media de 4,4×10 20 años. [22]
El 60 Fe es un radionucleido extinto de vida media larga (2,6 millones de años). [23] No se encuentra en la Tierra, pero su producto de desintegración final es su nieta, el nucleido estable 60 Ni . [9] Gran parte del trabajo anterior sobre la composición isotópica del hierro se ha centrado en la nucleosíntesis del 60 Fe a través de estudios de meteoritos y formación de minerales. En la última década, los avances en espectrometría de masas han permitido la detección y cuantificación de variaciones diminutas y naturales en las proporciones de los isótopos estables del hierro. Gran parte de este trabajo está impulsado por las comunidades científicas de la Tierra y planetarias , aunque están surgiendo aplicaciones a sistemas biológicos e industriales. [24]
En las fases de los meteoritos Semarkona y Chervony Kut, una correlación entre la concentración de 60 Ni, la nieta de 60 Fe, y la abundancia de los isótopos estables de hierro proporcionó evidencia de la existencia de 60 Fe en el momento de la formación del Sistema Solar . Posiblemente la energía liberada por la desintegración de 60 Fe, junto con la liberada por 26 Al , contribuyó a la refundición y diferenciación de los asteroides después de su formación hace 4.600 millones de años. La abundancia de 60 Ni presente en material extraterrestre puede aportar más información sobre el origen y la historia temprana del Sistema Solar . [25]
El isótopo de hierro más abundante, el 56 Fe, es de particular interés para los científicos nucleares porque representa el punto final más común de la nucleosíntesis . [26] Dado que el 56 Ni (14 partículas alfa ) se produce fácilmente a partir de núcleos más ligeros en el proceso alfa en reacciones nucleares en supernovas (véase proceso de quema de silicio ), es el punto final de las cadenas de fusión dentro de estrellas extremadamente masivas . Aunque es posible añadir más partículas alfa, no obstante la secuencia termina efectivamente en el 56 Ni porque las condiciones en el interior estelar hacen que la competencia entre la fotodesintegración y el proceso alfa favorezca la fotodesintegración alrededor del 56 Ni. [27] [28] Este 56 Ni, que tiene una vida media de unos 6 días, se crea en cantidad en estas estrellas, pero pronto se desintegra mediante dos emisiones de positrones sucesivas dentro de los productos de desintegración de la supernova en la nube de gas remanente de la supernova , primero en 56 Co radiactivo y luego en 56 Fe estable. Como tal, el hierro es el elemento más abundante en el núcleo de las gigantes rojas , y es el metal más abundante en los meteoritos de hierro y en los núcleos metálicos densos de planetas como la Tierra . [29] También es muy común en el universo, en relación con otros metales estables de aproximadamente el mismo peso atómico . [29] [30] El hierro es el sexto elemento más abundante en el universo , y el elemento refractario más común. [31]

Aunque se podría obtener una pequeña ganancia de energía adicional sintetizando 62 Ni , que tiene una energía de enlace ligeramente superior a la del 56 Fe, las condiciones en las estrellas no son adecuadas para este proceso. La producción de elementos en supernovas favorece en gran medida al hierro sobre el níquel y, en cualquier caso, el 56 Fe todavía tiene una masa por nucleón menor que el 62 Ni debido a su mayor fracción de protones más ligeros. [32] Por lo tanto, los elementos más pesados que el hierro requieren una supernova para su formación, lo que implica una rápida captura de neutrones mediante el inicio de núcleos de 56 Fe. [29]
En un futuro lejano del universo, suponiendo que no se produzca la desintegración de protones , la fusión fría que se produciría mediante efecto túnel cuántico haría que los núcleos ligeros de la materia ordinaria se fusionaran en núcleos de 56 Fe. La fisión y la emisión de partículas alfa harían que los núcleos pesados se desintegraran en hierro, convirtiendo todos los objetos de masa estelar en esferas frías de hierro puro. [33]
Origen y ocurrencia en la naturaleza
Cosmogénesis
La abundancia de hierro en planetas rocosos como la Tierra se debe a su abundante producción durante la fusión descontrolada y la explosión de supernovas de tipo Ia , que dispersan el hierro en el espacio. [34] [35]
Hierro metalico

El hierro metálico o nativo rara vez se encuentra en la superficie de la Tierra porque tiende a oxidarse. Sin embargo, se cree que tanto el núcleo interno como el externo de la Tierra , que juntos representan el 35% de la masa de toda la Tierra, consisten principalmente en una aleación de hierro, posiblemente con níquel . Se cree que las corrientes eléctricas en el núcleo externo líquido son el origen del campo magnético de la Tierra . Se cree que los otros planetas terrestres ( Mercurio , Venus y Marte ), así como la Luna, tienen un núcleo metálico que consiste principalmente en hierro. También se cree que los asteroides de tipo M están hechos parcial o principalmente de una aleación de hierro metálico.
Los meteoritos de hierro, poco frecuentes , son la principal forma de hierro metálico natural en la superficie de la Tierra. Se han encontrado objetos hechos de hierro meteorítico trabajado en frío en varios sitios arqueológicos que datan de una época en la que la fundición de hierro aún no se había desarrollado; y se ha informado de que los inuit de Groenlandia utilizan el hierro del meteorito de Cabo York para herramientas y armas de caza. [36] Aproximadamente 1 de cada 20 meteoritos consiste en los minerales únicos de hierro y níquel taenita (35-80% de hierro) y kamacita (90-95% de hierro). [37] El hierro nativo también se encuentra raramente en basaltos que se han formado a partir de magmas que han entrado en contacto con rocas sedimentarias ricas en carbono, que han reducido la fugacidad del oxígeno lo suficiente como para que el hierro cristalice. Esto se conoce como hierro telúrico y se describe en unas pocas localidades, como la isla Disko en el oeste de Groenlandia, Yakutia en Rusia y Bühl en Alemania. [38]
Minerales del manto
La ferropericlasa (Mg,Fe)O , una solución sólida de periclasa (MgO) y wüstita (FeO), constituye aproximadamente el 20% del volumen del manto inferior de la Tierra, lo que la convierte en la segunda fase mineral más abundante en esa región después de la perovskita de silicato (Mg,Fe)SiO 3 ; también es el principal huésped del hierro en el manto inferior. [39] En la parte inferior de la zona de transición del manto, la reacción γ- (Mg,Fe) 2 [SiO 4 ] ↔ (Mg,Fe)[SiO 3 ] + (Mg,Fe)O transforma la γ-olivina en una mezcla de perovskita de silicato y ferropericlasa y viceversa. En la literatura, esta fase mineral del manto inferior también se denomina a menudo magnesiowüstita. [40] La perovskita de silicato puede formar hasta el 93% del manto inferior, [41] y la forma de hierro y magnesio, (Mg,Fe)SiO 3 , se considera el mineral más abundante en la Tierra, representando el 38% de su volumen. [42]
Corteza terrestre

Si bien el hierro es el elemento más abundante en la Tierra, la mayor parte de este hierro se concentra en los núcleos interno y externo . [43] [44] La fracción de hierro que se encuentra en la corteza terrestre solo representa alrededor del 5% de la masa total de la corteza y, por lo tanto, es solo el cuarto elemento más abundante en esa capa (después del oxígeno , el silicio y el aluminio ). [45]
La mayor parte del hierro en la corteza se combina con varios otros elementos para formar muchos minerales de hierro . Una clase importante son los minerales de óxido de hierro como la hematita (Fe 2 O 3 ), la magnetita (Fe 3 O 4 ) y la siderita (FeCO 3 ), que son los principales minerales de hierro . Muchas rocas ígneas también contienen los minerales de sulfuro pirrotita y pentlandita . [46] [47] Durante la meteorización , el hierro tiende a lixiviarse de los depósitos de sulfuro como sulfato y de los depósitos de silicato como bicarbonato. Ambos se oxidan en solución acuosa y precipitan incluso a un pH ligeramente elevado como óxido de hierro (III) . [48]

Los grandes depósitos de hierro son formaciones de hierro bandeado , un tipo de roca que consiste en capas delgadas repetidas de óxidos de hierro que se alternan con bandas de esquisto y sílex pobres en hierro . Las formaciones de hierro bandeado se formaron en el período comprendido entre hace 3.700 millones de años y hace 1.800 millones de años . [49] [50]
Los materiales que contienen óxidos de hierro (III) finamente molidos u óxido-hidróxidos, como el ocre , se han utilizado como pigmentos amarillos, rojos y marrones desde tiempos prehistóricos. También contribuyen al color de varias rocas y arcillas , incluidas formaciones geológicas enteras como las Painted Hills en Oregón y el Buntsandstein ("arenisca coloreada", Bunter británico ). [51] A través del Eisensandstein (una "arenisca de hierro" jurásica , por ejemplo de Donzdorf en Alemania) [52] y la piedra de Bath en el Reino Unido, los compuestos de hierro son responsables del color amarillento de muchos edificios y esculturas históricas. [53] El proverbial color rojo de la superficie de Marte se deriva de un regolito rico en óxido de hierro . [54]
Se encuentran cantidades significativas de hierro en el mineral de sulfuro de hierro pirita (FeS 2 ), pero es difícil extraer hierro de él y por lo tanto no se explota. [55] De hecho, el hierro es tan común que la producción generalmente se centra solo en minerales con cantidades muy altas de este mineral. [56]
Según el informe Metal Stocks in Society del Panel Internacional de Recursos , las reservas mundiales de hierro en uso en la sociedad son de 2.200 kg per cápita. Los países más desarrollados difieren en este aspecto de los países menos desarrollados (7.000–14.000 frente a 2.000 kg per cápita). [57]
Océanos
La ciencia oceánica ha demostrado el papel del hierro en los mares antiguos tanto en la biota marina como en el clima. [58]
Química y compuestos
Estado de oxidación | Compuesto representativo |
|---|---|
| −4 (d 10 s 2 ) | [FeIn6 − xSnx ] [ 59 ] |
| −2 ( d10 ) | Tetracarbonilferrato de disodio (reactivo de Collman) |
| −1 ( d9 ) | Fé 2(CO)2− 8 |
| 0 ( d8 ) | Pentacarbonilo de hierro |
| 1 (día 7 ) | Dímero de dicarbonilo de ciclopentadienilo ("Fp 2 ") |
| 2 (día 6 ) | Sulfato ferroso , Ferroceno |
| 3 (día 5 ) | Cloruro férrico , Tetrafluoroborato de ferrocenio |
| 4 ( d4 ) | Fe(diares) 2Cl2+ 2, FeO( BF4 ) 2 |
| 5 (día 3 ) | FeO3− 4 |
| 6 ( d2 ) | Ferrato de potasio |
| 7 (d 1 ) | [FeO 4 ] – (aislamiento de matriz, 4K) |
El hierro muestra las propiedades químicas características de los metales de transición , a saber, la capacidad de formar estados de oxidación variables que difieren en pasos de uno y una química organometálica y de coordinación muy grande : de hecho, fue el descubrimiento de un compuesto de hierro, el ferroceno , lo que revolucionó este último campo en la década de 1950. [60] El hierro a veces se considera como un prototipo para todo el bloque de metales de transición, debido a su abundancia y al inmenso papel que ha desempeñado en el progreso tecnológico de la humanidad. [61] Sus 26 electrones están dispuestos en la configuración [Ar]3d 6 4s 2 , de los cuales los electrones 3d y 4s están relativamente cerca en energía, y por lo tanto se pueden ionizar varios electrones. [17]
El hierro forma compuestos principalmente en los estados de oxidación +2 ( hierro(II) , "ferroso") y +3 ( hierro(III) , "férrico"). El hierro también se presenta en estados de oxidación superiores , por ejemplo, el ferrato de potasio púrpura ( K2FeO4 ), que contiene hierro en su estado de oxidación +6. El anión [FeO4 ] – con hierro en su estado de oxidación +7, junto con un isómero peroxo de hierro(V), se ha detectado mediante espectroscopia infrarroja a 4 K después de la cocondensación de átomos de Fe eliminados por láser con una mezcla de O2 / Ar. [62] El hierro(IV) es un intermediario común en muchas reacciones de oxidación bioquímica. [63] [64] Numerosos compuestos de organohierro contienen estados de oxidación formales de +1, 0, −1 o incluso −2. Los estados de oxidación y otras propiedades de enlace a menudo se evalúan utilizando la técnica de espectroscopia Mössbauer . [65] Muchos compuestos de valencia mixta contienen centros de hierro (II) y hierro (III), como la magnetita y el azul de Prusia ( Fe 4 (Fe[CN] 6 ) 3 ). [64] Este último se utiliza como el "azul" tradicional en los planos . [66]
El hierro es el primero de los metales de transición que no puede alcanzar su estado de oxidación grupal de +8, aunque sus congéneres más pesados, el rutenio y el osmio, sí pueden, y el rutenio tiene más dificultades que el osmio. [11] El rutenio exhibe una química catiónica acuosa en sus estados de oxidación bajos similar a la del hierro, pero el osmio no, lo que favorece los estados de oxidación altos en los que forma complejos aniónicos. [11] En la segunda mitad de la serie de transición 3d, las similitudes verticales hacia abajo en los grupos compiten con las similitudes horizontales del hierro con sus vecinos cobalto y níquel en la tabla periódica, que también son ferromagnéticos a temperatura ambiente y comparten una química similar. Como tal, el hierro, el cobalto y el níquel a veces se agrupan juntos como la tríada del hierro . [61]
A diferencia de muchos otros metales, el hierro no forma amalgamas con el mercurio . Por ello, el mercurio se comercializa en frascos estandarizados de 76 libras (34 kg) hechos de hierro. [67]
El hierro es, con mucho, el elemento más reactivo de su grupo; es pirofórico cuando está finamente dividido y se disuelve fácilmente en ácidos diluidos, dando Fe 2+ . Sin embargo, no reacciona con ácido nítrico concentrado y otros ácidos oxidantes debido a la formación de una capa de óxido impermeable, que sin embargo puede reaccionar con ácido clorhídrico . [11] El hierro de alta pureza, llamado hierro electrolítico , se considera resistente al óxido, debido a su capa de óxido.
Compuestos binarios
Óxidos y sulfuros
El hierro forma diversos compuestos de óxido e hidróxido ; los más comunes son el óxido de hierro (II, III) (Fe 3 O 4 ) y el óxido de hierro (III) (Fe 2 O 3 ). También existe el óxido de hierro (II) , aunque es inestable a temperatura ambiente. A pesar de sus nombres, en realidad son todos compuestos no estequiométricos cuyas composiciones pueden variar. [68] Estos óxidos son los principales minerales para la producción de hierro (véase el horno de vapor y el alto horno). También se utilizan en la producción de ferritas , medios de almacenamiento magnéticos útiles en computadoras y pigmentos. El sulfuro más conocido es la pirita de hierro (FeS 2 ), también conocida como oro de los tontos debido a su brillo dorado. [64] No es un compuesto de hierro (IV), sino que es en realidad un polisulfuro de hierro (II) que contiene Fe 2+ y S2−
2iones en una estructura distorsionada de cloruro de sodio . [68]

Haluros
_chloride_hexahydrate.jpg/440px-Iron(III)_chloride_hexahydrate.jpg)
Los haluros ferrosos y férricos binarios son bien conocidos. Los haluros ferrosos surgen típicamente del tratamiento del metal de hierro con el ácido hidrohálico correspondiente para dar las sales hidratadas correspondientes. [64]
- Fe + 2HX → FeX2 + H2 ( X = F, Cl, Br, I)
El hierro reacciona con flúor, cloro y bromo para dar los haluros férricos correspondientes, siendo el cloruro férrico el más común. [69]
- 2 Fe + 3 X 2 → 2 Fe X 3 (X = F, Cl, Br)
El yoduro férrico es una excepción, siendo termodinámicamente inestable debido al poder oxidante del Fe 3+ y al alto poder reductor del I − : [69]
- 2I − + 2Fe 3+ → I 2 + 2Fe 2+ (E 0 = +0,23 V)
El yoduro férrico, un sólido negro, no es estable en condiciones ordinarias, pero se puede preparar mediante la reacción de pentacarbonilo de hierro con yodo y monóxido de carbono en presencia de hexano y luz a una temperatura de -20 °C, con oxígeno y agua excluidos. [69] Se sabe que los complejos de yoduro férrico con algunas bases blandas son compuestos estables. [70] [71]
Química de soluciones

Los potenciales de reducción estándar en solución acuosa ácida para algunos iones de hierro comunes se dan a continuación: [11]
[Fe( H2O ) 6 ] 2+ + 2e− ⇌ Fe E 0 = −0,447 V [Fe( H2O ) 6 ] 3+ + e− ⇌ [Fe( H2O ) 6 ] 2+ E0 = +0,77 V FeO2−
4+ 8 H 3 O + + 3 e −⇌ [Fe( H2O ) 6 ] 3+ + 6H2O E0 = +2,20 V
El anión ferrato tetraédrico rojo-púrpura (VI) es un agente oxidante tan fuerte que oxida el amoníaco a nitrógeno (N 2 ) y el agua a oxígeno: [69]
- 4FeO2−
4+ 34 horas
2O → 4 [Fe( H2O ) 6 ] 3+ + 20OH−
+ 3O2
El complejo hexacuoso violeta pálido [Fe(H 2 O) 6 ] 3+ es un ácido tal que por encima de pH 0 está completamente hidrolizado: [72]
[Fe( H2O ) 6 ] 3+ ⇌ [Fe(H2O ) 5 ( OH)] 2+ + H + K = 10 −3,05 mol dm −3 [Fe( H2O ) 5 (OH)] 2+ ⇌ [Fe(H2O ) 4 ( OH) 2 ] + + H + K = 10 −3,26 mol dm −3 2[Fe( H2O ) 6 ] 3+ ⇌ [Fe( H2O ) 4 (OH)]4+2+ 2H + + 2H2O K = 10 −2,91 mol dm −3
-sulfate-heptahydrate-sample.jpg/440px-Iron(II)-sulfate-heptahydrate-sample.jpg)
A medida que el pH se eleva por encima de 0, se forman las especies hidrolizadas amarillas anteriores y, a medida que se eleva por encima de 2-3, precipita de la solución óxido de hierro(III) hidratado de color marrón rojizo. Aunque el Fe3 + tiene una configuración ad 5 , su espectro de absorción no es como el del Mn2 + con sus bandas d–d débiles y de espín prohibido, porque el Fe3 + tiene una carga positiva más alta y es más polarizante, lo que reduce la energía de sus absorciones de transferencia de carga de ligando a metal . Por lo tanto, todos los complejos anteriores están coloreados bastante fuertemente, con la única excepción del ion hexaquo, e incluso este tiene un espectro dominado por la transferencia de carga en la región cercana al ultravioleta. [72] Por otro lado, el ion hexaquo de hierro(II) verde pálido [Fe(H2O ) 6 ] 2+ no sufre una hidrólisis apreciable. No se desprende dióxido de carbono cuando se añaden aniones de carbonato , lo que en cambio da como resultado la precipitación de carbonato de hierro(II) blanco . El exceso de dióxido de carbono forma bicarbonato, ligeramente soluble, que se encuentra comúnmente en las aguas subterráneas, pero se oxida rápidamente en el aire para formar óxido de hierro (III) , que es responsable de los depósitos marrones presentes en una cantidad considerable de arroyos. [73]
Compuestos de coordinación
Debido a su estructura electrónica, el hierro tiene una coordinación y química organometálica muy grande.

Se conocen muchos compuestos de coordinación de hierro. Un anión típico de seis coordenadas es el hexacloroferrato (III), [FeCl 6 ] 3− , que se encuentra en la sal mixta cloruro de tetrakis(metilamonio) hexacloroferrato (III) . [74] [75] Los complejos con múltiples ligandos bidentados tienen isómeros geométricos . Por ejemplo, el complejo trans - clorohidridobis(bis-1,2-(difenilfosfino)etano)hierro (II) se utiliza como material de partida para compuestos con la fracción Fe( dppe ) 2 . [76] [77] El ion ferrioxalato con tres ligandos oxalato muestra quiralidad helicoidal con sus dos geometrías no superponibles etiquetadas Λ (lambda) para el eje de tornillo zurdo y Δ (delta) para el eje de tornillo diestro, de acuerdo con las convenciones de la IUPAC. [72] El ferrioxalato de potasio se utiliza en actinometría química y, junto con su sal de sodio, se somete a fotorreducción aplicada en los procesos fotográficos de estilo antiguo. El dihidrato de oxalato de hierro (II) tiene una estructura polimérica con iones de oxalato coplanares que forman puentes entre los centros de hierro y el agua de cristalización que se encuentra formando las tapas de cada octaedro, como se ilustra a continuación. [78]

iron(III)_chloride.jpg/440px-Pentaaqua(thiocyanato)iron(III)_chloride.jpg)
Los complejos de hierro (III) son bastante similares a los de cromo (III), con la excepción de la preferencia del hierro (III) por ligandos donantes de O en lugar de ligandos donantes de N. Estos últimos tienden a ser bastante más inestables que los complejos de hierro (II) y a menudo se disocian en agua. Muchos complejos de Fe-O muestran colores intensos y se utilizan como pruebas para fenoles o enoles . Por ejemplo, en la prueba de cloruro férrico , utilizada para determinar la presencia de fenoles, el cloruro de hierro (III) reacciona con un fenol para formar un complejo de color violeta oscuro: [72]
- 3 ArOH + FeCl 3 → Fe(OAr) 3 + 3 HCl (Ar = arilo )
Entre los complejos de haluro y pseudohaluro, los complejos de flúor de hierro(III) son los más estables, siendo el incoloro [FeF 5 (H 2 O)] 2− el más estable en solución acuosa. Los complejos de cloro son menos estables y favorecen la coordinación tetraédrica como en [FeCl 4 ] − ; [FeBr 4 ] − y [FeI 4 ] − se reducen fácilmente a hierro(II). El tiocianato es una prueba común para la presencia de hierro(III), ya que forma el rojo sangre [Fe(SCN)(H 2 O) 5 ] 2+ . Al igual que el manganeso(II), la mayoría de los complejos de hierro(III) son de alto espín, las excepciones son aquellos con ligandos que están altos en la serie espectroquímica, como el cianuro . Un ejemplo de un complejo de hierro(III) de bajo espín es [Fe(CN) 6 ] 3− . El hierro muestra una gran variedad de estados de espín electrónico , incluidos todos los valores posibles de número cuántico de espín para un elemento del bloque d, desde 0 (diamagnético) hasta 5 ⁄ 2 (5 electrones desapareados). Este valor es siempre la mitad del número de electrones desapareados. Los complejos con cero a dos electrones desapareados se consideran de espín bajo y aquellos con cuatro o cinco se consideran de espín alto. [68]
Los complejos de hierro (II) son menos estables que los complejos de hierro (III), pero la preferencia por los ligandos O -donadores es menos marcada, de modo que, por ejemplo, se conoce [Fe(NH 3 ) 6 ] 2+ , mientras que no se conoce [Fe(NH 3 ) 6 ] 3+ . Tienen una tendencia a oxidarse a hierro (III), pero esto puede moderarse con un pH bajo y los ligandos específicos utilizados. [73]
Compuestos organometálicos

Pentacarbonilo de hierro
La química de organohierro es el estudio de los compuestos organometálicos de hierro, donde los átomos de carbono están unidos covalentemente al átomo de metal. Son muchos y variados, incluyendo complejos de cianuro , complejos de carbonilo , compuestos sándwich y semisándwich .

El azul de Prusia o "ferrocianuro férrico", Fe 4 [Fe(CN) 6 ] 3 , es un complejo de hierro-cianuro muy conocido y muy utilizado como pigmento y en otras aplicaciones. Su formación se puede utilizar como una prueba de química húmeda simple para distinguir entre soluciones acuosas de Fe 2+ y Fe 3+ a medida que reaccionan (respectivamente) con ferricianuro de potasio y ferrocianuro de potasio para formar azul de Prusia. [64]
Otro ejemplo antiguo de un compuesto de organohierro es el pentacarbonilo de hierro , Fe(CO) 5 , en el que un átomo de hierro neutro está unido a los átomos de carbono de cinco moléculas de monóxido de carbono . El compuesto se puede utilizar para hacer polvo de hierro carbonílico , una forma altamente reactiva de hierro metálico. La termólisis del pentacarbonilo de hierro da lugar a un complejo con un grupo de tres átomos de hierro en su núcleo. El reactivo de Collman, el tetracarbonilferrato de disodio , es un reactivo útil para la química orgánica; contiene hierro en el estado de oxidación −2. El dímero de dicarbonilo de ciclopentadieniliron contiene hierro en el raro estado de oxidación +1. [79]
Un hito en este campo fue el descubrimiento en 1951 del compuesto sándwich notablemente estable ferroceno Fe(C 5 H 5 ) 2 , por Pauson y Kealy [80] e independientemente por Miller y colegas [81] , cuya sorprendente estructura molecular fue determinada solo un año después por Woodward y Wilkinson [82] y Fischer . [83] El ferroceno sigue siendo una de las herramientas y modelos más importantes en esta clase. [84]
Como catalizadores se utilizan especies organometálicas centradas en el hierro . El complejo de Knölker , por ejemplo, es un catalizador de hidrogenación por transferencia para cetonas . [85]
Usos industriales
Los compuestos de hierro que se producen a mayor escala en la industria son el sulfato de hierro (II) (FeSO 4 ·7 H 2 O ) y el cloruro de hierro (III) (FeCl 3 ). El primero es una de las fuentes de hierro (II) más fácilmente disponibles, pero es menos estable a la oxidación aérea que la sal de Mohr ( (NH 4 ) 2 Fe(SO 4 ) 2 ·6H 2 O ). Los compuestos de hierro (II) tienden a oxidarse a compuestos de hierro (III) en el aire. [64]
Historia
Desarrollo de la metalurgia del hierro
El hierro es uno de los elementos indudablemente conocidos en el mundo antiguo. [86] Se ha trabajado o forjado durante milenios. Sin embargo, los artefactos de hierro de gran antigüedad son mucho más raros que los objetos hechos de oro o plata debido a la facilidad con la que el hierro se corroe. [87] La tecnología se desarrolló lentamente, e incluso después del descubrimiento de la fundición, pasaron muchos siglos hasta que el hierro reemplazó al bronce como el metal preferido para herramientas y armas.
Hierro meteorítico

GA Wainwright encontró en Gerzeh , Egipto, cuentas fabricadas con hierro meteórico en el año 3500 a. C. o antes . [88] Las cuentas contienen un 7,5 % de níquel, lo que es una señal de origen meteórico, ya que el hierro que se encuentra en la corteza terrestre generalmente solo tiene impurezas minúsculas de níquel.
El hierro meteórico era muy apreciado debido a su origen en los cielos y a menudo se usaba para forjar armas y herramientas. [88] Por ejemplo, se encontró una daga hecha de hierro meteórico en la tumba de Tutankamón , que contenía proporciones similares de hierro, cobalto y níquel a un meteorito descubierto en el área, depositado por una antigua lluvia de meteoritos. [89] [90] [91] Los artículos que probablemente fueron hechos de hierro por los egipcios datan de 3000 a 2500 a. C. [87]
El hierro meteorítico es comparativamente blando y dúctil y se forja fácilmente en frío, pero puede volverse quebradizo cuando se calienta debido al contenido de níquel . [92]
Hierro forjado

La primera producción de hierro comenzó en la Edad del Bronce Medio , pero pasaron varios siglos antes de que el hierro desplazara al bronce. Se hicieron muestras de hierro fundido de Asmar , Mesopotamia y Tall Chagar Bazaar en el norte de Siria en algún momento entre 3000 y 2700 a. C. [93] Los hititas establecieron un imperio en el centro-norte de Anatolia alrededor de 1600 a. C. Parecen ser los primeros en comprender la producción de hierro a partir de sus minerales y lo consideraban muy importante en su sociedad. [94] Los hititas comenzaron a fundir hierro entre 1500 y 1200 a. C. y la práctica se extendió al resto del Cercano Oriente después de que su imperio cayera en 1180 a. C. [93] El período posterior se llama Edad del Hierro .
Se han encontrado artefactos de hierro fundido en la India que datan de 1800 a 1200 a. C., [95] y en el Levante desde aproximadamente 1500 a. C. (lo que sugiere que la fundición se realizó en Anatolia o el Cáucaso ). [96] [97] Se han utilizado supuestas referencias (compárese con la historia de la metalurgia en el sur de Asia ) al hierro en los Vedas indios para afirmar un uso muy temprano del hierro en la India, respectivamente, para datar los textos como tales. El término rigveda ayas (metal) se refiere al cobre, mientras que el hierro, que se denomina śyāma ayas , literalmente "cobre negro", se menciona por primera vez en el Atharvaveda post-rigvédico . [98]
Algunas evidencias arqueológicas sugieren que el hierro se fundía en Zimbabwe y el sudeste de África ya en el siglo VIII a. C. [99] El trabajo del hierro se introdujo en Grecia a fines del siglo XI a. C., desde donde se extendió rápidamente por toda Europa. [100]

La difusión de la siderurgia en Europa central y occidental está asociada a la expansión celta . Según Plinio el Viejo , el uso del hierro era común en la época romana . [88] En las tierras de lo que ahora se considera China, el hierro aparece aproximadamente entre el 700 y el 500 a. C. [101] La fundición de hierro puede haberse introducido en China a través de Asia central. [102] La evidencia más temprana del uso de un alto horno en China data del siglo I d. C., [103] y los hornos de cubilote se usaban ya en el período de los Reinos Combatientes (403-221 a. C.). [104] El uso del alto horno y del cubilote siguió estando muy extendido durante las dinastías Tang y Song . [105]
Durante la Revolución Industrial en Gran Bretaña, Henry Cort comenzó a refinar el hierro, desde el arrabio hasta el hierro forjado (o hierro en barras), utilizando sistemas de producción innovadores. En 1783 patentó el proceso de pudling para refinar el mineral de hierro. Más tarde fue mejorado por otros, entre ellos Joseph Hall . [106]
Hierro fundido
El hierro fundido se produjo por primera vez en China durante el siglo V a. C., [107] pero apenas se encontró en Europa hasta el período medieval. [108] [109] Los primeros artefactos de hierro fundido fueron descubiertos por arqueólogos en lo que ahora es el moderno condado de Luhe , Jiangsu en China. El hierro fundido se usaba en la antigua China para la guerra, la agricultura y la arquitectura. [110] Durante el período medieval , se encontraron medios en Europa para producir hierro forjado a partir de hierro fundido (en este contexto conocido como arrabio ) utilizando forjas de refinación . Para todos estos procesos, se necesitaba carbón vegetal como combustible. [111]

Los altos hornos medievales tenían unos 3 metros de alto y estaban hechos de ladrillos ignífugos; el aire forzado se suministraba normalmente mediante fuelles accionados manualmente. [109] Los altos hornos modernos han crecido mucho más, con hogares de catorce metros de diámetro que les permiten producir miles de toneladas de hierro cada día, pero funcionan esencialmente de la misma manera que en la época medieval. [111]
En 1709, Abraham Darby I estableció un alto horno alimentado con coque para producir hierro fundido, reemplazando al carbón vegetal, aunque siguió utilizando altos hornos. La consiguiente disponibilidad de hierro barato fue uno de los factores que llevaron a la Revolución Industrial . Hacia fines del siglo XVIII, el hierro fundido comenzó a reemplazar al hierro forjado para ciertos propósitos, porque era más barato. El contenido de carbono en el hierro no se implicó como la razón de las diferencias en las propiedades del hierro forjado, el hierro fundido y el acero hasta el siglo XVIII. [93]
Como el hierro se estaba volviendo más barato y abundante, también se convirtió en un material estructural importante después de la construcción del primer puente de hierro innovador en 1778. Este puente todavía se mantiene en pie hoy como un monumento al papel que jugó el hierro en la Revolución Industrial. Después de esto, el hierro se utilizó en rieles, barcos, buques, acueductos y edificios, así como en cilindros de hierro en máquinas de vapor . [111] Los ferrocarriles han sido fundamentales para la formación de la modernidad y las ideas de progreso [112] y varios idiomas se refieren a los ferrocarriles como caminos de hierro (por ejemplo, francés chemin de fer , alemán Eisenbahn , turco demiryolu , ruso железная дорога , chino, japonés y coreano鐵道, vietnamita đường sắt ).
Acero
El acero (con un contenido de carbono menor que el hierro fundido pero mayor que el hierro forjado) se producía por primera vez en la antigüedad mediante el uso de una forjadora . Los herreros de Luristán , en el oeste de Persia, ya fabricaban acero de buena calidad en el año 1000 a. C. [93] Luego, se desarrollaron versiones mejoradas, el acero Wootz de la India y el acero de Damasco, alrededor del 300 a. C. y el 500 d. C. respectivamente. Estos métodos eran especializados, por lo que el acero no se convirtió en un producto básico importante hasta la década de 1850. [113]
En el siglo XVII se idearon nuevos métodos para producirlo mediante la carburación de barras de hierro en el proceso de cementación . En la Revolución Industrial se idearon nuevos métodos para producir barras de hierro sin carbón, que luego se aplicaron para producir acero. A fines de la década de 1850, Henry Bessemer inventó un nuevo proceso de fabricación de acero que implicaba soplar aire a través de arrabio fundido para producir acero dulce. Esto hizo que el acero fuera mucho más económico, lo que llevó a que el hierro forjado ya no se produjera en grandes cantidades. [114]
Fundamentos de la química moderna
En 1774, Antoine Lavoisier utilizó la reacción del vapor de agua con hierro metálico dentro de un tubo de hierro incandescente para producir hidrógeno en sus experimentos que llevaron a la demostración de la conservación de la masa , lo que fue fundamental para cambiar la química de una ciencia cualitativa a una cuantitativa. [115]
Papel simbólico
.jpg/440px-Eisernes_Kreuz_(1914).jpg)
El hierro desempeña un papel determinado en la mitología y ha encontrado diversos usos como metáfora y en el folclore . En Los trabajos y los días del poeta griego Hesíodo (líneas 109-201) se enumeran diferentes eras del hombre que llevan el nombre de metales como el oro, la plata, el bronce y el hierro para dar cuenta de las sucesivas eras de la humanidad. [116] La Edad del Hierro estaba estrechamente relacionada con Roma, y en Las metamorfosis de Ovidio
Las virtudes, desesperadas, abandonan la tierra y la depravación del hombre se vuelve universal y completa. El acero duro lo sustituyó.
— Ovidio, Metamorfosis , Libro I, Edad de hierro, línea 160 y siguientes.
Un ejemplo de la importancia del papel simbólico del hierro se puede encontrar en la Campaña Alemana de 1813. Federico Guillermo III encargó entonces la primera Cruz de Hierro como condecoración militar. La joyería de hierro de Berlín alcanzó su pico de producción entre 1813 y 1815, cuando la familia real prusiana instó a los ciudadanos a donar joyas de oro y plata para la financiación militar. La inscripción Ich gab Gold für Eisen (Di oro por hierro) también se utilizó en posteriores esfuerzos bélicos. [117]
Producción de hierro metálico

Rutas de laboratorio
Para algunos propósitos limitados cuando es necesario, el hierro puro se produce en el laboratorio en pequeñas cantidades reduciendo el óxido o hidróxido puro con hidrógeno, o formando pentacarbonilo de hierro y calentándolo a 250 °C para que se descomponga y forme polvo de hierro puro. [48] Otro método es la electrólisis del cloruro ferroso sobre un cátodo de hierro. [118]
Ruta industrial principal
| País | Mineral de hierro | Hierro fundido | Plancha directa | Acero |
|---|---|---|---|---|
 Porcelana Porcelana | 1.114,9 | 549,4 | 573.6 | |
 Australia Australia | 393,9 | 4.4 | 5.2 | |
 Brasil Brasil | 305.0 | 25.1 | 0,011 | 26.5 |
 Japón Japón | 66,9 | 87,5 | ||
 India India | 257,4 | 38.2 | 23.4 | 63,5 |
 Rusia Rusia | 92.1 | 43.9 | 4.7 | 60.0 |
 Ucrania Ucrania | 65,8 | 25.7 | 29.9 | |
 Corea del Sur Corea del Sur | 0,1 | 27.3 | 48.6 | |
 Alemania Alemania | 0,4 | 20.1 | 0,38 | 32.7 |
| Mundo | 1.594,9 | 914.0 | 64,5 | 1.232,4 |
En la actualidad, la producción industrial de hierro o acero consta de dos etapas principales. En la primera etapa, el mineral de hierro se reduce con coque en un alto horno y el metal fundido se separa de las impurezas gruesas, como los minerales de silicato . Esta etapa produce una aleación ( arrabio ) que contiene cantidades relativamente grandes de carbono. En la segunda etapa, la cantidad de carbono en el arrabio se reduce por oxidación para producir hierro forjado, acero o hierro fundido. [120] En esta etapa se pueden añadir otros metales para formar aceros aleados .
Procesamiento en alto horno
El alto horno se carga con minerales de hierro, generalmente hematita Fe2O3 o magnetita Fe3O4 , junto con coque ( carbón que se ha horneado por separado para eliminar los componentes volátiles) y fundente ( caliza o dolomita ) . Se insuflan "ráfagas" de aire precalentado a 900 °C (a veces enriquecido con oxígeno) a través de la mezcla, en cantidad suficiente para convertir el carbono en monóxido de carbono : [120]
- 2C + O2 → 2CO
Esta reacción eleva la temperatura a unos 2000 °C. El monóxido de carbono reduce el mineral de hierro a hierro metálico: [120]
- Fe 2 O 3 + 3 CO → 2 Fe + 3 CO 2
Parte del hierro en la región inferior de alta temperatura del horno reacciona directamente con el coque: [120]
- 2 Fe 2 O 3 + 3 C → 4 Fe + 3 CO 2
El fundente elimina los minerales silíceos del mineral, que de otro modo obstruirían el horno: el calor del horno descompone los carbonatos en óxido de calcio , que reacciona con cualquier exceso de sílice para formar una escoria compuesta de silicato de calcio CaSiO 3 u otros productos. A la temperatura del horno, el metal y la escoria están fundidos. Se acumulan en el fondo como dos capas líquidas inmiscibles (con la escoria en la parte superior), que luego se separan fácilmente. [120] La escoria se puede utilizar como material en la construcción de carreteras o para mejorar los suelos pobres en minerales para la agricultura . [109]
Por lo tanto, la fabricación de acero sigue siendo uno de los mayores contribuyentes industriales a las emisiones de CO 2 en el mundo. [121]
- Ilustración china del siglo XVII de trabajadores en un alto horno, fabricando hierro forjado a partir de arrabio [122]
- Cómo se extraía el hierro en el siglo XIX
- Horno de hierro en Columbus, Ohio, 1922
Fabricación de acero
El arrabio producido mediante el proceso de alto horno contiene hasta un 4-5% de carbono (en masa), con pequeñas cantidades de otras impurezas como azufre, magnesio, fósforo y manganeso. Este alto nivel de carbono lo hace relativamente débil y quebradizo. Al reducir la cantidad de carbono a un 0,002-2,1% se produce acero , que puede ser hasta 1000 veces más duro que el hierro puro. Se puede fabricar una gran variedad de artículos de acero mediante trabajo en frío , laminado en caliente , forjado , mecanizado , etc. Al eliminar las impurezas del arrabio, pero dejando un 2-4% de carbono, se obtiene el hierro fundido , que se moldea en fundiciones para fabricar artículos como estufas, tuberías, radiadores, farolas y rieles. [120]
Los productos de acero suelen someterse a diversos tratamientos térmicos después de ser forjados para darles forma. El recocido consiste en calentarlos a 700–800 °C durante varias horas y luego enfriarlos gradualmente. Esto hace que el acero sea más blando y más trabajable. [123]
- Este montón de pellets de mineral de hierro se utilizará en la producción de acero.
- Una olla de hierro fundido que se utiliza para fabricar acero.
Reducción directa de hierro
Debido a las preocupaciones ambientales, se han desarrollado métodos alternativos para procesar el hierro. La " reducción directa del hierro " reduce el mineral de hierro a un trozo ferroso llamado hierro "esponjoso" o hierro "directo" que es adecuado para la fabricación de acero. [109] Dos reacciones principales comprenden el proceso de reducción directa:
El gas natural se oxida parcialmente (con calor y un catalizador): [109]
- 2CH4 +O2 → 2CO + 4H2
Luego, el mineral de hierro se trata con estos gases en un horno, produciendo hierro esponjado sólido: [109]
- Fe 2 O 3 + CO + 2 H 2 → 2 Fe + CO 2 + 2 H 2 O
La sílice se elimina añadiendo un fundente de piedra caliza como se describió anteriormente. [109]
Proceso de termita
La ignición de una mezcla de polvo de aluminio y óxido de hierro produce hierro metálico a través de la reacción de termita :
- Fe 2 O 3 + 2 Al → 2 Fe + Al 2 O 3
Alternativamente, el arrabio se puede transformar en acero (con hasta un 2% de carbono) o hierro forjado (hierro comercialmente puro). Se han utilizado varios procesos para esto, incluidas las forjas de refinación , los hornos de pudling , los convertidores Bessemer , los hornos de solera abierta , los hornos de oxígeno básico y los hornos de arco eléctrico . En todos los casos, el objetivo es oxidar parte o la totalidad del carbono, junto con otras impurezas. Por otro lado, se pueden agregar otros metales para hacer aceros aleados. [111]
Electrólisis de óxido fundido
La electrólisis de óxido fundido (EMF) utiliza la electrólisis del óxido de hierro fundido para producir hierro metálico. Se estudia en experimentos a escala de laboratorio y se propone como un método para la producción industrial de hierro que no tiene emisiones directas de dióxido de carbono. Utiliza un cátodo de hierro líquido, un ánodo formado a partir de una aleación de cromo, aluminio y hierro, [124] y el electrolito es una mezcla de óxidos metálicos fundidos en los que se disuelve el mineral de hierro. La corriente mantiene el electrolito fundido y reduce el óxido de hierro. Se produce gas oxígeno además del hierro líquido. Las únicas emisiones de dióxido de carbono provienen de la electricidad generada por combustibles fósiles que se utiliza para calentar y reducir el metal. [125] [126] [127]
Aplicaciones
| Material | Presión de vapor (MPa) | BH ( Brinell ) |
|---|---|---|
| Bigotes de hierro | 11000 | |
Acero ausformado (endurecido) | 2930 | 850–1200 |
| Acero martensítico | 2070 | 600 |
| Acero bainítico | 1380 | 400 |
| Acero perlítico | 1200 | 350 |
| Hierro trabajado en frío | 690 | 200 |
| Hierro de grano pequeño | 340 | 100 |
| Hierro que contiene carbono | 140 | 40 |
| Hierro puro monocristalino | 10 | 3 |
Como material estructural
El hierro es el metal más utilizado de todos, y representa más del 90% de la producción mundial de metales. Su bajo coste y su alta resistencia hacen que a menudo sea el material de elección para soportar tensiones o transmitir fuerzas, como en la construcción de maquinaria y máquinas herramienta , rieles , automóviles , cascos de barcos , barras de refuerzo de hormigón y la estructura portante de los edificios. Dado que el hierro puro es bastante blando, lo más habitual es combinarlo con elementos de aleación para fabricar acero. [130]
Propiedades mecánicas
Las propiedades mecánicas del hierro y sus aleaciones son extremadamente importantes para sus aplicaciones estructurales. Dichas propiedades pueden evaluarse de diversas maneras, entre ellas, la prueba Brinell , la prueba Rockwell y la prueba de dureza Vickers .
Las propiedades del hierro puro se utilizan a menudo para calibrar mediciones o comparar pruebas. [129] [131] Sin embargo, las propiedades mecánicas del hierro se ven afectadas significativamente por la pureza de la muestra: los cristales individuales de hierro puro son en realidad más blandos que el aluminio, [128] y el hierro producido industrialmente más puro (99,99%) tiene una dureza de 20-30 Brinell. [132] El hierro puro (99,9% ~ 99,999%), especialmente llamado hierro electrolítico , se produce industrialmente mediante refinación electrolítica .
Un aumento en el contenido de carbono provocará un aumento significativo en la dureza y la resistencia a la tracción del hierro. La dureza máxima de 65 R c se logra con un contenido de carbono del 0,6 %, aunque la aleación tiene una baja resistencia a la tracción. [133] Debido a la suavidad del hierro, es mucho más fácil trabajarlo que sus congéneres más pesados, el rutenio y el osmio . [17]
Tipos de aceros y aleaciones

El hierro α es un metal bastante blando que puede disolver solo una pequeña concentración de carbono (no más del 0,021 % en masa a 910 °C). [134] La austenita (hierro γ) es igualmente blanda y metálica, pero puede disolver considerablemente más carbono (hasta un 2,04 % en masa a 1146 °C). Esta forma de hierro se utiliza en el tipo de acero inoxidable que se utiliza para fabricar cubiertos y equipos hospitalarios y de servicio de alimentos. [21]
El hierro disponible comercialmente se clasifica en función de su pureza y la abundancia de aditivos. El arrabio tiene entre un 3,5 y un 4,5 % de carbono [135] y contiene cantidades variables de contaminantes como azufre , silicio y fósforo . El arrabio no es un producto comercializable, sino más bien un paso intermedio en la producción de hierro fundido y acero. La reducción de contaminantes en el arrabio que afectan negativamente a las propiedades del material, como el azufre y el fósforo, produce hierro fundido que contiene entre un 2 y un 4 % de carbono, un 1 y un 6 % de silicio y pequeñas cantidades de manganeso [120] . El arrabio tiene un punto de fusión en el rango de 1420 a 1470 K, que es más bajo que cualquiera de sus dos componentes principales, y lo convierte en el primer producto que se funde cuando el carbono y el hierro se calientan juntos [11] . Sus propiedades mecánicas varían mucho y dependen de la forma que adopte el carbono en la aleación [17] .
Los hierros fundidos "blancos" contienen su carbono en forma de cementita o carburo de hierro (Fe 3 C). [17] Este compuesto duro y quebradizo domina las propiedades mecánicas de los hierros fundidos blancos, volviéndolos duros, pero poco resistentes a los golpes. La superficie rota de un hierro fundido blanco está llena de facetas finas de carburo de hierro roto, un material muy pálido, plateado y brillante, de ahí la denominación. Enfriar una mezcla de hierro con 0,8% de carbono lentamente por debajo de 723 °C a temperatura ambiente da como resultado capas separadas y alternas de cementita y hierro α, que es blando y maleable y se llama perlita por su apariencia. El enfriamiento rápido, por otro lado, no permite tiempo para esta separación y crea martensita dura y quebradiza . Luego, el acero se puede templar recalentándolo a una temperatura intermedia, cambiando las proporciones de perlita y martensita. El producto final con un contenido de carbono inferior al 0,8 % es una mezcla de perlita-αFe, y el producto final con un contenido de carbono superior al 0,8 % es una mezcla de perlita-cementita. [17]
En el hierro gris, el carbono existe como escamas finas y separadas de grafito , y también hace que el material sea quebradizo debido a las escamas de grafito con bordes afilados que producen sitios de concentración de tensión dentro del material. [136] Una variante más nueva del hierro gris, conocida como hierro dúctil , se trata especialmente con trazas de magnesio para alterar la forma del grafito a esferoides o nódulos, lo que reduce las concentraciones de tensión y aumenta enormemente la tenacidad y la resistencia del material. [136]
El hierro forjado contiene menos de 0,25% de carbono pero grandes cantidades de escoria que le dan una característica fibrosa. [135] El hierro forjado es más resistente a la corrosión que el acero. Ha sido reemplazado casi por completo por el acero dulce , que se corroe más fácilmente que el hierro forjado, pero es más barato y más disponible. El acero al carbono contiene 2,0% de carbono o menos, [137] con pequeñas cantidades de manganeso , azufre , fósforo y silicio. Los aceros aleados contienen cantidades variables de carbono, así como otros metales, como cromo , vanadio , molibdeno , níquel, tungsteno , etc. Su contenido de aleación aumenta su costo, por lo que generalmente solo se emplean para usos especializados. Sin embargo, un acero de aleación común es el acero inoxidable . Los recientes avances en la metalurgia ferrosa han producido una gama cada vez mayor de aceros microaleados, también denominados " HSLA " o aceros de alta resistencia y baja aleación, que contienen pequeñas adiciones para producir altas resistencias y, a menudo, una tenacidad espectacular a un costo mínimo. [137] [138] [139]
Las aleaciones con composiciones elementales de alta pureza (como las aleaciones de hierro electrolítico ) tienen propiedades específicamente mejoradas, como ductilidad , resistencia a la tracción , tenacidad , resistencia a la fatiga , resistencia al calor y resistencia a la corrosión.
Además de las aplicaciones tradicionales, el hierro también se utiliza para la protección contra la radiación ionizante. Aunque es más ligero que otro material de protección tradicional, el plomo , es mucho más resistente mecánicamente. [140]
La principal desventaja del hierro y del acero es que el hierro puro, y la mayoría de sus aleaciones, sufren mucho de oxidación si no se protegen de alguna manera, un costo que asciende a más del 1% de la economía mundial. [141] La pintura , la galvanización , la pasivación , el recubrimiento plástico y el pavonado se utilizan para proteger el hierro de la oxidación excluyendo el agua y el oxígeno o mediante protección catódica . El mecanismo de oxidación del hierro es el siguiente: [141]
- Cátodo: 3 O 2 + 6 H 2 O + 12 e − → 12 OH −
- Ánodo: 4 Fe → 4 Fe 2+ + 8 e − ; 4 Fe 2+ → 4 Fe 3+ + 4 e −
- En general: 4 Fe + 3 O 2 + 6 H 2 O → 4 Fe 3+ + 12 OH − → 4 Fe(OH) 3 o 4 FeO(OH) + 4 H 2 O
El electrolito suele ser sulfato de hierro (II) en las zonas urbanas (formado cuando el dióxido de azufre atmosférico ataca al hierro) y partículas de sal en la atmósfera en las zonas costeras. [141]
Catalizadores y reactivos
Debido a que el Fe es económico y no tóxico, se ha dedicado mucho esfuerzo al desarrollo de catalizadores y reactivos basados en Fe . Sin embargo, el hierro es menos común como catalizador en procesos comerciales que los metales más caros. [142] En biología, las enzimas que contienen Fe son omnipresentes. [143]
Los catalizadores de hierro se utilizan tradicionalmente en el proceso Haber-Bosch para la producción de amoníaco y en el proceso Fischer-Tropsch para la conversión de monóxido de carbono en hidrocarburos para combustibles y lubricantes. [144] El hierro en polvo en un medio ácido se utiliza en la reducción de Bechamp , la conversión de nitrobenceno en anilina . [145]
Compuestos de hierro
El óxido de hierro (III) mezclado con polvo de aluminio se puede encender para crear una reacción de termita , que se utiliza para soldar piezas de hierro de gran tamaño (como rieles ) y purificar minerales. El óxido de hierro (III) y el oxihidróxido se utilizan como pigmentos rojizos y ocres .
El cloruro de hierro (III) se utiliza en la purificación del agua y el tratamiento de aguas residuales , en el teñido de telas, como agente colorante en pinturas, como aditivo en alimentos para animales y como grabador de cobre en la fabricación de placas de circuitos impresos . [146] También se puede disolver en alcohol para formar tintura de hierro, que se utiliza como medicamento para detener el sangrado en los canarios . [147]
El sulfato de hierro (II) se utiliza como precursor de otros compuestos de hierro. También se utiliza para reducir el cromato en el cemento. Se utiliza para fortificar los alimentos y tratar la anemia por deficiencia de hierro . El sulfato de hierro (III) se utiliza para sedimentar partículas diminutas de aguas residuales en el agua de los tanques. El cloruro de hierro (II) se utiliza como agente floculante reductor, en la formación de complejos de hierro y óxidos de hierro magnéticos, y como agente reductor en la síntesis orgánica. [146]
El nitroprusiato de sodio es un fármaco que se utiliza como vasodilatador . Está incluido en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [148]
Papel biológico y patológico
El hierro es necesario para la vida. [10] [149] [150] Los grupos de hierro y azufre son omnipresentes e incluyen la nitrogenasa , la enzima responsable de la fijación biológica del nitrógeno. Las proteínas que contienen hierro participan en el transporte, almacenamiento y uso del oxígeno. [10] Las proteínas de hierro están involucradas en la transferencia de electrones . [151]

Ejemplos de proteínas que contienen hierro en organismos superiores incluyen la hemoglobina, el citocromo (ver hierro de alta valencia ) y la catalasa . [10] [152] El ser humano adulto promedio contiene aproximadamente 0,005% del peso corporal de hierro, o aproximadamente cuatro gramos, de los cuales tres cuartas partes están en hemoglobina, un nivel que permanece constante a pesar de que solo se absorbe alrededor de un miligramo de hierro cada día, [151] porque el cuerpo humano recicla su hemoglobina para el contenido de hierro. [153]
El crecimiento microbiano puede verse asistido por la oxidación del hierro (II) o por la reducción del hierro (III). [154]
Bioquímica
La adquisición de hierro plantea un problema para los organismos aeróbicos porque el hierro férrico es poco soluble cerca del pH neutro. Por ello, estos organismos han desarrollado medios para absorber el hierro en forma de complejos, a veces captando el hierro ferroso antes de oxidarlo de nuevo a hierro férrico. [10] En particular, las bacterias han desarrollado agentes secuestrantes de muy alta afinidad llamados sideróforos . [155] [156] [157]
Después de la absorción en las células humanas , el almacenamiento de hierro se regula con precisión. [10] [158] Un componente importante de esta regulación es la proteína transferrina , que se une a los iones de hierro absorbidos del duodeno y los transporta en la sangre a las células. [10] [159] La transferrina contiene Fe 3+ en el medio de un octaedro distorsionado, unido a un nitrógeno, tres oxígenos y un anión carbonato quelante que atrapa el ion Fe 3+ : tiene una constante de estabilidad tan alta que es muy eficaz para captar iones Fe 3+ incluso de los complejos más estables. En la médula ósea, la transferrina se reduce de Fe 3+ a Fe 2+ y se almacena como ferritina para incorporarse a la hemoglobina. [151]
Los compuestos de hierro bioinorgánicos (moléculas de hierro biológico) más conocidos y estudiados son las proteínas hemo : ejemplos son la hemoglobina , la mioglobina y el citocromo P450 . [10] Estos compuestos participan en el transporte de gases, la construcción de enzimas y la transferencia de electrones . [151] Las metaloproteínas son un grupo de proteínas con cofactores de iones metálicos . Algunos ejemplos de metaloproteínas de hierro son la ferritina y la rubredoxina . [151] Muchas enzimas vitales para la vida contienen hierro, como la catalasa , [160] las lipoxigenasas , [161] y la IRE-BP . [162]
La hemoglobina es un transportador de oxígeno que se produce en los glóbulos rojos y contribuye a su color, transportando oxígeno en las arterias desde los pulmones hasta los músculos donde se transfiere a la mioglobina , que lo almacena hasta que se necesita para la oxidación metabólica de la glucosa , generando energía. [10] Aquí la hemoglobina se une al dióxido de carbono , producido cuando la glucosa se oxida, que es transportado a través de las venas por la hemoglobina (predominantemente como aniones de bicarbonato ) de regreso a los pulmones donde se exhala. [151] En la hemoglobina, el hierro está en uno de los cuatro grupos hemo y tiene seis posibles sitios de coordinación; cuatro están ocupados por átomos de nitrógeno en un anillo de porfirina , el quinto por un nitrógeno imidazol en un residuo de histidina de una de las cadenas de proteína unidas al grupo hemo, y el sexto está reservado para la molécula de oxígeno a la que puede unirse reversiblemente. [151] Cuando la hemoglobina no está unida al oxígeno (y entonces se denomina desoxihemoglobina), el ion Fe2 + en el centro del grupo hemo (en el interior hidrofóbico de la proteína) está en una configuración de alto espín . Por lo tanto, es demasiado grande para caber dentro del anillo de porfirina, que en cambio se dobla en una cúpula con el ion Fe2 + aproximadamente 55 picómetros por encima de él. En esta configuración, el sexto sitio de coordinación reservado para el oxígeno está bloqueado por otro residuo de histidina. [151]
Cuando la desoxihemoglobina capta una molécula de oxígeno, este residuo de histidina se aleja y regresa una vez que el oxígeno está firmemente unido para formar un enlace de hidrógeno con él. Esto da como resultado que el ion Fe2 + cambie a una configuración de espín bajo, lo que resulta en una disminución del 20% en el radio iónico para que ahora pueda encajar en el anillo de porfirina, que se vuelve plano. [151] Además, este enlace de hidrógeno da como resultado la inclinación de la molécula de oxígeno, lo que resulta en un ángulo de enlace Fe–O–O de alrededor de 120° que evita la formación de puentes Fe–O–Fe o Fe–O2 – Fe que conducirían a la transferencia de electrones, la oxidación de Fe2 + a Fe3 + y la destrucción de la hemoglobina. Esto da como resultado un movimiento de todas las cadenas de proteínas que lleva a que las otras subunidades de la hemoglobina cambien de forma a una forma con mayor afinidad por el oxígeno. Por lo tanto, cuando la desoxihemoglobina capta oxígeno, su afinidad por más oxígeno aumenta, y viceversa. [151] La mioglobina, por otra parte, contiene sólo un grupo hemo y por lo tanto este efecto cooperativo no puede ocurrir. Así, mientras que la hemoglobina está casi saturada de oxígeno en las altas presiones parciales de oxígeno que se encuentran en los pulmones, su afinidad por el oxígeno es mucho menor que la de la mioglobina, que se oxigena incluso a bajas presiones parciales de oxígeno que se encuentran en el tejido muscular. [151] Como se describe mediante el efecto Bohr (nombrado en honor a Christian Bohr , el padre de Niels Bohr ), la afinidad de la hemoglobina por el oxígeno disminuye en presencia de dióxido de carbono. [151]

El monóxido de carbono y el trifluoruro de fósforo son venenosos para los humanos porque se unen a la hemoglobina de manera similar al oxígeno, pero con mucha más fuerza, de modo que el oxígeno ya no puede transportarse por todo el cuerpo. La hemoglobina unida al monóxido de carbono se conoce como carboxihemoglobina . Este efecto también juega un papel menor en la toxicidad del cianuro , pero allí el efecto principal es, con mucho, su interferencia con el funcionamiento adecuado de la proteína de transporte de electrones citocromo a . [151] Las proteínas del citocromo también involucran grupos hemo y están involucradas en la oxidación metabólica de la glucosa por el oxígeno. El sexto sitio de coordinación es ocupado entonces por otro nitrógeno imidazol o un azufre de metionina , de modo que estas proteínas son en gran parte inertes al oxígeno, con la excepción del citocromo a, que se une directamente al oxígeno y, por lo tanto, se envenena muy fácilmente con cianuro. [151] Aquí, la transferencia de electrones tiene lugar ya que el hierro permanece en espín bajo pero cambia entre los estados de oxidación +2 y +3. Como el potencial de reducción de cada paso es ligeramente mayor que el anterior, la energía se libera paso a paso y, por lo tanto, puede almacenarse en trifosfato de adenosina . El citocromo a es ligeramente distinto, ya que se encuentra en la membrana mitocondrial, se une directamente al oxígeno y transporta protones y electrones, de la siguiente manera: [151]
- 4 Cíc 2+ + O 2 + 8H+
dentro→ 4 Cíc 3+ + 2 H 2 O + 4H+
exterior
Aunque las proteínas hemo son la clase más importante de proteínas que contienen hierro, las proteínas hierro-azufre también son muy importantes, ya que participan en la transferencia de electrones, lo que es posible ya que el hierro puede existir de forma estable en los estados de oxidación +2 o +3. Estas tienen uno, dos, cuatro u ocho átomos de hierro que están cada uno aproximadamente coordinados tetraédricamente con cuatro átomos de azufre; debido a esta coordinación tetraédrica, siempre tienen hierro de alto espín. El más simple de estos compuestos es la rubredoxina , que tiene solo un átomo de hierro coordinado con cuatro átomos de azufre de los residuos de cisteína en las cadenas peptídicas circundantes. Otra clase importante de proteínas hierro-azufre son las ferredoxinas , que tienen múltiples átomos de hierro. La transferrina no pertenece a ninguna de estas clases. [151]
La capacidad de los mejillones marinos para mantener su agarre sobre las rocas en el océano se ve facilitada por el uso de enlaces organometálicos a base de hierro en sus cutículas ricas en proteínas . Según réplicas sintéticas, la presencia de hierro en estas estructuras aumentó el módulo elástico 770 veces, la resistencia a la tracción 58 veces y la tenacidad 92 veces. La cantidad de estrés necesaria para dañarlos permanentemente aumentó 76 veces. [164]
Nutrición
Dieta
El hierro está muy extendido, pero las fuentes dietéticas particularmente ricas en hierro incluyen la carne roja , las ostras , los frijoles , las aves , el pescado , las verduras de hoja , los berros , el tofu y la melaza . [10] El pan y los cereales para el desayuno a veces están fortificados específicamente con hierro. [10] [165]
El hierro que proporcionan los suplementos dietéticos se encuentra a menudo en forma de fumarato de hierro (II) , aunque el sulfato de hierro (II) es más barato y se absorbe igualmente bien. [146] El hierro elemental, o hierro reducido, a pesar de que se absorbe solo con un tercio o dos tercios de la eficiencia (en relación con el sulfato de hierro), [166] a menudo se añade a alimentos como los cereales de desayuno o la harina de trigo enriquecida. El hierro está más disponible para el cuerpo cuando está quelado con aminoácidos [167] y también está disponible para su uso como un suplemento de hierro común . La glicina , el aminoácido menos costoso, se utiliza con mayor frecuencia para producir suplementos de glicinato de hierro. [168]
Recomendaciones dietéticas
El Instituto de Medicina de los Estados Unidos (IOM) actualizó los Requerimientos Promedio Estimados (EAR) y las Ingestas Dietéticas Recomendadas (RDA) de hierro en 2001. [10] La EAR actual de hierro para mujeres de 14 a 18 años es de 7,9 mg/día, 8,1 mg/día para las edades de 19 a 50 años y 5,0 mg/día a partir de entonces (posmenopausia). Para los hombres, la EAR es de 6,0 mg/día para las edades de 19 años en adelante. La RDA es de 15,0 mg/día para mujeres de 15 a 18 años, 18,0 mg/día para las edades de 19 a 50 años y 8,0 mg/día a partir de entonces. Para los hombres, 8,0 mg/día para las edades de 19 años en adelante. Las RDA son más altas que las EAR para identificar las cantidades que cubrirán a las personas con requisitos superiores al promedio. La dosis diaria recomendada (RDA) para el embarazo es de 27 mg/día y, para la lactancia, de 9 mg/día. [10] Para niños de 1 a 3 años, 7 mg/día, 10 mg/día para niños de 4 a 8 años y 8 mg/día para niños de 9 a 13 años. En cuanto a la seguridad, el IOM también establece niveles máximos de ingesta tolerables (UL) para vitaminas y minerales cuando la evidencia es suficiente. En el caso del hierro, el UL se establece en 45 mg/día. En conjunto, los EAR, RDA y UL se denominan ingestas dietéticas de referencia . [169]
La Autoridad Europea de Seguridad Alimentaria (AESA) se refiere al conjunto colectivo de información como Valores Dietéticos de Referencia, con Ingesta de Referencia Poblacional (PRI) en lugar de RDA, y Requerimiento Promedio en lugar de EAR. La IA y el UL se definen de la misma manera que en los Estados Unidos. Para las mujeres, el PRI es de 13 mg/día de 15 a 17 años, 16 mg/día para mujeres de 18 años o más que son premenopáusicas y 11 mg/día posmenopáusicas. Para el embarazo y la lactancia, 16 mg/día. Para los hombres, el PRI es de 11 mg/día de 15 años o más. Para los niños de 1 a 14 años, el PRI aumenta de 7 a 11 mg/día. Los PRI son más altos que las RDA de EE. UU., con la excepción del embarazo. [170] La AESA revisó la misma pregunta de seguridad y no estableció un UL. [171]
Los bebés pueden necesitar suplementos de hierro si son alimentados con leche de vaca en biberón. [172] Los donantes de sangre frecuentes corren el riesgo de tener niveles bajos de hierro y a menudo se les aconseja que complementen su ingesta de hierro. [173]
Para los fines del etiquetado de alimentos y suplementos dietéticos en los EE. UU., la cantidad en una porción se expresa como un porcentaje del valor diario (% VD). Para los fines del etiquetado de hierro, el 100 % del valor diario fue de 18 mg y, al 27 de mayo de 2016, [actualizar]se mantuvo sin cambios en 18 mg. [174] [175] Se proporciona una tabla de los valores diarios antiguos y nuevos para adultos en Ingesta diaria de referencia .
Deficiencia
La deficiencia de hierro es la deficiencia nutricional más común en el mundo. [10] [176] [177] [178] Cuando la pérdida de hierro no se compensa adecuadamente con una ingesta adecuada de hierro en la dieta, se produce un estado de deficiencia de hierro latente , que con el tiempo conduce a una anemia ferropénica si no se trata, que se caracteriza por un número insuficiente de glóbulos rojos y una cantidad insuficiente de hemoglobina. [179] Los niños, las mujeres premenopáusicas (mujeres en edad fértil) y las personas con una dieta deficiente son los más susceptibles a la enfermedad. La mayoría de los casos de anemia ferropénica son leves, pero si no se tratan pueden causar problemas como ritmo cardíaco rápido o irregular, complicaciones durante el embarazo y retraso en el crecimiento en bebés y niños. [180]
El cerebro es resistente a la deficiencia aguda de hierro debido al lento transporte de hierro a través de la barrera hematoencefálica. [181] Las fluctuaciones agudas en el estado del hierro (marcadas por los niveles de ferritina sérica) no reflejan el estado del hierro en el cerebro, pero se sospecha que la deficiencia nutricional prolongada de hierro reduce las concentraciones de hierro en el cerebro con el tiempo. [182] [183] En el cerebro, el hierro desempeña un papel en el transporte de oxígeno, la síntesis de mielina, la respiración mitocondrial y como cofactor para la síntesis y el metabolismo de neurotransmisores. [184] Los modelos animales de deficiencia nutricional de hierro informan cambios biomoleculares similares a los observados en las enfermedades de Parkinson y Huntington. [185] [186] Sin embargo, la acumulación de hierro relacionada con la edad en el cerebro también se ha relacionado con el desarrollo de Parkinson. [187]
Exceso
La absorción de hierro está estrechamente regulada por el cuerpo humano, que no tiene medios fisiológicos regulados para excretar hierro. Solo se pierden pequeñas cantidades de hierro diariamente debido al desprendimiento de células epiteliales de la piel y las mucosas, por lo que el control de los niveles de hierro se logra principalmente regulando la absorción. [188] La regulación de la absorción de hierro se ve afectada en algunas personas como resultado de un defecto genético que se asigna a la región del gen HLA-H en el cromosoma 6 y conduce a niveles anormalmente bajos de hepcidina , un regulador clave de la entrada de hierro en el sistema circulatorio en mamíferos. [189] En estas personas, la ingesta excesiva de hierro puede provocar trastornos de sobrecarga de hierro , conocidos médicamente como hemocromatosis . [10] Muchas personas tienen una susceptibilidad genética no diagnosticada a la sobrecarga de hierro y no son conscientes de un historial familiar del problema. Por esta razón, las personas no deben tomar suplementos de hierro a menos que sufran deficiencia de hierro y hayan consultado a un médico. Se estima que la hemocromatosis es la causa del 0,3 al 0,8 % de todas las enfermedades metabólicas de los caucásicos. [190]
Las sobredosis de hierro ingerido pueden causar niveles excesivos de hierro libre en la sangre. Los altos niveles de hierro ferroso libre en la sangre reaccionan con los peróxidos para producir radicales libres altamente reactivos que pueden dañar el ADN , las proteínas , los lípidos y otros componentes celulares. La toxicidad del hierro ocurre cuando la célula contiene hierro libre, lo que generalmente ocurre cuando los niveles de hierro exceden la disponibilidad de transferrina para unirse al hierro. El daño a las células del tracto gastrointestinal también puede impedir que regulen la absorción de hierro, lo que lleva a mayores aumentos en los niveles en sangre. El hierro generalmente daña las células del corazón , el hígado y otras partes, causando efectos adversos que incluyen coma , acidosis metabólica , shock , insuficiencia hepática , coagulopatía , daño orgánico a largo plazo e incluso la muerte. [191] Los humanos experimentan toxicidad por hierro cuando el hierro excede los 20 miligramos por cada kilogramo de masa corporal; 60 miligramos por kilogramo se considera una dosis letal . [ 192] El consumo excesivo de hierro, que suele ser consecuencia de la ingestión por parte de los niños de grandes cantidades de comprimidos de sulfato ferroso destinados al consumo de adultos, es una de las causas toxicológicas de muerte más comunes en niños menores de seis años. [192] La ingesta dietética de referencia (IDR) establece el nivel máximo de ingesta tolerable (LM) para adultos en 45 mg/día. Para los niños menores de catorce años, el LM es de 40 mg/día. [193]
El tratamiento médico de la toxicidad del hierro es complicado y puede incluir el uso de un agente quelante específico llamado deferoxamina para unir y expulsar el exceso de hierro del cuerpo. [191] [194] [195]
TDAH
Algunas investigaciones han sugerido que los niveles bajos de hierro talámico pueden desempeñar un papel en la fisiopatología del TDAH . [196] Algunos investigadores han descubierto que la suplementación con hierro puede ser eficaz especialmente en el subtipo desatento del trastorno. [197]
Algunos investigadores de la década de 2000 sugirieron que existía una relación entre los niveles bajos de hierro en la sangre y el TDAH. Un estudio de 2012 no encontró tal correlación. [198]
Cáncer
El papel del hierro en la defensa contra el cáncer puede describirse como un "arma de doble filo" debido a su presencia omnipresente en procesos no patológicos. [199] Las personas que reciben quimioterapia pueden desarrollar deficiencia de hierro y anemia , para las cuales se utiliza la terapia con hierro intravenoso para restablecer los niveles de hierro. [200] La sobrecarga de hierro, que puede ocurrir por el alto consumo de carne roja, [10] puede iniciar el crecimiento del tumor y aumentar la susceptibilidad a la aparición del cáncer, [200] particularmente para el cáncer colorrectal . [10]
Sistemas marinos
El hierro desempeña un papel esencial en los sistemas marinos y puede actuar como un nutriente limitante para la actividad planctónica. [201] Debido a esto, una disminución demasiado grande del hierro puede conducir a una disminución en las tasas de crecimiento de los organismos fitoplanctónicos como las diatomeas. [202] El hierro también puede ser oxidado por microbios marinos en condiciones de alto contenido de hierro y bajo contenido de oxígeno. [203]
El hierro puede entrar en los sistemas marinos a través de los ríos adyacentes y directamente desde la atmósfera. Una vez que el hierro entra en el océano, puede distribuirse por toda la columna de agua a través de la mezcla oceánica y del reciclaje a nivel celular. [204] En el Ártico, el hielo marino desempeña un papel importante en el almacenamiento y la distribución de hierro en el océano, agotando el hierro oceánico cuando se congela en el invierno y liberándolo de nuevo en el agua cuando se descongela en el verano. [205] El ciclo del hierro puede fluctuar las formas del hierro de acuosas a formas de partículas alterando la disponibilidad de hierro para los productores primarios. [206] El aumento de la luz y el calor aumenta la cantidad de hierro que se encuentra en formas que son utilizables por los productores primarios. [207]
Véase también
- Los yacimientos de hierro de importancia económica incluyen:
- Se cree que la mina de Carajás, en el estado de Pará, Brasil, es el depósito de hierro más grande del mundo.
- El Mutún en Bolivia, donde se encuentra el 10% del mineral de hierro accesible del mundo.
- La cuenca de Hamersley es el depósito de mineral de hierro más grande de Australia .
- Kiirunavaara en Suecia, donde se encuentra uno de los depósitos de mineral de hierro más grandes del mundo
- Mesabi Iron Range es el principal distrito minero de hierro de los Estados Unidos.
- Siderurgia
- Ciclo del hierro
- Nanopartícula de hierro
- Nanopartícula de hierro y platino
- Fertilización con hierro : propuesta de fertilización de los océanos para estimular el crecimiento del fitoplancton
- Bacterias oxidantes de hierro
- Lista de países según producción de hierro
- Peletización : proceso de creación de pellets de mineral de hierro.
- Hierro inoxidable
- Acero
Referencias
- ^ "Pesos atómicos estándar: hierro". CIAAW . 1993.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ abc Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ abcd Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 28. ISBN 978-0-08-037941-8.
- ^ Ram, RS; Bernath, PF (2003). "Espectroscopia de emisión por transformada de Fourier del sistema g 4 Δ–a 4 Δ de FeCl". Journal of Molecular Spectroscopy . 221 (2): 261. Bibcode :2003JMoSp.221..261R. doi :10.1016/S0022-2852(03)00225-X.
- ^ Demazeau, G.; Buffat, B.; Bolsard, M.; Hagenmüller, P. (1982). "Desarrollos recientes en el campo de los altos estados de oxidación de elementos de transición en la estabilización de óxidos de hierro (V) de seis coordenadas". Zeitschrift für anorganische und allgemeine Chemie . 491 : 60–66. doi :10.1002/zaac.19824910109.
- ^ Lu, J.; Jian, J.; Huang, W.; Lin, H.; Li, J; Zhou, M. (2016). "Identificación experimental y teórica del estado de oxidación de Fe(VII) en FeO 4 − ". Química Física Química . 18 (45): 31125–31131. Bibcode :2016PCCP...1831125L. doi :10.1039/C6CP06753K. PMID 27812577.
- ^ Cardarelli, François (2008). Manual de materiales: una referencia de escritorio concisa . Londres: Springer. p. 65. ISBN 1-84628-668-9.
- ^ ab Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ abcdefghijklmnopq «Hierro». Centro de Información sobre Micronutrientes, Instituto Linus Pauling, Universidad Estatal de Oregón, Corvallis, Oregón. Abril de 2016. Consultado el 6 de marzo de 2018 .
- ^ abcdefgh Greenwood y Earnshaw 1997, págs. 1075–79.
- ^ Tateno S, Hirose K (2010). "La estructura del hierro en el núcleo interno de la Tierra". Science . 330 (6002). Asociación Estadounidense para el Avance de la Ciencia: 359–361. Bibcode :2010Sci...330..359T. doi :10.1126/science.1194662. PMID 20947762. S2CID 206528628.
- ^ Chamati, Gaminchev (2014). "Estabilidad dinámica del Fe bajo alta presión". Journal of Physics . 558 (1). IOP Publishing: 012013. Bibcode :2014JPhCS.558a2013G. doi : 10.1088/1742-6596/558/1/012013 .
- ^ Boehler, Reinhard (2000). "Experimentos de alta presión y el diagrama de fases de los materiales del manto inferior y del núcleo". Reseñas de Geofísica . 38 (2). American Geophysical Union: 221–45. Bibcode :2000RvGeo..38..221B. doi : 10.1029/1998RG000053 . S2CID 33458168.
- ^ Stixrude, Lars; Wasserman, Evgeny; Cohen, Ronald E. (10 de noviembre de 1997). "Composición y temperatura del núcleo interno de la Tierra". Journal of Geophysical Research: Solid Earth . 102 (B11): 24729–39. Bibcode :1997JGR...10224729S. doi : 10.1029/97JB02125 .
- ^ Greenwood y Earnshaw 1997, pág. 1116.
- ^ abcdef Greenwood y Earnshaw 1997, págs. 1074–75.
- ^ Boehler, Reinhard; Ross, M. (2007). "Propiedades de rocas y minerales_Fusión a alta presión". Mineral Physics . Tratado de geofísica. Vol. 2. Elsevier. págs. 527–41. doi :10.1016/B978-044452748-6.00047-X. ISBN 9780444527486.
- ^ Steinmetz, Charles (1917). "fig. 42". Teoría y cálculo de circuitos eléctricos. McGraw-Hill.
- ^ ab Cullidad; CD Graham (2008). Introducción a los Materiales Magnéticos, 2º. Nueva York: Wiley – IEEE. pag. 116.ISBN 978-0-471-47741-9.
- ^ ab Bramfitt, BL; Benscoter, Arlan O. (2002). "El diagrama de fases de hierro y carbono". Guía del metalógrafo: práctica y procedimientos para hierros y aceros . ASM International. págs. 24–28. ISBN 978-0-87170-748-2.
- ^ Bikit, I.; Krmar, M.; Slivka, J.; Vesković, M.; Čonkić, Lj.; Aničin, I. (1 de octubre de 1998). "Nuevos resultados sobre la doble desintegración β del hierro". Physical Review C . 58 (4): 2566–2567. Bibcode :1998PhRvC..58.2566B. doi :10.1103/PhysRevC.58.2566. ISSN 0556-2813.
- ^ Rugel, G.; Faestermann, T.; Knie, K.; Korschinek, G.; Poutivtsev, M.; Schumann, D.; Kivel, N.; Günther-Leopold, I.; Weinreich, R.; Wohlmuther, M. (2009). "Nueva medición de la vida media del 60Fe". Physical Review Letters . 103 (7): 072502. Bibcode :2009PhRvL.103g2502R. doi :10.1103/PhysRevLett.103.072502. PMID 19792637.
- ^ Dauphas, N.; Rouxel, O. (2006). "Espectrometría de masas y variaciones naturales de los isótopos de hierro" (PDF) . Mass Spectrometry Reviews . 25 (4): 515–50. Bibcode :2006MSRv...25..515D. doi :10.1002/mas.20078. PMID 16463281. Archivado desde el original (PDF) el 10 de junio de 2010.
- ^ Mostefaoui, S.; Lugmair, G. W.; Hoppe, P.; El Goresy, A. (2004). "Evidencia de 60Fe vivo en meteoritos". New Astronomy Reviews . 48 (1–4): 155–59. Bibcode :2004NewAR..48..155M. doi :10.1016/j.newar.2003.11.022.
- ^ Fewell, MP (1995). "El nucleido atómico con la energía de enlace media más alta". American Journal of Physics . 63 (7): 653. Bibcode :1995AmJPh..63..653F. doi :10.1119/1.17828.
- ^ Fewell, MP (1 de julio de 1995). "El nucleido atómico con la energía de enlace media más alta". American Journal of Physics . 63 (7): 653–658. Bibcode :1995AmJPh..63..653F. doi :10.1119/1.17828. ISSN 0002-9505.
- ^ Burbidge, E. Margaret ; Burbidge, GR ; Fowler, William A. ; Hoyle, F. (1 de octubre de 1957). "Síntesis de los elementos en las estrellas". Reseñas de Física Moderna . 29 (4): 547–650. Bibcode :1957RvMP...29..547B. doi : 10.1103/RevModPhys.29.547 .
- ^ abc Greenwood y Earnshaw 1997, pág. 12.
- ^ Woosley, S.; Janka, T. (2006). "La física de las supernovas por colapso del núcleo". Nature Physics . 1 (3): 147–54. arXiv : astro-ph/0601261 . Código Bibliográfico :2005NatPh...1..147W. doi :10.1038/nphys172. S2CID 118974639.
- ^ McDonald, I.; Sloan, GC; Zijlstra, AA; Matsunaga, N.; Matsuura, M.; Kraemer, KE; Bernard-Salas, J.; Markwick, AJ (2010). "Estrellas viejas y oxidadas: ¿una fuente del hierro interestelar que falta?". The Astrophysical Journal Letters . 717 (2): L92–L97. arXiv : 1005.3489 . Código Bibliográfico :2010ApJ...717L..92M. doi :10.1088/2041-8205/717/2/L92. S2CID 14437704.
- ^ Bautista, Manuel A.; Pradhan, Anil K. (1995). "Abundancias de hierro y níquel en regiones H~II y remanentes de supernova". Boletín de la Sociedad Astronómica Americana . 27 : 865. Código Bibliográfico :1995AAS...186.3707B.
- ^ Dyson, Freeman J. (1979). "Tiempo sin fin: Física y biología en un universo abierto". Reseñas de Física Moderna . 51 (3): 447–60. Bibcode :1979RvMP...51..447D. doi :10.1103/RevModPhys.51.447.
- ^ Aron, Jacob. «Las balas espaciales de supernova podrían haber sembrado el núcleo de hierro de la Tierra». New Scientist . Consultado el 2 de octubre de 2020 .
- ^ Croswell, Ken. "Iron in the Fire: The Little-Star Supernovae That Could" (Hierro en el fuego: las supernovas de estrellas pequeñas que sí pudieron). Scientific American . Consultado el 3 de enero de 2021 .
- ^ Buchwald, VF (1992). "Sobre el uso del hierro por los esquimales en Groenlandia". Caracterización de materiales . 29 (2): 139–176. doi :10.1016/1044-5803(92)90112-U.
- ^ Emiliani, Cesare (1992). Planeta Tierra: cosmología, geología y evolución de la vida y el medio ambiente. Cambridge University Press. p. 152. Bibcode :1992pecg.book.....E. ISBN 978-0-521-40949-0.
- ^ Pernet-Fisher, J.; Day, JMD; Howarth, GH; Ryabov, VV; Taylor, LA (2017). "Desgasificación atmosférica y formación de hierro nativo durante interacciones sedimento carbonoso-basalto fundido". Earth and Planetary Science Letters . 460 : 201–212. Bibcode :2017E&PSL.460..201P. doi : 10.1016/j.epsl.2016.12.022 .
- ^ Stark, Anne M. (20 de septiembre de 2007) Los investigadores localizan la zona de transición de giro del manto, lo que proporciona pistas sobre la estructura de la Tierra. Laboratorio Nacional Lawrence Livermore
- ^ Ferropericlasa. Mindat.org
- ^ Murakami, M.; Ohishi Y.; Hirao N.; Hirose K. (2012). "Un manto inferior perovskítico inferido a partir de datos de velocidad del sonido a alta presión y alta temperatura". Nature . 485 (7396): 90–94. Bibcode :2012Natur.485...90M. doi :10.1038/nature11004. PMID 22552097. S2CID 4387193.
- ^ Sharp, T. (27 de noviembre de 2014). "Bridgmanita: nombrada al fin". Science . 346 (6213): 1057–58. Bibcode :2014Sci...346.1057S. doi :10.1126/science.1261887. PMID 25430755. S2CID 206563252.
- ^ Kong, LT; Li, JF; Shi, QW; Huang, HJ; Zhao, K. (6 de marzo de 2012). "Estabilidad dinámica del hierro en condiciones de alta temperatura y alta presión". EPL . 97 (5): 56004p1–56004p5. Bibcode :2012EL.....9756004K. doi :10.1209/0295-5075/97/56004. S2CID 121861429.
- ^ Gaminchev, KG; Chamati, H. (3 de diciembre de 2014). "Estabilidad dinámica del Fe bajo alta presión". J. Phys . 558 (1): 012013(1–7). Código Bibliográfico :2014JPhCS.558a2013G. doi : 10.1088/1742-6596/558/1/012013 .
- ^ Morgan, John W. y Anders, Edward (1980). "Composición química de la Tierra, Venus y Mercurio". Proc. Natl. Sci. 77 (12): 6973–77. Bibcode :1980PNAS...77.6973M. doi : 10.1073/pnas.77.12.6973 . PMC 350422 . PMID 16592930.
- ^ "Pirrotita". Mindat.org . Consultado el 7 de julio de 2009 .
- ^ Klein, Cornelis y Cornelius S. Hurlbut, Jr. (1985) Manual de mineralogía, Wiley, 20.ª edición, págs. 278-79 ISBN 0-471-80580-7
- ^ desde Greenwood y Earnshaw 1997, pág. 1071.
- ^ Lyons, TW; Reinhard, CT (2009). "Tierra primitiva: oxígeno para los fanáticos del heavy metal". Nature . 461 (7261): 179–181. Bibcode :2009Natur.461..179L. doi : 10.1038/461179a . PMID 19741692. S2CID 205049360.
- ^ Cloud, P. (1973). "Importancia paleoecológica de la formación de hierro bandeado". Economic Geology . 68 (7): 1135–43. Bibcode :1973EcGeo..68.1135C. doi :10.2113/gsecongeo.68.7.1135.
- ^ Dickinson, Robert E. (1964). Alemania: una geografía regional y económica (2.ª ed.). Londres: Methuen.
- ^ Naturwerksteine en Baden-Württemberg. Landesamt für Geologie, Rohstoffe und Bergbau, Baden-Württemberg
- ^ "Cuentos desde la orilla del río". Conservación de la piedra Minerva. Archivado desde el original el 28 de septiembre de 2015. Consultado el 22 de septiembre de 2015 .
- ^ Klingelhöfer, G.; Morris, RV; Souza, PA; Rodionov, D.; Schröder, C. (2007). "Dos años terrestres de estudios de Mössbauer de la superficie de Marte con MIMOS II". Interacciones hiperfinas . 170 (1–3): 169–77. Código Bibliográfico :2006HyInt.170..169K. doi :10.1007/s10751-007-9508-5. S2CID 98227499.
- ^ Winderlich, R.; Pedro, W. (1954). Lehrbuch der Chemie für Höhere Lehranstalten: Einheitsausgabe für Unter- und Oberstufe (en alemán). Wiesbaden: Vieweg+Teubner Verlag. pag. 75.ISBN 978-3-663-04370-6.OCLC 913701506 .
- ^ Bertau, Martín (2013). Industrielle Anorganische Chemie (en alemán). Weinheim: Wiley-VCH. pag. 696.ISBN 978-3-527-64956-3.OCLC 855858511 .
- ^ Existencias de metales en la sociedad: síntesis científica, 2010, Panel Internacional de Recursos , PNUMA
- ^ Stoll, Heather (17 de febrero de 2020). "30 años de la hipótesis del hierro en las edades de hielo". Nature . 578 (7795). Springer Science and Business Media LLC: 370–371. Bibcode :2020Natur.578..370S. doi :10.1038/d41586-020-00393-x. ISSN 0028-0836. PMID 32066927. S2CID 211139074.
- ^ Se han observado Fe(−4), Ru(−4) y Os(−4) en compuestos ricos en metales que contienen complejos octaédricos [MIn 6− x Sn x ]; Se han observado Pt(−3) (como anión dimérico [Pt–Pt] 6− ), Cu(−2), Zn(−2), Ag(−2), Cd(−2), Au(−2) y Hg(−2) (como aniones diméricos y monoméricos; inicialmente se informó que los iones diméricos eran [T–T] 2− para Zn, Cd, Hg, pero luego se demostró que eran [T–T] 4− para todos estos elementos) en La 2 Pt 2 In, La 2 Cu 2 In, Ca 5 Au 3 , Ca 5 Ag 3 , Ca 5 Hg 3 , Sr 5 Cd 3 , Ca 5 Zn 3 (estructura (AE 2+ ) 5 (T–T) 4− T 2− ⋅4e − ), Yb 3 Ag 2 , Ca 5 Au 4 y Ca 3 Hg 2 ; Au(–3) se ha observado en ScAuSn y en otros compuestos de semi-Heusler de 18 electrones. Véase Changhoon Lee; Myung-Hwan Whangbo (2008). "Aniones de metales de transición tardía que actúan como elementos p-metálicos". Solid State Sciences . 10 (4): 444–449. Bibcode :2008SSSci..10..444K. doi :10.1016/j.solidstatesciences.2007.12.001.y Changhoon Lee; Myung-Hwan Whangbo; Jürgen Köhler (2010). "Análisis de estructuras electrónicas y enlaces químicos de compuestos ricos en metales. 2. Presencia de aniones dímeros (T–T) 4– y T 2– aislados en los compuestos polares intermetálicos tipo Cr 5 B 3 AE 5 T 3 (AE = Ca, Sr; T = Au, Ag, Hg, Cd, Zn)". Revista de química orgánica y general . 636 (1): 36–40. doi :10.1002/zaac.200900421.
- ^ Greenwood y Earnshaw 1997, pág. 905.
- ^ desde Greenwood y Earnshaw 1997, pág. 1070.
- ^ Lu, Jun-Bo; Jian, Jiwen; Huang, Wei; Lin, Hailu; Li, Jun; Zhou, Mingfei (16 de noviembre de 2016). "Identificación experimental y teórica del estado de oxidación de Fe(VII) en FeO 4 − ". Phys. Chem. Chem. Phys . 18 (45): 31125–31131. Bibcode :2016PCCP...1831125L. doi :10.1039/c6cp06753k. PMID 27812577.
- ^ Nam, Wonwoo (2007). «Complejos de hierro(IV)–oxo de alto valor de ligandos hemo y no hemo en reacciones de oxigenación» (PDF) . Accounts of Chemical Research . 40 (7): 522–531. doi :10.1021/ar700027f. PMID 17469792. Archivado desde el original (PDF) el 15 de junio de 2021. Consultado el 22 de febrero de 2022 .
- ^ abcdef Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Hierro". Lehrbuch der Anorganischen Chemie (en alemán) (91-100 ed.). Walter de Gruyter. págs. 1125–46. ISBN 3-11-007511-3.
- ^ Reiff, William Michael; Long, Gary J. (1984). "Espectroscopia de Mössbauer y la química de coordinación del hierro". Espectroscopia de Mössbauer aplicada a la química inorgánica . Springer. págs. 245–83. ISBN 978-0-306-41647-7.
- ^ Ware, Mike (1999). "Una introducción al monocromo". Cianotipia: historia, ciencia y arte de la impresión fotográfica en azul de Prusia . NMSI Trading Ltd., págs. 11-19. ISBN 978-1-900747-07-3.
- ^ Gmelin, Leopold (1852). "Mercurio y hierro". Manual de química . Vol. 6. Cavendish Society. págs. 128-129.
- ^ abc Greenwood y Earnshaw 1997, pág. 1079.
- ^ abcd Greenwood y Earnshaw 1997, págs. 1082–84.
- ^ Siegfried Pohl, Ulrich Bierbach, Wolfgang Saak; "FeI3SC(NMe2)2, un complejo neutro de tiourea de yoduro de hierro (III)", Angewandte Chemie International Edition en inglés (1989) 28 (6), 776-777. https://doi.org/10.1002/anie.198907761
- ^ Nicholas A. Barnes, Stephen M. Godfrey, Nicholas Ho, Charles A. McAuliffe, Robin G. Pritchard; "Síntesis sencilla de un ejemplo raro de un complejo de yoduro de hierro (III), [FeI3(AsMe3)2], a partir de la reacción de Me3AsI2 con polvo de hierro no activado", Polyhedron (2013) 55, 67-72. https://doi.org/10.1016/j.poly.2013.02.066
- ^ abcd Greenwood y Earnshaw 1997, págs. 1088–91.
- ^ desde Greenwood y Earnshaw 1997, págs. 1091–97.
- ^ Clausen, CA; Good, ML (1968). "Estabilización del anión hexacloroferrato(III) por el catión metilamonio". Química inorgánica . 7 (12): 2662–63. doi :10.1021/ic50070a047.
- ^ James, BD; Bakalova, M.; Lieseganga, J.; Reiff, WM; Hockless, DCR; Skelton, BW; White, AH (1996). "El anión hexacloroferrato(III) estabilizado en disposiciones de empaquetamiento con enlaces de hidrógeno. Una comparación de las estructuras cristalinas de rayos X y el magnetismo a baja temperatura del cloruro de tetrakis(metilamonio) hexacloroferrato(III) (I) y el tetracloruro de tetrakis(hexametilendiamonio) hexacloroferrato(III) tetracloroferrato(III) (II) ". Inorganica Chimica Acta . 247 (2): 169–74. doi :10.1016/0020-1693(95)04955-X.
- ^ Giannoccaro, P.; Sacco, A. (1977). "Complejos de bis[etilenobis(difenilfosfina)]-hidruro de hierro". Síntesis inorgánicas . Vol. 17. págs. 69–72. doi :10.1002/9780470132487.ch19. ISBN . 978-0-470-13248-7.
- ^ Lee, J.; Jung, G.; Lee, SW (1998). "Estructura del trans-clorohidridobis(difenilfosfinoetano)hierro(II)". Bull. Korean Chem. Soc . 19 (2): 267–69. doi :10.1007/BF02698412. S2CID 35665289.
- ^ Echigo, Takuya; Kimata, Mitsuyoshi (2008). "Estudios espectroscópicos y de difracción de rayos X de monocristales sobre humboldtina y lindbergita: efecto Jahn-Teller débil del ion Fe2 + ". Phys. Chem. Minerals . 35 (8): 467–75. Bibcode :2008PCM....35..467E. doi :10.1007/s00269-008-0241-7. S2CID 98739882.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1984). Química de los elementos. Oxford: Pergamon Press . págs. 1282–86. ISBN 978-0-08-022057-4..
- ^ Kealy, TJ; Pauson, PL (1951). "Un nuevo tipo de compuesto de organohierro". Nature . 168 (4285): 1039–40. Código Bibliográfico :1951Natur.168.1039K. doi :10.1038/1681039b0. S2CID 4181383.
- ^ Molinero, SA; Tebboth, JA; Tremaine, JF (1952). "114. Diciclopentadieniliron". J. química. Soc. : 632–635. doi :10.1039/JR9520000632.
- ^ Wilkinson, G .; Rosenblum, M.; Whiting, MC; Woodward, RB (1952). "La estructura del bis-ciclopentadienilo de hierro". J. Am. Chem. Soc. 74 (8): 2125–2126. doi :10.1021/ja01128a527.
- ^ Okuda, Jun (28 de diciembre de 2016). «Ferroceno: 65 años después». Revista Europea de Química Inorgánica . 2017 (2): 217–219. doi : 10.1002/ejic.201601323 . ISSN 1434-1948.
- ^ Greenwood y Earnshaw 1997, pág. 1104.
- ^ Bullock, RM (11 de septiembre de 2007). "Un catalizador de hierro para hidrogenaciones de cetonas en condiciones suaves". Angew. Chem. Int. Ed. 46 (39): 7360–63. doi : 10.1002/anie.200703053 . PMID 17847139.
- ^ Semanas 1968, pág. 4.
- ^ ab Semanas 1968, pág. 29.
- ^abc Semanas 1968, pág. 31.
- ^ Bjorkman, Judith Kingston (1973). "Meteoritos y meteoritos en el antiguo Cercano Oriente". Meteoritics . 8 (2): 91–132. Bibcode :1973Metic...8...91B. doi :10.1111/j.1945-5100.1973.tb00146.x.
- ^ Comelli, Daniela; d'Orazio, Massimo; Folco, Luigi; El-Halwagy, Mahmud; Frizzi, Tommaso; Alberti, Roberto; Capogrosso, Valentina; Elnaggar, Abdelrazek; Hassan, Hala; Nevin, Austin; Porcelli, Franco; Rashed, Mohamed G; Valentini, Gianluca (2016). "El origen meteorítico de la daga de hierro de Tutankamón". Meteoritos y ciencia planetaria . 51 (7): 1301–09. Código Bib : 2016M&PS...51.1301C. doi : 10.1111/mapas.12664 .
- ^ Walsh, Declan (2 de junio de 2016). "La daga del rey Tut está hecha de 'hierro del cielo', dicen los investigadores" . The New York Times . Archivado desde el original el 3 de enero de 2022. Consultado el 4 de junio de 2016.
La composición de hierro, níquel y cobalto de la hoja coincidía aproximadamente con la de un meteorito que cayó en el norte de Egipto. El resultado "sugiere firmemente un origen extraterrestre".
- ^ Ure, Andrés (1843). Technisches wörterbuch oder Handbuch der Gewerbskunde... : Bearb. nach Diccionario de artes, manufacturas y minas del Dr. Andrew Ure (en alemán). G. Haase. pag. 492.
- ^ abcd Semanas 1968, pág. 32.
- ^ McNutt, Paula (1990 1). La forja de Israel: tecnología del hierro, simbolismo y tradición en la sociedad antigua. A&C Black.
- ^ Tewari, Rakesh. "Los orígenes del trabajo del hierro en la India: Nueva evidencia de la llanura central del Ganges y los Vindhyas orientales" (PDF) . Departamento Arqueológico del Estado . Consultado el 23 de mayo de 2010 .
- ^ Fotos, E. (1989). "La cuestión del hierro rico en níquel fundido versus el hierro meteorítico: evidencia arqueológica y resultados experimentales". Arqueología mundial . 20 (3). Taylor & Francis, Ltd.: 403–21. doi :10.1080/00438243.1989.9980081. JSTOR 124562.
- ^ Muhly, James D. (2003). "Metalurgia y minería en el Levante". En Lake, Richard Winona (ed.). Arqueología del Cercano Oriente IN: Eisenbrauns . Vol. 180. págs. 174–83.
- ^ Witzel, Michael (2001), "¿Arios autóctonos? La evidencia de los textos antiguos indios e iraníes", en Electronic Journal of Vedic Studies (EJVS) 7-3, págs. 1–93
- ^ Weeks, pág. 33, citando a Cline, Walter (1937) "Minería y metalurgia en África negra", George Banta Publishing Co., Menasha, Wis., págs. 17-23.
- ^ Riederer, Josef; Wartke, Ralf-B. (2009) "Hierro", Cancik, Hubert; Schneider, Helmuth (eds.): El nuevo Pauly de Brill , Brill.
- ^ Sawyer, Ralph D. y Sawyer, Mei-chün (1993). Los siete clásicos militares de la antigua China. Boulder: Westview. ISBN 0-465-00304-4 . pág. 10.
- ^ Pigott, Vincent C. (1999). La arqueometalurgia del Viejo Mundo asiático . Filadelfia: Museo de Arqueología y Antropología de la Universidad de Pensilvania. ISBN 0-924171-34-0 , pág. 8.
- ^ Golas, Peter J. (1999). Ciencia y civilización en China: Volumen 5, Química y tecnología química, Parte 13, Minería. Cambridge University Press. pág. 152. ISBN 978-0-521-58000-7
El alto horno más antiguo descubierto en China data del siglo I d.C. aproximadamente
. - ^ Pigott, Vincent C. (1999). La arqueometalurgia del Viejo Mundo asiático . Filadelfia: Museo de Arqueología y Antropología de la Universidad de Pensilvania. ISBN 0-924171-34-0 , pág. 191.
- ^ La llegada de la era del acero. Archivo Brill. 1961. pág. 54.
- ^ Mott, RA (2014). "Puddling seco y húmedo". Transacciones de la Newcomen Society . 49 : 156–57. doi :10.1179/tns.1977.011.
- ^ Wagner, Donald B. (2003). «Altos hornos chinos del siglo X al XIV» (PDF) . Historical Metallurgy . 37 (1): 25–37. Archivado desde el original (PDF) el 7 de enero de 2018. Consultado el 7 de enero de 2018 .Publicado originalmente en Wagner, Donald B. (2001). "Altos hornos chinos del siglo X al XIV". Ciencia, tecnología y medicina de Asia occidental . 18 : 41–74. doi :10.1163/26669323-01801008.
- ^ Giannichedda, Enrico (2007): "La producción de metales en la Antigüedad tardía", en Tecnología en transición 300-650 d. C. Lavan, L.; Zanini, E. y Sarantis, A. (eds.), Brill, Leiden; ISBN 90-04-16549-5 , pág. 200.
- ^ abcdefg Biddle, Verne; Parker, Gregory. Química, precisión y diseño . A Beka Book, Inc.
- ^ Wagner, Donald B. (1993). Hierro y acero en la antigua China . Brill. págs. 335–340. ISBN 978-90-04-09632-5.
- ^ abcd Greenwood y Earnshaw 1997, pág. 1072.
- ^ Schivelbusch, G. (1986) El viaje en tren: industrialización y percepción del tiempo y el espacio en el siglo XIX. Oxford: Berg.
- ^ Spoerl, Joseph S. Breve historia de la producción de hierro y acero Archivado el 2 de junio de 2010 en Wayback Machine . Saint Anselm College
- ^ Enghag, Per (8 de enero de 2008). Enciclopedia de los elementos: datos técnicos, historia, procesamiento y aplicaciones. John Wiley & Sons. pp. 190–91. ISBN 978-3-527-61234-5.
- ^ Whitaker, Robert D (1975). "Una nota histórica sobre la conservación de la masa". Revista de Educación Química . 52 (10): 658. Bibcode :1975JChEd..52..658W. doi :10.1021/ed052p658.
- ^ Fontenrose, Joseph (1974). "Trabajo, justicia y las cinco edades de Hesíodo". Filología clásica . 69 (1): 1–16. doi :10.1086/366027. JSTOR 268960. S2CID 161808359.
- ^ Schmidt, Eva (1981) Der preußische Eisenkunstguss. (Arte del hierro fundido prusiano) Technik, Geschichte, Werke, Künstler . Verlag Mann, Berlín, ISBN 3-7861-1130-8
- ^ Lux, H. (1963) "Hierro metálico" en Handbook of Preparative Inorganic Chemistry , 2.ª ed. G. Brauer (ed.), Academic Press, NY. Vol. 2. págs. 1490–91.
- ^ Anuario estadístico del acero 2010. Asociación Mundial del Acero
- ^ abcdefg Greenwood y Earnshaw 1997, pág. 1073.
- ^ Wang, Peng; Ryberg, Morten; Yang, Yi; Feng, Kuishuang; Kara, Sami; Hauschild, Michael; Chen, Wei-Qiang (6 de abril de 2021). "El estancamiento de la eficiencia en la producción mundial de acero insta a realizar esfuerzos conjuntos de mitigación del lado de la oferta y la demanda". Nature Communications . 12 (1): 2066. Bibcode :2021NatCo..12.2066W. doi :10.1038/s41467-021-22245-6. ISSN 2041-1723. PMC 8024266 . PMID 33824307.
- ^ Song Yingxing (1637): La enciclopedia Tiangong Kaiwu .
- ^ Verhoeven, JD (1975) Fundamentos de la metalurgia física , Wiley, Nueva York, pág. 326
- ^ Allanore, Antoine; Yin, Lan; Sadoway, Donald R. (2013). "Un nuevo material de ánodo para la evolución del oxígeno en la electrólisis de óxido fundido". Nature . 497 (7449): 353–356. Bibcode :2013Natur.497..353A. doi :10.1038/nature12134. hdl : 1721.1/82073 . ISSN 0028-0836. PMID 23657254.
- ^ Wiencke, Jan; Lavelaine, Hervé; Panteix, Pierre-Jean; Petitjean, Carine; Rapin, Christophe (2018). "Electrólisis de hierro en un electrolito de óxido fundido". Revista de electroquímica aplicada . 48 (1): 115–126. doi : 10.1007/s10800-017-1143-5 . ISSN 0021-891X.
- ^ Fan, Zhiyuan; Friedmann, S. Julio (2021). "Producción de hierro y acero con bajas emisiones de carbono: opciones tecnológicas, evaluación económica y políticas". Joule . 5 (4): 829–862. Bibcode :2021Joule...5..829F. doi : 10.1016/j.joule.2021.02.018 .
- ^ Gallucci, Maria (7 de septiembre de 2023). «Boston Metal recibe un gran impulso financiero para fabricar acero ecológico». Canary Media . Rocky Mountain Institute . Consultado el 11 de marzo de 2024 .
- ^ ab Kohl, Walter H. (1995). Manual de materiales y técnicas para dispositivos de vacío. Springer. págs. 164–67. ISBN 1-56396-387-6.
- ^ ab Kuhn, Howard; Medlin, Dana; et al., eds. (2000). Manual de ASM: Pruebas mecánicas y evaluación (PDF) . Vol. 8. ASM International. pág. 275. ISBN 0-87170-389-0Archivado desde el original (PDF) el 9 de febrero de 2019 . Consultado el 22 de febrero de 2022 .
- ^ Greenwood y Earnshaw 1997, págs. 1070–71.
- ^ "Tabla de conversión de dureza". Métricas de Maryland. Archivado desde el original el 18 de junio de 2015. Consultado el 23 de mayo de 2010 .
- ^ Takaji, Kusakawa; Toshikatsu, Otani (1964). "Propiedades de varios hierros puros: estudio sobre el hierro puro I". Tetsu-a-Hagane . 50 (1): 42–47. doi : 10.2355/tetsutohagane1955.50.1_42 .
- ^ Raghavan, V. (2004). Ciencia e ingeniería de materiales. PHI Learning Pvt. Ltd. pág. 218. ISBN 81-203-2455-2.
- ^ Martin, John Wilson (2007). Enciclopedia concisa de la estructura de los materiales. Elsevier. pág. 183. ISBN 978-0-08-045127-5.
- ^ ab Camp, James McIntyre; Francis, Charles Blaine (1920). Fabricación, modelado y tratamiento del acero. Pittsburgh: Carnegie Steel Company. págs. 173-74. ISBN 1-147-64423-3.
- ^ ab Smith, William F.; Hashemi, Javad (2006), Fundamentos de la ciencia y la ingeniería de materiales (4.ª ed.), McGraw-Hill, pág. 431, ISBN 0-07-295358-6.
- ^ ab «Clasificación de aceros al carbono y de baja aleación». Archivado desde el original el 2 de enero de 2011 . Consultado el 5 de enero de 2008 .
- ^ "HSLA Steel". 15 de noviembre de 2002. Archivado desde el original el 30 de diciembre de 2009. Consultado el 11 de octubre de 2008 .
- ^ Oberg, E.; et al. (1996). Manual de maquinaria (25.ª ed.). Nueva York: Industrial Press. págs. 440–42. Código Bibliográfico :1984msh..book.....R.
- ^ Rokni, Sayed H.; Cossairt, J. Donald; Liu, James C. (enero de 2008). "Radiation Shielding at High-Energy Electron and Proton Accelerators" (PDF) . Consultado el 6 de agosto de 2016 .
- ^ abc Greenwood y Earnshaw 1997, pág. 1076.
- ^ Fürstner, Alois (2016). "Catálisis de hierro en síntesis orgánica: una evaluación crítica de lo que se necesita para hacer de este metal base un campeón en multitarea". ACS Central Science . 2 (11): 778–789. doi :10.1021/acscentsci.6b00272. PMC 5140022 . PMID 27981231.
- ^ Bullock, R. Morris; et al. (2020). "Uso del modelo de la naturaleza para expandir la catálisis con metales abundantes en la Tierra". Science . 369 (6505): eabc3183. doi :10.1126/science.abc3183. PMC 7875315 . PMID 32792370.
- ^ Kolasinski, Kurt W. (2002). "Dónde son importantes las reacciones heterogéneas". Ciencia de superficies: fundamentos de la catálisis y la nanociencia . John Wiley and Sons. págs. 15-16. ISBN 978-0-471-49244-3.
- ^ McKetta, John J. (1989). "Nitrobenceno y nitrotolueno". Enciclopedia de procesamiento y diseño químico: volumen 31: líquidos de gas natural y gasolina natural para tuberías de proceso en alta mar: aleaciones de alto rendimiento . CRC Press. págs. 166–67. ISBN 978-0-8247-2481-8.
- ^ abc Wildermuth, Egon; Stark, Hans; Friedrich, Gabriele; Ebenhöch, Franz Ludwig; Kühborth, Brigitte; Silver, Jack; Rituper, Rafael (2000). "Compuestos de hierro". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a14_591. ISBN 3-527-30673-0.
- ^ Stroud, Robert (1933). Enfermedades de los canarios . Canary Publishers Company. pág. 203. ISBN 978-1-4465-4656-7.
- ^ Organización Mundial de la Salud (2021). Lista modelo de medicamentos esenciales de la Organización Mundial de la Salud: 22.ª lista (2021) . Ginebra: Organización Mundial de la Salud. hdl : 10665/345533 . OMS/MHP/HPS/EML/2021.02.
- ^ Dlouhy, Adrienne C.; Outten, Caryn E. (2013). "El metaloma de hierro en organismos eucariotas". En Banci, Lucia (ed.). Metalómica y la célula . Iones metálicos en las ciencias de la vida. Vol. 12. Springer. págs. 241–78. doi :10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5560-4. PMC 3924584 . PMID 23595675.libro electrónico ISBN 978-94-007-5561-1
- ^ Yee, Gereon M.; Tolman, William B. (2015). "Complejos de metales de transición y la activación del dioxígeno". En Peter MH Kroneck; Martha E. Sosa Torres (eds.). Sustentando la vida en el planeta Tierra: metaloenzimas que dominan el dioxígeno y otros gases masticables . Iones metálicos en las ciencias de la vida. Vol. 15. Springer. págs. 131–204. doi :10.1007/978-3-319-12415-5_5. ISBN 978-3-319-12414-8. Número de identificación personal 25707468.
- ^ abcdefghijklmnop Greenwood y Earnshaw 1997, págs. 1098-104.
- ^ Lippard, SJ; Berg, JM (1994). Principios de química bioinorgánica . Mill Valley: University Science Books. ISBN 0-935702-73-3.
- ^ Kikuchi, G.; Yoshida, T.; Noguchi, M. (2005). "Heme oxygenase and heme reduction". Comunicaciones de investigación bioquímica y biofísica . 338 (1): 558–67. doi :10.1016/j.bbrc.2005.08.020. PMID 16115609.
- ^ "Contenido de los volúmenes de la serie Iones metálicos en las ciencias de la vida". Metales, microbios y minerales: el lado biogeoquímico de la vida . De Gruyter. 2021. págs. xxv–xlvi. doi :10.1515/9783110589771-006. ISBN 9783110589771.S2CID 196704759 .
- ^ Neilands, JB (1995). "Sideroforos: estructura y función de los compuestos de transporte de hierro microbiano". The Journal of Biological Chemistry . 270 (45): 26723–26. doi : 10.1074/jbc.270.45.26723 . PMID 7592901.
- ^ Neilands, JB (1981). "Compuestos de hierro microbianos". Revista anual de bioquímica . 50 (1): 715–31. doi :10.1146/annurev.bi.50.070181.003435. PMID 6455965.
- ^ Boukhalfa, Hakim; Crumbliss, Alvin L. (2002). "Aspectos químicos del transporte de hierro mediado por sideróforos". BioMetals . 15 (4): 325–39. doi :10.1023/A:1020218608266. PMID 12405526. S2CID 19697776.
- ^ Nanami, M.; Ookawara, T.; Otaki, Y.; Ito, K.; Moriguchi, R.; Miyagawa, K.; Hasuike, Y.; Izumi, M.; Eguchi, H.; Suzuki, K.; Nakanishi, T. (2005). "Secuestro de hierro y estrés oxidativo inducidos por el factor de necrosis tumoral α en células endoteliales humanas". Arteriosclerosis, trombosis y biología vascular . 25 (12): 2495–501. doi : 10.1161/01.ATV.0000190610.63878.20 . PMID 16224057.
- ^ Rouault, Tracey A. (2003). "Cómo los mamíferos adquieren y distribuyen el hierro necesario para el metabolismo basado en oxígeno". PLOS Biology . 1 (3): e9. doi : 10.1371/journal.pbio.0000079 . PMC 300689 . PMID 14691550.
- ^ Boon EM, Downs A, Marcey D. "Proposed Mechanism of Catalase" (Mecanismo propuesto de la catalasa). Catalasa: H 2 O 2 : H 2 O 2 oxidorreductasa: Tutorial estructural de la catalasa . Consultado el 11 de febrero de 2007 .
- ^ Boyington JC, Gaffney BJ, Amzel LM (1993). "La estructura tridimensional de una 15-lipoxigenasa del ácido araquidónico". Science . 260 (5113): 1482–86. Bibcode :1993Sci...260.1482B. doi :10.1126/science.8502991. PMID 8502991.
- ^ Gray, NK; Hentze, MW (agosto de 1994). "La proteína reguladora del hierro previene la unión del complejo de preiniciación de la traducción 43S a los ARNm de ferritina y eALAS". EMBO J . 13 (16): 3882–91. doi :10.1002/j.1460-2075.1994.tb06699.x. PMC 395301 . PMID 8070415.
- ^ Gregory B. Vásquez; Xinhua Ji; Clara Fronticelli; Gary L. Gilliland (1998). "Carboxihemoglobina humana con una resolución de 2,2 Å: Comparaciones de estructura y disolventes de hemoglobinas en estado R, estado R2 y estado T". Acta Crystallogr. D . 54 (3): 355–66. Bibcode :1998AcCrD..54..355V. doi : 10.1107/S0907444997012250 . PMID 9761903.
- ^ Sanderson, K (2017). "El agarre de hierro de los mejillones inspira polímeros fuertes y elásticos". Chemical & Engineering News . 95 (44). American Chemical Society: 8. doi :10.1021/cen-09544-notw3 . Consultado el 2 de noviembre de 2017 .
- ^ Agencia de Normas Alimentarias – Comer bien, estar bien – Deficiencia de hierro Archivado el 8 de agosto de 2006 en Wayback Machine . Eatwell.gov.uk (5 de marzo de 2012). Recuperado el 27 de junio de 2012.
- ^ Hoppe, M.; Hulthén, L.; Hallberg, L. (2005). "La biodisponibilidad relativa en humanos de polvos de hierro elemental para su uso en la fortificación de alimentos". Revista Europea de Nutrición . 45 (1): 37–44. doi :10.1007/s00394-005-0560-0. PMID 15864409. S2CID 42983904.
- ^ Pineda, O.; Ashmead, HD (2001). "Efectividad del tratamiento de la anemia ferropénica en lactantes y niños pequeños con quelato de bis-glicinato ferroso". Nutrición . 17 (5): 381–4. doi :10.1016/S0899-9007(01)00519-6. PMID 11377130.
- ^ Ashmead, H. DeWayne (1989).Conversaciones sobre quelación y nutrición mineral. Editorial Keats. ISBN 0-87983-501-X.
- ^ Instituto de Medicina (EE. UU.) Panel sobre micronutrientes (2001). "Hierro" (PDF) . Ingesta dietética de referencia para vitamina A, vitamina K, arsénico, boro, cromo, cobre, yodo, hierro, manganeso, molibdeno, níquel, silicio, vanadio y hierro . National Academy Press. págs. 290–393. ISBN 0-309-07279-4. PMID 25057538. Archivado desde el original (PDF) el 9 de septiembre de 2017 . Consultado el 9 de marzo de 2017 .
- ^ "Resumen de los valores de referencia dietéticos para la población de la UE elaborados por el Panel de Productos Dietéticos, Nutrición y Alergias de la EFSA" (PDF) . Autoridad Europea de Seguridad Alimentaria . 2017.
- ^ "Niveles máximos de ingesta tolerables de vitaminas y minerales" (PDF) . Autoridad Europea de Seguridad Alimentaria. 2006.
- ^ "Anemia por deficiencia de hierro". MediResource. Archivado desde el original el 16 de diciembre de 2008. Consultado el 17 de diciembre de 2008 .
- ^ Milman, N. (1996). "Ferritina sérica en daneses: estudios del estado del hierro desde la infancia hasta la vejez, durante la donación de sangre y el embarazo". Revista Internacional de Hematología . 63 (2): 103–35. doi : 10.1016/0925-5710(95)00426-2 . PMID 8867722.
- ^ "Registro Federal del 27 de mayo de 2016, Etiquetado de alimentos: Revisión de las etiquetas de información nutricional y de suplementos. Página FR 33982" (PDF) .
- ^ "Daily Value Reference of the Dietary Supplement Label Database (DSLD)" ( Base de datos de etiquetas de suplementos dietéticos (DSLD)) . Archivado desde el original el 7 de abril de 2020. Consultado el 16 de mayo de 2020 .
- ^ Centros para el Control y la Prevención de Enfermedades (2002). "Deficiencia de hierro: Estados Unidos, 1999-2000". MMWR . 51 (40): 897–99. PMID 12418542.
- ^ Hider, Robert C.; Kong, Xiaole (2013). "Capítulo 8. Hierro: efecto de la sobrecarga y la deficiencia". En Astrid Sigel, Helmut Sigel y Roland KO Sigel (ed.). Interrelaciones entre iones metálicos esenciales y enfermedades humanas . Iones metálicos en las ciencias de la vida. Vol. 13. Springer. págs. 229–94. doi :10.1007/978-94-007-7500-8_8. ISBN 978-94-007-7499-5. Número de identificación personal 24470094.
- ^ Dlouhy, Adrienne C.; Outten, Caryn E. (2013). "El metaloma de hierro en organismos eucariotas". En Banci, Lucia (ed.). Metalómica y la célula . Iones metálicos en las ciencias de la vida. Vol. 12. Springer. págs. 241–78. doi :10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5560-4. PMC 3924584 . PMID 23595675.libro electrónico ISBN 978-94-007-5561-1
- ^ CDC Centros para el Control y la Prevención de Enfermedades (3 de abril de 1998). "Recomendaciones para prevenir y controlar la deficiencia de hierro en los Estados Unidos". Informe semanal de morbilidad y mortalidad . 47 (RR3): 1. Consultado el 12 de agosto de 2014 .
- ^ Centros para el Control y la Prevención de Enfermedades. «Hierro y deficiencia de hierro» . Consultado el 12 de agosto de 2014 .
- ^ Youdim, MB; Ben-Shachar, D.; Yehuda, S. (septiembre de 1989). "Mecanismos biológicos putativos del efecto de la deficiencia de hierro en la bioquímica y el comportamiento del cerebro". The American Journal of Clinical Nutrition . 50 (3 Suppl): 607–615, discusión 615–617. doi : 10.1093/ajcn/50.3.607 . ISSN 0002-9165. PMID 2773840.
- ^ Erikson, KM; Pinero, DJ; Connor, JR; Beard, JL (octubre de 1997). "Concentraciones regionales de hierro, ferritina y transferrina en el cerebro durante la deficiencia de hierro y la reposición de hierro en ratas en desarrollo". The Journal of Nutrition . 127 (10): 2030–2038. doi : 10.1093/jn/127.10.2030 . ISSN 0022-3166. PMID 9311961.
- ^ Unger, Erica L.; Bianco, Laura E.; Jones, Byron C.; Allen, Richard P.; Earley, Christopher J. (noviembre de 2014). "Efectos de los niveles bajos de hierro en el cerebro y reversibilidad en la dinámica de la dopamina estriatal". Neurología experimental . 261 : 462–468. doi :10.1016/j.expneurol.2014.06.023. PMC 4318655. PMID 24999026 .
- ^ Ward, Roberta J.; Zucca, Fabio A.; Duyn, Jeff H.; Crichton, Robert R.; Zecca, Luigi (octubre de 2014). "El papel del hierro en el envejecimiento cerebral y los trastornos neurodegenerativos". The Lancet. Neurología . 13 (10): 1045–1060. doi :10.1016/S1474-4422(14)70117-6. ISSN 1474-4465. PMC 5672917 . PMID 25231526.
- ^ Pino, Jessica MV; da Luz, Marcio HM; Antunes, Hanna KM; Giampá, Sara Q. de Campos; Martins, Vilma R.; Lee, Kil S. (17 de mayo de 2017). "La dieta restringida en hierro afecta los niveles de ferritina cerebral, el metabolismo de la dopamina y la proteína priónica celular de una manera específica de la región". Frontiers in Molecular Neuroscience . 10 : 145. doi : 10.3389/fnmol.2017.00145 . ISSN 1662-5099. PMC 5434142 . PMID 28567002.
- ^ Beard, John; Erikson, Keith M.; Jones, Byron C. (1 de abril de 2003). "La deficiencia de hierro neonatal produce cambios irreversibles en la función de la dopamina en ratas". The Journal of Nutrition . 133 (4): 1174–1179. doi : 10.1093/jn/133.4.1174 . ISSN 0022-3166. PMID 12672939.
- ^ Dominic J. Hare; Kay L. Double (abril de 2016). "Hierro y dopamina: una pareja tóxica". Cerebro . 139 (4): 1026–1035. doi : 10.1093/brain/aww022 . PMID 26962053.
- ^ Ramzi S. Cotran; Vinay Kumar; Tucker Collins; Stanley Leonard Robbins (1999). Base patológica de la enfermedad de Robbins. Saunders. ISBN 978-0-7216-7335-6. Recuperado el 27 de junio de 2012 .
- ^ Ganz T (agosto de 2003). "Hepcidina, un regulador clave del metabolismo del hierro y mediador de la anemia inflamatoria". Sangre . 102 (3): 783–8. doi : 10.1182/blood-2003-03-0672 . PMID 12663437. S2CID 28909635.
- ^ Durupt, S.; Durieu, I.; Nové-Josserand, R.; Bencharif, L.; Rousset, H.; Vital Durand, D. (2000). "Hemocromatosis hereditaria". Rev Méd Interne . 21 (11): 961–71. doi :10.1016/S0248-8663(00)00252-6. PMID 11109593.
- ^ ab Cheney, K.; Gumbiner, C.; Benson, B.; Tenenbein, M. (1995). "Supervivencia después de una intoxicación grave por hierro tratada con infusiones intermitentes de deferoxamina". J Toxicol Clin Toxicol . 33 (1): 61–66. doi :10.3109/15563659509020217. PMID 7837315.
- ^ ab "Toxicidad del hierro". Medscape . Consultado el 23 de mayo de 2010 .
- ^ Ingestas dietéticas de referencia (IDR): ingestas recomendadas para individuos (PDF) , Food and Nutrition Board, Institute of Medicine, National Academies, 2004, archivado desde el original (PDF) el 14 de marzo de 2013 , consultado el 9 de junio de 2009
- ^ Tenenbein, M. (1996). "Beneficios de la deferoxamina parenteral para la intoxicación aguda por hierro". J Toxicol Clin Toxicol . 34 (5): 485–89. doi :10.3109/15563659609028005. PMID 8800185.
- ^ Wu H, Wu T, Xu X, Wang J, Wang J (mayo de 2011). "Toxicidad del hierro en ratones con hemorragia intracerebral inducida por colagenasa". J Cereb Blood Flow Metab . 31 (5): 1243–50. doi :10.1038/jcbfm.2010.209. PMC 3099628 . PMID 21102602.
- ^ Robberecht, Harry; et al. (2020). "Estado de magnesio, hierro, zinc, cobre y selenio en el trastorno por déficit de atención e hiperactividad (TDAH)". Moléculas . 25 (19): 4440. doi : 10.3390/molecules25194440 . PMC 7583976 . PMID 32992575.
- ^ Soto-Insuga, V; et al. (2013). "[El papel del hierro en el tratamiento del trastorno por déficit de atención e hiperactividad]". An Pediatr (Barc) . 79 (4): 230–235. doi :10.1016/j.anpedi.2013.02.008. PMID 23582950.
- ^ Donfrancesco, Renato; Parisi, Pasquale; Vanacore, Nicola; Martínes, Francesca; Sargentini, Vittorio; Cortese, Samuele (mayo de 2013). "Hierro y TDAH: es hora de ir más allá de los niveles séricos de ferritina". Revista de trastornos de la atención . 17 (4): 347–357. doi :10.1177/1087054711430712. ISSN 1087-0547. PMID 22290693. S2CID 22445593.
- ^ Thévenod, Frank (2018). "Capítulo 15. El hierro y su papel en la defensa contra el cáncer: un arma de doble filo". En Sigel, Astrid; Sigel, Helmut; Freisinger, Eva; Sigel, Roland KO (eds.). Metalofármacos: desarrollo y acción de agentes anticancerígenos . Iones metálicos en las ciencias de la vida 18. Vol. 18. Berlín: de Gruyter GmbH. págs. 437–67. doi :10.1515/9783110470734-021. PMID 29394034.
- ^ ab Beguin, Y; Aapro, M; Ludwig, H; Mizzen, L; Osterborg, A (2014). "Estudios epidemiológicos y no clínicos que investigan los efectos del hierro en la carcinogénesis: una revisión crítica". Critical Reviews in Oncology/Hematology . 89 (1): 1–15. doi : 10.1016/j.critrevonc.2013.10.008 . PMID 24275533.
- ^ Morel, FMM, Hudson, RJM y Price, NM (1991). Limitación de la productividad por metales traza en el mar. Limnología y Oceanografía, 36(8), 1742-1755. doi :10.4319/lo.1991.36.8.1742
- ^ Brezezinski, MA, Baines, SB, Balch, WM, Beucher, CP, Chai, F., Dugdale, RC, Krause, JW, Landry, MR, Marchi, A., Measures, CI, Nelson, DM, Parker, AE, Poulton, AJ, Selph, KE, Strutton, PG, Taylor, AG y Twining, BS (2011). Co-limitación de diatomeas por hierro y ácido silícico en el Pacífico ecuatorial. Investigación en aguas profundas, parte II: estudios temáticos en oceanografía, 58(3-4), 493-511. doi :10.1016/j.dsr2.2010.08.005
- ^ Field, EK, Kato, S., Findlay, AJ, MacDonald, DJ, Chiu, BK, Luther, GW y Chan, CS (2016). Los oxidantes de hierro marinos planctónicos impulsan la mineralización de hierro en condiciones de bajo oxígeno. Geobiology, 14(5), 499-508. doi :10.1111/gbi.12189
- ^ Wells, ML, Price, NM y Bruland, KW (1995). Química del hierro en el agua de mar y su relación con el fitoplancton: informe de un taller. Marine Chemistry, 48(2), 157-182. doi :10.1016/0304-4203(94)00055-I
- ^ Lannuzel, D., Vancoppenolle, M., van der Merwe, P., de Jong, J., Meiners, KM, Grotti, M., Nishioska, J. y Schoemann. (2016). Hierro en el hielo marino: revisión y nuevos conocimientos. Elementa: Ciencia del Antropoceno, 4 000130. doi :10.12952/journal.elementa.000130
- ^ Raiswell, R. 2011. Transporte de hierro desde los continentes hasta el océano abierto: el ciclo de envejecimiento-rejuvenecimiento. Elements, 7(2), 101–106. doi :10.2113/gselements.7.2.101
- ^ Tagliabue, A., Bopp, L., Aumont, O., y Arrigo, KR (2009). Influencia de la luz y la temperatura en el ciclo del hierro marino: del modelado teórico al global. Ciclos biogeoquímicos globales, 23. doi :10.1029/2008GB003214
Bibliografía
- Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- Weeks, Mary Elvira ; Leichester, Henry M. (1968). "Elementos conocidos por los antiguos". Descubrimiento de los elementos . Easton, PA: Journal of Chemical Education. págs. 29–40. ISBN 0-7661-3872-0. Número de serie 68-15217.
Lectura adicional
- HR Schubert, Historia de la industria británica del hierro y el acero... hasta 1775 d. C. (Routledge, Londres, 1957)
- RF Tylecote, Historia de la metalurgia (Instituto de Materiales, Londres 1992).
- RF Tylecote, "El hierro en la Revolución Industrial" en J. Day y RF Tylecote, La revolución industrial en los metales (Instituto de Materiales 1991), 200–60.
Enlaces externos
- Es elemental – Hierro
- El hierro en la tabla periódica de vídeos (Universidad de Nottingham)
- Metalurgia para no metalúrgicos
- Hierro de JB Calvert





![Ilustración china del siglo XVII de trabajadores en un alto horno, fabricando hierro forjado a partir de arrabio[122]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/8c/Chinese_Fining_and_Blast_Furnace.jpg/440px-Chinese_Fining_and_Blast_Furnace.jpg)

_(cropped).jpg/440px-Geography_of_Ohio_-_DPLA_-_aaba7b3295ff6973b6fd1e23e33cde14_(page_111)_(cropped).jpg)





