Cloruro de hierro (III)
| |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombres IUPAC Cloruro de hierro (III) Tricloruro de hierro | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.028.846 | ||
| Número CE |
| ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU |
| ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| FeCl3 | |||
| Masa molar |
| ||
| Apariencia | Verde-negro con luz reflejada; púrpura-rojo con luz transmitida; sólido amarillo como hexahidrato; marrón como solución acuosa | ||
| Olor | Ligero HCl | ||
| Densidad |
| ||
| Punto de fusión | 307,6 °C (585,7 °F; 580,8 K) (anhidro) 37 °C (99 °F; 310 K) (hexahidrato) [1] | ||
| Punto de ebullición |
| ||
| 912 g/L (anhidro o hexahidrato, 25 °C) [1] | |||
| Solubilidad en |
| ||
| +13.450·10 −6 cm3 /mol [ 2] | |||
| Viscosidad | 12 c P (solución al 40%) | ||
| Peligros [4] [5] [Nota 1] | |||
| Etiquetado SGA : | |||
  | |||
| Peligro | |||
| H290 , H302 , H314 | |||
| P234 , P260 , P264 , P270 , P273 , P280 , P301+P312 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P363 , P390 , P405 , P406 , P501 | |||
| NFPA 704 (diamante de fuego) | |||
| punto de inflamabilidad | Ininflamable | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
REL (recomendado) | TWA 1 mg/m3 [ 3] | ||
| Ficha de datos de seguridad (FDS) | ICSC | ||
| Compuestos relacionados | |||
Otros aniones | |||
Otros cationes | |||
Coagulantes relacionados | |||
| Estructura | |||
| Hexagonal , hR24 | |||
| R 3 , Núm. 148 [7] | |||
a = 0,6065 nm, b = 0,6065 nm, c = 1,742 nm α = 90°, β = 90°, γ = 120° | |||
Unidades de fórmula ( Z ) | 6 | ||
| Octaédrico | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El cloruro de hierro (III) describe los compuestos inorgánicos con la fórmula FeCl3 ( H2O ) x . También llamado cloruro férrico , estos compuestos son algunos de los compuestos de hierro más importantes y comunes. Están disponibles tanto en forma anhidra como hidratada, que son ambas higroscópicas . Presentan hierro en su estado de oxidación +3 . El derivado anhidro es un ácido de Lewis , mientras que todas las formas son agentes oxidantes suaves. Se utiliza como limpiador de agua y como decapante de metales.
Propiedades electronicas y opticas

Todas las formas de cloruro férrico son paramagnéticas , debido a la presencia de electrones desapareados que residen en orbitales 3d. Aunque el cloruro de Fe(III) puede ser octaédrico o tetraédrico (o ambos, consulte la sección de estructura), todas estas formas tienen cinco electrones desapareados, uno por orbital d . La configuración electrónica de alto espín d 5 requiere que las transiciones electrónicas dd sean de espín prohibido , además de violar la regla de Laporte . Esta doble prohibición da como resultado que sus soluciones sean solo de color pálido. O, dicho de manera más técnica, las transiciones ópticas no son intensas. El sulfato férrico acuoso y el nitrato férrico , que contienen [Fe(H 2 O) 6 ] 3+ , son casi incoloros, mientras que las soluciones de cloruro son amarillas. Por lo tanto, los ligandos de cloruro influyen significativamente en las propiedades ópticas del centro de hierro. [8] [9]
Estructura
El cloruro de hierro (III) puede existir como material anhidro y como una serie de hidratos, lo que da lugar a estructuras distintas.
Anhidro
El compuesto anhidro es un sólido cristalino higroscópico con un punto de fusión de 307,6 °C. El color depende del ángulo de observación: con luz reflejada, los cristales aparecen de color verde oscuro, pero con luz transmitida , aparecen de color rojo púrpura. El cloruro de hierro(III) anhidro tiene la estructura BiI 3 , con centros octaédricos de Fe(III) interconectados por ligandos de cloruro de dos coordenadas . [7] [10]
El cloruro de hierro (III) tiene un punto de fusión relativamente bajo y hierve a alrededor de 315 °C. El vapor consiste en el dímero Fe 2 Cl 6 , muy parecido al cloruro de aluminio . Este dímero se disocia en el monomérico FeCl 3 (con simetría molecular de grupo puntual D 3h ) a temperaturas más altas, en competencia con su descomposición reversible para dar cloruro de hierro (II) y gas cloro . [11]
Hidratos
El cloruro férrico forma hidratos al exponerse al agua, lo que refleja su acidez de Lewis. Todos los hidratos presentan deliquescencia , lo que significa que se vuelven líquidos al absorber humedad del aire. La hidratación invariablemente da derivados de complejos acuosos con la fórmula [FeCl 2 (H 2 O) 4 ] + . Este catión puede adoptar estereoquímica trans o cis , lo que refleja la ubicación relativa de los ligandos de cloruro en el centro octaédrico Fe. Se han caracterizado cuatro hidratos por cristalografía de rayos X : el dihidrato FeCl 3 ·2H 2 O , el disesquihidrato FeCl 3 ·2.5H 2 O , el trisesquihidrato FeCl 3 ·3.5H 2 O y, finalmente, el hexahidrato FeCl 3 ·6H 2 O . Estas especies difieren con respecto a la estereoquímica del catión de hierro octaédrico, la identidad de los aniones y la presencia o ausencia de agua de cristalización . [9] Las fórmulas estructurales son [ trans −FeCl 2 (H 2 O) 4 ][FeCl 4 ] , [ cis −FeCl 2 (H 2 O) 4 ][FeCl 4 ]·H 2 O , [ cis −FeCl 2 (H 2 O) 4 ][FeCl 4 ]·H 2 O y [ trans −FeCl 2 (H 2 O) 4 ]Cl·2H 2 O . Los primeros tres miembros de esta serie tienen el anión tetraédrico tetracloroferrato ( [FeCl 4 ] − ). [12]
Solución
_chloride_2.JPG/440px-Iron(III)_chloride_2.JPG)
Al igual que los hidratos sólidos, las soluciones acuosas de cloruro férrico también consisten en el octaédrico [FeCl 2 (H 2 O) 4 ] + de estereoquímica no especificada. [9] La especiación detallada de soluciones acuosas de cloruro férrico es un desafío porque los componentes individuales no tienen firmas espectroscópicas distintivas. Los complejos de hierro (III), con una configuración de espín alto d 5 , son cinéticamente lábiles, lo que significa que los ligandos se disocian y reasocian rápidamente. Una complicación adicional es que estas soluciones son fuertemente ácidas, como se espera para los complejos acuosos de un metal tricatiónico. Los complejos acuosos de hierro son propensos a la olación , la formación de derivados oxo poliméricos . Las soluciones diluidas de cloruro férrico producen nanopartículas solubles con un peso molecular de 10 4 , que exhiben la propiedad de "envejecer", es decir, la estructura cambia o evoluciona con el transcurso de los días. [13] Las especies poliméricas formadas por la hidrólisis de cloruros férricos son clave para el uso de cloruro férrico para el tratamiento del agua.
En contraste con el comportamiento complicado de sus soluciones acuosas, las soluciones de cloruro de hierro (III) en éter dietílico y tetrahidrofurano se comportan bien. Ambos éteres forman aductos 1:2 de fórmula general FeCl 3 (éter) 2 . En estos complejos, el hierro es pentacoordinado. [14]
Preparación
Anualmente se producen varios cientos de toneladas de cloruro de hierro(III) anhidro. El método principal, llamado cloración directa , utiliza chatarra de hierro como precursor: [10]
- 2Fe + 3Cl2 → 2FeCl3
La reacción se lleva a cabo a varios cientos de grados, de modo que el producto es gaseoso. El uso de un exceso de cloro garantiza que el cloruro ferroso intermedio se convierta al estado férrico. [10] También se ha descrito un proceso similar, pero a escala de laboratorio. [15] [16]
También se producen industrialmente soluciones acuosas de cloruro de hierro (III) a partir de varios precursores del hierro, incluidos los óxidos de hierro:
- Fe2O3 + 6HCl + 9H2O → 2FeCl3 ( H2O ) 6
En ruta complementaria, el hierro metálico puede oxidarse mediante ácido clorhídrico seguido de cloración: [10]
- Fe + 2 HCl → FeCl2 + H2
- FeCl2 + 0,5 Cl2 + 6 H2O → FeCl3 ( H2O ) 6
A estos procesos se aplican varias variables, entre ellas la oxidación del hierro por cloruro férrico y la hidratación de los intermediarios. [10] Los hidratos de cloruro de hierro(III) no producen fácilmente cloruro férrico anhidro. Los intentos de deshidratación térmica producen ácido clorhídrico y oxicloruro de hierro . En el laboratorio, el cloruro de hierro(III) hidratado se puede convertir a la forma anhidra mediante el tratamiento con cloruro de tionilo [17] o cloruro de trimetilsililo : [18]
- FeCl3 ·6H2O + 12(CH3 ) 3SiCl → FeCl3 + 6 ((CH3 ) 3Si ) 2O + 12HCl
- FeCl3 · 6H2O + 6 SOCl2 → FeCl3 + 6 SO2 + 12 HCl
Reacciones
Al tener una configuración electrónica de espín d 5 alto, los cloruros de hierro (III) son lábiles , lo que significa que sus ligandos Cl y H 2 O se intercambian rápidamente con cloruro libre y agua. [9] [19] En contraste con su labilidad cinética, los cloruros de hierro (III) son termodinámicamente robustos, como lo reflejan los métodos vigorosos aplicados a su síntesis, como se describió anteriormente.
FeCl anhidro3
Aparte de la labilidad, que se aplica a las formas anhidras e hidratadas, la reactividad del cloruro férrico anhidro revela dos tendencias: es un ácido de Lewis y un agente oxidante . [20]
Las reacciones del cloruro de hierro (III) anhidro reflejan su descripción como oxófilo y como un ácido de Lewis duro . Existen innumerables manifestaciones de la oxofilia del cloruro de hierro (III). Cuando se calienta con óxido de hierro (III) a 350 °C, reacciona para dar oxicloruro de hierro : [21]
- FeCl3 + Fe2O3 → 3FeOCl
Los alcóxidos de metales alcalinos reaccionan para formar complejos de alcóxido de hierro (III) . Estos productos tienen estructuras más complicadas que el cloruro de hierro (III) anhidro. [22] [23] En la fase sólida se han descrito diversos complejos multinucleares para la reacción estequiométrica nominal entre FeCl 3 y etóxido de sodio :
- FeCl 3 + 3 CH 3 CH 2 ONa → "Fe(OCH 2 CH 3 ) 3 " + 3 NaCl
El cloruro de hierro (III) forma un aducto 1:2 con bases de Lewis como el óxido de trifenilfosfina , por ejemplo, FeCl 3 (OP(C 6 H 5 ) 3 ) 2 . El complejo 1:2 relacionado FeCl 3 (OEt 2 ) 2 , donde Et = C 2 H 5 ) , se ha cristalizado a partir de una solución de éter. [14]
El cloruro de hierro (III) también reacciona con el cloruro de tetraetilamonio para dar la sal amarilla del ion tetracloroferrato ( (Et 4 N)[FeCl 4 ] ). De manera similar, la combinación de FeCl 3 con NaCl y KCl da Na[FeCl 4 ] y K[FeCl 4 ] , respectivamente. [24]
Además de estas reacciones estequiométricas simples , la acidez de Lewis del cloruro férrico permite su uso en una variedad de reacciones catalizadas por ácido , como se describe a continuación en la sección sobre química orgánica. [10]
En términos de su acción como oxidante, el cloruro de hierro (III) oxida el polvo de hierro para formar cloruro de hierro (II) a través de una reacción de proporción : [10]
- 2FeCl3 + Fe → 3FeCl2
Una síntesis tradicional de cloruro ferroso anhidro es la reducción de FeCl 3 con clorobenceno : [25]
- 2FeCl3 + C6H5Cl → 2FeCl2 + C6H4Cl2 + HCl
El cloruro de hierro (III) libera gas cloro cuando se calienta por encima de 160 °C, generando cloruro ferroso : [16]
- 2FeCl3 → 2FeCl2 + Cl2
Para suprimir esta reacción, la preparación de cloruro de hierro (III) requiere un exceso de agente clorante, como se explicó anteriormente. [16] [10]
FeCl hidratado3
A diferencia del material anhidro, el cloruro férrico hidratado no es un ácido de Lewis particularmente fuerte ya que los ligandos de agua han apagado la acidez de Lewis al unirse a Fe(III).
Al igual que el material anhidro, el cloruro férrico hidratado es oxofílico. Por ejemplo, las sales de oxalato reaccionan rápidamente con cloruro de hierro(III) acuoso para dar [Fe( C2O4 ) 3 ] 3− , conocido como ferrioxalato . Otras fuentes de carboxilato , por ejemplo, citrato y tartrato , también se unen para dar complejos de carboxilato . La afinidad del hierro(III) por los ligandos de oxígeno fue la base de las pruebas cualitativas para fenoles. Aunque reemplazada por los métodos espectroscópicos, la prueba de cloruro férrico es una prueba colorimétrica tradicional. [26] La afinidad del hierro(III) por los fenoles se explota en la prueba de la mancha de Trinder . [27]
El cloruro de hierro (III) acuoso actúa como un oxidante de un electrón, como lo ilustra su reacción con cloruro de cobre (I) para dar cloruro de cobre (II) y cloruro de hierro (II).
- FeCl3 + CuCl → FeCl2 + CuCl2
Esta reacción fundamental es relevante para el uso de soluciones de cloruro férrico en el grabado del cobre.
Química organometálica
La interacción del cloruro de hierro(III) anhidro con compuestos de organolitio y organomagnesio se ha examinado a menudo. Estos estudios son posibles debido a la solubilidad de FeCl 3 en disolventes etéreos, lo que evita la posibilidad de hidrólisis de los agentes alquilantes nucleofílicos . Dichos estudios pueden ser relevantes para el mecanismo de las reacciones de acoplamiento cruzado catalizadas por FeCl 3 . [28] El aislamiento de intermediarios de organohierro(III) requiere reacciones a baja temperatura, para que los intermediarios [FeR 4 ] − no se degraden. Utilizando bromuro de metilmagnesio como agente de alquilación, se han aislado sales de Fe(CH 3 ) 4 ] − . [29] Para ilustrar la sensibilidad de estas reacciones, el metil litio LiCH 3 reacciona con cloruro de hierro(III) para dar tetracloroferrato de litio (II) Li 2 [FeCl 4 ] : [30]
- 2 FeCl3 + LiCH3 → FeCl2 + Li[ FeCl4 ] + 0,5 CH3CH3
- Li[FeCl 4 ] + LiCH 3 → Li 2 [FeCl 4 ] + 0,5 CH 3 CH 3
En gran medida, el acetilacetonato de hierro (III) y los complejos beta-dicetonato relacionados se utilizan más ampliamente que el FeCl3 como fuentes solubles en éter de iones férricos. [20] Estos complejos dicetonato tienen la ventaja de que no forman hidratos, a diferencia del cloruro de hierro (III), y son más solubles en solventes relevantes. [28] El bromuro de ciclopentadienilmagnesio experimenta una reacción compleja con el cloruro de hierro (III), lo que da como resultado ferroceno : [31]
- 3C5H5MgBr + FeCl3 → Fe ( C5H5 ) 2 + 1 / n ( C5H5 ) n + 3MgBrCl
Esta conversión, aunque no tuvo valor práctico, fue importante en la historia de la química organometálica, donde el ferroceno es emblemático del campo. [32]
Usos
Tratamiento de agua
Las aplicaciones más importantes del cloruro de hierro (III) son el tratamiento de aguas residuales y la producción de agua potable . Al formar redes altamente dispersas de materiales que contienen Fe-O-Fe, los cloruros férricos sirven como coagulantes y floculantes. [33] En esta aplicación, una solución acuosa de FeCl 3 se trata con una base para formar un flóculo de hidróxido de hierro (III) ( Fe(OH) 3 ), también formulado como FeO(OH) ( ferrihidrita ). Este flóculo facilita la separación de materiales suspendidos, clarificando el agua. [10]
El cloruro de hierro (III) también se utiliza para eliminar el fosfato soluble de las aguas residuales. El fosfato de hierro (III) es insoluble y, por lo tanto, precipita como un sólido. [34] Una posible ventaja de su uso en el tratamiento del agua es que el ion férrico oxida (desodoriza) el sulfuro de hidrógeno . [35]
Grabado y limpieza de metales
También se utiliza como agente de lixiviación en la hidrometalurgia del cloruro, [36] por ejemplo en la producción de Si a partir de FeSi (proceso Silgrain de Elkem ). [37]
En otra aplicación comercial, una solución de cloruro de hierro (III) es útil para grabar cobre de acuerdo con la siguiente ecuación:
- 2 FeCl 3 + Cu → 2 FeCl 2 + CuCl 2
El cloruro de cobre (II) soluble se elimina por enjuague y deja un patrón de cobre. Esta química se utiliza en la producción de placas de circuito impreso (PCB). [19]
El cloruro de hierro (III) se utiliza en muchos otros pasatiempos que involucran objetos metálicos. [38] [39] [40] [41] [42]
Química orgánica

En la industria, el cloruro de hierro (III) se utiliza como catalizador para la reacción del etileno con cloro , formando dicloruro de etileno ( 1,2-dicloroetano ): [43]
- H2C = CH2 + Cl2 → ClCH2CH2Cl
El dicloruro de etileno es un producto químico básico que se utiliza principalmente para la producción industrial de cloruro de vinilo , el monómero para fabricar PVC . [44]
Para ilustrar su uso como ácido de Lewis , el cloruro de hierro (III) cataliza la sustitución aromática electrofílica y las cloraciones . En este papel, su función es similar a la del cloruro de aluminio . En algunos casos, se utilizan mezclas de los dos. [45]
Investigación en síntesis orgánica
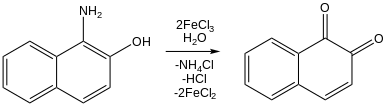
Aunque los cloruros de hierro (III) rara vez se utilizan en la síntesis orgánica práctica , han recibido considerable atención como reactivos porque son económicos, abundantes en la tierra y relativamente no tóxicos. Muchos experimentos investigan tanto su actividad redox como su acidez de Lewis. [20] Por ejemplo, el cloruro de hierro (III) oxida naftoles a naftoquinonas: [20] [46] Los 3-alquil tiofenos se polimerizan a politiofenos tras el tratamiento con cloruro férrico. [47] Se ha demostrado que el cloruro de hierro (III) promueve la reacción de acoplamiento CC . [48]
Se han desarrollado varios reactivos basados en cloruro de hierro (III) soportado . En gel de sílice , la sal anhidra se ha aplicado a ciertas reacciones de deshidratación y reordenamiento de tipo pinacol . Un reactivo similar pero humedecido induce reacciones de hidrólisis o epimerización . [49] En alúmina , se ha demostrado que el cloruro férrico acelera las reacciones de eno . [50]
Cuando se trata previamente con hidruro de sodio , el cloruro de hierro (III) produce un agente reductor de hidruro que convierte los alquenos y cetonas en alcanos y alcoholes , respectivamente. [51]
Histología
El cloruro de hierro (III) es un componente de colorantes útiles, como la solución de Carnoy , un fijador histológico con muchas aplicaciones. También se utiliza para preparar la tinción de Verhoeff . [52]
Ocurrencia natural
Al igual que muchos haluros metálicos, el FeCl3 se encuentra de forma natural como un mineral traza. El mineral raro molysita suele estar asociado con volcanes y fumarolas . [53] [54]
Los aerosoles a base de FeCl3 se producen por una reacción entre el polvo rico en hierro y el ácido clorhídrico de la sal marina. Este aerosol de sal de hierro causa entre el 1 y el 5 % de la oxidación natural del metano y se cree que tiene una serie de efectos refrescantes; por lo tanto, se ha propuesto como catalizador para la eliminación del metano atmosférico . [55]
Se plantea la hipótesis de que las nubes de Venus contienen aproximadamente un 1% de FeCl3 disuelto en ácido sulfúrico . [56] [57]
Seguridad
Los cloruros de hierro (III) se utilizan ampliamente en el tratamiento del agua potable , [10] por lo que plantean pocos problemas como venenos, en bajas concentraciones. [ ¿ Síntesis incorrecta? ] No obstante, el cloruro de hierro (III) anhidro, así como la solución acuosa concentrada de FeCl3 , son altamente corrosivos y deben manipularse utilizando el equipo de protección adecuado. [20]
Notas
- ^ Una clasificación alternativa del SGA del Comité Interministerial del SGA japonés (2006) [6] señala la posibilidad de irritación del tracto respiratorio por FeCl3 y difiere ligeramente en otros aspectos de la clasificación utilizada aquí.
Referencias
- ^ abcdef Haynes WM, ed. (2011). Manual de química y física del CRC (92.ª edición). Boca Raton, FL: CRC Press . pág. 4.69. ISBN 1-4398-5511-0.
- ^ Haynes WM, ed. (2011). Manual de química y física del CRC (92.ª edición). Boca Raton, FL: CRC Press . pág. 4.133. ISBN 1-4398-5511-0.
- ^ Guía de bolsillo del NIOSH sobre peligros químicos. "#0346". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Base de datos de información sobre clasificación química HSNO, Autoridad de Gestión de Riesgos Ambientales de Nueva Zelanda , consultado el 19 de septiembre de 2010
- ^ Diversos proveedores, recopilados por Baylor College of Dentistry, Texas A&M University . (consultado el 19 de septiembre de 2010)
- ^ Clasificación GHS – ID 831, Comité Interministerial del GHS japonés, 2006 , consultado el 19 de septiembre de 2010
- ^ ab Hashimoto S, Forster K, Moss SC (1989). "Refinamiento estructural de un cristal de FeCl3 utilizando una muestra de placa delgada". J. Appl. Crystallogr. 22 (2): 173–180. Código Bibliográfico :1989JApCr..22..173H. doi :10.1107/S0021889888013913.
- ^ Housecroft CE, Sharpe AG (2012). Química inorgánica (4.ª ed.). Prentice Hall. pág. 747. ISBN 978-0-273-74275-3.
- ^ abcd Simon A. Cotton (2018). "Cloruro de hierro (III) y su química de coordinación". Revista de química de coordinación . 71 (21): 3415–3443. doi :10.1080/00958972.2018.1519188. S2CID 105925459.
- ^ abcdefghij Wildermuth E, Stark H, Friedrich G, Ebenhöch FL, Kühborth B, Silver J, Rituper R (2000). "Compuestos de hierro". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a14_591. ISBN 3527306730.
- ^ Holleman AF, Wiberg E (2001). Wiberg N (ed.). Química inorgánica . San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ Lind MD (1967). "Estructura cristalina del cloruro férrico hexahidratado". The Journal of Chemical Physics . 47 (3): 990–993. Código Bibliográfico :1967JChPh..47..990L. doi : 10.1063/1.1712067 .
- ^ Flynn CM (1984). "Hidrolisis de sales inorgánicas de hierro (III)". Chemical Reviews . 84 : 31–41. doi :10.1021/cr00059a003.
- ^ ab Spandl J, Kusserow M, Brüdgam I (2003). "Alkoxo-Verbindungen des dreiwertigen Eisen: Synthese und Charakterisierung von [Fe2(Ot Bu)6], [Fe2Cl2(Ot Bu)4], [Fe2Cl4(Ot Bu)2] y [N(n Bu)4]2[Fe6OCl6 (OMe)12]". Zeitschrift für anorganische und allgemeine Chemie . 629 (6): 968–974. doi : 10.1002/zaac.200300008 .
- ^ Tarr BR, Booth HS, Dolance A (1950). "Cloruro de hierro(III) anhidro (cloruro férrico)". Síntesis inorgánica . Vol. 3. págs. 191-194. doi :10.1002/9780470132340.ch51. ISBN . 9780470131626.
- ^ abc H. Lux (1963). "Cloruro de hierro (III)". En G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2.ª ed . Vol. 2. Nueva York, NY: Academic Press. pág. 1492.
- ^ Pray AR, Heitmiller RF, Strycker S, et al. (1990). "Cloruros metálicos anhidros". Síntesis inorgánica . Vol. 28. págs. 321–323. doi :10.1002/9780470132593.ch80. ISBN. 9780470132593.
- ^ Boudjouk P, So JH, Ackermann MN, et al. (1992). "Cloruros metálicos anhidros solvatados y no solvatados a partir de hidratos de cloruro metálico". Síntesis inorgánica . Vol. 29. págs. 108-111. doi :10.1002/9780470132609.ch26. ISBN . 9780470132609.
- ^ ab Greenwood NN, Earnshaw A (1997). Química de los elementos (2.ª ed.). Oxford: Butterworth-Heinemann . pág. 1084. ISBN 9780750633659.
- ^ abcde White AD, Gallou F (2006). "Cloruro de hierro (III)". Enciclopedia de reactivos para síntesis orgánica . doi :10.1002/047084289X.ri054.pub2. ISBN 0471936235.
- ^ Kikkawa S, Kanamaru F, Koizumi M, et al. (1984). "Compuestos de intercalación estratificada". En Holt SL Jr (ed.). Síntesis inorgánica . Vol. 22. John Wiley & Sons, Inc. págs. 86–89. doi :10.1002/9780470132531.ch17. ISBN 9780470132531.
- ^ Turova NY, Turevskaya EP, Kessler VG, et al., eds. (2002). "12.22.1 Síntesis". La química de los alcóxidos metálicos. Springer Science. pág. 481. ISBN 0306476576.
- ^ Bradley DC, Mehrotra RC, Rothwell I, et al. (2001). "3.2.10. Alcóxidos de metales 3d posteriores". Derivados alcoxo y ariloxo de metales . San Diego: Academic Press. p. 69. ISBN 9780121241407.OCLC 162129468 .
- ^ Cook CM Jr, Dunn WE Jr (1961). "La reacción del cloruro férrico con cloruros de sodio y potasio". J. Phys. Chem . 65 (9): 1505–1511. doi :10.1021/j100905a008.
- ^ P. Kovacic y NO Brace (1960). "Cloruro de hierro (II)". Síntesis inorgánica . Vol. 6. págs. 172-173. doi :10.1002/9780470132371.ch54. ISBN . 9780470132371.
- ^ Furniss BS, Hannaford AJ, Smith PW, et al. (1989). Libro de texto de química orgánica práctica de Vogel (5.ª ed.). Nueva York: Longman / Wiley . ISBN 9780582462366.
- ^ James A. King, Alan B. Storrow, Jeff A. Finkelstein (1995). "Prueba de orina Trinder Spot: una prueba rápida de detección de salicilato para el servicio de urgencias". Anales de Medicina de Urgencias . 26 (3): 330–333. doi :10.1016/S0196-0644(95)70082-X. PMID 7661424.
- ^ ab Mako TL, Byers JA (2016). "Avances recientes en reacciones de acoplamiento cruzado catalizadas por hierro y su fundamento mecanicista". Fronteras de la química inorgánica . 3 (6): 766–790. doi :10.1039/C5QI00295H.
- ^ Sears JD, Muñoz SB, Cuenca MC, Brennessel WW, Neidig ML (2019). "Síntesis y caracterización de un complejo de ferrato de tetraalquilhierro(III) homoléptico estéricamente encofrado". Poliedro . 158 : 91–96. doi :10.1016/j.poly.2018.10.041. PMC 6481957 . PMID 31031511. y referencias contenidas en el mismo.
- ^ Berthold HJ, Spiegl HJ (1972). "Über die Bildung von Lithiumtetracloroferrat (II) Li 2 FeCl 4 bei der Umsetzung von Eisen (III) -cloruro de litiometilo (1: 1) en ätherischer Lösung". Z. Anorg. Allg. Química. (en alemán). 391 (3): 193–202. doi :10.1002/zaac.19723910302.
- ^ Kealy TJ, Pauson PL (1951). "Un nuevo tipo de compuesto de organohierro". Nature . 168 (4285): 1040. Bibcode :1951Natur.168.1039K. doi :10.1038/1681039b0. S2CID 4181383.
- ^ Pauson PL (2001). "Ferroceno: cómo empezó todo". Journal of Organometallic Chemistry . 637–639: 3–6. doi :10.1016/S0022-328X(01)01126-3.
- ^ Productos químicos para el tratamiento del agua (PDF) . Productos químicos básicos de Akzo Nobel . 2007. Archivado desde el original (PDF) el 13 de agosto de 2010 . Consultado el 26 de octubre de 2007 .
- ^ "Tecnologías de tratamiento y eliminación de fósforo" (PDF) . Agencia de Control de la Contaminación de Minnesota . Junio de 2006.
- ^ Prathna TC, Srivastava A (2021). "Cloruro férrico para el control de olores: estudios de plantas de tratamiento de aguas residuales en la India". Práctica y tecnología del agua . 16 (1): 35–41. doi : 10.2166/wpt.2020.111 . S2CID 229396639.
- ^ Park KH, Mohapatra D, Reddy BR (2006). "Un estudio sobre la lixiviación con cloruro férrico acidificado de una mata compleja (Cu–Ni–Co–Fe)". Tecnología de separación y purificación . 51 (3): 332–337. doi :10.1016/j.seppur.2006.02.013.
- ^ Dueñas Díez M, Fjeld M, Andersen E, et al. (2006). "Validación de un modelo de balance poblacional compartimentado de un proceso de lixiviación industrial: el proceso Silgrain". Chem. Eng. Sci. 61 (1): 229–245. Bibcode :2006ChEnS..61..229D. doi :10.1016/j.ces.2005.01.047.
- ^ John David Graham. "Safer Printmaking—Intaglio". Universidad de Saskatchewan . Consultado el 5 de febrero de 2024 .
- ^ Harris P, Hartman R, Hartman J (1 de noviembre de 2002). "Grabado de meteoritos de hierro". Meteorite Times . Consultado el 14 de octubre de 2016 .
- ^ Mike Lockwood, Carl Zambuto. "Un mensaje sobre el recubrimiento y repintado de espejos". Lockwood Custom Optics, Inc. Lockwood Custom Optics . Consultado el 5 de febrero de 2024 .
- ^ CoinValueLookup (13 de diciembre de 2023). "Valor de Buffalo Nickel sin fecha: ¿cuánto vale hoy?". CoinValueLookup . Consultado el 5 de febrero de 2024 .
- ^ Scott D, Schwab R (2019). "3.1.4. Grabado". Metalografía en arqueología y arte . Ciencia del patrimonio cultural. Springer. doi :10.1007/978-3-030-11265-3. ISBN 978-3-030-11265-3. Número de identificación S2C: 201676001.
- ^ Dreher EL, Beutel KK, Myers JD, Lübbe T, Krieger S, Pottenger LH (2014). "Cloroetanos y Cloroetilenos". Enciclopedia de química industrial de Ullmann . págs. 1–81. doi :10.1002/14356007.o06_o01.pub2. ISBN 9783527306732.
- ^ "Sustancias tóxicas: 1,2-dicloroetano". ATSDR . Consultado el 30 de agosto de 2023 .
- ^ Riddell WA, Noller CR (1932). "Catálisis mixta en la reacción de Friedel y Crafts. Rendimientos en reacciones típicas utilizando mezclas de cloruro férrico y cloruro de aluminio como catalizadores". J. Am. Chem. Soc . 54 (1): 290–294. doi :10.1021/ja01340a043.
- ^ Louis F. Fieser (1937). "1,2-Naphthoquinone". Síntesis orgánicas . 17 : 68. doi :10.15227/orgsyn.017.0068.
- ^ So RC, Carreon-Asok AC (2019). "Diseño molecular, estrategias sintéticas y aplicaciones de politiofenos catiónicos". Chemical Reviews . 119 (21): 11442–11509. doi :10.1021/acs.chemrev.8b00773. PMID 31580649. S2CID 206542971.
- ^ Albright H, Davis AJ, Gomez-Lopez JL, Vonesh HL, Quach PK, Lambert TH, Schindler CS (2021). "Metátesis de carbonil-olefinas". Chemical Reviews . 121 (15): 9359–9406. doi :10.1021/acs.chemrev.0c01096. PMC 9008594 . PMID 34133136.
- ^ White AD (2001). "Gel de sílice y cloruro de hierro (III)". Enciclopedia de reactivos para síntesis orgánica . doi :10.1002/047084289X.ri059. ISBN 0471936235.
- ^ White AD (2001). "Cloruro de hierro(III)-alúmina". Enciclopedia de reactivos para síntesis orgánica . doi :10.1002/047084289X.ri057. ISBN 0471936235.
- ^ White AD (2001). "Cloruro de hierro (III)-hidruro de sodio". Enciclopedia de reactivos para síntesis orgánica . doi :10.1002/047084289X.ri060. ISBN 0471936235.
- ^ Mallory, Sheehan, Hrapchak (1990). "Verhoeff's Elastic Stain". En Carson F, Cappellano CH (eds.). Histotechnology – A Self-Instructional Text. Chicago: ASCP Press . Consultado el 2 de enero de 2013 a través de The Visible Mouse Project, UC Davis .
- ^ "Molysite". mindat.org . Mindat . Consultado el 5 de febrero de 2024 .
- ^ "Lista de minerales de la IMA". Asociación Mineralógica Internacional . 21 de marzo de 2011. Consultado el 5 de febrero de 2024 .
- ^ Oeste FD, de Richter R, Ming T, Caillol S (13 de enero de 2017). "Ingeniería climática imitando el control climático del polvo natural: el método del aerosol de sal de hierro". Earth System Dynamics . 8 (1): 1–54. Bibcode :2017ESD.....8....1O. doi : 10.5194/esd-8-1-2017 – via esd.copernicus.org.
- ^ Krasnopolsky VA, Parshev VA (1981). "Composición química de la atmósfera de Venus". Nature . 292 (5824): 610–613. Código Bibliográfico :1981Natur.292..610K. doi :10.1038/292610a0. S2CID 4369293.
- ^ Krasnopolsky VA (2006). "Composición química de la atmósfera y las nubes de Venus: algunos problemas sin resolver". Ciencia planetaria y espacial . 54 (13–14): 1352–1359. Código Bibliográfico :2006P&SS...54.1352K. doi :10.1016/j.pss.2006.04.019.
Lectura adicional
- Lide DR, ed. (1990). Manual de química y física del CRC (71.ª edición). Ann Arbor, Michigan, EE. UU.: CRC Press. ISBN 9780849304712.
- Stecher PG, Finkel MJ, Siegmund OH, eds. (1960). Índice Merck de productos químicos y fármacos (7.ª ed.). Rahway, Nueva Jersey, EE. UU.: Merck & Co.
- Nicholls D (1974). Complexes and First-Row Transition Elements, Macmillan Press, Londres, 1973. Un texto de química de Macmillan. Londres: Macmillan Press. ISBN 9780333170885.
- Wells AF (1984). Química inorgánica estructural . Publicaciones científicas de Oxford (5.ª ed.). Oxford, Reino Unido: Oxford University Press. ISBN 9780198553700.
- Reich HJ, Rigby HJ, eds. (1999). Reactivos ácidos y básicos . Manual de reactivos para síntesis orgánica. Nueva York: John Wiley & Sons, Inc. ISBN 9780471979258.
_chloride_anhydrate.jpg/440px-Iron(III)_chloride_anhydrate.jpg)







