Fuerza del ácido
La fuerza ácida es la tendencia de un ácido , simbolizada por la fórmula química , a disociarse en un protón , , y un anión , . La disociación o ionización de un ácido fuerte en solución es efectivamente completa, excepto en sus soluciones más concentradas.
Ejemplos de ácidos fuertes son el ácido clorhídrico , el ácido perclórico , el ácido nítrico y el ácido sulfúrico .
Un ácido débil está sólo parcialmente disociado, o está parcialmente ionizado en agua, estando presentes tanto el ácido no disociado como sus productos de disociación, en solución, en equilibrio entre sí.
El ácido acético ( ) es un ejemplo de ácido débil. La fuerza de un ácido débil se cuantifica por su constante de disociación ácida , valor .
La fuerza de un ácido orgánico débil puede depender de los efectos de los sustituyentes. La fuerza de un ácido inorgánico depende del estado de oxidación del átomo al que puede estar unido el protón. La fuerza de un ácido depende del disolvente. Por ejemplo, el cloruro de hidrógeno es un ácido fuerte en solución acuosa, pero es un ácido débil cuando se disuelve en ácido acético glacial .
Medidas de fuerza ácida
La medida habitual de la fuerza de un ácido es su constante de disociación ácida ( ), que se puede determinar experimentalmente mediante métodos de titulación . Los ácidos más fuertes tienen una constante logarítmica mayor y menor ( ) que los ácidos más débiles. Cuanto más fuerte es un ácido, más fácilmente pierde un protón, . Dos factores clave que contribuyen a la facilidad de desprotonación son la polaridad del enlace y el tamaño del átomo A, que determinan la fuerza del enlace. La fuerza de los ácidos también depende de la estabilidad de la base conjugada.
Mientras que el valor mide la tendencia de un soluto ácido a transferir un protón a un solvente estándar (más comúnmente agua o DMSO ), la tendencia de un solvente ácido a transferir un protón a un soluto de referencia (más comúnmente una base de anilina débil ) se mide por su función de acidez de Hammett , el valor. Aunque estos dos conceptos de fuerza ácida a menudo equivalen a la misma tendencia general de una sustancia a donar un protón, los valores y son medidas de propiedades distintas y ocasionalmente pueden divergir. Por ejemplo, el fluoruro de hidrógeno, ya sea disuelto en agua ( = 3,2) o DMSO ( = 15), tiene valores que indican que sufre una disociación incompleta en estos solventes, lo que lo convierte en un ácido débil. Sin embargo, como medio ácido puro y rigurosamente secado, el fluoruro de hidrógeno tiene un valor de -15, [1] lo que lo convierte en un medio protonante más fuerte que el ácido sulfúrico al 100% y, por lo tanto, por definición, un superácido . [2] (Para evitar ambigüedades, en el resto de este artículo, "ácido fuerte" se referirá, a menos que se indique lo contrario, a un ácido que es fuerte medido por su valor ( < –1,74). Este uso es consistente con el lenguaje común de la mayoría de los químicos en ejercicio ).
Cuando el medio ácido en cuestión es una solución acuosa diluida, el es aproximadamente igual al valor del pH , que es un logaritmo negativo de la concentración de acuoso en solución. El pH de una solución simple de un ácido en agua está determinado tanto por y por la concentración de ácido. Para soluciones de ácidos débiles, depende del grado de disociación , que puede determinarse mediante un cálculo de equilibrio. Para soluciones concentradas de ácidos, especialmente ácidos fuertes para los cuales el pH < 0, el valor es una mejor medida de la acidez que el pH.
Ácidos fuertes

Un ácido fuerte es un ácido que se disocia según la reacción
donde S representa una molécula de disolvente, como una molécula de agua o de dimetilsulfóxido (DMSO), en tal medida que la concentración de la especie no disociada es demasiado baja para ser medida. Para fines prácticos, se puede decir que un ácido fuerte está completamente disociado. Un ejemplo de un ácido fuerte es el ácido perclórico .
- (en solución acuosa)
Cualquier ácido con un valor de pH inferior a -2 se clasifica como ácido fuerte. Esto se debe a la gran capacidad tampón de las soluciones con un valor de pH de 1 o inferior y se conoce como efecto nivelador . [3]
Los siguientes son ácidos fuertes en solución acuosa y de dimetilsulfóxido. Los valores de , no se pueden medir experimentalmente. Los valores de la siguiente tabla son valores promedio de hasta 8 cálculos teóricos diferentes.
Valores estimados de p K a [4] Ácido Fórmula En el agua En DMSO Ácido clorhídrico Clorhidrato -5,9 ± 0,4 -2,0 ± 0,6 Ácido bromhídrico HBr -8,8 ± 0,8 -6,8 ± 0,8 Ácido yodhídrico HOLA -9,5 ± 1 -10,9 ± 1 Ácido tríflico H [ CF3SO3 ] -14 ± 2 -14 ± 2 Ácido perclórico H[ClO 4 ] -15 ± 2 -15 ± 2
También en el agua
- Ácido nítrico = −1,6 [5]
- Ácido sulfúrico (sólo primera disociación, ≈ −3) [6] : (p. 171)
Los siguientes pueden usarse como protonadores en química orgánica.
Los ácidos sulfónicos , como el ácido p-toluenosulfónico (ácido tosílico), son una clase de oxiácidos orgánicos fuertes . [7] Algunos ácidos sulfónicos se pueden aislar como sólidos. El poliestireno funcionalizado en sulfonato de poliestireno es un ejemplo de una sustancia que es un ácido fuerte sólido.
Ácidos débiles

Un ácido débil es una sustancia que se disocia parcialmente o se ioniza parcialmente cuando se disuelve en un disolvente. En solución existe un equilibrio entre el ácido, y los productos de disociación.
El disolvente (por ejemplo, agua) se omite de esta expresión cuando su concentración no cambia efectivamente por el proceso de disociación ácida. La fuerza de un ácido débil se puede cuantificar en términos de una constante de disociación , , definida de la siguiente manera, donde significa la concentración de una fracción química, X.
Cuando se conoce un valor numérico de, se puede utilizar para determinar el grado de disociación en una solución con una concentración dada del ácido, , aplicando la ley de conservación de la masa .
donde es el valor de la concentración analítica del ácido. Cuando todas las cantidades en esta ecuación se tratan como números, las cargas iónicas no se muestran y esto se convierte en una ecuación cuadrática en el valor de la concentración de iones de hidrógeno, .
Esta ecuación muestra que el pH de una solución de un ácido débil depende tanto de su valor como de su concentración. Ejemplos típicos de ácidos débiles incluyen el ácido acético y el ácido fosforoso . Se dice que un ácido como el ácido oxálico ( ) es dibásico porque puede perder dos protones y reaccionar con dos moléculas de una base simple. El ácido fosfórico ( ) es tribásico.
Para un tratamiento más riguroso de la fuerza de los ácidos, véase la constante de disociación de los ácidos . Esto incluye ácidos como el ácido dibásico ácido succínico , para el cual no se puede utilizar el método simple de calcular el pH de una solución, que se muestra arriba.
Determinación experimental
La determinación experimental de un valor se realiza comúnmente mediante una titulación . [8] Un procedimiento típico sería el siguiente. Se añade una cantidad de ácido fuerte a una solución que contiene el ácido o una sal del ácido, hasta el punto en que el compuesto está completamente protonado. Luego, la solución se titula con una base fuerte.
hasta que solo la especie desprotonada, , permanezca en solución. En cada punto de la titulación se mide el pH utilizando un electrodo de vidrio y un medidor de pH . La constante de equilibrio se encuentra ajustando los valores de pH calculados a los valores observados, utilizando el método de mínimos cuadrados .
Par ácido/base conjugado
A veces se afirma que "el conjugado de un ácido débil es una base fuerte". Tal afirmación es incorrecta. Por ejemplo, el ácido acético es un ácido débil que tiene a = 1,75 x 10 −5 . Su base conjugada es el ion acetato con K b = 10 −14 / K a = 5,7 x 10 −10 (de la relación K a × K b = 10 −14 ), que ciertamente no corresponde a una base fuerte. El conjugado de un ácido débil es a menudo una base débil y viceversa .
Ácidos en disolventes no acuosos
La fuerza de un ácido varía de un disolvente a otro. Un ácido que es fuerte en agua puede ser débil en un disolvente menos básico, y un ácido que es débil en agua puede ser fuerte en un disolvente más básico. Según la teoría ácido-base de Brønsted-Lowry , el disolvente S puede aceptar un protón.
Por ejemplo, el ácido clorhídrico es un ácido débil en solución en ácido acético puro , que es más ácido que el agua.
El grado de ionización de los ácidos hidrohalogenados disminuye en el orden . Se dice que el ácido acético es un disolvente diferenciador para los tres ácidos, mientras que el agua no lo es. [6] : (p. 217)
Un ejemplo importante de un disolvente que es más básico que el agua es el dimetilsulfóxido , DMSO . Un compuesto que es un ácido débil en agua puede convertirse en un ácido fuerte en DMSO. El ácido acético es un ejemplo de este tipo de sustancia. Se puede encontrar una amplia bibliografía de valores en solución en DMSO y otros disolventes en Datos de acidez y basicidad en disolventes no acuosos.
Los superácidos son ácidos fuertes incluso en disolventes de baja constante dieléctrica. Algunos ejemplos de superácidos son el ácido fluoroantimónico y el ácido mágico . Algunos superácidos pueden cristalizarse. [9] También pueden estabilizar cuantitativamente los carbocationes . [10]
Los ácidos de Lewis que reaccionan con bases de Lewis en fase gaseosa y disolventes no acuosos se han clasificado en el modelo ECW , y se ha demostrado que no existe un orden único de fortalezas de los ácidos. [11] La fortaleza aceptora relativa de los ácidos de Lewis hacia una serie de bases, frente a otros ácidos de Lewis, se puede ilustrar mediante gráficos CB . [12] [13] Se ha demostrado que para definir el orden de fortaleza de los ácidos de Lewis se deben considerar al menos dos propiedades. Para la teoría HSAB cualitativa las dos propiedades son dureza y fortaleza, mientras que para el modelo ECW cuantitativo las dos propiedades son electrostática y covalente.
Factores que determinan la fuerza del ácido
El efecto inductivo
En los ácidos carboxílicos orgánicos, un sustituyente electronegativo puede extraer la densidad electrónica de un enlace ácido a través del efecto inductivo , lo que da como resultado un valor menor . El efecto disminuye cuanto más se aleja el elemento electronegativo del grupo carboxilato, como lo ilustra la siguiente serie de ácidos butanóicos halogenados .
| Estructura | Nombre | pK a |
|---|---|---|
 | Ácido 2-clorobutanoico | 2.86 |
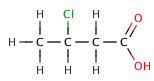 | Ácido 3-clorobutanoico | 4.0 |
 | Ácido 4-clorobutanoico | 4.5 |
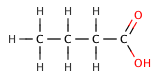 | ácido butanóico | 4.5 |
Efecto del estado de oxidación
En un conjunto de oxoácidos de un elemento, los valores disminuyen con el estado de oxidación del elemento. Los oxoácidos del cloro ilustran esta tendencia. [6] : (p. 171)
| Estructura | Nombre | Estado de oxidación | pK a |
|---|---|---|---|
 | ácido perclórico | 7 | -8 † |
 | ácido clorhídrico | 5 | -1 |
 | ácido cloroso | 3 | 2.0 |
 | ácido hipocloroso | 1 | 7.53 |
† teórico
Referencias
- ^ Liang, Joan-Nan Jack (1976). Función de acidez de Hammett para el ácido fluorhídrico y algunos sistemas superácidos relacionados (tesis doctoral) (PDF) . Hamilton, Ontario: Universidad McMaster. pág. 94.
- ^ Miessler GL y Tarr DA Química inorgánica (2.ª ed., Prentice-Hall 1998, pág. 170) ISBN 0-13-841891-8
- ^ Porterfield, William W. Química inorgánica (Addison-Wesley 1984) p.260 ISBN 0-201-05660-7
- ^ Trummal, Aleksander; Labios, Lauri; Kaljurand, Ivari; Koppel, Ilmar A.; Leito, Ivo (2016). "Acidez de ácidos fuertes en agua y dimetilsulfóxido". J. Física. Química. A . 120 (20): 3663–3669. Código Bib : 2016JPCA..120.3663T. doi : 10.1021/acs.jpca.6b02253. PMID 27115918. S2CID 29697201.
- ^ Bell, RP (1973), El protón en la química (2.ª ed.), Ithaca, NY: Cornell University Press
- ^ abc Housecroft, CE; Sharpe, AG (2004). Química inorgánica (2.ª ed.). Prentice Hall. ISBN 978-0-13-039913-7.
- ^ ab Guthrie, JP (1978). "Hidrolisis de ésteres de oxiácidos: valores de pKa para ácidos fuertes". Can. J. Chem . 56 (17): 2342–2354. doi : 10.1139/v78-385 .
- ^ Martell, AE; Motekaitis, RJ (1992). Determinación y uso de constantes de estabilidad . Wiley. ISBN 0-471-18817-4.Capítulo 4: Procedimiento experimental para la medición potenciométrica del pH en equilibrios de complejos metálicos
- ^ Zhang, Dingliang; Rettig, Stephen J.; Trotter, James; Aubke, Friedhelm (1996). "Aniones superácidos: estructuras cristalinas y moleculares de undecafluorodiantimonato de oxonio (V), [H 3 O][Sb 2 F 11 ], fluorosulfato de cesio, CsSO 3 F, bis(fluorosulfato)hidrógeno de cesio, Cs[H(SO 3 F) 2 ], tetrakis(fluorosulfato)aurato de cesio (III), Cs[Au(SO 3 F) 4 ], hexakis(fluorosulfato)platinato de cesio (IV), Cs 2 [Pt(SO 3 F) 6 ] y hexakis(fluorosulfato)antimoniato de cesio (V), Cs[Sb(SO 3 F) 6 ]". Inorg. Chem . 35 (21): 6113–6130. doi :10.1021/ic960525l.
- ^ George A. Olah , Schlosberg RH (1968). "Química en superácidos. I. Intercambio de hidrógeno y policondensación de metano y alcanos en solución FSO 3 H–SbF 5 ("ácido mágico"). Protonación de alcanos y la intermediación de CH 5 + e iones de hidrocarburos relacionados. La alta reactividad química de las "parafinas" en reacciones de solución iónica". Revista de la Sociedad Química Americana . 90 (10): 2726–7. doi :10.1021/ja01012a066.
- ^ Vogel GC; Drago, RS (1996). "El modelo ECW". Revista de educación química . 73 (8): 701–707. Código Bibliográfico :1996JChEd..73..701V. doi :10.1021/ed073p701.
- ^ Laurence, C. y Gal, JF. Escalas de afinidad y basicidad de Lewis, Datos y medición (Wiley 2010), págs. 50-51 ISBN 978-0-470-74957-9
- ^ Cramer, RE; Bopp, TT (1977). "Visualización gráfica de las entalpías de formación de aductos para ácidos y bases de Lewis". Journal of Chemical Education . 54 : 612–613. doi :10.1021/ed054p612.Los gráficos que se muestran en este artículo utilizan parámetros más antiguos. Los parámetros E&C mejorados se enumeran en el modelo ECW .
Enlaces externos
- Titulación de ácidos: software gratuito para el análisis de datos y simulación de curvas de titulación potenciométrica





















![{\displaystyle {\ce {H[SbF6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81fc97f79d4c3d395f535e093347d7e531a3abdf)
![{\displaystyle {\ce {H[FSO3SbF5]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc571089e72c64e3866cc0dac118eeabe50708a3)
![{\displaystyle {\ce {H[CHB11Cl11]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/90c05caa0a8732d637a5f63affde47aecf5a8030)
![{\displaystyle {\ce {H[FSO3]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bccda1d1c4b551781d4652eb6014aa363ea80da7)


![{\displaystyle {\ce {[H]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/570fdda794ab5f5775dc52489586e624583bbaa7)
![{\displaystyle K_{a}={\frac {[H^{+}][A^{-}]}{[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/83ee86c6746a584bd7b209324db405b0563af917)

![{\displaystyle {\begin{aligned}T_{H}&=[H]+[HA]\\&=[H]+[A][H]/K_{a}\\&=[H]+[H]^{2}/K_{a}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2d1d8921a76226cabb40caf4153fb742226ac0b6)
![{\displaystyle {\frac {[H]^{2}}{K_{a}}}+[H]-T_{H}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3bcbd6b27c9a030ff81364ef6128a3d3af18d630)







