Tropón
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Ciclohepta-2,4,6-trien-1-ona | |||
| Otros nombres Ciclohepta-2,4,6-trienona | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.007.933 | ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C7H6O | |||
| Masa molar | 106,12 g/mol | ||
| Densidad | 1,094 g/ml | ||
| Punto de ebullición | 113 °C (235 °F; 386 K) (15 mmHg) | ||
| Peligros | |||
| punto de inflamabilidad | > 113 °C (235 °F; 386 K) | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
La tropona o 2,4,6-cicloheptatrien-1-ona es un compuesto orgánico con cierta importancia en la química orgánica como un aromático no bencenoide . [2] El compuesto consiste en un anillo de siete átomos de carbono con tres grupos alqueno conjugados y un grupo cetona . El compuesto relacionado tropolona (2-hidroxi-2,4,6-cicloheptatrien-1-ona) tiene un grupo alcohol adicional (o un enol que incluye el doble enlace) junto a la cetona. Las troponas son poco comunes en productos naturales, con la notable excepción de los derivados 2-hidroxilo, que se denominan tropolonas .
La tropone se conoce desde 1951 y también se la denomina óxido de cicloheptatrienilio . El nombre tropolona fue acuñado por MJS Dewar en 1945 en relación con las propiedades aromáticas percibidas. [3]
Propiedades
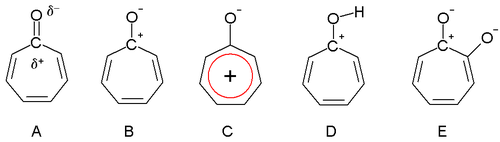
En 1945, Dewar propuso que las troponas podrían tener propiedades aromáticas. El grupo carbonilo está más polarizado como resultado del anillo de trieno, lo que le da una carga positiva parcial al átomo de carbono (A) y una carga negativa parcial al oxígeno. En un caso extremo, el átomo de carbono tiene una carga positiva completa (B) formando un anillo de iones de tropilio que es un sistema aromático de 6 electrones (C).
Las troponas también son básicas (D) como resultado de la estabilización aromática. Esta propiedad se puede observar en la facilidad de formación de sales con ácidos. El momento dipolar de la tropona es 4,17 D en comparación con un valor de solo 3,04 D para la cicloheptanona . Esta diferencia es consistente con la estabilización de la estructura de resonancia dipolar.
Síntesis
Existen numerosos métodos para la síntesis orgánica de troponas y sus derivados. Dos métodos seleccionados para la síntesis de tropona son la oxidación del cicloheptatrieno con dióxido de selenio [4] e indirectamente a partir de tropinona mediante una eliminación de Hofmann y una bromación [2] .
Reacciones
La tropona sufre una contracción del anillo para formar ácido benzoico con hidróxido de potasio a temperatura elevada. Muchos derivados también se contraen para formar los arenos correspondientes . [2] La tropona reacciona en sustitución electrofílica , por ejemplo con bromo , pero la reacción se produce a través del producto de adición 1,2 y no es una sustitución aromática electrofílica . [2]
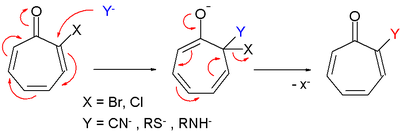
Los derivados de tropona también reaccionan en la sustitución nucleofílica de forma muy similar a la sustitución aromática nucleofílica . [2]
También se ha descubierto que la tropona reacciona en una anulación [8+3] con un aldehído cinámico [5].
Carácter de Diene
La tropona se comporta como un dieno en reacciones de Diels-Alder , por ejemplo con anhídrido maleico . [2] De manera similar, forma aductos con tricarbonilo de hierro, similar al (butadieno)tricarbonilo de hierro . [6]
Derivados
| Nombre | Estructura química | Fuentes naturales |
|---|---|---|
| Tropolona |  | Pseudomonas lindbergii , Pseudomonas plantarii [7] |
| Hinokitiol |  | Árboles cupresáceos [8] |
| Ácido estipitático |  | Talaromyces stipitatus [9] |
| Ácido tropodiético |  | Phaeobacter piscinae , Phaeobacter inhibens , Phaeobacter gallaeciensis [10] [11] |
| Colchicina |  | Colchicum otoñal , Gloriosa superba [12] |
Otros derivados de la tropona incluyen los ácidos puberulónico y puberúlico, los roseobacticidas, la pernambucona, la crototropona y la orobanona. [13] [14] [15] [16] [17]
Referencias
- ^ Tropone en Sigma-Aldrich
- ^ abcdef Pauson, Peter L. (1955). "Tropones y Tropolones". Química. Apocalipsis 55 (1): 9–136. doi :10.1021/cr50001a002.
- ^ MJS Dewar (1945). "Estructura del ácido estipitático". Nature . 155 (3924): 50–51. Código Bibliográfico :1945Natur.155...50D. doi :10.1038/155050b0. S2CID 4086209.
- ^ Dahnke, Karl R.; Paqueta, Leo A. (1993). "Cicloadición inversa de Diels-Alder con demanda de electrones de un ditioacetal ceteno. Reducción promovida por hidruro de cobre de una enona conjugada. 9-ditiolanobiciclo [3.2.2] no-6-en-2-ona". Org. Sintetizador. 71 : 181. doi : 10.15227/orgsyn.071.0181.
- ^ Una anulación catalizada por carbeno N-heterocíclico [8 + 3] de tropone y enals mediante homoenolato Vijay Nair, Manojkumar Poonoth, Sreekumar Vellalath, Eringathodi Suresh y Rajasekaran Thirumalai J. Org. Química. ; 2006 ; 71(23) págs. 8964 - 8965; (Nota) doi :10.1021/jo0615706
- ^ Dodge, RP (1964). "La estructura cristalina y molecular del hierro tricarbonilo de tropone". Revista de la Sociedad Química Americana . 86 (24): 5429–5431. doi :10.1021/ja01078a013.
- ^ Liu, Na; Song, Wangze; Schienebeck, Casi M.; Zhang, Min; Tang, Weiping (diciembre de 2014). "Síntesis de troponas y tropolonas de origen natural". Tetrahedron . 70 (49): 9281–9305. doi :10.1016/j.tet.2014.07.065. PMC 4228802 . PMID 25400298.
- ^ Saniewski, Marian; Horbowicz, Marcin; Kanlayanarat, Sirichai (10 de septiembre de 2014). "Las actividades biológicas de los troponoides y su uso en la agricultura: una revisión". Revista de investigación hortícola . 22 (1): 5–19. doi : 10.2478/johr-2014-0001 .
- ^ Davison, J.; al Fahad, A.; Cai, M.; Song, Z.; Yehia, SY; Lazarus, CM; Bailey, AM; Simpson, TJ; Cox, RJ (15 de mayo de 2012). "Base genética, molecular y bioquímica de la biosíntesis de tropolona fúngica". Actas de la Academia Nacional de Ciencias . 109 (20): 7642–7647. doi : 10.1073/pnas.1201469109 . PMC 3356636 . PMID 22508998.
- ^ Rabe, Patrick; Klapschinski, Tim A; Brock, Nelson L; Citron, Christian A; D'Alvise, Paul; Gram, Lone; Dickschat, Jeroen S (6 de agosto de 2014). "Síntesis y bioactividad de análogos del antibiótico marino ácido tropoditítico". Beilstein Journal of Organic Chemistry . 10 : 1796–1801. doi : 10.3762/bjoc.10.188 . PMC 4142847 . PMID 25161739.
- ^ Beyersmann, Paul G.; Tomasch, Jürgen; Son, Kwangmin; Stocker, Roman; Göker, Markus; Wagner-Döbler, Irene; Simon, Meinhard; Brinkhoff, Thorsten (diciembre de 2017). "Función dual del ácido tropoditítico como antibiótico y molécula de señalización en la regulación génica global de la bacteria probiótica Phaeobacter inhibens". Scientific Reports . 7 (1): 730. Bibcode :2017NatSR...7..730B. doi : 10.1038/s41598-017-00784-7 . PMC 5429656 . PMID 28389641.
- ^ Keith, Michael P.; Gilliland, William R.; Uhl, Kathleen (2009). "GOTA". Farmacología y terapéutica : 1039–1046. doi :10.1016/B978-1-4160-3291-5.50079-2. ISBN 978-1-4160-3291-5.
- ^ Thiel, Verena; Brinkhoff, Thorsten; Dickschat, Jeroen S.; Wickel, Susanne; Grunenberg, Jörg; Wagner-Döbler, Irene; Simon, Meinhard; Schulz, Stefan (10 de diciembre de 2009). "Identificación y biosíntesis de derivados de tropona y volátiles de azufre producidos por bacterias del clado marino Roseobacter". Química orgánica y biomolecular . 8 (1): 234–246. doi :10.1039/B909133E. PMID 20024154.
- ^ Duan, Ying; Petzold, Melanie; Saleem-Batcha, Raspudin; Teufel, Robin (septiembre de 2020). "Productos naturales y derivados de tropones bacterianos: descripción general de su biosíntesis, bioactividades, papel ecológico y potencial biotecnológico". ChemBioChem . 21 (17): 2384–2407. doi : 10.1002/cbic.201900786 . PMC 7497051 . PMID 32239689.
- ^ Randau, KP; Sproll, S.; Lerche, H.; Bracher, F. (1 de mayo de 2009). "Pernambucona, un nuevo derivado de tropona de Croton argyroglossum". Die Pharmazie . 64 (5): 350–351. doi :10.1691/ph.2009.7592. PMID 19530449.
- ^ Bracher, Franz; Randau, Karina P.; Lerche, Holger (1 de abril de 2008). "Crototropone, un nuevo derivado de tropone de Croton zehntneri". Fitoterapia . 79 (3): 236–237. doi :10.1016/j.fitote.2007.12.001. PMID 18321658.
- ^ Fruchier, Alain; Rascol, Jean-Pierre; Andary, Claude; Privatt, Guy (1 de enero de 1981). "Un derivado de tropona de Orobanche rapum-genistae". Fitoquímica . 20 ( 4): 777–779. doi : 10.1016 /0031-9422(81)85173-4.