Catión tropilio
 | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Cicloheptatrienilio [3] | |||
| Otros nombres ciclo - C 7yo+ 7, Ciclohepta-2,4,6-trienilio, [2] [1] Ciclohepta-1,3,5-trieno, [2] 2,4,6-Cicloheptatrienilio [1] | |||
| Identificadores | |||
| |||
Modelo 3D ( JSmol ) |
| ||
| 1902352 [1] | |||
| Araña química |
| ||
Identificador de centro de PubChem |
| ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| do 7yo+ 7[2] | |||
| Masa molar | 91,132 g·mol −1 | ||
| Estructura | |||
| D 7 horas | |||
| heptágono regular | |||
| Compuestos relacionados | |||
Otros aniones | Tetrafluoroborato de tropilio | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
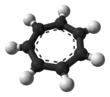
El ion tropilio o catión cicloheptatrienilo es una especie aromática con una fórmula de [C 7 H 7 ] + . [4] Su nombre deriva de la molécula tropina de la cual el cicloheptatrieno (tropilideno) fue sintetizado por primera vez en 1881. Las sales del catión tropilio pueden ser estables, incluso con nucleófilos de fuerza moderada, por ejemplo, tetrafluoroborato de tropilio y bromuro de tropilio ( ver abajo ). Sus sales de bromuro y cloruro [5] pueden estar hechas de cicloheptatrieno y bromo o pentacloruro de fósforo , respectivamente. [6]
Es un ion regular heptagonal , plano y cíclico. Tiene 6 electrones π (4 n + 2, donde n = 1), lo que cumple la regla de aromaticidad de Hückel . Puede coordinarse como ligando a átomos metálicos . La estructura mostrada es un compuesto de siete contribuyentes de resonancia en el que cada átomo de carbono lleva parte de la carga positiva.
Historia
En 1891, G. Merling obtuvo un compuesto que contenía bromo soluble en agua a partir de la reacción de cicloheptatrieno y bromo . [7] A diferencia de la mayoría de los bromuros de alquilo, este compuesto, posteriormente llamado bromuro de tropilio, es soluble en agua pero insoluble en muchos disolventes orgánicos. Se purifica por cristalización en etanol caliente. La reacción con nitrato de plata acuoso dio inmediatamente bromuro de plata, lo que indica bromuro lábil. Se dedujo que el bromuro de tropilio era una sal, C
7yo+
7Es−
, por Doering y Knox en 1954 mediante el análisis de sus espectros infrarrojo y ultravioleta. [8] [9] Las estructuras iónicas del perclorato de tropilio ( C
7yo+
7ClO−
4) y yoduro de tropilio ( C
7yo+
7I−
) se han confirmado mediante cristalografía de rayos X. [10] La longitud de enlace de los enlaces carbono-carbono es más larga (147 pm) que la del benceno (140 pm), pero aún más corta que la de una especie típica de enlace simple como el etano (154 pm).
Acidez
El ion tropilio es un ácido en solución acuosa (es decir, un ácido de Arrhenius ) como consecuencia de su acidez de Lewis: primero actúa como un ácido de Lewis para formar un aducto con agua, que luego puede donar un protón a otra molécula de agua, actuando así indirectamente como un ácido de Arrhenius:
- do
7yo+
7+ 2 horas
2O ⇌ C
7yo
7OH + H
3Oh+
( El ácido bórico produce soluciones acuosas ácidas de manera muy similar). La constante de equilibrio es1,8 × 10 −5 , lo que lo hace tan ácido en agua como el ácido acético . [8]
Espectrometría de masas
El ion tropilio se encuentra frecuentemente en la espectrometría de masas en forma de una señal en m / z = 91 y se utiliza en el análisis del espectro de masas . Este fragmento se encuentra a menudo en compuestos aromáticos que contienen una unidad bencílica. Tras la ionización , el fragmento bencílico forma un catión ( PhCH+
2), que se reorganiza en el catión tropilio altamente estable ( C
7yo+
7). [11]
Reacciones
El catión tropilio reacciona con nucleófilos para formar cicloheptatrienos sustituidos, por ejemplo: [12]
- do
7yo+
7+ CN−
→ C
7yo
7CN
La reducción con hidruro de litio y aluminio produce cicloheptatrieno . [12]
La reacción con una sal de ciclopentadienuro de sodio o litio produce 7-ciclopentadienilciclohepta-1,3,5-trieno : [12]
- do
7yo+
7incógnita−
+ C
5yo−
5N / A+
→ C
7yo
7do
5yo
5+ NaX
Cuando se trata con agentes oxidantes como el ácido crómico , el catión tropilio sufre una reorganización en benzaldehído : [12]
- do
7yo+
7+ HCrO−
4→ C
6yo
5CHO + CrO
2+ H
2Oh
Se conocen muchos complejos metálicos de ion tropilio. Un ejemplo es [Mo( η 7 -C 7 H 7 )(CO) 3 ] + , que se prepara mediante abstracción de hidruro a partir de cicloheptatrienomolibdeno tricarbonilo . [13]
Véase también
Referencias
- ^ abcdefg "tropylium | ChemSpider". www.chemspider.com . p. Nombres . Consultado el 30 de diciembre de 2018 .
tropylium
- ^ abcdef "Tropylium". pubchem.ncbi.nlm.nih.gov . Consultado el 30 de diciembre de 2018 .
Nombres químicos: Tropylium; Cicloheptatrienilio; Cyc-
C
7yo+
7; Ciclohepta-2,4,6-trienilio - ^ Unión Internacional de Química Pura y Aplicada (2014). Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013. The Royal Society of Chemistry . p. 1127. doi :10.1039/9781849733069. ISBN . 978-0-85404-182-4.
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "molécula". doi :10.1351/goldbook.M04002
- ^ Una mezcla de [C 7 H 7 ] + Cl − y [C 7 H 7 ] + [ PCl−
6] se produce mediante el tratamiento de tropilideno con pentacloruro de fósforo. - ^ Tropylium fluoborate Organic Syntheses, Coll. Vol. 5, p.1138 (1973); Vol. 43, p.101 (1963). enlace Archivado el 29 de agosto de 2012 en Wayback Machine .
- ^ Merling, G. (1891). "Ueber Tropin". Berichte der Deutschen Chemischen Gesellschaft . 24 (2): 3108–3126. doi :10.1002/cber.189102402151.
- ^ por Eggers Doering, W. von; Knox, LH (1954). "El ion cicloheptatrienilio (tropilio)". J. Am. Chem. Soc . 76 (12): 3203–3206. doi :10.1021/ja01641a027.
- ^ Balaban, Alexandru T.; Oniciu, Daniela C.; Katritzky, Alan R. (2004). "La aromaticidad como piedra angular de la química heterocíclica". Chem. Rev. 104 ( 5): 2777–2812. doi :10.1021/cr0306790. PMID 15137807.
- ^ Kitaigorodskii, AI; Struchkov, Yu. T.; Khotsyanova, TL; Vol'pin, ME; Kursanov, DN (1960). "Estructuras cristalinas del perclorato y el yoduro de tropilio". Boletín de la Academia de Ciencias de la URSS División de Ciencias Químicas . 9 (1): 32–36. doi :10.1007/bf01178699. ISSN 0568-5230.
- ^ Lifshitz, Chava (1994). "Formación de iones de tropilio a partir de tolueno: solución de un viejo problema en espectrometría de masas orgánica". Accounts of Chemical Research . 27 (5): 138–144. doi :10.1021/ar00041a004.
- ^ abcd OP Agarwai (2009). Reacciones y reactivos (46ª ed.). Medios de Krishna Prakashan. págs. 614–615. ISBN 978-81-87224-65-5.
- ^ Green, Malcolm LH; Ng, Dennis KP (1995). "Complejos de cicloheptatrieno y -enilo de los metales de transición tempranos". Chemical Reviews . 95 (2): 439–473. doi :10.1021/cr00034a006.