Temozolomida
 | |
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Temodar, Temodal, Temcad, otros [1] |
| Otros nombres | TMZ |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a601250 |
| Datos de licencia | |
Categoría de embarazo |
|
| Vías de administración | Por vía oral , intravenosa |
| Código ATC |
|
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | casi 100% |
| Unión de proteínas | 15% (10–20%) |
| Metabolismo | hidrólisis |
| Metabolitos | 3-metil-(triazen-1-il)imidazol-4-carboxamida (MTIC, la especie activa ); ácido temozolomida |
| Vida media de eliminación | 1,8 horas |
| Excreción | principalmente riñón |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.158.652 |
| Datos químicos y físicos | |
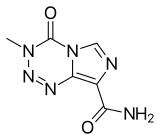
| Fórmula | C6H6N6O2 |
| Masa molar | 194,154 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| Punto de fusión | 212 °C (414 °F) (descomp.) |
| |
 norte norte Y (¿que es esto?) (verificar) Y (¿que es esto?) (verificar) | |
La temozolomida , que se vende bajo la marca Temodar , entre otras, es un medicamento contra el cáncer que se utiliza para tratar tumores cerebrales como el glioblastoma y el astrocitoma anaplásico . [4] [5] Se toma por vía oral o mediante infusión intravenosa. [4] [5]
Los efectos secundarios más comunes de la temozolomida son náuseas , vómitos , estreñimiento , pérdida de apetito , alopecia (pérdida de cabello), dolor de cabeza , fatiga , convulsiones , sarpullido , neutropenia o linfopenia (recuento bajo de glóbulos blancos) y trombocitopenia (recuento bajo de plaquetas en sangre). [5] Las personas que reciben la solución para infusión también pueden tener reacciones en el lugar de la inyección, como dolor, irritación, picazón, calor, hinchazón y enrojecimiento, así como hematomas. [5]
La temozolomida es un agente alquilante utilizado para tratar cánceres cerebrales graves; más comúnmente como tratamiento de segunda línea para astrocitoma y como tratamiento de primera línea para glioblastoma. [4] [6] [7] Olaparib en combinación con temozolomida demostró una actividad clínica sustancial en el cáncer de pulmón de células pequeñas recidivante . [8] Está disponible como medicamento genérico .
Usos médicos
En los Estados Unidos, la temozolomida está indicada para el tratamiento de adultos con glioblastoma recién diagnosticado concomitantemente con radioterapia y posteriormente como tratamiento de monoterapia; [4] [9] o adultos con astrocitoma anaplásico recién diagnosticado o refractario. [4] [9]
En la Unión Europea, la temozolomida está indicada para adultos con glioblastoma multiforme de nuevo diagnóstico concomitantemente con radioterapia y posteriormente como tratamiento en monoterapia; [5] [6] o niños a partir de los tres años, adolescentes y adultos con glioma maligno, como glioblastoma multiforme o astrocitoma anaplásico, que muestren recurrencia o progresión después de la terapia estándar. [5] [6]
La temozolomida también se utiliza para tratar tumores pituitarios agresivos y cáncer de pituitaria. [10]
Contraindicaciones
La temozolomida está contraindicada en personas con hipersensibilidad a ésta o al fármaco similar dacarbazina . [11]
Efectos adversos
Los efectos secundarios más comunes incluyen náuseas, vómitos, estreñimiento, pérdida de apetito, alopecia (pérdida de cabello), dolor de cabeza, fatiga (cansancio), convulsiones, sarpullido, neutropenia o linfopenia (recuento bajo de glóbulos blancos) y trombocitopenia (recuento bajo de plaquetas). [5] Las personas que reciben la solución para infusión también pueden tener reacciones en el lugar de la inyección, como dolor, irritación, picazón, calor, hinchazón y enrojecimiento, así como hematomas. [5]
Interacciones
La combinación de temozolomida con otros mielosupresores puede aumentar el riesgo de mielosupresión. [11]
Farmacología
Mecanismo de acción
El beneficio terapéutico de la temozolomida depende de su capacidad para alquilar / metilar el ADN, lo que ocurre con mayor frecuencia en las posiciones N-7 u O-6 de los residuos de guanina . [12] [ cita médica necesaria ] Esta metilación daña el ADN y desencadena la muerte de las células tumorales. [13] [ cita médica necesaria ] Sin embargo, algunas células tumorales pueden reparar este tipo de daño en el ADN y, por lo tanto, disminuir la eficacia terapéutica de la temozolomida, al expresar una proteína O 6 -alquilguanina ADN alquiltransferasa (AGT) codificada en humanos por el gen O -6-metilguanina-ADN metiltransferasa ( MGMT ). [14] En algunos tumores, el silenciamiento epigenético del gen MGMT impide la síntesis de esta enzima y, como consecuencia, dichos tumores son más sensibles a la muerte por temozolomida. [15] Por el contrario, la presencia de proteína AGT en tumores cerebrales predice una respuesta deficiente a la temozolomida y estos pacientes reciben poco beneficio de la quimioterapia con temozolomida. [16]
Farmacocinética
La temozolomida se absorbe rápidamente y casi por completo en el intestino, y penetra fácilmente la barrera hematoencefálica ; la concentración en el líquido cefalorraquídeo es el 30% de la concentración en el plasma sanguíneo . [ cita médica necesaria ] La ingesta con alimentos disminuye las concentraciones plasmáticas máximas en un 33% y el área bajo la curva en un 9%. [ cita médica necesaria ] Solo el 15% (10-20%) de la sustancia se une a las proteínas del plasma sanguíneo. [ cita médica necesaria ] La temozolomida es un profármaco ; se hidroliza espontáneamente a pH fisiológico a 3-metil-(triazen-1-il)imidazol-4-carboxamida (MTIC), que luego se divide en monometilhidrazina , probablemente el agente metilante activo, y 5-aminoimidazol-4-carboxamida (AIC). [ cita médica necesaria ] Otros metabolitos incluyen ácido temozolomida y sustancias hidrófilas no identificadas. [ 11 ]
La vida media plasmática es de 1,8 horas. [ cita médica necesaria ] La sustancia y sus metabolitos se excretan principalmente a través de la orina. [11]
- MTIC, el metabolito activo
- AIC (parte del ribonucleótido AICA de origen natural )
- El fármaco relacionado dacarbazina [17] para comparación
Propiedades químicas
La temozolomida es un derivado de la imidazotetrazina. [17] Es ligeramente soluble en agua y ácidos acuosos, [18] y se descompone a 212 °C (414 °F). [19] Recientemente se descubrió que la temozolomida es un explosivo, asignado provisionalmente como Clase 1 de las Naciones Unidas . [20] [21]
También se ha informado que la temozolomida es una fuente in situ relativamente segura y estable de diazometano en síntesis orgánica. [ cita requerida ] En particular, se ha demostrado su uso como reactivo metilante y ciclopropanante . [22]
Historia
El agente fue descubierto en la Universidad de Aston en Birmingham, Inglaterra . Su actividad preclínica se informó en 1987. [17] [23] [24]
Fue aprobado para uso médico en la Unión Europea en enero de 1999, [5] y en los Estados Unidos en agosto de 1999. [25] La formulación intravenosa fue aprobada en los Estados Unidos en febrero de 2009. [26]
Investigación
Estudios de laboratorio y ensayos clínicos han comenzado a investigar la posibilidad de aumentar la potencia anticancerígena de la temozolomida al combinarla con otros agentes farmacológicos. Por ejemplo, los ensayos clínicos han indicado que la adición de cloroquina podría ser beneficiosa para el tratamiento de pacientes con glioma . [27] Los estudios de laboratorio encontraron que la temozolomida mató las células tumorales cerebrales de manera más eficiente cuando se agregó galato de epigalocatequina ( EGCG ), un componente del té verde ; sin embargo, la eficacia de este efecto aún no se ha confirmado en pacientes con tumores cerebrales . [28] Los estudios preclínicos informados en 2010 sobre investigaciones sobre el uso del nuevo compuesto que mejora la difusión de oxígeno, crocetinato de sodio trans (TSC), cuando se combina con temozolomida y radioterapia [29] y un ensayo clínico estaba en marcha en agosto de 2015. [actualizar][ 30]
Si bien los enfoques mencionados anteriormente han investigado si la combinación de temozolomida con otros agentes podría mejorar el resultado terapéutico, también se han iniciado esfuerzos para estudiar si alterar la molécula de temozolomida en sí puede aumentar su actividad. Uno de esos enfoques fusionó permanentemente el alcohol perílico , un compuesto natural con actividad terapéutica demostrada en pacientes con cáncer cerebral, [31] a la molécula de temozolomida. El nuevo compuesto resultante, llamado NEO212 o TMZ-POH, reveló una actividad anticancerígena que fue significativamente mayor que la de cualquiera de sus dos moléculas parentales, temozolomida y alcohol perílico. Aunque hasta 2016 [actualizar], NEO212 no se ha probado en humanos, ha demostrado una actividad terapéutica superior contra el cáncer en modelos animales de glioma , [32] melanoma , [33] y metástasis cerebral de cáncer de mama triple negativo . [34]
Debido a que las células tumorales que expresan el gen de la O-6-metilguanina-ADN metiltransferasa (MGMT) son más resistentes a los efectos de la temozolomida, los investigadores investigaron si la inclusión de O 6 -bencilguanina ( O 6 -BG), un inhibidor de la AGT, podría superar esta resistencia y mejorar la eficacia terapéutica del fármaco. En el laboratorio, esta combinación de hecho mostró una mayor actividad de la temozolomida en cultivos de células tumorales in vitro y en modelos animales in vivo . [35] Sin embargo, un ensayo clínico de fase II completado recientemente [ ¿período de tiempo? ] con pacientes con tumores cerebrales arrojó resultados mixtos; si bien hubo cierta actividad terapéutica mejorada cuando se administraron O 6 -BG y temozolomida a pacientes con glioma anaplásico resistente a la temozolomida , no pareció haber una restauración significativa de la sensibilidad a la temozolomida en pacientes con glioblastoma multiforme resistente a la temozolomida . [36]
Algunos esfuerzos se centran en diseñar células madre hematopoyéticas que expresen el gen MGMT antes de trasplantarlas a pacientes con tumores cerebrales. Esto permitiría que los pacientes recibieran dosis más fuertes de temozolomida, ya que las células hematopoyéticas del paciente serían resistentes al fármaco. [37]
Las dosis altas de temozolomida en gliomas de alto grado tienen baja toxicidad, pero los resultados son comparables a las dosis estándar. [38]
Se han descrito dos mecanismos de resistencia a los efectos de la temozolomida: 1) resistencia intrínseca conferida por deficiencia de MGMT (MGMTd) y 2) resistencia intrínseca o adquirida a través de deficiencia de MMR (MMRd). La enzima MGMT es la primera línea de reparación de bases desapareadas creadas por la temozolomida. Las células normalmente son competentes en MGMT (MGMTp) ya que tienen un promotor MGMT no metilado que permite que el gen se exprese normalmente. En este estado, el daño del ADN inducido por temozolomida puede ser reparado eficientemente en células tumorales (y células normales) por la enzima MGMT activa. Las células pueden crecer y pasar por el ciclo celular normalmente sin detenerse o morir. Sin embargo, algunas células tumorales son deficientes en MGMT (MGMTd). Esto se debe más comúnmente a la metilación anormal del promotor del gen MGMT y la supresión de la expresión génica. También se ha descrito que la MGMTd ocurre por reordenamiento del promotor. En las células con MGMTd, el daño del ADN causado por la temozolomida activa la siguiente etapa de reparación en las células con un complejo enzimático de reparación de desajustes (MMRp) competente. En el caso de la MMRp, el complejo proteico MMR identifica el daño y hace que las células se detengan y mueran, lo que inhibe el crecimiento del tumor. Sin embargo, si las células tienen una deficiencia combinada de MGMTd y MMR (MGMTd + MMRd), las células conservan las mutaciones inducidas y continúan con su ciclo, además de ser resistentes a los efectos de la temozolomida. [ cita médica necesaria ]
En los gliomas y otros tipos de cáncer, se ha informado que la MMRd se presenta como MMRd primaria (bMMRd de Lynch intrínseca o germinal) o como MMRd secundaria (adquirida, no presente en el tumor original no tratado). Esta última ocurre después del tratamiento eficaz y la citorreducción de tumores con temozolomida y luego la selección o inducción de proteínas y células mutantes MSH6, MSH2, MLH1 o PMS2 que son resistentes a la MMRd y a la temozolomida. Esta última se describe como una vía de resistencia adquirida con mutaciones de puntos calientes en pacientes con glioma (MSH6 p.T1219I). [39]
Referencias
- ^ "Temozolomida". Drugs.com . 4 de mayo de 2020. Archivado desde el original el 29 de agosto de 2021 . Consultado el 7 de mayo de 2020 .
- ^ "Lista de todos los medicamentos con advertencias de recuadro negro obtenida por la FDA (use los enlaces Descargar resultados completos y Ver consulta)". nctr-crs.fda.gov . FDA . Consultado el 22 de octubre de 2023 .
- ^ "Cápsulas de Temodal - Resumen de las Características del Producto (RCP)". (emc) . 24 de octubre de 2019. Archivado desde el original el 20 de septiembre de 2020 . Consultado el 7 de mayo de 2020 .
- ^ abcdef «Cápsula de temozolomida Temodar- temozolomida inyectable, polvo liofilizado para solución». DailyMed . 31 de enero de 2020. Archivado desde el original el 8 de abril de 2021 . Consultado el 7 de mayo de 2020 .
- ^ abcdefghij «Temodal EPAR». Agencia Europea de Medicamentos (EMA) . 17 de septiembre de 2018. Archivado desde el original el 22 de octubre de 2020. Consultado el 7 de mayo de 2020 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ abc "Guía sobre el uso de temozolomida para el tratamiento del glioma maligno recurrente (cáncer cerebral)" (PDF) . 3 de marzo de 2016. Archivado desde el original el 11 de julio de 2021 . Consultado el 7 de mayo de 2020 .
- ^ Sasmita AO, Wong YP, Ling AP (febrero de 2018). "Biomarcadores y avances terapéuticos en el glioblastoma multiforme". Revista de Oncología Clínica de Asia y el Pacífico . 14 (1): 40–51. doi : 10.1111/ajco.12756 . PMID 28840962.
- ^ Farago AF, Yeap BY, Stanzione M, Hung YP, Heist RS, Marcoux JP, et al. (octubre de 2019). "Combinación de olaparib y temozolomida en el cáncer de pulmón de células pequeñas recidivante". Cancer Discovery . 9 (10): 1372–1387. doi : 10.1158/2159-8290.CD-19-0582 . PMC 7319046 . PMID 31416802.
- ^ ab "La FDA aprueba indicaciones nuevas y actualizadas para la temozolomida en virtud del Proyecto". Administración de Alimentos y Medicamentos de Estados Unidos . 14 de septiembre de 2023. Archivado desde el original el 15 de septiembre de 2023. Consultado el 14 de septiembre de 2023 .
- ^ Raverot G, Burman P, McCormack A, Heaney A, Petersenn S, Popovic V, et al. (enero de 2018). "Pautas de práctica clínica de la Sociedad Europea de Endocrinología para el tratamiento de tumores y carcinomas pituitarios agresivos". Revista Europea de Endocrinología . 178 (1): G1–G24. doi : 10.1530/EJE-17-0796 . PMID 29046323.
- ^ abcd Austria-Codex (en alemán). Viena: Österreichischer Apothekerverlag. 2018. Temodal 5 mg-Hartkapseln.
- ^ Fu D, Calvo JA, Samson LD (enero de 2012). "Equilibrio entre la reparación y la tolerancia del daño del ADN causado por agentes alquilantes". Nature Reviews. Cancer . 12 (2): 104–120. doi :10.1038/nrc3185. PMC 3586545 . PMID 22237395.
- ^ Li Z, Pearlman AH, Hsieh P (febrero de 2016). "Reparación de errores de emparejamiento del ADN y respuesta al daño del ADN". Reparación del ADN . 38 : 94–101. doi :10.1016/j.dnarep.2015.11.019. PMC 4740233 . PMID 26704428.
- ^ Jacinto FV, Esteller M (agosto de 2007). "Hipermetilación de MGMT: un enemigo del pronóstico, un amigo predictivo". Reparación del ADN . 6 (8): 1155–1160. doi :10.1016/j.dnarep.2007.03.013. PMID 17482895.
- ^ Hegi ME, Diserens AC, Gorlia T, Hamou MF, de Tribolet N, Weller M, et al. (marzo de 2005). "Silenciamiento del gen MGMT y beneficio de la temozolomida en el glioblastoma". The New England Journal of Medicine . 352 (10): 997–1003. doi : 10.1056/NEJMoa043331 . PMID 15758010. Archivado desde el original el 26 de abril de 2019. Consultado el 9 de abril de 2022 .
- ^ Stupp R, Hegi ME, Mason WP, van den Bent MJ, Taphoorn MJ, Janzer RC, et al. (mayo de 2009). "Efectos de la radioterapia con temozolomida concomitante y adyuvante frente a la radioterapia sola sobre la supervivencia en el glioblastoma en un estudio de fase III aleatorizado: análisis de 5 años del ensayo EORTC-NCIC". The Lancet. Oncología . 10 (5): 459–466. doi :10.1016/S1470-2045(09)70025-7. PMID 19269895. S2CID 25150249.
- ^ abc Sansom C (julio de 2009). «Temozolomida: el nacimiento de un gran éxito» (PDF) . Chemistry World : 48–51. Archivado (PDF) del original el 22 de octubre de 2020. Consultado el 28 de junio de 2015 .
- ^ "Temodal: EPAR – Discusión científica" (PDF) . Agencia Europea de Medicamentos . 13 de diciembre de 2005. Archivado (PDF) del original el 29 de agosto de 2021 . Consultado el 25 de abril de 2019 .
- ^ Dinnendahl, V, Fricke, U, eds. (2016). Perfil Arzneistoff (en alemán). vol. 9 (29 ed.). Eschborn, Alemania: Govi Pharmazeutischer Verlag. ISBN 978-3-7741-9846-3.
- ^ Sperry JB, Stone S, Azuma M, Barrett C (2021). "Importancia de los datos de estabilidad térmica para evitar reactivos peligrosos: estudio de caso de temozolomida". Investigación y desarrollo de procesos orgánicos . 25 (7): 1690–1700. doi :10.1021/acs.oprd.1c00206. S2CID 237644612.
- ^ Lowe D (12 de julio de 2021). «La temozolomida es explosiva». Science (Blog). Archivado desde el original el 4 de junio de 2022. Consultado el 30 de junio de 2022 .
- ^ Svec RL, Hergenrother PJ (enero de 2020). "Imidazotetrazinas como sustitutos de diazometano ponderables para esterificaciones y ciclopropanaciones". Angewandte Chemie . 59 (5): 1857–1862. doi :10.1002/anie.201911896. PMC 6982548 . PMID 31793158.
- ^ "Malcolm Steven – entrevista". Página de impacto y logros de Cancer Research UK . 22 de agosto de 2013. Archivado desde el original el 14 de marzo de 2012.
- ^ Newlands ES, Stevens MF, Wedge SR, Wheelhouse RT, Brock C (enero de 1997). "Temozolomida: una revisión de su descubrimiento, propiedades químicas, desarrollo preclínico y ensayos clínicos". Cancer Treatment Reviews . 23 (1): 35–61. doi :10.1016/S0305-7372(97)90019-0. PMID 9189180.
- ^ "Paquete de aprobación de medicamentos: Temodar (Temozolomida) NDA# 021029". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 30 de marzo de 2001. Archivado desde el original el 31 de marzo de 2021. Consultado el 7 de mayo de 2020 .
- ^ "Paquete de aprobación de medicamentos: Temodar NDA #022277". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 24 de noviembre de 2009. Archivado desde el original el 28 de marzo de 2021. Consultado el 7 de mayo de 2020 .
- ^ Gilbert MR (marzo de 2006). "Nuevos tratamientos para los gliomas malignos: se requiere una evaluación cuidadosa y un optimismo cauteloso". Annals of Internal Medicine . 144 (5): 371–373. doi :10.7326/0003-4819-144-5-200603070-00015. PMID 16520480. S2CID 21181702.
- ^ Pyrko P, Schönthal AH, Hofman FM, Chen TC, Lee AS (octubre de 2007). "El regulador de respuesta a proteínas desplegadas GRP78/BiP como un nuevo objetivo para aumentar la quimiosensibilidad en gliomas malignos". Cancer Research . 67 (20): 9809–9816. doi :10.1158/0008-5472.CAN-07-0625. PMID 17942911.
- ^ Sheehan J, Cifarelli CP, Dassoulas K, Olson C, Rainey J, Han S (agosto de 2010). "El crocetinato transsódico mejora la supervivencia y la respuesta del glioma en la resonancia magnética a la radiación y la temozolomida". Journal of Neurosurgery . 113 (2): 234–239. doi : 10.3171/2009.11.JNS091314 . PMID 20001586.
- ^ "Estudio de seguridad y eficacia del crocetinato de sodio trans (TSC) con radioterapia concomitante y temozolomida en el glioblastoma (GBM) de diagnóstico reciente". ClinicalTrials.gov . Noviembre de 2011. Archivado desde el original el 21 de octubre de 2014 . Consultado el 1 de febrero de 2016 .
- ^ Da Fonseca CO, Teixeira RM, Silva JC, Fischer JD, Meirelles OC, Landeiro JA, et al. (diciembre de 2013). "Resultados a largo plazo en pacientes con glioma maligno recurrente tratados con inhalación de alcohol perilílico". Anticancer Research . 33 (12): 5625–5631. PMID 24324108.
- ^ Cho HY, Wang W, Jhaveri N, Lee DJ, Sharma N, Dubeau L, et al. (agosto de 2014). "NEO212, temozolomida conjugada con alcohol perílico, es un fármaco novedoso para el tratamiento eficaz de una amplia gama de gliomas resistentes a la temozolomida". Molecular Cancer Therapeutics . 13 (8): 2004–2017. doi : 10.1158/1535-7163.mct-13-0964 . PMID 24994771.
- ^ Chen TC, Cho HY, Wang W, Nguyen J, Jhaveri N, Rosenstein-Sisson R, et al. (marzo de 2015). "Un nuevo análogo de temozolomida, NEO212, con actividad mejorada contra el melanoma MGMT-positivo in vitro e in vivo". Cancer Letters . 358 (2): 144–151. doi :10.1016/j.canlet.2014.12.021. PMID 25524552.
- ^ Chen TC, Cho HY, Wang W, Barath M, Sharma N, Hofman FM, et al. (mayo de 2014). "Un nuevo conjugado de temozolomida-alcohol perílico exhibe una actividad superior contra las células de cáncer de mama in vitro y el crecimiento tumoral triple negativo intracraneal in vivo". Molecular Cancer Therapeutics . 13 (5): 1181–1193. doi : 10.1158/1535-7163.mct-13-0882 . PMID 24623736.
- ^ Ueno T, Ko SH, Grubbs E, Yoshimoto Y, Augustine C, Abdel-Wahab Z, et al. (marzo de 2006). "Modulación de la resistencia a la quimioterapia en la terapia regional: un nuevo enfoque terapéutico para el melanoma avanzado de las extremidades utilizando temozolomida intraarterial en combinación con O6-bencilguanina sistémica". Molecular Cancer Therapeutics . 5 (3): 732–738. doi :10.1158/1535-7163.MCT-05-0098. PMID 16546988. S2CID 14455128.
- ^ Quinn JA, Jiang SX, Reardon DA, Desjardins A, Vredenburgh JJ, Rich JN, et al. (marzo de 2009). "Ensayo de fase II de temozolomida más o6-bencilguanina en adultos con glioma maligno recurrente resistente a la temozolomida". Journal of Clinical Oncology . 27 (8): 1262–1267. doi :10.1200/JCO.2008.18.8417. PMC 2667825 . PMID 19204199.
- ^ "Investigative Engineered Bone Marrow Cell Therapy". Centro de Investigación del Cáncer Fred Hutchinson. 23 de mayo de 2011. Archivado desde el original el 29 de noviembre de 2020. Consultado el 27 de junio de 2018 .
- ^ Dall'oglio S, D'Amico A, Pioli F, Gabbani M, Pasini F, Passarin MG, et al. (diciembre de 2008). "Intensidad de la dosis de temozolomida después de la quimiorradioterapia concurrente en gliomas de alto grado operados". Journal of Neuro-Oncology . 90 (3): 315–319. doi :10.1007/s11060-008-9663-9. PMID 18688571. S2CID 21517366.
- ^ Touat M, Li YY, Boynton AN, Spurr LF, Iorgulescu JB, Bohrson CL, et al. (abril de 2020). "Mecanismos e implicaciones terapéuticas de la hipermutación en gliomas". Nature . 580 (7804): 517–523. Bibcode :2020Natur.580..517T. doi :10.1038/s41586-020-2209-9. PMC 8235024 . PMID 32322066.
Lectura adicional
- Kaloshi G, Benouaich-Amiel A, Diakite F, Taillibert S, Lejeune J, Laigle-Donadey F, et al. (mayo de 2007). "Temozolomida para gliomas de bajo grado: impacto predictivo de la pérdida de 1p/19q en la respuesta y el resultado". Neurología . 68 (21): 1831–1836. doi : 10.1212/01.wnl.0000262034.26310.a2 . PMID 17515545.
Enlaces externos
- "Temozolomida (Temodal)". Cancer Research UK .
- "Temozolomida". Diccionario de cáncer del NCI . Instituto Nacional del Cáncer.
- "Temozolomida". Instituto Nacional del Cáncer . 5 de octubre de 2006.


![El fármaco relacionado dacarbazina[17] para comparación](http://upload.wikimedia.org/wikipedia/commons/thumb/1/11/Dacarbazine.svg/120px-Dacarbazine.svg.png)
