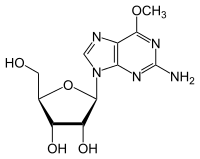
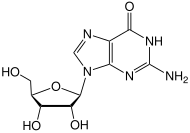
Metiltransferasa de proteína cisteína de ADN metilado
| GESTIÓN | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | MGMT , Mgmt, AGT, AI267024, Agat, O-6-metilguanina-ADN metiltransferasa | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 156569; MGI : 96977; HomoloGene : 31089; GeneCards : MGMT; OMA : MGMT - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Número CE | 2.1.1.63 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
La metiltransferasa de ADN-proteína-cisteína metilada (MGMT) , también conocida como O 6 -alquilguanina ADN alquiltransferasa AGT , es una proteína que en los humanos está codificada por el gen MGMT . [5] [6] La MGMT es crucial para la estabilidad del genoma. Repara la lesión mutagénica natural del ADN O 6 -metilguanina a guanina y previene el desajuste y los errores durante la replicación y transcripción del ADN . En consecuencia, la pérdida de MGMT aumenta el riesgo carcinogénico en ratones después de la exposición a agentes alquilantes . [7] Las dos isoenzimas bacterianas son Ada y Ogt .
Función y mecanismo
| ' O 6 -alquilguanina ADN alquiltransferasa' | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| N.º CE | 2.1.1.63 | ||||||||
| N.º CAS | 77271-19-3 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| |||||||||
Aunque los mutágenos alquilantes modifican preferentemente la base guanina en la posición N7, la O 6 -alquil-guanina es una lesión cancerígena importante en el ADN . Este aducto de ADN es eliminado por la proteína reparadora O 6 -alquilguanina ADN alquiltransferasa a través de un mecanismo S N 2 . Esta proteína no es una enzima verdadera ya que elimina el grupo alquilo de la lesión en una reacción estequiométrica y la enzima activa no se regenera después de ser alquilada (conocida como enzima suicida ). El residuo aceptor de metilo en la proteína es una cisteína . [8]
- Desmetilación de 6-O-metilguanosina a guanosina
Importancia clínica
En pacientes con glioblastoma , un tipo grave de tumor cerebral, el medicamento contra el cáncer temozolomida es más eficaz en aquellos con una metilación del promotor del gen . [9] En general, la metilación de MGMT se asocia con una supervivencia prolongada del paciente en los modelos de predicción clínica. [10] Para probar el estado de metilación del promotor de MGMT en el entorno clínico, se prefieren los métodos basados en ADN, como la reacción en cadena de la polimerasa específica de metilación (MS-PCR) o la pirosecuenciación, sobre los ensayos inmunohistoquímicos o basados en ARN. [11]
En pacientes con tumores hipofisarios, la MGMT puede predecir la respuesta clínica y radiológica al tratamiento con temozolomida. En este contexto, el estado de la MGMT se evalúa de forma óptima mediante inmunohistoquímica, y se espera que los tumores con depleción de MGMT demuestren una respuesta. [12] El estado de metilación del promotor (de la MGMT) no predice la respuesta a la temozolomida porque, en los tumores hipofisarios, el promotor casi siempre no está metilado. [13]
También se ha demostrado que la MGMT es una herramienta útil para aumentar la eficacia de la terapia génica. Al utilizar un vector de dos componentes que consiste en un transgén de interés y MGMT , se puede utilizar la selección de fármacos in vivo para seleccionar células transducidas con éxito. [14]
Los mutágenos en el medio ambiente [15] , en el humo del tabaco [16] , en los alimentos [17] , así como los productos metabólicos endógenos [18] generan especies electrofílicas reactivas que alquilan o metilan específicamente el ADN, generando 6-O-metilguanina (m6G).
En 1985, Yarosh resumió los primeros trabajos que establecieron que la m6G era la base alquilada del ADN más mutagénica y cancerígena. [19] En 1994, Rasouli-Nia et al. [20] demostraron que se inducía aproximadamente una mutación por cada ocho m6G no reparadas en el ADN. Las mutaciones pueden provocar la progresión al cáncer mediante un proceso de selección natural. [ cita requerida ]
Expresión en el cáncer
| Tipo de cáncer | Frecuencia de deficiencia en el cáncer | Frecuencia de deficiencia en defecto de campo adyacente |
|---|---|---|
| Cervical [21] | 61% | 39% |
| Colorrectal | 40%-90% [22] [23] [24] [25] [26] | 11%-34% [22] [23] |
| Colorrectal con inestabilidad de microsatélites [27] | 70% | 60% |
| Adenocarcinoma de esófago | 71%-79% [28] [29] | 89% [29] |
| Carcinoma de células escamosas del esófago | 38%-96% [28] [30] [31] | 65% [31] |
| Glioblastoma por metilación del promotor | 44%-59% [32] [33] | |
| Carcinoma de células escamosas de cabeza y cuello | 54% [34] | |
| Carcinoma hepatocelular (asociado al virus de la hepatitis C) [35] | 68% | 65% |
| Laringe | 54%-61% [36] [37] | 38% [37] |
| Estómago | 32%-88% [38] [39] | 17%-78% [38] [39] |
| Tiroides [40] | 87% |
Represión epigenética
Solo una minoría de los cánceres esporádicos con deficiencia en la reparación del ADN tienen una mutación en un gen de reparación del ADN. Sin embargo, la mayoría de los cánceres esporádicos con deficiencia en la reparación del ADN tienen una o más alteraciones epigenéticas que reducen o silencian la expresión del gen de reparación del ADN. Por ejemplo, en un estudio de 113 cánceres colorrectales secuenciales, solo cuatro tenían una mutación sin sentido en el gen de reparación del ADN MGMT , mientras que la mayoría tenía una expresión reducida de MGMT debido a la metilación de la región promotora de MGMT (una alteración epigenética ). [41]
La MGMT puede ser reprimida epigenéticamente de varias maneras. [42] Cuando la expresión de MGMT se reprime en los cánceres, esto se debe a menudo a la metilación de su región promotora. [42] Sin embargo, la expresión también puede ser reprimida por la dimetilación de la lisina 9 de la histona 3 [43] o por la sobreexpresión de una serie de microARN, incluidos miR-181d, miR-767-3p y miR-603. [42] [44] [45]
La MGMT (metiltransferasa de ADN-O-6-metilguanina) es un importante biomarcador del cáncer porque participa en la reparación del daño del ADN y a menudo se silencia o inactiva en las células cancerosas. La pérdida de la función de la MGMT conduce a una mayor tasa de mutaciones, lo que promueve la formación y progresión de tumores. La presencia o ausencia de expresión de MGMT en una muestra de cáncer puede indicar la respuesta de un paciente a la quimioterapia alquilante, que es un tratamiento común para ciertos tipos de cáncer. Por lo tanto, la MGMT se puede utilizar como un marcador pronóstico para predecir la probabilidad de respuesta al tratamiento y guiar la selección de terapias adecuadas. Se están desarrollando varios dispositivos de punto de atención para monitorear el estado de metilación de la MGMT. [46]
Deficiencia en defectos de campo

Un defecto de campo es un área o "campo" de epitelio que ha sido preacondicionado por cambios epigenéticos y/o mutaciones de modo que lo predispone al desarrollo de cáncer. Un defecto de campo se ilustra en la foto y el diagrama que se muestran de un segmento de colon que tiene un cáncer de colon y cuatro pólipos pequeños dentro de la misma área también. Como señaló Rubin, "La gran mayoría de los estudios en investigación del cáncer se han realizado en tumores bien definidos in vivo, o en focos neoplásicos discretos in vitro. [47] Sin embargo, hay evidencia de que más del 80% de las mutaciones somáticas encontradas en tumores colorrectales humanos de fenotipo mutador ocurren antes del inicio de la expansión clonal terminal". [48] De manera similar, Vogelstein et al. [49] señalan que más de la mitad de las mutaciones somáticas identificadas en tumores ocurrieron en una fase preneoplásica (en un defecto de campo), durante el crecimiento de células aparentemente normales.
En la tabla anterior, se observaron deficiencias de MGMT en los defectos de campo (tejidos histológicamente normales) que rodean la mayoría de los cánceres. Si la MGMT se reduce o silencia epigenéticamente, es probable que no confiera una ventaja selectiva a una célula madre. Sin embargo, la expresión reducida o ausente de MGMT causaría mayores tasas de mutación, y uno o más de los genes mutados pueden proporcionar a la célula una ventaja selectiva. El gen MGMT deficiente en expresión podría entonces ser transportado como un gen pasajero selectivamente neutral o solo ligeramente perjudicial (polizón) cuando la célula madre mutada genere un clon expandido. La presencia continua de un clon con una MGMT reprimida epigenéticamente continuaría generando más mutaciones, algunas de las cuales podrían producir un tumor.
Deficiencia con daño exógeno
La deficiencia de MGMT por sí sola puede no ser suficiente para provocar la progresión al cáncer. Los ratones con una mutación homocigótica en MGMT no desarrollaron más cánceres que los ratones de tipo salvaje cuando se los crió sin estrés. [50] Sin embargo, el tratamiento estresante de ratones con azoximetano y sulfato de dextrano provocó más de cuatro tumores colónicos por ratón mutante de MGMT, pero menos de un tumor por ratón de tipo salvaje. [51]
Represión en coordinación con otros genes de reparación del ADN
En un cáncer, a menudo se encuentra que múltiples genes de reparación del ADN se reprimen simultáneamente. [52] En un ejemplo, que involucra MGMT , Jiang et al. [53] realizaron un estudio en el que evaluaron la expresión de ARNm de 27 genes de reparación del ADN en 40 astrocitomas en comparación con tejidos cerebrales normales de individuos sin astrocitomas. Entre los 27 genes de reparación del ADN evaluados, 13 genes de reparación del ADN, MGMT, NTHL1 , OGG1 , SMUG1 , ERCC1 , ERCC2 , ERCC3 , ERCC4 , MLH1 , MLH3 , RAD50 , XRCC4 y XRCC5 fueron significativamente regulados a la baja en los tres grados (II, III y IV) de astrocitomas. La represión de estos 13 genes en astrocitomas de grado inferior y de grado superior sugirió que pueden ser importantes tanto en etapas tempranas como posteriores del astrocitoma. En otro ejemplo, Kitajima et al. [54] encontraron que la inmunorreactividad para la expresión de MGMT y MLH1 estaba estrechamente correlacionada en 135 muestras de cáncer gástrico y la pérdida de MGMT y hMLH1 parecía acelerarse sincrónicamente durante la progresión del tumor.
La expresión deficiente de múltiples genes de reparación del ADN se encuentra a menudo en los cánceres, [52] y puede contribuir a las miles de mutaciones que suelen encontrarse en los cánceres (ver frecuencias de mutación en cánceres ).
Interacciones
Se ha demostrado que la O 6 -metilguanina-ADN metiltransferasa interactúa con el receptor de estrógeno alfa . [55]
Véase también
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000170430 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000054612 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia de PubMed sobre ratón". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ Tano K, Shiota S, Collier J, Foote RS, Mitra S (enero de 1990). "Aislamiento y caracterización estructural de un clon de ADNc que codifica la proteína de reparación del ADN humano para O6-alquilguanina". Proc. Natl. Sci. EE. UU . . 87 (2): 686–90. Bibcode :1990PNAS...87..686T. doi : 10.1073/pnas.87.2.686 . PMC 53330 . PMID 2405387.
- ^ Natarajan AT, Vermeulen S, Darroudi F, Valentine MB, Brent TP, Mitra S, Tano K (enero de 1992). "Localización cromosómica del gen de la O6-metilguanina-ADN metiltransferasa (MGMT) humana mediante hibridación in situ". Mutagénesis . 7 (1): 83–5. doi :10.1093/mutage/7.1.83. PMID 1635460.
- ^ Shiraishi A, Sakumi K, Sekiguchi M (octubre de 2000). "Mayor susceptibilidad a los agentes alquilantes quimioterapéuticos de ratones deficientes en la metiltransferasa de reparación del ADN". Carcinogénesis . 21 (10): 1879–83. doi : 10.1093/carcin/21.10.1879 . PMID 11023546.
- ^ Kaina B, Christmann M, Naumann S, Roos WP (agosto de 2007). "MGMT: nodo clave en la batalla contra la genotoxicidad, carcinogenicidad y apoptosis inducidas por agentes alquilantes". Reparación de ADN (Amst.) . 6 (8): 1079–99. doi :10.1016/j.dnarep.2007.03.008. PMID 17485253.
- ^ Hegi ME, Diserens AC, Gorlia T, Hamou MF, de Tribolet N, Weller M, Kros JM, Hainfellner JA, Mason W, Mariani L, Bromberg JE, Hau P, Mirimanoff RO, Cairncross JG, Janzer RC, Stupp R ( 2005). "Silenciamiento del gen MGMT y beneficio de la temozolomida en el glioblastoma". N. inglés. J. Med . 352 (10): 997–1003. doi : 10.1056/NEJMoa043331 . PMID 15758010.
- ^ Molenaar RJ, Verbaan D, Lamba S, Zanon C, Jeuken JW, Boots-Sprenger SH, Wesseling P, Hulsebos TJ, Troost D, van Tilborg AA, Leenstra S, Vandertop WP, Bardelli A , van Noorden CJ, Bleeker FE ( 2014). "La combinación de mutaciones de IDH1 y el estado de metilación de MGMT predice la supervivencia en el glioblastoma mejor que IDH1 o MGMT solos". Neurooncología . 16 (9): 1263–73. doi :10.1093/neuonc/nou005. PMC 4136888 . PMID 24510240.
- ^ Preusser, M. ; Janzer, Charles R.; Felsberg, J.; Reifenberger, G.; Hamou, MF; Diserens, AC; Stupp, R.; Gorlia, T.; Marosi, C.; Heinzl, H.; Hainfellner, JA; Hegi, M. (Oct 2008). "Inmunohistoquímica anti-O6-metilguanina-metiltransferasa (MGMT) en glioblastoma multiforme: la variabilidad del observador y la falta de asociación con la supervivencia del paciente impiden su uso como biomarcador clínico". Brain Pathol . 18 (4): 520–532. doi :10.1111/j.1750-3639.2008.00153.x. PMC 8095504 . PMID 18400046. S2CID 21167901.
- ^ McCormack, A. (2022). "Temozolomida en tumores hipofisarios agresivos y carcinomas hipofisarios". Mejores prácticas e investigación. Endocrinología clínica y metabolismo . 36 (6): 101713. doi :10.1016/j.beem.2022.101713. PMID 36274026. S2CID 252941246.
- ^ Bush, ZM; Longtine, JA; Cunningham, T.; Schiff, D.; Jane Jr, JA; Vance, ML; Thorner, MO; Laws Jr, ER; Lopes, MB (2010). "Tratamiento con temozolomida para tumores pituitarios agresivos: correlación del resultado clínico con la metilación y la expresión del promotor de la O(6)-metilguanina metiltransferasa (MGMT)". The Journal of Clinical Endocrinology and Metabolism . 95 (11): E280-90. doi :10.1210/jc.2010-0441. PMC 5393383 . PMID 20668043.
- ^ Chang AH, Stephan MT, Lisowski L, Sadelain M (2008). "Entrega de factor IX humano específico para eritroides a partir de células madre hematopoyéticas seleccionadas in vivo después del condicionamiento no mieloablativo en ratones con hemofilia B". Mol. Ther . 16 (10): 1745–52. doi :10.1038/mt.2008.161. PMC 2658893. PMID 18682698 .
- ^ Bartsch H, Montesano R (1984). "Relevancia de las nitrosaminas en el cáncer humano". Carcinogénesis . 5 (11): 1381–93. doi : 10.1093/carcin/5.11.1381 . PMID 6386215.
- ^ Christmann M, Kaina B (2012). "O(6)-metilguanina-ADN metiltransferasa (MGMT): impacto en el riesgo de cáncer en respuesta al humo del tabaco". Mutat. Res . 736 (1–2): 64–74. doi :10.1016/j.mrfmmm.2011.06.004. PMID 21708177.
- ^ Fahrer J, Kaina B (2013). "O6-metilguanina-ADN metiltransferasa en la defensa contra compuestos N-nitrosos y cáncer colorrectal". Carcinogénesis . 34 (11): 2435–42. doi : 10.1093/carcin/bgt275 . PMID 23929436.
- ^ De Bont R, van Larebeke N (2004). "Daños endógenos del ADN en humanos: una revisión de datos cuantitativos". Mutagénesis . 19 (3): 169–85. doi : 10.1093/mutage/geh025 . PMID 15123782.
- ^ Yarosh DB (1985). "El papel de la O6-metilguanina-ADN metiltransferasa en la supervivencia celular, mutagénesis y carcinogénesis". Mutat. Res . 145 (1–2): 1–16. doi :10.1016/0167-8817(85)90034-3. PMID 3883145.
- ^ Rasouli-Nia A, Sibghat-Ullah, Mirzayans R, Paterson MC, Day RS (1994). "Sobre la relación cuantitativa entre los residuos de O6-metilguanina en el ADN genómico y la producción de intercambios de cromátidas hermanas, mutaciones y eventos letales en una línea celular tumoral humana Mer". Mutat. Res . 314 (2): 99–113. doi :10.1016/0921-8777(94)90074-4. PMID 7510369.
- ^ Iliopoulos D, Oikonomou P, Messinis I, Tsezou A (2009). "Correlación de la hipermetilación del promotor en los genes hTERT, DAPK y MGMT con la progresión de la oncogénesis cervical". Oncol. Rep . 22 (1): 199–204. doi : 10.3892/or_00000425 . PMID 19513524.
- ^ ab Shen L, Kondo Y, Rosner GL, Xiao L, Hernandez NS, Vilaythong J, Houlihan PS, Krouse RS, Prasad AR, Einspahr JG, Buckmeier J, Alberts DS, Hamilton SR, Issa JP (2005). "Metilación del promotor MGMT y defecto de campo en el cáncer colorrectal esporádico". J. Natl. Cancer Inst . 97 (18): 1330–8. doi : 10.1093/jnci/dji275 . PMID 16174854.
- ^ ab Lee KH, Lee JS, Nam JH, Choi C, Lee MC, Park CS, Juhng SW, Lee JH (2011). "Estado de metilación del promotor de los genes hMLH1, hMSH2 y MGMT en el cáncer colorrectal asociado con la secuencia adenoma-carcinoma". Langenbecks Arch Surg . 396 (7): 1017–26. doi :10.1007/s00423-011-0812-9. PMID 21706233. S2CID 8069716.
- ^ Psofaki V, Kalogera C, Tzambouras N, Stephanou D, Tsianos E, Seferiadis K, Kolios G (2010). "Estado de metilación del promotor de hMLH1, MGMT y CDKN2A/p16 en adenomas colorrectales". World J. Gastroenterol . 16 (28): 3553–60. doi : 10.3748/wjg.v16.i28.3553 . PMC 2909555 . PMID 20653064.
- ^ Amatu A, Sartore-Bianchi A, Moutinho C, Belotti A, Bencardino K, Chirico G, Cassingena A, Rusconi F, Esposito A, Nichelatti M, Esteller M, Siena S (2013). "La hipermetilación de la isla CpG del promotor de la enzima reparadora del ADN MGMT predice la respuesta clínica a la dacarbazina en un estudio de fase II para el cáncer colorrectal metastásico". Clin. Cancer Res . 19 (8): 2265–72. doi : 10.1158/1078-0432.CCR-12-3518 . PMID 23422094.
- ^ Mokarram P, Zamani M, Kavousipour S, Naghibalhossaini F, Irajie C, Moradi Sarabi M, Hosseini SV (2013). "Diferentes patrones de metilación del ADN de las dos regiones promotoras distintas de la O6-metilguanina-ADN metiltransferasa (O6-MGMT) en el cáncer colorrectal". Mol. Biol. Rep . 40 (5): 3851–7. doi :10.1007/s11033-012-2465-3. PMID 23271133. S2CID 18733871.
- ^ Svrcek M, Buhard O, Colas C, Coulet F, Dumont S, Massaoudi I, Lamri A, Hamelin R, Cosnes J, Oliveira C, Seruca R, Gaub MP, Legrain M, Collura A, Lascols O, Tiret E, Fléjou JF, Duval A (2010). "Tolerancia a la metilación debido a un defecto en el campo de la O6-metilguanina ADN metiltransferasa (MGMT) en la mucosa colónica: un paso inicial en el desarrollo de cánceres colorrectales deficientes en la reparación de desajustes". Gut . 59 (11): 1516–26. doi :10.1136/gut.2009.194787. PMID 20947886. S2CID 206950452.
- ^ ab Hasina R, Surati M, Kawada I, Arif Q, Carey GB, Kanteti R, Husain AN, Ferguson MK, Vokes EE, Villaflor VM, Salgia R (2013). "La metilación de la metiltransferasa del ácido O-6-metilguanina-desoxirribonucleico mejora la respuesta al tratamiento con temozolomida en el cáncer de esófago". J Carcinog . 12 : 20. doi : 10.4103/1477-3163.120632 . PMC 3853796 . PMID 24319345.
- ^ ab Kuester D, El-Rifai W, Peng D, Ruemmele P, Kroeckel I, Peters B, Moskaluk CA, Stolte M, Mönkemüller K, Meyer F, Schulz HU, Hartmann A, Roessner A, Schneider-Stock R (2009). "Silenciamiento de la expresión de MGMT por hipermetilación del promotor en la secuencia metaplasia-displasia-carcinoma del esófago de Barrett". Cancer Lett . 275 (1): 117–26. doi :10.1016/j.canlet.2008.10.009. PMC 4028828 . PMID 19027227.
- ^ Ling ZQ, Li P, Ge MH, Hu FJ, Fang XH, Dong ZM, Mao WM (2011). "La metilación aberrante de diferentes genes de reparación del ADN demuestra un valor pronóstico distinto para el cáncer de esófago". Dig. Dis. Sci . 56 (10): 2992–3004. doi :10.1007/s10620-011-1774-z. PMID 21674174. S2CID 22913110.
- ^ ab Su Y, Yin L, Liu R, Sheng J, Yang M, Wang Y, Pan E, Guo W, Pu Y, Zhang J, Liang G (2014). "Estado de metilación del promotor de MGMT, hMSH2 y hMLH1 y su relación con la expresión de proteínas correspondientes y las mutaciones de TP53 en el carcinoma de células escamosas esofágicas humano". Med. Oncol . 31 (2): 784. doi :10.1007/s12032-013-0784-4. PMID 24366688. S2CID 22746140.
- ^ Morandi L, Franceschi E, de Biase D, Marucci G, Tosoni A, Ermani M, Pession A, Tallini G, Brandes A (2010). "Análisis de la metilación del promotor de la O6-metilguanina-ADN metiltransferasa en el glioblastoma: detección mediante PCR cuantitativa basada en ácidos nucleicos bloqueados utilizando un gen impreso (SNURF) como referencia". BMC Cancer . 10 : 48. doi : 10.1186/1471-2407-10-48 . PMC 2843669 . PMID 20167086.
- ^ Quillien V, Lavenu A, Karayan-Tapon L, Carpentier C, Labussière M, Lesimple T, Chinot O, Wager M, Honnorat J, Saikali S, Fina F, Sanson M, Figarella-Branger D (2012). "Evaluación comparativa de 5 métodos (reacción en cadena de la polimerasa específica de metilación, MethyLight, pirosecuenciación, fusión de alta resolución sensible a la metilación e inmunohistoquímica) para analizar la O6-metilguanina-ADN-metiltransferasa en una serie de 100 pacientes con glioblastoma". Cáncer . 118 (17): 4201–11. doi : 10.1002/cncr.27392 . PMID 22294349. S2CID 8145409.
- ^ Koutsimpelas D, Pongsapich W, Heinrich U, Mann S, Mann WJ, Brieger J (2012). "Metilación del promotor de los genes supresores de tumores MGMT, MLH1 y RASSF1A en el carcinoma de células escamosas de cabeza y cuello: la desmetilación farmacológica del genoma reduce la proliferación de células de carcinoma escamoso de cabeza y cuello". Oncol. Rep . 27 (4): 1135–41. doi :10.3892/or.2012.1624. PMC 3583513. PMID 22246327 .
- ^ Zekri AR, Bahnasy AA, Shoeab FE, Mohamed WS, El-Dahshan DH, Ali FT, Sabry GM, Dasgupta N, Daoud SS (2014). "Metilación de múltiples genes en el carcinoma hepatocelular asociado al virus de la hepatitis C". J Adv Res . 5 (1): 27–40. doi :10.1016/j.jare.2012.11.002. PMC 4294722 . PMID 25685469.
- ^ Pierini S, Jordanov SH, Mitkova AV, Chalakov IJ, Melnicharov MB, Kunev KV, Mitev VI, Kaneva RP, Goranova TE (2014). "Hipermetilación del promotor de los genes CDKN2A, MGMT, MLH1 y DAPK en el carcinoma de células escamosas laríngeo y sus asociaciones con los perfiles clínicos de los pacientes". Cabeza y cuello . 36 (8): 1103–8. doi :10.1002/hed.23413. PMID 23804521. S2CID 11916790.
- ^ ab Paluszczak J, Misiak P, Wierzbicka M, Woźniak A, Baer-Dubowska W (2011). "Hipermetilación frecuente de DAPK, RARbeta, MGMT, RASSF1A y FHIT en carcinomas de células escamosas de laringe y mucosa normal adyacente". Oncol oral . 47 (2): 104–7. doi :10.1016/j.oraloncology.2010.11.006. PMID 21147548.
- ^ ab Jin J, Xie L, Xie CH, Zhou YF (2014). "Metilación aberrante del ADN de los genes MGMT y hMLH1 en la predicción del cáncer gástrico". Genet. Mol. Res . 13 (2): 4140–5. doi : 10.4238/2014.May.30.9 . PMID 24938706.
- ^ ab Zou XP, Zhang B, Zhang XQ, Chen M, Cao J, Liu WJ (2009). "Hipermetilación del promotor de múltiples genes en el adenocarcinoma gástrico temprano y las lesiones precancerosas". Hum. Pathol . 40 (11): 1534–42. doi :10.1016/j.humpath.2009.01.029. PMID 19695681.
- ^ Mokhtar M, Kondo K, Namura T, Ali AH, Fujita Y, Takai C, Takizawa H, Nakagawa Y, Toba H, Kajiura K, Yoshida M, Kawakami G, Sakiyama S, Tangoku A (2014). "Perfiles de metilación y expresión del gen MGMT en tumores epiteliales del timo". Cáncer de pulmón . 83 (2): 279–87. doi :10.1016/j.lungcan.2013.12.004. PMID 24388682.
- ^ Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (junio de 2005). "O(6)-metilguanina metiltransferasa en cánceres colorrectales: detección de mutaciones, pérdida de expresión y asociación débil con transiciones G:C>A:T". Gut . 54 (6): 797–802. doi :10.1136/gut.2004.059535. PMC 1774551 . PMID 15888787.
- ^ abc Cabrini G, Fabbri E, Lo Nigro C, Dechecchi MC, Gambari R (2015). "Regulación de la expresión de la O6-metilguanina-ADN metiltransferasa y el tratamiento del glioblastoma (revisión)". Int. J. Oncol . 47 (2): 417–28. doi :10.3892/ijo.2015.3026. PMC 4501657 . PMID 26035292.
- ^ Nakagawachi T, Soejima H, Urano T, Zhao W, Higashimoto K, Satoh Y, Matsukura S, Kudo S, Kitajima Y, Harada H, Furukawa K, Matsuzaki H, Emi M, Nakabeppu Y, Miyazaki K, Sekiguchi M, Mukai T (2003). "Efecto silenciador de la hipermetilación de la isla CpG y las modificaciones de histonas en la expresión del gen O6-metilguanina-ADN metiltransferasa (MGMT) en el cáncer humano". Oncogén . 22 (55): 8835–44. doi : 10.1038/sj.onc.1207183. PMID 14647440.
- ^ Kushwaha D, Ramakrishnan V, Ng K, Steed T, Nguyen T, Futalan D, Akers JC, Sarkaria J, Jiang T, Chowdhury D, Carter BS, Chen CC (2014). "Una prueba de miARN de todo el genoma reveló que miR-603 es un miARN regulador de MGMT en glioblastomas". Oncoobjetivo . 5 (12): 4026–39. doi : 10.18632/oncotarget.1974. PMC 4147303 . PMID 24994119.
- ^ Zhang W, Zhang J, Hoadley K, Kushwaha D, Ramakrishnan V, Li S, Kang C, You Y, Jiang C, Song SW, Jiang T, Chen CC (2012). "miR-181d: un biomarcador predictivo del glioblastoma que regula negativamente la expresión de MGMT". Neuro-Oncology . 14 (6): 712–9. doi :10.1093/neuonc/nos089. PMC 3367855 . PMID 22570426.
- ^ Jahin, M., Fenech-Salerno, B., Moser, N., Georgiou, P., Flanagan, J., Toumazou, C., ... y Kalofonou, M. (noviembre de 2021). Detección del estado de metilación de MGMT mediante un método de amplificación isotérmica compatible con Lab-on-Chip. En 2021, 43.ª Conferencia internacional anual de la IEEE Engineering in Medicine & Biology Society (EMBC) (pp. 7385-7389). IEEE. doi:10.1109/EMBC46164.2021.9630776.
- ^ Rubin H (marzo de 2011). "Campos y cancerización de campos: los orígenes preneoplásicos del cáncer: los campos hiperplásicos asintomáticos son precursores de la neoplasia y su progresión a tumores se puede rastrear mediante la densidad de saturación en el cultivo". BioEssays . 33 (3): 224–31. doi :10.1002/bies.201000067. PMID 21254148. S2CID 44981539.
- ^ Tsao JL, Yatabe Y, Salovaara R, Järvinen HJ, Mecklin JP, Aaltonen LA, Tavaré S, Shibata D (febrero de 2000). "Reconstrucción genética de historias individuales de tumores colorrectales". Proc. Natl. Sci. EE. UU . . 97 (3): 1236–41. Bibcode :2000PNAS...97.1236T. doi : 10.1073/pnas.97.3.1236 . PMC 15581 . PMID 10655514.
- ^ Vogelstein B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA, Kinzler KW (marzo de 2013). "Paisajes del genoma del cáncer". Science . 339 (6127): 1546–58. Bibcode :2013Sci...339.1546V. doi :10.1126/science.1235122. PMC 3749880 . PMID 23539594.
- ^ Meira LB, Calvo JA, Shah D, Klapacz J, Moroski-Erkul CA, Bronson RT, Samson LD (2014). "La reparación de lesiones endógenas en la base del ADN modula la longevidad en ratones". Reparación del ADN (Amst.) . 21 : 78–86. doi :10.1016/j.dnarep.2014.05.012. PMC 4125484. PMID 24994062 .
- ^ Wirtz S, Nagel G, Eshkind L, Neurath MF, Samson LD, Kaina B (2010). "Tanto la reparación por escisión de bases como la O6-metilguanina-ADN metiltransferasa protegen contra la carcinogénesis de colon inducida por metilación". Carcinogénesis . 31 (12): 2111–7. doi :10.1093/carcin/bgq174. PMC 2994278 . PMID 20732909.
- ^ ab Bernstein C, Bernstein H (2015). "Reducción epigenética de la reparación del ADN en la progresión del cáncer gastrointestinal". World J Gastrointest Oncol . 7 (5): 30–46. doi : 10.4251/wjgo.v7.i5.30 . PMC 4434036 . PMID 25987950.
- ^ Jiang Z, Hu J, Li X, Jiang Y, Zhou W, Lu D (2006). "Análisis de expresión de 27 genes de reparación de ADN en astrocitomas mediante matriz de baja densidad TaqMan". Neurosci. Lett . 409 (2): 112–7. doi :10.1016/j.neulet.2006.09.038. PMID 17034947. S2CID 54278905.
- ^ Kitajima Y, Miyazaki K, Matsukura S, Tanaka M, Sekiguchi M (2003). "Pérdida de expresión de las enzimas reparadoras del ADN MGMT, hMLH1 y hMSH2 durante la progresión tumoral en el cáncer gástrico". Cáncer gástrico . 6 (2): 86–95. doi : 10.1007/s10120-003-0213-z . PMID 12861399.
- ^ Teo AK, Oh HK, Ali RB, Li BF (octubre de 2001). "La enzima de reparación del ADN humano modificada O(6)-metilguanina-ADN metiltransferasa es un regulador negativo de la transcripción mediada por el receptor de estrógeno tras daño del ADN por alquilación". Mol. Cell. Biol . 21 (20): 7105–14. doi : 10.1128/MCB.21.20.7105-7114.2001. PMC 99886. PMID 11564893.