Neisseria gonorrhoeae
| Neisseria gonorrhoeae | |
|---|---|
 | |
| Tinción de Gram de uretritis gonocócica . Nótese la distribución en neutrófilos y la presencia de bacterias tanto intracelulares como extracelulares . ( CDC ) | |
| Clasificación científica | |
| Dominio: | Bacteria |
| Filo: | Pseudomonas aeruginosa |
| Clase: | Betaproteobacteria |
| Orden: | Neisseriales |
| Familia: | Neisseriáceas |
| Género: | Neisseria |
| Especies: | N. gonorrhoeae |
| Nombre binomial | |
| Neisseria gonorrhoeae | |
| Sinónimos | |
Neisseria gonorrhoeae , también conocida como gonococo (singular) o gonococos (plural), es una especie de bacteria diplococo gramnegativa aislada por primera vez por Albert Neisser en 1879. [3] Es un patógeno humano obligado que coloniza principalmente el revestimiento mucoso del tracto urogenital; sin embargo, también es capaz de adherirse a la mucosa de la nariz, [4] faringe, recto y conjuntiva . [5] Provoca lainfección genitourinaria de transmisión sexual gonorrea [6], así como otras formas de enfermedad gonocócica, incluida la gonococcemia diseminada, la artritis séptica y la oftalmía gonocócica neonatal.
N. gonorrhoeae es oxidasa positiva y un microaerófilo capaz de sobrevivir a la fagocitosis y crecer dentro de los neutrófilos . [6] Su cultivo requiere suplementación con dióxido de carbono y agar enriquecido ( agar chocolate ) con varios antibióticos ( Thayer–Martin ). Presenta variación antigénica a través de la recombinación genética de sus pili y proteínas de superficie que interactúan con el sistema inmunológico . [3]
La transmisión sexual se produce a través del sexo vaginal, anal u oral. [7] La transmisión sexual se puede prevenir mediante el uso de protección de barrera. [8] La transmisión perinatal puede ocurrir durante el parto, aunque se puede prevenir mediante el tratamiento con antibióticos de la madre antes del nacimiento y la aplicación de un gel antibiótico para los ojos del recién nacido. [8] Las infecciones gonocócicas no dan lugar a una inmunidad protectora; por lo tanto, las personas pueden infectarse varias veces. La reinfección es posible debido a la capacidad de N. gonorrhoeae de evadir el sistema inmunológico modificando sus proteínas de superficie. [9]
La infección asintomática es común tanto en hombres como en mujeres. [8] [10] La infección no tratada puede propagarse al resto del cuerpo (infección gonocócica diseminada), especialmente a las articulaciones (artritis séptica). La infección no tratada en mujeres puede causar enfermedad inflamatoria pélvica y posible infertilidad debido a la cicatrización resultante. [11] La gonorrea se diagnostica mediante cultivos , tinción de Gram o pruebas de ácido nucleico (es decir, reacción en cadena de la polimerasa ) de muestras de orina, hisopos uretrales o hisopos cervicales. [12] [13] Se recomienda la prueba conjunta de clamidia y otras ITS debido a las altas tasas de coinfección. [14]
La resistencia a los antibióticos en N. gonorrhoeae es un problema de salud pública cada vez mayor, especialmente dada su propensión a desarrollar resistencia con facilidad. [15] Esta capacidad de N. gonorrhoeae de adaptarse rápidamente a nuevos tratamientos antimicrobianos se ha observado varias veces desde la década de 1930, lo que ha hecho que numerosos planes de tratamiento resulten obsoletos. Algunas cepas han mostrado resistencia a los tratamientos actuales con ceftriaxona. [16]
Microbiología

Las especies de Neisseria son cocos fastidiosos , gramnegativos (aunque algunas especies tienen forma de bastón y se presentan en pares o cadenas cortas) que requieren suplementación de nutrientes para crecer en cultivos de laboratorio. [18] Son patógenos intracelulares facultativos, lo que significa que pueden persistir y colonizar dentro de las células huésped, pero también pueden multiplicarse fuera del entorno celular huésped. [19] [20] [21] Por lo general, aparecen en pares (diplococos), asemejándose a la forma de los granos de café. [21] Los miembros de este género no forman endosporas y no son móviles, con la excepción de las especies patógenas, que son capaces de moverse mediante motilidad por espasmos ; [22] la mayoría también son aerobios obligados . [23] [24] De las 17 especies que colonizan a los humanos, solo dos son patógenas: N. gonorrhoeae, que causa gonorrea, y N. meningitidis , una de las principales causas de meningitis bacteriana . [25] [26]
Cultura e identificación
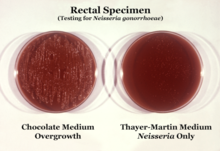
N. gonorrhoeae se puede aislar en agar Thayer-Martin (o VPN) en una atmósfera enriquecida con 3-7% de dióxido de carbono. [12] El agar Thayer-Martin es una placa de agar chocolate (agar sangre calentada) que contiene nutrientes y antimicrobianos ( vancomicina , colistina , nistatina y trimetoprima ). Esta preparación de agar facilita el crecimiento de especies de Neisseria al tiempo que inhibe el crecimiento de bacterias y hongos contaminantes. El agar Martin Lewis y el agar de la ciudad de Nueva York son otros tipos de agar chocolate selectivo que se utilizan comúnmente para el crecimiento de Neisseria . [12] N. gonorrhoeae es oxidasa positiva (posee citocromo c oxidasa) y catalasa positiva (capaz de convertir peróxido de hidrógeno en oxígeno). [12] Cuando se incuba con los carbohidratos lactosa, maltosa , sacarosa y glucosa , N. gonorrhoeae oxidará solo la glucosa. [12]
Metabolismo
Carbón
A diferencia de otras especies de Neisseria que también pueden metabolizar maltosa, N. gonorrhoeae es capaz de utilizar solo glucosa, piruvato y lactato como fuentes centrales de carbono, y la glucosa se cataboliza a través de las vías de Entner-Doudoroff (ED) y fosfato de pentosa (PP), y la vía ED es el método oxidativo primario. [19] [27] El uso de estas vías es necesario ya que N. gonorrhoeae es incapaz de catabolizar la glucosa a través de la vía de Embden-Meyerhof-Parnas (EMP) debido a su falta del gen de la fosfofructoquinasa (PFK); sin embargo, la enzima fructosa 1,6-bisfosfatasa está presente para permitir que ocurra la gluconeogénesis . [19]
La glucosa se metaboliza primero a través de la vía ED para producir piruvato y gliceraldehído 3-fosfato, el último de los cuales puede luego metabolizarse aún más por enzimas de la vía EMP para producir otra molécula de piruvato. [28] Las moléculas de piruvato resultantes luego se convierten en acetil-CoA , que luego se puede incorporar como sustrato para el ciclo del ácido cítrico (CAC) para producir portadores de electrones de alta energía que serán utilizados por la cadena de transporte de electrones (ETC) para la producción de ATP; sin embargo, el CAC se utiliza en gran medida para generar precursores biosintéticos en lugar de fines catabólicos. [19] [29] Esto se debe en parte a la expresión inhibida de varias enzimas CAC en presencia de glucosa, piruvato o lactato. Estas enzimas, a saber, citrato sintasa , aconitasa e isocitrato deshidrogenasa , son necesarias para la incorporación de acetato. En cambio, se ha observado un CAC parcial, donde el α-cetoglutarato se forma por la glutamato deshidrogenasa o la transaminación de oxaloacetato y glutamato por la aspartato aminotransferasa (dando lugar a aspartato y α-cetoglutarato). [27] [29] El CAC continúa desde allí para producir oxaloacetato, que es una molécula precursora importante para varias vías biosintéticas. [29] Otro aspecto diferenciador del CAC gonocócico es la falta de malato deshidrogenasa, que en su lugar se reemplaza por una malato:quinona-oxidorreductasa unida a la membrana que opera independientemente del NAD + al transferir directamente electrones a la ubiquinona. [19]
Por el contrario, el acetil-CoA que no entra en el CAC sino en la vía de la fosfotransacetilasa - acetato quinasa (PTA-AckA), donde puede convertirse en acetato por fosforilación (para formar acetilfosfato y liberar coenzima A) y desfosforilación para formar ATP. [30] Si bien este acetato puede entrar en el CAC para una mayor oxidación, esto no ocurre mientras estén presentes otras fuentes de carbono como la glucosa o el lactato, en cuyo caso se excreta de la célula o se incorpora para la síntesis de lípidos. [28] [31] N. gonorrhoeae carece de la derivación de glioxilato , lo que les impide utilizar el acetato para formar intermediarios del CAC para reponer el ciclo. [28] [27]
Una parte importante del gliceraldehído 3-fosfato formado en los gonococos se recicla a través de la vía gluconeogénica para reformar la glucosa 6-fosfato, así como la fructosa 6-fosfato intermedia. Ambos pueden utilizarse para la síntesis de pentosas en la vía PP a través de las vías oxidativa y no oxidativa, respectivamente, para la posterior formación de nucleótidos, así como para la producción de energía. [27]
N. gonorrhoeae , al igual que otros miembros patógenos del género Neisseria , son capnófilos , lo que significa que requieren concentraciones de dióxido de carbono (CO 2 ) más altas de lo normal para crecer, ya sea en forma de CO 2 o bicarbonato (HCO 3 - ) dependiendo de la cepa bacteriana. Este requisito debe satisfacerse de forma exógena durante las fases de crecimiento estacionario y de retraso, aunque parece satisfacerse mediante altas producciones metabólicas de CO 2 en la fase exponencial. La asimilación de este CO 2 en las especies de Neisseria se realiza mediante las enzimas anhidrasa carbónica y fosfoenolpiruvato en el espacio periplásmico y el citoplasma, respectivamente. [27]
El catabolismo del lactato también es de particular importancia para los gonococos, tanto para la patogenicidad como para el crecimiento. [19] El lactato externo se transporta a la célula a través de la permeasa de lactato (LctP). [19] El genoma de N. gonorrhoeae codifica tres enzimas lactato deshidrogenasas (LDH) que permiten el metabolismo tanto del L -lactato como del D -lactato: una D -lactato deshidrogenasa dependiente de NAD + citoplasmática (LdhA), que es responsable de y dos LDH unidas a la membrana, una específica para el L -lactato (LldD) y la otra específica para el D -lactato (LdhD). [19] [32] Se ha determinado que las LDH unidas a la membrana son enzimas respiratorias que contienen flavoproteínas que oxidan directamente el lactato para reducir la ubiquinona . Si bien estas enzimas no bombean protones directamente (iones H + ) al espacio periplásmico, se propone que la reducción de la ubiquinona por estas enzimas es capaz de alimentar la cadena de transporte de electrones más grande. [32]
Cadena de transporte de electrones y fosforilación oxidativa
Como patógeno humano obligado y capnófilo anaeróbico facultativo, Neisseria gonorrhoeae coloniza típicamente las superficies mucosas en ambientes microaeróbicos, como los del tracto genitourinario. [19] El crecimiento en áreas donde las concentraciones de oxígeno son limitadas requiere una oxidasa terminal con una alta afinidad por el oxígeno; en los gonococos, la reducción de oxígeno la realiza una citocromo oxidasa de tipo ccb 3. Además de la respiración aeróbica, los gonococos también pueden realizar respiración anaeróbica a través de la reducción de nitrito (NO 2 ) a óxido nítrico (NO) así como la reducción de NO a óxido nitroso (N 2 O). [19] [33]
Existen varias enzimas que aportan electrones al depósito intramembranoso de ubiquinona, el primer paso de la cadena de transporte de electrones. Entre ellas se encuentran las LDH unidas a la membrana (LldD y LdhD), la NADH:ubiquinona oxidorreductasa (también conocida como NADH deshidrogenasa; complejo Nuo I), la NADH deshidrogenasa translocante de Na + (Nqr), la succinato deshidrogenasa (SDH) y la malato:quinona oxidorreductasa independiente de NAD + unida a la membrana (MqR). [19]
Tras la transferencia inicial de electrones a la ubiquinona, los esquemas propuestos para la organización de la cadena de transporte de electrones del gonococo sugieren que los electrones pueden seguir pasando a lo largo de la cadena mediante la reducción del complejo citocromo bc 1 o pueden transferirse directamente al NO como aceptor terminal de electrones por la NO reductasa (NorB). [19] [34] En el caso del primero, los electrones pueden pasar desde el complejo bc 1 a lo largo de dos vías alternativas a través de la reducción del citocromo c 4 o c 5 . Ambos citocromos transfieren electrones a la citocromo ccb 3 oxidasa terminal para la reducción de O 2 para formar H 2 O en condiciones aeróbicas. [19] [33]
Los gonococos también reducen el NO 2 a través de una reductasa de nitrito que contiene cobre unida a la membrana externa inducible (AniA, un miembro de la familia de proteínas NirK) en condiciones anaeróbicas, aunque este proceso también se ha observado en condiciones microaeróbicas como un medio para complementar el crecimiento. [34] Esto conduce a la formación de NO que posteriormente se reduce a N 2 O en una vía de desnitrificación parcial. [19] [33] [34] La ccb 3 oxidasa de N. gonorrhoeae , a diferencia de otros miembros del género Neisseria , es una proteína trihemo que puede transferir electrones no solo a O 2 (conservado en las especies de Neisseria ) sino también a AniA para la reducción de NO 2 . Esto se suma al proceso típico de recibir electrones transferidos desde el citocromo c 5 . [34] [35]
El propósito general de la cadena de transporte de electrones (ETC) es la formación del gradiente electroquímico de iones de hidrógeno (H + o protones), resultante de las diferencias de concentración a través de la membrana plasmática, necesarios para impulsar la producción de ATP en un proceso conocido como fosforilación oxidativa . [36] En los gonococos, el movimiento de protones hacia el espacio periplásmico se logra mediante el complejo Nuo I, el complejo citocromo bc 1 y el citocromo ccb 3. [19] [34] [37] Posteriormente , la síntesis de ATP la realiza la F 1 F 0 ATP sintasa , un complejo proteico de dos partes presente en los gonococos, así como en numerosas otras especies en los dominios filogenéticos. [38] Este complejo acopla la translocación de protones de regreso al citoplasma a lo largo de su gradiente con la rotación mecánica para generar ATP. [39]
Hierro
El propósito general de la cadena de transporte de electrones es la formación del gradiente electroquímico de iones de hidrógeno (H + o protones), resultante de las diferencias de concentración a través de la membrana plasmática, necesarios para impulsar la producción de ATP en un proceso conocido como fosforilación oxidativa . [40] En los gonococos, el movimiento de protones hacia el espacio periplásmico se logra mediante el complejo Nuo I, el complejo citocromo bc 1 y el citocromo ccb 3. [19] [34] [41] Posteriormente, la síntesis de ATP la realiza la F 1 F 0 ATP sintasa , un complejo proteico de dos partes presente en los gonococos , así como en numerosas otras especies en los dominios filogenéticos. [42] Este complejo acopla la translocación de protones de regreso al citoplasma a lo largo de su gradiente con la rotación mecánica para generar ATP. [43]
Para adquirir el hierro necesario, los gonococos producen transportadores dependientes de TonB (TDT) en la superficie de su membrana externa que pueden extraer directamente el hierro, junto con otros metales, de sus respectivas proteínas transportadoras. Algunas de estas incluyen las proteínas de unión a transferrina A (TbpA) y B (TbpB), las proteínas de unión a la lactoferrina A (LbpA) y B (LbpB), y las proteínas de unión a hemoglobina/hemoglobina-haptoglobina HpuB y HpuA. [19] [44] Además de estas proteínas, los gonococos también son capaces de utilizar sideróforos , o compuestos que son capaces de quelar el hierro en el medio ambiente, que son producidos por otras bacterias; sin embargo, las células gonocócicas son incapaces de sintetizar sideróforos por sí mismas. Estos xenosideróforos son captados por el TDT FetA a través de la membrana externa y luego llevados a la célula por el sistema transportador fetBCDEF . [19] [44]
Junto con la defensa de secuestro que puede ser regulada positivamente por la inflamación del huésped, los humanos también producen siderocalinas que son capaces de quelar sideróforos como un método adicional para inhibir el crecimiento bacteriano patógeno. Estas a veces son ineficaces contra N. gonorrhoeae , que es capaz de colonizar intracelularmente, particularmente en células fagocíticas como macrófagos y neutrófilos. Los aumentos en el hierro intracelular del huésped también regulan negativamente algunos de los mecanismos intracelulares de eliminación de patógenos; coincidentemente, las Neisseria patógenas son capaces de alterar varios mecanismos de la célula huésped que finalmente permiten al patógeno tomar la mayor parte del hierro disponible de la célula inmune del huésped. [44]
Moléculas de superficie
En su superficie, N. gonorrhoeae tiene pili similares a pelos , proteínas de superficie con varias funciones y azúcares llamados lipooligosacáridos . Los pili median la adherencia, el movimiento y el intercambio de ADN. Las proteínas asociadas a la opacidad (Opa) interactúan con el sistema inmunológico, al igual que las porinas . El lipooligosacárido es una endotoxina que provoca una respuesta inmunitaria. Todos estos son antigénicos y exhiben variación antigénica . Los pili, las proteínas Opa, las porinas e incluso el lipooligosacárido tienen mecanismos para inhibir la respuesta inmunitaria, lo que hace posible la infección asintomática. [45]
Proteínas Opa
Las proteínas adhesivas asociadas a la opacidad variable en fase (Opa) son utilizadas por N. gonorrhoeae como parte de su estrategia de evadir la respuesta inmunitaria en una célula huésped. Se conocen al menos 12 proteínas Opa y las numerosas variaciones de las proteínas de superficie dificultan el reconocimiento de N. gonorrhoeae y el montaje de una defensa por parte de las células inmunitarias. [46] Las proteínas Opa se encuentran en la membrana externa y facilitan una respuesta cuando la bacteria interactúa con una variedad de células huésped. Estas proteínas se unen a varias células epiteliales y permiten que N. gonorrhoeae aumente la duración de la infección, así como la cantidad de invasión en otras células huésped. [47]
Pili tipo IV

Los filamentos proteicos poliméricos dinámicos llamados pili tipo IV permiten a N. gonorrhoeae realizar muchos procesos bacterianos, incluyendo la adhesión a superficies, la competencia de transformación, la motilidad de espasmos y las evasiones de la respuesta inmune. [19] Para entrar en el huésped, la bacteria utiliza los pili para adherirse y penetrar las superficies mucosas. Los pili son un factor de virulencia fundamental para N. gonorrhoeae ; sin ellos, la bacteria no puede promover la colonización. [48] Para la motilidad, las bacterias individuales utilizan sus pili de una manera que se asemeja a un gancho de agarre: primero, se extienden desde la superficie celular y se adhieren a un sustrato . La retracción posterior del pilus arrastra la célula hacia adelante. El movimiento resultante se conoce como motilidad de espasmos. N. gonorrhoeae es capaz de tirar 100.000 veces su propio peso, [49] y los pili utilizados para hacerlo se encuentran entre los motores biológicos más fuertes conocidos hasta la fecha, ejerciendo un nanonewton . [49] Las proteínas ATPasa PilF y PilT son responsables de impulsar la extensión y retracción del pilus tipo IV, respectivamente. Las funciones adhesivas del pilus gonocócico juegan un papel en la agregación de microcolonias y la formación de biopelículas . Estos pili también se utilizan para evitar respuestas inmunitarias de la célula que están invadiendo al hacer que sus pili tipo IV varíen antigénicamente. El filamento principal del pilus es reemplazado por secuencias de ADN variables con mucha frecuencia. [19] Al realizar este proceso rápidamente, pueden crear una diversidad de pili en su superficie y evadir la respuesta inmunitaria de la célula huésped. [48]
Lipo-igosacárido
El lipooligosacárido es una versión de bajo peso del lipopolisacárido presente en las superficies de la mayoría de las otras bacterias gramnegativas. Es una cadena lateral de azúcar (sacárido) unida al lípido A (por lo tanto, "lipo-") en la membrana externa que recubre la pared celular de la bacteria. La raíz "oligo" se refiere al hecho de que es unos pocos azúcares más corto que el lipopolisacárido típico. [6] Como endotoxina, provoca inflamación. La eliminación de lipooligosacárido por parte de las bacterias a veces es responsable de problemas asociados con la enfermedad inflamatoria pélvica. [6] Aunque funciona principalmente como una endotoxina, el lipooligosacárido puede camuflarse con el ácido siálico del huésped y bloquear la iniciación de la cascada del complemento . [6]
Variación antigénica
N. gonorrhoeae evade el sistema inmunológico a través de un proceso llamado variación antigénica . [50] Este proceso le permite a N. gonorrhoeae recombinar sus genes y alterar los determinantes antigénicos que adornan su superficie, [6] como los pili Tipo IV. [51] En términos simples, la composición química de las moléculas cambia debido a cambios a nivel genético. [9] N. gonorrhoeae puede variar la composición de sus pili y lipooligosacáridos. De estos, los pili exhiben la mayor variación antigénica debido al reordenamiento cromosómico. [11] [6] El gen pilS es un ejemplo de esta capacidad de reordenamiento, ya que se estima que su combinación con el gen pilE produce más de 100 variantes de la proteína PilE. [9] Estos cambios permiten el ajuste a las diferencias ambientales locales en el sitio de la infección, la evasión del reconocimiento por anticuerpos específicos e inhiben la formación de una vacuna efectiva. [9]
Además de la reorganización genética, también es naturalmente competente , lo que significa que puede adquirir ADN extracelular del entorno a través de su pilus tipo IV, específicamente las proteínas PilQ y PilT. [52] Estos procesos permiten a N. gonorrhoeae adquirir y propagar nuevos genes, disfrazarse con diferentes proteínas de superficie y evitar el desarrollo de la memoria inmunológica , una capacidad que ha contribuido a la resistencia a los antibióticos y ha impedido el desarrollo de vacunas. [53]
Variación de fase
La variación de fase es similar a la variación antigénica, pero en lugar de cambios a nivel genético que alteren la composición de las moléculas, estos cambios genéticos resultan en la activación o desactivación de un gen. [9] La variación de fase surge con mayor frecuencia de un cambio de marco en el gen expresado. [9] Las proteínas Opa de N. gonorrhoeae dependen estrictamente de la variación de fase. [9] Cada vez que las bacterias se replican, pueden activar o desactivar múltiples proteínas Opa a través de un desajuste de cadena deslizante . Es decir, las bacterias introducen mutaciones de cambio de marco que hacen que los genes entren o salgan del marco. El resultado es que se traducen diferentes genes Opa cada vez. [6] Los pili varían por la variación antigénica, pero también por la variación de fase. [9] Los cambios de marco ocurren tanto en los genes pilE como en los pilC , desactivando efectivamente la expresión de los pili en situaciones en las que no son necesarios, como durante la colonización intracelular en oposición a la adhesión a la superficie celular de la mucosa extracelular. [9]
Supervivencia de los gonococos
Después de que los gonococos invaden y transcitan las células epiteliales del huésped, aterrizan en la submucosa, donde los neutrófilos los consumen rápidamente. [6] Los pili y las proteínas Opa en la superficie pueden interferir con la fagocitosis, [11] pero la mayoría de los gonococos terminan en los neutrófilos. Los exudados de los individuos infectados contienen muchos neutrófilos con gonococos ingeridos. Los neutrófilos liberan una explosión oxidativa de especies reactivas de oxígeno en sus fagosomas para matar a los gonococos. [54] Sin embargo, una fracción significativa de los gonococos puede resistir la muerte a través de la acción de su catalasa [6] que descompone las especies reactivas de oxígeno y es capaz de reproducirse dentro de los fagosomas de los neutrófilos. [55]
La proteína bacteriana RecA, que media la reparación del daño del ADN, desempeña un papel importante en la supervivencia del gonococo. [56] N. gonorrhoeae puede reemplazar el ADN dañado en los fagosomas de los neutrófilos con ADN de los gonococos vecinos. [57] El proceso en el que los gonococos receptores integran el ADN de los gonococos vecinos en su genoma se denomina transformación. [58]
Genoma
Se han secuenciado los genomas de varias cepas de N. gonorrhoeae . La mayoría de ellos tienen un tamaño de aproximadamente 2,1 Mb y codifican entre 2100 y 2600 proteínas (aunque la mayoría parece estar en el rango inferior). [59] Por ejemplo, la cepa NCCP11945 consta de un cromosoma circular (2232025 pb) que codifica 2662 marcos de lectura abiertos (ORF) previstos y un plásmido (4153 pb) que codifica 12 ORF previstos. La densidad de codificación estimada en todo el genoma es del 87% y el contenido medio de G+C es del 52,4%, valores similares a los de la cepa FA1090. El genoma de NCCP11945 codifica 54 ARNt y cuatro copias de operones de ARNr 16S-23S-5S. [60]
Transferencia horizontal de genes
La transferencia horizontal de genes , también denominada transferencia lateral de genes, es el intercambio de información genética entre organismos vivos. [61] Esta transmisión de información es una fuerza impulsora de la resistencia a los antibióticos en N. gonorrhoeae . [62] [63] Los estudios han identificado que N. gonorrhoeae ha obtenido métodos de resistencia a los antimicrobianos mediante transferencia horizontal de genes de otras especies de Neisseria, incluidas N. lactamica , N. macacae y N. mucosa. [64]
La transformación en N. gonorrhoeae se realiza mediante el pilus tipo IV, donde el ADN se une y se lleva a la célula, seguido del procesamiento y la recombinación homóloga. [65]
La isla genética gonocócica (GGI), una isla genómica (GI) específica de los gonococos, se encuentra en algunos genomas de Neisseria gonorrhoeae y se ha identificado como un elemento genético móvil que se adquiere horizontalmente. [66] [67] La GGI está involucrada en la resistencia a los antimicrobianos, la transmisión de información genética y la adquisición de hierro. [66] Los genes dentro de la isla genética gonocócica codifican el infame sistema de secreción tipo IV (T4SS), que es responsable de la secreción de ADN y es esencial para la formación de biopelículas. [66] [68]
En 2011, investigadores de la Universidad Northwestern encontraron evidencia de un fragmento de ADN humano en un genoma de N. gonorrhoeae , el primer ejemplo de transferencia horizontal de genes de humanos a un patógeno bacteriano. [69] [70]
Enfermedad
Síntomas
Los síntomas de la infección por N. gonorrhoeae difieren según el sitio de la infección y muchas infecciones son asintomáticas independientemente del sexo. [71] [45] [7] Dependiendo de la vía de transmisión, N. gonorrhoeae puede causar infección de la garganta ( faringitis ) o infección del ano/recto ( proctitis ). [72] [11]
Las infecciones gonocócicas diseminadas pueden ocurrir cuando N. gonorrhoeae ingresa al torrente sanguíneo, a menudo se propaga a las articulaciones y causa una erupción (síndrome de dermatitis-artritis). [72] El síndrome de dermatitis-artritis produce dolor en las articulaciones ( artritis ), inflamación de los tendones ( tenosinovitis ) y dermatitis indolora no pruriginosa (sin picazón) . [11] La infección diseminada y la enfermedad inflamatoria pélvica en las mujeres tienden a comenzar después de las menstruaciones debido al reflujo durante las menstruaciones, lo que facilita la propagación. [72] En casos raros, la infección diseminada puede causar infección de las meninges del cerebro y la médula espinal ( meningitis ) o infección de las válvulas cardíacas ( endocarditis ). [72] [73]
Masculino
En los hombres sintomáticos, el síntoma principal de la infección genitourinaria es la uretritis: ardor al orinar ( disuria ), aumento de la necesidad de orinar y secreción purulenta (similar al pus ) del pene. La secreción puede tener mal olor. [72] Si no se trata, la cicatrización de la uretra puede provocar dificultad para orinar. La infección puede propagarse desde la uretra en el pene a las estructuras cercanas, incluidos los testículos ( epididimitis / orquitis ) o a la próstata ( prostatitis ). [72] [11] [74]
Femenino
.jpg/440px-Neisseria_gonorrhoeae_and_pus_cells_in_a_vaginal_swab_(Gram_stain).jpg)
En las mujeres sintomáticas, los síntomas principales de la infección genitourinaria son aumento del flujo vaginal, ardor al orinar ( disuria ), aumento de la urgencia de orinar, dolor durante las relaciones sexuales o anomalías menstruales. La enfermedad inflamatoria pélvica se produce si N. gonorrhoeae asciende al peritoneo pélvico (a través del cuello uterino , el endometrio y las trompas de Falopio ). La inflamación y la cicatrización resultantes de las trompas de Falopio pueden provocar infertilidad y un mayor riesgo de embarazo ectópico. [72] La enfermedad inflamatoria pélvica se desarrolla en el 10 al 20% de las mujeres infectadas con N. gonorrhoeae . [72]
Neonatos (infección perinatal)
En la infección perinatal , la manifestación primaria es la infección del ojo (conjuntivitis neonatal u oftalmía neonatal ) cuando el recién nacido está expuesto a N. gonorrhoeae en el canal del parto. La infección ocular puede provocar cicatrización o perforación de la córnea, lo que finalmente resulta en ceguera. Si el recién nacido está expuesto durante el parto, la conjuntivitis ocurre dentro de los 2 a 5 días posteriores al nacimiento y es grave. [72] [73] La oftalmía neonatal gonocócica, que alguna vez fue común en los recién nacidos, se previene mediante la aplicación de gel de eritromicina (antibiótico) en los ojos de los bebés al nacer como medida de salud pública. El nitrato de plata ya no se usa en los Estados Unidos. [73] [72]
Transmisión
La N. gonorrhoeae se transmite con mayor frecuencia a través del sexo vaginal, oral o anal; la transmisión no sexual es poco probable en la infección en adultos. [7] También se puede transmitir a un recién nacido durante el paso por el canal del parto si la madre tiene una infección genitourinaria no tratada. Dada la alta tasa de infección asintomática, se recomienda que las mujeres embarazadas se realicen una prueba de infección gonocócica antes del parto. [7] Los baños comunitarios, las toallas o telas compartidas, los termómetros rectales y la higiene inadecuada de las manos por parte de los cuidadores se han identificado como posibles medios de transmisión en entornos pediátricos. [75]
Tradicionalmente, se pensaba que la bacteria se desplazaba adherida a los espermatozoides, pero esta hipótesis no explicaba la transmisión de la enfermedad de la mujer al hombre. Un estudio reciente sugiere que, en lugar de "surfear" sobre los espermatozoides que se mueven , la bacteria N. gonorrhoeae utiliza pili para anclarse a las proteínas del espermatozoide y desplazarse a través del líquido coital. [76]
Infección
La transmisión exitosa es seguida por la adherencia a las células epiteliales encontradas en el sitio de la mucosa infectada por los pili tipo IV de la bacteria . La capacidad de los pili de unirse y posteriormente retraerse atrae a N. gonorrhoeae hacia la membrana epitelial en la superficie de la célula mucosa. [15] Después de la unión, N. gonorrhoeae replica su genoma y se divide para formar microcolonias . [15] La infección gonocócica a veces se ve favorecida por la proteína cofactor de membrana, CD46, ya que se sabe que actúa como receptor del pilus gonocócico. [45] Además, se ha demostrado que la interacción con los pili causa un reordenamiento del citoesqueleto de la célula huésped, lo que demuestra además que la participación de los pili gonocócicos altera la respuesta de la célula huésped y aumenta la probabilidad de una infección exitosa. [45] Durante el crecimiento y la colonización, N. gonorrhoeae estimula la liberación de citocinas y quimiocinas proinflamatorias de las células inmunes del huésped que resultan en el reclutamiento de neutrófilos al área. [9] Estas células fagocíticas típicamente absorben patógenos extraños y los destruyen, sin embargo, la capacidad de N. gonorrhoeae para manipular la respuesta de la célula huésped le permite al patógeno sobrevivir dentro de estas células inmunes y evadir la eliminación. [9]
Diagnóstico de laboratorio
Los principales métodos de detección de Neisseria gonorrhoeae son las pruebas de amplificación de ácidos nucleicos , que son las técnicas más sensibles disponibles. [77] [78] Otros métodos de detección incluyen la microscopía y el cultivo. [77]
Prevención
La transmisión se reduce mediante el uso de barreras de látex (por ejemplo, preservativos o barreras bucales ) durante las relaciones sexuales y limitando el número de parejas sexuales. [8] Los preservativos y las barreras bucales también deben usarse durante el sexo oral y anal. Los espermicidas, las espumas vaginales y las duchas vaginales no son métodos eficaces para prevenir la transmisión. [6]
Vacuna
Una vacuna contra N. gonorrhoeae se está volviendo cada vez más necesaria debido a la creciente incidencia de casos, el aumento de la resistencia a los antimicrobianos y su impacto en la salud reproductiva. [79] Hay problemas que han obstaculizado el desarrollo de la vacuna, incluidos: la ausencia de inmunidad después de la infección, huéspedes exclusivamente humanos y variación antigénica y de fase de los objetivos potenciales de la vacuna. [80] Actualmente, hay varias vacunas contra N. gonorrhoeae en desarrollo, incluida una vacuna de vesícula de membrana externa. [80] Esto incluye las vacunas candidatas NGoXIM, OMV nativa y Bexsero/4CMenB, que se encuentran todas en las últimas etapas clínicas de desarrollo. [81] La creación de una vacuna para N. gonorrhoeae tiene varios impactos potenciales en la salud pública. En una estimación, una vacuna para la población heterosexual administrada antes de que ocurra la actividad sexual mostró que la prevalencia de N. gonorrhoeae podría reducirse hasta en un 90% después de 20 años. [80]
Tratamiento
Actualmente, los CDC recomiendan una dosis única de la cefalosporina inyectable , ceftriaxona , como primera línea de defensa contra las infecciones gonocócicas. [82] A las personas que pesan menos de 150 kg se les suele recetar una concentración de ceftriaxona de 500 mg, mientras que a las personas que pesan más de 150 kg se les suele recetar una dosis de 1 g. Aunque la ceftriaxona no es la única cefalosporina que ha sido eficaz en el tratamiento de la gonorrea, es la más ventajosa. [79] En caso de alergia a la cefalosporina, los CDC recomiendan un tratamiento dual de gentamicina y azitromicina . Cada fármaco debe administrarse en una dosis única, con la gentamicina ingresando por vía intramuscular a una concentración de 240 mg, junto con 2 g de azitromicina por vía oral. [79] Si una persona no es alérgica a las cefalosporinas pero no dispone de ceftriaxona, un tratamiento alternativo es una dosis única de 800 mg de cefixima consumida por vía oral. [79] En todos estos casos, se recomienda la terapia combinada y el cotratamiento para la clamidia, ya que las infecciones simultáneas son comunes. [83]
Resistencia a los antibióticos
La resistencia a los antibióticos en la gonorrea se identificó por primera vez en la década de 1940. La gonorrea se trataba con penicilina, pero las dosis debían aumentarse progresivamente para mantener su eficacia. En la década de 1970, la gonorrea resistente a la penicilina y a la tetraciclina surgió en la cuenca del Pacífico. Estas cepas resistentes luego se extendieron a Hawai, California, el resto de los Estados Unidos, Australia y Europa. Las fluoroquinolonas fueron la siguiente línea de defensa, pero pronto también surgió la resistencia a este antibiótico. Desde 2007, el tratamiento estándar ha sido con cefalosporinas de tercera generación, como la ceftriaxona, que se consideran nuestra "última línea de defensa". [84] [85] Recientemente, se descubrió en Japón una cepa de gonorrea con alto nivel de resistencia a la ceftriaxona llamada H041. Las pruebas de laboratorio encontraron que era resistente a altas concentraciones de ceftriaxona, así como a la mayoría de los otros antibióticos probados. En N. gonorrhoeae existen genes que confieren resistencia a todos los antibióticos utilizados para curar la gonorrea, pero hasta el momento no coexisten en un mismo gonococo. Sin embargo, debido a la alta afinidad de N. gonorrhoeae por la transferencia horizontal de genes, la gonorrea resistente a los antibióticos se considera una amenaza emergente para la salud pública. [85]
Antes de 2007, las fluoroquinolonas eran una recomendación habitual para el tratamiento de la gonorrea. Los CDC dejaron de recomendar estos agentes bacterianos sistémicos una vez que surgió una cepa resistente de N. gonorrhoeae en los Estados Unidos. La eliminación de las fluoroquinolonas como posible tratamiento dejó a las cefalosporinas como la única opción antimicrobiana viable para el tratamiento de la gonorrea. Temerosos de una mayor resistencia gonocócica, las recomendaciones de los CDC cambiaron en 2010 a una estrategia de terapia dual: cefalosporina con azitromicina o doxiciclina . A pesar de estos esfuerzos, en 2011 se habían notificado casos de N. gonorrhoeae resistente en cinco continentes, lo que limitó aún más las opciones y recomendaciones de tratamiento. La resistencia a los antimicrobianos no es universal y las cepas de N. gonorrhoeae en los Estados Unidos siguen respondiendo a un régimen combinado de ceftriaxona y azitromicina. [86]
Resistencia al suero
Como bacteria Gram negativa, N. gonorrhoeae requiere mecanismos de defensa para protegerse contra el sistema del complemento (o cascada del complemento), cuyos componentes se encuentran en el suero humano . [45] Hay tres vías diferentes que activan este sistema, sin embargo, todas ellas dan como resultado la activación de la proteína 3 del complemento (C3). [87] Una porción escindida de esta proteína, C3b , se deposita en superficies patógenas y da como resultado la opsonización , así como la activación posterior del complejo de ataque de membrana . [87] N. gonorrhoeae tiene varios mecanismos para evitar esta acción. [15] En conjunto, estos mecanismos se conocen como resistencia al suero. [15]
Historia
Origen del nombre
Neisseria gonorrhoeae recibe su nombre de Albert Neisser, quien la aisló como agente causal de la enfermedad gonorrea en 1878. [15] [3] Galeno (130 d. C.) acuñó el término "gonorrea" del griego gonos que significa "semilla" y rhoe que significa "flujo". [88] [9] Por lo tanto, gonorrea significa "flujo de semilla", una descripción que se refiere a la secreción blanca del pene, que se supone es semen, que se observa en la infección masculina. [15]
Descubrimiento
En 1878, Albert Neisser aisló y visualizó diplococos N. gonorrhoeae en muestras de pus de 35 hombres y mujeres con los síntomas clásicos de infección genitourinaria con gonorrea –dos de los cuales también tenían infecciones en los ojos. [9] En 1882, Leistikow y Loeffler pudieron hacer crecer el organismo en cultivo. [15] Luego, en 1883, Max Bockhart demostró de manera concluyente que la bacteria aislada por Albert Neisser era el agente causal de la enfermedad conocida como gonorrea al inocular el pene de un hombre sano con la bacteria. [9] El hombre desarrolló los síntomas clásicos de la gonorrea días después, satisfaciendo el último de los postulados de Koch . Hasta este punto, los investigadores debatían si la sífilis y la gonorrea eran manifestaciones de la misma enfermedad o dos entidades distintas. [89] [9] Un investigador del siglo XVIII, John Hunter, intentó resolver el debate en 1767 [9] inoculando a un hombre con pus tomado de un paciente con gonorrea. Erróneamente concluyó que la sífilis y la gonorrea eran de hecho la misma enfermedad cuando el hombre desarrolló la erupción de color cobre que es clásica para la sífilis. [87] [89] Aunque muchas fuentes repiten que Hunter se inoculó a sí mismo, [87] [15] otros han argumentado que de hecho fue otro hombre. [90] Después del experimento de Hunter, otros científicos intentaron refutar sus conclusiones inoculando a otros médicos varones, estudiantes de medicina [15] y hombres encarcelados con pus gonorreico, quienes desarrollaron el ardor y secreción de la gonorrea. Un investigador, Ricord, tomó la iniciativa de realizar 667 inoculaciones de pus gonorreico en pacientes de un hospital psiquiátrico, con cero casos de sífilis. [9] [15] Cabe destacar que la llegada de la penicilina en la década de 1940 hizo que existieran tratamientos eficaces para la gonorrea. [91]
Véase también
Referencias
- ^ Euzéby JP, Parte AC. "Género Neisseria". Lista de nombres procariotas con estatus en la nomenclatura (LPSN) . Consultado el 7 de julio de 2017 .
- ^ Neisser A (1879). "Ueber eine der Gonorrhoe eigentümliche Micrococusform" [Acerca de una forma de micrococo peculiar de la gonorrea]. Centralblatt für die medizinischen Wissenschaften (en alemán). 17 (28): 497–500.
- ^ abc O'Donnell JA, Gelone SP (2009). "Causa bacteriana de la enfermedad inflamatoria pélvica: gonorrea". Enfermedad inflamatoria pélvica . Infobase Publishing. ISBN 978-1-4381-0159-0.
- ^ Inaba S, Aizawa Y, Kataoka S, Saitoh A (diciembre de 2023). "Secreción nasal purulenta por nasofaringitis gonocócica en un recién nacido". Revista de Infección y Quimioterapia . 29 (12): 1164-1166. doi :10.1016/j.jiac.2023.08.005. PMID 37558089.
- ^ Mahapure K, Singh A (agosto de 2023). "Una revisión de los avances recientes en nuestra comprensión de Neisseria gonorrhoeae". Cureus . 15 (8): e43464. doi : 10.7759/cureus.43464 . PMC 10498933 . PMID 37711920.
- ^ abcdefghijk Ryan KJ, Ray CG, eds. (2004). Microbiología médica Sherris (4.ª ed.). McGraw Hill. ISBN 978-0-8385-8529-0.[ página necesaria ]
- ^ abcd "Datos detallados sobre las ETS: gonorrea". www.cdc.gov . 26 de septiembre de 2017 . Consultado el 7 de diciembre de 2017 .
- ^ abcd "Pautas para el tratamiento de enfermedades de transmisión sexual de 2015". CDC . Centros para el Control y la Prevención de Enfermedades, Departamento de Salud y Servicios Humanos de los EE. UU. Archivado desde el original el 22 de diciembre de 2015.
- ^ abcdefghijklmnopq Hill SA, Masters TL, Wachter J (septiembre de 2016). "Gonorrea: una enfermedad en evolución del nuevo milenio". Microbial Cell . 3 (9): 371–389. doi :10.15698/mic2016.09.524 (inactivo el 1 de noviembre de 2024). PMC 5354566 . PMID 28357376.
{{cite journal}}: CS1 maint: DOI inactivo a partir de noviembre de 2024 ( enlace ) - ^ "Declaración de recomendación final: clamidia y gonorrea: detección". Grupo de trabajo de servicios preventivos de Estados Unidos . Consultado el 7 de diciembre de 2017 .
- ^ abcdef Levinson W (2014). Revisión de microbiología médica e inmunología . McGraw-Hill Education. ISBN 978-0-07-181811-7.OCLC 871305336 .[ página necesaria ]
- ^ abcde Ng LK, Martin IE (enero de 2005). "El diagnóstico de laboratorio de Neisseria gonorrhoeae". Revista Canadiense de Enfermedades Infecciosas y Microbiología Médica . 16 (1): 15–25. doi : 10.1155/2005/323082 . PMC 2095009. PMID 18159523.
- ^ "Infecciones gonocócicas: pautas para el tratamiento de las ETS en 2015". 4 de enero de 2018.
- ^ MacKenzie CR, Henrich B, eds. (2012). Diagnóstico de enfermedades de transmisión sexual: métodos y protocolos . Humana Press. ISBN 978-1-61779-936-5.OCLC 781681739 .
- ^ abcdefghijk Quillin SJ, Seifert HS (abril de 2018). "Adaptación al huésped y patogénesis de Neisseria gonorrhoeae". Nature Reviews. Microbiología . 16 (4): 226–240. doi :10.1038/nrmicro.2017.169. PMC 6329377 . PMID 29430011.
- ^ Costa-Lourenço AP, Barros Dos Santos KT, Moreira BM, Fracalanzza SE, Bonelli RR (1 de octubre de 2017). "Resistencia a los antimicrobianos en Neisseria gonorrhoeae: historia, mecanismos moleculares y aspectos epidemiológicos de una amenaza global emergente". Revista Brasileña de Microbiología . 48 (4): 617–628. doi :10.1016/j.bjm.2017.06.001. PMC 5628311 . PMID 28754299.
- ^ Sell J, Nasir M, Courchesne C (mayo de 2021). "Uretritis: revisión rápida de evidencia". American Family Physician . 103 (9): 553–558. PMID 33929174.
- ^ van Putten J, Tønjum T (1 de enero de 2010), Cohen J, Opal SM, Powderly WG (eds.), "Capítulo 168 - Neisseria", Enfermedades infecciosas (tercera edición) , Londres: Mosby, págs. 1676-1689, doi :10.1016/b978-0-323-04579-7.00168-4, ISBN 978-0-323-04579-7, consultado el 19 de noviembre de 2024
- ^ abcdefghijklmnopqrst Green LR, Cole J, Parga EF, Shaw JG (1 de enero de 2022). Kelly RK, Poole DJ (eds.). "Fisiología y patogénesis de Neisseria gonorrhoeae". Avances en fisiología microbiana . 80 . Academic Press: 35–83. doi :10.1016/bs.ampbs.2022.01.002. ISBN 978-0-323-98869-8. Número PMID 35489793.
- ^ Silva MT (2012). "Etiquetado clásico de patógenos bacterianos según su estilo de vida en el huésped: inconsistencias y alternativas". Frontiers in Microbiology . 3 : 71. doi : 10.3389/fmicb.2012.00071 . PMC 3289908 . PMID 22393329.
- ^ ab Yeshanew AG, Geremew RA (17 de julio de 2018). "Neisseria Gonorrhoae y sus patrones de susceptibilidad a los antimicrobianos entre pacientes sintomáticos de la ciudad de Gondar, noroeste de Etiopía". Resistencia a los antimicrobianos y control de infecciones . 7 (1): 85. doi : 10.1186/s13756-018-0376-3 . PMC 6050735. PMID 30026943 .
- ^ "Neisseria: una descripción general | Temas de ScienceDirect" www.sciencedirect.com . Consultado el 21 de noviembre de 2024 .
- ^ Gray-Owen SD, Dehio C, Rudel T, Naumann M, Meyer TF (1 de enero de 2001), Groisman EA (ed.), "CAPÍTULO 12 - Neisseria", Principles of Bacterial Pathogenesis , San Diego: Academic Press, págs. 559-618, doi :10.1016/b978-012304220-0/50013-3, ISBN 978-0-12-304220-0, consultado el 19 de noviembre de 2024
- ^ Eriksson J, Eriksson OS, Maudsdotter L, Palm O, Engman J, Sarkissian T, et al. (abril de 2015). "Caracterización de la motilidad y la piliación en Neisseria patógena". BMC Microbiology . 15 (1): 92. doi : 10.1186/s12866-015-0424-6 . PMC 4449605 . PMID 25925502.
- ^ Ladhani SN, Lucidarme J, Parikh SR, Campbell H, Borrow R, Ramsay ME (junio de 2020). "Enfermedad meningocócica y transmisión sexual: infecciones urogenitales y anorrectales y enfermedad invasiva debida a Neisseria meningitidis". Lancet . 395 (10240): 1865–1877. doi :10.1016/S0140-6736(20)30913-2. PMID 32534649. S2CID 219701418.
- ^ Groisman EA, ed. (2001). Principios de la patogénesis bacteriana . San Diego, California: Academic Press. ISBN 978-0-12-304220-0.
- ^ abcde Morse SA, Cacciapuoti AF, Lysko PG (1 de enero de 1980). "Fisiología de Neisseria gonorrhoeae". En Rose AH, Morris JG (eds.). Avances en fisiología microbiana , volumen 20. Vol. 20. Academic Press. págs. 251–320. doi :10.1016/s0065-2911(08)60209-x. ISBN 978-0-12-027720-9.PMID 43667 .
- ^ abc Morse SA, Stein S, Hines J (noviembre de 1974). "Metabolismo de la glucosa en Neisseria gonorrhoeae". Journal of Bacteriology . 120 (2): 702–714. doi :10.1128/jb.120.2.702-714.1974. PMC 245830 . PMID 4156358.
- ^ abc Hebeler BH, Morse SA (octubre de 1976). "Fisiología y metabolismo de la neisseria patógena: actividad del ciclo del ácido tricarboxílico en Neisseria gonorrhoeae". Journal of Bacteriology . 128 (1): 192–201. doi :10.1128/jb.128.1.192-201.1976. PMC 232843 . PMID 824268.
- ^ Ingram-Smith C, Martin SR, Smith KS (junio de 2006). "Acetato quinasa: no sólo una enzima bacteriana". Tendencias en microbiología . 14 (6): 249–253. doi :10.1016/j.tim.2006.04.001. PMID 16678422.
- ^ Leighton MP, Kelly DJ, Williamson MP, Shaw JG (junio de 2001). "Un estudio de RMN y enzimas del metabolismo del carbono de Neisseria meningitidis". Microbiología . 147 (Pt 6): 1473–1482. doi : 10.1099/00221287-147-6-1473 . PMID 11390678.
- ^ ab Atack JM, Ibranovic I, Ong CL, Djoko KY, Chen NH, Vanden Hoven R, et al. (octubre de 2014). "Un papel de las lactato deshidrogenasas en la supervivencia de Neisseria gonorrhoeae en leucocitos polimorfonucleares humanos y células epiteliales cervicales". The Journal of Infectious Diseases . 210 (8): 1311–1318. doi :10.1093/infdis/jiu230. PMC 4215069 . PMID 24737798.
- ^ abc Li Y, Hopper A, Overton T, Squire DJ, Cole J, Tovell N (mayo de 2010). "Organización de la cadena de transferencia de electrones al oxígeno en el patógeno humano obligado Neisseria gonorrhoeae: funciones de los citocromos c4 y c5, pero no del citocromo c2, en la reducción del oxígeno". Journal of Bacteriology . 192 (9): 2395–2406. doi :10.1128/JB.00002-10. PMC 2863483 . PMID 20154126.
- ^ abcdef Aspholm M, Aas FE, Harrison OB, Quinn D, Vik A, Viburiene R, et al. (agosto de 2010). "Alteraciones estructurales en un componente de la citocromo c oxidasa y evolución molecular de Neisseria patógena en humanos". PLOS Pathogens . 6 (8): e1001055. doi : 10.1371/journal.ppat.1001055 . PMC 2924362 . PMID 20808844.
- ^ Hopper A, Tovell N, Cole J (2009). "Un papel fisiológicamente significativo en la reducción de nitrito de la subunidad CcoP de la citocromo oxidasa CBB 3 de Neisseria gonorrhoeae". FEMS Microbiology Letters . 301 (2): 232–240. doi :10.1111/j.1574-6968.2009.01824.x. PMID 19889029 . Consultado el 18 de noviembre de 2024 .
- ^ Anraku Y (junio de 1988). "Cadenas de transporte de electrones en bacterias". Revisión anual de bioquímica . 57 (1): 101–132. doi :10.1146/annurev.bi.57.070188.000533. PMID 3052268.
- ^ Trumpower BL (junio de 1990). "Complejos de microorganismos con citocromo bc1". Microbiological Reviews . 54 (2): 101–129. doi :10.1128/mr.54.2.101-129.1990. PMC 372766 . PMID 2163487.
- ^ "UniProt". www.uniprot.org . Consultado el 18 de noviembre de 2024 .
- ^ Capaldi RA, Aggeler R (marzo de 2002). "Mecanismo de la ATP sintasa de tipo F(1)F(0), un motor rotatorio biológico". Tendencias en Ciencias Bioquímicas . 27 (3): 154–160. doi :10.1016/s0968-0004(01)02051-5. PMID 11893513.
- ^ Anraku Y (junio de 1988). "Cadenas de transporte de electrones en bacterias". Revisión anual de bioquímica . 57 (1): 101–132. doi :10.1146/annurev.bi.57.070188.000533. PMID 3052268.
- ^ Trumpower BL (junio de 1990). "Complejos de microorganismos con citocromo bc1". Microbiological Reviews . 54 (2): 101–129. doi :10.1128/mr.54.2.101-129.1990. PMC 372766 . PMID 2163487.
- ^ "UniProt". www.uniprot.org . Consultado el 18 de noviembre de 2024 .
- ^ Capaldi RA, Aggeler R (marzo de 2002). "Mecanismo de la ATP sintasa de tipo F(1)F(0), un motor rotatorio biológico". Tendencias en Ciencias Bioquímicas . 27 (3): 154–160. doi :10.1016/s0968-0004(01)02051-5. PMID 11893513.
- ^ abc Stoudenmire JL, Greenawalt AN, Cornelissen CN (15 de septiembre de 2022). "Microbios furtivos: cómo Neisseria gonorrhoeae secuestra el hierro baluarteado durante la infección". Frontiers in Cellular and Infection Microbiology . 12 : 1017348. doi : 10.3389/fcimb.2022.1017348 . PMC 9519893 . PMID 36189345.
- ^ abcde Edwards JL, Apicella MA (octubre de 2004). "Los mecanismos moleculares utilizados por Neisseria gonorrhoeae para iniciar la infección difieren entre hombres y mujeres". Clinical Microbiology Reviews . 17 (4): 965–81, índice. doi :10.1128/CMR.17.4.965-981.2004. PMC 523569 . PMID 15489357.
- ^ "Conocimiento sobre las ITS: gonorrea". Planned Parenthood Advocates of Arizona. 11 de abril de 2011. Archivado desde el original el 3 de noviembre de 2012. Consultado el 31 de agosto de 2011 .
- ^ Sadarangani M, Pollard AJ, Gray-Owen SD (mayo de 2011). "Proteínas Opa y CEACAM: vías de interacción inmunitaria para Neisseria patógena". FEMS Microbiology Reviews . 35 (3): 498–514. doi :10.1111/j.1574-6976.2010.00260.x. PMID 21204865.
- ^ ab Hu LI, Yin S, Ozer EA, Sewell L, Rehman S, Garnett JA, et al. (octubre de 2020). Justice S (ed.). "Descubrimiento de un nuevo factor de ensamblaje de pilus tipo IV de Neisseria gonorrhoeae, TfpC". mBio . 11 (5). doi :10.1128/mBio.02528-20. PMC 7593972 . PMID 33109763.
- ^ ab Merz AJ, So M, Sheetz MP (septiembre de 2000). "La retracción del pilus potencia la motilidad bacteriana por espasmos". Nature . 407 (6800): 98–102. doi :10.1038/35024105. PMID 10993081.
- ^ Stern A, Brown M, Nickel P, Meyer TF (octubre de 1986). "Genes de opacidad en Neisseria gonorrhoeae: control de la fase y variación antigénica". Cell . 47 (1): 61–71. doi :10.1016/0092-8674(86)90366-1. PMID 3093085. S2CID 21366517.
- ^ Cahoon LA, Seifert HS (septiembre de 2011). "Enfoque en la recombinación homóloga: variación antigénica de pilina en la Neisseria patógena". Microbiología molecular . 81 (5): 1136–1143. doi :10.1111/j.1365-2958.2011.07773.x. PMC 3181079 . PMID 21812841.
- ^ Obergfell KP, Seifert HS (febrero de 2015). "ADN móvil en la Neisseria patógena". Microbiology Spectrum . 3 (3). doi :10.1128/microbiolspec.MDNA3-0015-2014. PMC 4389775 . PMID 25866700.
- ^ Aas FE, Wolfgang M, Frye S, Dunham S, Løvold C, Koomey M (noviembre de 2002). "Competencia para la transformación natural en Neisseria gonorrhoeae: componentes de la unión y captación del ADN vinculados a la expresión del pilus tipo IV". Microbiología molecular . 46 (3): 749–760. doi : 10.1046/j.1365-2958.2002.03193.x . PMID 12410832. S2CID 21854666.
- ^ Simons MP, Nauseef WM, Apicella MA (abril de 2005). "Interacciones de Neisseria gonorrhoeae con leucocitos polimorfonucleares adherentes". Infección e inmunidad . 73 (4): 1971–1977. doi :10.1128/iai.73.4.1971-1977.2005. PMC 1087443 . PMID 15784537.
- ^ Escobar A, Rodas PI, Acuña-Castillo C (2018). "Interacciones entre macrófagos y Neisseria gonorrhoeae: una mejor comprensión de los mecanismos de inmunomodulación de los patógenos". Frontiers in Immunology . 9 : 3044. doi : 10.3389/fimmu.2018.03044 . PMC 6309159 . PMID 30627130.
- ^ Stohl EA, Seifert HS (noviembre de 2006). "Las enzimas de recombinación y reparación del ADN de Neisseria gonorrhoeae protegen contra el daño oxidativo causado por el peróxido de hidrógeno". Journal of Bacteriology . 188 (21): 7645–7651. doi :10.1128/JB.00801-06. PMC 1636252 . PMID 16936020.
- ^ Michod RE, Bernstein H, Nedelcu AM (mayo de 2008). "Valor adaptativo del sexo en patógenos microbianos". Infección, genética y evolución . 8 (3): 267–285. Bibcode :2008InfGE...8..267M. doi :10.1016/j.meegid.2008.01.002. PMID 18295550.
- ^ Blokesch M (noviembre de 2016). "Competencia natural para la transformación". Current Biology . 26 (21): R1126–R1130. Bibcode :2016CBio...26R1126B. doi : 10.1016/j.cub.2016.08.058 . PMID 27825443.
- ^ "Estadísticas del genoma de Neisseria gonorrhoeae". Broad Institute . Consultado el 8 de abril de 2017 .
- ^ Chung GT, Yoo JS, Oh HB, Lee YS, Cha SH, Kim SJ, et al. (septiembre de 2008). "Secuencia completa del genoma de Neisseria gonorrhoeae NCCP11945". Journal of Bacteriology . 190 (17): 6035–6036. doi :10.1128/JB.00566-08. PMC 2519540 . PMID 18586945.
- ^ Burmeister AR (julio de 2015). "Transferencia horizontal de genes". Evolución, medicina y salud pública . 2015 (1): 193–194. doi :10.1093/emph/eov018. PMC 4536854. PMID 26224621 .
- ^ Unemo M, Shafer WM (agosto de 2011). "Resistencia a los antibióticos en Neisseria gonorrhoeae: origen, evolución y lecciones aprendidas para el futuro". Anales de la Academia de Ciencias de Nueva York . 1230 (1): E19–E28. Código Bibliográfico :2011NYASA1230E..19U. doi :10.1111/j.1749-6632.2011.06215.x. PMC 4510988 . PMID 22239555.
- ^ Spencer-Smith R, Roberts S, Gurung N, Snyder LA (agosto de 2016). "Secuencias de captación de ADN en Neisseria gonorrhoeae como terminadores transcripcionales intrínsecos y marcadores de transferencia horizontal de genes". Genómica microbiana . 2 (8): e000069. doi : 10.1099/mgen.0.000069 . PMC 5320588 . PMID 28348864.
- ^ Manoharan-Basil SS, González N, Laumen JG, Kenyon C (17 de marzo de 2022). "Transferencia horizontal de genes que confieren resistencia a fluoroquinolonas desde Neisseria comensal a Neisseria gonorrhoeae: un análisis filogenético global de 20.047 aislamientos". Frontiers in Microbiology . 13 : 793612. doi : 10.3389/fmicb.2022.793612 . PMC 8973304 . PMID 35369513.
- ^ Hamilton HL, Dillard JP (enero de 2006). "Transformación natural de Neisseria gonorrhoeae: de la donación de ADN a la recombinación homóloga". Microbiología molecular . 59 (2): 376–385. doi :10.1111/j.1365-2958.2005.04964.x. PMID 16390436.
- ^ abc Cehovin A, Lewis SB (agosto de 2017). "Elementos genéticos móviles en Neisseria gonorrhoeae: movimiento para el cambio". Patógenos y enfermedades . 75 (6). doi :10.1093/femspd/ftx071. PMID 28645177.
- ^ Kravtsov D, Gryadunov D, Shaskolskiy B (junio de 2023). "Isla genética gonocócica en la población mundial de Neisseria gonorrhoeae: un modelo de diversidad genética y asociación con la resistencia a los antimicrobianos". Microorganismos . 11 (6): 1547. doi : 10.3390/microorganisms11061547 . PMC 10301925 . PMID 37375049.
- ^ Zweig M, Schork S, Koerdt A, Siewering K, Sternberg C, Thormann K, et al. (abril de 2014). "El ADN monocatenario secretado está involucrado en la fase inicial de la formación de biopelículas por Neisseria gonorrhoeae" (PDF) . Microbiología ambiental . 16 (4): 1040–1052. Bibcode :2014EnvMi..16.1040Z. doi :10.1111/1462-2920.12291. PMID 24119133.
- ^ Anderson MT, Seifert HS (mayo de 2011). "Neisseria gonorrhoeae y los humanos realizan una danza evolutiva en LINEA". Elementos genéticos móviles . 1 (1): 85–87. doi :10.4161/mge.1.1.15868. PMC 3190277 . PMID 22016852.
- ^ Anderson MT, Seifert HS (2011). "Oportunidad y medios: transferencia horizontal de genes desde el huésped humano a un patógeno bacteriano". mBio . 2 (1): e00005–e00011. doi :10.1128/mBio.00005-11. PMC 3042738 . PMID 21325040.
- ^ Detels R, Green AM, Klausner JD, Katzenstein D, Gaydos C, Handsfield H, et al. (junio de 2011). "La incidencia y correlatos de infecciones sintomáticas y asintomáticas por Chlamydia trachomatis y Neisseria gonorrhoeae en poblaciones seleccionadas de cinco países". Enfermedades de transmisión sexual . 38 (6): 503–509. doi :10.1097/OLQ.0b013e318206c288. PMC 3408314 . PMID 22256336.
- ^ abcdefghij Ryan KJ, Ray CG, eds. (2004). Microbiología médica Sherris (4.ª ed.). McGraw Hill. ISBN 978-0-8385-8529-0.[ página necesaria ]
- ^ abc "Infecciones gonocócicas: pautas para el tratamiento de las ETS en 2015" www.cdc.gov . Consultado el 7 de diciembre de 2017 .
- ^ "Síntomas de la gonorrea". std-gov.org. 2 de abril de 2015.
- ^ Goodyear-Smith F (noviembre de 2007). "¿Cuál es la evidencia de transmisión no sexual de la gonorrea en niños después del período neonatal? Una revisión sistemática". Revista de Medicina Forense y Legal . 14 (8): 489–502. doi :10.1016/j.jflm.2007.04.001. PMID 17961874.
- ^ Anderson MT, Dewenter L, Maier B, Seifert HS (marzo de 2014). "El plasma seminal inicia un estado de transmisión de Neisseria gonorrhoeae". mBio . 5 (2): e01004–e01013. doi :10.1128/mBio.01004-13. PMC 3958800 . PMID 24595372.
- ^ ab Meyer T, Buder S (enero de 2020). "El diagnóstico de laboratorio de Neisseria gonorrhoeae: pruebas actuales y demandas futuras". Patógenos . 9 (2): 91. doi : 10.3390/pathogens9020091 . PMC 7169389 . PMID 32024032.
- ^ Cosentino LA, Campbell T, Jett A, Macio I, Zamborsky T, Cranston RD, et al. (junio de 2012). "Uso de pruebas de amplificación de ácidos nucleicos para el diagnóstico de infecciones de transmisión sexual anorrectales". Journal of Clinical Microbiology . 50 (6): 2005–2008. doi :10.1128/JCM.00185-12. PMC 3372150 . PMID 22493338.
- ^ abcd "Infecciones gonocócicas en adolescentes y adultos: pautas para el tratamiento de las ITS". www.cdc.gov . Consultado el 19 de noviembre de 2024 .
- ^ abc Williams E, Seib KL, Fairley CK, Pollock GL, Hocking JS, McCarthy JS, et al. (marzo de 2024). Forrest GN (ed.). " Vacunas contra Neisseria gonorrhoeae : una visión general contemporánea". Clinical Microbiology Reviews . 37 (1): e0009423. doi :10.1128/cmr.00094-23. PMC 10938898. PMID 38226640.
- ^ Número de ensayo clínico NCT05630859 para "Seguridad y eficacia de la vacuna experimental GMMA (NgG) contra Neisseria Gonorrhoeae de GSK cuando se administra a adultos sanos de 18 a 50 años de edad" en ClinicalTrials.gov
- ^ CDC (16 de mayo de 2024). «Gonorrea resistente a los medicamentos». Gonorrea . Consultado el 20 de noviembre de 2024 .
- ^ St Cyr S, Barbee L, Workowski KA, Bachmann LH, Pham C, Schlanger K, et al. (diciembre de 2020). "Actualización de las pautas de tratamiento de los CDC para la infección gonocócica, 2020". MMWR. Informe semanal de morbilidad y mortalidad . 69 (50): 1911–1916. doi :10.15585/mmwr.mm6950a6. PMC 7745960. PMID 33332296 .
- ^ "Los médicos del Reino Unido advierten que la gonorrea se ha vuelto resistente a los fármacos". BBC News . 10 de octubre de 2011.
- ^ ab "Concientización sobre las ITS: gonorrea resistente a los antibióticos". Planned Parenthood Advocates of Arizona. 6 de marzo de 2012. Archivado desde el original el 5 de noviembre de 2012. Consultado el 6 de marzo de 2012 .
- ^ Tuddenham S, Hamill MM, Ghanem KG (enero de 2022). "Diagnóstico y tratamiento de las infecciones de transmisión sexual: una revisión". JAMA . 327 (2): 161–172. doi :10.1001/jama.2021.23487. PMID 35015033.
- ^ abcd Janeway Jr CA, Travers P, Walport M, Shlomchik MJ (2001). "El sistema del complemento y la inmunidad innata". Inmunobiología: El sistema inmunitario en la salud y la enfermedad. Quinta edición .
- ^ "gonorrea | Origen y significado de gonorrea por Diccionario Etimológico Online" www.etymonline.com . Consultado el 5 de diciembre de 2017 .
- ^ ab Singal A, Grover C (2016). Enfoque integral de las infecciones en dermatología . JP Medical. pág. 470. ISBN 978-93-5152-748-0.
- ^ Gladstein J (julio de 2005). "Chancro de Hunter: ¿el cirujano se provocó sífilis?". Clinical Infectious Diseases . 41 (1): 128, respuesta del autor 128-128, respuesta del autor 129. doi : 10.1086/430834 . PMID 15937780.
- ^ Jose PP, Vivekanandan V, Sobhanakumari K (15 de octubre de 2020). "Gonorrea: perspectiva histórica". Revista de enfermedades de la piel y de transmisión sexual . 2 (2): 110–114. doi : 10.25259/JSSTD_4_2020 . ISSN 2582-3175.
Enlaces externos
- Todar K. "Neisseriae patógena: gonorrea, oftalmía neonatal y meningitis meningocócica". Libro de texto en línea de bacteriología de Todar .
- Gonorrea en eMedicine
- "Neisseria gonorrhoeae". Navegador de taxonomía del NCBI . 485.
- Cepa tipo de Neisseria gonorrhoeae en BacDive – la base de metadatos de diversidad bacteriana
