Autoionización del agua

La autoionización del agua (también autoionización del agua , autoprotólisis del agua , autodisociación del agua o simplemente disociación del agua) es una reacción de ionización en agua pura o en una solución acuosa , en la que una molécula de agua, H 2 O, se desprotona (pierde el núcleo de uno de sus átomos de hidrógeno) para convertirse en un ion hidróxido , OH − . El núcleo de hidrógeno, H + , protona inmediatamente otra molécula de agua para formar un catión hidronio , H 3 O + . Es un ejemplo de autoprotólisis , y ejemplifica la naturaleza anfótera del agua.
Historia y notación
La autoionización del agua fue propuesta por primera vez en 1884 por Svante Arrhenius como parte de la teoría de la disociación iónica que propuso para explicar la conductividad de los electrolitos, incluido el agua. Arrhenius describió la autoionización como . En ese momento, todavía no se sabía nada sobre la estructura atómica o las partículas subatómicas, por lo que no tenía motivos para considerar que la formación de un ion a partir de un átomo de hidrógeno en la electrólisis fuera menos probable que, por ejemplo, la formación de un ion a partir de un átomo de sodio.
En 1923, Johannes Nicolaus Brønsted y Martin Lowry propusieron que la autoionización del agua en realidad involucra dos moléculas de agua: . Para entonces, se habían descubierto el electrón y el núcleo y Rutherford había demostrado que un núcleo es mucho más pequeño que un átomo. Esto incluiría un ion desnudo que correspondería a un protón con cero electrones. Brønsted y Lowry propusieron que este ion no existe libre en solución, sino que siempre se une a una molécula de agua (u otro solvente) para formar el ion hidronio (u otro solvente protonado).
Evidencias espectroscópicas posteriores han demostrado que muchos protones están hidratados por más de una molécula de agua. La notación más descriptiva para el ion hidratado es , donde aq (para acuoso) indica un número indefinido o variable de moléculas de agua. Sin embargo, las notaciones y también se siguen utilizando ampliamente debido a su importancia histórica. Este artículo representa principalmente el protón hidratado como , que corresponde a la hidratación por una sola molécula de agua.
Constante de equilibrio

El agua químicamente pura tiene una conductividad eléctrica de 0,055 μS / cm. Según las teorías de Svante Arrhenius , esto debe deberse a la presencia de iones . Los iones se producen por la reacción de autoionización del agua, que se aplica al agua pura y a cualquier solución acuosa:
- H2O + H2O⇌H3O + + OH−
Expresada con actividades químicas a , en lugar de concentraciones, la constante de equilibrio termodinámico para la reacción de ionización del agua es:
que es numéricamente igual a la constante de equilibrio termodinámico más tradicional escrita como:
bajo el supuesto de que la suma de los potenciales químicos de H + y H3O + es formalmente igual al doble del potencial químico de H2O a la misma temperatura y presión. [1]
Debido a que la mayoría de las soluciones ácido-base suelen ser muy diluidas, la actividad del agua generalmente se aproxima a ser igual a la unidad, lo que permite expresar el producto iónico del agua como: [2]
En soluciones acuosas diluidas, las actividades de los solutos (especies disueltas como los iones) son aproximadamente iguales a sus concentraciones. Por lo tanto, la constante de ionización , la constante de disociación , la constante de autoionización , la constante de producto iónico del agua o el producto iónico del agua, simbolizadas por K w , pueden expresarse mediante:
donde [H 3 O + ] es la molaridad ( concentración molar ) [3] del catión hidrógeno o ion hidronio , y [OH − ] es la concentración del ion hidróxido . Cuando la constante de equilibrio se escribe como un producto de concentraciones (en oposición a actividades), es necesario hacer correcciones al valor de en función de la fuerza iónica y otros factores (ver a continuación). [4]
A 24,87 °C y fuerza iónica cero , K w es igual a1.0 × 10 −14 . Nótese que como con todas las constantes de equilibrio, el resultado es adimensional porque la concentración es de hecho una concentración relativa al estado estándar , que para H + y OH − se definen como 1 molal (= 1 mol/kg) cuando se usa la molalidad o 1 molar (= 1 mol/L) cuando se usa la concentración molar. Para muchos propósitos prácticos, las concentraciones de molalidad (mol de soluto/kg de agua) y molar (mol de soluto/L de solución) pueden considerarse casi iguales a temperatura y presión ambiente si la densidad de la solución permanece cercana a uno ( es decir , soluciones suficientemente diluidas y efecto despreciable de los cambios de temperatura). La principal ventaja de la unidad de concentración molal (mol/kg de agua) es dar como resultado valores de concentración estables y robustos que son independientes de la densidad de la solución y los cambios de volumen (la densidad depende de la salinidad del agua ( fuerza iónica ), temperatura y presión); Por lo tanto, la molalidad es la unidad preferida utilizada en cálculos termodinámicos o en condiciones precisas o menos usuales, por ejemplo, para agua de mar con una densidad significativamente diferente de la del agua pura, [3] o a temperaturas elevadas, como las que prevalecen en las plantas de energía térmica.
También podemos definir p K w −log 10 K w (que es aproximadamente 14 a 25 °C). Esto es análogo a las notaciones pH y p K a para una constante de disociación ácida , donde el símbolo p denota un cologaritmo . La forma logarítmica de la ecuación de la constante de equilibrio es p K w = pH + pOH.
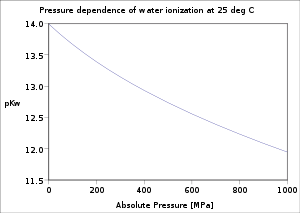
Dependencia de la temperatura, presión y fuerza iónica
Se ha investigado exhaustivamente la dependencia de la ionización del agua con respecto a la temperatura y la presión. [5] El valor de p K w disminuye a medida que aumenta la temperatura desde el punto de fusión del hielo hasta un mínimo de aproximadamente 250 °C, después de lo cual aumenta hasta el punto crítico del agua de aproximadamente 374 °C. Disminuye con el aumento de la presión.
| Temperatura | Presión [7] | pKw |
|---|---|---|
| 0 °C | 0,10 MPa | 14,95 |
| 25 °C | 0,10 MPa | 13,99 |
| 50 °C | 0,10 MPa | 13.26 |
| 75 °C | 0,10 MPa | 12,70 |
| 100 °C | 0,10 MPa | 12.25 |
| 150 °C | 0,47 MPa | 11.64 |
| 200 °C | 1,5 MPa | 11.31 |
| 250 °C | 4,0 MPa | 11.20 |
| 300 °C | 8,7 MPa | 11.34 |
| 350 °C | 17 MPa | 11,92 |
En el caso de las soluciones electrolíticas , el valor de p K w depende de la fuerza iónica del electrolito. Los valores de cloruro de sodio son típicos para un electrolito 1:1. En el caso de electrolitos 1:2, MX 2 , p K w disminuye con el aumento de la fuerza iónica. [8]
El valor de Kw suele ser de interés en la fase líquida . En la tabla se ofrecen valores de ejemplo para vapor (gas) sobrecalentado y fluido de agua supercrítica .
Comparación de valores p K w para agua líquida, vapor sobrecalentado y agua supercrítica. [1] Temperatura.Presión350 °C 400 °C 450 °C 500 °C 600 °C 800 °C 0,1 MPa 47.961 b 47.873 b 47.638 b 46.384b 40.785 b 17 MPa 11.920 (líquido) a 25 MPa 11.551 (líquido) c 16.566 18.135 18.758 19.425 20.113 100 MPa 10.600 (líquido) c 10.744 11.005 11.381 12.296 13.544 1000 MPa 8.311 (líquido) c 8.178 8.084 8.019 7.952 7.957
- Notas a la tabla. Los valores corresponden a fluido supercrítico excepto los marcados: a presión de saturación correspondiente a 350 °C. b vapor sobrecalentado. c líquido comprimido o subenfriado .
Efectos isotópicos
El agua pesada , D2O , se autoioniza menos que el agua normal, H2O ;
- D 2 O + D 2 O ⇌ D 3 O + + OD −
Esto se debe al efecto isotópico de equilibrio , un efecto mecánico cuántico atribuido al oxígeno que forma un enlace ligeramente más fuerte con el deuterio porque la mayor masa de deuterio da como resultado una energía de punto cero más baja .
Expresada con actividades a , en lugar de concentraciones, la constante de equilibrio termodinámico para la reacción de ionización de agua pesada es:
[9] Suponiendo que la actividad del D 2 O es 1, y suponiendo que las actividades del D 3 O + y OD − se aproximan estrechamente por sus concentraciones
La siguiente tabla compara los valores de p K w para H 2 O y D 2 O. [10]
Valores de p K w para agua pura Temperatura 10 20 25 30 40 50 H2O 14.535 14.167 13.997 13.830 13.535 13.262 D2O 15.439 15.049 14.869 14.699 14.385 14.103
Equilibrios de ionización en mezclas de agua y agua pesada
En los equilibrios de mezclas agua-agua pesada intervienen varias especies: H 2 O, HDO, D 2 O, H 3 O + , D 3 O + , H 2 DO + , HD 2 O + , HO − , DO − .
Mecanismo
La velocidad de reacción para la reacción de ionización.
- 2H2O → H3O + + OH −
depende de la energía de activación , Δ E ‡ . Según la distribución de Boltzmann la proporción de moléculas de agua que tienen suficiente energía, debido a la población térmica, está dada por
donde k es la constante de Boltzmann . Por lo tanto, puede ocurrir cierta disociación porque hay suficiente energía térmica disponible. La siguiente secuencia de eventos se ha propuesto sobre la base de fluctuaciones del campo eléctrico en agua líquida. [11] Las fluctuaciones aleatorias en los movimientos moleculares ocasionalmente (aproximadamente una vez cada 10 horas por molécula de agua [12] ) producen un campo eléctrico lo suficientemente fuerte como para romper un enlace oxígeno-hidrógeno , lo que resulta en un hidróxido (OH − ) y un ion hidronio (H 3 O + ); el núcleo de hidrógeno del ion hidronio viaja a lo largo de las moléculas de agua por el mecanismo de Grotthuss y un cambio en la red de enlaces de hidrógeno en el solvente aísla los dos iones, que se estabilizan por solvatación. Sin embargo, dentro de 1 picosegundo , una segunda reorganización de la red de enlaces de hidrógeno permite una rápida transferencia de protones a través de la diferencia de potencial eléctrico y la posterior recombinación de los iones. Esta escala de tiempo es consistente con el tiempo que tardan los enlaces de hidrógeno en reorientarse en el agua. [13] [14] [15]
La reacción de recombinación inversa
- H3O + + OH− → 2H2O
es una de las reacciones químicas más rápidas conocidas, con una constante de velocidad de reacción de1,3 × 10 11 M −1 s −1 a temperatura ambiente. Una velocidad tan rápida es característica de una reacción controlada por difusión , en la que la velocidad está limitada por la velocidad de difusión molecular . [16]
Relación con el punto neutro del agua
Las moléculas de agua se disocian en cantidades iguales de H 3 O + y OH − , por lo que sus concentraciones son casi exactamente1,00 × 10 −7 mol dm −3 a 25 °C y 0,1 MPa. Una solución en la que las concentraciones de H 3 O + y OH − son iguales se considera una solución neutra . En general, el pH del punto neutro es numéricamente igual a 1/2 pKw .
El agua pura es neutra, pero la mayoría de las muestras de agua contienen impurezas. Si una impureza es un ácido o una base , esto afectará las concentraciones de iones hidronio e hidróxido. Las muestras de agua que están expuestas al aire absorberán algo de dióxido de carbono para formar ácido carbónico (H 2 CO 3 ) y la concentración de H 3 O + aumentará debido a la reacción H 2 CO 3 + H 2 O = HCO 3 − + H 3 O + . La concentración de OH − disminuirá de tal manera que el producto [H 3 O + ][OH − ] permanece constante para temperatura y presión fijas. Por lo tanto, estas muestras de agua serán ligeramente ácidas. Si se requiere un pH de exactamente 7,0, debe mantenerse con una solución tampón adecuada .
Véase también
- Reacción ácido-base
- Equilibrio químico
- Autoionización molecular (de varios disolventes)
- Electrodo de hidrógeno estándar
Referencias
- ^ ab "Publicación sobre la constante de ionización del H2O" (PDF) . Lucerna : Asociación Internacional para las Propiedades del Agua y el Vapor. Agosto de 2007.
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "autoprotolysis constant". doi :10.1351/goldbook.A00532
- ^ ab Stumm, Werner; Morgan, James (1996). Química acuática. Equilibrios químicos y tasas en aguas naturales (3.ª ed.). John Wiley & Sons, Inc. ISBN 9780471511847.
- ^ Harned, HS; Owen, BB (1958). La química física de las soluciones electrolíticas (3.ª ed.). Nueva York: Reinhold. págs. 635.
- ^ Asociación Internacional para las Propiedades del Agua y el Vapor (IAPWS)
- ^ Bandura, Andrei V.; Lvov, Serguei N. (2006). "La constante de ionización del agua en amplios rangos de temperatura y densidad" (PDF) . Journal of Physical and Chemical Reference Data . 35 (1): 15–30. Bibcode :2006JPCRD..35...15B. doi :10.1063/1.1928231.
- ^ 0,1 MPa para T < 100 °C . Presión de saturación para T > 100 °C .
- ^ Harned, HS; Owen, BB (1958). La química física de las soluciones electrolíticas (3.ª ed.). Nueva York: Reinhold. págs. 634–649, 752–754.
- ^ John, Peter. «Molaridad vs. molalidad» . Consultado el 26 de septiembre de 2023 .
- ^ Lide, DR, ed. (1990). Manual de química y física del CRC (70.ª edición). Boca Raton (FL): CRC Press. ISBN 978-0-8493-0471-2.
- ^ Geissler, PL; Dellago, C.; Chandler, D.; Hutter, J.; Parrinello, M. (2001). "Autoionización en agua líquida". Science . 291 (5511): 2121–2124. Bibcode :2001Sci...291.2121G. CiteSeerX 10.1.1.6.4964 . doi :10.1126/science.1056991. PMID 11251111.
- ^ Eigen, M.; De Maeyer, L. (1955). "Untersuchungen über die Kinetik der Neutralization I" [Investigaciones sobre la cinética de la neutralización I]. Z. Elektrochem . 59 : 986.
- ^ Stillinger, FH (1975). "Teoría y modelos moleculares del agua". Avances en física química . Vol. 31. págs. 1–101. doi :10.1002/9780470143834.ch1. ISBN . 9780470143834.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Rapaport, DC (1983). "Enlaces de hidrógeno en el agua". Mol. Phys. 50 (5): 1151–1162. Código Bibliográfico :1983MolPh..50.1151R. doi :10.1080/00268978300102931.
- ^ Chen, S.-H.; Teixeira, J. (1986). Estructura y dinámica del agua a baja temperatura estudiada mediante técnicas de dispersión . Avances en física química. Vol. 64. págs. 1–45. doi :10.1002/9780470142882.ch1. ISBN. 9780470142882.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Tinoco, I.; Sauer, K.; Wang, JC (1995). Química física: principios y aplicaciones en las ciencias biológicas (3.ª ed.). Prentice-Hall. pág. 386. ISBN 978-0-13-435850-5.
Enlaces externos
- Química general – Autoionización del agua










![{\displaystyle K_{\rm {w}}=[{\rm {H_{3}O^{+}}}][{\rm {OH^{-}}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/86dca39006c4f875cacc14395c7ff6e38a09d990)





![{\displaystyle K_{\rm {w}}=[{\rm {D_{3}O^{+}}}][{\rm {OD^{-}}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1d7bac103d47e7740413a796f0347b2bf98fda2c)

