Indiplon
 | |
| Datos clínicos | |
|---|---|
| Vías de administración | Oral |
| Código ATC |
|
| Datos farmacocinéticos | |
| Vida media de eliminación | 1,5–1,8 horas |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh |
|
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.133.676 |
| Datos químicos y físicos | |
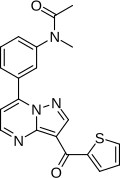
| Fórmula | C20H16N4O2S |
| Masa molar | 376,43 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
 norte norte Y (¿que es esto?) (verificar) Y (¿que es esto?) (verificar) | |
Indiplon ( INN y USAN ) es un sedante hipnótico no benzodiazepínico que se desarrolló en dos formulaciones: una de liberación inmediata para el inicio del sueño y una versión de liberación modificada (también llamada liberación controlada o liberación prolongada) para el mantenimiento del sueño.
Farmacología
Farmacodinamia
El indiplon actúa potenciando la acción del neurotransmisor inhibidor GABA , como la mayoría de los sedantes no benzodiazepínicos. Se une principalmente a las subunidades α1 de los receptores GABA A en el cerebro. [1]
Farmacocinética
Indiplon tiene una vida media de eliminación corta de 1,5 a 1,8 horas en sujetos jóvenes y ancianos, respectivamente. [2]
Historia
Indiplon fue descubierto en Lederle Laboratories (que luego fue adquirido por Wyeth ) en la década de 1980 y se llamó CL 285,489. [3] : 454 En 1998, Lederle lo licenció, junto con otros candidatos a fármacos en etapa inicial, a DOV Pharmaceutical , una startup formada por ex empleados de Lederle, y Dov sublicencia exclusivamente sus derechos en el fármaco a Neurocrine Biosciences en ese mismo año. [3] En 2002, Neurocrine firmó un acuerdo con Pfizer para desarrollar el fármaco. [3]
El lanzamiento de Indiplon estaba previsto originalmente para 2007, cuando el popular hipnótico zolpidem de Sanofi-Aventis perdió sus derechos de patente en los Estados Unidos y, por lo tanto, pasó a estar disponible como un genérico mucho más económico. En 2002, Neurocrine Biosciences había firmado un acuerdo con Pfizer para comercializar conjuntamente indiplon en los EE. UU., en un acuerdo por un valor potencial de 400 millones de dólares. [4] Sin embargo, tras la emisión de una carta de no aprobación para la formulación de liberación modificada de 15 mg y una carta de aprobación con estipulaciones para la versión de liberación inmediata de 5 mg y 10 mg por parte de la FDA en mayo de 2006, [5] Pfizer puso fin a su relación con Neurocrine. [6] El precio de las acciones de Neurocrine cayó un 60% tras la noticia. [7]
En diciembre de 2007 , tras una nueva presentación, la FDA consideró que la solicitud de nuevo fármaco (NDA) de Neurocrine era "aprobable" en las formulaciones de 5 y 10 mg, [8] pero solicitó nuevos estudios como requisito previo para la aprobación, incluido un ensayo clínico en ancianos, un estudio de seguridad que compare los efectos adversos con los de fármacos comercializados de manera similar y un estudio preclínico que examine la seguridad de indiplon en el tercer trimestre del embarazo. [9]
Tras la carta de la FDA de 2007, Neurocrine decidió interrumpir todo desarrollo clínico y comercial de Indiplon en los Estados Unidos. [8] [9]
Referencias
- ^ Petroski RE, Pomeroy JE, Das R, Bowman H, Yang W, Chen AP, Foster AC (abril de 2006). "Indiplon es un modulador alostérico positivo de alta afinidad con selectividad para los receptores GABAA que contienen la subunidad alfa1" (PDF) . The Journal of Pharmacology and Experimental Therapeutics . 317 (1): 369–77. doi :10.1124/jpet.105.096701. PMID 16399882. S2CID 46510829.
- ^ Lemon MD, Strain JD, Hegg AM, Farver DK (septiembre de 2009). "Indiplon en el tratamiento del insomnio". Diseño, desarrollo y terapia de fármacos . 3 : 131–142. doi : 10.2147/dddt.s3207 . PMC 2769245. PMID 19920929 .
- ^ abc Neubauer DN (2010). "Indiplon". En Monti JS, Pandi-Perumal SR, Möhler H (eds.). GABA y sueño: aspectos moleculares, funcionales y clínicos . Medios de ciencia y negocios de Springer. págs. 453–464. ISBN 9783034602266.
- ^ "Neurocrine Biosciences de San Diego logra su segundo gran acuerdo en dos días". The Motley Fool . 18 de junio de 2010.
- ^ "La pesadilla de la FDA para Neurocrine". TheStreet.com . 16 de mayo de 2006.
- ^ "Pfizer abandona acuerdo con Neurocrine". TheStreet.com . 22 de junio de 2006.
- ^ "El precio de las acciones de Neurocrine se desploma un 60 por ciento: la revisión mixta de la FDA sobre la pastilla para dormir Indiplon podría amenazar la asociación Pfizer-Neurocrine". CNN Money . 15 de mayo de 2006.
- ^ ab "Neurocrine recibe carta de aprobación para cápsulas de Indiplon con datos adicionales de seguridad y eficacia requeridos por la FDA" (Comunicado de prensa). Neurocrine Biosciences, Inc. 2007-12-13 . Consultado el 2007-12-13 .
- ^ ab "Proyectos de oleoductos adicionales". Neurocrine. 16 de febrero de 2012. Archivado desde el original el 27 de marzo de 2012. Consultado el 24 de junio de 2014 .
Enlaces externos
- Comunicado de prensa de 2004 que anuncia el nuevo producto de Neurocrine, Indiplon
- Entrada en GenomeNet: D02640