Hidrogenación por transferencia
En química , la hidrogenación por transferencia es una reacción química que implica la adición de hidrógeno a un compuesto de una fuente distinta del H2 molecular . Se aplica en síntesis orgánica industrial y de laboratorio para saturar compuestos orgánicos y reducir cetonas a alcoholes e iminas a aminas . Evita la necesidad de H2 molecular de alta presión utilizado en la hidrogenación convencional . La hidrogenación por transferencia suele producirse en condiciones de temperatura y presión moderadas utilizando catalizadores orgánicos u organometálicos , muchos de los cuales son quirales , lo que permite una síntesis asimétrica eficiente . Utiliza compuestos donantes de hidrógeno como el ácido fórmico , el isopropanol o el dihidroantraceno , deshidrogenándolos a CO2 , acetona o antraceno respectivamente. [1] A menudo, las moléculas donantes también funcionan como disolventes para la reacción. Una aplicación a gran escala de la hidrogenación por transferencia es la licuefacción del carbón utilizando "disolventes donantes" como la tetralina . [2] [3]
Catalizadores organometálicos
En el área de la síntesis orgánica , se ha desarrollado una familia útil de catalizadores de transferencia de hidrógeno basados en complejos de rutenio y rodio , a menudo con ligandos de diamina y fosfina . [4] Un precursor de catalizador representativo se deriva del dímero de dicloruro de (cimeno)rutenio y la difeniletilendiamina tosilada . Estos catalizadores se emplean principalmente para la reducción de cetonas e iminas a alcoholes y aminas , respectivamente. El donante de hidrógeno (agente de transferencia) es típicamente isopropanol , que se convierte en acetona tras la donación de hidrógeno. Las hidrogenaciones de transferencia pueden proceder con altas enantioselectividades cuando el material de partida es proquiral :
donde RR'C*H−OH es un producto quiral. Un catalizador típico es (cimeno) R,R -HNCHPhCHPhNTs , donde Ts se refiere a un grupo tosilo ( SO 2 C 6 H 4 Me ) y R,R se refiere a la configuración absoluta de los dos centros de carbono quirales. Este trabajo fue reconocido con el Premio Nobel de Química de 2001 a Ryōji Noyori . [5]
Otra familia de agentes de transferencia de hidrógeno son aquellos basados en alcóxidos de aluminio, como el isopropóxido de aluminio en la reducción MPV ; sin embargo, sus actividades son relativamente bajas en comparación con los sistemas basados en metales de transición.

La hidrogenación asimétrica catalítica de cetonas se demostró con complejos de BINAP basados en rutenio . [6] [7]
Aunque el catalizador de dihaluro de Ru-BINAP podía reducir cetonas funcionalizadas, la hidrogenación de cetonas simples seguía sin resolverse. Este desafío se resolvió con precatalizadores del tipo RuCl 2 ( difosfano ) (diamina). [8] Estos catalizadores reducen preferentemente cetonas y aldehídos, sin afectar a las olefinas y muchos otros sustituyentes.

Rutas sin metales
Antes del desarrollo de la hidrogenación catalítica, se desarrollaron muchos métodos para la hidrogenación de sustratos insaturados. Muchos de estos métodos solo tienen interés histórico y pedagógico. Un agente de hidrogenación de transferencia destacado es la diimida o (NH) 2 , también llamada diazeno. Este se oxida al muy estable N 2 :
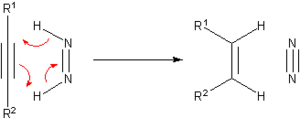
La diimida se puede generar a partir de hidrazina o de ciertos otros precursores orgánicos.
Dos hidrocarburos que pueden servir como donantes de hidrógeno son el ciclohexeno o el ciclohexadieno . En este caso, se forma un alcano , junto con un benceno . La ganancia de energía de estabilización aromática cuando se forma el benceno es la fuerza impulsora de la reacción. Se puede utilizar Pd como catalizador y se emplea una temperatura de 100 °C. Se han descrito hidrogenaciones por transferencia más exóticas, incluida esta intramolecular:

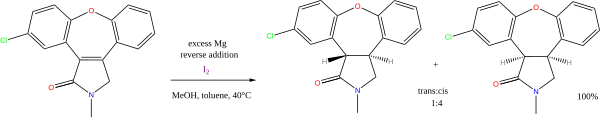
Existen muchas reacciones con alcohol o aminas como donantes de protones y metales alcalinos como donantes de electrones. De valor continuo es la reducción de Birch mediada por metal sodio de arenos (otro nombre para hidrocarburos aromáticos ). Menos importante actualmente es la reducción de Bouveault-Blanc de ésteres. La combinación de magnesio y metanol se utiliza en reducciones de alquenos, por ejemplo, la síntesis de asenapina : [11]
Hidrogenación por transferencia organocatalítica
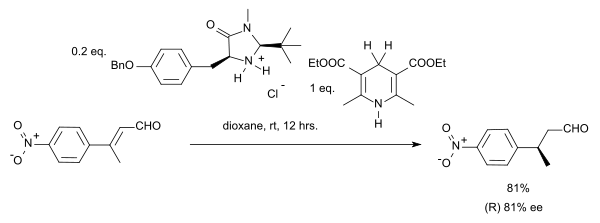
La hidrogenación por transferencia organocatalítica ha sido descrita por el grupo de List en 2004 en un sistema con un éster Hantzsch como donante de hidruro y un catalizador de amina: [12]
En esta reacción particular, el sustrato es un compuesto carbonílico α,β-insaturado . El donador de protones se oxida a la forma de piridina y se asemeja a la coenzima NADH , bioquímicamente relevante . En el ciclo catalítico de esta reacción, la amina y el aldehído primero forman un ion iminio , luego la transferencia de protones es seguida por la hidrólisis del enlace iminio, regenerando el catalizador. Al adoptar un organocatalizador MacMillan de imidazolidinona quiral, se obtuvo una enantioselectividad de 81% ee :
[13]
En un caso de estereoconvergencia , tanto el isómero E como el isómero Z en esta reacción producen el enantiómero (S) .
Para ampliar el alcance de esta reacción hacia las cetonas o más bien hacia las enonas es necesario ajustar con precisión el catalizador (añadir un grupo bencilo y reemplazar el grupo t-butilo por un furano ) y el éster de Hantzsch (añadir grupos t-butilo más voluminosos): [14]
Con otro organocatalizador, también se puede lograr la hidrogenación de iminas . Una reacción en cascada es catalizada por un ácido fosfórico quiral : [15]
La reacción se lleva a cabo a través de un ion iminio quiral . Los catalizadores tradicionales basados en metales y la hidrogenación de sustratos aromáticos o heteroaromáticos tienden a fallar.
Véase también
- Reducción de Meerwein-Ponndorf-Verley
- Oxidación de Oppenauer
- Deshidrogenación
- Hidrogenación
- Hidrogenólisis
- Préstamo de hidrógeno
Referencias
- ^ Wang, Dong; Astruc, Didier (2015). "La edad de oro de la hidrogenación por transferencia". Chem. Rev. 115 ( 13): 6621–6686. doi :10.1021/acs.chemrev.5b00203. ISSN 0009-2665.
- ^ Speight, JG "La química y la tecnología del carbón" Marcel Dekker; Nueva York, 1983; pág. 226 y siguientes. ISBN 0-8247-1915-8 .
- ^ Muñiz, Kilian (2005). "Catálisis bifuncional metal-ligando: hidrogenaciones y nuevas reacciones dentro del andamiaje metal-(di)amina13". Angewandte Chemie International Edition . 44 (41): 6622–6627. doi :10.1002/anie.200501787. PMID 16187395.
- ^ T. Ikariya, K. Murata, R. Noyori "Catalizadores moleculares basados en metales de transición bifuncionales para síntesis asimétricas" Org. Biomol. Chem., 2006, volumen 4, 393-406.
- ^ Shimizu, H., Nagasaki, I., Matsumura, K., Sayo, N. y Saito, T. "Desarrollos en hidrogenación asimétrica desde una perspectiva industrial" Acc. Chem. Res. 2007, vol. 40, págs. 1385-1393. doi :10.1021/ar700101x
- ^ Mashima, K.; Kusano, K.-h.; Sato, N.; Matsumura, Y.-i.; Nozaki, K.; Kumobayashi, H.; Sayo, N.; Hori, Y.; Ishizaki, T. (1994), "Complejos de haluro catiónicos BINAP -Ru(II): catalizadores altamente eficientes para la hidrogenación asimétrica estereoselectiva de cetonas α- y β-funcionalizadas", The Journal of Organic Chemistry , 59 (11): 3064–3076, doi :10.1021/jo00090a026
- ^ Kitamura, M.; Ohkuma, T.; Inoue, S.; Sayo, N.; Kumobayashi, H.; Akutagawa, S.; Ohta, T.; Takaya, H.; Noyori, R. (1988), "Hidrogenación asimétrica homogénea de cetonas funcionalizadas", Journal of the American Chemical Society , 110 (2): 629–631, doi :10.1021/ja00210a070
- ^ Noyori, R.; Ohkuma, T. (2001), "Catálisis asimétrica mediante ingeniería molecular funcional y arquitectónica: hidrogenación estereoselectiva y quimioselectiva práctica de cetonas", Angewandte Chemie International Edition , 40 (1): 40–73, doi : 10.1002/1521-3773(20010105)40:1<40::aid-anie40>3.0.co;2-5 , PMID 11169691
- ^ Dub, Pavel A.; Gordon, John C. (2018). "El papel de la funcionalidad N–H unida al metal en los catalizadores moleculares de tipo Noyori". Nature Reviews Chemistry . 2 (12): 396–408. doi :10.1038/s41570-018-0049-z. S2CID 106394152.
- ^ MM Midland (1989). "Reducciones asimétricas con reactivos de organoborano". Chemical Reviews . 89 (7): 1553–1561. doi :10.1021/cr00097a010.
- ^ Tilo, MVD; Roeters, T.; Harting, R.; Stokkingreef, E.; Gelpke, AS; Kemperman, G. (2008). "Desaceleración de la ruta de síntesis de asenapina". Investigación y desarrollo de procesos orgánicos . 12 (2): 196–201. doi :10.1021/op700240c.
- ^ Yang; Hechavarria Fonseca, M.; List, B. (2004). "Una hidrogenación por transferencia sin metales: reducción conjugada organocatalítica de aldehídos alfa, beta-insaturados". Angewandte Chemie International Edition en inglés . 43 (48): 6660–6662. doi : 10.1002/anie.200461816 . PMID 15540245.
- ^ Ouellet; Tuttle, J.; MacMillan, D. (2005). "Reducción de hidruros organocatalíticos enantioselectivos". Revista de la Sociedad Química Americana . 127 (1): 32–33. doi :10.1021/ja043834g. PMID 15631434.
- ^ Tuttle; Ouellet, S.; MacMillan, D. (2006). "Hidrogenación por transferencia organocatalítica de enonas cíclicas" (PDF) . Revista de la Sociedad Química Americana . 128 (39): 12662–12663. doi :10.1021/ja0653066. PMID 17002356. S2CID 12456921.
- ^ Rueping; Antonchick, A.; Theissmann, T. (2006). "Una reacción en cascada catalizada por ácido de Brønsted altamente enantioselectiva: hidrogenación por transferencia organocatalítica de quinolinas y su aplicación en la síntesis de alcaloides". Angewandte Chemie International Edition en inglés . 45 (22): 3683–3686. doi :10.1002/anie.200600191. PMID 16639754.