Organocatálisis

En química orgánica , la organocatálisis es una forma de catálisis en la que se aumenta la velocidad de una reacción química mediante un catalizador orgánico . Este "organocatalizador" está compuesto de carbono , hidrógeno , azufre y otros elementos no metálicos que se encuentran en los compuestos orgánicos. [3] [4] [5] [6] [7] [8] Debido a su similitud en composición y descripción, a menudo se los confunde con enzimas debido a sus efectos comparables en las velocidades de reacción y las formas de catálisis involucradas.
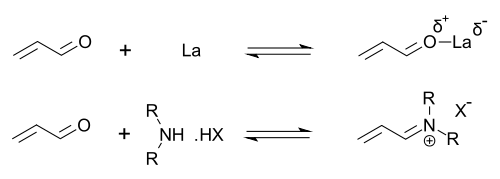
Los organocatalizadores que muestran funcionalidad de amina secundaria pueden describirse como catalizadores que realizan catálisis de enamina (formando cantidades catalíticas de un nucleófilo de enamina activo ) o catálisis de iminio (formando cantidades catalíticas de un electrófilo de iminio activado). Este mecanismo es típico de la organocatálisis covalente. La unión covalente del sustrato normalmente requiere una carga elevada de catalizador (para la catálisis de prolina, normalmente un 20-30 % molar). Las interacciones no covalentes, como los enlaces de hidrógeno, facilitan cargas bajas de catalizador (hasta un 0,001 % molar).
La organocatálisis ofrece varias ventajas. No es necesaria la catálisis a base de metales, por lo que contribuye a la química verde . En este contexto, se han utilizado ácidos orgánicos simples como catalizadores para la modificación de la celulosa en agua a escala de varias toneladas. [9] Cuando el organocatalizador es quiral , se abre una vía para la catálisis asimétrica ; por ejemplo, el uso de prolina en reacciones aldólicas es un ejemplo de quiralidad y química verde. [10] Los químicos orgánicos David MacMillan y Benjamin List recibieron el Premio Nobel de Química 2021 por su trabajo sobre la organocatálisis asimétrica. [11]
Introducción
Los organocatalizadores aquirales regulares se basan en nitrógeno, como la piperidina utilizada en la condensación de Knoevenagel . [12] El DMAP utilizado en esterificaciones [13] y el DABCO utilizado en la reacción de Baylis-Hillman . [14] Las sales de tiazolio se emplean en la reacción de Stetter . Estos catalizadores y reacciones tienen una larga historia, pero el interés actual en la organocatálisis se centra en la catálisis asimétrica con catalizadores quirales, llamada organocatálisis asimétrica u organocatálisis enantioselectiva . Una reacción pionera desarrollada en la década de 1970 se llama reacción de Hajos-Parrish-Eder-Sauer-Wiechert . Entre 1968 y 1997, solo hubo unos pocos informes del uso de pequeñas moléculas orgánicas como catalizadores para reacciones asimétricas (la reacción de Hajos-Parrish probablemente sea la más famosa), pero estos estudios químicos se vieron más como reacciones químicas únicas que como partes integrales de un campo más grande e interconectado. [15]
En esta reacción, la prolina quiral natural es el catalizador quiral en una reacción aldólica . El material de partida es una tricetona aquiral y se requiere solo un 3 % de prolina para obtener el producto de reacción, un cetol en un exceso enantiomérico del 93 % . Este es el primer ejemplo de una reacción aldólica asimétrica catalizada por aminoácidos. [16] [17]
La síntesis asimétrica de la cetona de Wieland-Miescher (1985) también se basa en la prolina y otra aplicación temprana fue una de las transformaciones en la síntesis total de eritromicina por Robert B. Woodward (1981). [18] Un artículo de resumen de mini-revisión se centra en ejemplos recientes seleccionados de síntesis total de productos naturales y farmacéuticos utilizando reacciones organocatalíticas. [19]
Muchos organocatalizadores quirales son una adaptación de ligandos quirales (que junto con un centro metálico también catalizan reacciones asimétricas) y ambos conceptos se superponen hasta cierto punto.
Un gran avance en el campo de la organocatálisis se produjo en 1997 cuando Yian Shi informó sobre la primera reacción organocatalítica general altamente enantioselectiva con la epoxidación asimétrica catalítica de olefinas trans y trisustituidas con dioxiranos quirales. [20] Desde entonces, se han desarrollado varios tipos diferentes de reacciones.
Clases de organocatalizadores
Los organocatalizadores para síntesis asimétrica se pueden agrupar en varias clases:
- Biomoléculas : prolina , fenilalanina . Aminas secundarias en general. [21] Los alcaloides de la quina , ciertos oligopéptidos .
- Catalizadores sintéticos derivados de biomoléculas.
- Catalizadores de unión de hidrógeno , incluidos TADDOLS , derivados de BINOL como NOBIN y organocatalizadores basados en tioureas.
- Sales de triazolio como catalizadores de reacción de Stetter de próxima generación
Ejemplos de reacciones asimétricas que involucran organocatalizadores son:
- Reacciones asimétricas de Diels-Alder
- Reacciones de Michael asimétricas
- Reacciones asimétricas de Mannich
- Epoxidación de Shi
- Hidrogenación por transferencia organocatalítica
Prolina
Se ha revisado la catálisis de prolina. [22] [23]
Organocatálisis de imidazolidinona
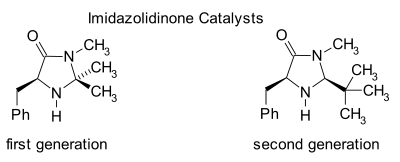
Las imidazolidinonas son catalizadores de muchas transformaciones, como las reacciones asimétricas de Diels-Alder y las adiciones de Michael . Los catalizadores quirales inducen reacciones asimétricas , a menudo con altas enantioselectividades. Este catalizador funciona formando un ion iminio con grupos carbonilo de aldehídos α,β-insaturados ( enales ) y enonas en un rápido equilibrio químico . Esta activación del iminio es similar a la activación de los grupos carbonilo por un ácido de Lewis y ambos catalizadores reducen el LUMO del sustrato : [24] [25]
El intermediario transitorio de iminio es quiral y se transfiere al producto de reacción mediante inducción quiral . Los catalizadores se han utilizado en reacciones de Diels-Alder , adiciones de Michael , alquilaciones de Friedel-Crafts , hidrogenaciones por transferencia y epoxidaciones .
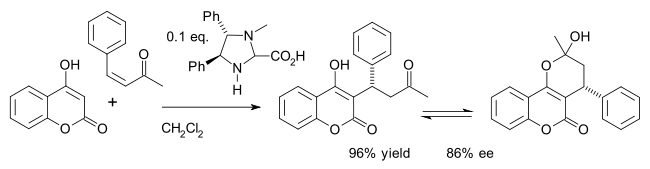
Un ejemplo es la síntesis asimétrica del fármaco warfarina (en equilibrio con el hemicetal ) en una adición de Michael de 4-hidroxicumarina y bencilidenoacetona : [26]
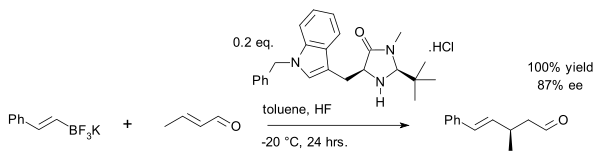
Una hazaña reciente es la alquilación de vinilo de crotonaldehído con una sal organotrifluoroborato : [27]
Para otros ejemplos de su uso: véase hidrogenación por transferencia organocatalítica y reacciones asimétricas de Diels-Alder .
Organocatálisis de tiourea
Un gran grupo de organocatalizadores incorporan la urea o la fracción tiourea . Estos derivados de (tio)urea catalíticamente eficaces, denominados organocatalizadores de (tio)urea, proporcionan interacciones explícitas de doble enlace de hidrógeno para coordinar y activar sustratos que aceptan enlaces de hidrógeno. [28]
Sus usos actuales están restringidos a reacciones multicomponentes asimétricas, incluidas aquellas que involucran adición de Michael, reacciones multicomponentes asimétricas para la síntesis de espirociclos, reacciones multicomponentes asimétricas que involucran reacciones de Strecker de acilo, reacciones asimétricas de Petasis, reacciones asimétricas de Biginelli, reacciones asimétricas de Mannich, reacciones asimétricas de aza-Henry y reacciones de acoplamiento reductivo asimétrico. [29]
Referencias
- ^ Justus von Liebig, Justus (1860). "Ueber die Bildung des Oxamids aus Cyan". Annalen der Chemie und Pharmacie . 113 (2): 246–247. doi :10.1002/jlac.18601130213.
- ^ W. Langenbeck (1929). "Über organische Katalysatoren. III. Die Bildung von Oxamid aus Dicyan bei Gegenwart von Aldehyden". Liebigs Ann . 469 : 16-25. doi :10.1002/jlac.19294690103.
- ^ Berkessel, A.; Groeger, H. (2005). Organocatálisis Asimétrica . Weinheim: Wiley-VCH. ISBN 978-3-527-30517-9.
- ^ Número especial: List, Benjamin (2007). "Organocatálisis". Chem. Rev. 107 ( 12): 5413–5883. doi : 10.1021/cr078412e .
- ^ Peter I. Dalko; Lionel Moisan (2004). "En la edad de oro de la organocatálisis". Angew. Chem. Int. Ed . 43 (39): 5138–5175. doi :10.1002/anie.200400650. PMID 15455437.
- ^ Matthew J. Gaunt; Carin CC Johansson; Andy McNally; Ngoc T. Vo (2007). "Organocatálisis enantioselectiva". Drug Discovery Today . 12 (1/2): 8–27. doi :10.1016/j.drudis.2006.11.004. PMID 17198969.
- ^ Dieter Enders; Christoph Grondal; Matthias RM Hüttl (2007). "Reacciones dominó organocatalíticas asimétricas". Angew. Chem. Int. Ed . 46 (10): 1570–1581. doi :10.1002/anie.200603129. PMID 17225236.
- ^ Peter I. Dalko; Lionel Moisan (2001). "Organocatálisis enantioselectiva". Angew. Chem. Int. Ed . 40 (20): 3726–3748. doi :10.1002/1521-3773(20011015)40:20<3726::AID-ANIE3726>3.0.CO;2-D. PMID 11668532.
- ^ Patente Internacional WO 2006068611 A1 20060629 "Modificación directa homogénea y heterogénea de aminas y alcoholes catalizada por ácidos orgánicos y aminoácidos" Inventores: Armando Córdova, Estocolmo, Suecia; Jonas Hafrén, Estocolmo, Suecia.
- ^ Ejemplo 4 en la patente de EE. UU. 3.975.440 del 17 de agosto de 1976, presentada el 9 de diciembre de 1970 Zoltan G. Hajos y David R. Parrish.
- ^ «Premio Nobel de Química 2021». Premio Nobel . Consultado el 6 de octubre de 2021 .
- ^ List, B. (2010). "Emil Knoevenagel y las raíces de la aminocatálisis". Angewandte Chemie International Edition en inglés . 49 (10): 1730–1734. doi :10.1002/anie.200906900. PMID 20175175.
- ^ Neises, Bernhard; Steglich, Wolfgang (julio de 1978). "Método simple para la esterificación de ácidos carboxílicos". Angewandte Chemie International Edition en inglés . 17 (7): 522–524. doi :10.1002/anie.197805221.
- ^ Basavaiah, Deevi; Rao, Anumolu Jaganmohan; Satyanarayana, Tummanapalli (marzo de 2003). "Avances recientes en la reacción y aplicaciones de Baylis-Hillman". Reseñas químicas . 103 (3): 811–892. doi :10.1021/cr010043d. PMID 12630854.
- ^ MacMillan, David WC (2008). "El advenimiento y desarrollo de la organocatálisis". Nature . 455 (7211). Springer Science and Business Media LLC: 304–308. Bibcode :2008Natur.455..304M. doi :10.1038/nature07367. ISSN 0028-0836. PMID 18800128. S2CID 205215034.
- ^ ZG Hajos, DR Parrish, Patente alemana DE 2102623 1971
- ^ Zoltan G. Hajos; David R. Parrish (1974). "Síntesis asimétrica de intermediarios bicíclicos de la química de productos naturales". J. Org. Chem . 39 (12): 1615–1621. doi :10.1021/jo00925a003.
- ^ RB Woodward; E. Logusch; KP Nambiar; K. Sakan; DE Ward; BW Au-Yeung; P. Balaram; LJ Browne; et al. (1981). "Síntesis total asimétrica de eritromcina. 1. Síntesis de un derivado secoácido de eritronolida A mediante inducción asimétrica". J. Am. Chem. Soc . 103 (11): 3210–3213. doi :10.1021/ja00401a049.
- ^ B. -F. Sun (2015). "Síntesis total de productos naturales y farmacéuticos impulsada por reacciones organocatalíticas". Tetrahedron Lett . 56 (17): 2133–2140. doi : 10.1016/j.tetlet.2015.03.046 .
- ^ Wang, Zhi-Xian; Tu, Yong; Frohn, Michael; Zhang, Jian-Rong; Shi, Yian (1997-11-01). "Un método eficiente de epoxidación catalítica asimétrica". Revista de la Sociedad Química Americana . 119 (46): 11224–11235. doi :10.1021/ja972272g. ISSN 0002-7863.
- ^ Bertelsen, Søren (2009). "Organocatálisis: después de la fiebre del oro". Chemical Society Reviews . 38 (8): 2178–89. doi :10.1039/b903816g. PMID 19623342.
- ^ Gaunt, MJ; Johansson, CCC; McNally, A.; Vo, NT (2007). "Organocatálisis enantioselectiva". Drug Discovery Today . 12 (1–2): 8–27. doi :10.1016/j.drudis.2006.11.004. PMID 17198969.
- ^ Kucherenko, AS; Siyutkin, DE; Maltsev, OV; Kochetkov, SV; Zlotin, SG (2013). "Organocatálisis asimétrica: de prolina a organocatalizadores inmovilizados de alta eficiencia". Boletín químico ruso . 61 (7): 1313. doi :10.1007/s11172-012-0177-4. S2CID 93168492.
- ^ Gérald Lelais; David WC MacMillan (2006). "Estrategias modernas en catálisis orgánica: el advenimiento y desarrollo de la activación por iminio" (PDF) . Aldrichimica Acta . 39 (3): 79.
- ^ Erkkilä, Anniinä; Majander, Inkeri; Pihko, Petri M. (2007). "Catálisis de iminio". Química. Rdo . 107 (12): 5416–5470. doi :10.1021/cr068388p. PMID 18072802.
- ^ Nis Halland; Tore Hansen; Karl Anker Jørgensen (2003). "Reacción de Michael asimétrica organocatalítica de compuestos cíclicos de 1,3-dicarbonilo y cetonas α,β-insaturadas: una formación catalítica en un solo paso altamente económica en átomos de anticoagulante de warfarina ópticamente activo". Angew. Chem. Int. Ed . 42 (40): 4955–4957. doi :10.1002/anie.200352136. PMID 14579449.
- ^ Sandra Lee; David WC MacMillan (2007). "Alquilaciones organocatalíticas de vinilo y Friedel-Crafts con sales de trifluoroborato" (PDF) . J. Am. Chem. Soc . 129 (50): 15438–15439. doi :10.1021/ja0767480. PMID 18031044. S2CID 34848947.
- ^ Madarász, Ádám; Dósa, Zsolt; Varga, Szilárd; Soós, Tibor; Csámpai, Antal; Pápai, Imre (julio de 2016). "Derivados de tiourea como organocatalizadores del ácido de Brønsted" (PDF) . Catálisis ACS . 6 (7): 4379–4387. doi :10.1021/acscatal.6b00618.
- ^ Parvin, Tasneem; Yadava, Rahul; Choudhury, Lokman (2020). "Aplicaciones recientes de organocatalizadores basados en tiourea en reacciones multicomponentes asimétricas (AMCR)". Org. Biomol. Chem . 18 (29): 5513–5532. doi :10.1039/D0OB00595A. PMID 32644077.