Ciclo celular


El ciclo celular , o ciclo de división celular , es la serie secuencial de eventos que tienen lugar en una célula y que provocan su división en dos células hijas. Estos eventos incluyen el crecimiento de la célula, la duplicación de su ADN ( replicación del ADN ) y algunos de sus orgánulos , y posteriormente la partición de su citoplasma, cromosomas y otros componentes en dos células hijas en un proceso llamado división celular .
En las células eucariotas (que tienen un núcleo celular ), incluidas las células animales , vegetales , fúngicas y protistas , el ciclo celular se divide en dos etapas principales: la interfase y la fase M , que incluye la mitosis y la citocinesis. [1] Durante la interfase, la célula crece, acumula los nutrientes necesarios para la mitosis y replica su ADN y algunos de sus orgánulos. Durante la fase M, los cromosomas , orgánulos y citoplasma replicados se separan en dos nuevas células hijas. Para garantizar la replicación adecuada de los componentes celulares y la división, existen mecanismos de control conocidos como puntos de control del ciclo celular después de cada uno de los pasos clave del ciclo que determinan si la célula puede progresar a la siguiente fase.
En las células sin núcleo, como las procariotas , las bacterias y las arqueas , el ciclo celular se divide en los períodos B, C y D. El período B se extiende desde el final de la división celular hasta el comienzo de la replicación del ADN. La replicación del ADN ocurre durante el período C. El período D se refiere a la etapa entre el final de la replicación del ADN y la división de la célula bacteriana en dos células hijas. [2]
En los organismos unicelulares, un solo ciclo de división celular es la forma en que el organismo se reproduce para asegurar su supervivencia. En los organismos multicelulares, como las plantas y los animales, una serie de ciclos de división celular es la forma en que el organismo se desarrolla a partir de un óvulo fertilizado unicelular hasta convertirse en un organismo maduro, y también es el proceso por el cual el cabello , la piel , las células sanguíneas y algunos órganos internos se regeneran y curan (con la posible excepción de los nervios ; ver daño a los nervios ). Después de la división celular, cada una de las células hijas comienza la interfase de un nuevo ciclo celular. Aunque las diversas etapas de la interfase no suelen ser morfológicamente distinguibles, cada fase del ciclo celular tiene un conjunto distinto de procesos bioquímicos especializados que preparan a la célula para el inicio de la división celular.
Fases
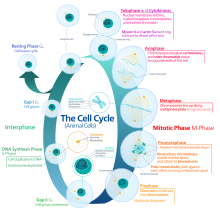
El ciclo celular eucariota consta de cuatro fases distintas: fase G 1 , fase S (síntesis), fase G 2 (conocidas colectivamente como interfase ) y fase M (mitosis y citocinesis). La fase M se compone a su vez de dos procesos estrechamente acoplados: la mitosis, en la que se divide el núcleo de la célula, y la citocinesis , en la que el citoplasma y la membrana celular de la célula se dividen formando dos células hijas. La activación de cada fase depende de la progresión y finalización adecuadas de la anterior. Se dice que las células que han dejado de dividirse de forma temporal o reversible han entrado en un estado de inactividad llamado fase G 0 o fase de reposo.
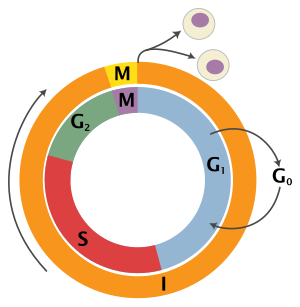
| Estado | Fase | Abreviatura | Descripción |
|---|---|---|---|
| Descansando | Brecha 0 | G 0 | Una fase en la que la célula ha abandonado el ciclo y ha dejado de dividirse. |
| Interfase | Brecha 1 | G 1 | Crecimiento celular. El punto de control G1 garantiza que todo esté listo para la síntesis de ADN . |
| Síntesis | S | Replicación del ADN . | |
| Brecha 2 | G2 | Crecimiento y preparación para la mitosis. El punto de control G2 garantiza que todo esté listo para entrar en la fase M (mitosis) y dividirse. | |
| División celular | Mitosis | METRO | Se produce la división celular. El punto de control de la metafase garantiza que la célula esté lista para completar la división celular. |
GRAMO0fase (quiescencia)
G 0 es una fase de reposo en la que la célula ha abandonado el ciclo y ha dejado de dividirse. El ciclo celular comienza con esta fase. Las células no proliferativas (que no se dividen) en eucariotas multicelulares generalmente entran en el estado G 0 quiescente desde G 1 y pueden permanecer quiescentes durante largos períodos de tiempo, posiblemente indefinidamente (como suele ser el caso de las neuronas ). Esto es muy común para las células que están completamente diferenciadas . Algunas células entran en la fase G 0 de forma semipermanente y se consideran posmitóticas, por ejemplo, algunas células del hígado, los riñones y el estómago. Muchas células no entran en G 0 y continúan dividiéndose a lo largo de la vida de un organismo, por ejemplo, las células epiteliales.
La palabra "postmitótica" se utiliza a veces para referirse tanto a células quiescentes como senescentes . La senescencia celular se produce en respuesta al daño del ADN y al estrés externo y suele constituir una detención de la G 1 . La senescencia celular puede hacer que la progenie de una célula no sea viable; a menudo es una alternativa bioquímica a la autodestrucción de una célula dañada por apoptosis .
Interfase
La interfase representa la fase entre dos fases M sucesivas. La interfase es una serie de cambios que tienen lugar en una célula recién formada y en su núcleo antes de que vuelva a ser capaz de dividirse. También se denomina fase preparatoria o intermitosis. Normalmente, la interfase dura al menos el 91 % del tiempo total necesario para el ciclo celular.
La interfase transcurre en tres etapas, G 1 , S y G 2 , seguidas por el ciclo de mitosis y citocinesis. El contenido de ADN nuclear de la célula se duplica durante la fase S.
GRAMO1Fase (primera fase de crecimiento o fase de brecha post mitótica)

La primera fase dentro de la interfase, desde el final de la fase M anterior hasta el comienzo de la síntesis de ADN, se llama G 1 (G indica gap ). También se llama fase de crecimiento. Durante esta fase, las actividades biosintéticas de la célula, que se ralentizan considerablemente durante la fase M, se reanudan a un ritmo elevado. La duración de G 1 es muy variable, incluso entre diferentes células de la misma especie. [4] En esta fase, la célula aumenta su suministro de proteínas, aumenta el número de orgánulos (como mitocondrias, ribosomas) y crece en tamaño. En la fase G 1 , una célula tiene tres opciones.
- Para continuar el ciclo celular y entrar en la fase S
- Detener el ciclo celular y entrar en la fase G0 para realizar la diferenciación .
- Queda detenido en la fase G 1 , por lo que puede entrar en la fase G 0 o reingresar al ciclo celular.
El punto de decisión se denomina punto de control ( punto de restricción ). Este punto de control se denomina punto de restricción o START y está regulado por las ciclinas G 1 /S, que provocan la transición de la fase G 1 a la fase S. El paso por el punto de control G 1 compromete a la célula a la división.
Fase S (replicación del ADN)
La fase S que sigue comienza cuando comienza la síntesis de ADN ; cuando se completa, todos los cromosomas se han replicado, es decir, cada cromosoma consta de dos cromátidas hermanas . Por lo tanto, durante esta fase, la cantidad de ADN en la célula se ha duplicado, aunque la ploidía y el número de cromosomas no han cambiado. Las tasas de transcripción de ARN y síntesis de proteínas son muy bajas durante esta fase. Una excepción a esto es la producción de histonas , la mayor parte de la cual ocurre durante la fase S. [5] [6] [7]
GRAMO2fase (crecimiento)
La fase G2 ocurre después de la replicación del ADN y es un período de síntesis de proteínas y crecimiento celular rápido para preparar la célula para la mitosis. Durante esta fase, los microtúbulos comienzan a reorganizarse para formar un huso (preprofase). Antes de pasar a la fase mitótica , las células deben revisarse en el punto de control G2 para detectar cualquier daño en el ADN dentro de los cromosomas. El punto de control G2 está regulado principalmente por la proteína tumoral p53 . Si el ADN está dañado, p53 reparará el ADN o desencadenará la apoptosis de la célula. Si p53 es disfuncional o mutado, las células con ADN dañado pueden continuar a través del ciclo celular, lo que lleva al desarrollo del cáncer.
Fase mitótica (separación de cromosomas)
La fase M, relativamente breve, consiste en la división nuclear ( cariocinesis ) y la división del citoplasma ( citocinesis ). Es un período relativamente corto del ciclo celular. La fase M es compleja y está muy regulada. La secuencia de eventos se divide en fases, que corresponden a la finalización de un conjunto de actividades y al inicio del siguiente. Estas fases se conocen secuencialmente como:

La mitosis es el proceso mediante el cual una célula eucariota separa los cromosomas de su núcleo celular en dos conjuntos idénticos en dos núcleos. [8] Durante el proceso de mitosis, los pares de cromosomas se condensan y se adhieren a microtúbulos que atraen a las cromátidas hermanas hacia lados opuestos de la célula. [9]
La mitosis se produce exclusivamente en células eucariotas , pero se produce de forma diferente en distintas especies. Por ejemplo, las células animales experimentan una mitosis "abierta", en la que la envoltura nuclear se rompe antes de que los cromosomas se separen, mientras que los hongos como Aspergillus nidulans y Saccharomyces cerevisiae ( levadura ) experimentan una mitosis "cerrada", en la que los cromosomas se dividen dentro de un núcleo celular intacto . [10]
Fase de citocinesis (separación de todos los componentes celulares)
La mitosis es seguida inmediatamente por la citocinesis , que divide los núcleos, el citoplasma , los orgánulos y la membrana celular en dos células que contienen proporciones aproximadamente iguales de estos componentes celulares. La citocinesis ocurre de manera diferente en las células vegetales y animales. Mientras que la membrana celular forma un surco que se profundiza gradualmente para separar el citoplasma en las células animales, se forma una placa celular para separarlo en las células vegetales. La posición de la placa celular está determinada por la posición de una banda preprofásica de microtúbulos y filamentos de actina . La mitosis y la citocinesis juntas definen la división de la célula madre en dos células hijas, genéticamente idénticas entre sí y a su célula madre. Esto representa aproximadamente el 10% del ciclo celular.
Debido a que la citocinesis suele ocurrir junto con la mitosis, "mitosis" se usa a menudo indistintamente con "fase M". Sin embargo, hay muchas células en las que la mitosis y la citocinesis ocurren por separado, formando células individuales con múltiples núcleos en un proceso llamado endorreplicación . Esto ocurre más notablemente entre los hongos y los mohos mucilaginosos , pero se encuentra en varios grupos. Incluso en animales, la citocinesis y la mitosis pueden ocurrir de forma independiente, por ejemplo durante ciertas etapas del desarrollo embrionario de la mosca de la fruta . [11] Los errores en la mitosis pueden provocar la muerte celular por apoptosis o causar mutaciones que pueden conducir al cáncer .
Regulación del ciclo celular eucariota

La regulación del ciclo celular implica procesos cruciales para la supervivencia de una célula, entre los que se incluyen la detección y reparación de daños genéticos, así como la prevención de la división celular descontrolada. Los eventos moleculares que controlan el ciclo celular son ordenados y direccionales; es decir, cada proceso ocurre de manera secuencial y es imposible "revertir" el ciclo.
Papel de las ciclinas y las CDK
 Premio Nobel Paul Nurse |  El premio Nobel Tim Hunt |
Dos clases clave de moléculas reguladoras, las ciclinas y las quinasas dependientes de ciclina (CDK), determinan el progreso de una célula a través del ciclo celular. [12] Leland H. Hartwell , R. Timothy Hunt y Paul M. Nurse ganaron el Premio Nobel de Fisiología o Medicina de 2001 por su descubrimiento de estas moléculas centrales. [13] Muchos de los genes que codifican ciclinas y CDK se conservan entre todos los eucariotas, pero en general, los organismos más complejos tienen sistemas de control del ciclo celular más elaborados que incorporan más componentes individuales. Muchos de los genes relevantes se identificaron por primera vez estudiando la levadura, especialmente Saccharomyces cerevisiae ; [14] la nomenclatura genética en levaduras denomina a muchos de estos genes cdc (para "ciclo de división celular") seguido de un número de identificación, p. ej. cdc25 o cdc20 .
Las ciclinas forman las subunidades reguladoras y las CDK las subunidades catalíticas de un heterodímero activado ; las ciclinas no tienen actividad catalítica y las CDK son inactivas en ausencia de una ciclina asociada. Cuando se activan por una ciclina unida, las CDK realizan una reacción bioquímica común llamada fosforilación que activa o inactiva las proteínas objetivo para orquestar la entrada coordinada a la siguiente fase del ciclo celular. Diferentes combinaciones de ciclina-CDK determinan las proteínas diana posteriores. Las CDK se expresan constitutivamente en las células, mientras que las ciclinas se sintetizan en etapas específicas del ciclo celular, en respuesta a varias señales moleculares. [15]
Mecanismo general de interacción ciclina-CDK
Al recibir una señal extracelular pro-mitótica, los complejos G 1 ciclina-CDK se activan para preparar la célula para la fase S, promoviendo la expresión de factores de transcripción que a su vez promueven la expresión de ciclinas S y de enzimas requeridas para la replicación del ADN . Los complejos G 1 ciclina-CDK también promueven la degradación de moléculas que funcionan como inhibidores de la fase S al dirigirlas a la ubiquitinación . Una vez que una proteína ha sido ubiquitinada, es dirigida a la degradación proteolítica por el proteasoma . Sin embargo, los resultados de un estudio reciente de la dinámica transcripcional de E2F a nivel de célula única sostienen que el papel de las actividades G1 ciclina-CDK, en particular ciclina D-CDK4/6, es ajustar el tiempo en lugar del compromiso de la entrada al ciclo celular. [16]
Los complejos de S-ciclina-CDK activos fosforilan las proteínas que forman los complejos de prerreplicación ensamblados durante la fase G 1 en los orígenes de replicación del ADN . La fosforilación tiene dos propósitos: activar cada complejo de prerreplicación ya ensamblado y evitar que se formen nuevos complejos. Esto garantiza que cada porción del genoma de la célula se replicará una vez y solo una vez. La razón para la prevención de brechas en la replicación es bastante clara, porque las células hijas a las que les faltan todos o parte de los genes cruciales morirán. Sin embargo, por razones relacionadas con los efectos del número de copias de genes , la posesión de copias adicionales de ciertos genes también es perjudicial para las células hijas.
Los complejos ciclina-CDK mitóticos, que se sintetizan pero se inactivan durante las fases S y G2 , promueven el inicio de la mitosis al estimular las proteínas posteriores involucradas en la condensación de los cromosomas y el ensamblaje del huso mitótico . Un complejo crítico activado durante este proceso es una ligasa de ubiquitina conocida como complejo promotor de anafase (APC), que promueve la degradación de las proteínas estructurales asociadas con el cinetocoro cromosómico . El APC también se dirige a las ciclinas mitóticas para su degradación, lo que garantiza que la telofase y la citocinesis puedan continuar. [17]
Acción específica de los complejos ciclina-CDK
La ciclina D es la primera ciclina producida en las células que entran en el ciclo celular, en respuesta a señales extracelulares (p. ej. factores de crecimiento ). Los niveles de ciclina D se mantienen bajos en células en reposo que no están proliferando. Además, CDK4/6 y CDK2 también están inactivos porque CDK4/6 está unido por miembros de la familia INK4 (p. ej., p16), lo que limita la actividad de la quinasa. Mientras tanto, los complejos CDK2 son inhibidos por las proteínas CIP/KIP como p21 y p27, [18] Cuando llega el momento de que una célula entre en el ciclo celular, lo que se desencadena por un estímulo mitogénico, los niveles de ciclina D aumentan. En respuesta a este desencadenante, la ciclina D se une al CDK4 /6 existente, formando el complejo ciclina D-CDK4/6 activo. Los complejos ciclina D-CDK4/6 a su vez monofosforilan la proteína de susceptibilidad al retinoblastoma ( Rb ) a pRb. El supresor tumoral Rb no fosforilado actúa induciendo la salida del ciclo celular y manteniendo el arresto de G0 (senescencia). [19]
En las últimas décadas, se ha aceptado ampliamente un modelo según el cual las proteínas pRB se inactivan mediante la fosforilación mediada por ciclina D-Cdk4/6. Rb tiene más de 14 sitios de fosforilación potenciales. La ciclina D-Cdk 4/6 fosforila progresivamente a Rb hasta el estado hiperfosforilado, lo que desencadena la disociación de los complejos pRB- E2F , induciendo así la expresión génica del ciclo celular G1/S y la progresión a la fase S. [20]
Sin embargo, las observaciones científicas de un estudio reciente muestran que Rb está presente en tres tipos de isoformas: (1) Rb no fosforilado en estado G0; (2) Rb monofosforilado, también denominado Rb "hipofosforilado" o "parcialmente" fosforilado en el estado G1 temprano; y (3) Rb hiperfosforilado inactivo en el estado G1 tardío. [21] [22] [23] En las células G1 tempranas, el Rb monofosforilado existe como 14 isoformas diferentes, una de cada una tiene una afinidad de unión a E2F distinta . [23] Se ha descubierto que el Rb se asocia con cientos de proteínas diferentes [24] y la idea de que diferentes isoformas de Rb monofosforiladas tienen diferentes parejas proteicas era muy atractiva. [25] Un informe reciente confirmó que la monofosforilación controla la asociación de Rb con otras proteínas y genera formas funcionales distintas de Rb. [26] Todas las diferentes isoformas de Rb monofosforiladas inhiben el programa transcripcional de E2F y pueden detener las células en la fase G1. Es importante destacar que las diferentes formas monofosforiladas de Rb tienen resultados transcripcionales distintos que son extendido más allá de la regulación E2F. [26]
En general, la unión de pRb a E2F inhibe la expresión del gen diana E2F de ciertos genes de transición G1/S y S, incluidas las ciclinas de tipo E. La fosforilación parcial de Rb desreprime la supresión mediada por Rb de la expresión del gen diana E2F, comienza la expresión de ciclina E. El mecanismo molecular que hace que la célula cambie a la activación de ciclina E actualmente no se conoce, pero a medida que aumentan los niveles de ciclina E, se forma el complejo ciclina E-CDK2 activo, lo que hace que Rb se inactive por hiperfosforilación. [23] El Rb hiperfosforilado se disocia completamente de E2F, lo que permite una mayor expresión de una amplia gama de genes diana E2F que son necesarios para impulsar a las células a pasar a la fase S [1]. Recientemente, se ha identificado que la ciclina D-Cdk4/6 se une a una región de hélice alfa C-terminal de Rb que solo se distingue de la ciclina D en lugar de otras ciclinas, ciclina E , A y B. [27] Esta observación basada en el análisis estructural de la fosforilación de Rb respalda que Rb se fosforila en un nivel diferente a través de múltiples complejos de ciclina-Cdk. Esto también hace factible el modelo actual de una inactivación simultánea de tipo interruptor de todas las isoformas monofosforiladas de Rb a través de un tipo de mecanismo de hiperfosforilación de Rb. Además, el análisis mutacional de la hélice C-terminal de Rb específica de ciclina D-Cdk 4/6 muestra que las interrupciones de la unión de ciclina D-Cdk 4/6 a Rb previenen la fosforilación de Rb, detienen las células en G1 y refuerzan las funciones de Rb en la supresión de tumores. [27] Este mecanismo de transición del ciclo celular impulsado por la ciclina-Cdk gobierna una célula comprometida con el ciclo celular que permite la proliferación celular. El crecimiento de una célula cancerosa suele ir acompañado de una desregulación de la actividad de la ciclina D-Cdk 4/6.
El Rb hiperfosforilado se disocia del complejo E2F/DP1/Rb (que estaba unido a los genes sensibles a E2F , "bloqueándolos" eficazmente de la transcripción), activando E2F. La activación de E2F da como resultado la transcripción de varios genes como ciclina E , ciclina A , ADN polimerasa , timidina quinasa , etc. La ciclina E así producida se une a CDK2 , formando el complejo ciclina E-CDK2, que empuja a la célula de la fase G 1 a la S (G 1 /S, que inicia la transición G 2 /M). [28] La activación del complejo ciclina B -cdk1 causa la ruptura de la envoltura nuclear y el inicio de la profase , y posteriormente, su desactivación hace que la célula salga de la mitosis. [15] Un estudio cuantitativo de la dinámica transcripcional de E2F a nivel de célula única mediante el uso de células reporteras fluorescentes diseñadas proporcionó un marco cuantitativo para comprender la lógica de control de la entrada al ciclo celular, desafiando el modelo canónico de los libros de texto. Los genes que regulan la amplitud de la acumulación de E2F, como Myc, determinan el compromiso en el ciclo celular y la entrada en la fase S. Las actividades de la ciclina G1-CDK no son el impulsor de la entrada en el ciclo celular. En cambio, principalmente ajustan el momento del aumento de E2F, modulando así el ritmo de la progresión del ciclo celular. [16]
Inhibidores
Endógeno

Dos familias de genes, la familia cip/kip ( proteína que interactúa con CDK/proteína inhibidora de quinasas ) y la familia INK4a/ARF ( inhibidor de la quinasa 4/ marco de lectura alternativo ) , impiden la progresión del ciclo celular. Debido a que estos genes son fundamentales para la prevención de la formación de tumores , se los conoce como supresores tumorales .
La familia cip/kip incluye los genes p21 , p27 y p57 . Estos genes detienen el ciclo celular en la fase G1 uniéndose a los complejos ciclina-CDK y desactivándolos. p21 es activado por p53 (que, a su vez, es activado por daño del ADN, por ejemplo, debido a la radiación). p27 es activado por el factor de crecimiento transformante β ( TGF β ), un inhibidor del crecimiento.
La familia INK4a/ARF incluye p16 INK4a , que se une a CDK4 y detiene el ciclo celular en la fase G 1 , y p14 ARF , que previene la degradación de p53.
Sintético
Los inhibidores sintéticos de Cdc25 también podrían ser útiles para detener el ciclo celular y, por lo tanto, ser útiles como agentes antineoplásicos y anticancerígenos. [29]
Muchos cánceres humanos poseen actividades hiperactivadas de Cdk 4/6. [30] Dadas las observaciones de las funciones de ciclina D-Cdk 4/6, la inhibición de Cdk 4/6 debería resultar en la prevención de la proliferación de un tumor maligno. En consecuencia, los científicos han tratado de inventar el inhibidor sintético de Cdk4/6, ya que Cdk4/6 se ha caracterizado por ser un objetivo terapéutico para la eficacia antitumoral. Tres inhibidores de Cdk4/6 ( palbociclib , ribociclib y abemaciclib ) recibieron actualmente la aprobación de la FDA para uso clínico para tratar el cáncer de mama en etapa avanzada o metastásico , positivo para el receptor de hormonas (HR-positivo, HR+), negativo para HER2 (HER2-). [31] [32] Por ejemplo, palbociclib es un inhibidor de CDK4/6 activo por vía oral que ha demostrado mejores resultados para el cáncer de mama avanzado ER-positivo/HER2-negativo. El principal efecto secundario es la neutropenia , que puede controlarse mediante la reducción de la dosis. [33]
La terapia dirigida a Cdk4/6 solo tratará los tipos de cáncer en los que se expresa Rb. Las células cancerosas con pérdida de Rb presentan resistencia primaria a los inhibidores de Cdk4/6.
Red reguladora de la transcripción
La evidencia actual sugiere que una red transcripcional semiautónoma actúa en conjunto con la maquinaria de ciclinas CDK para regular el ciclo celular. Varios estudios de expresión génica en Saccharomyces cerevisiae han identificado entre 800 y 1200 genes que cambian su expresión a lo largo del ciclo celular. [14] [34] [35] Se transcriben en niveles altos en puntos específicos del ciclo celular y permanecen en niveles más bajos durante el resto del ciclo. Si bien el conjunto de genes identificados difiere entre los estudios debido a los métodos computacionales y los criterios utilizados para identificarlos, cada estudio indica que una gran parte de los genes de la levadura están regulados temporalmente. [36]
Muchos genes expresados periódicamente son impulsados por factores de transcripción que también se expresan periódicamente. Un análisis de genes knockouts identificó 48 factores de transcripción (alrededor del 20% de todos los factores de transcripción no esenciales) que muestran defectos en la progresión del ciclo celular. [37] Estudios de todo el genoma que utilizan tecnologías de alto rendimiento han identificado los factores de transcripción que se unen a los promotores de los genes de levadura, y la correlación de estos hallazgos con patrones de expresión temporal ha permitido la identificación de factores de transcripción que impulsan la expresión génica específica de la fase. [34] [38] Los perfiles de expresión de estos factores de transcripción son impulsados por los factores de transcripción que alcanzan su pico en la fase anterior, y los modelos computacionales han demostrado que una red autónoma de CDK de estos factores de transcripción es suficiente para producir oscilaciones de estado estable en la expresión génica). [35] [39]
La evidencia experimental también sugiere que la expresión génica puede oscilar con el período observado en la división de células de tipo salvaje independientemente de la maquinaria CDK. Orlando et al. utilizaron microarrays para medir la expresión de un conjunto de 1.271 genes que identificaron como periódicos tanto en células de tipo salvaje como en células que carecían de todas las ciclinas de fase S y mitóticas ( clb1,2,3,4,5,6 ). De los 1.271 genes ensayados, 882 continuaron expresándose en las células deficientes en ciclina al mismo tiempo que en las células de tipo salvaje, a pesar del hecho de que las células deficientes en ciclina se detienen en el límite entre la fase G 1 y S . Sin embargo, 833 de los genes ensayados cambiaron de comportamiento entre las células de tipo salvaje y mutantes, lo que indica que es probable que estos genes estén regulados directa o indirectamente por la maquinaria CDK-ciclina. Algunos genes que continuaron expresándose a tiempo en las células mutantes también se expresaron en diferentes niveles en las células mutantes y de tipo salvaje. Estos hallazgos sugieren que si bien la red transcripcional puede oscilar independientemente del oscilador CDK-ciclina, están acoplados de una manera que requiere de ambos para asegurar la sincronización adecuada de los eventos del ciclo celular. [35] Otros trabajos indican que la fosforilación , una modificación postraduccional, de los factores de transcripción del ciclo celular por Cdk1 puede alterar la localización o actividad de los factores de transcripción para controlar estrictamente la sincronización de los genes objetivo. [37] [40] [41]
Si bien la transcripción oscilatoria desempeña un papel clave en la progresión del ciclo celular de la levadura, la maquinaria de ciclinas CDK opera de manera independiente en el ciclo celular embrionario temprano. Antes de la transición a la blástula media , no se produce la transcripción cigótica y todas las proteínas necesarias, como las ciclinas de tipo B, se traducen a partir del ARNm cargado por la madre . [42]
Actividad de replicación del ADN y origen de la replicación del ADN
Los análisis de cultivos sincronizados de Saccharomyces cerevisiae en condiciones que impiden el inicio de la replicación del ADN sin retrasar la progresión del ciclo celular mostraron que el licenciamiento del origen disminuye la expresión de genes con orígenes cerca de sus extremos 3', revelando que los orígenes descendentes pueden regular la expresión de genes ascendentes. [43] Esto confirma predicciones previas del modelado matemático de una coordinación causal global entre la actividad del origen de replicación del ADN y la expresión del ARNm, [44] [45] [46] y muestra que el modelado matemático de datos de microarrays de ADN se puede utilizar para predecir correctamente modos biológicos de regulación previamente desconocidos.
Puestos de control
Los puntos de control del ciclo celular son utilizados por la célula para monitorear y regular el progreso del ciclo celular. [47] Los puntos de control previenen la progresión del ciclo celular en puntos específicos, lo que permite la verificación de los procesos de fase necesarios y la reparación del daño del ADN . La célula no puede avanzar a la siguiente fase hasta que se hayan cumplido los requisitos del punto de control. Los puntos de control generalmente consisten en una red de proteínas reguladoras que monitorean y dictan la progresión de la célula a través de las diferentes etapas del ciclo celular.
Se estima que en las células humanas normales aproximadamente el 1% de los daños en el ADN monocatenario se convierten en aproximadamente 50 roturas de doble cadena de ADN endógeno por célula por ciclo celular. [48] Aunque dichas roturas de doble cadena suelen repararse con alta fidelidad, se considera que los errores en su reparación contribuyen significativamente a la tasa de cáncer en humanos. [48]
Existen varios puntos de control para garantizar que el ADN dañado o incompleto no pase a las células hijas. Existen tres puntos de control principales: el punto de control G 1 /S, el punto de control G 2 /M y el punto de control de la metafase (mitótica). Otro punto de control es el punto de control Go, en el que se comprueba la madurez de las células. Si las células no pasan este punto de control porque aún no están listas, se descartarán de la división.
La transición G 1 /S es un paso limitante de la velocidad en el ciclo celular y también se conoce como punto de restricción . [15] Aquí es donde la célula verifica si tiene suficientes materias primas para replicar completamente su ADN (bases de nucleótidos, ADN sintasa, cromatina, etc.). Una célula enferma o desnutrida se quedará atascada en este punto de control.
El punto de control G2 / M es donde la célula se asegura de tener suficiente citoplasma y fosfolípidos para dos células hijas. Pero a veces, lo que es más importante, verifica si es el momento adecuado para replicarse. Hay algunas situaciones en las que muchas células necesitan replicarse simultáneamente (por ejemplo, un embrión en crecimiento debe tener una distribución celular simétrica hasta que alcanza la transición a mitad de la blástula). Esto se hace controlando el punto de control G2 / M.
El punto de control de la metafase es un punto de control bastante menor, ya que una vez que una célula está en metafase, se ha comprometido a realizar la mitosis. Sin embargo, eso no quiere decir que no sea importante. En este punto de control, la célula verifica que se haya formado el huso y que todos los cromosomas estén alineados en el ecuador del huso antes de que comience la anafase. [49]
Aunque estos son los tres puntos de control "principales", no todas las células tienen que pasar por cada uno de ellos en este orden para replicarse. Muchos tipos de cáncer son causados por mutaciones que permiten a las células pasar rápidamente por los distintos puntos de control o incluso saltárselos por completo, pasando de la fase S a la M y de nuevo a la S casi consecutivamente. Como estas células han perdido sus puntos de control, cualquier mutación del ADN que pueda haberse producido se ignora y se transmite a las células hijas. Esta es una de las razones por las que las células cancerosas tienen tendencia a adquirir mutaciones de forma exponencial. Aparte de las células cancerosas, muchos tipos de células completamente diferenciadas ya no se replican, por lo que abandonan el ciclo celular y permanecen en G 0 hasta su muerte, eliminando así la necesidad de puntos de control celulares. También se ha propuesto un modelo alternativo de la respuesta del ciclo celular al daño del ADN, conocido como punto de control de posreplicación .
La regulación de los puntos de control desempeña un papel importante en el desarrollo de un organismo. En la reproducción sexual, cuando se produce la fecundación del óvulo, cuando el espermatozoide se une al óvulo, libera factores de señalización que notifican al óvulo que ha sido fecundado. Entre otras cosas, esto induce al ovocito ahora fecundado a regresar de su estado previamente latente, G 0 , al ciclo celular y a la replicación y división mitótica.
El p53 desempeña un papel importante en la activación de los mecanismos de control en los puntos de control G 1 /S y G 2 /M. Además del p53, se están investigando intensamente los reguladores de los puntos de control por su papel en el crecimiento y la proliferación del cáncer.
Fluorescence imaging of the cell cycle

Pioneering work by Atsushi Miyawaki and coworkers developed the fluorescent ubiquitination-based cell cycle indicator (FUCCI), which enables fluorescence imaging of the cell cycle. Originally, a green fluorescent protein, mAG, was fused to hGem(1/110) and an orange fluorescent protein (mKO2) was fused to hCdt1(30/120). Note, these fusions are fragments that contain a nuclear localization signal and ubiquitination sites for degradation, but are not functional proteins. The green fluorescent protein is made during the S, G2, or M phase and degraded during the G0 or G1 phase, while the orange fluorescent protein is made during the G0 or G1 phase and destroyed during the S, G2, or M phase.[50] A far-red and near-infrared FUCCI was developed using a cyanobacteria-derived fluorescent protein (smURFP) and a bacteriophytochrome-derived fluorescent protein (movie found at this link).[51]
Role in tumor formation
A disregulation of the cell cycle components may lead to tumor formation.[52] As mentioned above, when some genes like the cell cycle inhibitors, RB, p53 etc. mutate, they may cause the cell to multiply uncontrollably, forming a tumor. Although the duration of cell cycle in tumor cells is equal to or longer than that of normal cell cycle, the proportion of cells that are in active cell division (versus quiescent cells in G0 phase) in tumors is much higher than that in normal tissue.[53] Thus there is a net increase in cell number as the number of cells that die by apoptosis or senescence remains the same.
The cells which are actively undergoing cell cycle are targeted in cancer therapy as the DNA is relatively exposed during cell division and hence susceptible to damage by drugs or radiation. This fact is made use of in cancer treatment; by a process known as debulking, a significant mass of the tumor is removed which pushes a significant number of the remaining tumor cells from G0 to G1 phase (due to increased availability of nutrients, oxygen, growth factors etc.). Radiation or chemotherapy following the debulking procedure kills these cells which have newly entered the cell cycle.[15]
The fastest cycling mammalian cells in culture, crypt cells in the intestinal epithelium, have a cycle time as short as 9 to 10 hours. Stem cells in resting mouse skin may have a cycle time of more than 200 hours. Most of this difference is due to the varying length of G1, the most variable phase of the cycle. M and S do not vary much.
In general, cells are most radiosensitive in late M and G2 phases and most resistant in late S phase. For cells with a longer cell cycle time and a significantly long G1 phase, there is a second peak of resistance late in G1. The pattern of resistance and sensitivity correlates with the level of sulfhydryl compounds in the cell. Sulfhydryls are natural substances that protect cells from radiation damage and tend to be at their highest levels in S and at their lowest near mitosis.
Homologous recombination (HR) is an accurate process for repairing DNA double-strand breaks. HR is nearly absent in G1 phase, is most active in S phase, and declines in G2/M.[54] Non-homologous end joining, a less accurate and more mutagenic process for repairing double strand breaks, is active throughout the cell cycle.
Cell cycle evolution
Evolution of the genome
The cell cycle must duplicate all cellular constituents and equally partition them into two daughter cells. Many constituents, such as proteins and ribosomes, are produced continuously throughout the cell cycle (except during M-phase). However, the chromosomes and other associated elements like MTOCs, are duplicated just once during the cell cycle. A central component of the cell cycle is its ability to coordinate the continuous and periodic duplications of different cellular elements, which evolved with the formation of the genome.
The pre-cellular environment contained functional and self-replicating RNAs.[55] All RNA concentrations depended on the concentrations of other RNAs that might be helping or hindering the gathering of resources. In this environment, growth was simply the continuous production of RNAs. These pre-cellular structures would have had to contend with parasitic RNAs, issues of inheritance, and copy-number control of specific RNAs.[55][56]
Partitioning "genomic" RNA from "functional" RNA helped solve these problems.[57] The fusion of multiple RNAs into a genome gave a template from which functional RNAs were cleaved. Now, parasitic RNAs would have to incorporate themselves into the genome, a much greater barrier, in order to survive. Controlling the copy number of genomic RNA also allowed RNA concentration to be determined through synthesis rates and RNA half-lives, instead of competition.[55] Separating the duplication of genomic RNAs from the generation of functional RNAs allowed for much greater duplication fidelity of genomic RNAs without compromising the production of functional RNAs. Finally, the replacement of genomic RNA with DNA, which is a more stable molecule, allowed for larger genomes. The transition from self-catalysis enzyme synthesis to genome-directed enzyme synthesis was a critical step in cell evolution, and had lasting implications on the cell cycle, which must regulate functional synthesis and genomic duplication in very different ways.[55]
Cyclin-dependent kinase and cyclin evolution
Cell-cycle progression is controlled by the oscillating concentrations of different cyclins and the resulting molecular interactions from the various cyclin-dependent kinases (CDKs). In yeast, just one CDK (Cdc28 in S. cerevisiae and Cdc2 in S. pombe) controls the cell cycle.[58] However, in animals, whole families of CDKs have evolved.[59][60] Cdk1 controls entry to mitosis and Cdk2, Cdk4, and Cdk6 regulate entry into S phase. Despite the evolution of the CDK family in animals, these proteins have related or redundant functions.[61][62][63] For example, cdk2 cdk4 cdk6 triple knockout mice cells can still progress through the basic cell cycle.[64] cdk1 knockouts are lethal, which suggests an ancestral CDK1-type kinase ultimately controlling the cell cycle.[64]
Arabidopsis thaliana has a Cdk1 homolog called CDKA;1, however cdka;1 A. thaliana mutants are still viable,[65] running counter to the opisthokont pattern of CDK1-type kinases as essential regulators controlling the cell cycle.[66] Plants also have a unique group of B-type CDKs, whose functions may range from development-specific functions to major players in mitotic regulation.[67][68]
G1/S checkpoint evolution

The G1/S checkpoint is the point at which the cell commits to division through the cell cycle. Complex regulatory networks lead to the G1/S transition decision. Across opisthokonts, there are both highly diverged protein sequences as well as strikingly similar network topologies.[66][69]
Entry into S-phase in both yeast and animals is controlled by the levels of two opposing regulators.[66] The networks regulating these transcription factors are double-negative feedback loops and positive feedback loops in both yeast and animals.[66][69][70] Additional regulation of the regulatory network for the G1/S checkpoint in yeast and animals includes the phosphorylation/de-phosphorylation of CDK-cyclin complexes. The sum of these regulatory networks creates a hysteretic and bistable scheme, despite the specific proteins being highly diverged.[71][72] For yeast, Whi5 must be suppressed by Cln3 phosphorylation for SBF to be expressed,[73] while in animals Rb must be suppressed by the Cdk4/6-cyclin D complex for E2F to be expressed.[74] Both Rb and Whi5 inhibit transcript through the recruitment of histone deacetylase proteins to promoters.[75][76] Both proteins additionally have multiple CDK phosphorylation sites through which they are inhibited.[77][74] However, these proteins share no sequence similarity.
Studies in A. thaliana extend our knowledge of the G1/S transition across eukaryotes as a whole. Plants also share a number of conserved network features with opisthokonts, and many plant regulators have direct animal homologs.[78] For example, plants also need to suppress Rb for E2F translation in the network.[79] These conserved elements of the plant and animal cell cycles may be ancestral in eukaryotes. While yeast share a conserved network topology with plants and animals, the highly diverged nature of yeast regulators suggests possible rapid evolution along the yeast lineage.[66]
See also
- Cellular model
- Eukaryotic DNA replication
- Mitotic catastrophe
- Origin recognition complex
- Retinoblastoma protein
- Synchronous culture – synchronization of cell cultures
- Wee1
References
- ^ Alberts B, Hopkin K, Johnson A, Morgan D, Raff M, Roberts K, Walter P (2019). Essential cell biology (Fifth ed.). New York London: W. W. Norton & Company. pp. 624–625. ISBN 9780393680393.
- ^ Wang JD, Levin PA (November 2009). "Metabolism, cell growth and the bacterial cell cycle". Nature Reviews. Microbiology. 7 (11): 822–827. doi:10.1038/nrmicro2202. PMC 2887316. PMID 19806155.
- ^ Cooper GM (2000). "Chapter 14: The Eukaryotic Cell Cycle". The cell: a molecular approach (2nd ed.). Washington, D.C.: ASM Press. ISBN 978-0-87893-106-4.
- ^ Smith JA, Martin L (April 1973). "Do cells cycle?". Proceedings of the National Academy of Sciences of the United States of America. 70 (4): 1263–1267. Bibcode:1973PNAS...70.1263S. doi:10.1073/pnas.70.4.1263. PMC 433472. PMID 4515625.
- ^ Wu RS, Bonner WM (December 1981). "Separation of basal histone synthesis from S-phase histone synthesis in dividing cells". Cell. 27 (2 Pt 1): 321–330. doi:10.1016/0092-8674(81)90415-3. PMID 7199388. S2CID 12215040.
- ^ Nelson DM, Ye X, Hall C, Santos H, Ma T, Kao GD, et al. (November 2002). "Coupling of DNA synthesis and histone synthesis in S phase independent of cyclin/cdk2 activity". Molecular and Cellular Biology. 22 (21): 7459–7472. doi:10.1128/MCB.22.21.7459-7472.2002. PMC 135676. PMID 12370293.
- ^ Cameron IL, Greulich RC (July 1963). "Evidence for an essentially constant duration of DNA synthesis in renewing epithelia of the adult mouse". The Journal of Cell Biology. 18 (1): 31–40. doi:10.1083/jcb.18.1.31. PMC 2106275. PMID 14018040.
- ^ Rubenstein I, Wick SM (2008). "Cell". World Book Online Reference Center. Archived from the original on 30 May 2011. Retrieved 10 July 2009.
- ^ Maton A, Lahart D, Hopkins J, Warner MQ, Johnson S, Wright JD (1997). Cells: Building Blocks of Life. New Jersey: Prentice Hall. pp. 70–4. ISBN 978-0-13-423476-2.
- ^ De Souza CP, Osmani SA (September 2007). "Mitosis, not just open or closed". Eukaryotic Cell. 6 (9): 1521–1527. doi:10.1128/EC.00178-07. PMC 2043359. PMID 17660363.
- ^ Lilly MA, Duronio RJ (April 2005). "New insights into cell cycle control from the Drosophila endocycle". Oncogene. 24 (17): 2765–2775. doi:10.1038/sj.onc.1208610. PMID 15838513. S2CID 25473573.
- ^ Nigg EA (June 1995). "Cyclin-dependent protein kinases: key regulators of the eukaryotic cell cycle". BioEssays. 17 (6): 471–480. doi:10.1002/bies.950170603. PMID 7575488. S2CID 44307473.
- ^ "The Nobel Prize in Physiology or Medicine 2001 – Press release". Nobelprize.org.
- ^ a b Spellman PT, Sherlock G, Zhang MQ, Iyer VR, Anders K, Eisen MB, et al. (December 1998). "Comprehensive identification of cell cycle-regulated genes of the yeast Saccharomyces cerevisiae by microarray hybridization". Molecular Biology of the Cell. 9 (12): 3273–3297. doi:10.1091/mbc.9.12.3273. PMC 25624. PMID 9843569.
- ^ a b c d Robbins SL, Cotran RS (2004). Kumar V, Abbas AK, Fausto N (eds.). Pathological Basis of Disease. Elsevier. ISBN 978-81-8147-528-2.
- ^ a b Dong P, Maddali MV, Srimani JK, Thélot F, Nevins JR, Mathey-Prevot B, You L (September 2014). "Division of labour between Myc and G1 cyclins in cell cycle commitment and pace control". Nature Communications. 5: 4750. Bibcode:2014NatCo...5.4750D. doi:10.1038/ncomms5750. PMC 4164785. PMID 25175461.
- ^ Mahmoudi M, Azadmanesh K, Shokrgozar MA, Journeay WS, Laurent S (May 2011). "Effect of nanoparticles on the cell life cycle". Chemical Reviews. 111 (5): 3407–3432. doi:10.1021/cr1003166. PMID 21401073.
- ^ Goel S, DeCristo MJ, McAllister SS, Zhao JJ (November 2018). "CDK4/6 Inhibition in Cancer: Beyond Cell Cycle Arrest". Trends in Cell Biology. 28 (11): 911–925. doi:10.1016/j.tcb.2018.07.002. PMC 6689321. PMID 30061045.
- ^ Burkhart DL, Sage J (September 2008). "Cellular mechanisms of tumour suppression by the retinoblastoma gene". Nature Reviews. Cancer. 8 (9): 671–682. doi:10.1038/nrc2399. PMC 6996492. PMID 18650841.
- ^ Morgan DO (2007). The cell cycle : principles of control. London: New Science Press. ISBN 978-0-19-920610-0. OCLC 70173205.
- ^ Paternot S, Bockstaele L, Bisteau X, Kooken H, Coulonval K, Roger PP (February 2010). "Rb inactivation in cell cycle and cancer: the puzzle of highly regulated activating phosphorylation of CDK4 versus constitutively active CDK-activating kinase". Cell Cycle. 9 (4): 689–699. doi:10.4161/cc.9.4.10611. PMID 20107323.
- ^ Henley SA, Dick FA (March 2012). "The retinoblastoma family of proteins and their regulatory functions in the mammalian cell division cycle". Cell Division. 7 (1): 10. doi:10.1186/1747-1028-7-10. PMC 3325851. PMID 22417103.
- ^ a b c Narasimha AM, Kaulich M, Shapiro GS, Choi YJ, Sicinski P, Dowdy SF (June 2014). "Cyclin D activates the Rb tumor suppressor by mono-phosphorylation". eLife. 3: e02872. doi:10.7554/eLife.02872. PMC 4076869. PMID 24876129.
- ^ Morris EJ, Dyson NJ (1 January 2001). Retinoblastoma protein partners. Advances in Cancer Research. Vol. 82. Academic Press. pp. 1–54. doi:10.1016/s0065-230x(01)82001-7. ISBN 9780120066827. PMID 11447760.
- ^ Dyson NJ (July 2016). "RB1: a prototype tumor suppressor and an enigma". Genes & Development. 30 (13): 1492–1502. doi:10.1101/gad.282145.116. PMC 4949322. PMID 27401552.
- ^ a b Sanidas I, Morris R, Fella KA, Rumde PH, Boukhali M, Tai EC, et al. (March 2019). "A Code of Mono-phosphorylation Modulates the Function of RB". Molecular Cell. 73 (5): 985–1000.e6. doi:10.1016/j.molcel.2019.01.004. PMC 6424368. PMID 30711375.
- ^ a b Topacio BR, Zatulovskiy E, Cristea S, Xie S, Tambo CS, Rubin SM, et al. (May 2019). "Cyclin D-Cdk4,6 Drives Cell-Cycle Progression via the Retinoblastoma Protein's C-Terminal Helix". Molecular Cell. 74 (4): 758–770.e4. doi:10.1016/j.molcel.2019.03.020. PMC 6800134. PMID 30982746.
- ^ Norbury C (1995). "Cdk2 protein kinase (vertebrates)". In Hardie DG, Hanks S (eds.). Protein kinase factsBook. Boston: Academic Press. pp. 184. ISBN 978-0-12-324719-3.
- ^ "Presentation on CDC25 PHOSPHATASES: A Potential Target for Novel Anticancer Agents". Archived from the original on 3 March 2016. Retrieved 11 March 2010.
- ^ Sherr CJ, Beach D, Shapiro GI (April 2016). "Targeting CDK4 and CDK6: From Discovery to Therapy". Cancer Discovery. 6 (4): 353–367. doi:10.1158/2159-8290.cd-15-0894. PMC 4821753. PMID 26658964.
- ^ O'Leary B, Finn RS, Turner NC (July 2016). "Treating cancer with selective CDK4/6 inhibitors". Nature Reviews. Clinical Oncology. 13 (7): 417–430. doi:10.1038/nrclinonc.2016.26. PMID 27030077. S2CID 23646632.
- ^ Bilgin B, Sendur MA, Şener Dede D, Akıncı MB, Yalçın B (September 2017). "A current and comprehensive review of cyclin-dependent kinase inhibitors for the treatment of metastatic breast cancer". Current Medical Research and Opinion. 33 (9): 1559–1569. doi:10.1080/03007995.2017.1348344. PMID 28657360. S2CID 205542255.
- ^ Schmidt M, Sebastian M (August 2018). "Palbociclib—The First of a New Class of Cell Cycle Inhibitors". Small Molecules in Oncology. Recent Results in Cancer Research. Vol. 211. pp. 153–175. doi:10.1007/978-3-319-91442-8_11. ISBN 978-3-319-91441-1. PMID 30069766.
- ^ a b Pramila T, Wu W, Miles S, Noble WS, Breeden LL (August 2006). "The Forkhead transcription factor Hcm1 regulates chromosome segregation genes and fills the S-phase gap in the transcriptional circuitry of the cell cycle". Genes & Development. 20 (16): 2266–2278. doi:10.1101/gad.1450606. PMC 1553209. PMID 16912276.
- ^ a b c Orlando DA, Lin CY, Bernard A, Wang JY, Socolar JE, Iversen ES, et al. (June 2008). "Global control of cell-cycle transcription by coupled CDK and network oscillators". Nature. 453 (7197): 944–947. Bibcode:2008Natur.453..944O. doi:10.1038/nature06955. PMC 2736871. PMID 18463633.
- ^ de Lichtenberg U, Jensen LJ, Fausbøll A, Jensen TS, Bork P, Brunak S (April 2005). "Comparison of computational methods for the identification of cell cycle-regulated genes". Bioinformatics. 21 (7): 1164–1171. doi:10.1093/bioinformatics/bti093. PMID 15513999.
- ^ a b White MA, Riles L, Cohen BA (February 2009). "A systematic screen for transcriptional regulators of the yeast cell cycle". Genetics. 181 (2): 435–446. doi:10.1534/genetics.108.098145. PMC 2644938. PMID 19033152.
- ^ Lee TI, Rinaldi NJ, Robert F, Odom DT, Bar-Joseph Z, Gerber GK, et al. (October 2002). "Transcriptional regulatory networks in Saccharomyces cerevisiae". Science. 298 (5594): 799–804. Bibcode:2002Sci...298..799L. doi:10.1126/science.1075090. PMID 12399584. S2CID 4841222.
- ^ Simon I, Barnett J, Hannett N, Harbison CT, Rinaldi NJ, Volkert TL, et al. (September 2001). "Serial regulation of transcriptional regulators in the yeast cell cycle". Cell. 106 (6): 697–708. doi:10.1016/S0092-8674(01)00494-9. PMID 11572776. S2CID 9308235.
- ^ Sidorova JM, Mikesell GE, Breeden LL (December 1995). "Cell cycle-regulated phosphorylation of Swi6 controls its nuclear localization". Molecular Biology of the Cell. 6 (12): 1641–1658. doi:10.1091/mbc.6.12.1641. PMC 301322. PMID 8590795.
- ^ Ubersax JA, Woodbury EL, Quang PN, Paraz M, Blethrow JD, Shah K, et al. (October 2003). "Targets of the cyclin-dependent kinase Cdk1". Nature. 425 (6960): 859–864. Bibcode:2003Natur.425..859U. doi:10.1038/nature02062. PMID 14574415. S2CID 4391711.
- ^ Morgan DO (2007). "2–3". The Cell Cycle: Principles of Control. London: New Science Press. p. 18. ISBN 978-0-9539181-2-6.
- ^ Omberg L, Meyerson JR, Kobayashi K, Drury LS, Diffley JF, Alter O (October 2009). "Global effects of DNA replication and DNA replication origin activity on eukaryotic gene expression". Molecular Systems Biology. 5: 312. doi:10.1038/msb.2009.70. PMC 2779084. PMID 19888207.
- ^ Alter O, Golub GH, Brown PO, Botstein D (February 2004). Deutscher MP, Black S, Boehmer PE, D'Urso G, Fletcher TM, Huijing F, et al. (eds.). Novel Genome-Scale Correlation between DNA Replication and RNA Transcription During the Cell Cycle in Yeast is Predicted by Data-Driven Models (PDF). Miami Nature Biotechnology Winter Symposium. Cell Cycle, Chromosomes and Cancer. Vol. 15. Miami Beach, FL: University of Miami School of Medicine. Archived from the original (PDF) on 9 September 2014. Retrieved 7 February 2014.
- ^ Alter O, Golub GH (November 2004). "Integrative analysis of genome-scale data by using pseudoinverse projection predicts novel correlation between DNA replication and RNA transcription". Proceedings of the National Academy of Sciences of the United States of America. 101 (47): 16577–16582. Bibcode:2004PNAS..10116577A. doi:10.1073/pnas.0406767101. PMC 534520. PMID 15545604.
- ^ Omberg L, Golub GH, Alter O (November 2007). "A tensor higher-order singular value decomposition for integrative analysis of DNA microarray data from different studies". Proceedings of the National Academy of Sciences of the United States of America. 104 (47): 18371–18376. Bibcode:2007PNAS..10418371O. doi:10.1073/pnas.0709146104. PMC 2147680. PMID 18003902.
- ^ Elledge SJ (December 1996). "Cell cycle checkpoints: preventing an identity crisis". Science. 274 (5293): 1664–1672. Bibcode:1996Sci...274.1664E. doi:10.1126/science.274.5293.1664. PMID 8939848. S2CID 39235426.
- ^ a b Vilenchik MM, Knudson AG (October 2003). "Endogenous DNA double-strand breaks: production, fidelity of repair, and induction of cancer". Proceedings of the National Academy of Sciences of the United States of America. 100 (22): 12871–12876. Bibcode:2003PNAS..10012871V. doi:10.1073/pnas.2135498100. PMC 240711. PMID 14566050.
- ^ LeMaire-Adkins R, Radke K, Hunt PA (December 1997). "Lack of checkpoint control at the metaphase/anaphase transition: a mechanism of meiotic nondisjunction in mammalian females". The Journal of Cell Biology. 139 (7): 1611–1619. doi:10.1083/jcb.139.7.1611. PMC 2132649. PMID 9412457.
- ^ Sakaue-Sawano A, Kurokawa H, Morimura T, Hanyu A, Hama H, Osawa H, et al. (February 2008). "Visualizing spatiotemporal dynamics of multicellular cell-cycle progression". Cell. 132 (3): 487–498. doi:10.1016/j.cell.2007.12.033. PMID 18267078. S2CID 15704902.
- ^ Rodriguez EA, Tran GN, Gross LA, Crisp JL, Shu X, Lin JY, Tsien RY (September 2016). "A far-red fluorescent protein evolved from a cyanobacterial phycobiliprotein". Nature Methods. 13 (9): 763–769. doi:10.1038/nmeth.3935. PMC 5007177. PMID 27479328.
- ^ Champeris Tsaniras S, Kanellakis N, Symeonidou IE, Nikolopoulou P, Lygerou Z, Taraviras S (June 2014). "Licensing of DNA replication, cancer, pluripotency and differentiation: an interlinked world?". Seminars in Cell & Developmental Biology. 30: 174–180. doi:10.1016/j.semcdb.2014.03.013. PMID 24641889.
- ^ Baserga R (June 1965). "The Relationship of the Cell Cycle to Tumor Growth and Control of Cell Division: A Review". Cancer Research. 25 (5): 581–595. PMID 14347544.
- ^ Mao Z, Bozzella M, Seluanov A, Gorbunova V (September 2008). "DNA repair by nonhomologous end joining and homologous recombination during cell cycle in human cells". Cell Cycle. 7 (18): 2902–2906. doi:10.4161/cc.7.18.6679. PMC 2754209. PMID 18769152.
- ^ a b c d Nasmyth K (September 1995). "Evolution of the cell cycle". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 349 (1329): 271–281. doi:10.1098/rstb.1995.0113. PMID 8577838.
- ^ Cavalier-Smith T (July 1987). "The origin of eukaryotic and archaebacterial cells". Annals of the New York Academy of Sciences. 503 (1): 17–54. Bibcode:1987NYASA.503...17C. doi:10.1111/j.1749-6632.1987.tb40596.x. PMID 3113314. S2CID 38405158.
- ^ Maizels N, Weiner AM (July 1994). "Phylogeny from function: evidence from the molecular fossil record that tRNA originated in replication, not translation". Proceedings of the National Academy of Sciences of the United States of America. 91 (15): 6729–6734. Bibcode:1994PNAS...91.6729M. doi:10.1073/pnas.91.15.6729. PMC 44276. PMID 8041690.
- ^ Morgan DO (November 1997). "Cyclin-dependent kinases: engines, clocks, and microprocessors". Annual Review of Cell and Developmental Biology. 13 (1): 261–291. doi:10.1146/annurev.cellbio.13.1.261. PMID 9442875.
- ^ Malumbres M, Harlow E, Hunt T, Hunter T, Lahti JM, Manning G, et al. (November 2009). "Cyclin-dependent kinases: a family portrait". Nature Cell Biology. 11 (11): 1275–1276. doi:10.1038/ncb1109-1275. PMC 2914104. PMID 19884882.
- ^ Satyanarayana A, Kaldis P (August 2009). "Mammalian cell-cycle regulation: several Cdks, numerous cyclins and diverse compensatory mechanisms". Oncogene. 28 (33): 2925–2939. doi:10.1038/onc.2009.170. PMID 19561645. S2CID 3096776.
- ^ Barrière C, Santamaría D, Cerqueira A, Galán J, Martín A, Ortega S, et al. (June 2007). "Mice thrive without Cdk4 and Cdk2". Molecular Oncology. 1 (1): 72–83. doi:10.1016/j.molonc.2007.03.001. PMC 5543859. PMID 19383288.
- ^ Ortega S, Prieto I, Odajima J, Martín A, Dubus P, Sotillo R, et al. (September 2003). "Cyclin-dependent kinase 2 is essential for meiosis but not for mitotic cell division in mice". Nature Genetics. 35 (1): 25–31. doi:10.1038/ng1232. PMID 12923533. S2CID 19522248.
- ^ Aleem E, Kiyokawa H, Kaldis P (August 2005). "Cdc2-cyclin E complexes regulate the G1/S phase transition". Nature Cell Biology. 7 (8): 831–836. doi:10.1038/ncb1284. PMID 16007079. S2CID 10842071.
- ^ a b Santamaría D, Barrière C, Cerqueira A, Hunt S, Tardy C, Newton K, et al. (August 2007). "Cdk1 is sufficient to drive the mammalian cell cycle". Nature. 448 (7155): 811–815. Bibcode:2007Natur.448..811S. doi:10.1038/nature06046. PMID 17700700. S2CID 4412772.
- ^ Nowack MK, Harashima H, Dissmeyer N, Zhao X, Bouyer D, Weimer AK, et al. (May 2012). "Genetic framework of cyclin-dependent kinase function in Arabidopsis". Developmental Cell. 22 (5): 1030–1040. doi:10.1016/j.devcel.2012.02.015. PMID 22595674.
- ^ a b c d e f Harashima H, Dissmeyer N, Schnittger A (July 2013). "Cell cycle control across the eukaryotic kingdom". Trends in Cell Biology. 23 (7): 345–356. doi:10.1016/j.tcb.2013.03.002. PMID 23566594.
- ^ Boudolf V, Barrôco R, Engler J, Verkest A, Beeckman T, Naudts M, et al. (April 2004). "B1-type cyclin-dependent kinases are essential for the formation of stomatal complexes in Arabidopsis thaliana". The Plant Cell. 16 (4): 945–955. doi:10.1105/tpc.021774. PMC 412868. PMID 15031414.
- ^ Andersen SU, Buechel S, Zhao Z, Ljung K, Novák O, Busch W, et al. (January 2008). "Requirement of B2-type cyclin-dependent kinases for meristem integrity in Arabidopsis thaliana". The Plant Cell. 20 (1): 88–100. doi:10.1105/tpc.107.054676. PMC 2254925. PMID 18223038.
- ^ a b Cross FR, Buchler NE, Skotheim JM (December 2011). "Evolution of networks and sequences in eukaryotic cell cycle control". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 366 (1584): 3532–3544. doi:10.1098/rstb.2011.0078. PMC 3203458. PMID 22084380.
- ^ Skotheim JM, Di Talia S, Siggia ED, Cross FR (July 2008). "Positive feedback of G1 cyclins ensures coherent cell cycle entry". Nature. 454 (7202): 291–296. Bibcode:2008Natur.454..291S. doi:10.1038/nature07118. PMC 2606905. PMID 18633409.
- ^ Ferrell JE (April 2002). "Self-perpetuating states in signal transduction: positive feedback, double-negative feedback and bistability". Current Opinion in Cell Biology. 14 (2): 140–148. doi:10.1016/S0955-0674(02)00314-9. PMID 11891111.
- ^ Venta R, Valk E, Kõivomägi M, Loog M (2012). "Double-negative feedback between S-phase cyclin-CDK and CKI generates abruptness in the G1/S switch". Frontiers in Physiology. 3: 459. doi:10.3389/fphys.2012.00459. PMC 3515773. PMID 23230424.
- ^ Eser U, Falleur-Fettig M, Johnson A, Skotheim JM (August 2011). "Commitment to a cellular transition precedes genome-wide transcriptional change". Molecular Cell. 43 (4): 515–527. doi:10.1016/j.molcel.2011.06.024. PMC 3160620. PMID 21855792.
- ^ a b Narasimha AM, Kaulich M, Shapiro GS, Choi YJ, Sicinski P, Dowdy SF (June 2014). Davis R (ed.). "Cyclin D activates the Rb tumor suppressor by mono-phosphorylation". eLife. 3: e02872. doi:10.7554/eLife.02872. PMC 4076869. PMID 24876129.
- ^ Harbour JW, Luo RX, Dei Santi A, Postigo AA, Dean DC (September 1999). "Cdk phosphorylation triggers sequential intramolecular interactions that progressively block Rb functions as cells move through G1". Cell. 98 (6): 859–869. doi:10.1016/s0092-8674(00)81519-6. PMID 10499802.
- ^ Takahata S, Yu Y, Stillman DJ (November 2009). "The E2F functional analogue SBF recruits the Rpd3(L) HDAC, via Whi5 and Stb1, and the FACT chromatin reorganizer, to yeast G1 cyclin promoters". The EMBO Journal. 28 (21): 3378–3389. doi:10.1038/emboj.2009.270. PMC 2776103. PMID 19745812.
- ^ de Bruin RA, McDonald WH, Kalashnikova TI, Yates J, Wittenberg C (June 2004). "Cln3 activates G1-specific transcription via phosphorylation of the SBF bound repressor Whi5". Cell. 117 (7): 887–898. doi:10.1016/j.cell.2004.05.025. PMID 15210110.
- ^ Zhao X, Harashima H, Dissmeyer N, Pusch S, Weimer AK, Bramsiepe J, et al. (2 August 2012). Palanivelu R (ed.). "A general G1/S-phase cell-cycle control module in the flowering plant Arabidopsis thaliana". PLOS Genetics. 8 (8): e1002847. doi:10.1371/journal.pgen.1002847. PMC 3410867. PMID 22879821.
- ^ Weimer AK, Nowack MK, Bouyer D, Zhao X, Harashima H, Naseer S, et al. (October 2012). "Retinoblastoma related1 regulates asymmetric cell divisions in Arabidopsis". The Plant Cell. 24 (10): 4083–4095. doi:10.1105/tpc.112.104620. PMC 3517237. PMID 23104828.
Further reading
- Morgan DO (2007). The Cell Cycle: Principles of Control. London: Published by New Science Press in association with Oxford University Press. ISBN 978-0-87893-508-6.
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2008). "Chapter 17". Molecular Biology of the Cell (5th ed.). New York: Garland Science. ISBN 978-0-8153-4111-6.
- Krieger M, Scott MP, Matsudaira PT, Lodish HF, Darnell JE, Zipursky L, Kaiser C, Berk A (2004). Molecular cell biology. New York: W.H. Freeman and CO. ISBN 978-0-7167-4366-8.
- Watson JD, Baker TA, Bell SP, Gann A, Levine M, Losick R (2004). "Chapter 7". Molecular biology of the gene (5th ed.). San Francisco: Pearson/Benjamin Cummings. ISBN 978-0-8053-4642-8.
External links
 This article incorporates public domain material from Science Primer. NCBI. Archived from the original on 8 December 2009.
This article incorporates public domain material from Science Primer. NCBI. Archived from the original on 8 December 2009.- David Morgan's Seminar: Controlling the Cell Cycle
- The cell cycle & Cell death Archived 30 October 2018 at the Wayback Machine
- Transcriptional program of the cell cycle: high-resolution timing
- Cell cycle and metabolic cycle regulated transcription in yeast
- Cell Cycle Animation 1Lec.com
- Cell Cycle
- Fucci:Using GFP to visualize the cell-cycle
- Science Creative Quarterly's overview of the cell cycle
- KEGG – Human Cell Cycle Archived 3 November 2008 at the Wayback Machine



